–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ Barritt et al. –Њ—В–Ї—А—Л–ї–Њ –љ–Њ–≤—Г—О —Н–њ–Њ—Е—Г –≤ –ї–µ—З–µ–љ–Є–Є –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–Т–Ґ–≠–Ю) [10]. –Я—А–µ–њ—П—В—Б—В–≤—Г—П –і–∞–ї—М–љ–µ–є—И–µ–Љ—Г —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—О –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ —Б–Њ–Ї—А–∞—В–Є–ї–Њ –љ–∞ 25% –≤–љ—Г—В—А–Є–≥–Њ—Б–њ–Є—В–∞–ї—М–љ—Г—О –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –Є –љ–∞ 50% – –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –ї–µ–≥–Њ—З–љ—Л—Е —Н–Љ–±–Њ–ї–Є–є. –Я—А–Є–љ—Ж–Є–њ –њ–Њ—Б—В–Њ—П–љ–љ–Њ–≥–Њ –≥–Є–њ–Њ–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –±—Л–ї –Ј–∞–ї–Њ–ґ–µ–љ –Є –≤ –Њ—Б–љ–Њ–≤—Г –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є. –Я–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–Љ –і–∞–љ–љ—Л–Љ, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ —В–µ—З–µ–љ–Є–µ 1 –Љ–µ—Б. —Б –Љ–Њ–Љ–µ–љ—В–∞ –њ–µ—А–≤–Њ–≥–Њ —Н–њ–Є–Ј–Њ–і–∞ –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї 25-–Ї—А–∞—В–љ–Њ–Љ—Г —Г–≤–µ–ї–Є—З–µ–љ–Є—О —З–∞—Б—В–Њ—В—Л —А–µ—Ж–Є–і–Є–≤–∞ [12]. –≠—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ –і–ї—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ґ–У–Т –Є –Ґ–≠–Ы–Р [13–16]. –®–Є—А–Њ–Ї–Њ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤—Л–±–Њ—А–∞ –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Т–Ґ–≠–Ю –≤ –Љ–Є—А–Њ–≤–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ–Њ–ї—Г—З–Є–ї–Є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –≤–Є—В–∞–Љ–Є–љ–∞ –Ъ (–Р–Т–Ъ), –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л (–Э–Ь–У) –Є –љ–Њ–≤—Л–µ –њ–µ—А–Њ—А–∞–ї—М–љ—Л–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л (–Я–Р–Ъ), –љ–µ–і–∞–≤–љ–Њ –њ–Њ—П–≤–Є–≤—И–Є–µ—Б—П –љ–∞ —А—Л–љ–Ї–µ.
–Ю–±—Й–µ–њ—А–Є–Ј–љ–∞–љ–љ—Л–є «–Ј–Њ–ї–Њ—В–Њ–є —Б—В–∞–љ–і–∞—А—В» –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–µ—Ж–Є–і–Є–≤–∞ –Ґ–У–Т –Є –Ґ–≠–Ы–Р –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М – –Р–Т–Ъ. –Э–∞–Є–±–Њ–ї–µ–µ –њ–Њ–њ—Г–ї—П—А–љ—Л–Љ –Є –Є–Ј—Г—З–µ–љ–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ —Н—В–Њ–є –≥—А—Г–њ–њ—Л —П–≤–ї—П–µ—В—Б—П –Т–∞—А—Д–∞—А–Є–љ. –°–ї—Г—З–∞–є–љ–Њ –Њ—В–Ї—А—Л—В–Њ–µ –≤ 1929 –≥. —Б–Њ–µ–і–Є–љ–µ–љ–Є–µ – –Ї—Г–Љ–∞—А–Є–љ, –љ–∞ –±–∞–Ј–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –±—Л–ї–Є —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ—Л –Є –і—А—Г–≥–Є–µ –Я–Р–Ъ (–≤ —В. —З. –Є –Т–∞—А—Д–∞—А–Є–љ –≤ 1948 –≥.), –і–Њ–ї–≥–Њ–µ –≤—А–µ–Љ—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Њ—Б—М –ї–Є—И—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –Ї—А—Л—Б–Є–љ–Њ–≥–Њ —П–і–∞ [17, 18]. –Ю–і–љ–∞–Ї–Њ —Г—Б–њ–µ—И–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞ –њ–Њ—Б–ї–µ –њ–Њ–њ—Л—В–Ї–Є —Б—Г–Є—Ж–Є–і–∞ [19] –њ—А–Є–≤–µ–ї–Њ –≤ 1954 –≥. –Ї —В–Њ–Љ—Г, —З—В–Њ –Т–∞—А—Д–∞—А–Є–љ –±—Л–ї —А–∞–Ј—А–µ—И–µ–љ –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –≤ –Ї–∞—З–µ—Б—В–≤–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Б—А–µ–і—Б—В–≤–∞ (–Ы–°) [20].
–Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –і–Њ–ї–≥–Њ–µ –≤—А–µ–Љ—П –±—Л–ї –љ–µ –і–Њ –Ї–Њ–љ—Ж–∞ –њ–Њ–љ—П—В–µ–љ [21], –љ–Њ –≤ 1978 –≥. –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ —Б–≤—П–Ј—М —Б –±–ї–Њ–Ї–∞–і–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–≥–Њ —Н—В–∞–њ–∞ —Б–Є–љ—В–µ–Ј–∞ –≤–Є—В–∞–Љ–Є–љ –Ъ-–Ј–∞–≤–Є—Б–Є–Љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є –≤ –њ–µ—З–µ–љ–Є: VII, X, IX, II (–њ—А–Њ—В—А–Њ–Љ–±–Є–љ–∞) –Є 2-—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ (–њ—А–Њ—В–µ–Є–љ–Њ–≤ –° –Є S) [22]. –°–Ї–Њ—А–Њ—Б—В—М –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П —Д–∞–Ї—В–Њ—А–Њ–≤ —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –љ–µ–Њ–і–Є–љ–∞–Ї–Њ–≤–∞ [23]. –°–љ–∞—З–∞–ї–∞ —Б–љ–Є–ґ–∞–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М —Д–∞–Ї—В–Њ—А–∞ VII, –Ј–∞—В–µ–Љ, —З–µ—А–µ–Ј 1–3 —Б—Г—В, – IX, X –Є –њ–Њ—Б–ї–µ–і–љ–Є–Љ, –њ—А–Є–Љ–µ—А–љ–Њ –љ–∞ 3–4 —Б—Г—В, – —Г—А–Њ–≤–µ–љ—М –њ—А–Њ—В—А–Њ–Љ–±–Є–љ–∞. –Я–∞—А–∞–ї–ї–µ–ї—М–љ–Њ —Б–љ–Є–ґ–µ–љ–Є—О –њ—А–Њ–Ї–Њ–љ–≤–µ—А—В–Є–љ–∞ (—Д–∞–Ї—В–Њ—А VII) —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–Њ—В–µ–Є–љ–∞ –° [24], —З—В–Њ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї —Б–і–≤–Є–≥—Г –≥–µ–Љ–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –±–∞–ї–∞–љ—Б–∞ –≤ —Б—В–Њ—А–Њ–љ—Г –≥–Є–њ–µ—А–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є –≤ –њ–µ—А–≤—Л–µ 24–48 —З –ї–µ—З–µ–љ–Є—П [14]. –Я–Њ—Н—В–Њ–Љ—Г –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л –њ—А—П–Љ–Њ–≥–Њ –Є –љ–µ–њ—А—П–Љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —Б–Њ–≤–Љ–µ—Б—В–љ–Њ –љ–µ –Љ–µ–љ–µ–µ 4–5 –і–љ–µ–є [22, 25]. –Ф–Њ–Ј–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –і–Њ–ї–ґ–љ–∞ –њ–Њ–і–±–Є—А–∞—В—М—Б—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –≤ —Б–≤—П–Ј–Є —Б –љ–∞–ї–Є—З–Є–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е (—Б–Ї–Њ—А–Њ—Б—В—М –≤—Б–∞—Б—Л–≤–∞–љ–Є—П, –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ, –Ї–ї–Є—А–µ–љ—Б) –Є —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е (—А–µ–∞–Ї—Ж–Є—П –≥–µ–Љ–Њ–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є) –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є, –Ї–Њ—В–Њ—А—Л–µ –Ї —В–Њ–Љ—Г –ґ–µ –Љ–Њ–≥—Г—В –Є–Ј–Љ–µ–љ—П—В—М—Б—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Е–∞—А–∞–Ї—В–µ—А–∞ –њ–Є—В–∞–љ–Є—П, –њ—А–Є–µ–Љ–∞ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е –Ы–° [22, 26, 27, 29].
–Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –і–Њ–Ј—Г –Т–∞—А—Д–∞—А–Є–љ–∞ –њ–Њ–і–±–Є—А–∞—О—В –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–≥–Њ –љ–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–≥–Њ –Њ—В–љ–Њ—И–µ–љ–Є—П (–Ь–Э–Ю), –Ї–Њ—В–Њ—А–Њ–µ —Б–ї–µ–і—Г–µ—В –Њ–њ—А–µ–і–µ–ї—П—В—М –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ 2-—Е –Є–ї–Є 3-—Е –љ–∞—З–∞–ї—М–љ—Л—Е –і–Њ–Ј –њ—А–µ–њ–∞—А–∞—В–∞. –Т –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ –Ь–Э–Ю –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ–њ—А–µ–і–µ–ї—П—В—М –µ–ґ–µ–і–љ–µ–≤–љ–Њ –Є–ї–Є 1 —А–∞–Ј –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –і–љ–µ–є –і–Њ –њ–Њ–ї—Г—З–µ–љ–Є—П —Б—В–∞–±–Є–ї—М–љ—Л—Е —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –Ј–љ–∞—З–µ–љ–Є–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П, –Ј–∞—В–µ–Љ 2–3 —А./–љ–µ–і. –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 1–2 –љ–µ–і. –Я–Њ—Б–ї–µ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Б—В–∞–±–Є–ї—М–љ—Л—Е —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –Ј–љ–∞—З–µ–љ–Є–є –Ь–Э–Ю —Б–ї–µ–і—Г–µ—В –Њ–њ—А–µ–і–µ–ї—П—В—М –љ–µ —А–µ–ґ–µ —З–µ–Љ –Ї–∞–ґ–і—Л–µ 4 –љ–µ–і. (–±–Њ–ї–µ–µ —З–∞—Б—В–∞—П –Њ—Ж–µ–љ–Ї–∞ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ–Є –Ї–Њ–ї–µ–±–∞–љ–Є—П–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П). –Х—Б–ї–Є —В—А–µ–±—Г–µ—В—Б—П –Ї–Њ—А—А–µ–Ї—Ж–Є—П (—Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Є–ї–Є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ) –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞, —Б–ї–µ–і—Г–µ—В –њ–Њ–≤—В–Њ—А–Є—В—М —Ж–Є–Ї–ї –±–Њ–ї–µ–µ —З–∞—Б—В–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Ь–Э–Ю, –њ–Њ–Ї–∞ —Б–љ–Њ–≤–∞ –љ–µ –±—Г–і—Г—В –і–Њ—Б—В–Є–≥–љ—Г—В—Л —Б—В–∞–±–Є–ї—М–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П.
–Ю–і–љ–∞ –Є–Ј –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е —Б—Е–µ–Љ –њ–Њ–і–±–Њ—А–∞ –і–Њ–Ј—Л –Т–∞—А—Д–∞—А–Є–љ–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 1.

–Э–Ь–У –Њ–±–ї–∞–і–∞—О—В –≤—Л—Б–Њ–Ї–Њ–є –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О –њ—А–Є –њ–Њ–і–Ї–Њ–ґ–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є, –ї–µ–≥–Ї–Њ –і–Њ–Ј–Є—А—Г—О—В—Б—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Љ–∞—Б—Б—Л —В–µ–ї–∞, –љ–µ —В—А–µ–±—Г—О—В –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П —Б–Њ—Б—В–Њ—П–љ–Є—П –≥–µ–Љ–Њ—Б—В–∞–Ј–∞. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Э–Ь–У –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—А–µ–і—Б—В–≤–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞ –Є–Љ–µ–µ—В –і–∞–≤–љ—О—О –Є—Б—В–Њ—А–Є—О [28]. –Ю–і–љ–∞–Ї–Њ –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—А–µ–і—Б—В–≤ –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є—Е –њ–Њ–≤—Б–µ–Љ–µ—Б—В–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –љ–∞—З–∞–ї–Њ—Б—М –љ–µ —В–∞–Ї –і–∞–≤–љ–Њ. –Т —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ —Б –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є —Ж–µ–ї—М—О —З–∞—Й–µ –≤—Б–µ–≥–Њ –њ—А–Є–Љ–µ–љ—П—О—В —Б—В–∞–љ–і–∞—А—В–љ—Л–µ –і–Њ–Ј—Л –Э–Ь–У, —В. –Ї. –Є–Љ–µ—О—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (–≤ —В. —З. —Б —Г—А–Њ–≤–љ–µ–Љ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є –Р), —Г–Ї–∞–Ј—Л–≤–∞—О—Й–Є–µ –љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Э–Ь–У –±–µ–Ј —Г—З–µ—В–∞ –∞–љ—В–Є-–•–∞-–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є [31]. –Ш–Ј-–Ј–∞ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є —Б—В–Њ–Є–Љ–Њ—Б—В–Є –Э–Ь–У –Є –љ–µ—Г–і–Њ–±—Б—В–≤–∞ –µ–ґ–µ–і–љ–µ–≤–љ—Л—Е –Є–љ—К–µ–Ї—Ж–Є–є –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–µ—А–µ–≤–Њ–і–Є—В—Б—П –љ–∞ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–Љ —Н—В–∞–њ–µ –ї–µ—З–µ–љ–Є—П –љ–∞ –Р–Т–Ъ. –Я—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Э–Ь–У –њ—А–Є –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ, —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –Т–∞—А—Д–∞—А–Є–љ—Г (>105 –Љ–≥/–љ–µ–і.), —А–µ—Ж–Є–і–Є–≤–µ –Ґ–У–Т, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –∞–і–µ–Ї–≤–∞—В–љ—Г—О —В–µ—А–∞–њ–Є—О –Р–Т–Ъ, –љ–∞—И–ї–Њ —Б–≤–Њ–µ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ [30]. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Э–Ь–У –њ—А–Є–Ј–љ–∞–љ–Њ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л–Љ —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є; –≤—Л—Б–Њ–Ї–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М—О –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є; –љ–Є–Ј–Ї–Њ–є –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В—М—О –Ї –њ—А–Њ–≤–µ–і–µ–љ–Є—О –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П —Б–≤–µ—А—В—Л–≤–∞–µ–Љ–Њ—Б—В–Є –Ї—А–Њ–≤–Є –њ—А–Є –њ—А–Є–µ–Љ–µ –љ–µ–њ—А—П–Љ—Л—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤; –њ—А–µ–і—Б—В–Њ—П—Й–Є–Љ –≤ –±–ї–Є–ґ–∞–є—И–µ–µ –≤—А–µ–Љ—П –Њ–њ–µ—А–∞—В–Є–≤–љ—Л–Љ –ї–µ—З–µ–љ–Є–µ–Љ; –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є [31, 32]. –Я—А–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –Р–Т–Ъ –Є –Э–Ь–У —З–∞—Б—В–Њ—В–∞ —А–µ—Ж–Є–і–Є–≤–∞ –Ґ–У–Т —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 5,7% –њ—А–Њ—В–Є–≤ 4,9% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [35], —З—В–Њ –њ–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В —А–∞–≤–љ–Њ–Ј–љ–∞—З–љ–Њ—Б—В—М –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е —Б—В—А–∞—В–µ–≥–Є–є. –Ф–∞–љ–љ–Њ–µ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–Њ —П–≤–Є–ї–Њ—Б—М –Ї–ї—О—З–µ–≤–Њ–є –њ—А–µ–і–њ–Њ—Б—Л–ї–Ї–Њ–є –і–ї—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є American College of Chest Physicians (ACCP) 2012 –≥. [31], –≤ –Ї–Њ—В–Њ—А—Л—Е –њ—А–Є –≤—Л–±–Њ—А–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞ –і–ї—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –Њ—В–і–∞–µ—В—Б—П –Р–Т–Ъ (—Б—В–µ–њ–µ–љ—М —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є 2–°). –Ю–і–љ–∞–Ї–Њ –њ–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В—Б—П, —З—В–Њ –≤—Л–±–Њ—А –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Ј–∞–≤–Є—Б–Є—В –Њ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є —Б–∞–Љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞, –Ї–Њ—В–Њ—А—Л–є –і–Њ–ї–ґ–µ–љ –±—Л—В—М –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–µ–љ –Ї —З–∞—Б—В–Њ–Љ—Г —В–Є—В—А–Њ–≤–∞–љ–Є—О –і–Њ–Ј—Л –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Р–Т–Ъ –Є–ї–Є –љ–µ –Є—Б–њ—Л—В—Л–≤–∞—В—М —В—А—Г–і–љ–Њ—Б—В–µ–є –≤ —Б–≤—П–Ј–Є —Б –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ—Л–Љ –≤–≤–µ–і–µ–љ–Є–µ–Љ –Э–Ь–У –Є –Є—Е –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є —Б—В–Њ–Є–Љ–Њ—Б—В—М—О.
–Х—Й–µ –Њ–і–љ–∞ –≤–∞–ґ–љ–∞—П –≥—А—Г–њ–њ–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є – –њ—А—П–Љ—Л–µ –Я–Р–Ъ, –љ–µ–і–∞–≤–љ–Њ –њ–Њ—П–≤–Є–≤—И–Є–µ—Б—П –љ–∞ —А—Л–љ–Ї–µ. –Ш—Е –±–µ–Ј—Г—Б–ї–Њ–≤–љ—Л–Љ –Є –≤–∞–ґ–љ—Л–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ —П–≤–ї—П–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –њ—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Ф–Њ–Ј–∞ –Ы–° –љ–µ —В—А–µ–±—Г–µ—В –њ–Њ—Б—В–Њ—П–љ–љ–Њ–≥–Њ —В–Є—В—А–Њ–≤–∞–љ–Є—П, –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б–≤–µ—А—В—Л–≤–∞–µ–Љ–Њ—Б—В–Є, –∞ –і–µ–є—Б—В–≤–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ –Є–Љ–µ–µ—В –њ–Њ–ї–Є–≤–∞–ї–µ–љ—В–љ—Л—Е –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–µ–є –Њ—В –њ–Є—Й–µ–≤—Л—Е –њ—А–Є–≤—Л—З–µ–Ї –њ–∞—Ж–Є–µ–љ—В–∞.
–Я–µ—А–≤—Л–Љ –Ы–° –і–ї—П –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–Ј —Н—В–Њ–є –њ–Њ–і–≥—А—Г–њ–њ—Л —Б—В–∞–ї –Ї—Б–Є–Љ–µ–ї–∞–≥–∞—В—А–∞–љ [92], –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–≤—И–Є–є –і–Њ—Б—В–∞—В–Њ—З–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є–Є –Т–Ґ–≠–Ю –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е II—III —Д–∞–Ј. –Ъ—Б–Є–Љ–µ–ї–∞–≥–∞—В—А–∞–љ —Б 2004 –≥. –љ–∞—З–∞–ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –≤ –Х–≤—А–Њ–њ–µ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Т–Ґ–≠–Ю –≤ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–є –Є –Њ—А—В–Њ–њ–µ–і–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. –Ю–і–љ–∞–Ї–Њ —Б 2006 –≥. –µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –њ—А–µ–Ї—А–∞—Й–µ–љ–Њ –≤ —Б–≤—П–Ј–Є —Б –≤—Л—П–≤–ї–µ–љ–љ–Њ–є –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О –Є –љ–µ–Ї–Њ—В–Њ—А—Л–Љ–Є –і—А—Г–≥–Є–Љ–Є –њ–Њ–±–Њ—З–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є.
–Ф—А—Г–≥–Њ–є –њ–µ—А–Њ—А–∞–ї—М–љ—Л–є –Є–љ–≥–Є–±–Є—В–Њ—А —В—А–Њ–Љ–±–Є–љ–∞, –∞–Ї—В–Є–≤–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П, – –і–∞–±–Є–≥–∞—В—А–∞–љ–∞ —Н—В–µ–Ї—Б–Є–ї–∞—В. –Ю–љ –Є–Ј—Г—З–µ–љ –≤ 2-—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е III —Д–∞–Ј—Л: REMEDY –Є RE-SONATE [34] –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—А–µ–і—Б—В–≤–∞ –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і–∞–±–Є–≥–∞—В—А–∞–љ–∞ –њ—А–Є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Т–Ґ–≠–Ю –≤ –і–Њ–Ј–µ 150 –Љ–≥ 2 —А./—Б—Г—В —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–∞ —Б —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Т–∞—А—Д–∞—А–Є–љ–∞ (—З–∞—Б—В–Њ—В–∞ –њ–Њ–≤—В–Њ—А–љ—Л—Е –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –Є —Н–Љ–±–Њ–ї–Є–є 1,8% –њ—А–Њ—В–Є–≤ 1,3% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ).
–†–Є–≤–∞—А–Њ–Ї—Б–∞–±–∞–љ – –њ—А—П–Љ–Њ–є –Є–љ–≥–Є–±–Є—В–Њ—А —Д–∞–Ї—В–Њ—А–∞ –•–∞ –і–ї—П –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П [36]. –Ф–≤–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П EINSTEIN DVT & PE –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —А–Є–≤–∞—А–Њ–Ї—Б–∞–±–∞–љ–∞ –њ—А–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Т–Ґ–≠–Ю –≤ –і–Њ–Ј–µ 20 –Љ–≥ 1 —А./—Б—Г—В –њ–Њ—Б–ї–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ—Л—Е —А–∞–љ–µ–µ –Ґ–У–Т [37]. –Я—А–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Р–Т–Ъ –Є —А–Є–≤–∞—А–Њ–Ї—Б–∞–±–∞–љ–∞ —З–∞—Б—В–Њ—В–∞ —А–µ—Ж–Є–і–Є–≤–∞ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 3,0% –њ—А–Њ—В–Є–≤ 2,1% (p<0,001).
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В —Г–≤–µ—А–µ–љ–љ–Њ –≥–Њ–≤–Њ—А–Є—В—М –Њ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤—Б–µ—Е –≥—А—Г–њ–њ. –Т–∞—А—Д–∞—А–Є–љ –Є –µ–≥–Њ –∞–љ–∞–ї–Њ–≥–Є –Њ–±–ї–∞–і–∞—О—В —А—П–і–Њ–Љ –љ–µ—Б–Њ–Љ–љ–µ–љ–љ—Л—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤, —В–∞–Ї–Є–Љ–Є –Ї–∞–Ї –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞, –љ–Є–Ј–Ї–∞—П —Б—В–Њ–Є–Љ–Њ—Б—В—М, –Є–Ј—Г—З–µ–љ–љ–Њ—Б—В—М. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Р–Т–Ъ —Б–Њ–њ—А—П–ґ–µ–љ–Њ —Б —А—П–і–Њ–Љ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–≤ – —Б–ї–Њ–ґ–љ–Њ—Б—В—М—О –Ї–Њ–љ—В—А–Њ–ї—П –Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞, —З—В–Њ –≤–ї–µ—З–µ—В —З–∞—Б—В—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –≤ –≤–Є–і–µ –≥–µ–Љ–Њ—А—А–∞–≥–Є–є. –Ф–∞–љ–љ–Њ–µ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–Њ –Ј–∞—З–∞—Б—В—Г—О –Њ–њ—А–µ–і–µ–ї—П–µ—В –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ—Л–є –Њ—В–Ї–∞–Ј –Њ—В –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, —А–µ—Ж–Є–і–Є–≤ –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞ –Є –Ґ–≠–Ы–Р. –Ь–µ–ґ–і—Г —В–µ–Љ –Ї—А–∞–µ—Г–≥–Њ–ї—М–љ—Л–Љ –Ї–∞–Љ–љ–µ–Љ –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —П–≤–ї—П–µ—В—Б—П –µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М. –°—А–∞–≤–љ–µ–љ–Є–µ —В–µ—А–∞–њ–Є–Є –≤ —В–µ—З–µ–љ–Є–µ 1-–≥–Њ –Є 3-—Е –Љ–µ—Б. –њ–Њ—Б–ї–µ –≤–њ–µ—А–≤—Л–µ –≤–Њ–Ј–љ–Є–Ї—И–µ–≥–Њ –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ —А–µ—Ж–Є–і–Є–≤ –њ—А–Њ–Є–Ј–Њ—И–µ–ї —Г 7,8 –Є 4,0% –±–Њ–ї—М–љ—Л—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [38].
–Я—А–Є 6-–Љ–µ—Б—П—З–љ–Њ–Љ –Ї—Г—А—Б–µ —В–µ—А–∞–њ–Є–Є –Р–Т–Ъ —З–∞—Б—В–Њ—В–∞ —А–µ—Ж–Є–і–Є–≤–∞ —В—А–Њ–Љ–±–Њ–Ј–∞ —Б–љ–Є–ґ–∞–µ—В—Б—П –≤ 2 —А–∞–Ј–∞ –Ј–∞ 2-–ї–µ—В–љ–Є–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б 6-–љ–µ–і–µ–ї—М–љ—Л–Љ –Ї—Г—А—Б–Њ–Љ (—Б 18,1 –і–Њ 9,5%) [39, 40]. –Я–Њ –і–∞–љ–љ—Л–Љ S. Schulman et al. [41], –Ј–∞ 4––ї–µ—В–љ–Є–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П –њ–Њ—Б–ї–µ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ —Н–њ–Є–Ј–Њ–і–∞ —В—А–Њ–Љ–±–Њ–Ј–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Р–Т–Ъ 6 –Љ–µ—Б., —А–µ—В—А–Њ–Љ–±–Њ–Ј –≤–Њ–Ј–љ–Є–Ї –≤ 20,7% —Б–ї—Г—З–∞–µ–≤ –Є –ї–Є—И—М —Г 2,6% –Є–Ј —В–µ—Е, –Ї—В–Њ –њ—А–Њ–і–Њ–ї–ґ–∞–ї –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є–є –њ—А–Є–µ–Љ.
–Ю—Б–љ–Њ–≤–љ—Л–Љ –њ–∞—В—В–µ—А–љ–Њ–Љ –≤—Л–±–Њ—А–∞ –Ы–° –і–ї—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ґ–У–Т –Є –Ґ–≠–Ы–Р —П–≤–ї—П–µ—В—Б—П –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є – —З–∞—Б—В–Њ—В–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –±–Њ–ї—М—И–Є—Е –Є –Љ–∞–ї—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є, —А–Є—Б–Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –≥–µ–њ–∞—А–Є–љ-–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є (–У–Ш–Ґ), –Ї—Г–Љ–∞—А–Є–љ–Њ–≤—Л–µ –љ–µ–Ї—А–Њ–Ј—Л –Ї–Њ–ґ–Є. –Ґ–Њ–ї—М–Ї–Њ –≤–Ј–≤–µ—И–µ–љ–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї —В–Њ–є –Є–ї–Є –Є–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ –њ–Њ–і–Њ–±—А–∞—В—М —В–µ—А–∞–њ–Є—О.
–Ф–∞–љ–љ—Л–µ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –њ—А–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Р–Т–Ъ –Є –Э–Ь–У —З–µ—А–µ–Ј 3 –Љ–µ—Б. –њ—А–Њ–≤–µ–і–µ–љ–Є—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є, –љ–µ —Б—В–Њ–Є—В –≤–Њ—Б–њ—А–Є–љ–Є–Љ–∞—В—М —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –∞–±—Б–Њ–ї—О—В–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є – —З–∞—Б—В–Њ—В–∞ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –≤ –Ї–∞–ґ–і–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —А–∞–Ј–љ–∞—П –Є –Љ–Њ–ґ–µ—В –Њ—В–ї–Є—З–∞—В—М—Б—П –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј, —З—В–Њ, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —Б–Є–љ–Њ–њ—Б–Є—Б–Њ–Љ –њ—А–Њ—В–Њ–Ї–Њ–ї–Њ–≤. –Э–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ–Њ–є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –Њ—Ж–µ–љ–Ї–∞ –≤–Ј–∞–Є–Љ–Њ–Њ—В–љ–Њ—И–µ–љ–Є–є —З–∞—Б—В–Њ—В –≤ —В–Њ–Љ –Є–ї–Є –Є–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є.
–Т –Њ—Б–љ–Њ–≤–љ–Њ–Љ —А–∞–Ј–≤–Є—В–Є–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –њ—А–Є –њ—А–Є–µ–Љ–µ –Т–∞—А—Д–∞—А–Є–љ–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –љ–∞ –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–Љ —Н—В–∞–њ–µ –Є —Б–≤—П–Ј–∞–љ–Њ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —Б –њ–Њ–і–±–Њ—А–Њ–Љ –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞. –Я—А–Є –Њ—В—В–Є—В—А–Њ–≤–∞–љ–љ–Њ–є –і–Њ–Ј–µ —А–Є—Б–Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —В–Њ—В –ґ–µ, —З—В–Њ –Є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ –і—А—Г–≥–Є—Е –Ї–ї–∞—Б—Б–Њ–≤. –Ю—Б–Њ–±–љ—П–Ї–Њ–Љ —Б—В–Њ–Є—В –≥—А—Г–њ–њ–∞ –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е, —Г –Ї–Њ—В–Њ—А—Л—Е —А–Є—Б–Ї —Д–∞—В–∞–ї—М–љ—Л—Е –≥–µ–Љ–Њ—А—А–∞–≥–Є–є –љ–∞–Љ–љ–Њ–≥–Њ –≤—Л—И–µ [42]. –Ю—Б–љ–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –і–ї—П —Н—В–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є —Б–ї–µ–і—Г–µ—В —Б—З–Є—В–∞—В—М –Э–Ь–У – –њ—А–Є –Є—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є –ї–µ—В–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –Љ–µ–љ—М—И–µ [42], —З–µ–Љ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Р–Т–Ъ.
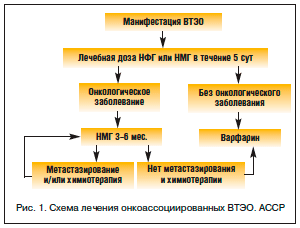
–Ю–±—Й–Є–є –∞–ї–≥–Њ—А–Є—В–Љ –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Г –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1 [43].
–Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –љ–∞ –і–∞–љ–љ—Л–є –Љ–Њ–Љ–µ–љ—В –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –Њ–±—И–Є—А–љ–Њ–≥–Њ –Њ–њ—Л—В–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А—П–Љ—Л—Е –Я–Р–Ъ –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—А–µ–і—Б—В–≤–∞ –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ґ–У–Т –Є –Ґ–≠–Ы–Р —Г —Н—В–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —З—В–Њ –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Є—Е –≤ —А—Г—В–Є–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ.
–Ф—А—Г–≥–Є–Љ –≤–∞–ґ–љ—Л–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –ї—О–±—Л—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ —П–≤–ї—П—О—В—Б—П –љ–µ–Ї—А–Њ–Ј—Л –Ї–Њ–ґ–Є [48, 49]. –Я–∞—В–Њ–≥–µ–љ–µ–Ј —Н—В–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Ј–∞–≤–Є—Б–Є—В –Њ—В –Ї–ї–∞—Б—Б–∞ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ – –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ї—Г–Љ–∞—А–Є–љ–Њ–≤–Њ–≥–Њ —А—П–і–∞ –ї–Є–±–Њ –њ—А—П–Љ—Л—Е –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ—Л—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤. –У–Ш–Ґ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –њ–∞—А–∞–і–Њ–Ї—Б–∞–ї—М–љ—Л–Љ —Д–µ–љ–Њ–Љ–µ–љ–∞–Љ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Ґ—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—З–µ—Б–Ї–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ (—Г—А–Њ–≤–µ–љ—М —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –Љ–µ–љ–µ–µ 60,00—Е109/–ї) —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —З–∞—Й–µ –≤—Б–µ–≥–Њ –љ–∞ 5–10 —Б—Г—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≥–µ–њ–∞—А–Є–љ–Њ–≤, –њ—А–Є—З–µ–Љ –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ (–Э–§–У) —Д–Њ—А–Љ—Л –Є–љ–і—Г—Ж–Є—А—Г—О—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Є–Љ–Љ—Г–љ–љ—Л—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ – 5% –њ—А–Њ—В–Є–≤ 1% [47]. –Я—А–Є —Н—В–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є –Љ–Њ–ї–µ–Ї—Г–ї—Л –≥–µ–њ–∞—А–Є–љ–∞ —Б–≤—П–Ј—Л–≤–∞—О—В—Б—П —Б –∞–≥—А–µ–≥–∞—Ж–Є—П–Љ–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ 4, —Д–Њ—А–Љ–Є—А—Г—П —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –Є–Љ–Љ—Г–љ–Њ–≥–µ–љ–љ—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б [44]. –Х–≥–Њ –∞–Ї—В–Є–≤–∞—Ж–Є—П –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М –њ—А–Є–≤–Њ–і–Є—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Љ–∞—Б—Б –Ј–∞ —Б—З–µ—В –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П FcγIIa-—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ [45].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –∞–і–µ–Ї–≤–∞—В–љ—Г—О —В–µ—А–∞–њ–Є—О, –Њ—Б–љ–Њ–≤–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ –У–Ш–Ґ —П–≤–ї—П–µ—В—Б—П –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –љ–µ —В–Њ–ї—М–Ї–Њ –≤–µ–љ–Њ–Ј–љ–Њ–є, –љ–Њ –Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Я—А–Є—З–µ–Љ –љ–∞—А–∞—Б—В–∞–љ–Є–µ —Г—А–Њ–≤–љ—П –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞ –Є –Ґ–≠–Ы–Р –љ–∞–±–ї—О–і–∞–µ—В—Б—П –≤ 4 —А–∞–Ј–∞ —З–∞—Й–µ, —З–µ–Љ –∞—А—В–µ—А–Є–∞–ї—М–љ—Л–µ —Н–Љ–±–Њ–ї–Є–Є [46]. –Х—Й–µ –±–Њ–ї–µ–µ —А–µ–і–Ї–Є–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ–Љ —П–≤–ї—П–µ—В—Б—П –≥–µ–њ–∞—А–Є–љ-–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –љ–µ–Ї—А–Њ–Ј –Ї–Њ–ґ–Є. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –У–Ш–Ґ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П —Г—А–Њ–≤–љ—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Э–Ь–У.
–Ъ—Г–Љ–∞—А–Є–љ–Њ–≤—Л–µ –љ–µ–Ї—А–Њ–Ј—Л –Ї–Њ–ґ–Є —Б–≤—П–Ј–∞–љ—Л –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ —Б –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О –њ—А–Њ—В–µ–Є–љ–Њ–≤ C –Є S, –Ы–µ–є–і–µ–љ–Њ–≤—Б–Ї–Њ–є –Љ—Г—В–∞—Ж–Є–µ–є, –Љ—Г—В–∞—Ж–Є–µ–є –≥–µ–љ–∞ –њ—А–Њ—В—А–Њ–Љ–±–Є–љ–∞ –Є –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ [50–52]. –Ь–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є—П –њ–Њ–і–Њ–±–љ–Њ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –љ–∞ 8–10 —Б—Г—В —В–µ—А–∞–њ–Є–Є, –Њ–і–љ–∞–Ї–Њ –Є–Љ–µ—О—В—Б—П —Б–Њ–Њ–±—Й–µ–љ–Є—П –Є –Њ –±–Њ–ї–µ–µ –њ–Њ–Ј–і–љ–Є—Е —Б—А–Њ–Ї–∞—Е – –Њ—В 15 —Б—Г—В –і–Њ 1 –Љ–µ—Б. [53, 54]. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Њ–±–ї–∞—Б—В–µ–є —Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –њ–Њ–і–Ї–Њ–ґ–љ–Њ-–ґ–Є—А–Њ–≤–Њ–є –Ї–ї–µ—В—З–∞—В–Ї–Њ–є: –Љ–Њ–ї–Њ—З–љ—Л—Е –ґ–µ–ї–µ–Ј, –±–µ–і–µ—А, –њ–µ—А–µ–і–љ–µ–є –±—А—О—И–љ–Њ–є —Б—В–µ–љ–Ї–Є [55].
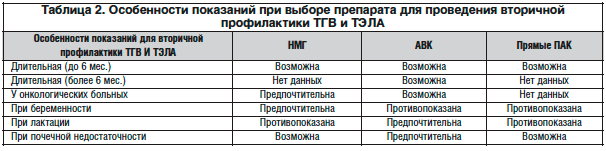
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–µ—Ж–Є–і–Є–≤–∞ –Ґ–У–Т –Є –Ґ–≠–Ы–Р. –Ъ–∞–ґ–і–Њ–µ –Є–Ј –Њ–њ–Є—Б–∞–љ–љ—Л—Е –Ы–° –Є–Љ–µ–µ—В —Б–≤–Њ–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –Є –љ–µ–і–Њ—Б—В–∞—В–Ї–Є, —А—П–і –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є, —З—В–Њ —В—А–µ–±—Г–µ—В –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –Ї –Ї–∞–ґ–і–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є. –°–≤–Њ–і–љ—Л–µ –і–∞–љ–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 2, –Є–Ј –Ї–Њ—В–Њ—А–Њ–є –≤–Є–і–љ–Њ, —З—В–Њ –љ–∞–Є–±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Є–Љ–Є –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –і–ї—П –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ–±–ї–∞–і–∞—О—В –Р–Т–Ъ. –Ю—В–і–µ–ї—М–љ–Њ–≥–Њ –≤–љ–Є–Љ–∞–љ–Є—П –Ј–∞—Б–ї—Г–ґ–Є–≤–∞–µ—В —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –њ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ ACCP (2012) –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Э–Ь–У –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –і–∞–±–Є–≥–∞—В—А–∞–љ–∞ –Є —А–Є–≤–∞—А–Њ–Ї—Б–∞–±–∞–љ–∞, –Ї–Њ—В–Њ—А—Л–µ –љ–∞ –і–∞–љ–љ—Л–є –Љ–Њ–Љ–µ–љ—В —Г–ґ–µ –Є–Љ–µ—О—В –Њ—Д–Є—Ж–Є–∞–ї—М–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–µ—Ж–Є–і–Є–≤–∞ –Ґ–У–Т –љ–∞ —В–µ—А—А–Є—В–Њ—А–Є–Є –°–®–Р (—Б—В–µ–њ–µ–љ—М —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є 2B–2C) [31].
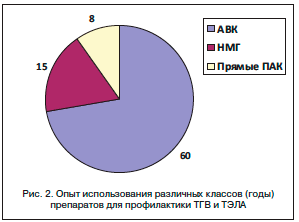
–£–Ј–Ї–Є–є –Ї–Њ—А–Є–і–Њ—А –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А—П–Љ—Л—Е –Я–Р–Ъ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, –Є—Е –љ–Є–Ј–Ї–Њ–є —Б—В–µ–њ–µ–љ—М—О –Є–Ј—Г—З–µ–љ–љ–Њ—Б—В–Є –Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –і–∞–љ–љ—Л—Е –Њ–±—И–Є—А–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (—А–Є—Б. 2).
–Т–∞—А—Д–∞—А–Є–љ –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і—А—Г–≥–Є—Е –≥—А—Г–њ–њ, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —В—А–µ–±—Г–µ—В –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П. –Ь–µ–ґ–і—Г —В–µ–Љ –Є–Љ–µ–љ–љ–Њ –∞–і–µ–Ї–≤–∞—В–љ—Л–є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ –Ь–Э–Ю —П–≤–ї—П–µ—В—Б—П –Ј–∞–ї–Њ–≥–Њ–Љ —Г—Б–њ–µ—И–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є—Е —Б–≤–µ—Б—В–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –Ї –Љ–Є–љ–Є–Љ—Г–Љ—Г. –°—А–µ–і–Є –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е –њ—А–Є—З–Є–љ, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї –Є–Ј–Љ–µ–љ–µ–љ–Є—О –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Ь–Э–Ю, –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, –Ї –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –і–Њ–Ј—Л –Т–∞—А—Д–∞—А–Є–љ–∞ —Б–Њ –≤—Б–µ–Љ–Є –≤—Л—В–µ–Ї–∞—О—Й–Є–Љ–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–≥–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞ –Ї—А–Њ–≤–Є –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П–Љ–Є, –љ–∞–Ј—Л–≤–∞—О—В –њ–Њ–≥—А–µ—И–љ–Њ—Б—В–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є, –љ–∞—А—Г—И–µ–љ–Є–µ —А–µ–ґ–Є–Љ–∞ –њ—А–Є–µ–Љ–∞, —А–∞–Ј–Њ–≤–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –ї–µ–Ї–∞—А—Б—В–≤, –Ї–Њ—В–Њ—А—Л–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—О—В —Б –Т–∞—А—Д–∞—А–Є–љ–Њ–Љ, –љ–∞—А—Г—И–µ–љ–Є–µ –і–Є–µ—В—Л. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ь–Э–Ю –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј–∞—В—М –≤–ї–Є—П–љ–Є–µ —А–∞–Ј–≤–Є–≤—И–µ–µ—Б—П –Є–љ—В–µ—А–Ї—Г—А—А–µ–љ—В–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, —Г –Љ–љ–Њ–≥–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ј–љ–∞—З–µ–љ–Є—П –Ь–Э–Ю, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –≤—Б–µ —Г—Б–Є–ї–Є—П –њ–Њ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—О —Ж–µ–ї–µ–≤–Њ–≥–Њ –Є–љ—В–µ—А–≤–∞–ї–∞, –њ–Њ—Б—В–Њ—П–љ–љ–Њ –Љ–µ–љ—П—О—В—Б—П. –†–Є—Б–Ї –Ї–∞–Ї —А–µ—Ж–Є–і–Є–≤–∞ –Т–Ґ–≠–Ю, —В–∞–Ї –Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г —В–∞–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤—Л—И–µ. –Ы–µ—З–∞—Й–Є–µ –≤—А–∞—З–Є –і–Њ–ї–ґ–љ—Л –њ–Њ—Б—В–Њ—П–љ–љ–Њ –љ–∞–њ–Њ–Љ–Є–љ–∞—В—М —Н—В–Є–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –Њ –≤–∞–ґ–љ–Њ—Б—В–Є —Б–Њ–±–ї—О–і–µ–љ–Є—П –і–Є–µ—В—Л –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –±–Њ–ї–µ–µ —З–∞—Б—В–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –Ь–Э–Ю.
–Р–Т–Ъ –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М —П–≤–ї—П—О—В—Б—П «–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ» –њ—А–Њ–≤–µ–і–µ–љ–Є—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Т–Ґ–≠–Ю. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ—А—П–Љ—Л—Е –Я–Р–Ъ –Є–Љ–µ–µ—В —И–Є—А–Њ–Ї–Є–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П, –љ–Њ —В—А–µ–±—Г–µ—В—Б—П –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –Њ–њ—Л—В–∞ –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П.












