Введение
Гипертрофия органов лимфоидного глоточного кольца Пирогова — Вальдейера (преимущественно носоглоточной и небных миндалин) имеет высокую распространенность у детей и наиболее часто встречается в возрасте 4–7 лет [1–3]. Именно на этот возраст приходится 4-й критический период формирования иммунной системы и имеется наиболее значительное развитие лимфоидных фолликулов в органах периферической иммунной системы.Гиперплазия небных миндалин (ГНМ) может быть обусловлена местной антигенной стимуляцией и системной гиперплазией лимфоидной ткани (ГЛТ) в периферических органах иммунной системы (небных миндалинах, аденоидах, лимфатических узлах, селезенке, мукозоассоциированной лимфоидной ткани).
Системная ГЛТ характерна для иммунокомпрометированных детей и наблюдается при вторичной иммунной недостаточности, острых и хронических вирусных и бактериальных инфекциях. В тяжелых случаях системная ГЛТ сопровождается нарушением нейроиммуноэндокринной регуляции, что может привести к развитию фатальных осложнений у детей с банальной инфекцией. Это состояние, хорошо известное патоморфологам, характеризуется выраженной реакцией лимфоидных фолликулов во всех органах и тканях периферической иммунной системы, дистрофией телец Гассаля в тимусе и гипоплазией коры надпочечников [4].
Традиционно основным методом лечения детей с ГНМ является хирургическое вмешательство с резекцией части миндалин (тонзиллотомия), которая, однако, не всегда эффективна [5]. По мнению ряда исследователей [6], проведение тонзиллотомии в возрасте до 8 лет приводит не только к нарушению механизмов местной иммунной защиты, но и к снижению общего иммунитета. Данный вид оперативного вмешательства оказывает мощное иммуносупрессивное воздействие на организм ребенка и может повлечь за собой не ожидаемое снижение частоты, а, напротив, повышение частоты острых респираторных заболеваний и стать пусковым механизмом развития хронического воспаления верхних дыхательных путей и иммунодефицитного состояния [7].
Высокий процент рецидивов ГНМ после тонзиллотомии связан с тем, что сама ГНМ является проявлением реактивной системной ГЛТ, а удаление части органа периферической иммунной системы провоцирует дальнейшее компенсаторное увеличение доли лимфоидной ткани в периферических лимфоидных органах и, соответственно, их увеличение. Это состояние хорошо известно педиатрам как лимфатико-гипопластический диатез, который встречается у 10% детей младшего возраста (в популяции) и до 30% детей с вторичной иммунной недостаточностью и хроническими вирусными и бактериальными инфекциями [4].
Все это делает актуальным поиск новых подходов к диагностике, дифференцированному выбору тактики лечения детей с ГНМ и оптимизации консервативной терапии.
Изучение состояния иммунной системы пациента строится на анализе клинических и лабораторных данных, а также оценке состояния периферических органов иммунной системы.
Лабораторная диагностика позволяет изучить широкий спектр иммунологических параметров. Следует, однако, отметить, что показатели иммунограммы характеризуют состояние иммунитета лишь в определенный короткий период времени, что связано с короткой продолжительностью активности клеток и медиаторов, участвующих в иммунном ответе: например, для лимфоцитов этот показатель составляет лишь 3–7 дней, для цитокинов — всего несколько минут. Кроме того, показатели иммунограммы зависят от возраста и пола пациента, физиологического гормонального цикла, биологических ритмов организма, физической нагрузки, привычных интоксикаций, техногенной нагрузки, факторов острого или хронического стресса, эпидемиологической обстановки и т. д.
На все это накладывается значительный разброс нормативных значений показателей иммунограммы в популяции клинически здоровых людей: по абсолютному количеству лейкоцитов — в 3,3 раза, по В-лимфоцитам — в 10 раз, Ig A — в 9 раз, Ig M — в 10 раз, Ig G — в 4 раза.
Важные данные о состоянии органов и тканей иммунной системы пациента предоставляют современные методы визуализации. Так, мультиспиральная и конусно-лучевая компьютерная томография, магнитно-резонансная томография позволяют получить важную диагностическую информацию о состоянии верхних дыхательных путей — рото- и носоглотки, придаточных пазух носа. Наиболее полное представление о состоянии периферических органов иммунной системы (небных миндалин, лимфатических узлов, селезенки) у детей, определяющее дифференцированный подход к ведению детей с ГНМ, позволяет получить ультразвуковое исследование (УЗИ) [8, 9].
Следует отметить, что именно комплексная ультразвуковая оценка состояния органов периферической иммунной системы позволяет дать ответ на основной вопрос, интересующий педиатров, ЛОР-врачей и иммунологов, от понимания которого зависит определение тактики лечения (хирургическое лечение или консервативная терапия) и объем консервативной терапии конкретного пациента: ГНМ обусловлена местными или системными иммунными проблемами?
Приходится, однако, констатировать, что широкого распространения УЗИ органов периферической иммунной системы еще не получило и алгоритм обследования детей с ГНМ остается дискутабельным и нуждается во внедрении высокоинформативных и простых в исполнении диагностических методов.
Цель исследования: обосновать необходимость ультразвуковой оценки состояния периферических органов иммунной системы для определения тактики лечения и контроля эффективности консервативной иммуномодулирующей терапии у детей с ГНМ с применением азоксимера бромида.
Материал и методы
Открытое проспективное когортное двухцентровое исследование проведено на базе ФБУН «ФНЦ медико-профилактических технологий управления рисками здоровью населения» и ФГБУ «ЦНИИС и ЧЛХ» Минздрава России. В исследование включены 167 детей (79 мальчиков, 88 девочек) в возрасте от 3 до 7 лет, которые были разделены на 2 группы: основную группу (77 детей — 36 мальчиков, 41 девочка) и контрольную группу (90 детей — 43 мальчика, 47 девочек).
Включение в исследование детей указанного возраста обусловлено наибольшей распространенностью ГНМ в данной возрастной категории. Критериями включения детей в основную группу являлись: наличие ГНМ, установленной врачом-оториноларингологом, и признаков системной ГЛТ, выявленных при УЗИ. Ультразвуковые признаки системной ГЛТ: увеличение коэффициента массы селезенки более 4 с признаками реакции фолликулов; реактивная гиперплазия шейных и брыжеечных лимфатических узлов — регионарных зон с наибольшей антигенной стимуляцией.
Контрольную группу составили дети с отсутствием острых инфекционных заболеваний и обострения хронических заболеваний носоглотки, дыхательных путей, острых желудочно-кишечных инфекций в течение предыдущих 3 мес., без ГНМ.
С учетом необходимости изучения состояния селезенки у детей для выявления системной ГЛТ критериями исключения для обеих групп являлись: заболевания органов сердечно-сосудистой системы и печени, вызывающие изменения портальной гемодинамики; заболевания крови; лимфопролиферативные и наследственные болезни; онкологические заболевания.
Всем детям выполнен анализ показателей общей иммунограммы с CD-типированием клеток (CD3+, CD4+, CD8+, CD16+56+, CD25+, CD95+, CD127-), иммуноферментный анализ крови с оценкой цитокинового профиля (интерлейкины ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-17, ИЛ-1β, интерферон-гамма (ИФН-γ), инсулиноподобный фактор роста, фактор роста эндотелия сосудов) и гормоноподобных веществ (лейкотриены), а также биохимический анализ крови. Проведен сравнительный анализ лабораторных показателей у детей основной и контрольной групп.
Определение маркеров клеточной регуляции (ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-17, фактор некроза опухоли α (ФНО-α), ИФН-γ) и лейкотриенов C4/D4/E4 выполнено методом твердофазного иммуноферментного анализа c использованием тест-систем «Вектор-Бест» (Россия), NeogenCorporation (США) на анализаторе Elx808IU (США).
Определение субпопуляций лимфоцитов выполнено методом иммунофлюоресценции на проточном цитофлюориметре FACSCalibur фирмы BectonDickinson (США) с использованием универсальной программы CellQuestPrO.
УЗИ выполнено на сканерах APLIO XG SSA-790A и VIAMO (Япония) широкополосными мультичастотными датчиками (конвексным 3–6 МГц и линейным 10–14 МГц) и на сканере MyLabTwice (Италия) широкополосными мультичастотными датчиками (конвексным 3–8 МГц и линейными 5–13 МГц и 10–22 МГц). Проводилось исследование шейных и мезентериальных лимфатических узлов по стандартной методике с оценкой кровотока в режиме цветового допплеровского картирования и импульсно-волновой допплерометрии и исследование селезенки с оценкой эхоструктуры и определением коэффициента массы селезенки по формуле:
где КМС — коэффициент массы селезенки, l — длина селезенки (мм), h — толщина селезенки (мм), M — масса тела ребенка (г). Ультразвуковое исследование было выполнено детям контрольной группы однократно, а детям основной группы дважды: в процессе отбора в основную группу (до лечения) и через 5–6 мес. после лечения для контроля реакции периферических органов иммунной системы на проводимое консервативное лечение.
После определения ультразвуковых признаков системной ГЛТ дети основной группы были проконсультированы врачом-иммунологом с назначением последующего курса персонализированной терапии. Базовым препаратом в лечении пациентов с системной ГЛТ и сопутствующей ГНМ являлся азоксимера бромид (Полиоксидоний®). Всем детям назначался лиофилизат для инъекций в дозе 0,1 мг/кг внутримышечно по схеме (3 дня подряд, далее через день, общим курсом 10 инъекций). Применение инъекционной формы введения препарата было обусловлено системным изменением лимфоидных органов. При наличии сопутствующей бактериальной инфекции проводилась антибактериальная терапия; при наличии аллергопатологии назначался курс антигистаминных или антилейкотриеновых препаратов; при нарушении кишечного биоценоза — пробиотические препараты.
Полиоксидоний® (азоксимера бромид) является N-оксидированным производным полиэтиленпиперазина и по своему химическому строению близок к веществам природного происхождения. Многочисленные публикации в отечественной и зарубежной литературе демонстрируют высокую эффективность Полиоксидония при острых и хронических инфекционно-воспалительных заболеваниях, в т. ч. ЛОР-органов, у детей, его выраженный профилактический эффект у часто и длительно болеющих лиц [10, 11], а также его безопасность, что особенно актуально для применения в педиатрической практике.
Статистическую обработку данных проводили с помощью программы Statistica 6.1. Количественные признаки, подчиняющиеся законам нормального распределения, представлены в виде М (среднее значение) и m (ошибка среднего значения, стандартное отклонение), вычисляли t-критерий Стьюдента. Различия считали статистически значимыми при р≤0,05.
Результаты исследования
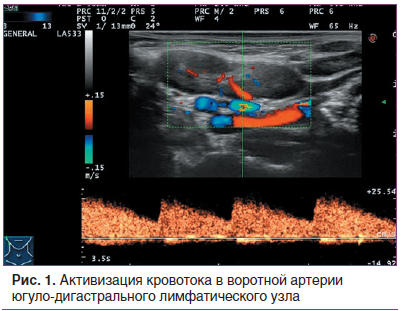
УЗИ позволило выявить достоверные межгрупповые различия (p≤0,05) по ряду количественных и качественных ультразвуковых параметров, указывающих на системную ГЛТ в периферических органах иммунной системы.Наблюдались достоверные различия в максимальной линейной скорости кровотока (ЛСК) в артерии югуло-дигастрального лимфатического узла (наиболее крупный лимфатический узел шеи) (рис. 1): среднегрупповое значение ЛСК в основной группе составило 14,5±1,8 см/с, в контрольной — 11,7±1,6 см/с.
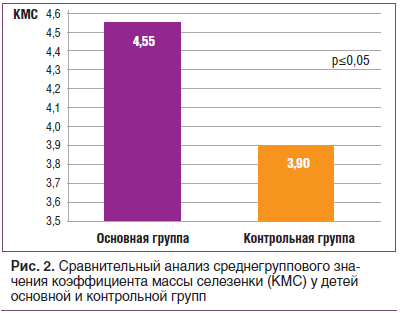
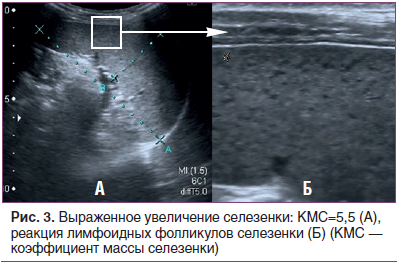
В основной группе было достоверно (p≤0,05) увеличено среднегрупповое значение коэффициента массы селезенки (4,55) в сравнении с группой здоровых детей (КМС=3,9) (рис. 2). При сканировании высокочастотным датчиком у 92,2% детей основной группы (71 человек) отмечалась реактивная гиперплазия фолликулов селезенки разной степени выраженности (рис. 3).
Сравнительный анализ показал достоверные различия ряда иммунологических, иммуноферментных и биохимических параметров у детей исследуемых групп (табл. 1).
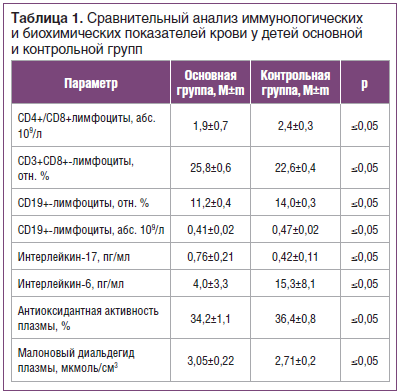
У детей основной группы отмечаются значимые отклонения уровня интерлейкинов, играющих важную роль в координации защитных механизмов. Они являются регуляторами и медиаторами иммунной системы. Достоверные различия в абсолютном и относительном содержании цитотоксических лимфоцитов и В-клеток (CD19+ лимфоциты), участвующих в гуморальном ответе, а также цитокинов, являющихся связующим звеном между врожденным и специфическим иммунным ответом, свидетельствуют о дисфункции иммунной системы. Тенденция к повышению малонового диальдегида в плазме крови характеризует активность свободнорадикального окисления и усиление процессов перекисного окисления липидов у детей основной группы, а тенденция к снижению антиоксидантной активности плазмы свидетельствует о нарушении стабильности цитомембран и усилении процессов липопероксидации в организме.
После проведения персонализированной терапии, в основе которой была схема внутримышечного введения лиофилизата Полиоксидония, дети основной группы были осмотрены врачом-оториноларингологом. У 60% детей (46 человек) было установлено уменьшение размеров небных миндалин, снижение степени гипертрофии. При УЗИ достоверно (p≤0,05) уменьшилось среднегрупповое значение коэффициента массы селезенки (рис. 4) (через 6 мес. после лечения), сканирование селезенки высокочастотным датчиком показало уменьшение реакции лимфоидных фолликулов в паренхиме органа.

Селезенка является самым крупным органом периферической иммунной системы, поэтому отражает состояние всей лимфоидной ткани в организме, а изменение ее размера и состояния фолликулов на фоне лечения свидетельствует о положительной динамике и эффективности проводимой терапии.
Высокая эффективность терапии препаратом Полиоксидоний® у детей основной группы, в которой было выявлено усиление свободнорадикального окисления и нарушение стабильности клеточных мембран, вероятно, обусловлена мембраностабилизирующим, антиоксидантным и детоксицирующим эффектами препарата. Выраженное иммуномодулирующее действие препарата Полиоксидоний® у детей с системной ГЛТ способствует повышению функциональной активности цитокинов, активации клеточного и гуморального иммунитета, что приводит к снижению реактивной лимфоидной гиперплазии в периферических органах иммунной системы и уменьшению значения коэффициента массы селезенки — маркера состояния лимфоидной ткани, что клинически проявляется снижением частоты острых заболеваний и обострений хронических заболеваний [8].
Заключение
Проведенное исследование показало, что комплексная ультразвуковая оценка состояния периферических органов иммунной системы позволяет различить местную и системную ГЛТ у детей с ГНМ и может быть использована как метод определения исходного состояния лимфоидных органов и метод контроля эффективности консервативного лечения.Анализ полученных результатов применения комплексной консервативной терапии с Полиоксидонием в качестве базового препарата показал достоверное уменьшение коэффициента массы селезенки, что связано с уменьшением степени гиперплазии лимфоидных фолликулов селезенки и свидетельствует об общем снижении выраженности ГЛТ у детей с ГНМ. Данный эффект, вероятнее всего, связан с иммуномодулирующим, детоксицирующим, противовоспалительным и антиоксидантным действием Полиоксидония. Полученные данные согласуются с результатами исследования В.П. Вавиловой [10], в котором показано, что применение Полиоксидония приводит к снижению степени ГМН у детей, а также подтверждаются многочисленными клиническими исследованиями.
Таким образом, дети с ГНМ и системной ГЛТ нуждаются в консервативной терапии с применением Полиоксидония в качестве базового препарата. Ультразвуковое исследование может быть использовано не только как метод определения исходного состояния лимфоидных органов, но и как метод контроля эффективности консервативного лечения.








.gif)



