–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –±–Њ–ї–Є –љ–µ —Г—Б—В–Њ—П–ї–∞—Б—М. –Ш—Б—Е–Њ–і—П –Є–Ј —А–∞–Ј–ї–Є—З–Є–є –≤ –∞–љ–∞—В–Њ–Љ–Є–Є –Є –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є–Є –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ–Љ –∞–≤—В–Њ—А–Њ–Љ –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М 3 —В–Є–њ–∞ –±–Њ–ї–Є:
– –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–∞—П;
– –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–∞—П;
– –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П.
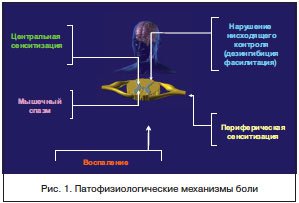
–Ю—Б–љ–Њ–≤–љ–∞—П –Є–і–µ—П –Є–і–µ–љ—В–Є—Д–Є–Ї–∞—Ж–Є–Є —В–Є–њ–Њ–≤ –±–Њ–ї–Є –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ–±—Л –Њ–њ—А–µ–і–µ–ї–Є—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л (—А–Є—Б. 1) –Є –њ–Њ–і–Њ–±—А–∞—В—М –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, —Б–њ–Њ—Б–Њ–±–љ—Л–µ —Ж–µ–ї–µ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ –≤–ї–Є—П—В—М –љ–∞ —Н—В–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –±–Њ–ї–Є.
–Э–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–Њ–є –љ–∞–Ј—Л–≤–∞—О—В –±–Њ–ї—М, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й—Г—О –≤ –Њ—В–≤–µ—В –љ–∞ —А–∞–Ј–і—А–∞–ґ–µ–љ–Є–µ –±–Њ–ї–µ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (–љ–Њ—Ж–Є—Ж–µ–њ—В–Њ—А–Њ–≤) —В–µ–њ–ї–Њ–≤—Л–Љ–Є, —Е–Њ–ї–Њ–і–Њ–≤—Л–Љ–Є, –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–Љ–Є, —Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ–Є —Б—В–Є–Љ—Г–ї–∞–Љ–Є –Є–ї–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ–Љ.
–Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–∞—П –±–Њ–ї—М —П–≤–ї—П–µ—В—Б—П –∞–і–∞–њ—В–Є–≤–љ–Њ–є –Ј–∞—Й–Є—В–љ–Њ–є —А–µ–∞–Ї—Ж–Є–µ–є – –Њ–љ–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –≤—Л–ґ–Є–≤–∞–љ–Є—О –Њ—Б–Њ–±–Є. –Я—А–Є —Б–Њ—Б—В–Њ—П–≤—И–µ–Љ—Б—П –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–Є —В–Ї–∞–љ–µ–є –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П —А–µ–∞–Ї—Ж–Є—П, –Њ–і–љ–Є–Љ –Є–Ј —Б–ї–µ–і—Б—В–≤–Є–є –Ї–Њ—В–Њ—А–Њ–є —П–≤–ї—П–µ—В—Б—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П –±–Њ–ї—М. –Ь–∞–Ї—А–Њ—Д–∞–≥–Є, —В—Г—З–љ—Л–µ –Ї–ї–µ—В–Ї–Є –Є –љ–µ–є—В—А–Њ—Д–Є–ї—Л –≤—Л–і–µ–ї—П—О—В –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –Љ–µ–і–Є–∞—В–Њ—А—Л –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –Ґ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—В –љ–∞ –љ–Њ—Ж–Є—Ж–µ–њ—В–Њ—А—Л –Є –њ–Њ–≤—Л—И–∞—О—В –Є—Е —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М. –Э–∞ —Н—В–Њ–Љ —Д–Њ–љ–µ –і–∞–ґ–µ –љ–µ–±–Њ–ї—М—И–Њ–µ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–µ, —В–µ–Љ–њ–µ—А–∞—В—Г—А–љ–Њ–µ –Є–ї–Є —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–µ —А–∞–Ј–і—А–∞–ґ–µ–љ–Є–µ –≤–Њ—Б–њ—А–Є–љ–Є–Љ–∞–µ—В—Б—П –Ї–∞–Ї –±–Њ–ї–µ–≤–Њ–є —Б–Є–≥–љ–∞–ї. –¶–µ–ї—М –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –±–Њ–ї–Є – –љ–µ –і–Њ–њ—Г—Б—В–Є—В—М –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–є —В—А–∞–≤–Љ–∞—В–Є–Ј–∞—Ж–Є–Є —В–Ї–∞–љ–µ–є –Є —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –Њ–±–µ—Б–њ–µ—З–Є—В—М –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–µ —Г—Б–ї–Њ–≤–Є—П –і–ї—П –Є—Е –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П. –Ю–і–љ–∞–Ї–Њ –≤ —Б–ї—Г—З–∞—П—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (–љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–Љ –∞—А—В—А–Є—В–µ) –∞–і–∞–њ—В–Є–≤–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –±–Њ–ї–Є —Г—В—А–∞—З–Є–≤–∞–µ—В—Б—П.
–Э–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–∞—П –±–Њ–ї—М –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –њ—А–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–Є –Є–ї–Є –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –ї–Є–±–Њ —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –Ј–≤–µ–љ—М–µ–≤ —Б–Њ–Љ–∞—В–Њ—Б–µ–љ—Б–Њ—А–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л: –њ—А–Є —В—А–∞–≤–Љ–µ –љ–µ—А–≤–∞, –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є–Є, –њ–Њ—Б—В–≥–µ—А–њ–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–≤—А–∞–ї–≥–Є–Є, —В—А–∞–≤–Љ–µ —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П—Е –Є–љ—Б—Г–ї—М—В–∞, —А–∞—Б—Б–µ—П–љ–љ–Њ–Љ —Б–Ї–ї–µ—А–Њ–Ј–µ –Є –і—А. –Э–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–∞—П –±–Њ–ї—М, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–Њ–є –Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є, –љ–µ —П–≤–ї—П–µ—В—Б—П —Б–Є–≥–љ–∞–ї–Њ–Љ –Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–Є —В–Ї–∞–љ–µ–є –Є –љ–µ –Є–Љ–µ–µ—В –Ј–∞—Й–Є—В–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є. –Х–µ –њ—А–Є—З–Є–љ–∞ – –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —Б–∞–Љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ–µ –љ–∞ —А–∞–Ј–љ—Л—Е —Г—А–Њ–≤–љ—П—Е.
–Х—Й–µ –Њ–і–Є–љ –≤–Є–і –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є – –±–Њ–ї—М –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–∞—П –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –љ–Њ—Ж–Є—Ж–µ–њ—В–Њ—А–Њ–≤ –Є –≤–Є–і–Є–Љ–Њ–≥–Њ –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П, –≤ —В. —З. —Б–Њ —Б—В–Њ—А–Њ–љ—Л –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –°—Г—В—М –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ —Н—В–∞ –±–Њ–ї—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л—Е —Б–Є—Б—В–µ–Љ, —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ –Ї–Њ–љ—В—А–Њ–ї–µ –±–Њ–ї–Є. –≠—В–Є –љ–∞—А—Г—И–µ–љ–Є—П –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –њ—А–Є–љ—П—В–Њ –љ–∞–Ј—Л–≤–∞—В—М «–љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Њ–±—А–∞–±–Њ—В–Ї–Є —Б–µ–љ—Б–Њ—А–љ–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є» –Є–ї–Є «—Б–Є–љ–і—А–Њ–Љ–Њ–Љ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ —Г—Б–Є–ї–µ–љ–Є—П –±–Њ–ї–Є».
–У–ї–∞–≤–љ–Њ–µ –Њ—В–ї–Є—З–Є–µ –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —В–Є–њ–∞ –±–Њ–ї–Є –Њ—В –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–Њ–є –Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ –њ—А–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–µ —Г–і–∞–µ—В—Б—П –≤—Л—П–≤–Є—В—М –њ—А–Є—З–Є–љ—Г –±–Њ–ї–Є –Є–ї–Є –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥–ї–Є –±—Л –Њ–±—К—П—Б–љ–Є—В—М –µ–µ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є–µ. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є–Љ–Є —А–∞–Ј–≤–Є—В–Є—О —Н—В–Њ–≥–Њ —В–Є–њ–∞ –±–Њ–ї–Є, —П–≤–ї—П—О—В—Б—П –љ–µ –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є–ї–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П, –∞ –њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ, —Б–Њ—Ж–Є–∞–ї—М–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л –Є —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є —Б—В—А–µ—Б—Б. –Ш–Љ–µ–љ–љ–Њ –Њ–љ–Є –Є–≥—А–∞—О—В –Ї–ї—О—З–µ–≤—Г—О —А–Њ–ї—М –≤ –љ–∞—А—Г—И–µ–љ–Є–Є –∞–і–µ–Ї–≤–∞—В–љ–Њ–є —А–∞–±–Њ—В—Л –љ–Є—Б—Е–Њ–і—П—Й–Є—Е –љ–Њ—А–∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–є –Є —Б–µ—А–Њ—В–Њ–љ–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–є —Б–Є—Б—В–µ–Љ. –Т –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ —Н—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —В–Њ–Љ—Г, —З—В–Њ –Њ–±—Л—З–љ—Л–µ –љ–µ–±–Њ–ї–µ–≤—Л–µ —Б—В–Є–Љ—Г–ї—Л –љ–∞—З–Є–љ–∞—О—В –≤–Њ—Б–њ—А–Є–љ–Є–Љ–∞—В—М—Б—П –Ї–∞–Ї –±–Њ–ї–µ–≤—Л–µ. –Ъ —В–Є–њ–Є—З–љ—Л–Љ –њ—А–Є–Љ–µ—А–∞–Љ —В–∞–Ї–Њ–є –±–Њ–ї–Є –Њ—В–љ–Њ—Б—П—В—Б—П —Д–Є–±—А–Њ–Љ–Є–∞–ї–≥–Є—П, –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М –љ–∞–њ—А—П–ґ–µ–љ–Є—П –Є –њ—Б–Є—Е–Њ–≥–µ–љ–љ—Л–µ –±–Њ–ї–Є (—Б–Њ–Љ–∞—В–Њ—Д–Њ—А–Љ–љ–Њ–µ –±–Њ–ї–µ–≤–Њ–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–Њ). –Т –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —Н—В–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є–Љ–µ–љ–љ–Њ –њ—Б–Є—Е–Њ—Б–Њ—Ж–Є–∞–ї—М–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л —П–≤–ї—П—О—В—Б—П –≥–ї–∞–≤–љ—Л–Љ–Є.
–Т –Њ—В–і–µ–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г –Љ–Њ–ґ–љ–Њ –≤—Л–і–µ–ї–Є—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –±–Њ–ї—М –њ–Њ —Б–≤–Њ–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ —П–≤–ї—П–µ—В—Б—П —Б–Љ–µ—И–∞–љ–љ–Њ–є. –≠—В–Њ —В–∞–Ї–Є–µ –±–Њ–ї–µ–Ј–љ–Є, –Ї–∞–Ї –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–є —А–µ–≥–Є–Њ–љ–∞—А–љ—Л–є –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ, —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –њ–Њ—Б—В–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–∞—П –±–Њ–ї—М, —Б–Є–љ–і—А–Њ–Љ —А–∞–Ј–і—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞, –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ—Л–є —Ж–Є—Б—В–Є—В, –≤—Г–ї—М–≤–Њ–і–Є–љ–Є—П, —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П —В–∞–Ј–Њ–≤–∞—П –±–Њ–ї—М, —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–Є. –Я—А–Є —Н—В–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —А–∞–±–Њ—В–µ —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л—Е –∞–љ—В–Є–љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л—Е —Б–Є—Б—В–µ–Љ (–і–Є—Б—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В) –Љ–Њ–≥—Г—В —А–∞–Ј–≤–Є–≤–∞—В—М—Б—П –Ї–∞–Ї –њ–µ—А–≤–Є—З–љ–Њ, —В–∞–Ї –Є –≤—В–Њ—А–Є—З–љ–Њ –љ–∞—А—П–і—Г —Б –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–Љ–Є –Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ–Є. –≠—В–Њ –Є–Љ–µ–µ—В —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П –њ–Њ–љ–Є–Љ–∞–љ–Є—П —Н—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–є –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л–µ –Ј–≤–µ–љ—М—П –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞: –Ї–∞–Ї –љ–∞ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–µ, —В–∞–Ї –Є –љ–∞ —Ж–µ–љ—В—А–∞–ї—М–љ—Л–µ.
–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П—О—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –±–Њ–ї—М –њ—А–Є —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–Є –Ї–∞–Ї —Б–Љ–µ—И–∞–љ–љ—Л–є —Б–Є–љ–і—А–Њ–Љ, –≥–і–µ –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В –Ї–∞–Ї –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–є, —В–∞–Ї –Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л.
–Ш—Б—Е–Њ–і—П –Є–Ј –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–Њ–≥–Њ –Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Є–њ–Њ–≤ –±–Њ–ї–Є —Б—В–∞–ї–Њ –њ–Њ–љ—П—В–љ—Л–Љ, —З—В–Њ –њ—А–Є —Б–Љ–µ—И–∞–љ–љ—Л—Е —Б–Є–љ–і—А–Њ–Љ–∞—Е –≤–∞–ґ–љ–Њ –Њ—Ж–µ–љ–Є—В—М –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ—Б—В—М —Н—В–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ —Б —Ж–µ–ї—М—О –њ—А–Њ–≤–µ–і–µ–љ–Є—П —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –љ–µ–і–∞–≤–љ–Є—Е —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є—Б–Ї–Њ–≥–µ–љ–љ–Њ–є —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–µ–є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В –±–Њ–ї–Є –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ 35% —Б–ї—Г—З–∞–µ–≤ [R. Freynhagen, R. Baron].
–І–∞—Й–µ –≤—Б–µ–≥–Њ –±–Њ–ї—М –≤ —Б–њ–Є–љ–µ (–С–°) –њ—А–Є –Ї–Њ–Љ–њ—А–µ—Б—Б–Є–Њ–љ–љ–Њ–є —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –≥—А—Л–ґ–µ–є –Љ–µ–ґ–њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Њ–≥–Њ –і–Є—Б–Ї–∞ –Є–ї–Є —Б—В–µ–љ–Њ–Ј–Њ–Љ —Б–њ–Є–љ–љ–Њ–Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї–∞–љ–∞–ї–∞. –Т —В–Є–њ–Є—З–љ—Л—Е —Б–ї—Г—З–∞—П—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –Њ–њ–Є—Б—Л–≤–∞—О—В—Б—П –Ї–∞–Ї —А–∞–і–Є–Ї—Г–ї—П—А–љ—Л–µ («–Ї–Њ—А–µ—И–Ї–Њ–≤—Л–µ») –±–Њ–ї–Є: –Њ—Б—В—А—Л–µ «–њ—А–Њ—Б—В—А–µ–ї—Л», –Є—А—А–∞–і–Є–∞—Ж–Є—П –±–Њ–ї–Є –њ–Њ —Е–Њ–і—Г –љ–µ—А–≤–љ–Њ–≥–Њ –Ї–Њ—А–µ—И–Ї–∞, –Њ—Й—Г—Й–µ–љ–Є–µ –ґ–ґ–µ–љ–Є—П, –њ–Њ–Ї–∞–ї—Л–≤–∞–љ–Є—П –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –≤—Л–њ–∞–і–µ–љ–Є—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Б—Г—Е–Њ–ґ–Є–ї—М–љ—Л—Е —А–µ—Д–ї–µ–Ї—Б–Њ–≤ [1, 3].
–Х—Б–ї–Є –њ—А–Є –Њ—Б—В—А–Њ–є –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –С–° –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–є —В–Є–њ –±–Њ–ї–Є, –∞ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є, –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–Є–Љ–Є –і–∞–љ–љ—Л–є —В–Є–њ, —П–≤–ї—П—О—В—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –Є –Љ—Л—И–µ—З–љ—Л–є —Б–њ–∞–Ј–Љ, —В–Њ —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–Њ–≤, –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Э–Я–Т–Я) –Є –Љ–Є–Њ—А–µ–ї–∞–Ї—Б–∞–љ—В–Њ–≤ (–Ъ–∞—В–∞–і–Њ–ї–Њ–љ® –Є –Ъ–∞—В–∞–і–Њ–ї–Њ–љ® —Д–Њ—А—В–µ) —П–≤–ї—П–µ—В—Б—П –Њ–њ—А–∞–≤–і–∞–љ–љ—Л–Љ –Є –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є.
–Ю–і–љ–∞–Ї–Њ –њ—А–Є –і–Њ–Ї–∞–Ј–∞–љ–љ–Њ–Љ –±–Њ–ї–µ–≤–Њ–Љ —А–∞–і–Є–Ї—Г–ї—П—А–љ–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ —В–∞–Ї–Њ–є –њ–Њ–і—Е–Њ–і –Ї –ї–µ—З–µ–љ–Є—О –љ–µ –≤—Б–µ–≥–і–∞ —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ, —З—В–Њ –љ–µ–≥–∞—В–Є–≤–љ–Њ –≤–ї–Є—П–µ—В –љ–∞ –њ—А–Њ—Ж–µ—Б—Б —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Є –Є –њ—А–Њ–≥–љ–Њ–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –С–° —А–∞–і–Є–Ї—Г–ї—П—А–љ—Л–µ –±–Њ–ї–Є —З–∞—Й–µ —Б—В–∞–љ–Њ–≤—П—В—Б—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є, –≤ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –і–µ–Ј–∞–і–∞–њ—В–Є—А—Г—О—В –±–Њ–ї—М–љ—Л—Е –Є —Б–љ–Є–ґ–∞—О—В –Ї–∞—З–µ—Б—В–≤–Њ –Є—Е –ґ–Є–Ј–љ–Є. –Т–Њ –Љ–љ–Њ–≥–Є—Е —Б–ї—Г—З–∞—П—Е –њ—А–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є–Є –≥—А—Л–ґ–Є –Љ–µ–ґ–њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Њ–≥–Њ –і–Є—Б–Ї–∞ –љ–∞ –Љ–∞–≥–љ–Є—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є –њ—А–Њ–≤–Њ–і—П—В –љ–µ–Њ–њ—А–∞–≤–і–∞–љ–љ–Њ–µ (–љ–µ –њ–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ) —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ј–∞—З–∞—Б—В—Г—О –Ї —А–∞–Ј–≤–Є—В–Є—О —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –≤ —А–∞–Љ–Ї–∞—Е —Б–Є–љ–і—А–Њ–Љ–∞ «–љ–µ—Г–і–∞—З–љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–µ». –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –ї–µ—З–µ–љ–Є–µ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –њ—А–Є —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Б–ї–Њ–ґ–љ—Л–Љ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —В–Є–њ –±–Њ–ї–Є –Є–Љ–µ–µ—В —Б–Љ–µ—И–∞–љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А [3, 7, 16]. –Я—А–Є —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–Є –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –±–Њ–ї–Є –Љ–Њ–≥—Г—В –±—Л—В—М –Ї–∞–Ї –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –љ–Њ—Ж–Є—Ж–µ–њ—В–Њ—А–Њ–≤ —Б–∞–Љ–Њ–≥–Њ –Љ–µ–ґ–њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤–Њ–≥–Њ –і–Є—Б–Ї–∞, —В–∞–Ї –Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –Љ–µ–і–Є–∞—В–Њ—А—Л –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –ї–Њ–Ї–∞–ї—М–љ–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—П –љ–∞ –љ–µ—А–≤–љ—Л–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –≤ —В–Ї–∞–љ—П—Е, —Г—З–∞—Б—В–≤—Г—О—В –≤ –≥–µ–љ–µ—А–∞—Ж–Є–Є –±–Њ–ї–µ–≤—Л—Е –Њ—Й—Г—Й–µ–љ–Є–є. –Т —В–∞–Ї–Њ–Љ —Б–ї—Г—З–∞–µ –≥–Њ–≤–Њ—А—П—В –Њ –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–Њ–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–µ –±–Њ–ї–Є.
–Ь–µ—Е–∞–љ–Є—З–µ—Б–Ї–∞—П –Ї–Њ–Љ–њ—А–µ—Б—Б–Є—П –Ї–Њ—А–µ—И–Ї–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–≤–Є—В–Є—О –Њ—З–∞–≥–Њ–≤ —Н–Ї—В–Њ–њ–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Є–Љ–њ—Г–ї—М—Б–∞—Ж–Є–Є, –Є–Ј–±—Л—В–Њ—З–љ–Њ–є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –љ–∞—В—А–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤, –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є —Б–µ–љ—Б–Є—В–Є–Ј–∞—Ж–Є–Є. –Э–∞ —Н—В–Њ–Љ —Д–Њ–љ–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Ж–µ–љ—В—А–∞–ї—М–љ–∞—П —Б–µ–љ—Б–Є—В–Є–Ј–∞—Ж–Є—П – –њ–Њ–≤—Л—И–µ–љ–љ–∞—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є –Є–Ј–±—Л—В–Њ—З–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–µ–љ—Б–Њ—А–љ—Л—Е –љ–µ–є—А–Њ–љ–Њ–≤ –Ј–∞–і–љ–µ–≥–Њ —А–Њ–≥–∞. –Т—Б–ї–µ–і—Б—В–≤–Є–µ —Б–љ–Є–ґ–µ–љ–Є—П –њ–Њ—А–Њ–≥–∞ –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є—П —Н—В–Є—Е –љ–µ–є—А–Њ–љ–Њ–≤ –ї—О–±–∞—П –љ–µ–±–Њ–ї–µ–≤–∞—П –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–∞—П —Б—В–Є–Љ—Г–ї—П—Ж–Є—П –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї –≥–µ–љ–µ—А–Є—А–Њ–≤–∞–љ–Є—О –±–Њ–ї–µ–≤—Л—Е –Є–Љ–њ—Г–ї—М—Б–Њ–≤. –Я—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ–µ—А—Б–Є—Б—В–Є—А–Њ–≤–∞–љ–Є–Є –±–Њ–ї–Є —Б–љ–Є–ґ–∞–µ—В—Б—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –љ–Є—Б—Е–Њ–і—П—Й–Є—Е –∞–љ—В–Є–љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л—Е –≤–ї–Є—П–љ–Є–є, —З—В–Њ —В—А–∞–Ї—В—Г–µ—В—Б—П –Ї–∞–Ї –і–µ–Ј–Є–љ–≥–Є–±–Є—Ж–Є—П.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –±–Њ–ї–Є –њ—А–Є —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–Є –њ—А–Є–љ–Є–Љ–∞—О—В —Г—З–∞—Б—В–Є–µ –Ї–∞–Ї –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–µ (—Н–Ї—В–Њ–њ–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М, —Н–Ї—Б–њ—А–µ—Б—Б–Є—П –љ–∞—В—А–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤, —Ж–µ–љ—В—А–∞–ї—М–љ–∞—П —Б–µ–љ—Б–Є—В–Є–Ј–∞—Ж–Є—П, –і–µ–Ј–Є–љ–≥–Є–±–Є—Ж–Є—П), —В–∞–Ї –Є –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–µ (–∞–Ї—В–Є–≤–∞—Ж–Є—П –љ–Њ—Ж–Є—Ж–µ–њ—В–Њ—А–Њ–≤, –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ) –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л. –†–∞–Ј—Г–Љ–µ–µ—В—Б—П, –љ–µ–ї—М–Ј—П –Ј–∞–±—Л–≤–∞—В—М –Є –Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–є —А–Њ–ї–Є –њ—Б–Є—Е–Њ–≥–µ–љ–љ—Л—Е –Є —Б–Њ—Ж–Є–∞–ї—М–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –≤ —А–∞–Ј–≤–Є—В–Є–Є –Є —Е—А–Њ–љ–Є—Д–Є–Ї–∞—Ж–Є–Є –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, —З—В–Њ –і–µ—В–∞–ї—М–љ–Њ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П –≤ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ [1, 12]. –°—В—А—Г–Ї—В—Г—А–љ—Л–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П, –≤–µ—А–Њ—П—В–љ–Њ, –Є–≥—А–∞—О—В —А–Њ–ї—М —В—А–Є–≥–≥–µ—А–∞, –Є–ї–Є –Ј–∞–њ—Г—Б–Ї–∞—О—Й–µ–≥–Њ —Д–∞–Ї—В–Њ—А–∞, –Є –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї—М –њ–µ—А—Б–Є—Б—В–Є—А—Г–µ—В –њ—А–Є –і–Њ–Љ–Є–љ–Є—А—Г—О—Й–µ–є —А–Њ–ї–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ (–љ–µ–є—А–Њ–њ–ї–∞—Б—В–Є—З–љ–Њ—Б—В–Є) –Є –њ—Б–Є—Е–Њ—Б–Њ—Ж–Є–∞–ї—М–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –∞ –љ–µ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —Б—В—А—Г–Ї—В—Г—А–∞—Е –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞.
–° —Г—З–µ—В–Њ–Љ —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –±–Њ–ї–Є –њ—А–Є —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–Є –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤—Б–µ —З–∞—Й–µ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є, –њ–Њ–і –Ї–Њ—В–Њ—А–Њ–є –њ–Њ–і—А–∞–Ј—Г–Љ–µ–≤–∞—О—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –і–µ–є—Б—В–≤—Г—О—Й–Є—Е –љ–∞ –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–є, –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–є –Є –њ—Б–Є—Е–Њ–≥–µ–љ–љ—Л–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –±–Њ–ї–Є [3, 8]. –•–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–µ –±–Њ–ї–Є —Г—Б–њ–µ—И–љ–Њ –њ–Њ–і–і–∞—О—В—Б—П –ї–µ—З–µ–љ–Є—О –Э–Я–Т–Я –Є –Љ–Є–Њ—А–µ–ї–∞–Ї—Б–∞–љ—В–∞–Љ–Є, —В–Њ–≥–і–∞ –Ї–∞–Ї –њ—А–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В—Л, –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В—Л, –Њ–њ–Є–Њ–Є–і—Л –Є –Љ–µ—Б—В–љ—Л–µ –∞–љ–µ—Б—В–µ—В–Є–Ї–Є. –Я—А–Є –њ—Б–Є—Е–Њ–≥–µ–љ–љ–Њ–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–µ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л –њ—Б–Є—Е–Њ—В–µ—А–∞–њ–Є—П –Є –њ—Б–Є—Е–Њ—В—А–Њ–њ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Г—В–Њ—З–љ—П—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ—Б—В—М –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ, –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–Њ–≥–Њ –Є –њ—Б–Є—Е–Њ–≥–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤, –Љ–Њ–ґ–љ–Њ —Б–Њ—Б—В–∞–≤–Є—В—М –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Г—О —Б—Е–µ–Љ—Г –ї–µ—З–µ–љ–Є—П, –Ї–Њ–Љ–±–Є–љ–Є—А—Г—П –њ—А–µ–њ–∞—А–∞—В—Л —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є –і–µ–є—Б—В–≤–Є—П.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –±—Л–≤–∞–µ—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Б–ї–Њ–ґ–љ–Њ –Њ—Ж–µ–љ–Є—В—М —В–Њ—З–љ–Њ–µ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –Є —А–Њ–ї—М —Н—В–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –њ—А–Є —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–Љ –±–Њ–ї–µ–≤–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ. –Т –љ–∞–Є–±–Њ–ї–µ–µ –Њ–±—Й–µ–Љ –≤–Є–і–µ –Љ–Њ–ґ–љ–Њ —Б–Ї–∞–Ј–∞—В—М, —З—В–Њ –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В –њ—А–Є –±–Њ–ї—П—Е –≤ –љ–Є–ґ–љ–µ–є —З–∞—Б—В–Є —Б–њ–Є–љ—Л —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П «–њ—А–Њ—Б—В—А–µ–ї–∞–Љ–Є», –Є—А—А–∞–і–Є–∞—Ж–Є–µ–є –±–Њ–ї–Є –њ–Њ –Ї–Њ—А–µ—И–Ї—Г, –ґ–≥—Г—З–Є–Љ–Є –±–Њ–ї—П–Љ–Є –≤ —Б—В–Њ–њ–µ, —Б–Є–Љ–њ—В–Њ–Љ–Њ–Љ –Ы–∞—Б–µ–≥–∞, —В–Њ–≥–і–∞ –Ї–∞–Ї –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –ї–Њ–Ї–∞–ї—М–љ—Л–Љ–Є –љ–Њ—О—Й–Є–Љ–Є, —В—П–љ—Г—Й–Є–Љ–Є, –њ—Г–ї—М—Б–Є—А—Г—О—Й–Є–Љ–Є –±–Њ–ї—П–Љ–Є –≤ –њ–Њ—П—Б–љ–Є—З–љ–Њ-–Ї—А–µ—Б—В—Ж–Њ–≤–Њ–є –Њ–±–ї–∞—Б—В–Є –±–µ–Ј –Є—А—А–∞–і–Є–∞—Ж–Є–Є. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Љ–µ—В–Њ–і—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –љ–µ –≤—Б–µ–≥–і–∞ –њ–Њ–Ј–≤–Њ–ї—П—О—В –Ї–Њ–љ–Ї—А–µ—В–Є–Ј–Є—А–Њ–≤–∞—В—М —Г—З–∞—Б—В–Є–µ –Є —А–Њ–ї—М —В–Њ–≥–Њ –Є–ї–Є –Є–љ–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –±–Њ–ї–Є. –•–Њ—А–Њ—И–Є–Љ –њ–Њ–і—Б–њ–Њ—А—М–µ–Љ –≤ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –±–Њ–ї–Є –Љ–Њ–≥—Г—В –±—Л—В—М —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–µ –Њ–њ—А–Њ—Б–љ–Є–Ї–Є. –Т –†–Њ—Б—Б–Є–Є –≤–∞–ї–Є–і–Є–Ј–Є—А–Њ–≤–∞–љ—Л —Б–Ї—А–Є–љ–Є–љ–≥–Њ–≤—Л–µ –Њ–њ—А–Њ—Б–љ–Є–Ї–Є Pain Detect –Є DN4 –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є [4, 9, 19]. –° –Є—Е –њ–Њ–Љ–Њ—Й—М—О –Љ–Њ–ґ–љ–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ –Њ—Ж–µ–љ–Є—В—М –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –њ—А–Є—Б—Г—В—Б—В–≤–Є—П –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –њ—А–Є –С–°.
–Я—А–Њ–≤–µ–і–µ–љ–љ—Л–µ –љ–µ–і–∞–≤–љ–Њ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В –≤—Л—Б–Њ–Ї—Г—О —З–∞—Б—В–Њ—В—Г –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ—Б—В–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –С–° [3, 17, 18, 36]. –Э–∞–њ—А–Є–Љ–µ—А, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –≤ –°–®–Р —Г 213 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –С–°, —А–∞–і–Є–Ї—Г–ї—П—А–љ—Л–є –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ –≤—Б—В—А–µ—З–∞–ї—Б—П –≤ 28% —Б–ї—Г—З–∞–µ–≤. –Т –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–Љ –±—А–Є—В–∞–љ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б—А–µ–і–Є –≤—Б–µ—Е –Њ–њ—А–Њ—И–µ–љ–љ—Л—Е, –Њ—В–Љ–µ—З–∞–≤—И–Є—Е –≤ —В–µ—З–µ–љ–Є–µ 1 –≥–Њ–і–∞ —Н–њ–Є–Ј–Њ–і—Л –С–°, 45,6% –Є–Љ–µ–ї–Є –њ—А–Є–Ј–љ–∞–Ї–Є –Є—А—А–∞–і–Є–Є—А—Г—О—Й–µ–є –±–Њ–ї–Є, –Њ–љ–µ–Љ–µ–љ–Є—П –Є –њ–Њ–Ї–∞–ї—Л–≤–∞–љ–Є—П –≤ –љ–Њ–≥–∞—Е. –Т –Њ–±—Й–µ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є —Н—В–Є –ґ–µ –њ—А–Є–Ј–љ–∞–Ї–Є –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л —Г 17,8% –Њ–њ—А–Њ—И–µ–љ–љ—Л—Е –ї—О–і–µ–є. –°–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –љ–µ –≤—Б–µ —Б–ї—Г—З–∞–Є –Є—А—А–∞–і–Є–Є—А—Г—О—Й–µ–є (–Њ—В—А–∞–ґ–µ–љ–љ–Њ–є) –±–Њ–ї–Є –Љ–Њ–ґ–љ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А–Њ–≤–∞—В—М –Ї–∞–Ї –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–µ. –°–Њ–≥–ї–∞—Б–љ–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—О, –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–∞—П –±–Њ–ї—М –≤—Б–µ–≥–і–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ (–Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ) —Б–Њ–Љ–∞—В–Њ—Б–µ–љ—Б–Њ—А–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –±–Њ–ї—М –њ—А–Є —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–Є –Љ–Њ–ґ–љ–Њ –Њ—В–љ–µ—Б—В–Є –Ї –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є. –Ю–і–љ–∞–Ї–Њ —Б–ї–µ–і—Г–µ—В —Г—З–Є—В—Л–≤–∞—В—М, —З—В–Њ –Њ—В—А–∞–ґ–µ–љ–љ–∞—П –±–Њ–ї—М –Љ–Њ–ґ–µ—В –≤–Њ–Ј–љ–Є–Ї–∞—В—М –љ–µ —В–Њ–ї—М–Ї–Њ –њ—А–Є —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–Є, –љ–Њ –Є –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Б–≤—П–Ј–Њ—З–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞, –њ–µ—А–Є–і—Г—А–∞–ї—М–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А, –Љ—Л—И—Ж, —Д–∞—Б–µ—В–Њ—З–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤, –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –њ–Њ–і–≤–Ј–і–Њ—И–љ–Њ-–Ї—А–µ—Б—В—Ж–Њ–≤–Њ–≥–Њ —Б–Њ—З–ї–µ–љ–µ–љ–Є—П.
–Ґ—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ —В–µ—А–∞–њ–Є—П –С–° –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Б–≤–Њ–і–Є—В—Б—П –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤ –Є –Љ–µ—В–Њ–і–Њ–≤ –љ–µ–ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, —В–∞–Ї–Є—Е –Ї–∞–Ї –Љ–∞—Б—Б–∞–ґ, –Љ–∞–љ—Г–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П, —З—А–µ—Б–Ї–Њ–ґ–љ–∞—П —Н–ї–µ–Ї—В—А–Њ–љ–µ–є—А–Њ—Б—В–Є–Љ—Г–ї—П—Ж–Є—П, –∞–Ї—Г–њ—Г–љ–Ї—В—Г—А–∞, –ї–∞–Ј–µ—А–Њ—В–µ—А–∞–њ–Є—П –Є –і—А. –Ш–Ј –Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –±–ї–Њ–Ї–∞–і—Л —Б –љ–Њ–≤–Њ–Ї–∞–Є–љ–Њ–Љ, –Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–∞–Љ–Є –Є–ї–Є –±–Њ—В—Г–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ —В–Њ–Ї—Б–Є–љ–Њ–Љ –≤ —А–∞–Ј–ї–Є—З–љ—Л–µ –Љ—Л—И–µ—З–љ—Л–µ —В–Њ—З–Ї–Є –Є–ї–Є —Б—Г—Б—В–∞–≤—Л. –І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є, —В–Њ –љ–∞–Ї–Њ–њ–ї–µ–љ –±–Њ–ї—М—И–Њ–є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–Њ—Б—В—Л—Е –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–Њ–≤, –Э–Я–Т–Я, –Љ—Л—И–µ—З–љ—Л—Е —А–µ–ї–∞–Ї—Б–∞–љ—В–Њ–≤, –њ–ї–∞—Б—В–Є–љ —Б –ї–Є–і–Њ–Ї–∞–Є–љ–Њ–Љ, –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В–Њ–≤, –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–Њ–≤, –Њ–њ–Є–Њ–Є–і–Њ–≤. –Ю–і–љ–∞–Ї–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Н—В–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –≤ —В–µ—А–∞–њ–Є–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –С–° –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –љ–µ —П–≤–ї—П–µ—В—Б—П –Њ—З–µ–≤–Є–і–љ–Њ–є —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –њ—А–Є–љ—Ж–Є–њ–Њ–≤ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л.
–Э–Я–Т–Я –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –ї–µ—З–µ–љ–Є—П –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–Њ–є –±–Њ–ї–Є. –Ф–ї—П –ї–µ—З–µ–љ–Є—П –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –С–° –Њ–љ–Є —П–≤–ї—П—О—В—Б—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤—Л–±–Њ—А–∞ –њ–µ—А–≤–Њ–≥–Њ –њ–Њ—А—П–і–Ї–∞. –Ю–і–љ–∞–Ї–Њ –њ—А–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –Э–Я–Т–Я, –∞ —В–∞–Ї–ґ–µ –њ–∞—А–∞—Ж–µ—В–∞–Љ–Њ–ї –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ–Є –Є –њ–Њ—Н—В–Њ–Љ—Г –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В—Б—П –і–ї—П –ї–µ—З–µ–љ–Є—П –Є –љ–µ –≤–Ї–ї—О—З–µ–љ—Л –≤ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –ї–µ—З–µ–љ–Є—О –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є [11]. –Ґ–Њ–ї—М–Ї–Њ –њ—А–Є —Б–Љ–µ—И–∞–љ–љ–Њ–Љ —В–Є–њ–µ –±–Њ–ї–Є (—В—Г–љ–љ–µ–ї—М–љ—Л–µ —Б–Є–љ–і—А–Њ–Љ—Л, —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–Є, –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –±–Њ–ї—М), –Ї–Њ–≥–і–∞ –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В –Ї–∞–Ї –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–є, —В–∞–Ї –Є –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л, –Њ–љ–Є –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –і–ї—П —Ж–µ–ї–µ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В, —З–∞—Й–µ –≤—Б–µ–≥–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Э–Я–Т–Я –Љ–Њ–≥—Г—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –і–ї—П –ї–µ—З–µ–љ–Є—П –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –С–°, –Ї–Њ–≥–і–∞ –љ–µ—В –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –љ–µ—А–≤–љ–Њ–≥–Њ –Ї–Њ—А–µ—И–Ї–∞, –∞ —В–∞–Ї–ґ–µ –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ї–Њ—А–µ—И–Ї–Њ–≤–Њ–≥–Њ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–∞–Љ–Є, –Љ–µ—Б—В–љ—Л–Љ–Є –∞–љ–µ—Б—В–µ—В–Є–Ї–∞–Љ–Є –Є –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В–∞–Љ–Є.
–°—А–µ–і–Є –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–Њ–≤ –љ–∞–Є–±–Њ–ї–µ–µ –њ—А–Є–Ј–љ–∞–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –і–ї—П –ї–µ—З–µ–љ–Є—П –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є —П–≤–ї—П—О—В—Б—П –≥–∞–±–∞–њ–µ–љ—В–Є–љ –Є –њ—А–µ–≥–∞–±–∞–ї–Є–љ [3, 11, 16, 20]. –Ь–µ—Е–∞–љ–Є–Ј–Љ –Є—Е –і–µ–є—Б—В–≤–Є—П —Б–≤—П–Ј–∞–љ —Б –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ —Ж–µ–љ—В—А–∞–ї—М–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –±–Њ–ї–Є: —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є —Б–µ–љ—Б–Є—В–Є–Ј–∞—Ж–Є–Є, —Г–ї—Г—З—И–µ–љ–Є–µ –љ–µ–є—А–Њ–Љ–µ–і–Є–∞—В–Њ—А–љ–Њ–≥–Њ –±–∞–ї–∞–љ—Б–∞ –≤ —Б—В–Њ—А–Њ–љ—Г —Г—Б–Є–ї–µ–љ–Є—П –∞–љ—В–Є–±–Њ–ї–µ–≤—Л—Е –У–Р–Ь–Ъ-–µ—А–≥–Є—З–µ—Б–Ї–Є—Е (–У–Р–Ь–Ъ – γ-–∞–Љ–Є–љ–Њ–Љ–∞—Б–ї—П–љ–∞—П –Ї–Є—Б–ї–Њ—В–∞) –≤–ї–Є—П–љ–Є–є –Є —А–µ–і—Г–Ї—Ж–Є–Є —Н—Д—Д–µ–Ї—В–Њ–≤ –≥–ї—О—В–∞–Љ–∞—В–∞ – –≥–ї–∞–≤–љ–Њ–≥–Њ –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—В—В–µ—А–∞ –±–Њ–ї–Є.
–Я—А–µ–≥–∞–±–∞–ї–Є–љ, –Њ–±–ї–∞–і–∞—П –ї–Є–љ–µ–є–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Њ–є, –Є–Љ–µ–µ—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥–∞–±–∞–њ–µ–љ—В–Є–љ–Њ–Љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –±—Л—Б—В—А–Њ—В—Л –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–∞. –Т —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л—Е —А–∞–±–Њ—В–∞—Е –Є–Ј—Г—З–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–≥–∞–±–∞–ї–Є–љ–∞ –њ—А–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –С–°. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–µ–≥–∞–±–∞–ї–Є–љ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –Э–Я–Т–Я –Є–ї–Є –Њ–њ–Є–Њ–Є–і–љ—Л–Љ–Є –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–∞–Љ–Є, –љ–µ–ґ–µ–ї–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є [13, 26, 29]. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ—А–µ–≥–∞–±–∞–ї–Є–љ–∞ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е —Б —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–µ–є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О —Н—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є.
–Я–Њ—П–≤–ї–µ–љ–Є–µ –љ–∞ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–Љ —А—Л–љ–Ї–µ –†–Њ—Б—Б–Є–Є –љ–Њ–≤–Њ–≥–Њ –µ–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –і–ґ–µ–љ–µ—А–Є–Ї–∞ –њ—А–µ–≥–∞–±–∞–ї–Є–љ–∞ – –Р–ї—М–≥–µ—А–Є–Ї–Є —А–∞—Б—И–Є—А—П–µ—В –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л–є –∞—А—Б–µ–љ–∞–ї –љ–µ–≤—А–Њ–ї–Њ–≥–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–Њ—Ж–Є–∞–ї—М–љ—Л—Е —Б–ї–Њ–µ–≤, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–µ–њ–∞—А–∞—В –Є–Љ–µ–µ—В —Ж–µ–љ–Њ–≤–Њ–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ—А–Є–≥–Є–љ–∞–ї–Њ–Љ. –Р–ї—М–≥–µ—А–Є–Ї–∞ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –≤ –і–Њ–Ј–∞—Е –Њ—В 150 –і–Њ 600 –Љ–≥/—Б—Г—В. –≠—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–є –њ–Њ–і–±–Њ—А –і–Њ–Ј—Л –Р–ї—М–≥–µ—А–Є–Ї–Є –Љ–µ—В–Њ–і–Њ–Љ –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–≥–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є—П —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј—Л –љ–∞ 75 –Љ–≥ –Ї–∞–ґ–і—Л–µ 7 –і–љ–µ–є.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —В–Њ–њ–Є—А–∞–Љ–∞—В–∞ –њ—А–Є —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є–Є –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М, –Њ–і–љ–∞–Ї–Њ –њ–Њ –њ—А–Є—З–Є–љ–µ —З–∞—Б—В—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ (—В–Њ—И–љ–Њ—В–∞, —Б–µ–і–∞—Ж–Є—П, –њ–∞—А–µ—Б—В–µ–Ј–Є–Є, –∞–Љ–љ–µ–Ј–Є—П) –Њ–љ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П —В–Њ–ї—М–Ї–Њ –Ї–∞–Ї —Б—А–µ–і—Б—В–≤–Њ –≤—Л–±–Њ—А–∞ –≤—В–Њ—А–Њ–≥–Њ –њ–Њ—А—П–і–Ї–∞ –Є –њ–Њ–Ї–∞–Ј–∞–љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –µ–≥–Њ —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є [21].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–і–Є–Ї—Г–ї—П—А–љ–Њ–є –±–Њ–ї—М—О –і–Њ–ї–ґ–љ–∞ –±—Л—В—М –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б —Г—З–µ—В–Њ–Љ –≤–Ї–ї–∞–і–∞ –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–Њ–≥–Њ, –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –њ—Б–Є—Е–Њ–≥–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤, —В. –Ї. –≤—Б–µ –Њ–љ–Є —Б –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–Љ —Г–і–µ–ї—М–љ—Л–Љ –≤–µ—Б–Њ–Љ –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В —Г —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е. –Ф–ї—П –њ–Њ–і–±–Њ—А–∞ –Ї–Њ–љ–Ї—А–µ—В–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –±–Њ–ї–Є –≤–∞–ґ–љ–Њ –Ј–љ–∞–љ–Є–µ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤. –Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ —В–Њ–ї—М–Ї–Њ —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞ —П–≤–ї—П–µ—В—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –і–ї—П –≤—Л–±–Њ—А–∞ —В–µ—А–∞–њ–Є–Є. –Э–∞—А—П–і—Г —Б –Њ—З–µ–љ—М –≤–∞–ґ–љ–Њ–є –Њ—Ж–µ–љ–Ї–Њ–є –≤—Б–µ—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–Є—Е –≤ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–µ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М —В–Њ—В —Д–∞–Ї—В, —З—В–Њ —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї—М –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —Б–Њ —Б–≤–Њ–Є–Љ–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–Љ–Є –Є —Ж–µ–љ—В—А–∞–ї—М–љ—Л–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞. –Ъ–ї–Є–љ–Є—Ж–Є—Б—В –і–Њ–ї–ґ–µ–љ –њ–Њ–і—Е–Њ–і–Є—В—М –Ї —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –С–° —З–µ—А–µ–Ј –њ–Њ–љ–Є–Љ–∞–љ–Є–µ —В–∞–Ї–Є—Е –≤–∞–ґ–љ—Л—Е –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤, –Ї–∞–Ї –љ–µ–є—А–Њ–≥–µ–љ–љ–Њ–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ, –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–∞—П —Б–µ–љ—Б–Є—В–Є–Ј–∞—Ж–Є—П, —Н–Ї—Б–њ—А–µ—Б—Б–Є—П –љ–∞—В—А–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤ –љ–µ–є—А–Њ–љ–Њ–≤ –Є —Н–Ї—В–Њ–њ–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М. –Ґ–∞–Ї–ґ–µ –љ—Г–ґ–љ–Њ –Њ—Ж–µ–љ–Є–≤–∞—В—М –≤–ї–Є—П–љ–Є–µ —Н—В–Є—Е –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –љ–∞ –њ—А–Њ—Ж–µ—Б—Б—Л –≤ –¶–Э–°: –∞–Ї—В–Є–≤–∞—Ж–Є—П NMDA-—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, —Д–µ–љ–Њ–Љ–µ–љ –≤–Ј–≤–Є–љ—З–Є–≤–∞–љ–Є—П, —Ж–µ–љ—В—А–∞–ї—М–љ–∞—П —Б–µ–љ—Б–Є—В–Є–Ј–∞—Ж–Є—П, –≤—В–Њ—А–Є—З–љ–∞—П –≥–Є–њ–µ—А–∞–ї–≥–µ–Ј–Є—П, –љ–∞—А—Г—И–µ–љ–Є—П –≤ –љ–Є—Б—Е–Њ–і—П—Й–µ–Љ —Б—Г–њ—А–∞—Б–µ–≥–Љ–µ–љ—В–∞—А–љ–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї–µ –±–Њ–ї–Є (–і–µ–Ј–Є–љ–≥–Є–±–Є—Ж–Є—П).
–Ш—В–∞–Ї, –њ—А–Є –љ–∞–ї–Є—З–Є–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ —Б–ї–µ–і—Г–µ—В –Њ—В–і–∞–≤–∞—В—М –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ –і–ї—П –ї–µ—З–µ–љ–Є—П –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є (–≥–∞–±–∞–њ–µ–љ—В–Є–љ, –њ—А–µ–≥–∞–±–∞–ї–Є–љ, –ї–Є–і–Њ–Ї–∞–Є–љ, –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В—Л). –Ю–і–љ–∞–Ї–Њ –Њ—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –ї–Њ–љ–≥–Є—В—Г–і–Є–љ–∞–ї—М–љ—Л–µ –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –ї–µ—З–µ–љ–Є—О –Є–Љ–µ–љ–љ–Њ –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –С–° –і–Њ–ї–ґ–љ—Л –±—Л—В—М –њ—А–Њ–і–Њ–ї–ґ–µ–љ—Л. –†–∞–Ј—Г–Љ–µ–µ—В—Б—П, –Љ—Л –±—Г–і–µ–Љ –ґ–і–∞—В—М —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –љ–Њ–≤—Л—Е –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Љ–Њ–љ–Њ- –Є –њ–Њ–ї–Є—Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –≤ –ї–µ—З–µ–љ–Є–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –С–°, –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Ї–Њ—В–Њ—А—Л—Е –±—Г–і—Г—В –≤—Л—А–∞–±–Њ—В–∞–љ—Л –±–Њ–ї–µ–µ —В–Њ—З–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –ї–µ—З–µ–љ–Є—О, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–µ –љ–∞ –њ—А–Є–љ—Ж–Є–њ–∞—Е –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л.
–°—В–∞—В—М—П –њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ–∞ –њ—А–Є —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –њ–Њ–і–і–µ—А–ґ–Ї–µ –Ю–Ю–Ю «–Ґ–µ–≤–∞»
–†–Њ—Б—Б–Є—П, 119049, –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –®–∞–±–Њ–ї–Њ–≤–Ї–∞, –і. 10, –Ї–Њ—А–њ. 2
–Ґ–µ–ї.:+7 (495) 6442234, —Д–∞–Ї—Б: +7 (495) 6442235; www.teva.ru
OCEAN-KATandALG-ART-171014-10000-791-161014
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –С–Њ–ї–µ–≤—Л–µ —Б–Є–љ–і—А–Њ–Љ—Л –≤ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ / –њ–Њ–і —А–µ–і. –Р.–Ь. –Т–µ–є–љ–∞. –Ь.: –Ь–Х–Ф–њ—А–µ—Б—Б-–Є–љ—Д–Њ—А–Љ, 2001.
2. –Ф–∞–љ–Є–ї–Њ–≤ –Р.–С. –Э–µ–є—А–Њ–љ—В–Є–љ –≤ –ї–µ—З–µ–љ–Є–Є –±–Њ–ї–µ–є –њ–Њ—П—Б–љ–Є—З–љ–Њ-–Ї—А–µ—Б—В—Ж–Њ–≤–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є // –Т—А–∞—З. 2005. вДЦ 11.
–Ч. –Ф–∞–љ–Є–ї–Њ–≤ –Р.–С., –Ф–∞–≤—Л–і–Њ–≤ –Ю.–°. –Э–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–∞—П –±–Њ–ї—М. –Ь.: –С–Њ—А–≥–µ—Б, 2007.
4. –Ф–∞–љ–Є–ї–Њ–≤ –Р.–С., –Ф–∞–≤—Л–і–Њ–≤ –Ю.–°. –Э–Њ–≤—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –љ–µ–≤—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –∞–љ–Ї–µ—В–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ // –°–њ—А–∞–≤. –њ–Њ–ї–Є–Ї–ї–Є–љ. –≤—А–∞—З–∞. 2008. вДЦ 5. –°. 40–44.
5. –Ф–∞–љ–Є–ї–Њ–≤ –Р.–С., –Ц–∞—А–Ї–Њ–≤–∞ –Ґ.–†. –•—А–Њ–љ–Є—З–µ—Б–Ї–∞—П —А–∞–і–Є–Ї—Г–ї–Њ–њ–∞—В–Є—П: –љ–Њ–≤—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є // –С–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ (—Б–њ–µ—Ж. –≤—Л–њ—Г—Б–Ї). 2010. вДЦ 18. –°.15–19.
6. –Ы–µ–≤–Є–љ –Ю.–°., –Ь–Њ—Б–µ–є–Ї–Є–љ –Ш. –Р. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –ї–Є–і–Њ–Ї–∞–Є–љ–Њ–≤—Л—Е –њ–ї–∞—Б—В—Л—А–µ–є (–Т–µ—А—Б–∞—В–Є—Б) –≤ –ї–µ—З–µ–љ–Є–Є –±–Њ–ї–Є –≤ —Б–њ–Є–љ–µ //–Ц—Г—А–љ. –љ–µ–≤—А–Њ–ї. –Є –њ—Б–Є—Е–Є–∞—В—А. –Є–Љ. –°.–°. –Ъ–Њ—А—Б–∞–Ї–Њ–≤–∞. 2009. вДЦ 109. –°. 44–50.
7. Baron R., Binder A. How neuropathic is sciatica? The mixed pain concept // Orthopade. 2004. Vol. 33 (5). –†. 568–575.
8. Birklein F. Mechanism-based treatment principles of neuropathic pain // Fortschr Neurol Psychiatr. 2002. Vol. 70 (2). –†. 88–94.
9. Bouhassira D., Attal N., Alchaar. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4) // Pain. 2005. Vol. 114 (1-2). –†. 29–36.
10. Dickens C., Jayson M., Sutton –°. et al. The relationship between pain and depression in a trial using paroxetine in sufferers of chronic low back pain // Psychosomatics. 2000. Vol. 41. –†. 490–499.
11. Dworkin R.H., –Ю 'Connor A.B., Backonja Metal. Pharmacologic management of neuropathic pain: evidence-based recommen dations // Pain. 2007. Vol. 132. –†. 237–251.
12. Gatchel R.J., Gardea M.A. Lower back pain: psychosocial issues. Their importance in predicting disability, response to treatment and search for compensation // Neurologic clinics. 1999. Vol. 17. –†. 149–166.
13. Gatti A., Sabato A.F., OcchioniR etal. Controlled-release oxycodone andpregabalin in the treatment of neuropathic pain: resultsofa multicenter Italian study // Eur Neurol. 2009. Vol. 61. –†. 129–137.
14. Gatti A., Sabato A.F., Carucci A. et al. Adequacy assessment of oxycodone/paracetamol (acetaminophen) in multimodal chron-icpain: a prospective observational study // Clin Drug Investig. 2009. Vol. 29 (Suppl. 1). –†. 31–40.
15. Gimbel J., Linn R., Hale M., Nicholson B. Lidocainepatch treatment inpatients with low back pain: results of an open-label, nonrandomized pilot study // Am J Ther. 2005. Vol. 12 (4). –†. 311–319.
16. Hansson P., Fields H., Hill R., Marchettini P. Neuropathic Pain: Pathophysiology and Treatment, Progress in Pain Research and Management. Seattle, WA.-IASP Press; 2001. Vol. 21. –†. 151–167.
17. Hassan A.E., Saleh H.A., Baroudy Y.M. et al. Prevalence of neuropathic pain amongpatients sufferingfrom chronic low back pain in Saudi Arabia // Saudi Med J. 2004. Vol. 25 (12). –†. 1986–1990.
18. Freynhagen R., Baron R., Tolle T. et al. Screening of neuropathic pain components inpatients with chronic back pain associated with nerve root compression: a prospective observational pilot study (MIPORT) // CurrMedRes Opin. 2006. Vol. 22 (3). –†. 529–537.
19. Freynhagen R., Baron R., Gockel U., Tolle T.R. Pain DETECT a new screening questionnaire to identify neuropathic components in patients with back pain // CurrMedRes Opin. 2006. Vol. 22 (10). –†. 1911–1920.
20. Junker U., Brunnmuller U. Efficacy and tolerability of gabapentin in the treatment of patients with neuropathic pain. Results of an observational study involving 5620 patients. MMW // Fortschr Med. 2003. Vol. 145. –†. 37.
21. Kboromi S., Patsalides A., Parada S. et al. Topiramate in chronic lumbar radicular pain // Pain. 2005. Vol. 6 (12). –†. 829–836.
22. Khoromi S., Cui L., Nackers L., Max M.B. Morphine, nortriptyline and their combination vs.placebo inpatients with chronic lumbar root pain // Pain. 2007. Vol. 130 (1-2). –†. 66–75.
23. McQuay H.J. et al. A systematic review of antidepressants in neuropathic pain // Pain. 1996. Vol. 68. –†. 217–227.
24. McCleane G.J. Does Gabapentin have an analgesis effect on background movement and refferedpain?A randomized, double-blind, placebo-controlled study // Pain Clinic. 2001. Vol. 13. –†. 103–107.
25. Morlion B. Pharmacotherapy of low back pain: targeting nociceptive and neuropathic pain components // Current Medical Research & Opinion. 2011. Vol. 27 (1). –†. 11–33.
26. Romano C.L., Romano D., Bonora C., Mineo G. Pregabalin, cele-coxib, and their combination for treatment of chronic low-back pain // JOrthop Traumatol. 2009. Vol. 4. –†. 185–191. Epub 2009; 18.
27. Ruoff G.E., Rosenthal N., Jordan D. et al. Tramadol/acetaminophen combination tablets for the treatment of chronic lower back pain: a multicenter, randomized, double-blind, placebo-controlled outpatient study // Clin Ther. 2003. Vol. 25, –†. 123–141.
28. Peloso P.M., Fortin L., Beaulieu A. et al. Analgesic efficacy and safety oftramadol/acetaminophen combination tablets (Ultra-cet) in treatment of chronic low back pain: a multicenter, outpatient, randomized, double blind, placebo controlled trial // Rheumatol. 2004. Vol. 31. –†. 2454–2463.
29. Pota V., Maisto M., Pace M.C. et al. Association ofbuprenorphine TDS and pregabalin in the treatment of low back pain // Eur Pain. 2007. Vol. 11. –†. 83.
30. Verdu B., Decosterd I., Buclin T. et al. Antidepressants for the treatment of chronic pain // Drugs. 2008. Vol. 68. –†. 2611–2632.
31. Salerno S.M., Browning R., Jackson J.L. The effect of antidepressant treatment on chronic back pain: a meta-analysis // Arch Intern Med. 2002. Vol. 162. –†. 19–24.
32. Staiger T.O., Gaster B., Sullivan M.D. et al. Systematic review of antidepressants in the treatment of chronic low back pain // Spine (Phila Pa 1976). 2003. Vol. 28. –†. 2540–2545.
33. Urquhart D.M., Hoving J.L., Assendelft W.W. et al. Antidepressants for nonspecific low back pain // Cochrane Database Syst Rev. 2008. CD001703, p. 2.
34. Schofferman J. Opioid analgesic therapy for severe intractable low back pain // Clin J Pain. 1999 June. Vol. 15 (2). –†. 136–140.
35. Skljarevski V., Ossanna M., Liu-Seifert H. et al. A double-blind, randomized trial ofduloxetine versus placebo in the management of chronic low back pain // Eur J Neurol. 2009. Vol. 16. –†. 1041–1048.
36. Torrance N., Smith B.H., Bennett M.I., Lee A.J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey // JPain. 2006. Vol. 7 (4). –†. 281–289.
37. White W.T., Patel N., Dross M., Nalamachu S. Lidocaine patch 5% with systemic analgesics such as gabapentin: a rational polypharmacy approach for the treatment of chronic pain // Pain Med. 2003. Vol. 4 (4). –†. 321–330.












