Введение
Механизмы устойчивости к повреждающим воздействиям различного генеза (травма, инфекции, интоксикации) в значительной степени определяются уровнем здоровья и возможностью противостоять негативным факторам внешней среды. Гормональный профиль, функциональный и метаболический стереотипы во многом определяют устойчивость организма к тому или иному повреждающему специфическому воздействию, например токсическому, в т. ч. к инфекциям, к коим относится и туберкулез (ТБ) [1–4]. Поэтому изучение и поиск эффективных защитных, резистентных к повреждающим воздействиям механизмов являются актуальной задачей [2, 4]. Известно, что количество и соотношение аминокислот-адаптогенов в тканях имеет большое значение для реализации механизмов, определяющих степень резистентности к повреждающим факторам. Так, высокоустойчивые к ТБ и острым токсическим воздействиям животные — крысы отличаются большим количеством в тканях таурина, глутатиона, аргинина, полиаминов, влияющих на фагоцитоз и обладающих мембраностабилизирующим эффектом [5–7]. Высокоустойчивые к мутагенным и канцерогенным воздействиям ксенобиотиков животные — морские свинки отличаются не только повышенным количеством восстановленного глутатиона (и входящих в него аминокислот) в печени, но и его способностью к интенсивному окислению. Имеются также сведения, что морские свинки гораздо более устойчивы к гипоксическим состояниям, чем крысы [8–10]. Эти различия, надо полагать, могут быть обусловлены не только различиями в количестве, соотношении и обменных процессах перечисленных метаболитов-адаптогенов [10–13], но и различной стратегией защитно-компенсаторных механизмов у этих животных, что и явилось предметом нашего исследования.
Цель исследования: изучение типовых реакций аминокислотного гомеостаза при повреждающих воздействиях различного генеза.
Материал и методы
Для достижения поставленной цели были выбраны две экспериментальные модели: животные с низкой и высокой резистентностью к туберкулезной инфекции и повреждающим воздействиям (морские свинки и крысы соответственно). Изучались три варианта воздействия на них: 1) заражение микобактериями ТБ (МБТ); 2) заражение МБТ в сочетании с последующим эндотрахеальным введением мутагенных и канцерогенных полициклических ароматических углеводородов, адсорбированных на саже в виде масляного раствора каменноугольной смолы (КС);
3) заражение МБТ в сочетании с острой кровопотерей.
Проведение эксперимента согласовано с этическим комитетом УНИИФ, протокол № 3 от 18.04.2016.
В эксперименте использованы 160 лабораторных животных — крыс (80 особей) и морских свинок (80 особей) массой 230–250 г. Животные содержались в стандартных условиях вивария при естественном освещении, свободном доступе к корму и питьевой воде. Животные выводились в условиях вивария Уральского научно-исследовательского института фтизиопульмонологии — филиала ФГБУ «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Минздрава России.
Все животные были разделены на сопоставимые по массе тела, возрасту и статусу здоровья 8 групп (по 20 особей в каждой).
2 контрольные группы:группа 1 — интактные морские свинки;
группа 2 — интактные крысы.
6 опытных групп:группы 3 (морские свинки) и 4 (крысы) — кроме заражения МБТ никаким воздействиям не подвергались;
группы 5 (морские свинки) и 6 (крысы) — подвергались сочетанному воздействию: заражению МБТ и эндотрахеальному введению КС, адсорбированной на саже в виде масляного раствора, в дозировке 1 мг/кг;
группы 7 (морские свинки) и 8 (крысы) — подвергались заражению МБТ в сочетании с острой кровопотерей: из бедренной артерии производилось кровопускание с помощью катетера в объеме 2,5% крови от массы тела в течение 15 мин, что соответствует массивной кровопотере.
Заражение животных производилось музейным штаммом МБТ Н31Rv: морских свинок — в дозе 0,001 г в паховую складку, крыс — в дозе 0,1 г в хвостовую вену.
Через 2 нед. животных декапитировали и производили забор крови из сердца. В группах 5 и 6 в микроядерном тесте определяли мутагенное воздействие КС на морских свинок и крыс. Наличие мутагенного эффекта учитывалось при увеличении количества микроядер в костном мозге в 3 раза [14].
Методы оценки экспериментальной модели: макроскопическая оценка внутренних органов (легкие, лимфоузлы, печень, селезенка); морфометрическая оценка органов [15]. В плазме крови (после депротеинизирования сульфосалициловой кислотой) и в печени (после замораживания в жидком азоте) методом хроматографии на хроматографе (ААА 339 «Микротехника», Чехия) определяли количество свободных аминокислот и глутатиона. Для уточнения роли отмеченных метаболитов в регуляции образования высокоактивных соединений азота (ВСА) и активных форм кислорода (АФК) определяли уровень перекисного окисления с использованием набора OXYSTAT (Biomedica Gruppe, Австрия), нитропроизводных оксида азота (NO3) в плазме крови методом ИФА (иммуноферментный анализатор Multiskan Ascent). Содержание аскорбиновой кислоты (АК) и ее метаболита — дикетогулоновой кислоты (ДКГК) в печени определяли с использованием фенилгидразинового реактива. Для определения состояния мембран, являющихся наиболее чувствительными к повреждающим воздействиям АФК и ВСА, хроматографически определяли количество в ткани печени фосфоэтаноламина (ФЭА) и этаноламина (ЭА), необходимых для биосинтеза фосфолипидов мембран. Функциональную активность нейтрофилов определяли путем оценки параметров кислородного взрыва (НСТ-тест). Статистическую обработку проводили с помощью непараметрического U-критерия Манна — Уитни.
Результаты и их обсуждение
Воздействие на животных заражения МБТ
Через 2 нед. после заражения МБТ у морских свинок развивается генерализованный ТБ: прогрессирующий специфический процесс приводит к значительному увеличению массы легких, печени, селезенки и внутригрудных лимфоузлов. У крыс, напротив, даже при использовании гораздо большей дозы МБТ специфический процесс не развивается, изменений массы органов после заражения не происходит, что отмечалось нами и ранее [5–7].
Ресурс как восстановленного (GSH), так и окисленного (GSSG) глутатиона в печени морских cвинок гораздо выше, чем у крыс (см. табл. 1).
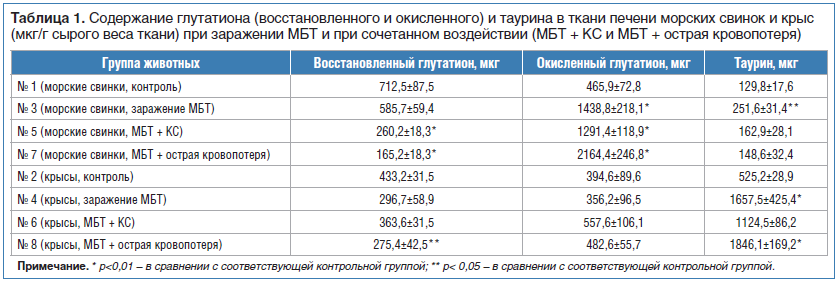
После заражения МБТ у морских свинок, несмотря на то что количество GSH у них по-прежнему было больше, чем у крыс, отмечено значительное увеличение количества GSSG, что характеризует антиоксидантный потенциал морской свинки как неблагоприятный. При этом у крыс количество GSSG практически не меняется, а количество GSH снижается на 30% по сравнению с контролем, что отражает интенсивность метаболических реакций, реализующих антиоксидантную защиту (см. табл. 1). Вместе с тем известно, что среди всех свободных аминокислот в тканях крыс наиболее представлен таурин, являющийся антиоксидантом, стабилизатором мембран и стимулятором фагоцитарных реакций организма [16, 17]. Количество таурина в тканях крыс превышает 50%, в тканях морских свинок таурина значительно меньше. Так, содержание таурина в печени морских свинок соответственно значительно меньше, чем в печени крыс (см. табл. 1). После заражения количество этой аминокислоты в ткани печени морских свинок увеличивается практически вдвое. У крыс количество таурина в ткани печени также увеличивается и становится на порядок больше, чем у морских свинок. Вероятно, в формировании высокой резистентности крыс к МБТ этот факт может играть существенную роль. Также мы отметили, что после заражения в крови морских свинок возрастает количество лейкоцитов, однако метаболическая активность (НСТ-тест) подавляется. У крыс таких изменений мы не зафиксировали.
Наряду с глутатионом АК также является мощным антиоксидантом, выполняющим важнейшую защитно-адаптивную функцию на метаболическом уровне [2, 4]. Содержание АК в печени морских свинок примерно в 2 раза меньше, чем в печени крыс (см. рис. 1).
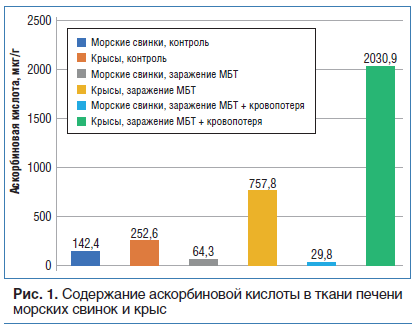
После заражения МБТ в печени крыс количество АК значительно возрастает (почти в 3 раза), а у морских свинок (которые в отличие от крыс не могут ее синтезировать) наблюдается более чем двукратное ее снижение. При этом у морских свинок на фоне уменьшения содержания АК повышается уровень ее метаболита — ДКГК, которая может включаться в процессы, необходимые для поддержания глутатиона в восстановленном состоянии (пентозный цикл). При этом у крыс количество ДКГК существенно не меняется. Следует подчеркнуть, что глутатион, синтезируемый у морских свинок в повышенном количестве, интенсивно окисляется и существенного повышения антиоксидантного ресурса не происходит. Преобладание синтеза и последующее быстрое окисление глутатиона в отсутствие возможности синтезировать АК являются неблагоприятным фактором, ослабляющим резистентность морских свинок к туберкулезной инфекции. Напротив, исходно высокие концентрации АК и существенное усиление ее биосинтеза в печени у крыс является одним из факторов, обеспечивающих защитные механизмы от воздействия МБТ. Мощный антиоксидантный потенциал АК и таурина не позволяет чрезмерно повышаться уровню АФК и ВСА в тканях крыс после экстремальных воздействий и ограничивает их повреждающий эффект. У морских же свинок этого не происходит. Так, в контрольных группах количество перекисей (по OXYSTAT) у морских свинок примерно в 2 раза выше, чем у крыс, равно как и нитропроизводных NO3 (см. табл. 1 и рис. 2).
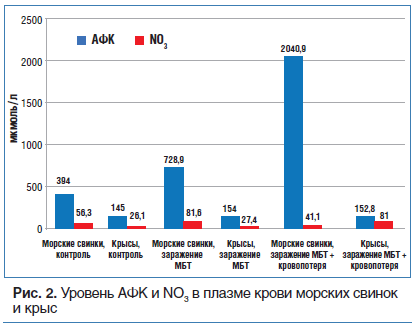
После заражения у морских свинок уровень ВСА в крови увеличивается еще примерно на 50%, а у крыс не изменяется. Уровень перекисей липидов в крови морских свинок после заражения МБТ повышается почти в 2 раза, а у крыс статистически значимо не изменяется.
Кроме того, после заражения МБТ в печени крыс практически не определялись ФЭА и ЭА, что может быть обусловлено усиленным их потреблением для обеспечения детоксикационных, анаболических, фагоцитарных механизмов. Это также может отражать востребованность этих субстратов в адаптивных механизмах крыс, ведущим среди которых, на наш взгляд, является стабилизация мембран.
Таким образом, различия в количестве АФК и ВСА при заражении МБТ соответственно указывает на различия защитных механизмов у сравниваемых животных.
Воздействие на животных заражения МБТ в сочетании с введением КС
Несмотря на то, что морские свинки практически беззащитны даже перед единичными вирулентными МБТ, они высокоустойчивы к мутагенным и канцерогенным воздействиям. Как указывает ряд авторов, вызвать у них экспериментальный опухолевый процесс очень трудно [3, 5, 17, 18]. При интратрахеальном воздействии КС в дозе 1 мг/кг массы тела каких-либо нарушений в костном мозге морских свинок не отмечено, а у крыс количество микроядер в костном мозге увеличивалось в 3 раза, т. е. развивался мутагенный эффект.
Несмотря на то, что морские свинки гораздо более устойчивы к мутагенному воздействию КС, чем крысы, при интенсивном токсическом воздействии КС через 2 нед. они все погибают, крысы же все остаются живы. Воздействие КС на морских свинок сопровождается повышением уровня ФЭА и ЭА в печени, что отражает степень повреждения клеточных мембран. Как указывает ряд авторов, высокий уровень GSSG, АФК и ВСА усиливает апоптоз клеток, оказывает повреждающее воздействие на их мембраны и структуры ядра [3–5, 13, 18, 19]. В то же время повышенный ресурс GSH и его активное включение в механизмы защиты являются механизмом антимутагенеза и антиканцерогенеза [2, 4, 11], следовательно, можно предположить, что в случае заражения МБТ, сопровождающегося значительным повышением количества глутатиона, у крыс создаются условия для антимутагенеза и антиканцерогенеза.
При воздействии КС в крови морских свинок, зараженных МБТ, заметно повышается уровень АФК и ВСА, важнейших регуляторных биомолекул, способных оказывать как протективное, так и повреждающее воздействие. Так, после заражения морских свинок МБТ уровень ВСА в крови у них повышается на 50%, перекисей липидов — почти в 2 раза, а у крыс — не меняется. После воздействия КС на морских свинок содержание этих метаболитов в плазме (особенно перекисей липидов) продолжает повышаться, а у крыс столь же значительного повышения этих метаболитов в плазме не отмечается (см. табл. 1 и рис. 2).
Вместе с тем прогрессирующее увеличение АФК и ВСА у крыс, вероятно, компенсируется большим количеством таурина и АК в тканях. Так, после заражения МБТ и воздействия КС в печени крыс количество АК возрастает с 252,6 мкг/г до 724,8 мкг/г, а у морских свинок наблюдается ее более чем двукратное уменьшение (с 142,4 мкг/г до 70,1 мкг/г). Вместе с тем мы отметили, что в костном мозге крыс при сочетанном воздействии КС и МБТ общее количество глутатиона повышалось, а концентрация таурина резко уменьшалась.
Таким образом, у крыс имеются метаболические предпосылки резистентности и к заражению МБТ, и к токсическому воздействию КС, при этом заражение МБТ создает условия для более активного антимутагенеза. Несмотря на то, что морские свинки устойчивы к мутагенным воздействиям, изменения метаболизма, вызванные заражением МБТ, создают условия, существенно понижающие резистентность к токсическому воздействию КС.
Воздействие заражения МБТ в сочетании с острой кровопотерей
Морские свинки гораздо более устойчивы к гипоксии, развивающейся при кровопотере, а также к высотной гипоксии, чем крысы [8, 9]. Через сутки после кровопускания из 20 морских свинок живых осталось 16, а у крыс из 20 особей — 5. То есть морские свинки явно более резистентны к острой массивной кровопотере, чем крысы.
После острой кровопотери у крыс достоверного увеличения количества аминокислот в печени мы не наблюдали, а количество АК возросло почти в 8 раз (см. рис. 1). Вместе с тем в плазме отмечается более чем двукратное повышение количества таурина, а общее количество глутатиона становится еще меньше, чем в контроле, и существенного окисления глутатиона при этом не происходит (см. табл. 1).
При этом мы отметили, что у крыс в костном мозге в 2–3 раза повышается содержание глутаминовой кислоты, глутамина, глицина, аланина, таурина, GSH. Но, несмотря на перераспределение метаболических ресурсов для мобилизации кроветворения, крысы все же не способны компенсировать острую кровопотерю. Большой метаболический и антиоксидантный ресурс позволяет хорошо переносить инфекции, интоксикации, но не гипоксию.
В печени морских свинок после острой кровопотери, напротив, происходит 2–3-кратное повышение количества глутамата, аспартата, цистеина, пролина, орнитина, а также отмечается резкое повышение общего количества глутатиона наряду с его активным окислением, что, на наш взгляд, отражает ведущее значение метаболической активности печени. Все указанные метаболиты обладают антигипоксантным эффектом, с чем, очевидно, связана гораздо большая, чем у крыс, устойчивость морских свинок к гипоксическим состояниям. В данном случае этих ресурсов оказывается достаточно даже при более чем четырехкратном уменьшении АК. Повышенное количество антиоксидантных метаболитов (АК, таурина, аргинина, полиамина, метионина и др.) в тканях крыс, видимо, определяет их устойчивость к воздействиям, сопряженным с генерацией повышенных количеств АФК, таким как заражение МБТ, токсическое воздействие ксенобиотиков, но не к состояниям, связанным с выраженной
постгеморрагической гипоксией.
Рассуждая о возможных причинах большей резистентности морских свинок по сравнению с крысами в данном варианте повреждающего воздействия, следует подчеркнуть, что мобильным ресурсом глутамата, глицина, серосодержащих аминокислот также может быть и нежноволокнистая соединительная ткань, преобладающая у морских свинок. У крыс же преобладает грубоволокнистая соединительная ткань, участвующая в детоксикационных процессах, но не в метаболических перестройках организма при стрессе [7, 20].
Заключение
Резистентность морских свинок и крыс при заражении МБТ и других повреждающих специфических воздействиях зависит от многих факторов.
Как нам представляется, к этим факторам можно отнести видовые особенности метаболизма аминокислот, связанных с биосинтезом глутатиона и таурина, которые проявляются в двух типах метаболизма у исследованных животных: 1-й тип характерен для крыс и обусловлен исходно высоким ресурсом таурина и глутатиона (мы его назвали условно субстратно-метаболическим); 2-й тип характерен для морских свинок, с существенно более низким количеством таурина и интенсивным окислением глутатиона (функционально-метаболически-перераспределительный тип).
Особенности этих типов предопределяют различие защитно-компенсаторных механизмов при воздействии различных повреждающих факторов. Так, субстратно-метаболический тип характеризуется высокой резистентностью к бактериальным инфекциям и токсическим воздействиям, а функционально-метаболически-перераспределительный — весьма низкой резистентностью к инфекционным воздействиям при устойчивости к мутагенным факторам и острой кровопотере.
В наших предшествующих исследованиях [5] было показано, что применение таурина повышает устойчивость морских свинок к МБТ. При этом снижается уровень АФК и ВСА в крови экспериментальных животных [3, 21–23]. Следует подчеркнуть, что, несмотря на значительные внутривидовые различия в защитно-метаболических типах, последние в какой-то мере могут быть присущи и человеку. Данные механизмы, вероятно, зависят от особенностей защитно-компенсаторного типа.
Нами было отмечено влияние таурина на купирование побочных реакций химиотерапии (ХТ), включающей основные и резервные противотуберкулезные препараты (ПТП). Таурин использовали в таблетированной форме в дозе 1000 мг/день на протяжении не менее 2 мес. Исследование проводили с участием 20 больных с различными клиническими формами туберкулезного процесса в легких: инфильтративным ТБ (n=3), множественными туберкуломами (n=3), фиброзно-кавернозным ТБ (ФКТ) (n=9) и с внелегочными формами ТБ: ТБ женских половых органов (n=2), ТБ почек (n=3). Ранее у всех этих больных лечение комплексом ПТП сопровождалось разнообразными реакциями непереносимости (РН) со стороны различных органов и систем, из-за чего приходилось корректировать или прерывать ХТ. В большей степени это было характерно для ФКТ и для ТБ женских половых органов. В этих случаях из-за отмены ХТ продолжительность лечения составляла в среднем только половину срока заболевания.
Дополнение к ХТ таурина улучшило общее состояние пациентов, привело к купированию РН и позволило провести курс ХТ без коррекции режима и дозы ПТП. Таурин, обладая мембраностабилизирующими, гепатопротекторными, кардиотропными и нейротропными свойствами, способствовал устранению или уменьшению не только гепатотоксических побочных реакций, но и кардио-, нефро- и нейротоксических, а также токсико-аллергических.
Проявления непереносимости ПТП были полностью купированы у 7 больных через сутки, у 7 — через 5–7 дней. У остальных 6 больных РН уменьшились до переносимых. Использование таурина менее 2 мес. не давало стойкого купирования РН. Вместе с тем при длительной ХТ у больных, получивших 2-месячный курс лечения таурином, в ряде случаев через 3–4 нед. после прекращения приема таурина возобновлялись РН. Однако эти реакции были выражены в значительно меньшей степени, не требовали коррекции ХТ и устранялись повторным курсом таурина.
Другой вариант возможного клинического применения аминокислот нами продемонстрирован на 42 пациентах, оперированных по поводу туберкуломы легких.
Исследованы общая антиоксидантная активность плазмы крови (ОАС), суммарное количество аминокислот и их процентное соотношение до и через 3 нед. после оперативного вмешательства. У всех больных послеоперационный период протекал без осложнений. Отмечено достоверное снижение ОАС и суммарного количества аминокислот. При этом наблюдалось достоверное повышение концентрации тех аминокислот, которые принимали участие в синтезе глутатиона и таурина, с 1,3±0,01 мкмоль/л до 3,3±0,02 мкмоль/л.
Таким образом, у больных, оперированных по поводу туберкуломы легких, даже при благоприятном течении послеоперационного периода имеются изменения гомеостаза, характеризующиеся выраженным дефицитом антиоксидантных ресурсов, а повышение концентрации аминокислот, принимающих участие в синтезе глутатиона, является компенсаторным. Приведенные данные позволяют сделать вывод о необходимости коррекции антиоксидантных ресурсов у данной категории больных путем использования аминокислот, принимающих участие в синтезе глутатиона.
Таким образом, метаболиты-адаптогены, на наш взгляд, могут применяться для усиления защитно-адаптивных механизмов организма человека. Полученные результаты могут послужить основой для разработки технологий повышения эффективности лечения туберкулеза у человека.











