–°–µ–≥–Њ–і–љ—П –Ш–У–Ъ–° —П–≤–ї—П—О—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –њ—А–Њ—В–Є–≤–Њ–∞—Б—В–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ –Ї–ї–∞—Б—Б–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ—Л –≤ –Ї–∞—З–µ—Б—В–≤–µ —В–µ—А–∞–њ–Є–Є –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤—Б–µ—Е –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –≥—А—Г–њ–њ, –Ї–Њ—В–Њ—А—Л–µ —Б—В—А–∞–і–∞—О—В –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–є –∞—Б—В–Љ–Њ–є –ї—О–±–Њ–є —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є [5].
–†–Њ–ї—М –Љ–µ–ї–Ї–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є
–≤ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є–Є –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є
–∞—Б—В–Љ—Л
–Э–µ–Ї–Њ—В–Њ—А—Л–µ –∞–≤—В–Њ—А—Л —Б–≤—П–Ј—Л–≤–∞—О—В –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–є –Ї–Њ–љ—В—А–Њ–ї—М –С–Р —Б –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ–Љ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –љ–∞ —Г—А–Њ–≤–љ–µ –Љ–µ–ї–Ї–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є (–Ь–Ф–Я) [6–10]. –Ь–µ–ї–Ї–Є–Љ –±—А–Њ–љ—Е–∞–Љ, –≤–љ—Г—В—А–µ–љ–љ–Є–є –і–Є–∞–Љ–µ—В—А –Ї–Њ—В–Њ—А—Л—Е —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Љ–µ–љ–µ–µ 2 –Љ–Љ, –і–Њ–ї–≥–Њ–µ –≤—А–µ–Љ—П –љ–µ –њ—А–Є–і–∞–≤–∞–ї–Њ—Б—М –Њ—Б–Њ–±–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П –њ—А–Є –С–Р. –Ш—Е —А–Њ–ї—М —Б—В–∞–ї–∞ –њ—А–µ–і–Љ–µ—В–Њ–Љ –±–Њ–ї–µ–µ –њ—А–Є—Б—В–∞–ї—М–љ–Њ–≥–Њ –Є–Ј—Г—З–µ–љ–Є—П –њ–Њ—Б–ї–µ —В–Њ–≥–Њ, –Ї–∞–Ї Mead –Є —Б–Њ–∞–≤—В. [11] –≤ —Б–≤–Њ–µ–є —Б—В–∞—В—М–µ –Њ–њ–Є—Б–∞–ї–Є –Ь–Ф–Я –Ї–∞–Ї «–љ–µ–Љ—Г—О –Ј–Њ–љ—Г» –Є–Ј––Ј–∞ —В–Њ–≥–Њ, —З—В–Њ –Є—Е —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –≤—Б–µ–≥–Њ –ї–Є—И—М 10% –Њ—В –Њ–±—Й–µ–≥–Њ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є (—А–Є—Б. 1).
–°–µ–≥–Њ–і–љ—П —Г–ґ–µ –µ—Б—В—М –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П —В–Њ–≥–Њ, —З—В–Њ –њ—А–Є —В—П–ґ–µ–ї–Њ–є –С–Р –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –љ–∞ —Г—А–Њ–≤–љ–µ –Ь–Ф–Я –≤—Л—А–∞–ґ–µ–љ–Њ –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, —З–µ–Љ –љ–∞ —Г—А–Њ–≤–љ–µ –Ї—А—Г–њ–љ—Л—Е –±—А–Њ–љ—Е–Њ–≤ [12,13]. –Ю–±—К–µ–Љ —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤—Л–і–Њ—Е–∞ –Ј–∞ 1 —Б (–Ю–§–Т1) –Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —Б–Ї–Њ—А–Њ—Б—В—М –≤—Л–і–Њ—Е–∞ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Њ—В—А–∞–ґ–∞—О—В —Д—Г–љ–Ї—Ж–Є—О –Ї—А—Г–њ–љ—Л—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є –Є –і–∞—О—В –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–Є –Ь–Ф–Я [6,14].
–Ь–µ—В–Њ–і—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є
–≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Ь–Ф–Я
–°—Г—Й–µ—Б—В–≤—Г–µ—В —Ж–µ–ї—Л–є —А—П–і –ї–µ–≥–Њ—З–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –љ–∞—А—Г—И–µ–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–Љ–Њ—Б—В–Є –Ь–Ф–Я –≤—Б–ї–µ–і—Б—В–≤–Є–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (—В–∞–±–ї. 1).
–°–µ–≥–Њ–і–љ—П –љ–µ —Б–Њ–≤—Б–µ–Љ —П—Б–љ–Њ, —П–≤–ї—П–µ—В—Б—П –ї–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –Ь–Ф–Я –њ—А–Є –С–Р —Е–∞—А–∞–Ї—В–µ—А–љ—Л–Љ —В–Њ–ї—М–Ї–Њ –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ —Д–µ–љ–Њ—В–Є–њ–∞ –Є–ї–Є –Њ–љ–Њ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ —Г –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е –С–Р. –Т –Њ–і–љ–Њ–Љ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [15] –Є–Ј—Г—З–∞–ї–∞—Б—М –≥—А—Г–њ–њ–∞ –±–Њ–ї—М–љ—Л—Е –С–Р —Б —З–∞—Б—В—Л–Љ–Є –њ–Њ–≤—В–Њ—А—П—О—Й–Є–Љ–Є—Б—П –Њ–±–Њ—Б—В—А–µ–љ–Є—П–Љ–Є (–±–Њ–ї–µ–µ –і–≤—Г—Е –Њ–±–Њ—Б—В—А–µ–љ–Є–є –Ј–∞ –њ—А–µ–і—Л–і—Г—Й–Є–є –≥–Њ–і, —В—А—Г–і–љ–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–∞—П –∞—Б—В–Љ–∞, n=513) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –±–Њ–ї—М–љ—Л—Е —Б –∞–і–µ–Ї–≤–∞—В–љ–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–є —В—П–ґ–µ–ї–Њ–є –∞—Б—В–Љ–Њ–є –±–µ–Ј –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є—Е –Њ–±–Њ—Б—В—А–µ–љ–Є–є (—Б—В–∞–±–Є–ї—М–љ–∞—П –∞—Б—В–Љ–∞, n=515). –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ—Л –≤–Њ –≤—А–µ–Љ—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ–∞—Ж–Є–µ–љ—В—Л —Б –С–Р –Є —З–∞—Б—В—Л–Љ–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П–Љ–Є –Є–Љ–µ–ї–Є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞ –ї–µ–≥–Ї–Є—Е (–Ю–Ю) –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –Њ—Б—В–∞—В–Њ—З–љ–Њ–є –µ–Љ–Ї–Њ—Б—В–Є (–§–Ю–Х) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –±–Њ–ї—М–љ—Л–Љ–Є —Б –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–є —В—П–ґ–µ–ї–Њ–є –С–Р –±–µ–Ј —З–∞—Б—В—Л—Е –Њ–±–Њ—Б—В—А–µ–љ–Є–є. –≠—В–Њ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –і–∞–ґ–µ –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А–Њ–≤ –≤ –њ–µ—А–Є–Њ–і—Л –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [16].
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –≤—Л—Б–Њ–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Њ–±—К–µ–Љ–∞ –Ј–∞–Ї—А—Л—В–Є—П –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є (closing volume (CV)) –і–∞–ґ–µ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є —Б—В–∞–±–Є–ї—М–љ—Л–µ –њ–µ—А–Є–Њ–і—Л –Љ–Њ–≥—Г—В –±—Л—В—М —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —З–∞—Б—В—Л—Е —В—П–ґ–µ–ї—Л—Е –Њ–±–Њ—Б—В—А–µ–љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е –С–Р. –≠—В–Є –і–∞–љ–љ—Л–µ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ–Љ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –≤ –Ь–Ф–Я –Є —Д–µ–љ–Њ—В–Є–њ–Њ–Љ —В—П–ґ–µ–ї–Њ–є –С–Р.
–Ф–∞–љ–љ—Л–µ –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–∞–Ј—А–µ—И–µ–љ–Є—П –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –≤ –Њ–і–љ–Њ–Љ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —З—В–Њ –∞—Н—А–Њ–Ј–Њ–ї—М–љ—Л–є –Љ–µ–ї–Ї–Њ–і–Є—Б–њ–µ—А—Б–љ—Л–є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –≤—Л–Ј—Л–≤–∞–µ—В –њ–Њ–≤—Л—И–µ–љ–Є–µ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є –њ—А–Њ–≤–Њ–і–Є–Љ–Њ—Б—В–Є –≤ –і–Є—Б—В–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–∞—Е –ї–µ–≥–Ї–Њ–≥–Њ. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≥–Є–і—А–Њ—Д–ї—О–Њ—А–Њ–∞–ї–Ї–∞–љ (HFA)––Ш–У–Ъ–° —Г–Љ–µ–љ—М—И–∞–ї –≤–Њ–Ј–і—Г—И–љ—Л–µ –ї–Њ–≤—Г—И–Ї–Є –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, —З–µ–Љ —Е–ї–Њ—А—Д–ї—О–Њ—А–Њ–Ї–∞—А–±–Њ–љ (—Д—А–µ–Њ–љ) (CFC)–—Б–Њ–і–µ—А–ґ–∞—Й–Є–є –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є –Ш–У–Ъ–° [16].
–Т–ї–Є—П–љ–Є–µ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ –љ–∞ —Д—Г–љ–Ї—Ж–Є—О –Ь–Ф–Я –Є —Д–∞–Ї—В–Њ—А—Л –њ–Њ–≤—Л—И–µ–љ–Є—П
—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞
–Ь–µ—В–∞–±–Њ–ї–Є–Ј–Љ –њ—А–µ–њ–∞—А–∞—В–∞. –Т —Б–≤—П–Ј–Є —Б –≤—Л—Б–Њ–Ї–Њ–є –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В—М—О —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і –±—Л—Б—В—А–Њ –∞–±—Б–Њ—А–±–Є—А—Г–µ—В—Б—П –Є –Ј–∞–і–µ—А–ґ–Є–≤–∞–µ—В—Б—П –≤ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е [17]. –¶–Є–Ї–ї–µ—Б–Њ–љ–Є–і –њ—А–µ–і—Б—В–∞–ї—П–µ—В —Б–Њ–±–Њ–є –њ—А–Њ–ї–µ–Ї–∞—А—Б—В–≤–Њ, –Ї–Њ—В–Њ—А–Њ–µ –±—Л—Б—В—А–Њ –∞–Ї—В–Є–≤–Є—А—Г–µ—В—Б—П –њ–Њ—Б–ї–µ –Є–љ–≥–∞–ї—П—Ж–Є–Є, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≤ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е –ї–µ–≥–Ї–Є—Е –њ—А–Є —Г—З–∞—Б—В–Є–Є —Н—Б—В–µ—А–∞–Ј [18,19]. –Р–Ї—В–Є–≤–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В –і–µ–Ј—Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і –Њ–±–ї–∞–і–∞–µ—В –≤—Л—Б–Њ–Ї–Є–Љ —Б—А–Њ–і—Б—В–≤–Њ–Љ –Ї –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–Љ (–У–Ъ) —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ [20]. –Ф–µ–Ј—Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і –Њ–±—А–∞–Ј—Г–µ—В –Ї–Њ–љ—К—О–≥–∞—В—Л —Б –ї–Є–њ–Є–і–∞–Љ–Є –≤ –ї–µ–≥–Ї–Є—Е, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ [21].
–Т–ї–Є—П–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—О –Ф–Э–Ъ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –≤—Л—Б–Њ–Ї—Г—О –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М [22]. –¶–Є–Ї–ї–µ—Б–Њ–љ–Є–і –∞–Ї—В–Є–≤–Є—А—Г–µ—В –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –≥–µ–љ—Л –Є –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –≥–µ–љ–Њ–≤.
–°—А–µ–і—Б—В–≤–Њ –і–Њ—Б—В–∞–≤–Ї–Є. –Т–∞–ґ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ш–У–Ъ–°, —П–≤–ї—П–µ—В—Б—П —Б–њ–Њ—Б–Њ–± –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–Њ–є –і–Њ—Б—В–∞–≤–Ї–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –ї–µ–≥–Ї–Є–µ. –†–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Ш–У–Ъ–° –≤ –ї–µ–≥–Ї–Є—Е –Є –Њ—Б–Њ–±–µ–љ–љ–Њ –Є—Е –і–µ–њ–Њ–Ј–Є—Ж–Є—П –љ–∞ —Г—А–Њ–≤–љ–µ –Љ–µ–ї–Ї–Є—Е –±—А–Њ–љ—Е–Њ–≤ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В—Б—П –Њ—З–µ–љ—М –≤–∞–ґ–љ—Л–Љ–Є –і–ї—П –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П —В–µ—З–µ–љ–Є—П –С–Р –Є —Г–ї—Г—З—И–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–∞ [23]. –Ф–Њ—Б—В–∞–≤–Ї–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –Є –µ–≥–Њ –і–µ–њ–Њ–Ј–Є—Ж–Є—П –≤ –Љ–µ–ї–Ї–Є—Е –±—А–Њ–љ—Е–∞—Е –Ј–∞–≤–Є—Б—П—В –Њ—В —Б—В–µ–њ–µ–љ–Є –њ—А–Є—Б—Г—В—Б—В–≤–Є—П –Љ–µ–ї–Ї–Њ–і–Є—Б–њ–µ—А—Б–љ—Л—Е —З–∞—Б—В–Є—Ж –≤ –Њ–±—Й–µ–Љ –Њ–±—К–µ–Љ–µ –Є–љ–≥–∞–ї–Є—А—Г–µ–Љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞.
–Ю–і–љ–Є–Љ–Є –Є–Ј –ї—Г—З—И–Є—Е —Б—А–µ–і—Б—В–≤ –і–Њ—Б—В–∞–≤–Ї–Є –љ–∞ —Г—А–Њ–≤–µ–љ—М –Љ–µ–ї–Ї–Є—Е –±—А–Њ–љ—Е–Њ–≤ —П–≤–ї—П—О—В—Б—П –і–Њ–Ј–Є—А—Г–µ–Љ—Л–µ –∞—Н—А–Њ–Ј–Њ–ї—М–љ—Л–µ –Є–љ–≥–∞–ї—П—В–Њ—А—Л, –Є—Б–њ–Њ–ї—М–Ј—Г—О—Й–Є–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Њ–њ–µ–ї–ї–µ–љ—В–∞ HFA, –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є–є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –Њ–Ї—А—Г–ґ–∞—О—Й—Г—О —Б—А–µ–і—Г. –Я—А–Є –Є—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≤ –њ–Њ–ї—Г—З–µ–љ–љ–Њ–Љ –∞—Н—А–Њ–Ј–Њ–ї–µ –≤—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Ж–µ–љ—В —З–∞—Б—В–Є—Ж –Є–Љ–µ—О—В —А–∞–Ј–Љ–µ—А 1,1 –Љ–Ї–Љ. –Ґ–∞–Ї–Є–µ —З–∞—Б—В–Є—Ж—Л –Њ–±–ї–∞–і–∞—О—В –≤—Л—Б–Њ–Ї–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –њ—А–µ–Њ–і–Њ–ї–µ–≤–∞—В—М –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є–є —А–Њ—В–Њ–≥–ї–Њ—В–Њ—З–љ—Л–є –±–∞—А—М–µ—А –Є –і–Њ—Б—В–Є–≥–∞—В—М —Г—А–Њ–≤–љ—П –±—А–Њ–љ—Е–Њ–≤ —А–∞–Ј–Љ–µ—А–Њ–Љ –Љ–µ–љ–µ–µ 2 –Љ–Љ. –Т —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –і–µ–њ–Њ–Ј–Є—Ж–Є—П –Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—О—В—Б—П –Є–Љ–µ–љ–љ–Њ –≤ —В–Њ–Љ –Љ–µ—Б—В–µ, –≥–і–µ —Н—В–Њ –±–Њ–ї–µ–µ –≤—Б–µ–≥–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ (—А–Є—Б. 2).
–Ю–±—А–∞—В–Є–Љ–∞—П —Н—Б—В–µ—А–Є—Д–Є–Ї–∞—Ж–Є—П –Є –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л–є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В. –§–∞–Ї—В–Њ—А–Њ–Љ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ 1 —А–∞–Ј/—Б—Г—В., —П–≤–ї—П–µ—В—Б—П –Ј–∞–і–µ—А–ґ–Ї–∞ –µ–≥–Њ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ – –і–µ–Ј—Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ –≤ –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В—П—Е –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –µ–≥–Њ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –і–µ–њ–Њ –±–ї–∞–≥–Њ–і–∞—А—П –Њ–±—А–∞—В–Є–Љ–Њ–є —Н—Б—В–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є (–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—О —Н—Д–Є—А–Њ–≤ –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В).
–°–≤—П–Ј—Л–≤–∞–љ–Є–µ –Ш–У–Ъ–° –Є –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –±–ї–∞–≥–Њ–і–∞—А—П –љ–∞–ї–Є—З–Є—О –≥–Є–і—А–Њ–Ї—Б–Є–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л –≤ –њ–Њ–Ј–Є—Ж–Є–Є –°–21 —Г –і–µ–Ј—Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ [24]. –Ч–∞ —Б—З–µ—В —Н—В–Њ–≥–Њ –і–µ–Ј—Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і —Б–њ–Њ—Б–Њ–±–µ–љ –Њ–±—А–∞–Ј–Њ–≤—Л–≤–∞—В—М –≤–љ—Г—В—А–Є –Ї–ї–µ—В–Њ–Ї –Ї–Њ–љ—К—О–≥–∞—В—Л (—Н—Д–Є—А—Л –≤ 21 –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є) —Б –і–ї–Є–љ–љ–Њ—Ж–µ–њ–Њ—З–µ—З–љ—Л–Љ–Є –ґ–Є—А–љ—Л–Љ–Є –Ї–Є—Б–ї–Њ—В–∞–Љ–Є (–Њ–ї–µ–Є–љ–Њ–≤–Њ–є, —Б—В–µ–∞—А–Є–љ–Њ–≤–Њ–є, –њ–∞–ї—М–Љ–Є—В–Є–љ–Њ–≤–Њ–є, –њ–∞–ї—М–Љ–Є—В–Њ–ї–µ–Є–љ–Њ–≤–Њ–є). –≠—В–Є –Ї–Њ–љ—К—О–≥–∞—В—Л –Њ—В–ї–Є—З–∞—О—В—Б—П –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В—М—О, –Ї–Њ—В–Њ—А–∞—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ—А–µ–≤—Л—И–∞–µ—В —В–∞–Ї–Њ–≤—Г—О —Г –і—А—Г–≥–Є—Е –Ш–У–Ъ–°.
–Я—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –і–µ–Ј—Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ –≤ –Ї–ї–µ—В–Ї–µ –∞–Ї—В–Є–≤–Є—А—Г—О—В—Б—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л–µ –ї–Є–њ–∞–Ј—Л, –Ї–Њ—В–Њ—А—Л–µ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞—О—В –Є–Ј —Н—Д–Є—А–Њ–≤ –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В –і–µ–Ј—Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і. –Т—Л—Б–≤–Њ–±–Њ–ґ–і–∞—О—Й–Є–є—Б—П –њ—А–µ–њ–∞—А–∞—В –≤–љ–Њ–≤—М —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П —Б –У–Ъ–—А–µ—Ж–µ–њ—В–Њ—А–Њ–Љ. –Ф–∞–љ–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–Є—О –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞, –і–µ–ї–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –љ–∞–Ј–љ–∞—З–∞—В—М –њ—А–µ–њ–∞—А–∞—В 1 —А–∞–Ј/—Б—Г—В. –Є –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј–∞—В—М—Б—П –±–Њ–ї–µ–µ –≤–∞–ґ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞, —З–µ–Љ –µ–≥–Њ —Б—А–Њ–і—Б—В–≤–Њ –Ї —А–µ—Ж–µ–њ—В–Њ—А—Г. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –Ї–Њ–љ—К—О–≥–∞—Ж–Є—П —Б –і–ї–Є–љ–љ–Њ—Ж–µ–њ–Њ—З–µ—З–љ—Л–Љ–Є –ґ–Є—А–љ—Л–Љ–Є –Ї–Є—Б–ї–Њ—В–∞–Љ–Є —П–≤–ї—П–µ—В—Б—П —Г–љ–Є–Ї–∞–ї—М–љ–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –њ—А–µ–њ–∞—А–∞—В–∞, –±–ї–∞–≥–Њ–і–∞—А—П —З–µ–Љ—Г —Б–Њ–Ј–і–∞–µ—В—Б—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–µ –і–µ–њ–Њ –Є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В—Б—П –µ–≥–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ.
C–≤—П–Ј—Л–≤–∞–љ–Є–µ —Б –±–µ–ї–Ї–∞–Љ–Є. –Ф–ї—П –Ш–У–Ъ–° —Б–≤—П–Ј—М –њ—А–µ–њ–∞—А–∞—В–∞ —Б –±–µ–ї–Ї–∞–Љ–Є –њ–ї–∞–Ј–Љ—Л –Є–Љ–µ–µ—В –Њ—З–µ–љ—М –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, —В–∞–Ї –Ї–∞–Ї —В–Њ–ї—М–Ї–Њ —Б–≤–Њ–±–Њ–і–љ–∞—П —Д—А–∞–Ї—Ж–Є—П –Є–ї–Є –љ–µ —Б–≤—П–Ј–∞–љ–љ—Л–є —Б –±–µ–ї–Ї–∞–Љ–Є –њ—А–µ–њ–∞—А–∞—В –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Б–≤—П–Ј—М —Б –±–µ–ї–Ї–∞–Љ–Є –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –Ш–У–Ъ–° –≤ —В–Ї–∞–љ–Є [25]. –Я–Њ—Н—В–Њ–Љ—Г –≤—Л—Б–Њ–Ї–∞—П —Б—В–µ–њ–µ–љ—М (98,4–99%) —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б –±–µ–ї–Ї–∞–Љ–Є —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –Ш–У–Ъ–°, —В–∞–Ї–Є—Е –Ї–∞–Ї –і–µ–Ј—Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —В–Њ–Љ, —З—В–Њ —Б–≤–Њ–±–Њ–і–љ–∞—П —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ–∞—П —Д—А–∞–Ї—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞, –њ–Њ—Б—В—Г–њ–∞—О—Й–∞—П –≤ –Ї—А–Њ–≤–Њ—В–Њ–Ї, –Њ—З–µ–љ—М –љ–Є–Ј–Ї–∞ – ≤1,5% (—В–∞–±–ї. 2).
–Э–µ–і–∞–≤–љ–Њ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Б—А–∞–≤–љ–Є–≤–∞–ї–Є —Н—Д—Д–µ–Ї—В—Л —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ –Є —Д–ї—Г—В–Є–Ї–∞–Ј–Њ–љ–∞ –њ—А–Њ–њ–Є–Њ–љ–∞—В–∞ –љ–∞ —Д—Г–љ–Ї—Ж–Є—О –Ь–Ф–Я —Г 30 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–µ–≥–Ї–Њ–є –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–є –С–Р, —А–∞–љ–µ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Д–ї—Г—В–Є–Ї–∞–Ј–Њ–љ–∞ –њ—А–Њ–њ–Є–Њ–љ–∞—В 200 –Љ–Ї–≥/—Б—Г—В. [26]. –Я–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ—Л –≤ –≥—А—Г–њ–њ—Л, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є–µ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і 160 –Љ–Ї–≥ 1 —А–∞–Ј/—Б—Г—В. –Є–ї–Є —Д–ї—Г—В–Є–Ї–∞–Ј–Њ–љ–∞ –њ—А–Њ–њ–Є–Њ–љ–∞—В–∞ 100 –Љ–Ї–≥ 2 —А–∞–Ј–∞/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 8 –љ–µ–і. –§—Г–љ–Ї—Ж–Є—П –Ь–Ф–Я –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –Є–Љ–њ—Г–ї—М—Б–љ–Њ–є –Њ—Б—Ж–Є–ї–ї–Њ–Љ–µ—В—А–Є–Є. –Ъ—А–Њ–Љ–µ —Н—В–Њ–≥–Њ, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ –Є–Ј–Љ–µ—А—П–ї–Є —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —Н–Њ–Ј–Є–љ–Њ—Д–Є–ї–Њ–≤ –≤ –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –Љ–Њ–Ї—А–Њ—В–µ.
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–Љ–µ–љ—М—И–∞–ї —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ –Ь–Ф–Я –Є –Є—Е –≥–Є–њ–µ—А—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В—М, –∞ —В–∞–Ї–ґ–µ —Б—В–µ–њ–µ–љ—М —Н–Њ–Ј–Є–љ–Њ—Д–Є–ї—М–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —Д–ї—Г—В–Є–Ї–∞–Ј–Њ–љ–∞ –њ—А–Њ–њ–Є–Њ–љ–∞—В–Њ–Љ (—А–Є—Б. 3).
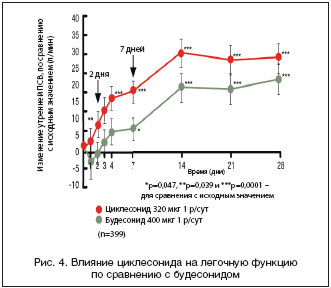
–Ф—А—Г–≥–Њ–µ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ 12––љ–µ–і–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б —Г—З–∞—Б—В–Є–µ–Љ 399 –±–Њ–ї—М–љ—Л—Е, —Б—В—А–∞–і–∞—О—Й–Є—Е –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–є –С–Р, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Б—А–∞–≤–љ–Є–≤–∞–ї–Є—Б—М —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і 320 –Љ–Ї–≥ 1 —А–∞–Ј/—Б—Г—В. –Є –±—Г–і–µ—Б–Њ–љ–Є–і 400 –Љ–Ї–≥ 1 —А–∞–Ј/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 12 –љ–µ–і., –∞ –њ–µ—А–≤–Є—З–љ—Л–Љ –Ї—А–Є—В–µ—А–Є–µ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –±—Л–ї–∞ –Ю–§–Т1, –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –≤ –≥—А—Г–њ–њ–µ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ —Г—А–Њ–≤–љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ю–§–Т1 —З–µ—А–µ–Ј 12 –љ–µ–і., –∞ –њ–Є–Ї–Њ–≤–∞—П —Б–Ї–Њ—А–Њ—Б—В—М –≤—Л–і–Њ—Е–∞ – —Г–ґ–µ –љ–∞ 2––є –і–µ–љ—М –Є –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ –ї–µ—З–µ–±–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ (—А–Є—Б. 4) [27].
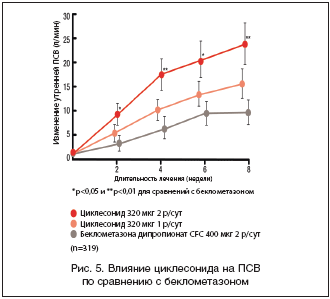
–Х—Й–µ –≤ –Њ–і–љ–Њ–Љ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Њ—В–Ї—А—Л—В–Њ–Љ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Б—А–∞–≤–љ–Є–≤–∞–ї–Є—Б—М —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і HFA 320 –Љ–Ї–≥/—Б—Г—В. (–±–µ–Ј —Б–њ–µ–є—Б–µ—А–∞), —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і HFA 640 –Љ–Ї–≥/—Б—Г—В. (–±–µ–Ј —Б–њ–µ–є—Б–µ—А–∞) –Є –±–µ–Ї–ї–Њ–Љ–µ—В–∞–Ј–Њ–љ–∞ –і–Є–њ—А–Њ–њ–Є–Њ–љ–∞—В–∞ CFC 800 –Љ–Ї–≥/—Б—Г—В. (—Б–Њ —Б–њ–µ–є—Б–µ—А–Њ–Љ) —Г 319 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Г–Љ–µ—А–µ–љ–љ–Њ–є –Є–ї–Є —В—П–ґ–µ–ї–Њ–є –С–Р, —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і –≤ –і–Њ–Ј–µ 640 –Љ–Ї–≥/—Б—Г—В. –њ–Њ–Ї–∞–Ј–∞–ї —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –≤–ї–Є—П—В—М –љ–∞ –њ–Є–Ї–Њ–≤—Г—О —Б–Ї–Њ—А–Њ—Б—В—М –≤—Л–і–Њ—Е–∞ (–Я–°–Т) —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞—Б—В–Љ–Њ–є —Б—А–µ–і–љ–µ–є –Є —В—П–ґ–µ–ї–Њ–є —Б—В–µ–њ–µ–љ–Є. –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –±–∞–ї–ї–Њ–≤ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є –∞—Б—В–Љ—Л –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –њ—А–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –њ—А–µ–њ–∞—А–∞—В–∞—Е –љ–µ–Њ—В–ї–Њ–ґ–љ–Њ–є –њ–Њ–Љ–Њ—Й–Є (—А–Є—Б. 5) [28].
–£ 528 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 12 –і–Њ 75 –ї–µ—В, –Є–Љ–µ–≤—И–Є—Е –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ —Г–Љ–µ—А–µ–љ–љ—Г—О –Є–ї–Є —В—П–ґ–µ–ї—Г—О –С–Р, –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ—Г—О –љ–µ –Љ–µ–љ–µ–µ 6 –Љ–µ—Б. –љ–∞–Ј–∞–і, –Є –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і –≤ –і–Њ–Ј–µ 640 –Љ–Ї–≥/—Б—Г—В. –Є–ї–Є —Д–ї—Г—В–Є–Ї–∞–Ј–Њ–љ–∞ –њ—А–Њ–њ–Є–Њ–љ–∞—В 1000 –Љ–Ї–≥/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б., –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і, –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —А–µ–ґ–µ –≤–Њ–Ј–љ–Є–Ї–∞–ї–Є –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –≤ –Њ–±–ї–∞—Б—В–Є —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є–Љ–Є —Д–ї—Г—В–Є–Ї–∞–Ј–Њ–љ [29].
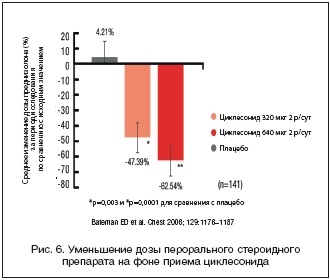
–Т –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б —Г—З–∞—Б—В–Є–µ–Љ 141 –±–Њ–ї—М–љ–Њ–≥–Њ —Б —В—П–ґ–µ–ї–Њ–є –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–є —Б—В–µ—А–Њ–Є–і––Ј–∞–≤–Є—Б–Є–Љ–Њ–є –С–Р –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ –Є –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (≥12 –ї–µ—В) –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і (640 –Љ–Ї–≥/—Б—Г—В. –Є–ї–Є 1280 –Љ–Ї–≥/—Б—Г—В. –Є–ї–Є –њ–ї–∞—Ж–µ–±–Њ –≤ —В–µ—З–µ–љ–Є–µ 12 –љ–µ–і.). –Х–ґ–µ–љ–µ–і–µ–ї—М–љ–Њ –њ—А–Њ–≤–Њ–і–Є–ї–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї —Б–љ–Є–ґ–µ–љ–Є—О –і–Њ–Ј—Л –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞.
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є, —З—В–Њ –њ–µ—А–µ—Е–Њ–і —Б —А–∞–Ј–ї–Є—З–љ—Л—Е –Ш–У–Ъ–° –≤ –≤—Л—Б–Њ–Ї–Њ–є –і–Њ–Ј–µ –љ–∞ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і 320 –Љ–Ї–≥ –Є–ї–Є 640 –Љ–Ї–≥ 2 —А–∞–Ј–∞/—Б—Г—В. –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–Љ–µ–љ—М—И–∞–ї –і–Њ–Ј—Г –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ —Б—В–µ—А–Њ–Є–і–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 62,5% (—А–Є—Б. 6). –С—Л–ї–Њ —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤ –≥—А—Г–њ–њ–µ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ —Г 30% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ –Њ—В–Љ–µ–љ–Є–ї–Є; —Г 85,4% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Њ–Ј—Г —Б—В–µ—А–Њ–Є–і–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ —Г–Љ–µ–љ—М—И–Є–ї–Є; –Ю–§–Т1 –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ —Б–љ–Є–ґ–∞–ї—Б—П; –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –±—Л–ї–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ [30]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–Њ–±–∞–≤–ї–µ–љ–Є–µ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ –≤ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–∞—Е –Ї —В–µ—А–∞–њ–Є–Є –Ш–У–Ъ–° –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–љ–љ–µ–Љ—Г –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –і–Њ–Ј—Л —Б—В–µ—А–Њ–Є–і–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞. –≠—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—В—М –Ї–Њ–љ—В—А–Њ–ї—М –С–Р –њ—А–Є –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–Љ —Б–Є—Б—В–µ–Љ–љ–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є.
–Т–ї–Є—П–љ–Є–µ –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ –љ–∞ —А–Њ—Б—В –і–µ—В–µ–є —Б –ї–µ–≥–Ї–Њ–є –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–є –∞—Б—В–Љ–Њ–є –Є–Ј—Г—З–∞–ї–Њ—Б—М –≤ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є [31]. –Я–Њ—Б–ї–µ –њ–Њ–ї—Г–≥–Њ–і–Њ–≤–Њ–≥–Њ –≤–≤–Њ–і–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ (661 —А–µ–±–µ–љ–Њ–Ї) –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 5,0 –і–Њ 8,5 –≥–Њ–і–∞ –±—Л–ї–Є –љ–∞–Ј–љ–∞—З–µ–љ—Л –ї–Є–±–Њ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і –≤ –і–Њ–Ј–∞—Е 40 –Є–ї–Є 160 –Љ–Ї–≥, –ї–Є–±–Њ –њ–ї–∞—Ж–µ–±–Њ 1 —А–∞–Ј/—Б—Г—В. —Г—В—А–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ 52 –љ–µ–і.
–Я–µ—А–Є–Њ–і –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї 8 –љ–µ–і. –Я–µ—А–≤–Є—З–љ—Л–Љ –Ї—А–Є—В–µ—А–Є–µ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –±—Л–ї–∞ —Б–Ї–Њ—А–Њ—Б—В—М –ї–Є–љ–µ–є–љ–Њ–≥–Њ —А–Њ—Б—В–∞ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –њ–µ—А–Є–Њ–і–∞ –і–≤–Њ–є–љ–Њ–≥–Њ —Б–ї–µ–њ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б—А–µ–і–љ–µ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –і–ї–Є–љ—Л —В–µ–ї–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–Њ—Б—М –≤ –≥—А—Г–њ–њ–∞—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і –Є –њ–ї–∞—Ж–µ–±–Њ. –Ф–∞–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є, —З—В–Њ –≤–ї–Є—П–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ —А–Њ—Б—В –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–Њ —Б –њ–ї–∞—Ж–µ–±–Њ.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і (–Р–ї—М–≤–µ—Б–Ї–Њ®) —П–≤–ї—П–µ—В—Б—П –Ш–У–Ъ–° –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –љ–Њ–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –і–ї—П –ї–µ—З–µ–љ–Є—П –≤–Ј—А–Њ—Б–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –і–µ—В–µ–є, —Б—В—А–∞–і–∞—О—Й–Є—Е –С–Р. –£–љ–Є–Ї–∞–ї—М–љ—Л–Љ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞ —П–≤–ї—П—О—В—Б—П –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –≤ –ї–µ–≥–Ї–Є—Е –Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –≤ –Ь–Ф–Я, –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є–µ –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–±–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ —Г—А–Њ–≤–љ–µ –љ–µ —В–Њ–ї—М–Ї–Њ –Ї—А—Г–њ–љ—Л—Е, –љ–Њ –Є –Љ–µ–ї–Ї–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є; –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л; –±—Л—Б—В—А–Њ–і–µ–є—Б—В–≤–Є–µ –Є –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–є –Ї–Њ–љ—В—А–Њ–ї—М –С–Р –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –Ш–У–Ъ–°.



![–†–Є—Б. 3. –Т–ї–Є—П–љ–Є–µ —Ж–Є–Ї–ї–µ—Б–Њ–љ–Є–і–∞ –љ–∞ —Д—Г–љ–Ї—Ж–Є—О –Љ–µ–ї–Ї–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є –Є –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є [1-3]](/data/articles/Image/t20/n6/341-4.gif)

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Crompton G. A brief history of inhaled asthma therapy over the last fifty years // Primary Care Respiratory Journal. 2006. Vol. 15. –†. 326–331.
2. Cameron S.J., Cooper E.J., Crompton G.K., Hoare M.V., Grant I.W. Substitution of beclomethasone aerosol for oral prednisolone in the treatment of chronic asthma // British Medical Journal. 1973. Vol. 4. –†. 205–207.
3. Hodson M.E., Batten J.C., Clarke S.W., Gregg I.. Beclomethasone dipropionate aerosol in asthma. Transfer of steroid-dependent asthmatic patients from oral prednisone to beclomethasone dipropionate aerosol // The American Review of Respiratory Disease 1974. Vol. 110. –†. 403–408.
4. Vilsvik J.S., Schaanning J. Beclomethasone dipropionate aerosol in adult steroid-dependent obstructive lung disease // Scandinavian Journal of Respiratory Disease.1974 Vol. 55. –†. 169–175.
5. National Heart Lung and Blood Institute. Guidelines for the diagnosis and management of asthma. Bethesda, MD: National Institutes of Health, US Department of Health and Human Services. 2007.
6. Cohen J., W.R. Douma, N.H.T. ten Hacken et al. Ciclesonide improves measures of small airway involvement in asthma // EurRespir J. 2008. Vol. 31. –†. 1213–1220.
7. Bellamy D., Harris T. Poor perceptions and expectations of asthma control: results of the International Control of Asthma Symptoms (ICAS) survey of patients and general practitioners // Prim Care Respir J. 2005. Vol. 14. –†. 252–258.
8. Rabe K.F., Vermeire P.A., Soriano J.B., Maier W.C. Clinical management of asthma in 1999: the Asthma Insights and Reality in Europe (AIRE) study // Eur Respir J. 2000. Vol. 16. –†. 802–807.
9. Carlton B.G., Lucas D.O., Ellis E.F., Conboy-Ellis K., Shoheiber O., Stempel D.A. The status of asthma control and asthma prescribing practices in the United States: results of a large prospective asthma control survey of primary care practices // J Asthma. 2005. Vol. 42. –†. 529–535.
10. Leach C.L. Improved delivery of inhaled steroids to the large and small airways // Respir Med. 1998. Vol. 92. Suppl. A. –†. 3–8.
11. Mead J., Takishima T., Leith D. Stress distribution in lungs: a model of pulmonary elasticity // J Appl Physiol. 1970. Vol. 28. –†. 596–608.
12. Woolcock A.J. Effect of drugs on small airways // Am J RespirCrit Care Med. 1998. Vol. 157. –†. 203–207.
13. Balzar S., Wenzel S.E., Chu H.W. Transbronchial biopsy as a tool to evaluate small airways in asthma // EurRespir J. 2002. Vol. 20. –†. 254–259.
14. Contoli M. et al. // Allergy. 2010; Vol. 65. –†. 141–15.
15. Burgel P.-R. The role of small airways in obstructive airway diseases // Review.EurRespirRev. 2011. Vol. 20. 119. –†. 23–33.
16. Martin R.J. Therapeutic significance of distal airway inflammation in asthma // J Allergy Clin Immunol. 2002. Vol. 109 (2 Supply.). –†.447–460.
17. Nonaka T., Nave R., McCracken N., et al. Ciclesonide uptake and metabolism in human alveolar type II epithelial cells (A549). BMC Pharmacol. 2007 Sep 27;7:12.
18. Mutch E., Nave R., McCracken N., et al. The role of esterases in the metabolism of ciclesonide to desisobutyryl–ciclesonide in human tissue.Biochem Pharmacol. 2007 May 15;73(10):1657–1664.
19. Nave R., McCracken N. Metabolism of ciclesonide in the upper and lower airways: review of available data.J Asthma Allergy. 2008 Sep 7;1:11–18.
20. Stoeck M., Riedel R., Hochhaus G., et al. In vitro and in vivo anti–inflammatory activity of the new glucocorticoid ciclesonide.J Pharmacol Exp Ther. 2004 Apr;309(1):249–258.
21. Nave R., Meyer W., Fuhst R., Zech K. Formation of fatty acid conjugates of ciclesonide active metabolite in the rat lung after 4–week inhalation of ciclesonide.Pulm Pharmacol Ther. 2005;18(6):390–396.
22. EU SmPC Alvesco, 2011.
23.Nave R., Herzog R., Laurent A., Wingertzahn M.A. Pharmacokinetics of ciclesonide and desisobutyryl ciclesonide after administration via aqueous nasal spray or hydrofluoroalkane nasal aerosol compared with orally inhaled ciclesonide: an open label, single dose, three period crossover study in healthy volunteers. Clin Ther. 2009; 31: 2988–2999.
24. Tunek A., Sjodin K., Hallstrom G. Reversible formation of fatty acid esters of budesonide, an antiasthma glucocorticoid, in human lung and liver microsomes // Drug MetabDispos. 1997 Nov. Vol. 25(11). –†. 1311–1317.
25. Winkler J., Hochhaus G., Derendorf H. How the lung handles drugs: pharmacokinetics and pharmacodynamics of inhaled corticosteroids. Proc Am Thorac Soc. 2004;1(4):356–63. Review.
26. Hoshino M. Comparison of effectiveness in ciclesonide and fluticasone propionate on small airway function in mild asthma. Allergol Int 2010;59 (1):59–66.
27. Ukena D., Biberger C., Steinijans V., von Behren V., Malek R., Weber H.H., et al. Ciclesonide is more effective than budesonide in the treatment of persistent asthma.Pulm Pharmacol Ther. 2007;20(5):562–70.
28. Adachi M., Ishihara K., Inoue H., et al. Efficacy and safety of inhaled ciclesonide compared with chlorofluorocarbon beclomethasone dipropionate in adults with moderate to severe persistent asthma.Respirology. 2007 Jul;12(4):573–80.
29. Bateman E.D., Linnhof A.E., Homik L., et al. Comparison of twice–daily inhaled ciclesonide and fluticasone propionate in patients with moderate–to–severe persistent asthma.Pulm Pharmacol Ther. 2008;21(2):264–75.
30. Bateman E, Karpel J, Casale T, et al.Ciclesonide reduces the need for oral steroid use in adult patients with severe, persistent asthma.Chest. 2006 May;129(5):1176–87.
31. Skoner D.P., Maspero J., Banerji D., et al. Assessment of the Long–term Safety of Inhaled Ciclesonide on Growth in Children With Asthma. Pediatrics Vol. 121, N. 1, January 2008, –µ1––µ14












