С учетом этого современная клиническая классификация выделяет [7] в зависимости от условий возникновения 2 основные клинические формы:
– внебольничную пневмонию (ВП);
– госпитальную (нозокомиальную) пневмонию (под это определение попадают пневмонии, развившиеся у пациента в стационаре не ранее чем через 48 ч после госпитализации или в амбулаторных условиях в течение периода инкубации после выписки из стационара).
В зависимости от статуса пациента выделяют дополнительные варианты:
– пневмонию у лиц с иммунодефицитными состояниями;
– пневмонию вследствие аспирации содержимого желудка (аспирационная пневмония).
Об аспирационной природе пневмонии необходимо задуматься в тех случаях, когда у пациента отмечается нарушение глотания, например, при нарушениях мозгового кровообращения, психических заболеваниях, а также у пациентов, у которых были эпизоды нарушения сознания и рвоты (например, у больных алкоголизмом).
Такая дифференцировка пневмоний удобна с точки зрения рутинной практики, поскольку правильный учет перечисленных факторов позволяет избежать возможных ошибок при эмпирическом назначении антибактериальной терапии (АБТ) и сказывается на сроках оказания помощи. Назначение антибиотиков в первые часы от начала заболевания значительно снижает риск развития осложнений и оптимизирует прогноз пневмонии.
В связи с тем, что в практике преобладают ВП (распространенность среди взрослого населения в РФ составляет 5–8%) [3], дальнейший разговор пойдет именно об этой форме пневмонии.
ВП – острое заболевание, возникшее во внебольничных условиях, т. е. вне стационара, или диагностированное в первые 48 ч от момента госпитализации, или развившееся у пациента, не находившегося в домах сестринского ухода / отделениях длительного медицинского наблюдения ≥14 сут, сопровождающееся симптомами инфекции нижних отделов дыхательных путей (лихорадка, кашель, выделение мокроты, возможно гнойной, боль в грудной клетке, одышка) и рентгенологическими признаками «свежих» очагово-инфильтративных изменений в легких при отсутствии очевидной диагностической альтернативы [4].
Пример формулировки диагноза: внебольничная долевая (пневмококковая) пневмония нижней доли правого легкого. Тяжелое течение. Правосторонний экссудативный плеврит. Инфекционно-токсический шок. Дыхательная недостаточность 3-й степени.
Этиологических вариантов ВП очень много – описано более 100 микроорганизмов, которые способны вызывать ВП. Частота их встречаемости зависит как от региональных особенностей и эпидемиологической обстановки, так и от особенностей самих пациентов (возраст, наличие сопутствующих заболеваний и т. д.).
В большинстве случаев достоверно установить причинный микроорганизм не представляется возможным. Связано это с разнообразными факторами, как субъективными (нарушение условий сбора и транспортировки мокроты, самолечение), так и объективными (отсутствие продуктивного кашля, невозможность идентификации внутриклеточных возбудителей стандартными методами, употребление продуктов питания, содержащих примеси АБП, необходимость быстрого начала лечения в условиях отсутствия бактериологической лаборатории и т. д.).
Знание вероятного этиологического фактора этих заболеваний играет первостепенную роль в определении тактики ведения. Сложность и длительный срок этиологической диагностики при необходимости быстрого начала лечения, с одной стороны, и постоянно изменяющаяся картина резистентности микроорганизмов, с другой, привели к тому, что в течение последних 20 лет практически постоянно ведутся исследования по определению спектра и резистентности CARTI-патогенов (pathogens Causing Community-Acquired Respiratory Tract Infections). Наиболее известное – Alexander Project, с 1992 г. ведется непрерывный мониторинг чувствительности возбудителей внебольничных инфекций дыхательного тракта у взрослых к антимикробным препаратам. В результате исследований было установлено, что причинами внебольничных инфекций нижних отделов дыхательных путей могут быть более сотни патогенов, однако определяющую роль играет ограниченное количество микроорганизмов.
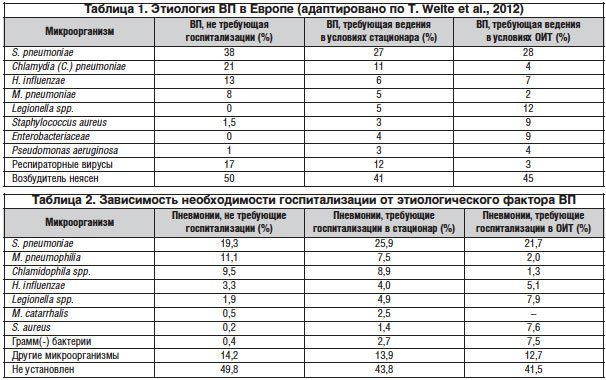
В 2009 г. T. Welte еt al. провели метаанализ 46 (из первоначально отобранных 1652) исследований за период с 1990 по 2008 г. по определению этиологического фактора ВП в Европе. Следует отметить, что, несмотря на широту используемых методов диагностики (культуральные методы, серодиагностика, амплификация ДНК), приблизительно в половине случаев точно установить причинный возбудитель не удалось (табл. 1) [20].
Наиболее типичным возбудителем ВП является Streptococcus (S.) pneumoniae. В качестве этиологического фактора, по данным разных авторов, он выступает в 35–90% всех случаев ВП. Его встречаемость практически не зависит от каких-либо факторов (возраст, наличие сопутствующей патологии, состояние иммунитета, сезонность и т. д.). Этиологический вклад в развитие ВП, особенно у пациентов в возрасте до 60 лет, вносят внутриклеточные микроорганизмы (Chlamydophila spp. и Mycoplasma (M.) pneumoniae). У пожилых и пациентов, имеющих сопутствующие заболевания, а также у курильщиков значительно возрастает вероятность наличия Haemophilus (H.) influenzae. Можно отметить и наличие географического фактора: так, например, наиболее высокая выявляемость Chlamydophila spp. и M. pneumoniae отмечалась в Словении (26 и 32% соответственно) и Финляндии (20 и 16%), а во Франции, Ирландии и Турции их вклад в этиологию был близким к нулю [20].
Этиологический фактор ВП может влиять на тяжесть течения пневмонии, что особенно наглядно демонстрируют данные бактериологических исследований в случаях пневмонии, требующих или не требующих госпитализации [18] (табл. 2).
В оценке вероятности наличия того или иного возбудителя ВП может помочь дифференцировка пациентов по возрасту, наличию сопутствующей патологии и тяжести течения (рис. 1).
Для пациентов молодого возраста без сопутствующих заболеваний и при нетяжелом течении ВП основными возбудителями являются пневмококки и «атипичные» микроорганизмы. Для пожилых пациентов или пациентов, имеющих сопутствующую патологию, характерными являются пневмококк, гемофильная палочка и представители семейства энтеробактерий.
Особенно большое число диагностических ошибок приходится на долю пневмоний, вызванных микоплазмами и хламидиями. Продромальный период, характерный для этих возбудителей при ВП, является причиной ошибочной диагностики наличия у больных ОРВИ (до 54,5%). Так, для ВП, вызванной микоплазмой, характерными признаками будут мышечные и суставные боли на фоне постепенного повышения температуры тела, непродуктивный кашель, возможно – заложенность носа. У пациентов с хламидийной природой пневмонии в продромальном периоде часто могут отмечаться явления фарингита и ларингита.
Даже при отсутствии «атипичной» природы ВП ее диагностика имеет определенные трудности, и связано это с тем, что абсолютно патогномоничных признаков ВП не существует. В связи с этим большое значение имеет многосторонняя оценка критериев вероятности наличия пневмонии (табл. 3) [2].
Наиболее важный диагностический критерий установления диагноза пневмонии – рентгенография грудной клетки. Не будет преувеличением сказать, что практически всегда для диагностики ВП требуется обнаружение очагово-инфильтративных изменений в легких в сочетании с соответствующей симптоматикой поражения органов дыхания. Однако рассматривать рентгенографию как абсолютно чувствительный и специфичный метод нельзя: ряд факторов способен привести к ложноотрицательной или ложноположительной оценке (табл. 4).
В случаях наличия очевидной клинической симптоматики и невозможности визуализации очагово-инфильтративных изменений в легких при помощи рентгенографии, а также для исключения альтернативных причин показано проведение компьютерной томографии (метод, обладающий большей чувствительностью).
При наличии у пациента пневмонии врачу предстоит ответить на ряд ключевых вопросов по тактике ведения:
1. Место лечения (амбулаторно, терапевтическое отделение стационара, отделение интенсивной терапии (ОИТ)).
2. Выбор первоначального антибиотика.
3. Оценка эффективности проводимой АБТ.
4. Продолжительность АБТ.
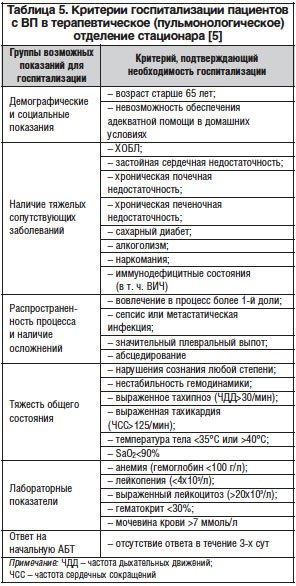
Выбирая место лечения, необходимо осознавать, что «госпитализация ради госпитализации» является не только напрасной экономической нагрузкой на всю систему здравоохранения, но и может сказаться негативно на пациенте, т. к. увеличивает вероятность госпитальных инфекций. Критерии госпитализации пациентов с ВП в терапевтическое (пульмонологическое) отделение стационара представлены в таблице 5.
Критерии для госпитализации в отделение реанимации и интенсивной терапии [8, 11]:
– острая дыхательная недостаточность (РаО2<50 мм рт. ст. при дыхании атмосферным воздухом, признаки утомления дыхательной мускулатуры);
– нестабильная гемодинамика (систолическое АД <90 мм рт. ст., диастолическое АД <60 мм рт. ст., олигурия, необходимость в вазопрессорных препаратах более 4 ч);
– острая почечная недостаточность с необходимостью проведения диализа;
– выраженный синдром диссеминированного внутрисосудистого свертывания;
– выраженные нарушения сознания;
– тяжелые септические осложнения;
– необходимость проведения искусственной вентиляции легких;
– вовлечение в процесс более 2-х долей легких;
– быстрое увеличение пневмонического фокуса на рентгенограмме (на 50% в течение 48 ч).
Практическую помощь в оценке тяжести ВП также могут оказать оценочные шкалы. Самая распространенная и приемлемая с практической точки зрения – балльная шкала PORT (Pneumonia Outcomes Research Team), разработанная M.J. Fine в 1997 г., которая в литературе чаще встречается под названием PSI (Pneumonia Severity Index). Шкала предполагает определение 20 клинических и лабораторных параметров [5]. Чем большее количество баллов имеет больной, тем более вероятен плохой прогноз заболевания. В соответствии с прогностическими критериями ВП больных можно разделить на 5 классов риска. Больные, соответствующие I, II классам риска, могут лечиться в амбулаторных условиях. Больные, соответствующие III классу риска, нуждаются в непродолжительной госпитализации. Больные IV и V классов риска, безусловно, требуют госпитализации (табл. 6, 7).
Основные недостатки шкалы PSI:
– громоздкость: врач вынужден учитывать большое количество критериев и должен быть уверен, что не забыл чего-либо и не ошибся в подсчете баллов;
– трудоемкость: включение в шкалу ряда лабораторных признаков обусловливает зависимость врачебного решения от результатов работы других, нередко нескольких, медработников;
– невозможность принятия быстрого решения из-за ожидания результатов лабораторных исследований.
Для ориентировочной оценки больше подходит шкала CURB-65 (С – нарушение сознания, U – уровень мочевины >7 ммоль/л, R – ЧДД >30/мин, B – систолическое АД <90 мм рт. ст., диастолическое АД <60 мм рт. ст., возраст >65 лет) или ее редуцированный вариант CRB-65. Оценка признаков происходит по двоичному принципу (отсутствие = 0, наличие = 1), пациентов распределяют на 3 группы (табл. 8).
Установив диагноз пневмонии и определившись с местом лечения, необходимо как можно раньше начать АБТ, т. к. раннее начало терапии позволяет значительно снизить риск развития осложнений и летальность [16].
Как уже упоминалось выше, первоначальная АБТ назначается эмпирически, что заставляет особенно тщательно подходить к выбору АБП. Однако такой подход не означает отказ от попытки идентификации возбудителя (особенно в случаях тяжелого течения пневмонии), поскольку определение этиологического фактора может оказать влияние на исход заболевания. Также к преимуществам направленного этиотропного лечения можно отнести сокращение количества назначаемых препаратов, снижение стоимости лечения, уменьшение числа побочных эффектов терапии и потенциала селекции резистентных штаммов микроорганизмов [9, 15].
Требования к оптимальному АБП для лечения ВП:
1) высокая активность против большинства наиболее часто встречающихся и наиболее вероятных микроорганизмов с учетом меняющейся резистентности;
2) высокая биодоступность и создание эффективных концентраций в легочной ткани;
3) низкие токсичность и частота развития побочных эффектов;
4) простота приема, обеспечивающая приверженность пациента терапии;
5) оптимальное соотношение цена/эффективность.
Первые 2 пункта являются приоритетными. Достаточно часто в терапевтической практике сталкиваются со случаями неадекватного выбора первоначального АБП. Наиболее распространенная ошибка – назначение сульфаниламидов, ципрофлоксацина и гентамицина, а также пероральных форм ампициллина и эритромицина [1].
Если учитывать, что в большинстве случаев ВП вызывается пневмококком, гемофильной палочкой и «атипичными» возбудителями, предпочтения в назначении должны отдаваться β-лактамным антибиотикам и макролидам (табл. 9, 10) [6].
Среди пенициллинов ведущее место сегодня принадлежит амоксициллину или его комбинациям с ингибиторами β-лактамаз (клавулановой кислотой и сульбактамом), т. к. он оказывает прямое бактерицидное действие на широкий спектр грамположительных, грамотрицательных, аэробных и анаэробных микроорганизмов, включая резистентные штаммы. Кроме того, по сравнению с другими пенициллиновыми антибиотиками амоксициллин обладает лучшими фармакокинетическими свойствами, в частности, большей биодоступностью при приеме внутрь, возможностью одновременного приема с пищей, молоком, меньшей степенью связывания белками плазмы и др.
В случаях подозрения на пневмонию, вызванную «атипичными» возбудителями, или при непереносимости β-лактамов необходимо назначать так называемые «современные» макролиды, т. е. макролиды с улучшенной фармакокинетикой: кларитромицин, рокситромицин, азитромицин, спирамицин (термин «современные» приходится употреблять с известной оговоркой, т. к., например, спирамицин используется уже более 50 лет). Основными достоинствами макролидов, позволяющими им сохранять ведущие позиции в лечении респираторных инфекций, являются хорошая переносимость и высокая эффективность при острых неосложненных инфекциях, сравнимая с эффективностью β–лактамных антибиотиков. В то же время, в отличие от β–лактамов, макролиды проникают внутрь клеток макроорганизма, в результате чего могут воздействовать на внутриклеточные бактерии. Полусинтетические макролиды (азитромицин, кларитромицин, рокситромицин) отличаются от природных более высокой активностью против гемофильной палочки и грамположительных кокков, а также пролонгированной фармакокинетикой. В то же время природные 16-членные макролиды (спирамицин) могут сохранять активность против резистентных к эритромицину и полусинтетическим макролидам пневмококкам и пиогенным стрептококкам.
Альтернативными препаратами являются респираторные фторхинолоны (левофлоксацин, моксифлоксацин, гемифлоксацин), т. к. они успешно сочетают в себе антипневмококковую активность с действием на внутриклеточных возбудителей и при этом имеют практически нулевой профиль резистентности. Для случаев тяжелого течения ВП имеются данные о сравнимой со стандартным режимом терапии (комбинация β-лактамного антибиотика и макролида) эффективности монотерапии респираторными фторхинолонами. Однако подобные исследования немногочисленны, поэтому более надежной является комбинация респираторных фторхинолонов или макролидов с цефалоспоринами III поколения (цефотаксим, цефтриаксон), что позволяет максимально перекрыть спектр вероятных возбудителей. Подобная схема позволяет быть уверенным в адекватности терапии как при наличии пневмококка и золотистого стафилококка (включая большинство резистентных к пенициллинам штаммов), так и энтеробактерий и внутриклеточных возбудителей.
Во всех случаях назначения АБП актуальным остается «правило 48–72 часов» – именно в этот промежуток времени врач должен определить, является ли назначенный антибиотик эффективным. Основные критерии эффективности в эти сроки – снижение температуры тела, уменьшение симптомов интоксикации, одышки и других проявлений дыхательной недостаточности. Если у пациента сохраняются лихорадка и интоксикация или симптоматика прогрессирует, необходимо пересмотреть тактику АБТ и, в случае амбулаторного лечения, повторно оценить целесообразность госпитализации пациента [4].
С целью обеспечения большей комфортности лечения, сокращения пребывания в стационаре и снижения затрат на лечение при получении адекватного ответа в течение 48–72 ч на парентеральное введение АБП возможен переход с парентерального на оральный путь введения («ступенчатая терапия»). Наиболее оптимальным вариантом ступенчатой терапии является последовательное использование 2-х форм (парентеральной и пероральной) одного и того же антибиотика. Для ступенчатой терапии предпочтение отдается препаратам, имеющим как парентеральную, так и пероральную формы выпуска: кларитромицину, азитромицину, спирамицину, амоксициллину/клавулановой кислоте, левофлоксацину, моксифлоксацину, цефуроксиму. Для принятия решения о смене пути введения АБП необходимо учитывать следующие критерии [6]:
– нормализация температуры тела (<37,5оС при 2–кратном измерении с интервалом в 8 ч);
– редукция одышки;
– отсутствие нарушений сознания;
– положительная динамика других симптомов;
– отсутствие проблем с ЖКТ, препятствующих всасыванию;
– согласие пациента.
Одним из ключевых пунктов тактики ведения пациентов с ВП является длительность АБТ, что важно как с экономической точки зрения, так и с точки зрения снижения вероятности негативных последствий для пациента. К сожалению, в практике довольно часто (>50% случаев) превалирует подход к оценке достаточности АБТ с точки зрения нормализации рентгенологической картины [1]. Однако следует учитывать тот факт, что сроки исчезновения рентгенологических признаков ВП в значительной степени отстают от сроков клинического выздоровления [17].
Клинические критерии достаточности АБТ ВП:
– температура тела <37,5°С (в течение 3-х дней);
– отсутствие интоксикации;
– отсутствие дыхательной недостаточности (частота дыхания – менее 20/мин);
– отсутствие гнойной мокроты;
– количество лейкоцитов в крови <10х109/л, нейтрофилов <80%, юных форм <6%;
– отсутствие отрицательной рентгенологической динамики.
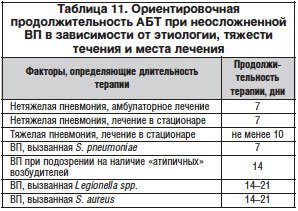
Следует отметить, что продолжительность лечения до нормализации клинических критериев зависит от ряда факторов: этиологии, тяжести течения, места лечения и т. д. Ориентировочная продолжительность АБТ представлена в таблице 11 [14].
Период диспансеризации больных, перенесших пневмонию без осложнений, может составлять 6 мес., для всех остальных больных – не менее 1 года. В это время пациентам рекомендуется вакцинопрофилактика как противогриппозными вакцинами – ежегодно в осенний период, так и пневмококковыми: Пневмо 23 (до 50 лет) – 1 раз в 5 лет, Превенар 13 (после 50 лет) – однократно в жизни.





Литература
1. Рачина С.А., Козлов С.Н., Иделевич Е.А. и соавт. Представления врачей поликлиник об этиологии и тактике лечения внебольничной пневмонии в амбулаторных условиях // Пульмонология. 2004. № 2. С. 6–12.
2. Синопальников А.И. Внебольничная пневмония у взрослых // Consilium Medicum. 2007. № 3. С. 5–16.
3. Чучалин А.Г. Болезни органов дыхания // Мед. газета. 2000. № 43. С. 8–9.
4. Чучалин А.Г., Синопальников А.И., Козлов Р.С., Тюрин И.Е., Рачина С.А. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике (Пособие для врачей) // Клиническая микробиология и антимикробная химиотерапия. 2010. Т. 12. № 3. С. 186–226.
5. Чучалин А.Г., Синопальников А.И., Страчунский Л.С., Козлов Р.С., Рачина С.А., Яковлев С.В. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике. Современные клинические рекомендации по антимикробной терапии. Вып. 2. Смоленск: МАКМАХ, 2007. 608 c.
6. Чучалин А.Г., Синопальников А.И., Яковлев С.В., Страчунский Л.С., Козлов Р.С., Рачина С.А. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике // Рос. мед. вести. 2003. № 3. С. 53–79.
7. Чучалин А.Г., Синопальников А.И., Яковлев С.В. и др. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике (Пособие для врачей). Смоленск, 2003. 53 с.
8. American Thoracic Society. Guidelines for the initial management of adults with community–acquired pneumonia: diagnosis, assessment of severity, and initial antimicrobial therapy // Am. Rev. Respir. Dis. 1993. Vol. 148. Р. 1418–1426.
9. Bartlett J.G., Dowell S.F., Mandell L.A. et al. Practice guidelines for the management of community–acquired pneumonia in adults. Clin. Infect. Dis. 2000; Vol. 31: 347– 382.
10. Barlett J.C., Mundy L.M. Community-acquired pneumonia // N. Eng. J. Med. 1995. Vol. 333. Р. 1618–1624.
11. European Respiratory Society. Guidelines for the management of adult lower respiratory tract infections // Eur. Respir. J. 2005. Vol. 26. Р. 1138–1180.
12. File T., Tan J., Plouffe J. The role of atypical pathogens: Mycoplasma pneumoniae, Clamydia pneumoniae and Legionella pneumophila in respiratory infection // Infect. Dis. Clin. North Am. 1998. Vol. 12 (3). Р. 569–592.
13. Garibaldi R.A. Epidemiology of community-acquired respiratory tract infections in adults: incidence, etiology, and impact // Am. J. Med. 1985. Vol. 78. Р. 32–37.
14. Halm E.A., Fine M.J., Marrie T.J., et al. Time to clinical stability in patients hospitalized with community–acquired pneumonia: implications for practice guidelines // JAMA. 1998. Vol. 279.Р. 452–457.
15. Mandell L.A., Marrie T.J., Grossman R.E. et al. Canadian guidelines for the initial management of community-acquired pneumonia: en evidence-based update by the Canadian Infectious Diseases Society and the Canadian Thoracic Society // Clin. Infect. Dis. 2000. Vol. 31. Р. 383–421.
16. Meehan T.P., Fine M.J., Krumholz H.M. et al. Quality of care, process, and outcomes in elderly patients with pneumonia // JAMA. 1997. Vol. 278. Р. 2080–2084.
17. Mitti R.L., Schwab R.J., Duchin J.S. et al. Radiographic resolution of community-acquired pneumonia // Am. J. Respir. Crit. Care Med. 1994. Vol. 149. Р. 28–33.
18. Woodhead M. Community acquired pneumonia in Europe: causative pathogens and resistance patterns // Eur. Respir. J. 2002. Vol. 20. Р. 20–27.
19. UK Department of Health. Getting ahead of the curve. A strategy for combating infectious diseases. 2002. 146 р.
20. Welte T., Torres A., Nathwani D. Clinical and economic burden of community-acquired pneumonia among adults in Europe // Thorax. 2012. Vol. 67. Р. 71–79.












