–Ф–µ–Ї–ї–∞—А–∞—Ж–Є—П –Њ —Д–Є–љ–∞–љ—Б–Њ–≤—Л—Е –Є –і—А—Г–≥–Є—Е –≤–Ј–∞–Є–Љ–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П—Е. –Т—Б–µ –∞–≤—В–Њ—А—Л –њ—А–Є–љ–Є–Љ–∞–ї–Є —Г—З–∞—Б—В–Є–µ –≤ —А–∞–Ј—А–∞–±–Њ—В–Ї–µ –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є, –і–Є–Ј–∞–є–љ–∞ —А–∞–±–Њ—В—Л –Є –љ–∞–њ–Є—Б–∞–љ–Є–Є
—А—Г–Ї–Њ–њ–Є—Б–Є. –Ю–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–∞—П –≤–µ—А—Б–Є—П —А—Г–Ї–Њ–њ–Є—Б–Є –Њ–і–Њ–±—А–µ–љ–∞ –≤—Б–µ–Љ–Є –∞–≤—В–Њ—А–∞–Љ–Є.
–Р–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М
–Э–∞ —Д–Њ–љ–µ —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ –≤ –†–Њ—Б—Б–Є–Є –≤ –њ–Њ—Б–ї–µ–і–љ–µ–µ –і–µ—Б—П—В–Є–ї–µ—В–Є–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Б—В—А—Г–Ї—В—Г—А—Л –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Љ–Є–Ї–Њ–±–∞–Ї—В–µ—А–Є–Є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ (–Ь–С–Ґ). –Э–∞ –њ–µ—А–≤—Л–є –њ–ї–∞–љ –≤—Л—И–ї–∞ –њ—А–Њ–±–ї–µ–Љ–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ-—Г—Б—В–Њ–є—З–Є–≤–Њ–≥–Њ —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ —Б –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–Њ–є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М—О (–Ь–Ы–£) –Є —И–Є—А–Њ–Ї–Њ–є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М—О (–®–Ы–£) –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П. –Ґ–∞–Ї, –≤ 2013 –≥. –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є —Б—А–µ–і–Є –≤–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ—Л—Е –±–∞—Ж–Є–ї–ї—П—А–љ—Л—Е –±–Њ–ї—М–љ—Л—Е —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ –Њ—А–≥–∞–љ–Њ–≤ –і—Л—Е–∞–љ–Є—П –і–Њ–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤—Л–і–µ–ї—П—О—Й–Є—Е –Ь–С–Ґ —Б –Ь–Ы–£ –Ї –њ—А–Њ—В–Є–≤–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ (–Я–Ґ–Я), —Б–Њ—Б—В–∞–≤–Є–ї–∞ 17,3%, –∞ —Б—А–µ–і–Є –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ —А–∞–Ј–ї–Є—З–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є —Б –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є–µ–Љ вАУ 40,0% [1]. –Т 2015 –≥. –Њ—В–Љ–µ—З–µ–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Њ–ї–Є –≤–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ—Л—Е –±–Њ–ї—М–љ—Л—Е —Б –Ь–Ы–£-—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ –і–Њ 23,0%, –∞ —Б—А–µ–і–Є –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ —Б –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є–µ–Љ вАУ –і–Њ 47,5%. –Т –£—А–∞–ї—М—Б–Ї–Њ–Љ –§–µ–і–µ—А–∞–ї—М–љ–Њ–Љ –Њ–Ї—А—Г–≥–µ —Н—В–Є —Ж–Є—Д—А—Л —Б–Њ—Б—В–∞–≤–Є–ї–Є 24,1 –Є 50,2% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [2]. –Ф–Њ–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ –Ь–С–Ґ —Б –®–Ы–£ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П —Б—А–µ–і–Є –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П –≤ –†–Њ—Б—Б–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –±–Њ–ї–µ–µ 10% [1].–Ы–µ—З–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ —Б –Ь–Ы–£/–®–Ы–£ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –њ—А–Њ–≤–Њ–і–Є—В—Б—П –≤ –†–Њ—Б—Б–Є–Є –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –§–µ–і–µ—А–∞–ї—М–љ—Л–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –њ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є—О —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ –Њ—А–≥–∞–љ–Њ–≤ –і—Л—Е–∞–љ–Є—П —Б –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–Њ–є –Є —И–Є—А–Њ–Ї–Њ–є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М—О –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П, —Г—В–≤–µ—А–ґ–і–µ–љ–љ—Л–Љ–Є –њ—А–Є–Ї–∞–Ј–Њ–Љ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є –Њ—В 29.12.2014 вДЦ 951 [3, 4].
–Я—А–Є –ї–µ—З–µ–љ–Є–Є —Н—В–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –±–Њ–ї—М–љ—Л—Е —Г –≤—А–∞—З–∞ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ—Л –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е —А–µ–ґ–Є–Љ–Њ–≤ —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є. –≠—В–Њ —Б–≤—П–Ј–∞–љ–Њ –љ–µ —В–Њ–ї—М–Ї–Њ —Б –њ–ї–Њ—Е–Њ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –њ—А–Њ—В–Є–≤–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –љ–∞–ї–Є—З–Є–µ–Љ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –љ–Њ –Є —Б –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М—О –Ї –Є–Љ–µ—О—Й–Є–Љ—Б—П –≤ —А–∞—Б–њ–Њ—А—П–ґ–µ–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є –Я–Ґ–Я [5, 6]. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –Є–Ј—Г—З–µ–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–Њ–≤—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ –Є–Љ–µ–µ—В –±–Њ–ї—М—И–Њ–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ [7].
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –Њ—Ж–µ–љ–Ї–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –≤–Ї–ї—О—З–µ–љ–Є—П –≤ —Б—Е–µ–Љ—Л –њ—А–Њ—В–Є–≤–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –љ–Њ–≤—Л—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–є –Я–Ґ–Я –њ—А–Є –ї–µ—З–µ–љ–Є–Є –ї–µ–≥–Њ—З–љ–Њ–≥–Њ —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ —Б –Ь–Ы–£/–®–Ы–£ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –љ–∞ –±–∞–Ј–µ –Ї–ї–Є–љ–Є–Ї–Є –§–У–С–£ ¬Ђ–£–Э–Ш–Ш–§¬ї –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є —Б 2012 –њ–Њ 2016 –≥. –С—Л–ї–Є –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є–љ–і–Є–≤–Є–і—Г–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ —А–µ–ґ–Є–Љ—Л –њ—А–Њ—В–Є–≤–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Я–Ґ–Ґ) —Б–ї–µ–і—Г—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤:1. –Э–∞—В—А–Є—П –њ–∞—А–∞–∞–Љ–Є–љ–Њ—Б–∞–ї–Є—Ж–Є–ї–∞—В–∞ (–Я–Р–°–Ъ) 1145 –Љ–≥ + –Є–Ј–Њ–љ–Є–∞–Ј–Є–і–∞ (–Ш–Ј–Њ–њ–∞—Б–Ї) 33,3 –Љ–≥ вАУ —В–∞–±–ї–µ—В–Ї–Є, –њ–Њ–Ї—А—Л—В—Л–µ –Ї–Є—И–µ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є.
2. –Ґ–Є–Њ—Г—А–µ–Є–і–Њ–Є–Љ–Є–љ–Њ–Љ–µ—В–Є–ї–њ–Є—А–Є–і–Є–љ–Є—П –њ–µ—А—Е–ї–Њ—А–∞—В–∞ (–Я–µ—А—Е–ї–Њ–Ј–Њ–љ¬Ѓ) –њ–Њ 200 –Љ–≥ –Є 400 –Љ–≥ вАУ —В–∞–±–ї–µ—В–Ї–Є, –њ–Њ–Ї—А—Л—В—Л–µ –њ–ї–µ–љ–Њ—З–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є.
3. –С–µ–і–∞–Ї–≤–Є–ї–Є–љ–∞ —Д—Г–Љ–∞—А–∞—В вАУ —В–∞–±–ї–µ—В–Ї–Є –њ–Њ 100 –Љ–≥.
4. –У–Є–і—А–Њ–Ї—Б–Є–Љ–µ—В–Є–ї—Е–Є–љ–Њ–Ї—Б–∞–ї–Є–љ–і–Є–Њ–Ї—Б–Є–і–∞ 100 –Љ–≥ + –Є–Ј–Њ–љ–Є–∞–Ј–Є–і–∞ 250 –Љ–≥ (–•–Є–Ї—Б–Њ–Ј–Є–і) вАУ –ї–Є–Њ—Д–Є–ї–Є–Ј–∞—В –і–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П —А–∞—Б—В–≤–Њ—А–∞ –і–ї—П –≤–љ—Г—В—А–Є–њ–ї–µ–≤—А–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –Є –Є–љ–≥–∞–ї—П—Ж–Є–є.
–Я—А–Є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Њ—Ж–µ–љ–Ї—Г —В—П–ґ–µ—Б—В–Є –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є (–Э–ѓ) –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –Я–Ґ–Я –≤—Л–њ–Њ–ї–љ—П–ї–Є –њ–Њ –њ—П—В–Є–±–∞–ї–ї—М–љ–Њ–є —И–Ї–∞–ї–µ ¬Ђ–Ъ—А–Є—В–µ—А–Є–Є –Њ—Ж–µ–љ–Ї–Є –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є, –≤–µ—А—Б–Є—П 4.03¬ї вАУ Common terminology Criteria for Adverse Events (CTCAE v.4.03) [8].
1. –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–Ї–ї—О—З–µ–љ–Є—П –≤ —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Ш–Ј–Њ–њ–∞—Б–Ї –±—Л–ї–Є —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ—Л 2 –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞. –У—А—Г–њ–њ—Л –±—Л–ї–Є –Њ–і–љ–Њ—А–Њ–і–љ—Л –њ–Њ –≤–Њ–Ј—А–∞—Б—В—Г, –њ–Њ–ї—Г, —Е–∞—А–∞–Ї—В–µ—А—Г –Є —В—П–ґ–µ—Б—В–Є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –Ю—Б–љ–Њ–≤–љ—Г—О —З–∞—Б—В—М —Б–Њ—Б—В–∞–≤–Є–ї–Є –њ–∞—Ж–Є–µ–љ—В—Л —Б –Є–љ—Д–Є–ї—М—В—А–∞—В–Є–≤–љ—Л–Љ вАУ 36 —З–µ–ї–Њ–≤–µ–Ї (60%) –Є —Д–Є–±—А–Њ–Ј–љ–Њ-–Ї–∞–≤–µ—А–љ–Њ–Ј–љ—Л–Љ —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ вАУ 18 —З–µ–ї–Њ–≤–µ–Ї (30%). –С—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л –Њ—В–і–µ–ї—М–љ—Л–µ —Б–ї—Г—З–∞–Є —Б –Ї–∞–Ј–µ–Њ–Ј–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є –Є –і–Є—Б—Б–µ–Љ–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ –ї–µ–≥–Ї–Є—Е. –†–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–ї—П –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М –њ—Г—В–µ–Љ –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –≥–µ–љ–µ—А–∞—Ж–Є–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –≥–µ–љ–µ—А–∞—В–Њ—А–∞ —Б–ї—Г—З–∞–є–љ—Л—Е —З–Є—Б–µ–ї.
–Т—Б–µ–≥–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –і–ї—П –Њ—Ж–µ–љ–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–Ї–ї—О—З–µ–љ–Є—П –Ї –Є–љ–і–Є–≤–Є–і—Г–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ—Г 4-–Љ—Г —А–µ–ґ–Є–Љ—Г –Я–Ґ–Ґ –њ—А–µ–њ–∞—А–∞—В–∞ –Ш–Ј–Њ–њ–∞—Б–Ї —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Є 60 –њ–∞—Ж–Є–µ–љ—В–Њ–≤: 39 (65%) –Љ—Г–ґ—З–Є–љ, 21 (35%) –ґ–µ–љ—Й–Є–љ. –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В —Б–Њ—Б—В–∞–≤–Є–ї 34 –≥–Њ–і–∞. –Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –њ—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ш–Ј–Њ–њ–∞—Б–Ї–∞ 31 –њ–∞—Ж–Є–µ–љ—В –≤ —В–µ—З–µ–љ–Є–µ 2-—Е –Љ–µ—Б—П—Ж–µ–≤ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –њ–Њ–ї—Г—З–∞–ї –Ш–Ј–Њ–њ–∞—Б–Ї –≤–љ—Г—В—А—М –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є, –Ј–∞–њ–Є–≤–∞—П –≤–Њ–і–Њ–є (150 –Љ–ї). –Ф–Њ–Ј–∞ –Ш–Ј–Њ–њ–∞—Б–Ї–∞ —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–∞—Б—М –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Љ–∞—Б—Б—Л —В–µ–ї–∞ –±–Њ–ї—М–љ–Њ–≥–Њ. –Я—А–Є –Љ–∞—Б—Б–µ —В–µ–ї–∞ 30 –Ї–≥ –љ–∞–Ј–љ–∞—З–∞–ї–Њ—Б—М 4 —В–∞–±–ї–µ—В–Ї–Є, 40 –Ї–≥ вАУ 6 —В–∞–±–ї–µ—В–Њ–Ї, 50 –Ї–≥ вАУ 8 —В–∞–±–ї–µ—В–Њ–Ї, 60 –Ї–≥ вАУ 10 —В–∞–±–ї–µ—В–Њ–Ї 2 —А./—Б—Г—В. –С–Њ–ї–µ–µ 10 —В–∞–±–ї–µ—В–Њ–Ї –љ–µ –љ–∞–Ј–љ–∞—З–∞–ї–Њ—Б—М. –У—А—Г–њ–њ–∞ —Б—А–∞–≤–љ–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–ї–∞ –Є–Ј 29 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –≤ —В–µ—З–µ–љ–Є–µ 2-—Е –Љ–µ—Б—П—Ж–µ–≤ –њ–Њ–ї—Г—З–∞–ї–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Ї 4-–Љ—Г —А–µ–ґ–Є–Љ—Г –Я–Ґ–Ґ –Я–Р–°–Ъ: —В–∞–±–ї–µ—В–Ї–Є –њ–Њ 1000 –Љ–≥, –њ–Њ–Ї—А—Л—В—Л–µ –Ї–Є—И–µ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є. –Я—А–Є –Љ–∞—Б—Б–µ —В–µ–ї–∞ 30 –Ї–≥ –љ–∞–Ј–љ–∞—З–∞–ї–Њ—Б—М 4 —В–∞–±–ї–µ—В–Ї–Є, 40 –Ї–≥ вАУ 6 —В–∞–±–ї–µ—В–Њ–Ї, 50 –Ї–≥ вАУ 8 —В–∞–±–ї–µ—В–Њ–Ї, 60 –Ї–≥ вАУ 10 —В–∞–±–ї–µ—В–Њ–Ї 2 —А./—Б—Г—В. –С–Њ–ї–µ–µ 10 —В–∞–±–ї–µ—В–Њ–Ї –љ–µ –љ–∞–Ј–љ–∞—З–∞–ї–Њ—Б—М.
–Ъ—А–Є—В–µ—А–Є—П–Љ–Є –≤–Ї–ї—О—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є: –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Т–Ш–І; –≤–Њ–Ј—А–∞—Б—В –Њ—В 18 –і–Њ 60 –ї–µ—В; –љ–∞–ї–Є—З–Є–µ –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П —Б –Ь–Ы–£ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ –њ—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ь–С–Ґ –Ї –Я–Р–°–Ъ. –Ъ—А–Є—В–µ—А–Є–Є –љ–µ–≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ: –љ–∞–ї–Є—З–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤ —Д–∞–Ј–µ –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є, –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –Я–Р–°–Ъ –Є–ї–Є –Є–Ј–Њ–љ–Є–∞–Ј–Є–і—Г. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —А–µ–Ј—Г–ї—М—В–∞—В –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –њ–Њ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—О –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П, –Ј–∞–Ї—А—Л—В–Є—О –њ–Њ–ї–Њ—Б—В–µ–є —А–∞—Б–њ–∞–і–∞, –∞ —В–∞–Ї–ґ–µ —З–∞—Б—В–Њ—В–µ –Є —В—П–ґ–µ—Б—В–Є –Э–ѓ –љ–∞ —Д–Њ–љ–µ —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –Я–Ґ–Я. –Я—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –і–ї—П –Њ—Ж–µ–љ–Ї–Є —А–µ–Ј—Г–ї—М—В–∞—В–∞ –±—Л–ї —Б—А–Њ–Ї 2 –Љ–µ—Б. –њ—А–Є–µ–Љ–∞ –Ш–Ј–Њ–њ–∞—Б–Ї–∞. –Ъ–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –і–ї—П –Њ—Ж–µ–љ–Ї–Є —А–µ–Ј—Г–ї—М—В–∞—В–∞ –±—Л–ї –≤—Л–±—А–∞–љ —Б—А–Њ–Ї 6 –Љ–µ—Б. –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–≥–Њ —Н—В–∞–њ–∞ —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є.
2. –Ґ–Є–Њ—Г—А–µ–Є–і–Њ–Є–Љ–Є–љ–Њ–Љ–µ—В–Є–ї–њ–Є—А–і–Є–љ–Є—П –њ–µ—А—Е–ї–Њ—А–∞—В (–Я–µ—А—Е–ї–Њ–Ј–Њ–љ¬Ѓ) вАУ –љ–Њ–≤—Л–є –њ—А–µ–њ–∞—А–∞—В, –≤—Л—А–∞–ґ–µ–љ–љ–Њ –Є–љ–≥–Є–±–Є—А—Г—О—Й–Є–є –ґ–Є–Ј–љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ь–С–Ґ, —Г—Б—В–Њ–є—З–Є–≤—Л—Е –Ї —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–Љ –њ—А–Њ—В–Є–≤–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ [2]. –Ю—Ж–µ–љ–Ї–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–≥–Њ –Ь–Ы–£ —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ –ї–µ–≥–Ї–Є—Е –±—Л–ї–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –≤ –Њ—В–Ї—А—Л—В–Њ–Љ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б 38 –Т–Ш–І-–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–Љ–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є. –Ь—Г–ґ—З–Є–љ –±—Л–ї–Њ 27 (71,1%), –ґ–µ–љ—Й–Є–љ вАУ 11 (28,9%). –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В —Б–Њ—Б—В–∞–≤–Є–ї 32,5 –≥–Њ–і–∞. –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–Є—В–µ–ї—П–Љ–Є —Б –Ь–Ы–£ –Ь–С–Ґ. –Ш–љ—Д–Є–ї—М—В—А–∞—В–Є–≤–љ—Л–є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј –Є–Љ–µ–ї –Љ–µ—Б—В–Њ —Г 28 (73,7%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Д–Є–±—А–Њ–Ј–љ–Њ-–Ї–∞–≤–µ—А–љ–Њ–Ј–љ—Л–є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј вАУ —Г 10 (26,3%). –°—А–µ–і–Є –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–µ–Њ–±–ї–∞–і–∞–ї–Є –±–Њ–ї—М–љ—Л–µ —Б —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–≥–Њ —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ —Б –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –і–µ—Б—В—А—Г–Ї—Ж–Є—П–Љ–Є —Б –Њ–і–љ–Њ- –Є –і–≤—Г—Б—В–Њ—А–Њ–љ–љ–Є–Љ –Њ–±—Б–µ–Љ–µ–љ–µ–љ–Є–µ–Љ. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л –Т–Ш–І-–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ –њ–∞—Ж–Є–µ–љ—В—Л –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 18 –і–Њ 65 –ї–µ—В —Б –Ь–Ы–£ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞. –Ъ –Ї—А–Є—В–µ—А–Є—П–Љ –љ–µ–≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –Њ—В–љ–µ—Б–µ–љ—Л —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ —Д–∞–Ј–µ –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є, –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ, –≤—Е–Њ–і—П—Й–Є–Љ –≤ —Б–Њ—Б—В–∞–≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞. –Я–∞—Ж–Є–µ–љ—В—Л, –Њ—В–≤–µ—З–∞–≤—И–Є–µ –Ї—А–Є—В–µ—А–Є—П–Љ –≤–Ї–ї—О—З–µ–љ–Є—П, –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –њ–Њ –њ—А–Є–љ—Ж–Є–њ—Г —Б–ї—Г—З–∞–є–љ—Л—Е —З–Є—Б–µ–ї. –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л, —А–∞–Ј–і–µ–ї–µ–љ–љ—Л–µ –љ–∞ 3 –≥—А—Г–њ–њ—Л, –±—Л–ї–Є –љ–∞ –Є–љ–і–Є–≤–Є–і—Г–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ 4-–є —А–µ–ґ–Є–Љ–µ –Я–Ґ–Ґ. –Т 2-—Е –Њ—Б–љ–Њ–≤–љ—Л—Е –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В—Л –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –њ–Њ–ї—Г—З–∞–ї–Є –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 3-—Е –Љ–µ—Б. –Я–µ—А—Е–ї–Њ–Ј–Њ–љ¬Ѓ –≤ —А–∞–Ј–љ—Л—Е –і–Њ–Ј–Є—А–Њ–≤–Ї–∞—Е: I –≥—А—Г–њ–њ–∞ –≤ –і–Њ–Ј–µ 9,5 –Љ–≥/–Ї–≥ (9 –њ–∞—Ж–Є–µ–љ—В–Њ–≤) –Є II –≥—А—Г–њ–њ–∞ вАУ –≤ –і–Њ–Ј–µ 12,5 –Љ–≥/–Ї–≥ (11 –њ–∞—Ж–Є–µ–љ—В–Њ–≤) 1 —А./—Б—Г—В –њ–Њ—Б–ї–µ –µ–і—Л. –Ґ—А–µ—В—М—П –≥—А—Г–њ–њ–∞ (–≥—А—Г–њ–њ–∞ —Б—А–∞–≤–љ–µ–љ–Є—П) –≤–Ї–ї—О—З–∞–ї–∞ 18 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є–љ–і–Є–≤–Є–і—Г–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Г—О 5-–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–љ—Г—О –Я–Ґ–Ґ –±–µ–Ј –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–∞.
–Я—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –і–ї—П –Њ—Ж–µ–љ–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –±—Л–ї —Б—А–Њ–Ї –Њ–Ї–Њ–љ—З–∞–љ–Є—П –њ—А–Є–µ–Љ–∞ –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–∞ вАУ 3 –Љ–µ—Б. –Ъ–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –і–ї—П –Њ—Ж–µ–љ–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –≤–Њ –≤—Б–µ—Е 3-—Е –≥—А—Г–њ–њ–∞—Е –±—Л–ї –Њ–њ—А–µ–і–µ–ї–µ–љ –Љ–Њ–Љ–µ–љ—В –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —Д–∞–Ј—Л –ї–µ—З–µ–љ–Є—П вАУ 6 –Љ–µ—Б.
3. –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –≤–Ї–ї—О—З–µ–љ–љ–Њ–≥–Њ –≤ —Б—Е–µ–Љ—Г 5-–≥–Њ —А–µ–ґ–Є–Љ–∞ –Я–Ґ–Ґ –С–µ–і–∞–Ї–≤–Є–ї–Є–љ–∞ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М 6-–Љ–µ—Б—П—З–љ–Њ–µ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –љ–µ—А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ 222 –Т–Ш–І-–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–Љ —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–Љ —И—В–∞–Љ–Љ–∞–Љ–Є –Ь–С–Ґ —Б –®–Ы–£, –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 24 –і–Њ 52 –ї–µ—В. –Ь—Г–ґ—З–Є–љ –±—Л–ї–Њ 63 (28,4%), –ґ–µ–љ—Й–Є–љ вАУ 159 (71,6%). –Т–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Њ 28 (12,6%), –њ—А–Њ—И–µ–і—И–Є—Е –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–є –Ї—Г—А—Б –ї–µ—З–µ–љ–Є—П вАУ 194 (87,4%). –Ф–∞–≤–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ –і–Њ –≥–Њ–і–∞ –Њ—В–Љ–µ—З–µ–љ–∞ —Г 28 (12,6%), 1вАУ3 –≥–Њ–і–∞ вАУ —Г 151 (68%), –±–Њ–ї–µ–µ 3-—Е –ї–µ—В вАУ —Г 43 (19,4%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –љ–∞ –Љ–Њ–Љ–µ–љ—В –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–Є—В–µ–ї—П–Љ–Є —Б –®–Ы–£ –Ь–С–Ґ, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–є –Љ–µ—В–Њ–і–Њ–Љ –њ–Њ—Б–µ–≤–∞, —Г 131 (59%) –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є–µ –±—Л–ї–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Њ —В–∞–Ї–ґ–µ –±–∞–Ї—В–µ—А–Є–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є. –Я–Њ–ї–Њ—Б—В–Є —А–∞—Б–њ–∞–і–∞ –≤ –ї–µ–≥–Њ—З–љ–Њ–є —В–Ї–∞–љ–Є –Є–Љ–µ–ї–Є—Б—М —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –і–≤—Г—Б—В–Њ—А–Њ–љ–љ–µ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ вАУ —Г 145 (65,6%). –Ю—Б–љ–Њ–≤–љ—Г—О –≥—А—Г–њ–њ—Г —Б–Њ—Б—В–∞–≤–Є–ї–Є 112 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ–љ—В—А–Њ–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г вАУ 110 –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –У—А—Г–њ–њ—Л –±—Л–ї–Є –Є–і–µ–љ—В–Є—З–љ—Л –њ–Њ –њ–Њ–ї—Г, –≤–Њ–Ј—А–∞—Б—В—Г, —Д–Њ—А–Љ–∞–Љ —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞, —Е–∞—А–∞–Ї—В–µ—А—Г –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П. –Ъ—Г—А—Б —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –≤–Ї–ї—О—З–∞–ї 4 –њ—А–µ–њ–∞—А–∞—В–∞ –њ–µ—А–≤–Њ–≥–Њ –Є –≤—В–Њ—А–Њ–≥–Њ —А—П–і–∞ —Б —Б–Њ—Е—А–∞–љ–µ–љ–љ–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П, –≤ –Ї–∞—З–µ—Б—В–≤–µ 5-–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –±—Л–ї –≤—Л–±—А–∞–љ –ї–Є–љ–µ–Ј–Њ–ї–Є–і, –Ї–Њ—В–Њ—А—Л–є –њ—А–Є–Љ–µ–љ—П–ї—Б—П –≤ –і–Њ–Ј–µ 600 –Љ–≥ –њ—А–Є –≤–µ—Б–µ 33вАУ70 –Ї–≥ –Є –≤ –і–Њ–Ј–µ 1200 –Љ–≥ –њ—А–Є –≤–µ—Б–µ –±–Њ–ї–µ–µ 70 –Ї–≥. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ, 6-–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤ —Б—Е–µ–Љ—Г —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –±—Л–ї –≤–Ї–ї—О—З–µ–љ –С–µ–і–∞–Ї–≤–Є–ї–Є–љ. –Т –њ–µ—А–≤—Л–µ 2 –љ–µ–і. –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є 400 –Љ–≥ –С–µ–і–∞–Ї–≤–Є–ї–Є–љ–∞ 1 —А./—Б—Г—В –≤–Њ –≤—А–µ–Љ—П –µ–і—Л, –≤ –і–∞–ї—М–љ–µ–є—И–Є–µ 22 –љ–µ–і. вАУ –њ–Њ 200 –Љ–≥ 3 —А./–љ–µ–і. –≠–Ъ–У –Є –њ–Њ–і—Б—З–µ—В Q–Ґ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –і–Њ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П –Є –µ–ґ–µ–Љ–µ—Б—П—З–љ–Њ. –Я–∞—Ж–Є–µ–љ—В—Л –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л –њ–Њ–ї—Г—З–∞–ї–Є 6-–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–љ—Г—О —Б—Е–µ–Љ—Г —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є —В–Њ–ї—М–Ї–Њ –Є–Ј –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–µ—А–≤–Њ–≥–Њ –Є –≤—В–Њ—А–Њ–≥–Њ —А—П–і–∞. –Ъ–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –і–ї—П –Њ—Ж–µ–љ–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –±—Л–ї –Њ–њ—А–µ–і–µ–ї–µ–љ —Б—А–Њ–Ї 6 –Љ–µ—Б. вАУ –Љ–Њ–Љ–µ–љ—В –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —Д–∞–Ј—Л –ї–µ—З–µ–љ–Є—П –њ–Њ –Ї—А–Є—В–µ—А–Є—О –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –њ–Њ—Б–µ–≤–∞ –Љ–Њ–Ї—А–Њ—В—Л, –Ј–∞–Ї—А—Л—В–Є—П –њ–Њ–ї–Њ—Б—В–µ–є —А–∞—Б–њ–∞–і–∞, —А–µ–≥—А–µ—Б—Б–Є–Є —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є.
4. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ –Њ—Ж–µ–љ–Ї–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –≤–Ї–ї—О—З–µ–љ–Є—П –≤ —Б—Е–µ–Љ—Л –Я–Ґ–Ґ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –≥–Є–і—А–Њ–Ї—Б–Є–Љ–µ—В–Є–ї—Е–Є–љ–Њ–Ї—Б–∞–ї–Є–љ–і–Є–Њ–Ї—Б–Є–і + –Є–Ј–Њ–љ–Є–∞–Ј–Є–і (–•–Є–Ї—Б–Њ–Ј–Є–і) –±—Л–ї–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–Њ –Ї–∞–Ї –Њ—В–Ї—А—Л—В–Њ–µ –љ–µ—А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ. –Я—А–µ–њ–∞—А–∞—В –≤ –≤–Є–і–µ –Є–љ–≥–∞–ї—П—Ж–Є–є –±—Л–ї –≤–Ї–ї—О—З–µ–љ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –≤ —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—О —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ –ї–µ–≥–Ї–Є—Е —Б –Ь–Ы–£/–®–Ы–£ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П, –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–≥–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ –Є –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ –і–µ—А–µ–≤–∞. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Є 46 –Т–Ш–І-–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤: 25 (54,3%) –Љ—Г–ґ—З–Є–љ, 21 –ґ–µ–љ—Й–Є–љ–∞ (45,7%). –Ш—Е —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В —Б–Њ—Б—В–∞–≤–Є–ї 38,5 –≥–Њ–і–∞. –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–Є—В–µ–ї—П–Љ–Є —Б –Ь–Ы–£/–®–Ы–£ –Ь–С–Ґ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Є–љ—Д–Є–ї—М—В—А–∞—В–Є–≤–љ—Л—Е –Є —Д–Є–±—А–Њ–Ј–љ–Њ-–Ї–∞–≤–µ—А–љ–Њ–Ј–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –ї–µ–≥–Ї–Є—Е –Є –∞–Ї—В–Є–≤–љ—Л—Е —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –Є–ї–Є –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –±—А–Њ–љ—Е–Њ–≤, –≤—Л—П–≤–ї–µ–љ–љ—Л—Е –њ—А–Є —Д–Є–±—А–Њ–±—А–Њ–љ—Е–Њ—Б–Ї–Њ–њ–Є–Є (–§–С–°). –Ъ—А–Є—В–µ—А–Є—П–Љ–Є –љ–µ–≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ —Д–∞–Ј–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є, –љ–∞–ї–Є—З–Є–µ –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї –Є–Ј–Њ–љ–Є–∞–Ј–Є–і—Г –Є –і–Є–Њ–Ї—Б–Є–і–Є–љ—Г. –У—А—Г–њ–њ—Л (–Њ—Б–љ–Њ–≤–љ–∞—П –Є –≥—А—Г–њ–њ–∞ —Б—А–∞–≤–љ–µ–љ–Є—П) –±—Л–ї–Є –Є–і–µ–љ—В–Є—З–љ—Л –њ–Њ –њ–Њ–ї—Г, –≤–Њ–Ј—А–∞—Б—В—Г, —Д–Њ—А–Љ–∞–Љ —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞, —Е–∞—А–∞–Ї—В–µ—А—Г –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П, —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ. –Ю—Б–љ–Њ–≤–љ–∞—П –≥—А—Г–њ–њ–∞ —Б–Њ—Б—В–Њ—П–ї–∞ –Є–Ј 24 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є –•–Є–Ї—Б–Њ–Ј–Є–і (–≥–Є–і—А–Њ–Ї—Б–Є–Љ–µ—В–Є–ї—Е–Є–љ–Њ–Ї—Б–∞–ї–Є–љ–і–Є–Њ–Ї—Б–Є–і 100 –Љ–≥ + –Є–Ј–Њ–љ–Є–∞–Ј–Є–і 250 –Љ–≥) –≤ –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–Њ–є —Д–Њ—А–Љ–µ, 1 –Є–љ–≥–∞–ї—П—Ж–Є—П –≤ –і–µ–љ—М, –Њ–±—Й–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –і–Њ–Ј вАУ 21, –љ–∞ —Д–Њ–љ–µ 5-–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–љ–Њ–є –Я–Ґ–Ґ –Є–Ј –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–µ—А–≤–Њ–≥–Њ –Є –≤—В–Њ—А–Њ–≥–Њ —А—П–і–∞. –У—А—Г–њ–њ–∞ —Б—А–∞–≤–љ–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–ї–∞ –Є–Ј 22 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е 5-–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–љ—Г—О –Я–Ґ–Ґ –Є–Ј –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–µ—А–≤–Њ–≥–Њ –Є –≤—В–Њ—А–Њ–≥–Њ —А—П–і–∞, –Є—Б–Ї–ї—О—З–∞—П –•–Є–Ї—Б–Њ–Ј–Є–і –≤ –Є–љ–≥–∞–ї—П—Ж–Є—П—Е. –Я—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –Ї–Њ–љ—В—А–Њ–ї—П —Б–ї—Г–ґ–Є–ї–∞ –і–∞—В–∞ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Ї—Г—А—Б–∞ –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –•–Є–Ї—Б–Њ–Ј–Є–і–Њ–Љ. –Ъ–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –і–ї—П –Њ—Ж–µ–љ–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –±—Л–ї –≤—Л–±—А–∞–љ —Б—А–Њ–Ї 6 –Љ–µ—Б. вАУ –Њ–Ї–Њ–љ—З–∞–љ–Є–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–≥–Њ —Н—В–∞–њ–∞ –±–∞–Ј–Њ–≤–Њ–є –њ—А–Њ—В–Є–≤–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є.
–Ю—Ж–µ–љ–Ї–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –•–Є–Ї—Б–Њ–Ј–Є–і–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –±—А–Њ–љ—Е–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –њ–Њ –і–Є–љ–∞–Љ–Є–Ї–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ, –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ (–Љ–∞—В–µ—А–Є–∞–ї —Й–Є–њ—Ж–Њ–≤–Њ–є –±–Є–Њ–њ—Б–Є–Є) –Є —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ (–Љ–∞—В–µ—А–Є–∞–ї –±—А–∞—И-–±–Є–Њ–њ—Б–Є–Є) –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –∞ —В–∞–Ї–ґ–µ –њ–Њ –Ї–ї–Є–љ–Є–Ї–Њ-—А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Є –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Ї—А–Є—В–µ—А–Є—П–Љ –≤ 2-—Е –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л—Е —В–Њ—З–Ї–∞—Е:
1) –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П 21-–і–љ–µ–≤–љ–Њ–є –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –•–Є–Ї—Б–Њ–Ј–Є–і–Њ–Љ;
2) –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П 6 –Љ–µ—Б. –±–∞–Ј–Њ–≤–Њ–є –њ—А–Њ—В–Є–≤–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є.
–Я—А–Є –§–С–° –і–Њ –љ–∞—З–∞–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –±—А–Њ–љ—Е–∞—Е: –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В —Б IвАУII —Б—В–µ–њ–µ–љ—М—О –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –±—Л–ї –≤—Л—П–≤–ї–µ–љ —Г 11 (45,8%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ —Б –•–Є–Ї—Б–Њ–Ј–Є–і–Њ–Љ –Є —Г 10 (45,6%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П; —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В —Б IвАУII —Б—В–µ–њ–µ–љ—М—О –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П вАУ —Г 12 (50%) –Є 12 (54,4%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ; III —Б—В–µ–њ–µ–љ—М —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –±—А–Њ–љ—Е–Є—В–∞ –≤—Л—П–≤–ї–µ–љ–∞ —Г 1 –њ–∞—Ж–Є–µ–љ—В–∞ –Є–Ј –≥—А—Г–њ–њ—Л —Б –•–Є–Ї—Б–Њ–Ј–Є–і–Њ–Љ. –°–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є —Е–∞—А–∞–Ї—В–µ—А –њ–Њ—А–∞–ґ–µ–љ–Є—П –±—А–Њ–љ—Е–Њ–≤ –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є —Г 8 (33,3%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б –•–Є–Ї—Б–Њ–Ј–Є–і–Њ–Љ –Є 6 (27,2%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П –≤ –≤–Є–і–µ –њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–≥–Њ —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ —Б—В–µ–љ–Ї–Є –±—А–Њ–љ—Е–∞ –≤ –∞–Ї—В–Є–≤–љ–Њ–є —Д–∞–Ј–µ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г 5 (20,8%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б –•–Є–Ї—Б–Њ–Ј–Є–і–Њ–Љ –Є 6 (27,2%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П –±—Л–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –≤ —Ж–Є—В–Њ–≥—А–∞–Љ–Љ–µ —Н–њ–Є—В–µ–ї–Є–Њ–Є–і–љ–Њ-–Ї–ї–µ—В–Њ—З–љ—Л–µ –≥—А–∞–љ—Г–ї–µ–Љ—Л, –Ї–∞–Ј–µ–Њ–Ј–љ—Л–є –љ–µ–Ї—А–Њ–Ј, –ї–Є–Љ—Д–Њ—Ж–Є—В–∞—А–љ–∞—П –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є—П, –Љ–∞–Ї—А–Њ—Д–∞–≥–Є. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –≤ –≤–Є–і–µ –Ї–∞—И–ї—П, –Њ–і—Л—И–Ї–Є –њ—А–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–µ –Є–Љ–µ–ї–Є –Љ–µ—Б—В–Њ —Г 21 (87,5%) –њ–∞—Ж–Є–µ–љ—В–∞ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –Є 19 (86,4%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П.
–Я–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Ї—Г—А—Б–∞ –Є–љ–≥–∞–ї—П—Ж–Є–є –•–Є–Ї—Б–Њ–Ј–Є–і–∞ (—З–µ—А–µ–Ј 21 –і–µ–љ—М –ї–µ—З–µ–љ–Є—П) –±—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ –Њ—Ж–µ–љ–Ї–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –±—А–Њ–љ—Е–Њ–≤ –Є –і–Є–љ–∞–Љ–Є–Ї–Є –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ. –Ю–±—Й–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В—М –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –њ–Њ –Ї—А–Є—В–µ—А–Є—П–Љ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П –Є –Ј–∞–Ї—А—Л—В–Є—П –њ–Њ–ї–Њ—Б—В–Є —А–∞—Б–њ–∞–і–∞ —З–µ—А–µ–Ј 6 –Љ–µ—Б. вАУ –љ–∞ –Љ–Њ–Љ–µ–љ—В –Њ–Ї–Њ–љ—З–∞–љ–Є—П –±–∞–Ј–Њ–≤–Њ–є –њ—А–Њ—В–Є–≤–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ –Љ–∞—В–µ—А–Є–∞–ї–∞ –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ–≥—А–∞–Љ–Љ–љ–Њ–≥–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П Statistica 9.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Ш–Ј–Њ–њ–∞—Б–Ї
–Э–ѓ –≤ –≥—А—Г–њ–њ–µ —Б –Ш–Ј–Њ–њ–∞—Б–Ї–Њ–Љ —Б–Њ—Б—В–∞–≤–Є–ї–Є 32,2%, –≤ –≥—А—Г–њ–њ–µ —Б –Я–Р–°–Ъ вАУ 62,1% (t=2,4285, p<0,005). –Э–ѓ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ –љ–∞–±–ї—О–і–µ–љ–Є—П, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –њ—А–Є–µ–Љ–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ш–Ј–Њ–њ–∞—Б–Ї/–Я–Р–°–Ъ, –њ—А–Њ—П–≤–ї—П–ї–Є—Б—М –≤ –≤–Є–і–µ –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є: —В–Њ—И–љ–Њ—В—Л, —Б–љ–Є–ґ–µ–љ–Є—П –∞–њ–њ–µ—В–Є—В–∞, —А–≤–Њ—В—Л –Є –і–Є–∞—А–µ–Є, –∞ —В–∞–Ї–ґ–µ —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е (–≥–Є–њ–Њ—В–Є—А–µ–Њ–Ј, —А–∞–Ј–≤–Є–≤—И–Є–є—Б—П –≤ –≥—А—Г–њ–њ–µ –љ–∞–±–ї—О–і–µ–љ–Є—П —Б –Я–Р–°–Ъ). –Т—Б–µ –Э–ѓ –±—Л–ї–Є I —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –њ–Њ CTCAE. –£ —А—П–і–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –≥–µ–њ–∞—В–Є—В–Њ–Љ –° –Њ—В–Љ–µ—З–µ–љ—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –љ–µ–Ј–љ–∞—З–Є–Љ—Л–µ –њ–Њ–≤—Л—И–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Р–Ы–Ґ, –Р–°–Ґ, –Ї–Њ—В–Њ—А—Л–µ –љ–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–ї–Є—Б—М –±–µ–Ј –Њ—В–Љ–µ–љ—Л –Я–Ґ–Я –љ–∞ —Д–Њ–љ–µ –≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є.–І–∞—Б—В–Њ—В–∞ —Г—Б—В—А–∞–љ–Є–Љ—Л—Е –Є –љ–µ—Г—Б—В—А–∞–љ–Є–Љ—Л—Е –Э–ѓ –љ–∞ —Д–Њ–љ–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –Ш–Ј–Њ–њ–∞—Б–Ї–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 1.
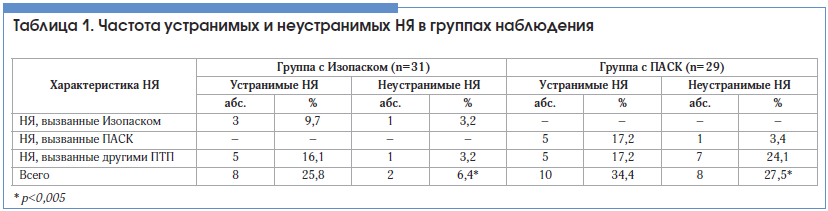
–Э–ѓ, –њ–Њ—В—А–µ–±–Њ–≤–∞–≤—И–Є–µ –Њ—В–Љ–µ–љ—Л –Я–Ґ–Я, –≤ –≥—А—Г–њ–њ–µ —Б –Ш–Ј–Њ–њ–∞—Б–Ї–Њ–Љ —Б–Њ—Б—В–∞–≤–Є–ї–Є 6,4%, –∞ –≤ –≥—А—Г–њ–њ–µ —Б –Я–Р–°–Ъ вАУ 27,5% (t=2,2483, p<0,005).
–Ю—Ж–µ–љ–Ї–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –≤ –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ–Њ–є —В–Њ—З–Ї–µ –љ–∞–±–ї—О–і–µ–љ–Є—П (—З–µ—А–µ–Ј 2 –Љ–µ—Б.). –Ш—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є –Њ—В–Љ–µ—З–µ–љ–Њ —Г 16 (57,1%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б –Ш–Ј–Њ–њ–∞—Б–Ї–Њ–Љ –Є —Г 12 (42,8%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б –Я–Р–°–Ъ. –Т –≥—А—Г–њ–њ–µ —Б –Ш–Ј–Њ–њ–∞—Б–Ї–Њ–Љ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–µ –Љ–µ—В–Њ–і–Њ–Љ –±–∞–Ї—В–µ—А–Є–Њ—Б–Ї–Њ–њ–Є–Є, –Ї 2-–Љ—Г –Љ–µ—Б—П—Ж—Г –ї–µ—З–µ–љ–Є—П –љ–∞—Б—В—Г–њ–Є–ї–Њ —Г 17 (73,9%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ –≥—А—Г–њ–њ–µ —Б –Я–Р–°–Ъ вАУ —Г 13 (50%). –Я—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–µ –Љ–µ—В–Њ–і–Њ–Љ –њ–Њ—Б–µ–≤–∞, –≤ –≥—А—Г–њ–њ–µ —Б –Ш–Ј–Њ–њ–∞—Б–Ї–Њ–Љ –Є–Љ–µ–ї–Њ –Љ–µ—Б—В–Њ —Г 20 (71,4%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ –≥—А—Г–њ–њ–µ —Б –Я–Р–°–ЪвАУ —Г 16 (57,1%).
–†–µ–≥—А–µ—Б—Б–Є—П –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–Є, –Њ—З–∞–≥–Њ–≤ –Њ–±—Б–µ–Љ–µ–љ–µ–љ–Є—П –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —Г 27 (96,4%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б –Ш–Ј–Њ–њ–∞—Б–Ї–Њ–Љ, –≤ –≥—А—Г–њ–њ–µ —Б –Я–Р–°–Ъ вАУ —Г 21 (75%) –њ–∞—Ж–Є–µ–љ—В–∞ (t=2,4022, p<0,05). –Ч–∞–Ї—А—Л—В–Є–µ –њ–Њ–ї–Њ—Б—В–Є —А–∞—Б–њ–∞–і–∞ –≤ –≥—А—Г–њ–њ–µ —Б –Ш–Ј–Њ–њ–∞—Б–Ї–Њ–Љ –і–Њ—Б—В–Є–≥–љ—Г—В–Њ —Г 5 (17,9%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –њ–Њ–ї–Њ—Б—В–µ–є —А–∞—Б–њ–∞–і–∞ —Г 23 (82,1%). –Ч–∞–Ї—А—Л—В–Є—П –њ–Њ–ї–Њ—Б—В–Є —А–∞—Б–њ–∞–і–∞ –≤ –≥—А—Г–њ–њ–µ —Б –Я–Р–°–Ъ –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –њ–Њ–ї–Њ—Б—В–µ–є —А–∞—Б–њ–∞–і–∞ –њ—А–Њ–Є–Ј–Њ—И–ї–Њ —Г 21 (75%) –њ–∞—Ж–Є–µ–љ—В–∞.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤ –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–µ –љ–∞–±–ї—О–і–µ–љ–Є—П. –Ч–∞–≤–µ—А—И–Є–ї–Є 6-–Љ–µ—Б—П—З–љ—Г—О –Є–љ—В–µ–љ—Б–Є–≤–љ—Г—О —Д–∞–Ј—Г —В–µ—А–∞–њ–Є–Є 26 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј –≥—А—Г–њ–њ—Л —Б –Ш–Ј–Њ–њ–∞—Б–Ї–Њ–Љ –Є 27 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј –≥—А—Г–њ–њ—Л —Б –Я–Р–°–Ъ. –Я—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–µ –≤—Б–µ–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є, –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г 22 (84,6%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б –Ш–Ј–Њ–њ–∞—Б–Ї–Њ–Љ –Є —Г 18 (66,6%) вАУ –≥—А—Г–њ–њ—Л —Б –Я–Р–°–Ъ (t=1,6037, p>0,05). –Ч–∞–Ї—А—Л—В–Є–µ –њ–Њ–ї–Њ—Б—В–µ–є —А–∞—Б–њ–∞–і–∞ –њ—А–Њ–Є–Ј–Њ—И–ї–Њ —Г 16 (61,5%) –Є 11 (40,7%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (t=1,5917, p>0,05).
–Я–µ—А—Е–ї–Њ–Ј–Њ–љ¬Ѓ
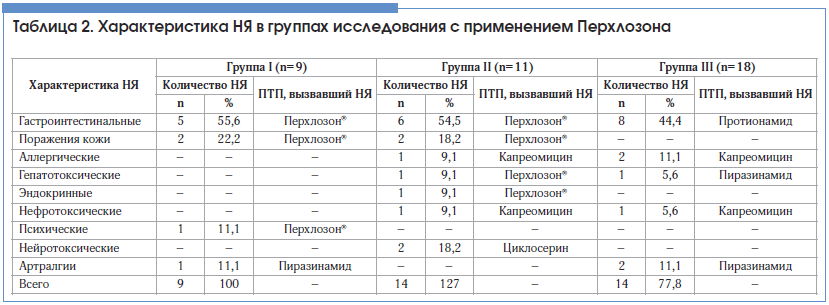
–Ч–∞–Ї–Њ–љ—З–Є–ї–Є –Ї—Г—А—Б –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О 3 –Љ–µ—Б. 29 –Є–Ј 38 –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я—А–Є—З–Є–љ–Њ–є –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–Њ–Љ —П–≤–Є–ї–Є—Б—М –Э–ѓ, –Ї–Њ—В–Њ—А—Л–µ –≤–Њ–Ј–љ–Є–Ї–∞–ї–Є –≤ –њ–µ—А–≤—Л–µ 2 –Љ–µ—Б. –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Э–ѓ –љ–Њ—Б–Є–ї–Є –Њ–±—А–∞—В–Є–Љ—Л–є —Е–∞—А–∞–Ї—В–µ—А. –•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –Э–ѓ –≤ –≥—А—Г–њ–њ–∞—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 2.–У–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л–µ –Э–ѓ –њ—А–µ–Њ–±–ї–∞–і–∞–ї–Є –≤ I –Є II –≥—А—Г–њ–њ–∞—Е: —В–Њ—И–љ–Њ—В–∞, —А–≤–Њ—В–∞, —Б–љ–Є–ґ–µ–љ–Є–µ –∞–њ–њ–µ—В–Є—В–∞, –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –≤–Ї—Г—Б–∞ –њ–Є—Й–Є –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —Г 11 (55%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ю—В–Љ–µ—З–∞–ї–Є—Б—М –Э–ѓ I —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є, –Њ–љ–Є –љ–µ —В—А–µ–±–Њ–≤–∞–ї–Є –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞, –њ—А–Њ—Е–Њ–і–Є–ї–Є —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –Є–ї–Є –љ–∞ —Д–Њ–љ–µ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є. –°–љ–Є–ґ–µ–љ–Є–µ –і–Њ–Ј—Л –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–∞ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М —Г –Њ–і–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ II –≥—А—Г–њ–њ—Л —Б 12,5 –Љ–≥/–Ї–≥ –і–Њ 9,5 –Љ–≥/–Ї–≥. –Т III (–Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є) –≥—А—Г–њ–њ–µ –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П I —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є —Б–Њ—Б—В–∞–≤–Є–ї–Є 44,4% (8 –њ–∞—Ж–Є–µ–љ—В–Њ–≤). –Ч–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –Э–ѓ –≤ 2-—Е –≥—А—Г–њ–њ–∞—Е –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ.
–Ъ–Њ–ґ–љ—Л–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П –≤ –≤–Є–і–µ —В—А–∞–љ–Ј–Є—В–Њ—А–љ–Њ–є —Б—Л–њ–Є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–≤—И–Є–µ—Б—П –ї–Є—Е–Њ—А–∞–і–Ї–Њ–є II —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є, –Є–Љ–µ–ї–Є –Љ–µ—Б—В–Њ —Г 4-—Е (20%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ I –Є II –≥—А—Г–њ–њ. –Т –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –њ–Њ–і–Њ–±–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є –љ–µ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М (t=2,2361, p<0,05). –Я–Њ—В—А–µ–±–Њ–≤–∞–ї–Є—Б—М –Њ—В–Љ–µ–љ–∞ –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–∞ –Є –і–Њ—Б—А–Њ—З–љ–Њ–µ –Ј–∞–≤–µ—А—И–µ–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г 3-—Е –±–Њ–ї—М–љ—Л—Е. –Ъ–Њ–ґ–љ—Л–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П —А–µ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–ї–Є –љ–∞ —Д–Њ–љ–µ –і–µ—Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–Є—А—Г—О—Й–Є—Е —Б—А–µ–і—Б—В–≤. –£ 1 –±–Њ–ї—М–љ–Њ–≥–Њ II –≥—А—Г–њ–њ—Л (–љ–∞ –і–Њ–Ј–µ –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–∞ 12,5 –Љ–≥/–Ї–≥) –≤–Њ–Ј–љ–Є–Ї–ї–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ –Ї–Њ—А–Њ—В–Ї–Њ–Љ –Ї—Г—А—Б–µ –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞.
–≠–љ–і–Њ–Ї—А–Є–љ–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —Г 1 –њ–∞—Ж–Є–µ–љ—В–∞ II –≥—А—Г–њ–њ—Л (–љ–∞ –і–Њ–Ј–µ –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–∞ 12,5 –Љ–≥/–Ї–≥) –≤ –≤–Є–і–µ –њ–Њ–і–Њ—Б—В—А–Њ–≥–Њ —В–Є—А–µ–Њ–Є–і–Є—В–∞ III —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є, —А–∞–Ј–≤–Є–≤—И–µ–≥–Њ—Б—П –Ї 8-–є –љ–µ–і–µ–ї–µ –њ—А–Є–µ–Љ–∞ –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–∞, –њ—А–Њ—П–≤–ї—П–≤—И–µ–≥–Њ—Б—П –ї–Є—Е–Њ—А–∞–і–Ї–Њ–є –≤ —В–µ—З–µ–љ–Є–µ 7 –і–љ–µ–є, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л II —Б—В–µ–њ–µ–љ–Є –љ–∞ —Д–Њ–љ–µ —Н—Г—В–Є—А–µ–Њ–Ј–∞. –Ф–∞–љ–љ–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –±—Л–ї–Њ —А–∞—Б—Ж–µ–љ–µ–љ–Њ –Ї–∞–Ї —Б–µ—А—М–µ–Ј–љ–Њ–µ –Э–ѓ, –Є –Я–µ—А—Е–ї–Њ–Ј–Њ–љ¬Ѓ –±—Л–ї –Њ—В–Љ–µ–љ–µ–љ. –Э–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–Њ–Љ 30 –Љ–≥/—Б—Г—В (60 –і–љ–µ–є —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –і–Њ–Ј—Л –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞ —З–µ—А–µ–Ј 30 –і–љ–µ–є) –Э–ѓ —А–∞–Ј—А–µ—И–Є–ї–Њ—Б—М –±–µ–Ј –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є. –Т –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ.
–У–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ –Э–ѓ –њ—А–Њ—П–≤–Є–ї–Є—Б—М –≤ –≤–Є–і–µ —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–њ–∞—В–Є—В–∞ II —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є —Г –Њ–і–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ II –≥—А—Г–њ–њ—Л: —Б–љ–Є–ґ–µ–љ–∞ –і–Њ–Ј–∞ –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–∞ —Б 12,5 –Љ–≥/–Ї–≥ –і–Њ 9,5 –Љ–≥/–Ї–≥, –њ—А–Њ–≤–µ–і–µ–љ–∞ –і–µ–Ј–Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Њ–љ–љ–∞—П –Є –≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ–∞—П —В–µ—А–∞–њ–Є—П. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –њ–Њ—Б–ї–µ 3-x –љ–µ–і–µ–ї—М —В–µ—А–∞–њ–Є–Є –љ–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–ї–Є—Б—М.
–Я—Б–Є—Е–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П II —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є —Б–Њ –Ј—А–Є—В–µ–ї—М–љ—Л–Љ–Є –≥–∞–ї–ї—О—Ж–Є–љ–∞—Ж–Є—П–Љ–Є —З–µ—А–µ–Ј 1 –љ–µ–і. –њ—А–Є–µ–Љ–∞ –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–∞ —А–∞–Ј–≤–Є–ї–Є—Б—М —Г 1 –њ–∞—Ж–Є–µ–љ—В–Ї–Є –Є –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Є –њ–Њ–ї–љ–Њ–є –Њ—В–Љ–µ–љ—Л –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–∞.
–Э–µ–Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –Э–ѓ –Є –і—А—Г–≥–Є–µ –Я–Ґ–Я —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–Є I —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є. –°–Њ—З–µ—В–∞–љ–Є–µ 2-—Е –Є –±–Њ–ї–µ–µ –Э–ѓ –Є–Љ–µ–ї–Њ –Љ–µ—Б—В–Њ —Г 6 (30%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ I –Є II –≥—А—Г–њ–њ –Є —Г 1 (5,5%) –њ–∞—Ж–Є–µ–љ—В–∞ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л (t=2,1175, p<0,05). –°–Њ—З–µ—В–∞–ї–Є—Б—М –љ–∞—А—Г—И–µ–љ–Є—П —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ, –њ–µ—З–µ–љ–Є, —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є –Ї–Њ–ґ–Є.
–Ч–∞–Ї–Њ–љ—З–Є–ї–Є –Ї—Г—А—Б –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О 6 –Љ–µ—Б. 29 –Є–Ј 38 –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ф–µ–≤—П—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–µ–Ї—А–∞—В–Є–ї–Є –Ї—Г—А—Б –ї–µ—З–µ–љ–Є—П –њ–Њ –њ—А–Є—З–Є–љ–µ: –љ–∞—А—Г—И–µ–љ–Є—П –њ—А–Њ—В–Њ–Ї–Њ–ї–∞ вАУ 1 –њ–∞—Ж–Є–µ–љ—В; –Э–ѓ вАУ 5 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ I –Є II –≥—А—Г–њ–њ; —Г 3-—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П –≤—Л—П–≤–ї–µ–љ–Њ –љ–∞—А—Г—И–µ–љ–Є–µ –њ—А–Њ—В–Њ–Ї–Њ–ї–∞.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї—Г—О —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В—М –≤ –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ–Њ–є —В–Њ—З–Ї–µ –љ–∞–±–ї—О–і–µ–љ–Є—П –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –њ–Њ—Б–ї–µ 3-—Е –Љ–µ—Б—П—Ж–µ–≤ —В–µ—А–∞–њ–Є–Є –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–Њ–Љ: –ї–Њ–Ї–∞–ї—М–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ –Є —Б–Є–Љ–њ—В–Њ–Љ—Л –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є –≤ I –Є II –≥—А—Г–њ–њ–∞—Е —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–∞ –Є—Б—З–µ–Ј–ї–Є —Г 11 –Є–Ј 14 (78,6%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ III (–Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є) –≥—А—Г–њ–њ–µ вАУ —Г 5 –Є–Ј 15 (33,3%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –†–∞–Ј–ї–Є—З–Є—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –≤ –≥—А—Г–њ–њ–∞—Е —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л (t=2,7578, p<0,01). –Я—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–µ –Љ–µ—В–Њ–і–Њ–Љ –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є, –љ–∞—Б—В—Г–њ–Є–ї–Њ —Г 12 –Є–Ј 14 (85,7%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ I –Є II –≥—А—Г–њ–њ, –≤ III –≥—А—Г–њ–њ–µ вАУ —Г 5 –Є–Ј 15 (33,3%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (t=3,4138, p<0,001). –Я—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–µ –Љ–µ—В–Њ–і–Њ–Љ –њ–Њ—Б–µ–≤–∞, –љ–∞—Б—В—Г–њ–Є–ї–Њ —Г 11 –Є–Ј 14 (78,6%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ I –Є II –≥—А—Г–њ–њ, –≤ III –≥—А—Г–њ–њ–µ вАУ —Г 4 –Є–Ј 15 (26,7%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (t=3,2784, p<0,01). –Ч–∞–Ї—А—Л—В–Є–µ –њ–Њ–ї–Њ—Б—В–µ–є —А–∞—Б–њ–∞–і–∞ –љ–∞—Б—В—Г–њ–Є–ї–Њ —Г 5 –Є–Ј 14 (35,7%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ I –Є II –≥—А—Г–њ–њ, –≤ III –≥—А—Г–њ–њ–µ –њ–Њ–ї–Њ—Б—В–Є —А–∞—Б–њ–∞–і–∞ —Б–Њ—Е—А–∞–љ—П–ї–Є—Б—М –Є –Ї 90-–Љ—Г –і–љ—О —В–µ—А–∞–њ–Є–Є.
–Т –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–µ –Њ—Ж–µ–љ–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є вАУ –њ–Њ—Б–ї–µ 6 –Љ–µ—Б. –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —Д–∞–Ј—Л —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –њ—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–µ –Љ–µ—В–Њ–і–Њ–Љ –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є, –љ–∞—Б—В—Г–њ–Є–ї–Њ —Г 13 –Є–Ј 14 (92,9%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ I –Є II –≥—А—Г–њ–њ, –≤ III –≥—А—Г–њ–њ–µ вАУ —Г 9 –Є–Ј 15 (60%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (t=2,2861, p<0,05). –Я—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–µ –Љ–µ—В–Њ–і–Њ–Љ –њ–Њ—Б–µ–≤–∞, –љ–∞—Б—В—Г–њ–Є–ї–Њ —Г 12 –Є–Ј 14 (85,7%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ I –Є II –≥—А—Г–њ–њ, –≤ III –≥—А—Г–њ–њ–µ вАУ —Г 9 –Є–Ј 15 (60%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ч–∞–Ї—А—Л—В–Є–µ –њ–Њ–ї–Њ—Б—В–µ–є —А–∞—Б–њ–∞–і–∞ –љ–∞—Б—В—Г–њ–Є–ї–Њ —Г 10 –Є–Ј 14 (71,4%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ I –Є II –≥—А—Г–њ–њ, –≤ III –≥—А—Г–њ–њ–µ вАУ —Г 8 –Є–Ј 15 (53,3%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (t=5,2712, p<0,001).
–С–µ–і–∞–Ї–≤–Є–ї–Є–љ
–Я–Њ–ї–љ–Њ—Б—В—М—О 24-–љ–µ–і–µ–ї—М–љ—Л–є –Ї—Г—А—Б –Ј–∞–≤–µ—А—И–Є–ї–Є 110 (98,2%) —З–µ–ї–Њ–≤–µ–Ї –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –Є 107 (97,2%) вАУ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л (t=0,3448, p>0,05). –Я—А–Є—З–Є–љ–Њ–є –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є —Г 2вАУ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –њ–Њ—Б–ї—Г–ґ–Є–ї–Є –Э–ѓ III —Б—В–µ–њ–µ–љ–Є. –Ю—В–Љ–µ—З–∞–ї–Њ—Б—М —Г–і–ї–Є–љ–µ–љ–Є–µ –Є–љ—В–µ—А–≤–∞–ї–∞ QT –і–Њ 520 –Љ—Б –Ї 2-–Љ—Г –Љ–µ—Б—П—Ж—Г —В–µ—А–∞–њ–Є–Є, —Б–≤—П–Ј–∞–љ–љ–Њ–µ —Б –њ—А–Є–µ–Љ–Њ–Љ –С–µ–і–∞–Ї–≤–Є–ї–Є–љ–∞, —А–∞—Б—Ж–µ–љ–µ–љ–љ–Њ–µ –Ї–∞–Ї —Б–µ—А—М–µ–Ј–љ–∞—П —Г–≥—А–Њ–Ј–∞ –ґ–Є–Ј–љ–Є, –С–µ–і–∞–Ї–≤–Є–ї–Є–љ –±—Л–ї –Њ—В–Љ–µ–љ–µ–љ. –І–µ—А–µ–Ј 2 –љ–µ–і. –њ–Њ—Б–ї–µ –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞ –Є–љ—В–µ—А–≤–∞–ї QT –љ–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–ї—Б—П. –£ 3-—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П –њ—А–Є—З–Є–љ–Њ–є –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є —П–≤–Є–ї–Њ—Б—М –љ–∞—А—Г—И–µ–љ–Є–µ –њ—А–Њ—В–Њ–Ї–Њ–ї–∞.–Ф—А—Г–≥–Є–µ –Э–ѓ I –Є II —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є (—Б–ї–∞–±–Њ–є –Є —Г–Љ–µ—А–µ–љ–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –њ–Њ CTCAE) –±—Л–ї–Є –Њ—В–Љ–µ—З–µ–љ—Л —Г 64 (57,4%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –Є —Г 69 (62,7%) вАУ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л (p>0,05). –°—А–µ–і–Є –Э–ѓ –њ—А–µ–Њ–±–ї–∞–і–∞–ї–Є –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л–µ вАУ 44,4%, –љ–µ–є—А–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ вАУ 23,8%, –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ вАУ 19,0%, –∞—А—В—А–∞–ї–≥–Є—З–µ—Б–Ї–Є–µ вАУ 7,9%, –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–µ вАУ 4,8%. –Т—Б–µ –Њ–љ–Є –±—Л–ї–Є —Б–ї–∞–±–Њ–є –Є–ї–Є —Г–Љ–µ—А–µ–љ–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –њ–Њ CTCAE –Є –љ–µ —Б–≤—П–Ј–∞–љ—Л —Б –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ.
–С–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є–µ, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–µ –Љ–µ—В–Њ–і–Њ–Љ –њ–Њ—Б–µ–≤–∞, –њ—А–µ–Ї—А–∞—В–Є–ї–Њ—Б—М –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ —Г 59,8%, –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є вАУ —Г 36,6% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (t=1,9733, p<0,05), –Ј–∞–Ї—А—Л—В–Є–µ –њ–Њ–ї–Њ—Б—В–Є –і–µ—Б—В—А—Г–Ї—Ж–Є–Є –Њ—В–Љ–µ—З–µ–љ–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ —Г 23,9% –Є 15,4% (t=1,1184, p>0,05), –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–∞ вАУ —Г 15,2% –Є 28,2% (t=1,9883, p<0,05).
–•–Є–Ї—Б–Њ–Ј–Є–і
–Ю—Ж–µ–љ–Ї–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –≤ –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ–Њ–є —В–Њ—З–Ї–µ –љ–∞–±–ї—О–і–µ–љ–Є—П. –Ъ—Г—А—Б –ї–µ—З–µ–љ–Є—П —Б –Є–љ–≥–∞–ї—П—Ж–Є—П–Љ–Є –•–Є–Ї—Б–Њ–Ј–Є–і–∞ –Ј–∞–Ї–Њ–љ—З–Є–ї–Є –≤—Б–µ 24 –њ–∞—Ж–Є–µ–љ—В–∞. –Э–ѓ I —Б—В–µ–њ–µ–љ–Є –њ–Њ CTCAE –љ–∞ —Д–Њ–љ–µ –Є–љ–≥–∞–ї—П—Ж–Є–є –•–Є–Ї—Б–Њ–Ј–Є–і–∞ –≤ –≤–Є–і–µ —Б—Г—Е–Њ–≥–Њ –Ї–∞—И–ї—П –Њ—В–Љ–µ—З–µ–љ—Л —Г 4-—Е (16,6%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –ї–µ—З–µ–љ–Є–µ –љ–µ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М. –Я—А–Є–Ј–љ–∞–Ї–Њ–≤ —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –•–Є–Ї—Б–Њ–Ј–Є–і–∞ –њ—А–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л—Е –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е (–Њ–±—Й–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є, –Њ–±—Й–Є–є –∞–љ–∞–ї–Є–Ј –Љ–Њ—З–Є, –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –∞–љ–∞–ї–Є–Ј—Л) –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ. –Ш—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ –Ї–∞—И–ї—П –њ–Њ—Б–ї–µ –Ї—Г—А—Б–∞ –Є–љ–≥–∞–ї—П—Ж–Є–є –•–Є–Ї—Б–Њ–Ј–Є–і–∞ –Њ—В–Љ–µ—З–µ–љ–Њ —Г 7 (33,3%) –Є–Ј 21 –њ–∞—Ж–Є–µ–љ—В–∞, —Б–љ–Є–ґ–µ–љ–Є–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –Ї–∞—И–ї—П вАУ —Г 14 (66,7%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П (–±–µ–Ј –Є–љ–≥–∞–ї—П—Ж–Є–є –•–Є–Ї—Б–Њ–Ј–Є–і–∞) –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –≤ –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ–Њ–є —В–Њ—З–Ї–µ –љ–∞–±–ї—О–і–µ–љ–Є—П, –∞ —Б–љ–Є–ґ–µ–љ–Є–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –Ї–∞—И–ї—П –Њ—В–Љ–µ—З–µ–љ–Њ —Г 5 (22,7%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ш–Ј–Љ–µ–љ–µ–љ–Є—П —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л —Г –±–Њ–ї—М–љ—Л—Е —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ –ї–µ–≥–Ї–Є—Е –і–Њ –Є –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –•–Є–Ї—Б–Њ–Ј–Є–і–Њ–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 3. –†–µ–≥—А–µ—Б—Б–Є—П –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В–∞ IвАУII —Б—В–µ–њ–µ–љ–Є –њ–Њ—Б–ї–µ –Є–љ–≥–∞–ї—П—Ж–Є–є –•–Є–Ї—Б–Њ–Ј–Є–і–∞ –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –§–С–° –њ–Њ—Б–ї–µ –Ј–∞–≤–µ—А—И–µ–љ–Є—П –Є–љ–≥–∞–ї—П—Ж–Є–є –љ–∞—Б—В—Г–њ–Є–ї–∞ —Г –≤—Б–µ—Е 11 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (100%).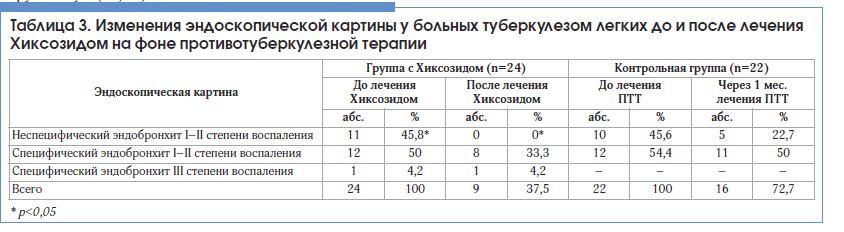
–°–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В IвАУII —Б—В–µ–њ–µ–љ–Є –≤–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е –Њ—Б–ї–Њ–ґ–љ–Є–ї—Б—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ —Б—В–µ–љ–Њ–Ј–Њ–Љ –±—А–Њ–љ—Е–∞. –£ 8 –Є–Ј 12 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ—Б–ї–µ –Є–љ–≥–∞–ї—П—Ж–Є–є –•–Є–Ї—Б–Њ–Ј–Є–і–∞ —Б–Њ—Е—А–∞–љ–Є–ї–∞—Б—М I —Б—В–µ–њ–µ–љ—М —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В–∞ —Б–Њ —Б—В–µ–љ–Њ–Ј–Њ–Љ I —Б—В–µ–њ–µ–љ–Є. –£ 4-—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–Љ–µ—З–µ–љ–∞ –њ–Њ–ї–љ–∞—П —А–µ–≥—А–µ—Б—Б–Є—П —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В–∞. –£ 1 –њ–∞—Ж–Є–µ–љ—В–∞ —Б–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В–Њ–Љ III —Б—В–µ–њ–µ–љ–Є –Є —Б—В–µ–љ–Њ–Ј–Њ–Љ III —Б—В–µ–њ–µ–љ–Є –љ–∞—Б—В—Г–њ–Є–ї–∞ —З–∞—Б—В–Є—З–љ–∞—П —А–µ–≥—А–µ—Б—Б–Є—П –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–Є, –Њ—В–µ–Ї–∞ –Є —Б—В–µ–љ–Њ–Ј–∞ –і–Њ II —Б—В–µ–њ–µ–љ–Є. –Т –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П —Г 16 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є–љ–≥–∞–ї—П—Ж–Є–Є –•–Є–Ї—Б–Њ–Ј–Є–і–∞, –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –њ—А–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –§–С–° –≤ –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ–Њ–є —В–Њ—З–Ї–µ –Ї–Њ–љ—В—А–Њ–ї—П –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ. –Я–Њ–ї–љ–∞—П —А–µ–≥—А–µ—Б—Б–Є—П —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В–∞ (—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ) –≤ –≥—А—Г–њ–њ–µ —Б –•–Є–Ї—Б–Њ–Ј–Є–і–Њ–Љ –љ–∞—Б—В—Г–њ–Є–ї–∞ —Г 15 (62,5%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П вАУ —Г 6 (27,3%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (t=2,5681, p<0,05).
–Я—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–µ –Љ–µ—В–Њ–і–Њ–Љ –ї—О–Љ–Є–љ–µ—Б—Ж–µ–љ—В–љ–Њ–є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є, –љ–∞—Б—В—Г–њ–Є–ї–Њ —Г 18 (75%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л —Г–ґ–µ –љ–∞ –Љ–Њ–Љ–µ–љ—В –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Є–љ–≥–∞–ї—П—Ж–Є–є –•–Є–Ї—Б–Њ–Ј–Є–і–∞ (–љ–∞ 21-–є –і–µ–љ—М), –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ вАУ —Г 5 (22,7%).
–†–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П –њ–Њ –Ї—А–Є—В–µ—А–Є—О –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П –Є –Ј–∞–Ї—А—Л—В–Є—П –њ–Њ–ї–Њ—Б—В–Є —А–∞—Б–њ–∞–і–∞ —З–µ—А–µ–Ј 6 –Љ–µ—Б. –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —Д–∞–Ј—Л (–≤ –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–µ –Ї–Њ–љ—В—А–Њ–ї—П) —Б–ї–µ–і—Г—О—Й–Є–µ: –њ—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–µ –Љ–µ—В–Њ–і–Њ–Љ –±–∞–Ї—В–µ—А–Є–Њ—Б–Ї–Њ–њ–Є–Є –Є –њ–Њ—Б–µ–≤–∞, –≤ –≥—А—Г–њ–њ–µ —Б –•–Є–Ї—Б–Њ–Ј–Є–і–Њ–Љ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 83,3% (20 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј 24), –Ј–∞–Ї—А—Л—В–Є–µ –њ–Њ–ї–Њ—Б—В–Є —А–∞—Б–њ–∞–і–∞ вАУ 75% (18 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј 20). –Т –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П –њ–Њ—Б–ї–µ 6 –Љ–µ—Б. –Я–Ґ–Ґ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–µ –Љ–µ—В–Њ–і–∞–Љ–Є –±–∞–Ї—В–µ—А–Є–Њ—Б–Ї–Њ–њ–Є–Є –Є –њ–Њ—Б–µ–≤–∞, —Б–Њ—Б—В–∞–≤–Є–ї–Њ 77,3% (17 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј 22), –Ј–∞–Ї—А—Л—В–Є–µ –њ–Њ–ї–Њ—Б—В–Є —А–∞—Б–њ–∞–і–∞ вАУ 68,2% (15 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј 20). –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –≤ –≥—А—Г–њ–њ–∞—Е –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Ґ—А—Г–і–љ–Њ—Б—В–Є –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е —А–µ–ґ–Є–Љ–Њ–≤ —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –њ—А–Є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–µ —Б –Ь–Ы–£/–®–Ы–£ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –і–µ–ї–∞—О—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ –Є–Ј—Г—З–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –љ–Њ–≤—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ї–µ—З–µ–љ–Є—П —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞. –Я—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ –љ–∞–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –≤–Ї–ї—О—З–µ–љ–Є—П –љ–Њ–≤—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ —Б –Ь–Ы–£/–®–Ы–£ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –і–Њ–њ–Њ–ї–љ–Є—В—М —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–µ —Б—Е–µ–Љ—Л —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є. –Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –Ш–Ј–Њ–њ–∞—Б–Ї —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ—А–Є —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Я–Р–°–Ъ. –Э–∞–Є–±–Њ–ї–µ–µ —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –≤–Ї–ї—О—З–µ–љ–Є–µ –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–∞ –≤ —Б–Є—В—Г–∞—Ж–Є–Є, –Ї–Њ–≥–і–∞ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –±–∞–Ј–Њ–≤–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞ –Є–Ј 6 –њ—А–Њ—В–Є–≤–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ. –Т–Ї–ї—О—З–µ–љ–Є–µ –≤ 5-–є —А–µ–ґ–Є–Љ –С–µ–і–∞–Ї–≤–Є–ї–Є–љ–∞ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Њ –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Є–љ–≥–∞–ї—П—Ж–Є–є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –•–Є–Ї—Б–Њ–Ј–Є–і –Њ–±–µ—Б–њ–µ—З–Є–ї–Њ –њ–Њ–ї–љ—Г—О —А–µ–≥—А–µ—Б—Б–Є—О –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В–∞. –Я—А–µ–Њ–±–ї–∞–і–∞–ї–∞ —Б–ї–∞–±–∞—П –Є–ї–Є —Г–Љ–µ—А–µ–љ–љ–∞—П —Б—В–µ–њ–µ–љ—М –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Э–ѓ –њ—А–Є –њ—А–Є–µ–Љ–µ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, III —Б—В–µ–њ–µ–љ—М –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –≤ –µ–і–Є–љ–Є—З–љ—Л—Е —Б–ї—Г—З–∞—П—Е (—В–∞–±–ї. 4).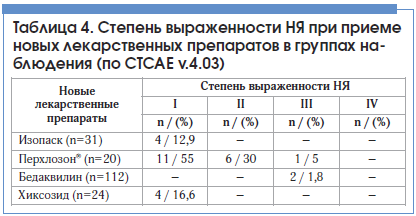
–Т—Л–≤–Њ–і—Л :
1. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–Є —Б—В–∞–љ–і–∞—А—В–љ–Њ–Љ 4-–Љ —А–µ–ґ–Є–Љ–µ –Я–Ґ–Ґ –Ш–Ј–Њ–њ–∞—Б–Ї–∞ –±–Њ–ї–µ–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ, —З–µ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Я–Р–°–Ъ. –Э–ѓ –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Ш–Ј–Њ–њ–∞—Б–Ї, –±—Л–ї–Є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ—Л –≤ 32,2% —Б–ї—Г—З–∞–µ–≤, –≤ –≥—А—Г–њ–њ–µ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Я–Р–°–Ъ вАУ –≤ 62,1% (p<0,005). –Ф–Њ–ї—П –Э–ѓ, –њ–Њ—В—А–µ–±–Њ–≤–∞–≤—И–Є—Е –Њ—В–Љ–µ–љ—Л –Я–Ґ–Я, –≤ –≥—А—Г–њ–њ–µ —Б –Ш–Ј–Њ–њ–∞—Б–Ї–Њ–Љ вАУ 6,4%, –≤ –≥—А—Г–њ–њ–µ —Б –Я–Р–°–Ъ вАУ 27,5% (p<0,005).2. –Ы–µ—З–µ–љ–Є–µ –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–Њ–Љ –љ–∞ —Д–Њ–љ–µ 4-–≥–Њ —А–µ–ґ–Є–Љ–∞ –Я–Ґ–Ґ –Њ–±–µ—Б–њ–µ—З–Є–ї–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ —Ж–µ–ї–µ–≤–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞ —Г–ґ–µ –≤ –њ–µ—А–≤—Л–µ 90 –і–љ–µ–є –ї–µ—З–µ–љ–Є—П. –Ю–і–љ–∞–Ї–Њ —Г—А–Њ–≤–µ–љ—М —Б–Њ—З–µ—В–∞–љ–љ—Л—Е (2-—Е –Є –±–Њ–ї–µ–µ) –Э–ѓ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Я–µ—А—Е–ї–Њ–Ј–Њ–љ–Њ–Љ –±—Л–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–∞–Ї–Њ–≤—Л–Љ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ вАУ 30% –Є 5,5% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (p<0,05).
3. –Т–Ї–ї—О—З–µ–љ–Є–µ –С–µ–і–∞–Ї–≤–Є–ї–Є–љ–∞ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Г—О —В–µ—А–∞–њ–Є—О —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ —Б –®–Ы–£ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –љ–∞ —Д–Њ–љ–µ 4-—Е –Я–Ґ–Я –њ–µ—А–≤–Њ–≥–Њ –Є –≤—В–Њ—А–Њ–≥–Њ —А—П–і–∞, –Ї –Ї–Њ—В–Њ—А—Л–Љ —Б–Њ—Е—А–∞–љ–µ–љ–∞ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ь–С–Ґ, –Є –ї–Є–љ–µ–Ј–Њ–ї–Є–і–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ–±–Є—В—М—Б—П –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –±–∞–Ї—В–µ—А–Є–Њ–≤—Л–і–µ–ї–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–Њ–Љ –њ–Њ—Б–µ–≤–∞, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ —Г 59,8% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П вАУ —Г 36,6% (p<0,05).
4. –Ш–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –•–Є–Ї—Б–Њ–Ј–Є–і –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Ї 4-–Љ—Г –Є–ї–Є 5-–Љ—Г —А–µ–ґ–Є–Љ–∞–Љ –Я–Ґ–Ґ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ –њ—А–Є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–Є –±—А–Њ–љ—Е–Њ–≤ –Є –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В–∞—Е —Г –±–Њ–ї—М–љ—Л—Е —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ –Њ—А–≥–∞–љ–Њ–≤ –і—Л—Е–∞–љ–Є—П. –Я–Њ–ї–љ–∞—П —А–µ–≥—А–µ—Б—Б–Є—П —Н–љ–і–Њ–±—А–Њ–љ—Е–Є—В–∞ –љ–∞ –Љ–Њ–Љ–µ–љ—В –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Ї—Г—А—Б–∞ (21 –і–µ–љ—М) –Є–љ–≥–∞–ї—П—Ж–Є–є –•–Є–Ї—Б–Њ–Ј–Є–і–Њ–Љ –љ–∞—Б—В—Г–њ–Є–ї–∞ —Г 62,5% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ вАУ —Г 27,3% (p<0,05).












