В то же время столь широкое применение макролидных антибиотиков сопровождается растущими показателями антибиотикорезистентности к ним актуальных для ИНДП микроорганизмов. В этой связи актуализация значения макролидов в современных схемах терапии ИНДП имеет большое значение.
Резистентность к макролидам ключевых возбудителей инфекций дыхательных путей
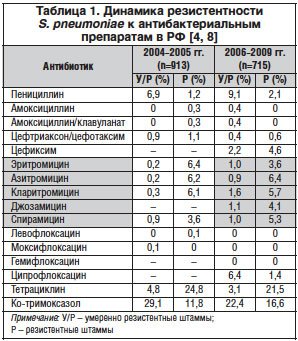
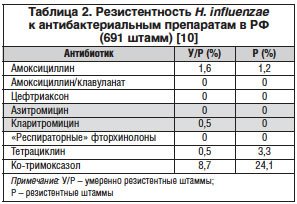
Одна из наиболее серьезных проблем – рост устойчивости основного возбудителя инфекций респираторного тракта – Streptococcus (S.) pneumoniae к макролидам в ряде регионов. Так, например, в Юго-Восточной Азии (Гонконг, Сингапур и др.) резистентность к макролидам достигает 80%, в странах Европы количество резистентных S. pneumoniae варьирует от 12,2% (Великобритания) до 36,6 и 58,1% (Испания и Франция соответственно) [7]. В РФ уровень резистентности пневмококков к наиболее часто назначаемым макролидам – азитромицину и кларитромицину, по данным исследования ПеГАС III, составляет 6–7% (табл. 1) [8]. В то же время данная ситуация требует постоянного мониторинга, так, в исследовании ЦЕРБЕРУС отмечен рост числа резистентных штаммов пневмококка к эритромицину до 29,8% [26]. Другой потенциальной проблемой является растущая устойчивость S. pyogenes к макролидам, достигающая, в частности, в Китае 90%. Однако в РФ частота устойчивых к макролидным антибиотикам штаммов пиогенных стрептококков не превышает 7% [9]. Стоит отметить, что азитромицин превосходит кларитромицин по активности в отношении Haemophilus (H.) influenzae, для других макролидов, включая рокситромицин, спирамицин и джозамицин, эта активность минимальна. Уровень резистентности гемофильной палочки к антибиотикам представлен в таблице 2 [10]. Макролиды характеризуются высокой активностью в отношении Mycoplasma (М.) pneumoniae, Chlamydia (С.) pneumoniae и Legionella pneumophila, данных о какой-либо резистентности этих микроорганизмов к макролидам в РФ пока не опубликовано.
Внебольничная пневмония
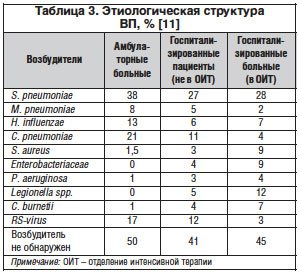
В этиологии ВП, как нетяжелой, так и требующей госпитализации, преимущественное значение сохраняется за S. pneumoniae (30–50%) (табл. 3) [11]. Немаловажной, особенно в случаях нетяжелых форм заболевания, является роль атипичных микроорганизмов, на долю которых приходится от 8 до 30% случаев заболевания: C. pneumoniae и M. pneumoniaе [4, 11–12]. Микоплазменная инфекция – нередкий возбудитель ВП в группе пациентов с легким течением заболевания, при этом чаще всего выделяется у лиц молодого возраста (20–40 лет). Кроме того, данный возбудитель вызывает ВП у детей от 5 до 15 лет. Значение C. pneumoniae в этиологии нетяжелой ВП достигает 20% [11]. L. pneumophila обусловливает до 6% случаев тяжелой пневмонии, требующей лечения в условиях отделения реанимации и интенсивной терапии. Н. influenzae, Staphylococcus (S.) aureus и Klebsiella (К.) pneumoniae встречаются реже (3–10%). ВП также может вызывать Pseudomonas (Р.) aeruginosa (у больных с бронхоэктатической болезнью, муковисцидозом). Гемофильная палочка выявляется чаще всего у больных ВП с сопутствующей хронической бронхолегочной патологией, курильщиков. Клиническое значение K. pneumoniae, S. аureus и P. aeruginosa возрастает при наличии таких факторов риска, как алкоголизм, проживание в домах престарелых, наличие сопутствующих заболеваний, длительная терапия пероральными кортикостероидами и частые/повторные курсы антибактериальной терапии [4, 13, 14].
Часто (~50%) у взрослых пациентов, переносящих ВП, выявляют 2 и более возбудителей, в большинстве случаев речь идет о сочетании пневмококка с микоплазменной или хламидийной инфекцией [15]. Подтверждение данному факту мы находим в одном из российских исследований [16], показавшем, что микст-инфекция, вызванная типичными и атипичными микроорганизмами, была выявлена в 62,5% случаев.
Важно отметить, что этиологическая структура ВП различается в зависимости от возраста больных, тяжести заболевания, наличия сопутствующей патологии и предшествующей системной антибиотикотерапии. Соответственно, учет данных факторов позволяет определить последующую тактику и направления эмпирической антибактериальной терапии. Так, ключевыми возбудителями нетяжелой ВП у пациентов без сопутствующих заболеваний и не принимавших в последние 3 мес. антибактериальные препараты чаще всего являются S. pneumoniae, C. pneumoniaе и M. pneumoniaе, а также их сочетания. Напротив, в случае нетяжелой ВП у лиц, принимавших в последние 3 мес. антибактериальные препараты и/или имеющих сопутствующую патологию (ХОБЛ, сахарный диабет, сердечная недостаточность, хроническая почечная недостаточность, заболевания печени, алкоголизм, наркомания, дефицит массы тела), помимо S. pneumoniae и C. pneumoniae возрастает роль таких возбудителей, как H. influenzae, S. aureus и K. pneumoniae, в т. ч. штаммов, обладающих механизмами антибиотикорезистентности.
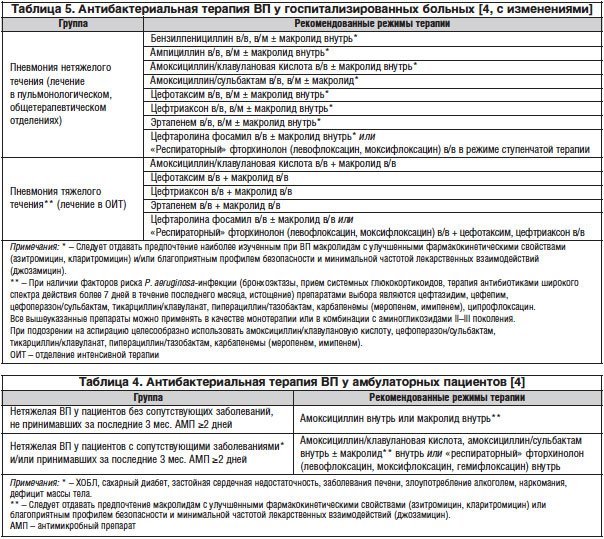
«Современные» макролиды – азитромицин и кларитромицин наряду с амоксициллином являются препаратами выбора при лечении нетяжелой ВП у амбулаторных пациентов без сопутствующих заболеваний, не принимавших в последние 3 мес. антибактериальные препараты (табл. 4) [4]. При подозрении на атипичную этиологию заболевания (M. pneumoniae, C. pneumoniae) отдается предпочтение макролидам. На основании данных только анамнеза (вспышка пневмонии в закрытом коллективе, семье) этиологическая настороженность в пользу хламидийной или микоплазменной инфекции нередко выглядит сомнительной, но дополнительные клинические признаки могут быть все же полезны. К ним относятся постепенное (в течение 3–7 дней) начало, дебют заболевания с симптоматикой поражения верхних дыхательных путей, непродуктивный кашель, внелегочная симптоматика: миалгии, артралгии, головная боль, диарея.
Использование «респираторных» фторхинолонов у пациентов без сопутствующей патологии и/или при отсутствии факторов риска инфицирования лекарственно устойчивыми пневмококками не приветствуется, т. к. широкое использование препаратов данной группы может привести к селекции антибиотикорезистентных штаммов микроорганизмов.
Пациентам, получавшим в последние 3 мес. антибактериальные препараты ≥2 дней, и/или при наличии сопутствующих заболеваний (ХОБЛ, сахарный диабет, застойная сердечная недостаточность, заболевания печени, злоупотребление алкоголем, наркомания, дефицит массы тела), что может оказывать влияние на этиологию заболевания, рекомендуется назначать терапию с использованием «защищенных» аминопенициллинов (амоксициллин/клавулановая кислота или амоксициллин/сульбактам). У пациентов данной категории с учетом возможной атипичной этиологии ВП возможно назначение комбинации β-лактама с макролидом. Альтернативой может быть применение «респираторного» фторхинолона.
У госпитализированных в отделение общего профиля больных с ВП применяется комбинация β-лактам парентерально + макролид для приема внутрь (табл. 5) [4]. Такой подход является оправданным, т. к. наличие в стартовом режиме терапии препарата, активного в отношении атипичных микроорганизмов, улучшает прогноз и сокращает продолжительность пребывания пациента в стационаре. Механизмы влияния комбинированной терапии на снижение летальности окончательно не определены. Так, одним из объяснений является наличие ко-инфекции, вызванной атипичными возбудителями, другим объяснением служит противовоспалительный эффект макролидных антибиотиков, который наиболее выражен у азитромицина [17].
Для лечения тяжелых форм ВП в условиях отделений интенсивной терапии зарезервированы ингибиторозащищенные пенициллины, цефалоспорины III поколения, эртапенем, цефтаролина фосамил в обязательной комбинации с макролидом в/в. Указанные комбинации перекрывают практически весь спектр потенциальных возбудителей (как типичных, так и атипичных) тяжелой ВП.
Помимо эмпирической терапии макролидные антибиотики широко используются при лечении ВП известной этиологии, являясь стандартом лечения пневмонии, вызванной M. pneumoniae, C. pneumoniae или L. pneumophila [2, 4, 18].
Обострение ХБ/ХОБЛ
Доминирующими микроорганизмами при бактериологическом исследовании образцов мокроты (бронхиального секрета) у больных с обострением ХОБЛ являются H. influenzae, а также S. pneumoniae и Moraxella (М.) catarrhalis, удельный вес которых, по данным различных исследователей, составляет 13–46, 7–26 и 9–20% соответственно [19]. Реже выделяются H. parainfluenzae, S. aureus, P. aeruginosa и представители семейства Enterobacteriaceae [20]. Удельный вес M. pneumoniae и C. pneumoniae в развитии обострений составляет порядка 5%, однако точная распространенность данных инфекций неизвестна ввиду трудностей диагностики. До 30% случаев обострений ХОБЛ имеют вирусную природу [21]. Как правило, речь идет о риновирусной и гриппозной инфекциях. Также следует учитывать тот факт, что вирусная инфекция служит проводником развития бактериального обострения ХОБЛ.
Результаты исследований свидетельствуют, что степень тяжести ХОБЛ зависит от типа возбудителя. Так, у пациентов с легкой степенью ХОБЛ обострение чаще всего обусловлено S. pneumoniae, по мере прогрессирования болезни (снижение объема форсированного выдоха за 1-ю с (ОФВ1) частые обострения) вызывают H. influenzae, M. catarrhalis и Enterobacteriaceae (табл. 6) [22, 23]. В случае тяжелого обострения нередко обнаруживают P. aeruginosa.
Обострение ХБ/ХОБЛ характеризуют критерии, предложенные N. Anthonisen в 1987 г. [24]: появление или усиление одышки; увеличение объема отделяемой мокроты; усиление гнойности мокроты. Наличие 3-х вышеуказанных критериев описывается как I тип, 2-х из них – как II тип, одного – как III тип обострения заболевания. Назначение антибактериальных препаратов оправданно у пациентов с I типом обострения ХОБЛ, т. к. в данном случае наиболее вероятна инфекционная природа обострения. Кроме того, показаниями к назначению антимикробной химиотерапии являются II тип обострения ХОБЛ (при наличии гнойной мокроты), а также тяжелое обострение (сопровождаемое признаками острой дыхательной недостаточности).
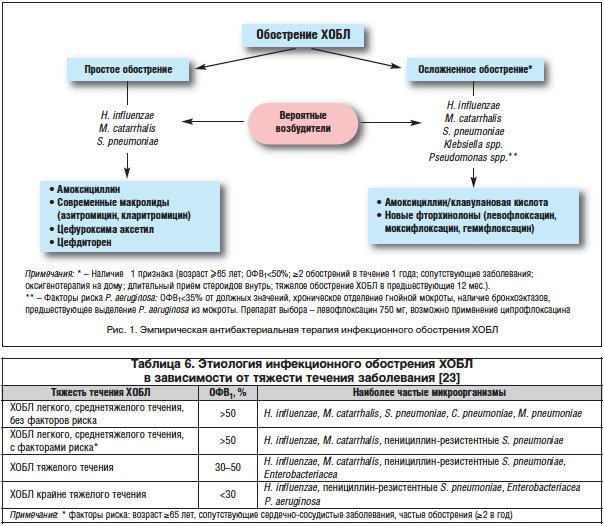
Тактика лечения пациентов с обострением ХБ/ХОБЛ предполагает рубрификацию больных на переносящих простое/неосложненное1 обострение заболевания и осложненное обострение2. В первом случае ведущее значение в этиологии возникшего обострения имеют микроорганизмы (H. influenzae, S. pneumoniae и M. catarrhalis) с природным уровнем чувствительности к антибиотикам, и, соответственно, препаратами выбора являются амоксициллин либо современные макролиды: азитромицин, кларитромицин [22, 25].
Больным с осложненным обострением ХОБЛ2 рекомендовано назначение ингибиторозащищенных аминопенициллинов либо «респираторных» фторхинолонов (рис. 1).
Профиль безопасности макролидов
Современные макролиды (азитромицин и кларитромицин) являются одними из наиболее безопасных антибактериальных препаратов. Согласно данным метаанализа, включавшего 45 клинических исследований, общая частота нежелательных лекарственных реакций (НЛР) при приеме азитромицина составила 8,7%, наиболее типичными из которых являлись нарушения со стороны ЖКТ – боли и дискомфорт в животе, тошнота, диарея [27]. В другом метаанализе было показано, что частота отмены азитромицина из-за нежелательных явлений при лечении инфекций нижних и верхних отделов дыхательных путей составила 0,7 и 0,8% соответственно [28]. Стоит отметить, что нарушения со стороны ЖКТ (боли в животе, тошнота, рвота и/или диарея) – наиболее частые побочные эффекты, возникающие на фоне применения макролидов [29]. В этом контексте важно уточнить, что диарея является весьма частой жалобой при терапии макролидами, однако она, как правило, не представляет опасности для пациента. Случаи возникновения истинной антибиотик-ассоциированной диареи (или C. difficile-ассоциированной диареи), которая является серьезным осложнением антибактериальной терапии, описаны при применении большинства антибиотиков, однако установлено, что наиболее часто это состояние возникает при применении ингибиторозащищенных аминопенициллинов, цефалоспоринов, линкозамидов и фторхинолонов [30]. Макролиды же столь серьезную НЛР вызывают значительно реже.
Аллергические реакции при применении макролидов отмечаются очень редко. Так, по данным крупномасштабного исследования, в котором приняли участие 1893 пациента, частота сообщаемых пациентами аллергических реакций на АМП была максимальной на пенициллин (15,6%) и сульфаниламиды (7,3%) [31]. Эритромицин, кларитромицин, азитромицин вызывали аллергические реакции у 2,0, 0,3 и 0,1% пациентов соответственно. Известно, что азитромицин имеет ряд преимуществ перед другими макролидами, в т. ч. с точки зрения потенциальной гепатотоксичности. Так, C.Y. Chang et al. (2007) приводят данные 7 проспективных и ретроспективных исследований, посвященных изучению гепатотоксичности лекарственных средств (ЛС) при их применении в широкой медицинской практике [32]. Ни в одном из них не выявлено ни одного случая поражения печени, вызванного азитромицином. При проведении поиска в базе данные Национальной медицинской библиотеки США Medline были найдены 4 публикации, посвященные описанию случаев обратимого внутрипеченочного холестаза при приеме азитромицина взрослыми пациентами, большинство из которых имели дополнительные факторы риска [33]. В базе данных спонтанных сообщений о нежелательных реакциях FDA (Adverse Event Reporting System – AERS), в которую поступают сообщения о НЛР от производителей ЛС, медицинских и фармацевтических работников, а также пациентов, у лиц, получавших азитромицин за период с 1.11.1991 г. по 19.07.2000 г. было зарегистрировано 24 случая лекарственных поражений печени (19 у взрослых и 5 у детей), в 5 из которых азитромицин применяли совместного с потенциально гепатотоксичными препаратами (парацетамолом или другими нестероидными противовоспалительными препаратами) [33, 34]. За этот период число назначений азитромицина превысило 200 млн. Таким образом, частота развития тяжелых гепатотоксических реакций составила <0,01 случая на 100 тыс. назначений (или <1 случая на 10 млн назначений).
Таким образом, макролидные антибиотики обладают благоприятным профилем безопасности, что позволяет назначать их для терапии различных инфекций у амбулаторных и стационарных пациентов, включая детей, беременных женщин, пациентов пожилого возраста и лиц с сопутствующей патологией [33].
Проблема комплаентности пациентов при лечении ИНДП
В настоящее время большое значение придается такому показателю, как комплаентность лечения (приверженность пациента к выполнению врачебных рекомендаций). О том, что значительное число больных нарушают режим приема антибиотиков, известно по целому ряду исследований. Порядка 30% амбулаторных больных не выполняют предписанный режим антибиотикотерапии [35] – это общемировая тенденция. В настоящее время имеются доказательства связи между кратностью приема ЛС и приверженностью пациента к выполнению врачебных рекомендаций [36]. Так, в одном из исследований было показано, что при однократном приеме препарата в сутки комплаентность составляет 98,3%, а при 2–3-кратном приеме – 75 и 63,3% соответственно [37]. Таким образом, прием антибиотика 1 р./сут позволяет достичь наибольшей комплаентности, что особенно важно при лечении пациента в амбулаторных условиях. Продолжительность лечения также является одним из ключевых факторов, определяющих комплаентность антибиотикотерапии [38, 39], что делает короткие курсы при ВП наиболее привлекательными для амбулаторной практики, т. к. данный подход позволяет повысить эффективность лечения.
В этой связи стоит отметить, что возможность применения 1 р./сут одного из наиболее ярких представителей группы макролидов – азитромицина (Хемомицина) короткими курсами (≤5 дней) при нетяжелой ВП, неосложненном обострении ХОБЛ обеспечивает наиболее высокую приверженность пациентов к лечению.
Проблема применения препаратов-дженериков при ИНДП
Макролидные антибиотики до настоящего времени являются одними из самых назначаемых антибактериальных препаратов. Так, по данным IMS Health в США в 2009 г. было выписано 53,8 млн рецептов на азитромицин, и этот препарат по числу назначений занимал пятое место среди всех ЛС [40]. Столь широкая популярность обусловила повышенный интерес к данному препарату со стороны компаний, занимающихся производством воспроизведенных (дженерических) форм ЛС. Так, в РФ на фармацевтическом рынке присутствует, по крайней мере, 10 дженериков азитромицина.
Конечно, использование дженерических форм антимикробных препаратов позволяет сократить прямые расходы за счет разницы в стоимости между ними и оригинальными препаратами. Однако такая, на первый взгляд понятная, альтернатива не учитывает все затраты на лечение. При ближайшем рассмотрении оказывается, что отнюдь не все дженерики равноценны в качественном отношении в сравнении с оригинальным ЛС. Различия в биоэквивалентности, фармакодинамических характеристиках приводят к снижению клинической эффективности терапии и, как следствие, к значительному увеличению экономических затрат на лечение [41]. В частности, при сравнении оригинального азитромицина с дженериками, представленными на российском рынке, было показано, что общее количество примесей в копиях в 3–5 раз превышает таковое в оригинале, и они уступают ему по показателю растворения [42, 43]. В другом исследовании отражено, что содержание активного вещества в 2 инъекционных исследуемых дженерических формах было ниже указанного производителем – 89 и 94% от должного, а время растворения было выше по сравнению с оригинальным азитромицином [44]. Очевидно, что следствием указанных нарушений является снижение эффективности лечения. К сожалению, работ, посвященных анализу терапевтической эквивалентности и эффективности воспроизведенных препаратов в сравнении с оригинальным ЛС, немного. Так, в ходе российского фармакоэкономического исследования было показано, что одинаковая по длительности и дозе терапия нетяжелой ВП оригинальным азитромицином и аналогами демонстрирует различную эффективность и стоимость [45]. В цитируемом исследовании только у оригинального ЛС и препарата Хемомицин отмечена сравнимая клиническая эффективность в лечении нетяжелой ВП, что обеспечило наилучшие экономические результаты. Лечение другими препаратами, согласно представленному фармакоэкономическому анализу, оказалось наиболее затратным за счет меньшей эффективности терапии. Таким образом, при выборе дженерического антибиотика необходимо обладать знаниями о его биоэквивалентности с оригинальным препаратом и результатами контролируемых, в т. ч. отечественных, клинико-экономических исследований.
Заключение
Таким образом, доказанная в многочисленных исследованиях высокая эффективность и многолетний успешный опыт эффективного и безопасного клинического применения современных макролидов позволяют им сохранять свое значение в современных схемах антимикробной химиотерапии внебольничных инфекций нижних отделов дыхательных путей.
1 Нечастые (<2) обострения заболевания в течение 12 мес., больные в возрасте <65 лет с отсутствием серьезных сопутствующих заболеваний и умеренными нарушениями бронхиальной проходимости (ОФВ1≥50% от должных значений)
2 Наличие ≥1 признака (возраст ≥65 лет; ОФВ1<50%; ≥2 обострений в течение года; сопутствующие заболевания: сахарный диабет, застойная сердечная недостаточность, заболевания печения и почек с нарушениями их функции; оксигенотерапия на дому; длительный прием стероидов внутрь; тяжелое обострение ХОБЛ в предшествующие 12 мес.)
Литература
1. Anzueto A. Acute exacerbation of chronic bronchitis // J Crit Illness. 1999. Vol. 14 (Suppl). Р. 27–33.
2. Mandell L., Wunderink R., Anzueto A. et al. Infectious Diseases Society of America/American Thoracic Society Consensus Guidelines on the Management of Community Acquired Pneumonia in Adults // Clin Infect. Dis. 2007. Vol. 44 (2). Р. 27–72.
3. Woodhead M., Blasi F., Ewig S. et al. Guidelines for the management of adult lower respiratory tract infections // Clin Microbiol Infect. 2011. Vol. 17 (6). Р. 1–59.
4. Чучалин А.Г., Синопальников А.И., Козлов Р.С. и соавт. Внебольничная пневмония у взрослых. Практические рекомендации по диагностике, лечению и профилактике. М., 2010. 82 с.
5. Ferech M., Coenen S., Malhotra-Kumar S. et al. European Surveillance of Antimicrobial Consumption (ESAC): outpatient antibiotic use in Europe // J Antimicrob Chemother. 2006. Vol. 58 (2). Р. 401–407.
6. Metz-Gercek S., Maieron A., Strau R. et al. Ten years of antibiotic consumption in ambulatory care: Trends in prescribing practice and antibiotic resistance in Austria // BMC Infectious Diseases. 2009. Vol. 13. ( 9). Р. 61.
7. Schito G.C., Debbia E.A., Marchese A. The evolving threat of antibiotic resistance in Europe: new data from the Alexander project // J.Antimicrob. Chemother. 2000. Vol. 46. (1). Р. 3–9.
8. Козлов Р.С., Сивая О.В., Кречикова О.И., Иванчик Н.В., Группа исследователей проекта «ПеГАС». Динамика резистентности Streptococcus pneumoniae к антибиотикам в России за период 1999–2009 гг. // Клин. микробиол. антимикроб. химиотер. 2010. № 12 (4). С. 329–341
9. Козлов Р.С., Веселов А.В. Макролиды и кетолиды. В кн.: Внебольничные инфекции дыхательных путей: диагностика и лечение. М., 2008. С. 49–65.
10. Сивая О.В., Козлов Р.С., Кречикова О.И., Иванчик Н.В., Катосова Л.К., Гудкова Л.В., группа исследователей проекта ПеГАС. Антибиотикорезистентность Haemophilus influenzae в России: результаты многоцентрового проспективного исследования ПеГАС // Клин. микробиол. антимикроб. химиотер. 2014. № 16 (1). С. 57–69.
11. Welte T., Torres A., Nathwani D. Clinical and economic burden of community-acquired pneumonia among adults in Europe // Thorax. 2012. Vol. 67. Р. 71–79.
12. Marrie T., Peeling R., Fine M. et al. Ambulatory patients with community-acquired pneumonia: the frequency of atypical agents and clinical course // Am J Med. 1996. Vol. 101. Р. 508–515.
13. Paganin F., Lilienthal F., Bourdin A. et al. Severe community-acquired pneumonia: assessment of microbial aetiology as mortality factor // Eur Respir J. 2004. Vol. 24. Р. 779–785.
14. Arancibia F., Bauer T., Ewig S. et al. Community-acquired pneumonia due to gram-negative bacteria and Pseudomonas aeruginosa: incidence, risk and prognosis // Arch Intern Med. 2002. Vol. 162. Р. 1849–1858.
15. Lim W., Macfarlane J., Bosivell T. et al. Study of community aacquired pneumonia aetiology (SCAPA) in adults admitted to hospital: implications for management guidelines // Thorax. 2001. Vol. 56. Р. 296–201.
16. Савинова Т.Л., Бейкин А.Б., Шилова В.П. с соавт. Практический опыт лабораторной диагностики внебольничных пневмоний // КМАХ. 2009. Т. 11. № 1. С. 79–85.
17. Amsden G. Anti-inflammatory effects of macrolides - an underappreciated benefit in the treatment of community-acquired respiratory tract infections and chronic inflammatory pulmonary conditions? // J Antimicrob Chemoter. 2005. Vol. 55. Р. 10–21.
18. Roig J., Rello J. Legionnaires' disease: a rational approach to therapy // J Antimicrob Chemother. 2003. Vol. 51 (5). Р. 1119–1129.
19. Sethi S. Bacteria in exacerbations of chronic obstructive pulmonary disease // The Proceedings of the American Thoracic Society. 2004. Vol. 1. Р. 109–114.
20. Donaldson G., Seemungal T., Bhowmik A. et al. The relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease // Thorax. 2002. Vol. 57. Р. 847–852.
21. Sethi S., Murphy T.F. Bacterial Infection in Chronic Obstructive Pulmonary Disease in 2000: a State-of-the-Art Review // Clinical Microbiology Reviews. 2001. Vol. 14 (2). Р. 336–363.
22. Синопальников А.И., Козлов Р.С., Романовских А.Г., Рачина С.А. Инфекционное обострение ХОБЛ: практические рекомендации по диагностике, лечению и профилактике // Российские медицинские вести. 2006. XI. №1. С. 4–18.
23. Чучалин А.Г., Айсанов З.Р., Авдеев С.Н. с соавт. Федеральные клинические рекомендации по диагностике и лечению хронической обструктивной болезни легких. Москва 2014. Доступно на: http://www.pulmonology.ru/publications/guide.php?clear_cache=Y.
24. Anthonisen N., Manfreda J., Warren C., et al. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease // Ann Intern Med. 1987. Vol. 106. Р. 196–204.
25. Зайцев А.А., Безлепко А.В., Овчинников Ю.В. Диагностика и лечение хронической обструктивной болезни легких (методические рекомендации). М.: ГВКГ им. Н.Н. Бурденко, 2014. 75 с.
26. Рачина С.А. Этиологическая диагностика внебольничных инфекций нижних дыхательных путей: Доклад на Всеармейской научно-практической конференции «Острые вирусные и бактериальные инфекции органов дыхания у военнослужащих: диагностика, лечение и профилактика», Москва, ГВКГ имени Н.Н. Бурденко, 9 октября 2014 г.
27. Treadway G., Pontani D. Paediatric savety of azithromycin: world-wide experience. J Antimicrob Chemother. 1996. Vol. 37 (suppl. C). P. 143–149.
28. Ioannidis J., Contopoulos-Ioannidis D., Chew P., Lau J. Meta-analysis of randomized controlled trials on the comparative efficacy and safety of azithromycin against other antibiotics for upper respiratory tractinfections. J Antimicrob Chemoter. 2001. Vol. 48. P. 677–689.
29. Rubinstein E. Comparative safety of the different macrolides. Int J Antimicrob Agents. 2001. 18 Suppl 1. S71–76.
30. Kuntz J.L., Chrischilles E.A., Pendergast J.F., et al. Incidence of and risk factors for community-associated Clostridium difficile infection: a nested case-control study. BMC Infect Dis. 2011. Vol. 11. P. 194.
31. Lee C.E., Zembower T.R., Fotis M.A., et al. The incidence of antimicrobial allergies in hospitalized patients: implications regarding prescribing patterns and emerging bacterial resistance. Arch Intern Med. 2000. Vol. 160 (18). P. 2819–2822.
32. Chang C.Y., Schiano T.D. Review article: drug hepatotoxicity. Aliment Pharmacol Ther. 2007. Vol. 25 (10). P. 1135–1151.
33. Синопальников А.И., Андреева И.В., Стецюк О.У. Безопасность макролидных антибиотиков: критический анализ // Клиническая медицина. 2012. № 3. С. 23–30.
34. FDA, July, 8, 2000. PID# D000539. Drug: Azithromycin. Reaction: Hepatic necrosis/hepatic failure. http://www.docstoc.com/docs/76282324/Date-January-To-Lisa-Mathis-MD-Associate-Director.
35. Pechere J., Hughes D., Kardas P., Cornaglia G. Non compliance with antibiotic therapy for acute community infections: a global survey // Int J of Antimicrob Agents. 2007. Vol. 29. Р. 245–253.
36. Kardas P. Comparison of patient compliance with once–daily and twice–daily antibiotic regimens in respiratory tract infections: results of a randomized trial // J of Аntimicrob Сhemother. 2007. Vol. 59 (3). Р. 531–536.
37. Cockburn J., Gibberd R.W., Reid A.L. et al. Determinants of non-compliance with short term antibiotic regimens // British Medical Journal. Vol. 295. Р. 814–818.
38. Kardas P. Patient compliance with antibiotic treatment for respiratory tract infections // Antimicrob Chemother. 2002. Vol. 49. Р. 897–903.
39. Синопальников А.И., Зайцев А.А. Комплаентность пациентов с инфекциями дыхательных путей // Клин. микробиол. и антимикроб. химиотер. 2008. Т. 10. №1 С. 50–58.
40. Bartholow M. Top 200 Prescription Drugs of 2009. Pharmacy Times. May 11, 2010.
41. Зайцев А. А. Снижение стоимости антибактериальной терапии: от общих вопросов к анализу стратегий // Российские мед. вести. 2008. Т.13, № 3. С. 34–42.
42. Панюшин Р. Оригинальные и дженериковые препараты: единство или борьба противоположностей? // Фарм. вестник. 2003. № 16. С. 23.
43. Карпов О.И. Оригинальные препараты и копии макролидов: тенденции противостояния // Фарматека. 2004. № 3–4. С. 83–87.
44. Мартинович А.А., Эйдельштейн М.В., Цюман Ю.П., Козлов Р.С. Азитромицин: сравнение качества инъекционных лекарственных форм оригинального препарата и его генериков // Клин. микроб. и антимикроб. химиотер. 2011. С. 335–345.
45. Смоленов И.В., Красильникова А.В. Фармакоэкономические аспекты применения азитромицина различных производителей при внебольничной пневмонии у взрослых // Фарматека. 2003. № 13. С. 78–87.












