–°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ —Н–њ–Њ—Е–∞ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –љ–∞—З–∞–ї–∞—Б—М –≤ 1941 –≥. –≤ –°–®–Р, –Њ–і–љ–∞–Ї–Њ –њ–µ—А–≤—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є –љ–∞—З–∞—В—Л –µ—Й–µ –≤ 1929 –≥., –Ї–Њ–≥–і–∞ –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥ –Р. –§–ї–µ–Љ–Є–љ–≥ –≤ –њ–ї–µ—Б–µ–љ–Є Penicillium notatum –Њ—В–Ї—А—Л–ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ. –Я—А–µ–і—И–µ—Б—В–≤—Г—О—Й–Є–µ –Њ–њ—Л—В—Л —Б —А–∞–Ј–Љ–љ–Њ–ґ–µ–љ–Є–µ–Љ –≤—А–µ–і–Њ–љ–Њ—Б–љ—Л—Е –±–∞–Ї—В–µ—А–Є–є –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –≤–Є–і—Л –њ–ї–µ—Б–µ–љ–Є —Б–њ–Њ—Б–Њ–±–љ—Л —Г–љ–Є—З—В–Њ–ґ–∞—В—М –і—А—Г–≥–Є—Е –Є –љ–µ –і–Њ–њ—Г—Б–Ї–∞—В—М –Є—Е –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Н—В–Њ –Ї–∞—Б–∞–ї–Њ—Б—М —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤ –Є —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Њ–≤. –≠—В–Њ —П–≤–ї–µ–љ–Є–µ –±—Л–ї–Њ –љ–∞–Ј–≤–∞–љ–Њ «–∞–љ—В–Є–±–Є–Њ–Ј–Њ–Љ» (–Њ—В –≥—А–µ—З. «–∞–љ—В–Є» – –њ—А–Њ—В–Є–≤ –Є «–±–Є–Њ—Б» – –ґ–Є–Ј–љ—М).
–Ю—В–Ї—А—Л—В–Є–µ —Б—В–∞–ї–Њ –љ–∞—Б—В–Њ—П—Й–µ–є —А–µ–≤–Њ–ї—О—Ж–Є–µ–є –≤ –Љ–µ–і–Є—Ж–Є–љ–µ, –љ–Њ –і–Њ –љ–∞—Б—В–Њ—П—Й–µ–є –њ–Њ–±–µ–і—Л –±—Л–ї–Њ –µ—Й–µ –і–∞–ї–µ–Ї–Њ. –Я—Г—В—М –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞ –Є–Ј –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –Ї –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤—Г –≤ –њ—А–Њ–Љ—Л—И–ї–µ–љ–љ—Л—Е –Љ–∞—Б—И—В–∞–±–∞—Е –Њ–Ї–∞–Ј–∞–ї—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –і–ї–Є–љ–љ—Л–Љ. –Ґ–Њ–ї—М–Ї–Њ –±–ї–Є–ґ–µ –Ї –Ї–Њ–љ—Ж—Г –Т—В–Њ—А–Њ–є –Љ–Є—А–Њ–≤–Њ–є –≤–Њ–є–љ—Л –≤ –°–®–Р —Г–і–∞–ї–Њ—Б—М –љ–∞–ї–∞–і–Є—В—М –Љ–∞—Б—Б–Њ–≤–Њ–µ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–Њ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞. –Х–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–Є–≤–µ–ї–Њ –Ї —В–Њ–Љ—Г, —З—В–Њ —Б–Љ–µ—А—В–љ–Њ—Б—В—М –Њ—В –≥–∞–љ–≥—А–µ–љ—Л –Є —Б–µ–њ—Б–Є—Б–∞ —Г–њ–∞–ї–∞ –і–Њ –љ—Г–ї—П, –∞–Љ–њ—Г—В–∞—Ж–Є–є —Г–і–∞–≤–∞–ї–Њ—Б—М –Є–Ј–±–µ–ґ–∞—В—М, —В—П–ґ–µ–ї–Њ—А–∞–љ–µ–љ—Л–µ –і–Њ–≤–Њ–ї—М–љ–Њ –±—Л—Б—В—А–Њ –њ–Њ–њ—А–∞–≤–ї—П–ї–Є—Б—М.
–Я–Њ–љ–Є–Љ–∞—П –≤—Б–µ –Ј–љ–∞—З–µ–љ–Є–µ —Н—В–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞, –Њ—В–Ї—А—Л–≤–∞—В–µ–ї–Є –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞ –§–ї–µ–Љ–Є–љ–≥, –§–ї–Њ—А–Є –Є –І–µ–є–љ –љ–µ –Ј–∞–њ–∞—В–µ–љ—В–Њ–≤–∞–ї–Є –µ–≥–Њ, –Њ–і–љ–∞–Ї–Њ –Ї–∞–ґ–і–∞—П —Б—В—А–∞–љ–∞ –і–Њ–ї–ґ–љ–∞ –±—Л–ї–∞ –њ–Њ–ї—Г—З–Є—В—М —Б–≤–Њ–є –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ. –Т –°–Њ–≤–µ—В—Б–Ї–Њ–Љ –°–Њ—О–Ј–µ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –≤–Њ–µ–љ–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є —Н—В—Г —А–∞–±–Њ—В—Г –≤—Л–њ–Њ–ї–љ–Є–ї–∞ –Ч.–Т. –Х—А–Љ–Њ–ї—М–µ–≤–∞ —Б–Њ —Б–≤–Њ–Є–Љ–Є –µ–і–Є–љ–Њ–Љ—Л—И–ї–µ–љ–љ–Є–Ї–∞–Љ–Є, –Є —Г–ґ–µ –≤ 1942 –≥. –±—Л–ї –љ–∞–є–і–µ–љ —И—В–∞–Љ–Љ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞, –њ–Њ—Е–Њ–ґ–Є–є –љ–∞ –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є–є. –Т –Ї—А–∞—В—З–∞–є—И–Є–µ —Б—А–Њ–Ї–Є –µ–≥–Њ –≤—Л–њ—Г—Б–Ї –±—Л–ї –љ–∞–ї–∞–ґ–µ–љ –≤ –њ—А–Њ–Љ—Л—И–ї–µ–љ–љ—Л—Е –Љ–∞—Б—И—В–∞–±–∞—Е, –Є –≤ 1944 –≥. –Њ–љ —Б—В–∞–ї –њ–Њ—Б—В—Г–њ–∞—В—М –≤ –≥–Њ—Б–њ–Є—В–∞–ї–Є –Є –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –љ–∞ —Д—А–Њ–љ—В.
–§–ї–µ–Љ–Є–љ–≥, –§–ї–Њ—А–Є –Є –І–µ–є–љ –≤ 1945 –≥. –њ–Њ–ї—Г—З–Є–ї–Є –Э–Њ–±–µ–ї–µ–≤—Б–Ї—Г—О –њ—А–µ–Љ–Є—О –Ј–∞ —Б–≤–Њ–µ –Њ—В–Ї—А—Л—В–Є–µ. –Э–∞—Б—В–Њ—П—Й–µ–є –њ–Њ–±–µ–і–Њ–є –љ–∞–і —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ —П–≤–Є–ї–Њ—Б—М –Њ—В–Ї—А—Л—В–Є–µ–Љ —Б—В—А–µ–њ—В–Њ–Љ–Є—Ж–µ—В–∞ –≤ 1944 –≥. –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є–Љ —Г—З–µ–љ—Л–Љ –°.–ѓ. –Т–∞–Ї—Б–Љ–∞–љ–Њ–Љ. –Т 1948 –≥. –С–∞—А—Ж –≤—Л–і–µ–ї–Є–ї –ї–µ–≤–Њ–Љ–Є—Ж–µ—В–Є–љ, –Ф—Г–≥–≥–∞—А – —Е–ї–Њ—А—В–µ—В—А–∞—Ж–Є–Ї–ї–Є–љ, –∞ –≤ 1949 –≥. –С—А–Њ—В—В—Ж –њ–Њ–ї—Г—З–Є–ї —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ. –Ъ 1955 –≥. –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –љ–∞—Б—З–Є—В—Л–≤–∞–ї–Њ—Б—М —Г–ґ–µ –±–Њ–ї–µ–µ 500. –°–µ–є—З–∞—Б –Њ—В–Ї—А—Л—В–Њ –Є –Є–Ј—Г—З–µ–љ–Њ –њ—А–Є–Љ–µ—А–љ–Њ 10 000 —Б–Њ–µ–і–Є–љ–µ–љ–Є–є —Н—В–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞, –њ—А–Є—З–µ–Љ –±–Њ–ї–µ–µ 200 –Є–Ј –љ–Є—Е –љ–∞—И–ї–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ –Љ–µ–і–Є—Ж–Є–љ–µ.
–Ш –≤—Б–µ –ґ–µ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –і–Њ—Б—В–Њ–Є–љ—Б—В–≤–∞ –љ–Њ–≤—Л—Е –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ –і–Њ —Б–Є—Е –њ–Њ—А –Њ—Б—В–∞–µ—В—Б—П «–і–Њ–ї–≥–Њ–ґ–Є—В–µ–ї–µ–Љ» —Б—А–µ–і–Є –љ–Є—Е, –њ—А–Њ—П–≤–ї—П—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≥—А–∞–Љ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е –Є –∞–љ–∞—Н—А–Њ–±–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, –њ—А–Є —Н—В–Њ–Љ –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л –Њ–±–ї–∞–і–∞—О—В –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М—О –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Љ.
–Ь–∞–ї–Њ–≤–µ—А–Њ—П—В–љ–Њ, —З—В–Њ —Г–і–∞—Б—В—Б—П –Њ–і–µ—А–ґ–∞—В—М –њ–Њ–ї–љ—Г—О –њ–Њ–±–µ–і—Г –љ–∞–і –Љ–Є—А–Њ–Љ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤. –Т –Њ—В–≤–µ—В –љ–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –Љ–Є–Ї—А–Њ–±—Л –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Є–Љ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ. –Ь–µ—Е–∞–љ–Є–Ј–Љ—Л –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –±–∞–Ї—В–µ—А–Є–є –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ –≤–Ї–ї—О—З–∞—О—В:
• —Б–Є–љ—В–µ–Ј —Д–µ—А–Љ–µ–љ—В–Њ–≤, —А–∞–Ј—А—Г—И–∞—О—Й–Є—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є;
• —Б—В—А—Г–Ї—В—Г—А–љ—Г—О –Є–ї–Є –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ—Г—О –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—О –Љ–Є—И–µ–љ–µ–є –і–ї—П –і–µ–є—Б—В–≤–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤;
• –љ–∞—А—Г—И–µ–љ–Є–µ –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ—З–љ—Л—Е —Б—В–µ–љ–Њ–Ї –Є –Љ–µ–Љ–±—А–∞–љ –±–∞–Ї—В–µ—А–Є–є –і–ї—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤;
• –∞–Ї—В–Є–≤–љ–Њ–µ —Г–і–∞–ї–µ–љ–Є–µ (—Н—Д—Д–ї—О–Ї—Б–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ) –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –Є–Ј –Ї–ї–µ—В–Ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –Љ–µ–Љ–±—А–∞–љ–љ—Л—Е –љ–∞—Б–Њ—Б–Њ–≤;
• —Б–Њ–Ј–і–∞–љ–Є–µ –љ–Њ–≤—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—Г—В–µ–є.
–Я—А–Є—А–Њ–і–љ—Л–µ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л —Б–і–∞–ї–Є —Б–≤–Њ–Є –њ–Њ–Ј–Є—Ж–Є–Є –њ–µ—А–µ–і —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –±–∞–Ї—В–µ—А–Є–є —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞—В—М –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Ј—Л, –Ї–Њ—В–Њ—А—Л–µ —А–∞–Ј—А—Л–≤–∞—О—В β––ї–∞–Ї—В–∞–Љ–љ–Њ–µ –Ї–Њ–ї—М—Ж–Њ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤. –Я–ї–∞–Ј–Љ–Є–і––∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–µ —Н–љ–Ј–Є–Љ—Л (–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Ј—Л) –Њ—В–љ–Њ—Б—П—В—Б—П –Ї –Њ—Б–љ–Њ–≤–љ—Л–Љ —Д–∞–Ї—В–Њ—А–∞–Љ, –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є–Љ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Г—О —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М. –Ю–і–љ–Є–Љ–Є –Є–Ј –њ–µ—А–≤—Л—Е —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞—В—М –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Ј—Л «–љ–∞—Г—З–Є–ї–Є—Б—М» —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Є. –Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М 90% —И—В–∞–Љ–Љ–Њ–≤ —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Њ–≤ —Г—Б—В–Њ–є—З–Є–≤—Л –Ї –њ—А–Є—А–Њ–і–љ—Л–Љ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Љ.
–Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –≤ 1940––µ –≥–≥. –≤–Њ–Ј–љ–Є–Ї–ї–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ —А–∞–Ј—А–∞–±–Њ—В–Ї–µ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є –±—Л —Г—Б—В–Њ–є—З–Є–≤—Л –Ї –і–µ–є—Б—В–≤–Є—О –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Њ–≤—Л—Е) –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Ј, –і–µ–є—Б—В–≤–Њ–≤–∞–ї–Є –љ–∞ –≥—А–∞–Љ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ –Є –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ –Љ–Є–Ї—А–Њ–±—Л. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б–ї–µ–і–Њ–≤–∞–ї–Њ —Г—З–µ—Б—В—М —В–∞–Ї–Њ–µ —Б–≤–Њ–є—Б—В–≤–Њ –њ—А–Є—А–Њ–і–љ—Л—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, –Ї–∞–Ї –Є—Е –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є –њ—А–Є–µ–Љ–µ –≤–љ—Г—В—А—М (—А–∞–Ј—А—Г—И–∞—О—В—Б—П –≤ –Ї–Є—Б–ї–Њ–є —Б—А–µ–і–µ –ґ–µ–ї—Г–і–Ї–∞).
–Я–µ—А–≤—Л–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–Љ, —Г—Б—В–Њ–є—З–Є–≤—Л–Љ –Ї –і–µ–є—Б—В–≤–Є—О –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Ј, —Б—В–∞–ї –Љ–µ—В–Є—Ж–Є–ї–ї–Є–љ. –Ю–і–љ–∞–Ї–Њ –Љ–µ—В–Є—Ж–Є–ї–ї–Є–љ –Є —Б–ї–µ–і—Г—О—Й–Є–µ –Ј–∞ –љ–Є–Љ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Ј–∞—Г—Б—В–Њ–є—З–Є–≤—Л–µ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л (–Њ–Ї—Б–∞—Ж–Є–ї–ї–Є–љ, –Ї–ї–Њ–Ї—Б–∞—Ж–Є–ї–ї–Є–љ, –і–Є–Ї–ї–Њ–Ї—Б–∞—Ж–Є–ї–ї–Є–љ –Є –і—А.) –љ–µ –±—Л–ї–Є –∞–Ї—В–Є–≤–љ—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤. –°—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Є –Є –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Є –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –±–Њ–ї–µ–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–Љ–Є –Ї –њ—А–Є—А–Њ–і–љ—Л–Љ, —З–µ–Љ –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Ј–∞—Г—Б—В–Њ–є—З–Є–≤—Л–Љ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Љ. –Х–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ –њ–Њ–ї—Г—Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є—Е –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ —П–≤–ї—П–µ—В—Б—П —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є β––ї–∞–Ї—В–∞–Љ–∞–Ј —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Њ–≤, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –і–∞–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л —Б—З–Є—В–∞—О—В—Б—П –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤—Л–±–Њ—А–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Њ–≤–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є.
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤—Л–і–µ–ї–µ–љ—Л —И—В–∞–Љ–Љ—Л —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–∞, —Г—Б—В–Њ–є—З–Є–≤—Л–µ –Ї –Њ–Ї—Б–∞—Ж–Є–ї–ї–Є–љ—Г (–Њ–љ–Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Г—Б—В–Њ–є—З–Є–≤—Л —В–∞–Ї–ґ–µ –Ї —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–∞–Љ). –І–∞—Б—В–Њ—В–∞ –≤—Л—П–≤–ї–µ–љ–Є—П —Г—Б—В–Њ–є—З–Є–≤—Л—Е —И—В–∞–Љ–Љ–Њ–≤ —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 5–15%. –Т —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Љ–Њ–ґ–µ—В –±—Л—В—М –і–Њ—Б—В–Є–≥–љ—Г—В –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј—Л –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ (–Њ–Ї—Б–∞—Ж–Є–ї–ї–Є–љ –і–Њ 12–16 –≥) –Є –Є—Е —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–Њ–Ј–Є–і–∞–Љ–Є. –Я–Њ—Н—В–Њ–Љ—Г –Њ–±–ї–∞—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–Њ–є –≥—А—Г–њ–њ—Л –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ–≥—А–∞–љ–Є—З–Є–ї–∞—Б—М –ї–µ—З–µ–љ–Є–µ–Љ –Є–љ—Д–µ–Ї—Ж–Є–є, –≤—Л–Ј–≤–∞–љ–љ—Л—Е —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–Љ–Є –Ї –Љ–µ—В–Є—Ж–Є–ї–ї–Є–љ—Г —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–∞–Љ–Є.
–Т –Ї–Њ–љ—Ж–µ 1950–—Е –≥–≥. –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–µ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л (–∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ), –∞ –≤ 1972 –≥. – –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ, –Ї–Њ—В–Њ—А—Л–є –≤—Л–≥–Њ–і–љ–Њ –Њ—В–ї–Є—З–∞–ї—Б—П –Њ—В –∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ–∞ —Б–≤–Њ–µ–є –≤—Л—Б–Њ–Ї–Њ–є –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О. –Ю–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 90% –њ—А–Є –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–Љ –њ—А–Є–µ–Љ–µ –Є –љ–µ –Ј–∞–≤–Є—Б–µ–ї–∞ –Њ—В –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ–∞ –љ–µ –њ—А–µ–≤—Л—И–∞–ї–∞ 40% –Є –≤ 2 —А–∞–Ј–∞ —Б–љ–Є–ґ–∞–ї–∞—Б—М, –µ—Б–ї–Є –њ—А–µ–њ–∞—А–∞—В –њ—А–Є–Љ–µ–љ—П–ї—Б—П –≤–Њ –≤—А–µ–Љ—П –µ–і—Л. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –љ–∞–Љ–љ–Њ–≥–Њ —А–µ–ґ–µ, —З–µ–Љ –∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ, –Њ–Ї–∞–Ј—Л–≤–∞–ї –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л. –Р–Љ–њ–Є—Ж–Є–ї–ї–Є–љ –Є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ —А–∞–Ј—А—Г—И–∞–ї–Є—Б—М –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Ј–∞–Љ–Є, –љ–µ –і–µ–є—Б—В–≤–Њ–≤–∞–ї–Є –љ–∞ —Б–Є–љ–µ–≥–љ–Њ–є–љ—Г—О –њ–∞–ї–Њ—З–Ї—Г, —Г—Б—В—Г–њ–∞–ї–Є –±–µ–љ–Ј–Є–ї–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Г –њ–Њ –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –Ї –њ–Њ—Б–ї–µ–і–љ–µ–Љ—Г —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤ –Є —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Њ–≤. –Я—А–Є —Н—В–Њ–Љ —Б–њ–µ–Ї—В—А –Є—Е –і–µ–є—Б—В–≤–Є—П –±—Л–ї –≥–Њ—А–∞–Ј–і–Њ —И–Є—А–µ, —З–µ–Љ —Г –њ—А–Є—А–Њ–і–љ—Л—Е –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –њ—А–Є–Љ–µ–љ—П—В—М –Є—Е –њ—А–Є –Є–љ—Д–µ–Ї—Ж–Є—П—Е, –≤—Л–Ј—Л–≤–∞–µ–Љ—Л—Е –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–Љ–Є –±–∞–Ї—В–µ—А–Є—П–Љ–Є. –С–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ—В–Є–≤ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞ –±—Л–ї–∞ –µ—Й–µ –Њ–і–љ–Є–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ, –±–ї–∞–≥–Њ–і–∞—А—П –Ї–Њ—В–Њ—А–Њ–Љ—Г –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –±—Л—Б—В—А–Њ –Ј–∞–љ—П–ї –ї–Є–і–Є—А—Г—О—Й–µ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ —Б—А–µ–і–Є –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤.
–Ч–∞—В–µ–Љ –±—Л–ї –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ —Б–Є–љ—В–µ–Ј –∞–љ—В–Є—Б–Є–љ–µ–≥–љ–Њ–є–љ—Л—Е –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ –Є —Б–Њ–Ј–і–∞–љ—Л –Є–љ–≥–Є–±–Є—В–Њ—А—Л –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е β––ї–∞–Ї—В–∞–Љ–∞–Ј: –Ї–ї–∞–≤—Г–ї–∞–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞, —Б—Г–ї—М–±–∞–Ї—В–∞–Љ –Є —В–∞–Ј–Њ–±–∞–Ї—В–∞–Љ. –Р–љ—В–Є—Б–Є–љ–µ–≥–љ–Њ–є–љ—Л–µ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л, –Є–Љ–µ—О—Й–Є–µ –љ–µ—В–Є–њ–Є—З–љ–Њ–µ β––ї–∞–Ї—В–∞–Љ–љ–Њ–µ –Ї–Њ–ї—М—Ж–Њ (—В–Є–Ї–∞—А—Ж–Є–ї–ї–Є–љ, –њ–Є–њ–µ—А–∞—Ж–Є–ї–ї–Є–љ, —Г—А–µ–Є–і–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л), —П–≤–ї—П—О—В—Б—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є —А–µ–Ј–µ—А–≤–∞. –Ъ–ї–∞–≤—Г–ї–∞–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞, —Б—Г–ї—М–±–∞–Ї—В–∞–Љ –Є —В–∞–Ј–Њ–±–∞–Ї—В–∞–Љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Є–Љ–µ—О—В —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –љ–Њ —Б–њ–Њ—Б–Њ–±–љ—Л –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Ј—Л. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б–µ–≥–Њ–і–љ—П –Љ–Њ–≥—Г—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П —В–∞–Ї–Є–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є, –Ї–∞–Ї –∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ/—Б—Г–ї—М–±–∞–Ї—В–∞–Љ, –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ/ –Ї–ї–∞–≤—Г–љ–∞—В, –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ/—Б—Г–ї—М–±–∞–Ї—В–∞–Љ, —В–Є–Ї–∞—А—Ж–Є–ї–ї–Є–љ/–Ї–ї–∞–≤—Г–љ–∞—В, –њ–Є–њ–µ—А–∞—Ж–Є–ї–ї–Є–љ/—В–∞–Ј–Њ–±–∞–Ї—В–∞–Љ [1,2].
–Ь–µ—Е–∞–љ–Є–Ј–Љ—Л —А–∞–Ј–≤–Є—В–Є—П
—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤
–У—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ –±–∞–Ї—В–µ—А–Є–Є –њ—А–Є–Њ–±—А–µ—В–∞—О—В —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М, —В–µ—А—П—П –Ї–∞–љ–∞–ї—Л (–њ–Њ—А–Є–љ—Л) –≤ –Њ–±–Њ–ї–Њ—З–Ї–µ, —З–µ—А–µ–Ј –Ї–Њ—В–Њ—А—Л–µ β––ї–∞–Ї—В–∞–Љ–љ—Л–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є –њ—А–Њ–љ–Є–Ї–∞—О—В –≤ –Ї–ї–µ—В–Ї—Г. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б–Є–љ–µ–≥–љ–Њ–є–љ–∞—П –њ–∞–ї–Њ—З–Ї–∞ –Њ–±–ї–∞–і–∞–µ—В —Н—Д—Д–ї—О–Ї—Б–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ, –±–ї–∞–≥–Њ–і–∞—А—П –Ї–Њ—В–Њ—А–Њ–Љ—Г –∞–љ—В–Є–±–Є–Њ—В–Є–Ї –≤—Л–±—А–∞—Б—Л–≤–∞–µ—В—Б—П –Є–Ј –Ї–ї–µ—В–Ї–Є –≤–Њ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–µ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–Њ. –Э–µ–Ї–Њ—В–Њ—А—Л–µ —И—В–∞–Љ–Љ—Л –≥–µ–Љ–Њ—Д–Є–ї—М–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Є –Є –Љ–Њ—А–∞–Ї—Б–µ–ї–ї—Л –њ—А–Њ–і—Г—Ж–Є—А—Г—О—В β––ї–∞–Ї—В–∞–Љ–∞–Ј—Л. –Я–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Є –љ–µ —Б–Є–љ—В–µ–Ј–Є—А—Г—О—В –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Ј—Г, –Љ–µ—Е–∞–љ–Є–Ј–Љ —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є —Б–≤—П–Ј–∞–љ —Б –Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є–µ–Љ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Б–≤—П–Ј—Л–≤–∞—О—Й–Є—Е –±–µ–ї–Ї–Њ–≤ (–Я–°–Т), —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ —Б–Є–љ—В–µ–Ј–µ –Љ–Є–Ї—А–Њ–±–љ–Њ–є —Б—В–µ–љ–Ї–Є, – —Н—В–Њ –Њ—Б–љ–Њ–≤–љ–Њ–є —Б—Г–±—Б—В—А–∞—В, –љ–∞ –Ї–Њ—В–Њ—А—Л–є –і–µ–є—Б—В–≤—Г—О—В β––ї–∞–Ї—В–∞–Љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –і–ї—П –њ—А–µ–Њ–і–Њ–ї–µ–љ–Є—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —В–Њ–ї—М–Ї–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Њ–Ј—Л β––ї–∞–Ї—В–∞–Љ–љ—Л—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, –і–Њ–±–∞–≤–Ї–∞ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ β––ї–∞–Ї—В–∞–Љ–∞–Ј –≤ –і–∞–љ–љ–Њ–Љ —Б–ї—Г—З–∞–µ –љ–µ –Є–Љ–µ–µ—В –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П. –†–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ј–Њ–ї–Њ—В–Є—Б—В—Л—Е —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Њ–≤ –Ї –Њ–Ї—Б–∞– –Є –Љ–µ—В–Є—Ж–Є–ї–ї–Є–љ—Г (MRSA) –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В—Б—П –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Њ—Б–Њ–±–Њ–≥–Њ –±–µ–ї–Ї–∞ – –Я–°–Т2–∞. –Ь–љ–Њ–≥–Є–µ –Љ–Є–Ї—А–Њ–±—Л –њ—А–Є–Њ–±—А–µ—В–∞—О—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ –Є–љ–∞–Ї—В–Є–≤–Є—А–Њ–≤–∞—В—М –Љ–∞–Ї—А–Њ–ї–Є–і—Л, –ї–Є–љ–Ї–Њ–Ј–∞–Љ–Є–і—Л, –∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–Њ–Ј–Є–і—Л, –і—А—Г–≥–Є–µ –Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г—О—В –Љ–Є—И–µ–љ–Є –і–µ–є—Б—В–≤–Є—П —В–µ—Е –ґ–µ –Ї–ї–∞—Б—Б–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ –≥–ї–Є–Ї–Њ–њ–µ–њ—В–Є–і–Њ–≤, —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤, —Б—Г–ї—М—Д–∞–љ–Є–ї–∞–Љ–Є–і–Њ–≤. –°—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Є –≤—Л–±—А–∞—Б—Л–≤–∞—О—В (—Н—Д—Д–ї—О–Ї—Б–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ) 14– –Є 15–—З–ї–µ–љ–љ—Л–µ –Љ–∞–Ї—А–Њ–ї–Є–і—Л. –°—Г—Й–µ—Б—В–≤—Г—О—В –Є —Б–Є—Б—В–µ–Љ—Л –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–Є–µ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ –Ј–∞—Й–Є—В—Г –Њ—В –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –≥—А—Г–њ–њ. –†–∞–Ј–≤–Є—В–Є–µ —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –Ї –Њ–і–љ–Њ–Љ—Г –њ—А–µ–њ–∞—А–∞—В—Г –љ–µ—А–µ–і–Ї–Њ —Б–љ–Є–ґ–∞–µ—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –њ—А–µ–њ–∞—А–∞—В–∞–Љ –і—А—Г–≥–Є—Е –≥—А—Г–њ–њ (—В–∞–±–ї. 1, 2).
–°–Њ—З–µ—В–∞–љ–Є–µ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ —Б –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є β––ї–∞–Ї—В–∞–Љ–∞–Ј, –≤–Њ––њ–µ—А–≤—Л—Е, –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є β––ї–∞–Ї—В–∞–Љ–∞–Ј–∞–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е —И—В–∞–Љ–Љ–Њ–≤, –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –Ї –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Љ –±–∞–Ї—В–µ—А–Є–є: —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Њ–≤ (–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е), H. influenzae, M. catarrhalis, –Ї–Є—И–µ—З–љ—Л—Е –±–∞–Ї—В–µ—А–Є–є –Є –і—А—Г–≥–Є—Е. –Т–Њ––≤—В–Њ—А—Л—Е, –і–Њ–±–∞–≤–ї–µ–љ–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ—П–≤–ї–µ–љ–Є—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —А—П–і–∞ –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ (Klebsiella spp., Proteus vulgaris, Citobacter), –Є–Љ–µ—О—Й–Є—Е –њ—А–Є—А–Њ–і–љ—Г—О —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Љ.
–£ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ (—В–∞–Ї –ґ–µ –Ї–∞–Ї —Г –Ї–∞—А–±–∞–њ–µ–љ–µ–Љ–Њ–≤ –Є –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ—Л—Е —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–Њ–≤ III–IV –њ–Њ–Ї–Њ–ї–µ–љ–Є–є) —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≤–µ–і—Г—Й–µ–≥–Њ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –Є–љ—Д–µ–Ї—Ж–Є–є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є –Ы–Ю–†––Њ—А–≥–∞–љ–Њ–≤ – –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞. –£—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М S. pneumoniae –Ї β––ї–∞–Ї—В–∞–Љ–љ—Л–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–µ–є –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–—Б–≤—П–Ј—Л–≤–∞—О—Й–µ–≥–Њ –±–µ–ї–Ї–∞ (–Я–°–С) – –Љ–Є—И–µ–љ–Є –і–µ–є—Б—В–≤–Є—П –і–ї—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –Ї–ї–µ—В–Ї–µ, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є –њ–Њ–і–∞–≤–ї—П—О—Й–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є (–Ь–Я–Ъ) –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є —Б–љ–Є–ґ–µ–љ–Є—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Б –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є β––ї–∞–Ї—В–∞–Љ–∞–Ј –Љ–∞–ї–Њ –≤–ї–Є—П–µ—В –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –µ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Љ –љ–µ —Б–≤—П–Ј–∞–љ —Б –њ—А–Њ–і—Г–Ї—Ж–Є–µ–є β––ї–∞–Ї—В–∞–Љ–∞–Ј. –Я–Њ—Н—В–Њ–Љ—Г –і–ї—П –љ–∞–і–µ–ґ–љ–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –њ—А–Њ—В–Є–≤ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞, –њ—А–µ–≤—Л—И–∞—О—Й–Є–µ –Ь–Я–Ъ –і–ї—П —И—В–∞–Љ–Љ–Њ–≤, —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Г. –≠—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М –і–Њ—Б—В–Є–≥–љ—Г—В–Њ —В–Њ–ї—М–Ї–Њ –њ—Г—В–µ–Љ –њ–Њ–≤—Л—И–µ–љ–Є—П –µ–≥–Њ –і–Њ–Ј—Л. –Э–Є–Ј–Ї–∞—П —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –і–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л —Н—В–Њ–≥–Њ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞.
–Т –Љ–Є—А–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –љ–µ—Г–Ї–ї–Њ–љ–љ–∞—П —В–µ–љ–і–µ–љ—Ж–Є—П —А–Њ—Б—В–∞ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є S. pneumoniae –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Г, —З—В–Њ –Њ–њ—А–µ–і–µ–ї—П–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ–µ—А–µ—Б–Љ–Њ—В—А–∞ –њ—А–Є–љ—Ж–Є–њ–Њ–≤ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤—Л—Е –Є–љ—Д–µ–Ї—Ж–Є—П—Е. –Т 1998–2000 –≥–≥. –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–µ—Б—П—В–Ї–∞—Е —Ж–µ–љ—В—А–Њ–≤ 26 —Б—В—А–∞–љ (–≤ —В–Њ–Љ —З–Є—Б–ї–µ –≤ –†–Њ—Б—Б–Є–Є) –њ—А–Њ–≤–µ–і–µ–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤ —Е–Њ–і–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М 18 000 —И—В–∞–Љ–Љ–Њ–≤ –Њ—Б–љ–Њ–≤–љ—Л—Е –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Є–љ—Д–µ–Ї—Ж–Є–є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є –Ы–Ю–†––Њ—А–≥–∞–љ–Њ–≤ (S. pneumoniae, H. influenzae –Є M. catarrhalis) –Ї 23 –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ. –†–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Г (–Ь–Я–Ъ≥2 –Љ–≥/–ї) –±—Л–ї–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —Г 18,2% —И—В–∞–Љ–Љ–Њ–≤ S. pneumoniae [4]. –Э–∞–Є–±–Њ–ї—М—И–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞ —Б—А–µ–і–Є β––ї–∞–Ї—В–∞–Љ–љ—Л—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —Г –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞ (2000/125 –Љ–≥) – 97,9%. –Р–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ—В–Є–≤ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞ —Г –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞ —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ–Љ –і–µ–є—Б—В–≤—Г—О—Й–Є—Е –≤–µ—Й–µ—Б—В–≤ –±—Л–ї–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–µ–љ—М—И–µ – 95,5%, –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –Є —Ж–µ—Д—В—А–Є–∞–Ї—Б–Њ–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 95,1%. –Э–∞–Є–±–Њ–ї—М—И–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б—А–µ–і–Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤—Б–µ—Е –≥—А—Г–њ–њ –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —В–Њ–ї—М–Ї–Њ —Г —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤ – 98,5–98,9%.
–Я–Њ –і–∞–љ–љ—Л–Љ —А–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є «–Я–µ–У–Р–°–III», –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –≤ 2006–2009 –≥–≥. –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–µ—Б—П—В–Ї–∞—Е –≥–Њ—А–Њ–і–Њ–≤ —Б—В—А–∞–љ—Л, —Г—А–Њ–≤–µ–љ—М —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є S. pneumoniae (–≤–Ї–ї—О—З–∞—П —И—В–∞–Љ–Љ—Л —Б —Г–Љ–µ—А–µ–љ–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М—О) –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Г —Б–Њ—Б—В–∞–≤–ї—П–µ—В 11,2%. –Ґ–Њ –µ—Б—В—М —Д–Њ—А–Љ–∞–ї—М–љ–Њ –њ—А–µ–≤—Л—И–µ–љ —Г—А–Њ–≤–µ–љ—М —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є, –њ–Њ—Б–ї–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –і–ї—П —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–є, –≤ —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ –Ї–Њ—В–Њ—А—Л—Е —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Г—О —А–Њ–ї—М –Є–≥—А–∞—О—В –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Є. –Э–Њ, –њ–Њ –і–∞–љ–љ—Л–Љ —Н—В–Њ–≥–Њ –ґ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –≤ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –і–Њ–Ј–µ –Є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ–Љ –і–µ–є—Б—В–≤—Г—О—Й–Є—Е –≤–µ—Й–µ—Б—В–≤ —Б–Њ—Е—А–∞–љ—П—О—В –≤—Л—Б–Њ–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ—В–Є–≤ S. pneumoniae – –ї–Є—И—М 0,4% —И—В–∞–Љ–Љ–Њ–≤ –њ—А–Њ—П–≤–ї—П—О—В —Г–Љ–µ—А–µ–љ–љ—Г—О —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М.
–І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є H. influenzae –Ї –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ, —В–Њ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б—В—А–∞–љ–∞—Е –Њ–љ–∞ –і–Њ—Б—В–∞—В–Њ—З–љ–∞ –≤–∞—А–Є–∞–±–µ–ї—М–љ–∞. –Т–Њ –Љ–љ–Њ–≥–Є—Е —Б—В—А–∞–љ–∞—Е –≥–µ–Љ–Њ—Д–Є–ї—М–љ–∞—П –њ–∞–ї–Њ—З–Ї–∞ –њ—А–Є–Њ–±—А–µ–ї–∞ —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –Ї –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Љ – –љ–∞ 30–50% –Є –±–Њ–ї–µ–µ. –£–ґ–µ –≤ 1980–—Е –≥–≥. –њ–Њ—П–≤–Є–ї–Є—Б—М —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ —В–Њ–Љ, —З—В–Њ —З–∞—Б—В–Њ—В–∞ β––ї–∞–Ї—В–∞–Љ–∞–Ј–∞––Њ–њ–Њ—Б—А–µ–і—Г–µ–Љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ—Г —Б—А–µ–і–Є –љ–µ—В–Є–њ–Є—А—Г–µ–Љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ –≥–µ–Љ–Њ—Д–Є–ї—М–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Є –≤ –°–µ–≤–µ—А–љ–Њ–є –Р–Љ–µ—А–Є–Ї–µ –і–Њ—Б—В–Є–≥–ї–∞ 15–16%. –Т –Х–≤—А–Њ–њ–µ —З–∞—Б—В–Њ—В–∞ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ –≥–µ–Љ–Њ—Д–Є–ї—М–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Є –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 13 –і–Њ 31%. –Т –†–Њ—Б—Б–Є–Є —Б–Є—В—Г–∞—Ж–Є—П –≤—Л–≥–ї—П–і–Є—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Њ–њ—В–Є–Љ–Є—Б—В–Є—З–љ–Њ: 90–95% —И—В–∞–Љ–Љ–Њ–≤ –≥–µ–Љ–Њ—Д–Є–ї—М–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л –Ї –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ—Г –Є 100% – –Ї –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ—Г/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В—Г –Є —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–∞–Љ III–IV –њ–Њ–Ї–Њ–ї–µ–љ–Є–є.
–Р–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –≤ —В–µ—А–∞–њ–Є–Є
—Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –±—А–Њ–љ—Е–Є—В–∞ (–•–С)
–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–є
–±–Њ–ї–µ–Ј–љ–Є –ї–µ–≥–Ї–Є—Е (–•–Ю–С–Ы)
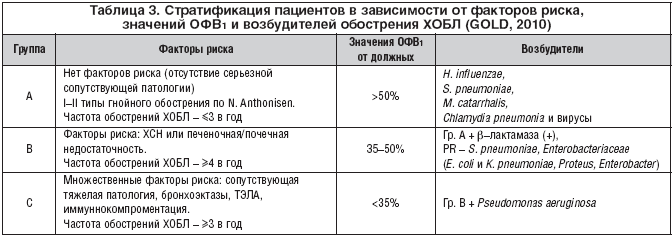
–Я–Њ––њ—А–µ–ґ–љ–µ–Љ—Г –ї–Є–і–µ—А—Б—В–≤–Њ –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П—Е –•–С –Є –•–Ю–С–Ы —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –Ј–∞ —В–∞–Ї–Є–Љ–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є –∞–≥–µ–љ—В–∞–Љ–Є, –Ї–∞–Ї H. influenzae, S. pneumoniae –Є M. catarrhalis. –†–Њ–ї—М Enterobacteriaceae, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є Klebsiella pneumoniae, –Є –љ–µ—Д–µ—А–Љ–µ–љ—В–Є—А—Г—О—Й–Є—Е –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –±–∞–Ї—В–µ—А–Є–є (Pseudomonas aeruginosa) –≤–Њ–Ј—А–∞—Б—В–∞–µ—В —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –Є–Љ–µ—О—Й–Є—Е —В—П–ґ–µ–ї—Г—О —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й—Г—О –њ–∞—В–Њ–ї–Њ–≥–Є—О –Є/–Є–ї–Є –≤—Л—А–∞–ґ–µ–љ–љ—Г—О –±—А–Њ–љ—Е–Є–∞–ї—М–љ—Г—О –Њ–±—Б—В—А—Г–Ї—Ж–Є—О (–Ю–§–Т1 –Љ–µ–љ–µ–µ 40% –Њ—В –і–Њ–ї–ґ–љ—Л—Е –Є/–Є–ї–Є –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—П –≤ –±—А–Њ–љ—Е–Њ—Н–Ї—В–∞–Ј—Л). –Р—В–Є–њ–Є—З–љ—Л–µ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–Є –Ї–∞–Ї –њ—А–Є—З–Є–љ–∞ –Њ–±–Њ—Б—В—А–µ–љ–Є—П –≤—Б—В—А–µ—З–∞—О—В—Б—П –≥–Њ—А–∞–Ј–і–Њ —А–µ–ґ–µ (GOLD, 2010).
–Ю–±–Њ—Б—В—А–µ–љ–Є—П, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –≤–Є—А—Г—Б–љ—Л–Љ–Є –Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ–Є, –≤–Њ–Ј–љ–Є–Ї–∞—О—В –њ—А–Є –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є–Є –≤–Є—А—Г—Б–∞–Љ–Є (—А–Є–љ–Њ–≤–Є—А—Г—Б, –†–°–Т) –≤ 40–64% —Б–ї—Г—З–∞–µ–≤, H. influenzae – –≤ 30–70%, M. catarrhalis – –≤ 8–13%, S. pneumoniae – –≤ 20–25%, –њ—А–Є –њ–Њ–ї–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П – –≤ 12–22% —Б–ї—Г—З–∞–µ–≤.
–Т—Б–µ–≥–і–∞ –ї–Є –і–Њ–ї–ґ–љ—Л –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–Є –•–С –Є –•–Ю–С–Ы? –Я—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ –≤—А–∞—З–Є —Б—З–Є—В–∞—О—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ –ї–µ—З–Є—В—М –•–С –Є –•–Ю–С–Ы –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –≤–Њ–њ—А–Њ—Б –Њ–± –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –њ—А–Є—З–Є–љ–∞—Е –Њ–±–Њ—Б—В—А–µ–љ–Є–є –•–С –Є –•–Ю–С–Ы –Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –≤ —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е –Њ—Б—В–∞–µ—В—Б—П –љ–µ—А–µ—И–µ–љ–љ—Л–Љ. –≠—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б —В–µ–Љ, —З—В–Њ –љ–µ—А–µ–і–Ї–Њ –њ—А–Є—З–Є–љ–Њ–є –Њ–±–Њ—Б—В—А–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П –≤–Є—А—Г—Б–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П, —З–∞—Б—В–Њ –Њ—В–Љ–µ—З–∞—О—В—Б—П —Б–ї—Г—З–∞–Є –Є —Б–њ–Њ–љ—В–∞–љ–љ–Њ–≥–Њ –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є—П. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–∞ –Ї—А—Г–њ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–µ —Г–і–∞–ї–Њ—Б—М –≤—Л—П–≤–Є—В—М —З–µ—В–Ї–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы, –Њ–і–љ–∞–Ї–Њ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М, —З—В–Њ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –њ–Њ–≤–ї–Є—П–ї–∞ –љ–∞ —Б—А–Њ–Ї–Є —А–∞–Ј—А–µ—И–µ–љ–Є—П –Њ–±–Њ—Б—В—А–µ–љ–Є—П [5].
–Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –±—Л–ї–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы –њ—А–Є —Г—Б–Є–ї–µ–љ–Є–Є –Њ–і—Л—И–Ї–Є, –≥–љ–Њ–є–љ–Њ–Љ —Е–∞—А–∞–Ї—В–µ—А–µ –Љ–Њ–Ї—А–Њ—В—Л –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ (—В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ «–≤–Є–љ–љ–Є–њ–µ–≥—Б–Ї–Є–µ» –Ї—А–Є—В–µ—А–Є–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П –•–С, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ—Л–µ N. Anthonisen –Є —Б–Њ–∞–≤—В.). –Я—А–Є –љ–∞–ї–Є—З–Є–Є –Њ–і–љ–Њ–≥–Њ––і–≤—Г—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Є–Ј –≤—Л—И–µ–љ–∞–Ј–≤–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ–љ–∞–Љ–љ–Њ–≥–Њ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –њ–ї–∞—Ж–µ–±–Њ (—В–∞–±–ї. 3).
–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы, –Њ—Б–Њ–±–µ–љ–љ–Њ —В—П–ґ–µ–ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П, –і–∞–ґ–µ –≤ –њ–µ—А–Є–Њ–і —А–µ–Љ–Є—Б—Б–Є–Є –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В –Ї–Њ–љ—В–∞–Љ–Є–љ–∞—Ж–Є—П –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ –і–µ—А–µ–≤–∞ –њ–∞—В–Њ–≥–µ–љ–љ–Њ–є —Д–ї–Њ—А–Њ–є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П —А–Њ–ї—М –Љ–Є–Ї—А–Њ–±–љ–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є –≤ —А–∞–Ј–≤–Є—В–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ–±–Њ—Б—В—А–µ–љ–Є–є –•–Ю–С–Ы, —З—В–Њ –Њ–њ—А–∞–≤–і—Л–≤–∞–µ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ —Б —Ж–µ–ї—М—О —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤.
–°–Њ–≥–ї–∞—Б–љ–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–µ –Њ–±–Њ—Б—В—А–µ–љ–Є–µ –•–Ю–С–Ы/–•–С –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є, –≤—Л–Ј—Л–≤–∞–µ–Љ–Њ–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞–Љ–Є, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Ї–Њ—В–Њ—А—Л—Е –њ—А–µ–≤—Л—И–∞–µ—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л–є –њ–Њ—А–Њ–≥. β––ї–∞–Ї—В–∞–Љ—Л –Њ—Б—В–∞—О—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –≤ –ї–µ—З–µ–љ–Є–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–є –•–Ю–С–Ы/–•–С. –Ю—Б–љ–Њ–≤–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–Њ–є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П β––ї–∞–Ї—В–∞–Љ–Њ–≤ –њ—А–Є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є—П—Е —П–≤–ї—П–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є S. pneumoniae –Є —А–∞–Ј—А—Г—И–∞—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ β––ї–∞–Ї—В–∞–Љ–∞–Ј, –њ—А–Њ–і—Г—Ж–Є—А—Г–µ–Љ—Л—Е H. influenzae –Є M. catarrhalis. –Я—А–Њ–±–ї–µ–Љ–∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞, –Љ–Њ–ґ–µ—В –≤–Њ–Ј–љ–Є–Ї–∞—В—М –≤ —А–µ–≥–Є–Њ–љ–∞—Е —Б –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є S. pneumoniae, —Б —З–µ–Љ, –≤–µ—А–Њ—П—В–љ–Њ, —Б–≤—П–Ј–∞–љ—Л –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Є–ї–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –•–Ю–С–Ы/–•–С. –Я–Њ—Н—В–Њ–Љ—Г –њ—А–Є —Г—З–µ—В–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞—В—М—Б—П –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –љ–∞ —Г—А–Њ–≤–µ–љ—М —А–µ–≥–Є–Њ–љ–∞–ї—М–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤–Њ–є –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є [6].
–Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–є –≤—А–∞—З –і–∞–ї–µ–Ї–Њ –љ–µ –≤—Б–µ–≥–і–∞ –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ –Њ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Њ—Б–љ–Њ–≤–љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–Њ–≤ –≤ —Б–≤–Њ–µ–є —Б—В—А–∞–љ–µ/—А–µ–≥–Є–Њ–љ–µ/–Њ–±–ї–∞—Б—В–Є. –Я–Њ–Ї–∞–Ј–∞–љ–Є—П –і–ї—П –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ –Є –Є–љ–≥–Є–±–Є—В–Њ—А–Ј–∞—Й–Є—Й–µ–љ–љ—Л—Е –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ –≤–Њ –Љ–љ–Њ–≥–Њ–Љ —Б–Њ–≤–њ–∞–і–∞—О—В. –Я—А–Є —Н—В–Њ–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ –±–Њ–ї–µ–µ –Њ–њ—А–∞–≤–і–∞–љ–Њ –њ—А–Є –ї–µ–≥–Ї–Є—Е –Є –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є—П—Е, –∞ –Є–љ–≥–Є–±–Є—В–Њ—А–Ј–∞—Й–Є—Й–µ–љ–љ—Л—Е –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е – –њ—А–Є –±–Њ–ї–µ–µ —В—П–ґ–µ–ї—Л—Е –Є–ї–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є—Е –Є–љ—Д–µ–Ї—Ж–Є—П—Е, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –і–∞–љ–љ—Л—Е –Њ –≤—Л—Б–Њ–Ї–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є β––ї–∞–Ї—В–∞–Љ–Њ–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е –њ–∞—В–Њ–≥–µ–љ–Њ–≤. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –њ–Њ–Ї–∞–Ј–∞–љ –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П—Е –•–С –Є –•–Ю–С–Ы, –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є—Е—Б—П —В—П–ґ–µ–ї–Њ–є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є, —З–∞—Б—В–Њ—В–Њ–є –Њ–±–Њ—Б—В—А–µ–љ–Є—П –љ–µ –±–Њ–ї–µ–µ 2–—Е —А–∞–Ј –≤ –≥–Њ–і –Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –Ю–§–Т1 –љ–µ –Љ–µ–љ–µ–µ 50%.
–Р–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –њ—А–Є –ї–µ—З–µ–љ–Є–Є
–≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є (–Т–Я)
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ–Є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є —П–≤–ї—П—О—В—Б—П S. pneumoniae, H. influenzae, M. pneumoniae, C. pneumoniae, L. pneumophilla, S. aureus, –∞–љ–∞—Н—А–Њ–±—Л. –Ъ–Њ–≥–і–∞ —А–µ—З—М –Ј–∞—Е–Њ–і–Є—В –Њ –њ–љ–µ–≤–Љ–Њ–љ–Є–Є, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —А–µ—И–∞–µ—В—Б—П –≤–Њ–њ—А–Њ—Б –Њ –Љ–µ—Б—В–µ –µ–µ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П (–≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–∞—П –Є–ї–Є –љ–Њ–Ј–Њ–Ї–Њ–Љ–Є–∞–ї—М–љ–∞—П), –Ј–∞—В–µ–Љ —Г—З–Є—В—Л–≤–∞—О—В—Б—П –≤–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–∞ –Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П. –≠—В–Є –Ї—А–Є—В–µ—А–Є–Є –њ–Њ–ї–Њ–ґ–µ–љ—Л –≤ –Њ—Б–љ–Њ–≤—Г –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є.
–Т –њ–µ—А–≤—Г—О –≥—А—Г–њ–њ—Г –≤–Ї–ї—О—З–µ–љ—Л –њ–∞—Ж–Є–µ–љ—В—Л –≤ –≤–Њ–Ј—А–∞—Б—В–µ –і–Њ 60 –ї–µ—В –±–µ–Ј —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –£ —Н—В–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –∞–і–µ–Ї–≤–∞—В–љ—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Њ—В–≤–µ—В –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–Њ–ї—Г—З–µ–љ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Я—А–µ–Њ–±–ї–∞–і–∞—О—Й–∞—П —З–∞—Б—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–Њ–ґ–µ—В –ї–µ—З–Є—В—М—Б—П –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ. –≠—В–Њ –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –±–Њ–ї—М–љ—Л–Љ —Б –љ–µ—В—П–ґ–µ–ї—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –Т–Я, —Г –Ї–Њ—В–Њ—А—Л—Е –Њ—В—Б—Г—В—Б—В–≤—Г—О—В —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –і—А—Г–≥–Є–µ «–Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г—О—Й–Є–µ» —Д–∞–Ї—В–Њ—А—Л. –Т –Ї–∞—З–µ—Б—В–≤–µ —Б—А–µ–і—Б—В–≤–∞ –≤—Л–±–Њ—А–∞ —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В—Б—П –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –Є–ї–Є –Љ–∞–Ї—А–Њ–ї–Є–і–љ—Л–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –∞–Љ–Њ–Ї—Б–Є–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л –љ–µ –і–µ–є—Б—В–≤—Г—О—В –љ–∞ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л–µ –∞—В–Є–њ–Є—З–љ—Л–µ –њ–∞—В–Њ–≥–µ–љ—Л (–ї–µ–≥–Є–Њ–љ–µ–ї–ї—Г, –Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ—Г –Є —Е–ї–∞–Љ–Є–і–Є–Є) –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤, —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤, –Ї–µ—В–Њ–ї–Є–і–Њ–≤ –Є –і–Њ–Ї—Б–Є—Ж–Є–Ї–ї–Є–љ–∞. –Ю–і–љ–∞–Ї–Њ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–µ –≤—Л—П–≤–Є–ї–Є —А–∞–Ј–ї–Є—З–Є–є –≤ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—В–Є—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, –∞ —В–∞–Ї–ґ–µ –Њ—В–і–µ–ї—М–љ—Л—Е –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–є –Ї–ї–∞—Б—Б–∞ –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –Є–ї–Є «—А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е» —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤.
–Т–Њ –≤—В–Њ—А—Г—О –≥—А—Г–њ–њ—Г –≤–Ї–ї—О—З–µ–љ—Л –ї–Є—Ж–∞ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (60 –ї–µ—В –Є —Б—В–∞—А—И–µ) –Є/–Є–ї–Є –њ–∞—Ж–Є–µ–љ—В—Л —Б —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є–Љ–Є –≤–ї–Є—П–љ–Є–µ –љ–∞ —Н—В–Є–Њ–ї–Њ–≥–Є—О –Є —П–≤–ї—П—О—Й–Є–Љ–Є—Б—П —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –њ—А–Њ–≥–љ–Њ–Ј–∞ –њ—А–Є –Т–Я. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Н—В–Њ–є –≥—А—Г–њ–њ—Л –∞–і–µ–Ї–≤–∞—В–љ—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–Њ–ї—Г—З–µ–љ –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤. –Ю–і–љ–∞–Ї–Њ –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —А–Њ–ї–Є –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ (–≤ —В–Њ–Љ —З–Є—Б–ї–µ –Њ–±–ї–∞–і–∞—О—Й–Є—Е –љ–µ–Ї–Њ—В–Њ—А—Л–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є) —Г —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е –≤–Њ–Ј—А–∞—Б—В–∞–µ—В, –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤—Л–±–Њ—А–∞ —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В—Б—П –Є–љ–≥–Є–±–Є—В–Њ—А–Ј–∞—Й–Є—Й–µ–љ–љ—Л–µ –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В). –Т –љ–µ—В—П–ґ–µ–ї—Л—Е —Б–ї—Г—З–∞—П—Е –ї–µ—З–µ–љ–Є–µ –Љ–Њ–ґ–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ. –Я–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –і–ї—П –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є —П–≤–ї—П—О—В—Б—П: –≤–Њ–Ј—А–∞—Б—В —Б—В–∞—А—И–µ 65 –ї–µ—В, –љ–∞–ї–Є—З–Є–µ —В—П–ґ–µ–ї–Њ–є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є (–•–Ю–С–Ы, —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В, –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–љ—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є –і—А.), –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ —Г—Е–Њ–і–∞ –Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –≤—А–∞—З–µ–±–љ—Л—Е –љ–∞–Ј–љ–∞—З–µ–љ–Є–є –≤ –і–Њ–Љ–∞—И–љ–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е, –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ —Б—В–∞—Ж–Є–Њ–љ–∞—А–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л–Љ –Є–ї–Є —З–ї–µ–љ–∞–Љ–Є –µ–≥–Њ —Б–µ–Љ—М–Є, –љ–∞–ї–Є—З–Є–µ –Њ–і–љ–Њ–≥–Њ –Є–Ј –Ї—А–Є—В–µ—А–Є–µ–≤ —В—П–ґ–µ–ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –њ–љ–µ–≤–Љ–Њ–љ–Є–Є, –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ —В–µ—З–µ–љ–Є–µ 72 —З.
–Ф–ї—П –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –љ–µ—В—П–ґ–µ–ї–Њ–є –Т–Я –Њ–±—Л—З–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –њ–µ—А–Њ—А–∞–ї—М–љ—Л–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –Њ—З–µ–≤–Є–і–љ—Л–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ —Б—В—Г–њ–µ–љ—З–∞—В–Њ–є —В–µ—А–∞–њ–Є–Є, –≤ —Б–Є–ї—Г —А–∞–Ј–љ—Л—Е –њ—А–Є—З–Є–љ (–Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –Є–ї–Є —Б–Њ–Љ–љ–µ–љ–Є–µ –≤ –Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є, —Б–ї–Њ–ґ–Є–≤—И–Є–µ—Б—П —Б—В–µ—А–µ–Њ—В–Є–њ—Л –Є —В.–і.) –Њ–љ–∞ –љ–µ –≤—Б–µ–≥–і–∞ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –љ–∞ –њ—А–∞–Ї—В–Є–Ї–µ. –Ш–Љ–µ—О—В—Б—П —Б–Њ–Њ–±—Й–µ–љ–Є—П, —З—В–Њ 75% –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є –Љ–Њ–≥–ї–Є –±—Л—В—М –њ–µ—А–µ–≤–µ–і–µ–љ—Л —Б –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –љ–∞ –њ–µ—А–Њ—А–∞–ї—М–љ—Л–є –њ—Г—В—М –≤–≤–µ–і–µ–љ–Є—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —З—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–Њ–Ї—А–∞—Й–∞–µ—В –Ј–∞—В—А–∞—В—Л –љ–∞ –ї–µ—З–µ–љ–Є–µ [7]. –Т –°–®–Р —Б—В—Г–њ–µ–љ—З–∞—В–∞—П —В–µ—А–∞–њ–Є—П –Њ–і–Њ–±—А–µ–љ–∞ FDA –Є –Є–Ј–ї–Њ–ґ–µ–љ–∞ –≤ –Њ–±—Й–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е —Н—В–Њ–є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є –њ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є. –Т–∞–ґ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –њ—А–Є —Б—В—Г–њ–µ–љ—З–∞—В–Њ–є —В–µ—А–∞–њ–Є–Є —П–≤–ї—П–µ—В—Б—П —Б—А–Њ–Ї –њ–µ—А–µ–≤–Њ–і–∞ –њ–∞—Ж–Є–µ–љ—В–∞ –љ–∞ –њ–µ—А–Њ—А–∞–ї—М–љ—Л–є –њ—Г—В—М –≤–≤–µ–і–µ–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞: –Њ–±—Л—З–љ–Њ —Н—В–Њ —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—П –Є–ї–Є —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –љ–∞ 2–3 —Б—Г—В., –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—М –Є –µ–≥–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Љ–Њ–≥—Г—В –±—Л—В—М —Г–ґ–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Њ–≤–µ—Б—В–Є –Ї–Њ—А—А–µ–Ї—Ж–Є—О —В–µ—А–∞–њ–Є–Є.
–Р–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –њ—А–Є –ї–µ—З–µ–љ–Є–Є
–≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є
–Ь–∞–∞—Б—В—А–Є—Е—В—Б–Ї–Є–Љ–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є (III) –≤ –Ї–∞—З–µ—Б—В–≤–µ —В–µ—А–∞–њ–Є–Є –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –Њ–њ—А–µ–і–µ–ї–µ–љ—Л —В—А–µ—Е–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–љ—Л–µ —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П: –њ–Њ 2 —А–∞–Ј–∞/—Б—Г—В. —В–∞–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л, –Ї–∞–Ї –Є–љ–≥–Є–±–Є—В–Њ—А –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л (–Ш–Я–Я) –≤ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –і–Њ–Ј–Є—А–Њ–≤–Ї–µ + –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ 500 –Љ–≥ + –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ – 1000 –Љ–≥ –Є–ї–Є –Љ–µ—В—А–Њ–љ–Є–і–∞–Ј–Њ–ї – 400 –Є–ї–Є 500 –Љ–≥. –Ь–Є–љ–Є–Љ–∞–ї—М–љ–∞—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —В—А–Њ–є–љ–Њ–є —В–µ—А–∞–њ–Є–Є – 7 –і–љ–µ–є, –љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ 14––і–љ–µ–≤–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ –ї–µ—З–µ–љ–Є—П –њ–Њ–≤—Л—И–∞–µ—В –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М.
–Ф–ї—П —Б—В—А–∞–љ, –≤ –Ї–Њ—В–Њ—А—Л—Е –њ—А–µ–њ–∞—А–∞—В—Л –≤–Є—Б–Љ—Г—В–∞ –љ–µ–і–Њ—Б—В—Г–њ–љ—Л, –Є –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—Е–µ–Љ –≤—В–Њ—А–Њ–є –ї–Є–љ–Є–Є –Ь–∞–∞—Б—В—А–Є—Е—В—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є (III) –њ—А–µ–і–ї–Њ–ґ–Є–ї–Є –≤–∞—А–Є–∞–љ—В—Л —В—А–Њ–є–љ–Њ–є —В–µ—А–∞–њ–Є–Є: –Ш–Я–Я + –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ + —В–µ—В—А–∞—Ж–Є–Ї–ї–Є–љ + –Љ–µ—В—А–Њ–љ–Є–і–∞–Ј–Њ–ї.
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П —Г–і–µ–ї—П–µ—В—Б—П –Љ–љ–Њ–≥–Њ –≤–љ–Є–Љ–∞–љ–Є—П –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б–Њ–≥–ї–∞—Б–љ–Њ –љ–Њ–≤–Њ–є —Б—Е–µ–Љ–µ —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є Helicobacter pylori. –Я–µ—А–≤—Л–µ 5 –і–љ–µ–є –љ–∞–Ј–љ–∞—З–∞—О—В –Ш–Я–Я –≤ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –і–Њ–Ј–µ 2 —А–∞–Ј–∞/—Б—Г—В. –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–Њ–Љ (2000 –Љ–≥/—Б—Г—В.); –Ј–∞—В–µ–Љ –≤ —В–µ—З–µ–љ–Є–µ –µ—Й–µ 5 –і–љ–µ–є – –Ш–Я–Я –≤ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –і–Њ–Ј–µ 2 —А–∞–Ј–∞/—Б—Г—В. –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ (1000 –Љ–≥/—Б—Г—В.) –Є —В–Є–љ–Є–і–∞–Ј–Њ–ї–Њ–Љ (1000 –Љ–≥/—Б—Г—В.).
–Ю—Б–љ–Њ–≤–љ–Њ–µ –Љ–µ—Б—В–Њ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –≤ —А—П–і—Г –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є —В–µ—А–∞–њ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є H. pylori –±—Л–ї–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ –Є –њ—А–Є —Б–Њ–Ј–і–∞–љ–Є–Є –Ь–∞–∞—Б—В—А–Є—Е—В—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є (IV) [12].
–Р–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –±—Л–ї –њ–µ—А–≤—Л–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–Љ, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–Љ –і–ї—П —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є H. pylori –Є–Ј––Ј–∞ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ–Њ–≥–Њ –Њ—В—Б—Г—В—Б—В–≤–Є—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –љ–µ–Љ—Г –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Р–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ —Б–Њ–Ј–і–∞–µ—В –≤—Л—Б–Њ–Ї–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ, —Б–ї–Њ–µ —Б–ї–Є–Ј–Є, —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–Љ –ґ–µ–ї—Г–і–Ї–∞. –§–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–∞ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ (–≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞) –љ–µ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П –њ—А–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —Б –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–Љ–Є –≤ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Я—А–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Б –Ш–Я–Я –љ–∞–±–ї—О–і–∞–µ—В—Б—П —А–Э––Ј–∞–≤–Є—Б–Є–Љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –∞–љ—В–Є–≥–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ —Б —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –Ь–Я–Ъ –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї H. pylori.
–Ю–і–љ–∞–Ї–Њ —А–∞–Ј–≤–Є—В–Є–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ. –Ґ–Њ—З–µ—З–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ pbp1 –њ—А–Є–≤–Њ–і—П—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –∞—Д—Д–Є–љ–љ–Њ—Б—В–Є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –Є —Н—В–Њ–≥–Њ –±–µ–ї–Ї–∞ –Є —П–≤–ї—П—О—В—Б—П –≥–ї–∞–≤–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є —Б–љ–Є–ґ–µ–љ–Є—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є H. pylori. –Ґ–Њ—З–µ—З–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≤ hopB –Є –і–µ–ї–µ—Ж–Є—П –≤ hopC, —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є—Е –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–∞–љ–∞–ї–Њ–≤, —З–µ—А–µ–Ј –Ї–Њ—В–Њ—А—Л–µ –њ–µ–љ–µ—В—А–Є—А—Г—О—В –љ–µ–Ї–Њ—В–Њ—А—Л–µ –≤–µ—Й–µ—Б—В–≤–∞, –њ—А–Є–≤–Њ–і—П—В –Ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г –њ–Њ–≤—Л—И–µ–љ–Є—О –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є –Є–љ–≥–Є–±–Є—А—Г—О—Й–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞. –Я—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В—М –Љ–µ–Љ–±—А–∞–љ—Л —В–∞–Ї–ґ–µ –Ј–∞–≤–Є—Б–Є—В –Њ—В –≥–µ–љ–Њ–≤ omp25 –Є omp32, —В–Њ—З–µ—З–љ—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≤ –Ї–Њ—В–Њ—А—Л—Е —В–∞–Ї–ґ–µ –љ–∞–Ј–≤–∞–љ—Л –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Є—З–Є–љ —А–∞–Ј–≤–Є—В–Є—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є H. pylori –Ї –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ—Г [8].
–Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–µ —Б–ї—Г—З–∞–Є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є H. pylori –Ї –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ—Г –љ–µ–Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л –љ–∞ —Д–Њ–љ–µ –≤—Л—Б–Њ–Ї–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –і—А—Г–≥–Є–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ (–Ї—А–Њ–Љ–µ —Б—В—А–∞–љ –Р—Д—А–Є–Ї–Є –Є –Р–Ј–Є–Є) (—В–∞–±–ї. 4).
–Ф–Є–љ–∞–Љ–Є–Ї–∞ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є (–≤ %) –Ї –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ—Г —Г —И—В–∞–Љ–Љ–Њ–≤ H. pylori, –≤—Л–і–µ–ї–µ–љ–љ—Л—Е —Г –≤–Ј—А–Њ—Б–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Ь–Њ—Б–Ї–≤–µ –≤ 1996–2001 –≥–≥., –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –Ы.–Т. –Ъ—Г–і—А—П–≤—Ж–µ–≤–Њ–є –≤ 2004 [10]. –Т 1996 –≥. –≤ –Ь–Њ—Б–Ї–≤–µ –±—Л–ї–Њ –≤—Л–і–µ–ї–µ–љ–Њ 3 —И—В–∞–Љ–Љ–∞ H. pylori, —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е –Ї –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ—Г, –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ —В–∞–Ї–Є–µ –љ–∞—Е–Њ–і–Ї–Є –љ–µ –њ–Њ–≤—В–Њ—А—П–ї–Є—Б—М.
–Т —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –Є–Ј—Г—З–µ–љ–Є—О –≤–ї–Є—П–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ—Л—Е —Б—Е–µ–Љ –љ–∞ –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Г –Ї–Є—И–µ—З–љ–Є–Ї–∞, –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –њ—А–µ–њ–∞—А–∞—В—Л 7 –і–љ–µ–є –њ–Њ —В—А–Њ–є–љ–Њ–є —Б—Е–µ–Љ–µ: –≤ –Њ–і–љ–Њ–Љ —Б–ї—Г—З–∞–µ –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї 20 –Љ–≥, –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ 1000 –Љ–≥ –Є –Љ–µ—В—А–Њ–љ–Є–і–∞–Ј–Њ–ї 400 –Љ–≥ 2 —А–∞–Ј–∞/—Б—Г—В., –≤ –і—А—Г–≥–Њ–Љ —Б–ї—Г—З–∞–µ – –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї 20 –Љ–≥, –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ 250 –Љ–≥ –Є –Љ–µ—В—А–Њ–љ–Є–і–∞–Ј–Њ–ї 400 –Љ–≥ 2 —А–∞–Ј–∞/—Б—Г—В., –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–∞ –Њ—А–Њ—Д–∞—А–Є–љ–≥–µ–∞–ї—М–љ–Њ–є, –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –Є –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л, –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ —Б—Е–µ–Љ—Г –ї–µ—З–µ–љ–Є—П –Ї–Њ—В–Њ—А—Л—Е –≤—Е–Њ–і–Є–ї –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ [11].
–Р–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ
–≤ –њ—А–∞–Ї—В–Є–Ї–µ –≤—А–∞—З–∞––њ–µ–і–Є–∞—В—А–∞
–£ –Љ–∞–ї–µ–љ—М–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –Є –Ы–Ю–†––Њ—А–≥–∞–љ–Њ–≤ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –Є–Љ–µ–µ—В —Б–≤–Њ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є. –Я—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —В–Њ—З–љ—Л—Е –і–∞–љ–љ—Л—Е –Њ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ —А–µ—И–µ–љ–Є–µ –Њ –≤—Л–±–Њ—А–µ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –љ–∞—Ж–µ–ї–µ–љ–Њ –љ–∞ —В–Њ, —З—В–Њ–±—Л –Њ—Е–≤–∞—В–Є—В—М —Б–њ–µ–Ї—В—А –Њ—Б–љ–Њ–≤–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є. –Т –Ы–Ю–†––њ—А–∞–Ї—В–Є–Ї–µ —З–∞—Й–µ –≤—Б–µ–≥–Њ –њ—А–Є—Е–Њ–і–Є—В—Б—П —Б—В–∞–ї–Ї–Є–≤–∞—В—М—Б—П —Б –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є —Б—А–µ–і–љ–µ–≥–Њ —Г—Е–∞, –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є –≥–ї–Њ—В–Ї–Є, –∞–љ–≥–Є–љ–∞–Љ–Є, —Б–Є–љ—Г—Б–Є—В–∞–Љ–Є, –Т–Я.
–Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —Б—А–µ–і–љ–µ–≥–Њ —Г—Е–∞ –Њ–±—Л—З–љ–Њ –≤—Л–Ј—Л–≤–∞—О—В S. pneumoniae, H. influenzae, M. pneumoniae, C. pneumoniae, L. pneumophilla, S. aureus, S. pyogenes –Р, –±–∞–Ї—В–µ—А–Њ–Є–і—Л, –і—А—Г–≥–Є–µ –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ –±–∞–Ї—В–µ—А–Є–Є (—Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П). –Я—А–Є –Є–љ—Д–µ–Ї—Ж–Є—П—Е –≥–ї–Њ—В–Ї–Є –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Л—П–≤–ї—П—О—В—Б—П S. pyogenes –Р, N. meningitidis, L. buccalis, –і–Є—Д—В–µ—А–Є–є–љ–∞—П –њ–∞–ї–Њ—З–Ї–∞, –њ–∞–ї–Њ—З–Ї–∞ –Ї–Њ–Ї–ї—О—И–∞, H. influenzae. –Р–љ–≥–Є–љ—Г —З–∞—Й–µ –≤—Б–µ–≥–Њ –≤—Л–Ј—Л–≤–∞–µ—В S. pyogenes –Р (50–75%). –Я—А–Є —Б–Є–љ—Г—Б–Є—В–∞—Е –≤—Б—В—А–µ—З–∞—О—В—Б—П —Б–∞–Љ—Л–µ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л, –Љ–љ–Њ–≥–Є–µ –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –Њ–±—Л—З–љ–Њ –Њ–±–Є—В–∞—О—В –≤ –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В—П—Е (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –≥—А–∞–Љ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ), –њ–Њ—Н—В–Њ–Љ—Г —Б–ї–Њ–ґ–љ–Њ —А–µ—И–Є—В—М, –Ї–∞–Ї–Є–µ –Є–Ј –љ–Є—Е —Б–ї—Г–ґ–∞—В –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ.
–І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –Т–Я, —В–Њ –Є–Љ–µ—О—В—Б—П –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П —Б—А–µ–і–Є –њ–∞—В–Њ–≥–µ–љ–Њ–≤ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–Њ–Ј—А–∞—Б—В–∞ —А–µ–±–µ–љ–Ї–∞. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ–Є –Т–Я —Г –і–µ—В–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 6 –Љ–µ—Б. –і–Њ 5 –ї–µ—В —П–≤–ї—П—О—В—Б—П S. pneumoniae –Є H. influenzae b, –≤ —Н–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–µ —Б–µ–Ј–Њ–љ—Л (–∞–≤–≥—Г—Б—В – –љ–Њ—П–±—А—М) –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –Ј–љ–∞—З–µ–љ–Є–µ –∞—В–Є–њ–Є—З–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є Mycoplasma pneumoniae –Є Chlamidia pneumoniae. –Т–Є—А—Г—Б—Л –Є–Љ–µ—О—В –Ј–љ–∞—З–µ–љ–Є–µ –≤ —А–∞–Ј–≤–Є—В–Є–Є –≤–Є—А—Г—Б–љ—Л—Е –њ–љ–µ–≤–Љ–Њ–љ–Є–є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г –і–µ—В–µ–є –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ –ґ–Є–Ј–љ–Є.
–Т –њ–µ–і–Є–∞—В—А–Є–Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Г–і–Њ–±–љ–µ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≤ —Д–Њ—А–Љ–µ —Б—Г—Б–њ–µ–љ–Ј–Є–Є –Є–ї–Є —Б–Є—А–Њ–њ–∞. –Р–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –і–ї—П –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤—Л–±–Њ—А–∞ –і–ї—П —Б—В–∞—А—В–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –і–µ—В–µ–є —Б –≥–љ–Њ–є–љ—Л–Љ –±—А–Њ–љ—Е–Є—В–Њ–Љ, –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є, –Њ—В–Є—В–Њ–Љ, —Б–Є–љ—Г—Б–Є—В–Њ–Љ, –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –Љ–љ–Њ–≥–Є—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
–£ –і–µ—В–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 6 –Љ–µ—Б. –і–Њ 15 –ї–µ—В –ї–µ—З–µ–љ–Є–µ –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –њ—А–Њ–≤–Њ–і–Є—В—Б—П –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ —Б –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞. –Р–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є –њ–µ—А–≤–Њ–≥–Њ –≤—Л–±–Њ—А–∞ —П–≤–ї—П—О—В—Б—П –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –Є –Љ–∞–Ї—А–Њ–ї–Є–і—Л, –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л–Љ–Є – –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ —Б –Ї–ї–∞–≤—Г–ї–∞–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є –Є —Ж–µ—Д—Г—А–Њ–Ї—Б–Є–Љ –∞–Ї—Б–µ—В–Є–ї. –Я—А–Є –∞—В–Є–њ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –љ–∞—З–Є–љ–∞—В—М –ї–µ—З–µ–љ–Є–µ —Б –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤. –Я–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –њ–µ—А–µ—Е–Њ–і—Г –љ–∞ –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л–µ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л —П–≤–ї—П–µ—В—Б—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–µ—А–≤–Њ–≥–Њ –≤—Л–±–Њ—А–∞ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 48–72 —З –њ—А–Є –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є –Є 36–48 —З – –њ—А–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є, –∞ —В–∞–Ї–ґ–µ —А–∞–Ј–≤–Є—В–Є–µ —Б–µ—А—М–µ–Ј–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є.
–Т –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –ї–µ—З–µ–љ–Є–µ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–Њ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –њ—А–Є–Љ–µ—А–љ–Њ —Г 80% –і–µ—В–µ–є —Б –Њ—Б—В—А—Л–Љ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ —Б–Є–љ—Г—Б–Є—В–Њ–Љ. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ —В–µ—А–∞–њ–Є–Є –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –Њ—Б—В–∞–µ—В—Б—П –∞–Ї—В—Г–∞–ї—М–љ—Л–Љ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є, –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є, —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Є –љ–Є–Ј–Ї–Њ–є —Б—В–Њ–Є–Љ–Њ—Б—В–Є [13].
–Ы–µ—З–µ–љ–Є–µ –і–µ—В–µ–є —Б –Њ—Б—В—А—Л–Љ —Б—А–µ–і–љ–Є–Љ –Њ—В–Є—В–Њ–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–∞—З–Є–љ–∞–µ—В—Б—П —Б –љ–∞–±–ї—О–і–µ–љ–Є—П –≤—А–∞—З–Њ–Љ –Є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –Х—Б–ї–Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –Є–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ–Њ–Ј–Є—В–Є–≤–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Є, –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П – –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ. –Х—Б–ї–Є –Њ—В–Љ–µ—З–∞–µ—В—Б—П —В—П–ґ–µ–ї–Њ–µ —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–±–Њ–ї—М –≤ —Г—И–∞—Е —Г–Љ–µ—А–µ–љ–љ–Њ–є –Є–ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є, –ї–Є—Е–Њ—А–∞–і–Ї–∞ 39°–° –Є –≤—Л—И–µ), –∞ —В–∞–Ї–ґ–µ –≤ —Б–ї—Г—З–∞–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ H. influenzae –Є M. catarrhalis, –њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е β––ї–∞–Ї—В–∞–Љ–∞–Ј—Л, –љ–∞–Ј–љ–∞—З–∞—О—В –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ —Б –Ї–ї–∞–≤—Г–ї–∞–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є (Clinical Practice Guidelines of American Academy of Pediatrics, 2004).
–Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –љ–∞ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–Љ —А—Л–љ–Ї–µ –љ–∞—А—П–і—Г —Б –Њ—А–Є–≥–Є–љ–∞–ї—М–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –±–Њ–ї—М—И–Њ–є –≤—Л–±–Њ—А –і–ґ–µ–љ–µ—А–Є–Ї–Њ–≤ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞, –Њ—В–ї–Є—З–∞—О—Й–Є—Е—Б—П –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Њ–є —Ж–µ–љ–Њ–є. –Ю–і–љ–∞–Ї–Њ –≤—Б–µ–≥–і–∞ –ї–Є —В–∞–Ї —Е–Њ—А–Њ—И –і–ґ–µ–љ–µ—А–Є–Ї –Є–ї–Є —Б–ї–µ–і—Г–µ—В –Њ—В–і–∞—В—М –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–Љ—Г –њ—А–µ–њ–∞—А–∞—В—Г?
–С—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –Є–Ј—Г—З–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –і–ґ–µ–љ–µ—А–Є–Ї–∞ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ – –њ—А–µ–њ–∞—А–∞—В–∞ –Р–Љ–Њ—Б–Є–љ («–Ъ–ї–Є–љ–Є–Ї–Њ–—Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Р–Љ–Њ—Б–Є–љ (–∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–∞ –Ј–∞–≤–Њ–і–∞ «–°–Є–љ—В–µ–Ј», –≥. –Ъ—Г—А–≥–∞–љ) –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є», –Ґ—О–Љ–µ–љ—М, 2004 –≥., –У–Ю–£ –Т–Я–Ю –Ґ—О–Љ–µ–љ—Б–Ї–Њ–є –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –∞–Ї–∞–і–µ–Љ–Є–Є –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є, –Ї–∞—Д–µ–і—А–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є) –Є –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Т–Я. –Т —Н—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л –њ–∞—Ж–Є–µ–љ—В—Л –Њ—В 3 –і–Њ 18 –ї–µ—В (n=14) —Б –Т–Я, –Ї–Њ—В–Њ—А—Л—Е —А–∞–Ј–і–µ–ї–Є–ї–Є –љ–∞ 2 –≥—А—Г–њ–њ—Л: 1–—П –њ–Њ–ї—Г—З–∞–ї–∞ –Р–Љ–Њ—Б–Є–љ, –∞ 2–—П – –Њ—А–Є–≥–Є–љ–∞–ї—М–љ—Л–є –њ—А–µ–њ–∞—А–∞—В. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –≤ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –љ–µ –±—Л–ї–Њ.
–Р–Љ–Њ—Б–Є–љ –≤—Л–њ—Г—Б–Ї–∞–µ—В—Б—П –≤ –≤–Є–і–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Њ—А–Љ –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–Њ–Ј–Є—А–Њ–≤–Ї–∞—Е: —В–∞–±–ї–µ—В–Ї–Є –њ–Њ 250 –Є 500 –Љ–≥, –Ї–∞–њ—Б—Г–ї—Л –њ–Њ 250 –Љ–≥, –∞ —В–∞–Ї–ґ–µ —А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ —Д–Њ—А–Љ—Л –њ–Њ 125, 250 –Є 500 –Љ–≥ вДЦ 10 (–Њ–і–љ–Њ–і–Њ–Ј–Њ–≤—Л–µ –њ–∞–Ї–µ—В–Є–Ї–Є —В–Є–њ–∞ —Б–∞—И–µ –і–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П —А–∞—Б—В–≤–Њ—А–∞ –і–ї—П —Б—Г—Б–њ–µ–љ–Ј–Є–Є). –Я–Њ–і–Њ–±–љ–∞—П —Д–Њ—А–Љ–∞ –≤—Л–њ—Г—Б–Ї–∞ —Г–њ—А–Њ—Й–∞–µ—В –њ—А–Њ—Ж–µ—Б—Б –Є–Ј–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П —Б—Г—Б–њ–µ–љ–Ј–Є–Є –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–∞—Б—И–Є—А—П–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –ї–µ–Ї–∞—А—Б—В–≤ —Г –і–µ—В–µ–є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤—Л–±–Є—А–∞—П –і–ґ–µ–љ–µ—А–Є–Ї, —Б–ї–µ–і—Г–µ—В –Њ–Ј–љ–∞–Ї–Њ–Љ–Є—В—М—Б—П —Б —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
–Т –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ —Е–Њ—В–µ–ї–Њ—Б—М –±—Л –µ—Й–µ —А–∞–Ј –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Њ—В–Ї—А—Л—В–Є–µ –љ–Њ–≤—Л—Е –Ї–ї–∞—Б—Б–Њ–≤ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ —Г–і–µ—А–ґ–Є–≤–∞–µ—В —Б–≤–Њ–Є –њ–Њ–Ј–Є—Ж–Є–Є –±–ї–∞–≥–Њ–і–∞—А—П —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є, –≤—Л—Б–Њ–Ї–Њ–Љ—Г –њ—А–Њ—Д–Є–ї—О –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є, —Г–і–Њ–±–љ–Њ–Љ—Г —А–µ–ґ–Є–Љ—Г –њ—А–Є–µ–Љ–∞, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є —Б—В—Г–њ–µ–љ—З–∞—В–Њ–є —В–µ—А–∞–њ–Є–Є –Є –љ–µ–≤—Л—Б–Њ–Ї–Њ–є —Б—В–Њ–Є–Љ–Њ—Б—В–Є.

![–Ґ–∞–±–ї–Є—Ж–∞ 2. –Э–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л–µ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–Є –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є [3]](/data/articles/Image/t20/n6/329-2.gif)
![–Ґ–∞–±–ї–Є—Ж–∞ 4. –Р–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М H. pylori, % [9]](/data/articles/Image/t20/n6/329-4.gif)
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Ъ–Њ–Ј–ї–Њ–≤ –°.–Э., –°—В—А–∞—З—Г–љ—Б–Ї–Є–є –Ы.–°. –Я–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л. –І–∞—Б—В—М I. –Я—А–Є—А–Њ–і–љ—Л–µ –Є –њ–Њ–ї—Г—Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–µ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л // –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–∞—П —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—П. 2000. –Ґ. 2. вДЦ 1. –°. 32–38.
2. –°–њ—А–∞–≤–Њ—З–љ–Є–Ї –њ–Њ –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –°–Љ–Њ–ї–µ–љ—Б–Ї: –Ь–Р–Ъ–Ь–Р–•, 2006. 384 —Б.
3. –ѓ–Ї–Њ–≤–ї–µ–≤ –°.–Т. –Р–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В – «–Ј–Њ–ї–Њ—В–Њ–є —Б—В–∞–љ–і–∞—А—В» –ї–µ—З–µ–љ–Є—П –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ—Л—Е —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є // Consilium Medicum. 2006. –Ґ. 04, вДЦ 10.
4. –Я—А–Њ–µ–Ї—В –≠–†–Р (—Н–Ї—Б–њ–µ—А—В–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є–Є). –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —А–µ–ґ–Є–Љ—Л –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ // –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є—П –Є –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–∞—П —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—П. 2004. –Ґ. 6. C. 224–231.
5. Saint S., Bent S., Vittinghoff E. et al. Antibiotics in chronic obstructive pulmonary disease exacerbations: a meta–analysis // JAMA 1995. Vol. 273. –†. 957–960.
6. –Ъ–Њ–Ј–ї–Њ–≤ –°.–Э., –Ъ–Њ–Ј–ї–Њ–≤ –†.–°. –Р–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. –Ь.: –У–µ–Њ—В–∞—А––Ь–µ–і–Є–∞, 2010.
7. Quintiliani R., Nightingale C., Crowe H. et al. Strategic antibiotic decision–making at the formulary level // Rev. Inf. Dis. 1991. Vol. 13. –†. 770–7778.
8. De Francesco V., Zullo A., Hassan C., Giorgio F. et al. Mechanisms of Helicobacter pylori antibiotic resistance: An updated appraisal // World J Gastrointest Pathophysiol. 2011 June 15. Vol. 2(3). –†. 35–41.
9. De Francesco V., Giorgio F., Hassan C., Manes G. et al. Worldwide H. pylori Antibiotic Resistance: a Systematic Review // J Gastrointest Liver Dis. 2010. Vol. 19. No 4. –†. 409–414.
10. –Ъ—Г–і—А—П–≤—Ж–µ–≤–∞ –Ы.–Т. –†–µ–≥–Є–Њ–љ–∞–ї—М–љ—Л–µ –≥–µ–љ–Њ—В–Є–њ—Л –Є —Г—А–Њ–≤–љ–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ Helicobacter pylori: –Р–≤—В–Њ—А–µ—Д. … –і–Њ–Ї—В. –Љ–µ–і. –љ–∞—Г–Ї. –Ь., 2004. –°. 40.
11. Adamsson I., Nord C.E., Lindquist P., Sj stedt S. et al. Comparative effects of omeprazole, amoxicillin plus metronidazole versus omeprazole, clarithromycin plus metronidazole in the oral, gastric and intestinal microflora in Helicobacter pylori–infected patients // Journal of Antimicrobial Chemotherapy. 1999. Vol. 44(5). P. 629–640.
12. –Ь–∞—В–µ—А–Є–∞–ї—Л XXIV –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–≥–Њ —Б–µ–Љ–Є–љ–∞—А–∞ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О Helicobacter –Є —А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –±–∞–Ї—В–µ—А–Є–є –≤ —А–∞–Ј–≤–Є—В–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –Є —А–∞–Ї–∞ –ґ–µ–ї—Г–і–Ї–∞ (—Б–Є–Љ–њ–Њ–Ј–Є—Г–Љ «–Ь–∞–∞—Б—В—А–Є—Е—В–4»:. –Я—А–Њ–≥—А–∞–Љ–Љ–∞. URL: http: // www.helicobacter.org/2011.
13. Clinical Practice Guidelines of American Academy of Pediatrics, 2001.












