Хроническая обструктивная болезнь легких (ХОБЛ) является одной из ведущих причин заболеваемости и летальности в современном мире. Летальность от ХОБЛ занимает 4–е место среди всех причин смерти в общей популяции, что составляет около 4% в структуре общей летальности (GOLD, 2001). Тревожный факт – продолжающаяся тенденция к росту летальности от ХОБЛ. В период от 1966 до 1995 г. летальность от ишемической болезни сердца и инсульта снизились на 45% и 58%, в то же время летальность от ХОБЛ выросла на 71% (NLHEP, 1998). Основной причиной смерти больных ХОБЛ является тяжелое обострение заболевания и/или острая дыхательная недостаточность (ОДН) (Zielinski et al.,1997).
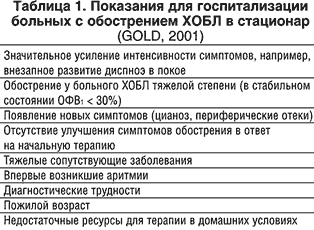
Обострение ХОБЛ характеризуется усилением выраженности одышки и кашля, нарастанием числа свистящих хрипов, увеличением продукции мокроты и повышением ее гнойности, появлением заложенности в грудной клетке, появлением периферических отеков (Georgupolos & Anthonisen, 1991). Недавно рабочей группой специалистов США и Европы по болезням легких было предложено следующее определение: обострение ХОБЛ – это относительно длительное (не менее 24 часов) ухудшение состояния больного, по своей тяжести выходящее за пределы нормальной суточной вариабельности симптомов, характеризующееся острым началом и требующее изменения схемы обычной терапии (Rodriguez–Roisin, 2000). Тяжелое обострение у больных ХОБЛ в большинстве случаев сопряжено с развитием ОДН и требует госпитализации больных в стационар или отделение интенсивной терапии (таблицы 1,2). Наиболее часто употребляемым является следующее определение: острая дыхательная недостаточность (ОДН) – острый патологический синдром, при котором парциальное напряжение кислорода в артериальной крови (РаО2) меньше 60 мм рт.ст., а парциальное напряжение углекислого газа (РаСО2) больше 45 мм рт.ст. (Rochester, 1993).

Причины обострений ХОБЛ
Инфекции бронхиального дерева традиционно рассматриваются, как ведущая причина обострения ХОБЛ (Ball, 1995). Однако примерно в половине всех случаев причинами обострения заболевания могут быть неинфекционные факторы: застойные явления в малом кругу кровообращения, тромбоэмболии ветвей легочной артерии, бронхоспазм, ятрогенные причины (неадекватная кислородотерапия, седативные препараты) и др. (табл. 3).

Вирусная инфекция может быть причиной 30% всех обострений ХОБЛ (Ball, 1995). В проспективном исследовании Seemungal et al., 1998 (в течение 2–х лет проводилось наблюдение за 89 больными ХОБЛ) вирусные инфекции являлись причиной обострения ХОБЛ в 30% случаев, причем в 27% были выявлены риновирусы и лишь в 3% – вирусы гриппа. В исследовании Soler et al., 1998 вирусы гриппа были выявлены в 13% случаев тяжелого обострения ХОБЛ, потребовавшего проведения ИВЛ, в то время как среди других вирусов был обнаружен только респираторно–син цитиальный вирус – 3%. Вероятнее всего, такие различия связаны с сезонными эпидемиями вирусных инфекций.
Тромбоэмболия ветвей легочной артерии является частой причиной ОДН при ХОБЛ, но может также явиться осложнением самого обострения заболевания. При аутопсии признаки тромбоэмболии обнаруживают в 20–51% случаев обострения ХОБЛ (Derenne et al.,1988).
Менее хорошо изучена роль дисфункции левого желудочка в генезе ОДН у больных ХОБЛ. Основным механизмом развития ОДН в данном случае является повышение сопротивления дыхательных путей вследствие перибронхиального отека. По данным одного крупного проспективного исследования, сердечная недостаточность была причиной развития ОДН в 25,7% всех случаев обострений ХОБЛ (Connors et al., 1996).
Антибактериальная терапия
Основанием для назначения антибактериальных препаратов у больных ХОБЛ является ведущая роль бактериального фактора в генезе обострения.
Одним из наиболее тщательно спланированных и проведенных исследований, посвященных роли антибиотиков при обострении ХОБЛ, остается исследование Anthonisen et al., 1987. В данном плацебо–контролируемом, рандомизированном двойном слепом исследовании было проанализировано 362 обострения хронического бронхита у 173 больных в течение 3,5 лет. В группе больных, получавших антибиотики, по сравнению с больными группы плацебо наблюдалась большая частота улучшения клинической картины (68% против 55%) и меньшая – ухудшения (10% против 19%), кроме того, было отмечено более быстрое разрешение симптомов обострения (в среднем на 2 дня). Преимущества антибиотикотерапии были наиболее значимы у больных с I и II типами обострения, т.е при наличии не менее двух из трех кардинальных симптомов обострения (повышение объема мокроты, повышение ее степени гнойности и усиление одышки), т.е. у 80% всех пациентов.
В мета–анализ рандомизированных исследований, сравнивавших эффективность терапии антибиотиками и плацебо при обострении хронического бронхита, было включено 9 исследований, проведенных в 1955–1994 гг. (Saint et al., 1995). Отсутствие преимущества антибиотиков отмечалось лишь в одном исследовании, в других же продемонстрировано небольшое, однако статистически значимое клиническое улучшение при их использовании. В 6 исследованиях было также показано, что терапия антибиотиками приводила к более быстрому и существенному увеличению пиковой скорости выдоха, в среднем на 10,8 л/мин.
Так как не все обострения ХОБЛ имеют бактериальную природу, то назначение антибиотиков не всегда требуется при легких обострениях. Антибиотики назначаются, когда присутствуют два из трех критериев Anthonisen (усиление диспноэ, увеличение объема мокроты и повышение ее гнойности). Однако довольно часто при тяжелом обострении ХОБЛ, особенно у больных с ОДН, наблюдается не увеличение выделения мокроты, а, наоборот, ее задержка, что делает невозможным также и оценку степени ее гнойности. В исследовании, посвященном изучению роли бактериальной инфекции у больных с тяжелым обострением ХОБЛ, находящихся на ИВЛ, не было найдено ни одного различия в клинической картине у больных с положительными и отрицательными результатами культуры по данным защищенной щеточной биопсии. Т.е. до получения данных бактериологического анализа бронхиального секрета нельзя было с полной уверенностью предсказать, кто из больных ХОБЛ нуждается в проведении антибиотикотерапии (Fagon et al., 1990). Учитывая непосредственную угрозу жизни при развитии ОДН на фоне ХОБЛ, все больные с тяжелым обострением ХОБЛ должны получать антибиотики, так как устранение причинного фактора ОДН может улучшить прогноз (Huchon & Woodhead, 1998).
В подавляющем большинстве случаев антибиотикотерапия при обострении ХОБЛ назначается на эмпирической основе. Одним из предложенных подходов к антимикробной терапии у таких больных является классификация обострений хронического бронхита Интернациональной группы специалистов по легочным и инфекционным заболеваниям (Grossman, 1997). Эта классификация основана на факторах риска, возрасте, функциональных особенностях больных и позволяет предположить причинный фактор, рекомендовать оптимальную антимикробную терапию и значительно снизить шанс неудачи терапии обострения ХОБЛ (табл. 4).

Для терапии обострения ХОБЛ рекомендованы амоксициллин/клавуланат, цефалоспорины II и III поколений, антисинегнойные фторхинолоны (ципрофлоксацин). Респираторные фторхинолоны (левофлоксацин, моксифлоксацин) рассматриваются, как терапия первой линии у данных больных (Grossman, 1997). Даже в условиях стационара, принимая во внимание стоимость и побочные эффекты, антибактериальные препараты могут быть назначены per os. Однако данный подход требует достаточной кооперации с пациентом и сохранной функции желудочно–кишечного тракта. У больных, находящихся на ИВЛ, предпочтение обычно отдается внутривенному пути введения. Длительность антибиотикотерапии у стационарных больных недостаточно четко определена, на сегодняшний день практически нет работ, доказавших, что более короткие курсы антибиотикотерапии (за исключением азитромицина) способны эффективно снижать «бактериальную нагрузку» бронхиального дерева и приводить к клиническому улучшению. Поэтому длительность терапии не должна быть менее 7–10 дней.
Бронходилататоры
Несмотря на то, что ХОБЛ в отличие от бронхиальной астмы характеризуется «необратимой» обструкцией дыхательных путей, бронходилататоры являются препаратами первой линии терапии при обострении ХОБЛ (Friedman, 1995). Задачи терапии бронходилататорами при ХОБЛ более «скромные», чем при бронхиальной астме. Даже небольшое повышение проходимости дыхательных путей у больных ХОБЛ может привести к снижению сопротивления дыхательных путей и уменьшению работы дыхания, значительному улучшению клинических симптомов, особенно если бронходилатация сопровождается снижением дыхательного усилия и динамической гиперинфляции легких («воздушной ловушки») (Scorodin, 1993).
Основные препараты при терапии обострения ХОБЛ – b2–агонисты и антихолинергические препараты, которые по сравнению с теофиллином являются более сильными бронходилататорами и обладают меньшим числом побочных эффектов (Siefkin, 1996). Эффективность данных препаратов при обострении ХОБЛ примерно одинакова, преимущество b2–агонистов – более быстрое начало действия, а антихолинергических препаратов – высокая безопасность и хорошая переносимость (Karpel et al., 1990). Оптимальной ингаляционной техникой доставки препарата при тяжелом обострении ХОБЛ являются небулайзеры, либо (у более кооперативных больных) возможно использование дозированных ингаляторов (ДИ) в комбинации со спейсером (Turner et al., 1997). Использование небулайзеров имеет большие преимущества при лечении больных с ОДН, с выраженным диспноэ, так как ингаляционная техника не зависит от усилия больного, не требует кооперации пациента и контроля медицинским персоналом правильности применения ингаляционной техники.
По данным рандомизированных контролируемых исследований, у больных с обострением ХОБЛ не было показано преимуществ ингаляционного антихолинергического препарата ипратропиума бромида (ИБ) по сравнению с сальбутамолом или фенотеролом (Rebuck et al., 1987; Karpel et al., 1990). Лишь в одном исследовании было отмечено небольшое преимущество ИБ перед b2–агонистом метопротеренолом – через 30 мин после ингаляции показатель РаО2 повысился у больных группы ИБ и снизился у пациентов в группе b2–агониста, однако данное различие нивелировалось к 90 минуте терапии (Karpel et al., 1990). Таким образом, в качестве терапии первого выбора при тяжелом обострении ХОБЛ возможен выбор либо ИБ, либо b2–агониста.
Не вполне решены вопросы об оптимальной дозе бронхолитических препаратов при обострении ХОБЛ. Обычно дозирование осуществляют эмпирически, основываясь на ответе больного на лечение и развитии побочных эффектов (Siafakas et al., 1995). При назначении симпатомиметиков обычным режимом является назначение сальбутамола в дозе 2,5 мг (или фенотерола в дозе 1,0 мг) при помощи небулайзера или сальбутамола 400 мкг (фенотерол 200 мкг) при помощи дозированного ингалятора/спейсера каждые 4–6 часов (O’Driscoll, 1997). Ответ на ингаляционный b2–агонист наблюдается обычно в течение 10–15 минут, если же облегчение симптомов отсутствует, то назначают повторные ингаляции. При тяжелом обострении ХОБЛ кратность введения симпатомиметиков может быть значительно увеличена – возможно назначение препаратов каждые 30–60 минут до достижения клинического эффекта (Siafakas et al., 1995). Такие большие дозы b2–агонистов при обострении ХОБЛ (по сравнению с периодом стабильного течения заболевания) объясняются повышением клиренса препаратов вследствие значительного увеличения общего метаболизма.
Применение ингаляционных симпатомиметиков может быть ограничено ростом побочных эффектов, которые развиваются вследствие системной абсорбции препаратов. Наиболее частые осложнения при терапии b2–агонистами – триада симптомов: тахикардия, гипоксемия и гипокалиемия. Основным механизмом нарастания гипоксемии является b2–индуцированная легочная вазодилатация, в т.ч. и в регионах с низким соотношением вентиляция/перфузия, что приводит к дальнейшему ухудшению вентиляционно–перфузионного соотношения и нарастанию гипоксемии. Этот неблагоприятный эффект заслуживает внимания у больных с РаО2 < 60 мм рт.ст., поэтому ингаляционная терапия b2–агонистами должна проводиться под тщательным контролем насыщения крови кислородом.
ИБ обладает более длительным действием, чем симпатомиметики, его общая продолжительность действия составляет около 4–8 часов, начало действия – через 10 минут, а пик действия наступает через 1 час. Однократная доза ИБ при использовании дозированного ингалятора/спейсера – 0,08–0,16 мкг (4–8 ингаляций), при использовании небулайзера – 250–500 мкг, частота дозирования при обострении ХОБЛ – не менее 4 раз в сутки (O’Driscoll, 1997). При использовании обычных доз ИБ наиболее частыми побочными эффектами являются металлический привкус и сухость во рту, при использовании препаратов при помощи небулайзера с маской возможно попадание препарата в глаза, что приводит к расширению зрачка и повышению внутриглазного давления. ИБ может снижать объем мокроты, однако не оказывает влияния на ее вязкость (Gross, 1988). В отличие от симпатомиметиков ИБ не вызывает гипоксемии и снижения уровня калия в крови.
Довольно часто при обострении ХОБЛ используют комбинированную терапию (антихолинергический препарат + b2–агонист) либо в виде фиксированных комбинаций (беродуал = фенотерол + ИБ), либо в виде комбинации отдельных препаратов (например, сальбутамол + ИБ). Комбинированное использование симпатомиметика и ИБ в исследовании, посвященном терапии обострения ХОБЛ в условиях отделения неотложной помощи, позволило сократить время пребывания больных в отделении по сравнению с больными, которым назначали только b2–агонист (Shrestha et al., 1991). В другом исследовании комбинация фенотерола и ипратропиума у пациентов с ОДН на фоне обострения ХОБЛ, получающих респираторную поддержку, оказалась значительно эффективнее по влиянию на показатели механики дыхания, чем каждый из препаратов в отдельности (Fernandez et al,, 1994). С другой стороны, ряд рандомизированных исследований не выявил преимуществ комбинированной терапии при обострении ХОБЛ (Rebuck et al., 1987; O’Driscoll et al., 1989).
Теофиллин
В течение нескольких десятилетий теофиллин считался основным препаратом для лечения обострения ХОБЛ. Однако в настоящее время целесообразность его назначения оспаривается, что связано с его относительно слабым бронходилатирующим эффектом (по сравнению с b2–агонистами и ИБ), небольшой широтой терапевтического действия и выраженными побочными эффектами. Поэтому препараты теофиллина при обострении ХОБЛ рассматриваются, как препараты второй или третьей линии. Кроме того, число рандомизированных контролируемых исследований роли теофиллина при обострении ХОБЛ, на удивление, очень мало.
В одном из таких исследований сравнивали внутривенный аминофиллин и плацебо у госпитализированных больных с обострением ХОБЛ (Rice et al., 1987). Оказалось, что добавление аминофиллина к стандартной терапии (ингаляционные b2–агонисты) не приводит к дальнейшему улучшению субъективных (диспноэ) или объективных (показатели спирометрии) показателей, при этом число побочных эффектов (желудочно–кишечные симптомы) было достоверно выше в группе теофиллина.
В другом рандомизированном исследовании эффективность аминофиллина и плацебо (как дополнение к терапии b2–агонистами и парентеральными кортикостероидами) сравнивались у 134 больных с острым бронхоспазмом в условиях отделения неотложной помощи, в исследование были включены не только больные ХОБЛ, но и с бронхиальной астмой (Wrenn et al., 1991). Аминофиллин (средняя сывороточная концентрация 9,7 мг/л) по сравнению с плацебо также не приводил к улучшению функциональных показателей, однако позволил более чем в три раза снизить частоту госпитализаций больных в стационар (6% против 21%). При раздельном анализе больных ХОБЛ была выявлена та же тенденция: снижение госпитализации больных, получивших терапию аминофиллином – 7% против 26%. Объяснением данного факта может быть наличие небронхолитических свойств теофиллинов: уменьшение феномена воздушной ловушки, улучшение газообмена, физической работоспособности, силы дыхательных мышц и уменьшение диспноэ (Kirsten et al., 1993). Однако это исследование в пользу теофиллина остается пока единственным среди всех других работ, и его данные, безусловно, нуждаются в дальнейшем подтверждении.
Так как эффективность теофиллина при обострении ХОБЛ пока не доказана, рекомендован строго индивидуальный подход к назначению данного препарата, который особенно показан больным с плохим ответом на ингаляционную бронхолитическую терапию (Wilkens & Sybrecht, 1995). Для обеспечения эффективного и безопасного действия теофиллина сывороточная концентрация препарата должна поддерживаться в пределах 10–15 мг/л. При отсутствии возможности определять концентрацию теофиллина его суточная доза не должна превышать 10 мг/кг веса больного.
Глюкокортикостероиды
Подходы к назначению глюкокортикостероидов (ГКС) при обострении ХОБЛ претерпели значительные изменения за последние 5 лет. Если ранее рекомендации к их приему были основаны больше на мнении экспертов, чем на строгих научных доказательствах, то к настоящему времени роль ГКС при терапии обострения ХОБЛ считается доказанной (GOLD, 2001). Предпосылками положительного эффекта ГКС при обострении ХОБЛ являются умеренное увеличение числа эозинофилов в слизистой дыхательных путей и повышение уровня воспалительных цитокинов (IL–6), т.е воспалительный ответ, который может быть подавлен ГКС. При стабильном течении ХОБЛ в развитии воспаления участвуют другие клеточные популяции (нейтрофилы, CD8 T–лимфоциты) и цитокины (IL–8, TNF–a). Этим объясняется невысокий эффект стероидов вне обострения заболевания (Wedzicha, 2000).
Наиболее крупное на сегодня контролируемое исследование SCOPE, посвященное изучению роли пероральных ГКС при обострении ХОБЛ, включало 271 больного: 80 пациентов получали ГКС в течение 2 недель, 80 больных – ГКС в течение 8 недель и 111 пациентов – плацебо (Niewoehner et al., 1999). Стероиды назначались внутривенно в течение 3–х дней (метилпреднизолон 125 мг каждые 6 часов), затем больные получали препараты per os (преднизолон 60 мг с постепенным снижением дозы). ГКС значительно уменьшили число «неудач» терапии (смерть больного, интубация трахеи, ИВЛ, повторная госпитализация больного) – примерно на 10% по сравнению с плацебо на 30–й день терапии (23% и 33%) и на 90–й день (37% и 48%). Улучшение функциональных показателей было более выражено у больных, получавших ГКС (прирост ОФВ1 в первый день выше на 100 мл по сравнению с плацебо). Длительность пребывания больных в стационаре была достоверно ниже на фоне приема ГКС: 8,5 против 9,7 дней (р=0,03). Терапия ГКС в течение 8 недель оказалась не более эффективной по сравнению с 2–недельным курсом терапии. Побочные эффекты (особенно гипергликемия) значительно чаще наблюдались у больных, принимавших ГКС.
В рандомизированное контролируемое исследование Davies et al., (1999) было включено 56 госпитализированных больных с обострением ХОБЛ, которым в течение 14 дней назначали преднизолон per os в дозе 30 мг или плацебо. Все больные получали стандартную терапию, включающую кислород, антибиотики и небулизированные бронхолитики. К 5–му дню терапии показатель ОФВ1 увеличился в группе ГКС в среднем на 90 мл в день, а в группе плацебо – на 30 мл в день, продолжительность госпитализации также была заметно ниже у больных, принимавших преднизолон (7 дней против 9). Благоприятный эффект ГКС не был отмечен после выписки больных из стационара: через 6 недель после госпитализации показатель ОФВ1 у больных обеих групп существенно не отличался от такового на 5–й день терапии, т.е. положительное действие ГКС достигается уже в первые дни терапии.
Таким образом, внутривенные и оральные формы ГКС значительно улучшают функциональные легочные показатели к 3–5 дню терапии и снижают риск «неудач». Длительность назначения системных стероидов не должна превышать 2–х недель; средних доз ГКС (эквивалент 30 мг преднизолона per os) достаточно для достижения положительного эффекта.
Кислородотерапия
Гипоксемия представляет реальную угрозу для жизни больного, поэтому кислородотерапия является приоритетным направлением терапии ОДН на фоне ХОБЛ. Цель кислородотерапии – достижение РаО2 в пределах 60–65 мм рт.ст. и сатурации артериальной крови SaO2 > 90% (Siafakas et al., 1995). Одним из хорошо известных осложнений О2–терапии является гиперкапния (т.н. кислород–индуцированная гиперкапния). Раньше, при отсутствии четких рекомендаций и контроля кислородотерапии, тяжелая гиперкапния после назначения О2 развивалась у 90% больных, причем в 30% случаев она сопровождалась нарушением сознания. Концепция «контролируемой» О2–терапии (имеется в виду точный контроль потока или даже фракции О2 во вдыхаемой смеси – FiO2, позволила значительно уменьшить риск развития кислород–индуцированной гиперкапнии (Campbell, 1967).
Природа кислород–индуцированной гиперкапнии до конца не изучена. Замечено, что значительное повышение углекислоты развивается только при ОДН и не наблюдается при длительной кислородотерапии стабильных, хотя и тяжелых больных ХОБЛ (Rudolph et al.,1977). Риск развития гиперкапнии во время О2–терапии значительно повышен у больных ХОБЛ с выраженной гипоксемией (РаО2 ниже 49 мм рт.ст.) и респираторным ацидозом (рН < 7,35) (Bone et al., 1978).
Важно помнить, что при развитии кислород–индуцированной гиперкапнии грубой ошибкой является прекращение кислородотерапии, т.к. падение РаО2 будет происходить быстрее, чем элиминация из организма СО2, и наступит момент, когда вследствие высокого парциального давления СО2 в альвеолах произойдет снижение РаО2 до значений более низких, чем исходные. В подобных ситуациях правильной тактикой является проведение мероприятий, направленных на улучшение механики дыхания (бронходилататоры, мобилизация и удаление мокроты), и инициация респираторной поддержки.
При ОДН у больных ХОБЛ для доставки О2 чаще всего используются носовые канюли или маска Вентури. При назначении О2 через канюли большинству больных достаточно потока О2 1–2 л/мин. Примерный FiO2 при использовании носовых канюль высчитывается по формуле: FiO2 = 20% + 4 ( поток О2. Маска Вентури – более предпочтительный способ доставки О2, т.к. позволяет обеспечивать довольно точные значения FiO2, не зависящие от минутной вентиляции и инспираторного потока. Кроме того, маска Вентури более безопасна в условиях гиперкапнии. В среднем у больных ХОБЛ кислородотерапия с FiO2 24% повышает РаО2 на 10 мм рт.ст, а с FiO2 28% – на 20 мм рт.ст. (Bone et al., 1978). При наличии пневмонии или интерстициального отека легких может потребоваться назначение высоких фракций О2, что связано с появлением нового механизма гипоксемии – внутрилегочного шунтирования. После начала или изменения режима кислородотерапии в течение ближайших 30–60 минут рекомендовано проведение газового анализа артериальной крови для контроля показателей РаСО2 и рН.
Неинвазивная вентиляция легких
Обычно для проведения искусственной вентиляции легких (ИВЛ) требуется установка искусственных дыхательных путей – интубационной или трахеостомической трубки. Однако кроме того, что интубация трахеи (ИТ) является инвазивной процедурой и сопряжена с развитием многих инфекционных и механических осложнений, присутствие интубационной трубки приводит к дальнейшему повышению сопротивления дыхательных путей и работы дыхания (Mehta & Hill, 2001). Развитие нового направления респираторной поддержки – неинвазивной вентиляции легких (НВЛ), т.е. проведения вентиляционного пособия без постановки искусственных дыхательных путей – обеспечивает безопасное и эффективное достижение разгрузки дыхательной мускулатуры, восстановление газообмена и уменьшение диспноэ у больных с ОДН (Meduri et al., 1989). Во время НВЛ взаимосвязь пациент–респиратор осуществляется при помощи носовых или лицевых масок, больной находится в сознании и, как правило, не требуется применения седативных и миорелаксирующих препаратов. Масочная вентиляция является более комфортной процедурой, чем обычная вентиляция – больной может разговаривать, принимать пищу, проводить сеансы физиотерапии, откашливать мокроту. Еще одним важным достоинством НВЛ является возможность её быстрого прекращения, а также немедленного возобновления, если в этом есть необходимость (Mehta & Hill, 2001).
Показания и противопоказания для проведения НВЛ представлены в табл. 5 (Mehta & Hill, 2001). Неподходящими кандидатами для НВЛ считаются больные ОДН, нуждающиеся в проведении экстренной интубации трахеи и инвазивной респираторной поддержке.

- Использование НВЛ снижает потребность в интубации трахеи на 66% по сравнению со стандартной терапией (О2, бронхолитики, антибиотики) (Brochard et al., 1995; Kramer et al., 1995).
- Использование НВЛ снижает летальность по сравнению со стандартной терапией (8–9% против 29–31%) (Brochard et al., 1995; Авдеев и кол., 1998).
- НВЛ снижает длительность пребывания больных в отделении интенсивной терапии (13 против 32 дней) (Kramer et al., 1995).
- НВЛ снижает длительность пребывания больных в стационаре (23–26 против 34–35 дней) (Brochard et al., 1995; Авдеев и кол., 1998).
В мета–анализе шести рандомизированных контролируемых исследований, посвященном изучению НВЛ у больных ОДН на фоне ХОБЛ, было показано, что НВЛ значительно снижает риск проведения ИТ (отношение шансов (ОШ)= 0,29) и летальность больных (ОШ= 0,20) (Keenan et al., 1997). Также было показано, что использование НВЛ в период ОДН позволяет снизить число последующих госпитализаций и улучшить долговременный прогноз у больных ХОБЛ (Avdeev et al., 1998).
Общий успех (т.е. предотвращение ИТ и летального исхода) при ОДН на фоне ХОБЛ составляет около 70–80%. Так как НВЛ является эффективным способом терапии ОДН на фоне ХОБЛ и предсказание ответа на НВЛ до начала ее проведения не всегда возможно, то назначение НВЛ рекомендовано всем больным ХОБЛ, отвечающим критериям включения и исключения данного метода респираторной поддержки (Hyzy, 2001).
Инвазивная респираторная поддержка
Искусственная вентиляция легких (ИВЛ) показана больным ХОБЛ с ОДН, у которых медикаментозная или другая консервативная терапия (НВЛ) не приводит к дальнейшему улучшению состояния. Показания к проведению ИВЛ должны учитывать не только отсутствие эффекта от консервативных методов терапии, тяжесть функциональных показателей, но и быстроту их развития и потенциальную обратимость процесса, вызвавшего ОДН. Как правило, при назначении респираторной поддержки проводится комплексная клиническая и функциональная оценка статуса больного (табл. 6).

Заключение
Хроническая обструктивная болезнь легких – одна из ведущих причин заболеваемости и летальности. Основная причина смерти больных ХОБЛ – тяжелое обострение заболевания и/или ОДН. Инфекции бронхиального дерева являются самой частой причиной обострения ХОБЛ, хотя немалую роль играют и неинфекционные факторы (сердечная недостаточность, тромбоэмболии и др.). Кислородотерапия – приоритетное направление терапии ОДН на фоне ХОБЛ, так как гипоксемия является серьезным жизнеугрожающим фактором. При обострении ХОБЛ доказана роль использования бронходилататоров (симпатомиметиков и антихолинергических препаратов), глюкокортикостероидов, неинвазивной вентиляции легких, антибиотиков. Антибиотики назначаются эмпирически, выбор препарата основан на местных эпидемиологических данных о структуре возбудителей и их чувствительности к антимикробным препаратам. Использование теофиллинов при обострении ХОБЛ не имеет прочной доказательной базы. Искусственная вентиляция легких показана пациентам, у которых медикаментозная и НВЛ не приводит к дальнейшему улучшению состояния.
1. Авдеев С.Н., Третьяков А.В., Григорьянц Р.А., Куценко М.А., Чучалин А.Г. Исследование применения неинвазивной вентиляции легких при острой дыхательной недостаточности на фоне обострения хронического обструктивного заболевания легких. Анест. и реаниматолог.– 1998.– № 3.– с. 45– 51.
2. Anthonisen NR, Manfreda J, Warren CP, Hershfield ES, Harding GK, Nelson NA. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease. Ann Intern Med. 1987;106:196–204.
3. Avdeev S., Kutsenko M., Tretyakov A., Grigoryants, Chuchalin A. Posthospital survival in COPD patients after noninvasive positive pressure ventilation (NIPPV). Eur.Respir.J. 1998; 11: 312s.
4. Ball P. Epidemiology and treatment of chronic bronchitis and its exacerbations. Chest. 1995;108:43S–52S.
5. Bone RC, Pierce AK, Johnson RL Jr. Controlled oxygen administration in acute respiratory failure in chronic obstructive pulmonary disease: a reappraisal. Am J Med. 1978;65:896–902.
6. Brochard L, Mancebo J, Wysocki M, Lofaso F, Conti G, Rauss A, et al. Noninvasive ventilation for acute exacerbations of chronic obstructive pulmonary disease. N Engl J Med. 1995;333:817–22.
7. Brochard L, Rauss A, Benito S, et al. Comparison of three methods of gradual withdrawal from ventilatory support during weaning from mechanical ventilation. Am J Respir Crit Care Med 1994; 150: 896– 903.
8. Campbell E.J.M. The J.Burns Amberson Lecture: the management of acute respiratory failure in chronic bronchitis and emphysema. Am.Rev.Respir.Dis. 1967; 96: 626– 639.
9. Connors AF Jr, Dawson NV, Thomas C, Harrell FE Jr, Desbiens N, Fulkerson WJ, et al. Outcomes following acute exacerbation of severe chronic obstructive lung disease. The SUPPORT investigators (Study to Understand Prognoses and Preferences for Outcomes and Risks of Treatments). Am J Respir Crit Care Med. 1996;154:959–67.
10. Davies L, Angus RM, Calverley PM. Oral corticosteroids in patients admitted to hospital with exacerbations of chronic obstructive pulmonary disease: a prospective randomised controlled trial. Lancet. 1999;354:456–60.
11. Derenne J.P., Fleury B., Pariente R. Acute respiratory failure of chronic obstructive pulmonary disease. Amer.Rev.Respir.Dis. 1988; 138: 1006– 1033.
12. Esteban A, Alia I, Gordo F, et al. Extubation outcome after spontaneous breathing trials with T–tube or pressure support ventilation. The Spanish Lung Failure Collaborative Group. Am J Respir Crit Care Med 1997; 156: 459– 465.
13. Fagon JY, Chastre J, Trouillet JL, Domart Y, Dombret MC, Bornet M, Gibert C. Characterization of distal bronchial microflora during acute exacerbation of chronic bronchitis: use of the protected specimen brush technique in 54 mechanically ventilated patients. Am Rev Respir Dis 1990; 142: 1004– 08.
14. Fagon JY, Chastre J, Gibert C. Acute respiratory failure in chronic obstructive pulmonary disease. Bacterial infection as a precipitating factor: 337– 389. In: Derenne J.–P., Whitelaw W.A., Similowski T. (Ed.) Acute respiratory failure. Marcel Dekker, Inc. New York, 1995.
15. Fernandez A, Munoz J, de la Calle B, et al. Comparison of one versus two bronchodilators in ventilated COPD patients. Intensive Care Med 1994; 20: 199– 202.
16. Friedman M. Changing practices in COPD. A new pharmacologic treatment algorithm. Chest 1995; 107(Suppl.5): 194S– 197S.
17. Fuso L, Incalzi RA, Pistelli R, Muzzolon R, Valente S, Pagliari G, et al. Predicting mortality of patients hospitalized for acutely exacerbated chronic obstructive pulmonary disease. Am J Med. 1995;98:272–7.
18. Georgupolos D, Antonisen NR. Symptoms and signs of COPD. In: Cherniak NS, ed. Chronic obstructive pulmonary disease. Philadelphia: Saunders, 1991: 357– 363.
19. Giraut C., Richard J.–C., Chevron V., Tamion F., Pasquis P., Leroy J., Bonmarchand G. Comparative physiologic effects of noninvasive assist–control and pressure support ventilation in acute respiratory failure. Chest 1997; 111: 1639– 1648.
20. Global Initiative for Chronic Obstructive Lung Diseas (GOLD). Global strategy for diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI/WHO workshop report. Publication Number 2701, April 2001: 1– 100.
21. Gross N. Ipratropium bromide. N Engl J Med 1988; 319: 486– 494
22. Grossman R. Guidelines for the treatment of acute exacerbations of chronic bronchitis. Chest 1997; 112(suppl): 310S– 313S.
23. Huchon G., Woodhead M. and European Study on Community Acquired Pneumoniae (ESOCAP) committee. Management of adult community–acquired lower respiratory tract infections. Eur Respir Rev 1998; 8: 61, 391– 426.
24. Hyzy RC. Noninvasive positive presure ventilation in acute respiratory failure. In: UpToDate, Rose BD (Ed), UpToDate Wellesley, MA 2001.
25. Karpel JP, Pesin J, Greenberg D, Gentry E. A comparison of the effects of ipratropium bromide and metaproterenol sulfate in acute exacerbations of COPD. Chest. 1990;98:835–9.
26. Keenan SP, Kernerman PD, Cook DJ, Martin CM, McCormack D, Sibbald WJ. Effect of noninvasive positive pressure ventilation on mortality in patients admitted with acute respiratory failure: a meta–analysis. Crit Care Med. 1997;25:1685–92.
27. Kirsten DK, Wegner RE, Jorres RA, Magnussen H. Effects of theophylline withdrawl in severe COPD. Chest 1993; 104: 1101– 1105.
28. Kramer N, Meyer TJ, Meharg J, Cece RD, Hill NS. Randomized, prospective trial of noninvasive positive pressure ventilation in acute respiratory failure. Am J Respir Crit Care Med. 1995;151:1799–806.
29. Mehta S, Hill NS. Noninvasive ventilation. Am J Respir Crit Care Med 2001; 163: 540– 577.
30. Meduri G.U., Conoscenti C.C., Menashe P., Nair S. Noninvasive fase mask ventilation in patients with acute respiratory failure. Chest 1989; 95: 865– 870.
31. Moayyedi P, Congleton J, Page RL, Pearson SB, Muers MF. Comparison of nebulised salbutamol and ipratropium bromide with salbutamol alone in the treatment of chronic obstructive pulmonary disease. Thorax. 1995;50:834–7.
32. National Lung Health Education Program (NLHEP). Strategies in preserving lung health and preventing COPD and associated diseases. Chest. 1998;113:123S–163S.
33. Nava S, Ambrosino N, Clini E, et al. Noninvasive mechanical ventilation in the weaning of patients with respiratory failure due to chronic obstructive pulmonary disease. A randomized, controlled trial. Ann Intern Med 1998; 128: 721– 728.
34. Niewoehner DE, Erbland ML, Deupree RH, Collins D, Gross NJ, Light RW, et al. Effect of systemic glucocorticoids on exacerbations of chronic obstructive pulmonary disease. Department of Veterans Affairs Cooperative Study Group. N Engl J Med. 1999;340:1941–7.
35. O’Driscoll BR, Taylor RJ, Horsley MG, Chambers DK, Bernstein A. Nebulised salbutamol with and without ipratropium bromide in acute airflow obstruction. Lancet. 1989;1:1418–20.
36. O’Driscoll B.R. Nebulizers for chronic obstructive pulmonary diseases. Thorax 1997; 52(Suppl.2): S49– S52.
37. Plant PK, Owen JL, Elliott MW. Early use of non–invasive ventilation for acute exacerbation of chronic obstructive pulmonary disease on general respiratory wards: a multicentre randomized controlled trial. Lancet 2000; 355: 1931– 1935.
38. Rebuck AS, Chapman KR, Abboud R, Pare PD, Kreisman H, Wolkove N, et al. Nebulized anticholinergic and sympathomimetic treatment of asthma and chronic obstructive airways disease in the emergency room. Am J Med. 1987;82:59–64.
39. Rice KL, Leatherman JW, Duane PG, Snyder LS, Harmon KR, Abel J, et al. Aminophylline for acute exacerbations of chronic obs












