Внебольничная пневмония (ВП) остается важнейшей медицинской проблемой ввиду своей распространенности и высокой летальности. Streptococcus pneumoniae является наиболее частым возбудителем ВП. Наряду с этим значительную роль играют атипичные возбудители пневмонии (Mycoplasma pneumoniae, Legionella sp., Chlamydia pneumonia), которые вместе ответственны за возникновение примерно 40% случаев ВП, в качестве основных или ко–патогенов, при этом летальность может увеличиваться и достигать 25%. Лабораторные методы выявления атипичной флоры нельзя назвать рутинными и общедоступными, возбудители не выявляются при окраске по Граму, культивирование этих микробов обычными микробиологическими методами – затруднительно [1,2]. Отсутствуют достоверные различия клинических и рентгенографических проявлений инфекций, вызванных типичной и атипичной флорой. Поэтому эмпирическая терапия ВП должна быть выбрана с учетом необходимости подавления и типичной, и атипичной флоры.
Атипичная флора и наиболее
частые возбудители
внебольничной пневмонии
Микоплазмы (Mycoplasma pneumonia) являются мелкими микроорганизмами, лишенными клеточной стенки (т.е. не могут быть окрашены по Граму), но отграниченными от окружающей среды 3–слойной мембраной. Хламидии (Chlamydophila psittaci, Chlamydophila pneumoniae) являются возбудителями пситтакоза, который также известен, как заболевание или лихорадка, возникающие после контакта с различными видами птиц (например, попугаями). Легионеллы (Legionella species) являются грамотрицательными бактериями, которые могут обитать в открытой воде и развиваться в системах водоснабжения. Поэтому одним из источников вспышек заболевания может быть водопроводная вода. Легионеллы являются причиной легионеллеза, который проявляется различной степенью нарушения сознания и диареей, деструкцией легких, легочными кровотечениями, гипонатриемией. Coxiella burnetii является возбудителем лихорадки Q – зооноза, которым человек заболевает после контакта с животным (кошки, овцы, крупный рогатый скот) и очень редко – от другого человека. Bordetella pertussis является причиной продолжительного кашля у взрослых и коклюша у детей, у которых приступы изнурительного кашля могут заканчиваться рвотой.
Этиология внебольничной пневмонии в порядке убывания [2]:
• Амбулаторные пациенты:
° S. pneumoniae;
° M. pneumoniae;
° H. influenzae;
° C. pneumoniae;
° Респираторные вирусы.
• Госпитализированные пациенты, вне ОРИТ:
° S. pneumoniae;
° M. pneumoniae;
° C. pneumoniae;
° H. influenzae;
° Legionella species;
° аспирационная;
° Респираторные вирусы.
• Госпитализированные в ОРИТ:
° S. pneumoniae;
° S. aureus;
° Legionella species;
° Грамотрицательная флора.
Предрасполагающие условия
Анамнестические указания на следующие факты могут указывать на предполагаемую этиологию бактериальной пневмонии: нахождение в помещении с кондиционированным воздухом (контаминация системы кондиционера) или влажным воздухом (фонтаны, увлажнители воздуха, джакузи, спа) – Legionella species; тесные помещения или высокая скученность лиц (казармы, тюрьмы, ночлежки для бездомных) – S. pneumoniae, Mycobacteria, Mycoplasma, Chlamydophila; контакт с животными – кошки, крупный рогатый скот, козы, овцы – C. burnetii, B. anthracis (отсутствие ветеринарного контроля за крупным рогатым скотом); индюки, куры, утки и птицы – C. psittaci; кролики, грызуны – F. tularensis, Y. pestis.
Патогенез инфекций дыхательных путей и пенетрация антибиотиков
При пневмонии в воспалительный процесс вовлекаются слизистая дыхательных путей, альвеолы и более глубоко расположенные ткани легкого. Все эти структуры дыхательной системы имеют различное кровоснабжение, поэтому процесс пенетрации антибиотика в различные ткани дыхательной системы может быть различен [3]. На начальных этапах развития инфекций нижних дыхательных путей важнейшим условием эффективности антибактериальных препаратов является их высокая концентрация в жидкости, омывающей эпителиальные клетки, и тонком слое клеток, выстилающих альвеолы [3–5]. Этот слой клеток контактирует с эпителиальными клетками бронхов и отделен от крови эндотелием капилляров, который является барьером для пенетрации антибиотиков в жидкость, омывающую эпителий альвеол [4]. Антибиотики могут достигать эффективной концентрации во внеклеточном пространстве при лечении инфекций, вызванных бактериями, которые обычно располагаются внеклеточно (например, Streptococcus pneumoniae, Н. influenzae, М. саtarrhalis) [6]. Однако возбудителями внебольничных инфекций нижних дыхательных путей могут быть Mycoplasma pneumoniae, Legionella sp., Chlamydia pneumonia, которые локализуются внутриклеточно и могут выживать и размножаться внутри клеток миелоидного ряда. Аль-веолярные макрофаги являются важнейшим противоинфекционным барьером легких. Они ответственны за клиренс бактерий, попадающих в нижние дыхательные пути вместе с вдыхаемым воздухом [7]. Однако и сами эти клетки могут быть инфицированы возбудителями, способными к внутриклеточной персистенции или размножению [3,4,8]. Обычно антибиотики из крови пенетрируют в альвеолы, а затем диффундируют через клеточную мембрану, попадая во внутриклеточное пространство.
Азитромицин и другие макролиды
Антимикробное действие. Все макролидные антибиотики имеют один механизм антимикробного действия, заключающийся в ингибировании синтеза рибонуклеиновой кислоты на этапе элонгации чувствительных микроорганизмов. Они обратимо связываются с 505 субъединицей рибосом, что приводит к блокированию транспептидазной или транслокационной реакции. Кроме того, они способны ингибировать образование 50S субъединицы рибосом, подобно линкозамидам и стрептограмину В. Макролиды обладают широким спектром антимикробной активности, который включает грамположительные и грамотрицательные возбудители инфекций дыхательных путей, актиномицет, микобактерий, атипичных возбудителей пневмонии.
Фармакологические особенности. Азитромицин является 15–членным макролидом, относящимся по химической структуре к классу, который называется «азалиды» [6]. Продолжительность полувыведения препарата составляет 68 часов, т.е. концентрация, которая достигается после применения препарата, снижается в два раза через указанный промежуток времени. Этот показатель существенно превышает таковой эритромицина и кларитромицина [9]. Именно поэтому у взрослых пациентов с инфекциями дыхательных путей обычно применялся следующий курс азитромицина: в первый день 500 мг однократно внутрь, со 2 по 5–е сутки – по 250 мг однократно внутрь.
Внутрилегочная фармакокинетика азитромицина была изучена у добровольцев при 5–дневном режиме дозирования [10]. Сывороточная концентрация азитромицина оказалась очень низкой во все периоды наблюдения: на 5 и 10–е сутки лечения средняя сывороточная концентрация азитромицина составляла, соответственно, 0,054±0,008 и 0,015±0,005 мкг/мл. Концентрация азитромицина в жидкости, омывающей альвеолы, измерялась каждые 4 часа и к 5–м суткам лечения достигала максимума (3,12±0,93 мкг/мл). Точно так же максимум средней концентрации азитромицина (464±65 мкг/мл) в альвеолярных макрофагах был достигнут к 5–м суткам. Высокая концентрация азитромицина в жидкости, омывающей альвеолы, и в тканевых макрофагах обнаруживалась на 7 и 21–е сутки после начала лечения. Концентрация обоих макролидов (азитромицина и кларитромицина) в легочной ткани многократно превышала его концентрацию в плазме и сыворотке. Такая высокая тканевая концентрация и медленное выведение азитромицина позволяют сокращать продолжительность приема препарата при лечении инфекций дыхательных путей. Однако в отличие от кларитромицина максимальная внутриклеточная концентрация азитромицина не достигалась немедленно и требовала приема препарата в течение нескольких суток.
Предполагаемая клиническая эффективность. Большим количеством исследований антибиотиков подтверждена высокая корреляционная зависимость микробного киллинга, фармакокинетических, фармакодинамических показателей и клинической эффективности. Процесс микробного киллинга и фармакокинетический/ фармакодинамический профиль определяются на основании изучения концентрации препарата в плазме. Все антибактериальные препараты в отношении фармакокинетических/динамических параметров условно разделены на 2 группы: препараты с киллингом микробов зависимым (аминогликозиды, фторхинолоны, макролиды) или не зависимым (b–лактамы) от концентрации препарата в плазме. Обычно макролиды относят к первой группе препаратов. Однако для эритромицина и кларитромицина важнейшим фармакодинамическим показателем, предсказывающим высокую клиническую эффективность, является показатель отношения периода превышения минимальной подавляющей концентрации антибиотика в плазме (Т>МПК) к периоду между введениями препарата (выраженному в %). С формальной точки зрения этот показатель относит эти препараты к группе антибиотиков, эффективность киллинга которых не зависит от концентрации, что противоречит сказанному ранее. В отличие от них клиническая эффективность азитромицина больше соответствует отношению площади под фармакокинетической кривой и минимальной подавляющей концентрации (AUC/МПК) [9,11]. По этому параметру азитромицин нужно отнести к группе препаратов с концентрационно–зависимым киллингом. Поэтому при применении экспериментальных моделей с целью прогнозирования клинической эффективности макролидов в лечении инфекций дыхательных путей возникают серьезные теоретические проблемы. Оба показателя Т>МПК и AUC /МПК получают в процессе экспериментальных исследований или на моделях животных с использованием концентрации препарата в «плазме». Однако, как было показано ранее, концентрация кларитромицина и азитромицина в жидкости, омывающей альвеолы, и в альвеолярных макрофагах в сотни раз выше, чем в плазме. При применении моделей, учитывающих только фармакокинетику в плазме, без учета тканевой концентрации, можно существенно снизить прогнозируемую клиническую эффективность макролидов. Однако до настоящего времени фармакодинамические модели, в которых применяются показатели тканевых кон-центраций в легких, не разработаны, что и представляет теоретическую проблему прогнозирования клинической эффективности на существующих моделях [12].
Резистентность к макролидам
Эпидемиологические исследования, проведенные в США, выявили тенденцию к росту резистентности возбудителей инфекций дыхательных путей к макролидам в 2001–2002 годах; наиболее высокая резистентность наблюдалась у S. pneumoniae (до 30%). Глобальный мониторинг резистентности (программа SENTRY) с 1997 года указывает на регионарную вариабельность резистентности пнев-мококков (10,4–38,6%) и низкую резистентность Н. influenzae и М. саtarrhalis (~1%) [13]. Резистентность грамположительных кокков к макролидам реализуется двумя основными механизмами. У 25% резистентных штаммов выявляется метилирование областей связывания антибиотика в бактериальных рибосомах в результате экспрессии генов эритромицин–резистентной метилазы [13–15]. Этот механизм обычно определяет высокий уровень резистентности с минимальной подавляющей концентрацией (МПК) 64 мкг/мл и выше [16]. Другим механизмом резистентности является их целенаправленный выброс (эффлюкс) из микробной клетки в результате экспрессии соответствующих генов. Этот механизм резистентности несет ответственность за эффективное удаление из микробной клетки 14– и 15–членных макролидов и приводит к резистентности низкого уровня (МПК 1–32 мкг/мл) [16–18].
Клиническое значение резистентности к макролидам до настоящего времени широко обсуждается. Неэффективность лечения макролидами, связанная с резистентностью, пока не очень высока [19–21]. В исследовании 41 госпитализированного пациента с пневмонией и бактериемией только у 3 (7%) – были выделены пневмококки, резистентные к макролидам (МПК 8–16 мкг/мл) [20]. Проведено сравнение результатов лечения больных пневмонией с бактериемией (S. pneumoniae) у 86 пациентов с резистентной или промежуточнорезистентной и 141 пациента с чувствительной флорой [21]. Было показано: массивная бактериемия чаще наблюдалась у пациентов с резистентной флорой; однако не было выявлено определенного механизма резистентности, который обязательно бы приводил к клинической неэффектив-ности лечения. Таким образом, до настоящего времени не получено убедительных данных того, что рост резистентности флоры приводит к снижению эффективности обычных режимов лечения макролидами, за исключением пациентов с массивной бактериемией, характерной для тяжелого течения инфекции и требующей других режимов антибактериальной терапии.
Комплаентность
и пути ее оптимизации
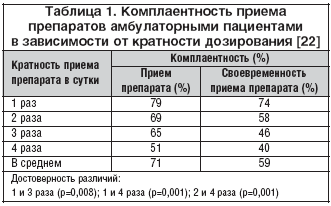
Влияние комплаентности и адекватной продолжительности лечения на резистентность флоры к антибиотикам является проблемой, которая до настоящего времени нуждается в уточнении. В мета–анализе 76 исследований (1987–2000 гг.), посвященных комплаентности, было показано, что ее уровень составляет около 71%, а своевременность приема препаратов – 59%. Снижение комплаентности наблюдалось при увеличением кратности приема в течение суток, а своевременность приема снижалась в еще большей степени (табл. 1) [22]. При назначении препарата один раз в сутки комплаентность достигала 100%, что позволяло сократить продолжительность лечения (<7 суток) [23,24]. У пациентов с инфекциями нижних дыхательных путей комплаентность обычно была высокой, что объясняется выра-женностью симптоматики и относительно высокой стоимостью препаратов. Причиной нарушения комплаентности может быть убеждение пациента в том, что несоблюдение правил приема препарата не сопровождается снижением его клинической эффективности.
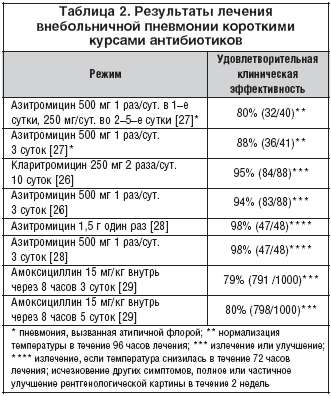
Азитромицин является препаратом, который применяется для лечения внебольничной пневмонии короткими курсами, т.к. имеет очень продолжительный период полувыведения и постантибиотического эффекта. Доказана равная эффективность применения азитромицина курсом в 3 или 5 суток по сравнению с 10–дневным курсом кларитромицина [25,26]. Эти данные послужили основой для продолжения изучения еще более коротких курсов лечения макролидами. Необходимо отметить, что клиническая эффективность приема азитромицина в течение 3 суток (4 исследования) существенно не отличалась от эффективности терапии в течение 5 суток (2 исследования) (табл. 2). Тем не менее в большинстве клинических рекомендаций предлагается 5–суточный курс терапии, обоснованность которого не вытекает из результатов клинических исследований. По–видимому, короткий курс лечения и желание создать определенный «запас прочности» заставляет разработчиков рекомендаций на подсознательном уровне склоняться к более продолжительным режимам лечения.
Короткие курсы лечения амоксициллином были изучены у детей с внебольничной пневмонией и показали хорошие результаты [29]. Причем при сравнении 3 и 5–дневного курса лечения первый режим отличался более высокой комплаентностью (р<0,001). Снижение комплаентности при 5–дневном курсе приводило к достоверно большему количеству случаев неэффективности лечения (р<0,0001).
Клиническая эффективность лечения указывает на высокую чувствительность флоры к выбранному препарату и отсутствие внелегочных очагов, таких как менингит или эмпиема. Оценка результатов бактериологического исследования имеет в таких случаях не более чем формальный интерес.
Эмпирическая терапия внебольничной пневмонии у госпитализированых пациентов
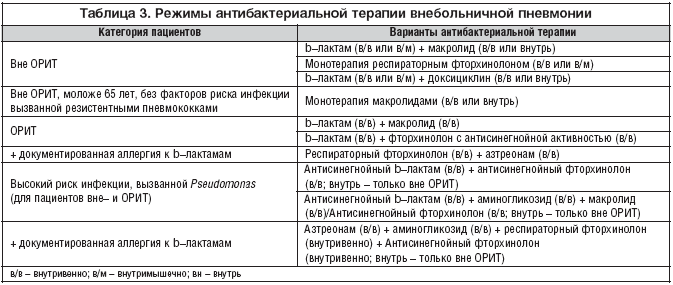
Из–за высокой актуальности внебольничной пневмонии вопросы, связанные с антибактериальной терапией, являются предметом постоянного обсуждения. Несмотря на наличие международных и национальных рекомендаций по лечению этого заболевания, с каждым годом вносятся дополнения и уточнения. Так, в 2009 г. опубликована новая версия рекомендаций по лечению пневмонии у госпитализированных пациентов. В них еще раз обращается внимание на важность применения АБ в течение 6 часов после госпитализации пациентов и уточнение режимов антибактериальной терапии у различных групп пациентов (табл. 3) [30].
Эмпирическая терапия внебольничной пневмонии у амбулаторных пациентов
При назначении антибиотиков в амбулаторных условиях необходимо учитывать отсутствие факторов риска неблагоприятного исхода инфекции, применение антибактериальных препаратов в недалеком прошлом, сопутствующую патологию и особенности резистентности локальной флоры. Если антибиотики не назначались в течение предшествующих 90 дней, то могут применяться макролиды или доксициклин. При наличии сопутствующих хронических заболеваний сердца, легких, почек, печени, сахарном диабете, хроническом алкоголизме, онкологической патологии, иммуносупрессии (связанной с лечением или заболеванием) или при лечении антибиотиками в предшествующие 90 дней, обычно применяются респираторные фторхинолоны или b–лактамы в сочетании с макролидами. При указании на применение антибиотиков в предшествующие 90 дней обычно назначаются антибиотики других классов.
Резюме
Назначение макролидов один раз в сутки короткими курсами является стандартом лечения внебольничной пневмонии, а также обострения хронического бронхита и острого бактериального синусита. При этих инфекциях пациенты нуждаются в применении режимов антибактериальной терапии, которые будут приводить к быстрой ликвидации клинических проявлений и возвращению к обычной жизни. При этом необходимо помнить о том, что повышение комплаентности не менее важно, чем адекватный выбор антибактериальной терапии, особенно при лечении инфекций в амбулаторных условиях. Сочетание однократного применения антибиотика в течение суток и короткого курса антибактериальной терапии обеспечивает высокую комплаентность лечения. Фармакокинетические и фармакодинамические особенности современных макролидов и фторхинолоны определяют соответствие этим принципам.
В отличие от b–лактамных антибиотиков и фторхинолонов азитромицин (Хемомицин и др.) имеет существенно большую продолжительность полувыведения и постбиотического эффекта, которая позволяет применять его с высокой эффективностью в режиме коротких курсов. Азитромицин создает высокую концентрацию в клетках различных тканей, в лейкоцитах и макрофагах. Высокая тканевая концентрация препарата в области инфекции достигается целенаправленным переносом его лейкоцитами. Пенетрация препарата внутрь клеток не ограничена, повторное введение препарата в процессе лечения приводит к увеличению захвата лейкоцитами и доставки в область инфекционного воспаления, то есть именно туда, где количество микробов самое высокое и где возникает необходимость высокой тканевой концентрации препарата. Из–за высокой концентрации азитромицина в области инфекции его фармакодинамические характеристики отличаются от других препаратов, для которых отношение плазменной концентрации и минимальной ингибирующей концентрации антибиотика влияет на величину киллинга возбудителей. Плазменная концентрация важна для лечения инфекций, сопровождающихся бактериемией, но не для инфекций с низкой вероятностью бактериемии.
Во всем мире отмечается медленное нарастание резистентности пневмококков к макролидам. Причем наиболее изучена популяция пневмококков, выделенных от пациентов с тяжелым течением пневмонии, которым потребовалась госпитализация. Помимо особенностей пневмококков, тяжесть состояния таких пациентов могут определять сопутствующие заболевания, особенно те, которые требуют повторного применения антибактериальных препаратов и сами по себе являются факторами риска инфекций, вызванных резистентной флорой. Кроме того, имеются различия между резистентностью к макролидам и частотой выделения клинических значимых штаммов резистентных пневмококков – возбудителей инфекций верхних дыхательных путей [31]. Например, в недавних исследованиях, проведенных у пациентов с обострением хронического бронхита, внебольничной пневмонией и острым бактериальным отитом, S. pneumoniae оказался возбудителем инфекции примерно в 11% (от 2 до 17%) случаев [32,33]. Определенные данные по иммуномодулирующему эффекту азитромицина и других макролидов, получен-ные первоначально in vitro и в экспериментальных условиях, дополнены клиническими данными при исследовании пациентов с муковисцидозом и бронхоэктазами. Еще одно направление повышения фармакологических свойств азитромицина – применение формы, содержащей более высокие дозы препарата, что позволяет применять его всего один раз при сохранении высокой эффективности лечения инфекций верхних дыхательных путей. Отрадно, что это направление уже интенсивно изучается и получены обнадеживающие клинические результаты.
Литература
1. Forgie S, Marrie TJ. Healthcare–associated atypical pneumonia. Semin Respir Crit Care Med. Feb 2009;30(1):67–85.
2. Mandell LA, Wunderink RG, Anzueto A, et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community–acquired pneumonia in adults. Clin Infect Dis. Mar 1 2007;44 Suppl 2:S27–72.
3. Honeybourne D, Baldwin DR. The site concentrations of antimicrobial agents in the lung. J Antimicrob Chemother. 1992;30:249–260.
4. Baldwin DR, Honeybourne D, Wise R. Pulmonary disposition of antimicrobial agents: methodological considerations. Antimicrob Agents Chemother. 1992;36:1171 –1175.
5. Nix DE. Intrapulmonary concentrations of antimicrobial agents. Infect Dis Clin North Am. 1998:12:631–646.
6. Carbon C. Pharmacodynamics of macrolides, azalides, and streptogramins: effect on extracellular pathogens. Clin Infect Dis. 1998:27:28–32.
7. Nelson S, Summer WR. Innate immunity, cytokines, and pulmonary host defense. Infect Dis Clin North Am. 1998;12:555–567.
8. Baldwin DR, Honeybourne D, Wise R. Pulmonary disposition of antimicrobial agents: in vivo observations and clinical relevance. Antimicrob Agents Chemother. 1992:36:1176–1180.
9. Craig WA. Postantibiotic effects and the dosing of macrolides, azalides and streptogramins. In: Zinner SH, Young LS, Acar JF, Neu HC, eds. Expanding Indications for the New Macrolides, Azalides and Streptogramins. New York: Marcel Dekker Inc; 1997:27–38.
10. Olsen KM, San Pedro GS, Gann LP, et al. Intrapulmonary pharmacokinetics of azithromycin in healthy volunteers given five oral doses. Antimicrob Agents Chemother. 1996;40:2582–2585.
11. Drusano GL, Craig WA. Relevance of pharmacokinetics and pharmacodynamics in the selection of antibiotics for respiratory tract infections. J Chemother. 1997:9(suppl 3):38–44.
12. Bearden DT, Rodvold KA.Practical Pharmacology – Penetration of Macrolides Into Pulmonary Sites of Infection. Infect Med 16(7):480–484A, 1999.
13. Hoban DJ, Doern GV, Fluit AC, Roussel–Delvallez M, Jones RN. Worldwide prevalence of antimicrobial resistance in Streptococcus pneumonia, Haemophilus influenzae, and Moraxella catarrhalis in the SENTRY antimicrobial surveillance program, 1997–1999. Clin Infect Dis 2001; 32(Suppl 2):S81 –S93.
14. Doern GV, Brown SD. Antimicrobial susceptibility among community–acquired respiratory tract pathogens in the USA: data from PROTECT US 2000–01. J Infect 2004;48:56 – 65.
15. Leclercq R, Courvalin P. Bacterial resistance to macrolide, lincosamide, and streptogramin antibiotics by target modification. Antimicrob Agents Chemother 1991 ;35:1267– 72.
16. Nuermberger E, Bishai WR. The clinical significance of macrolideresistant Streptococcus pneumoniae: it’s all relative. Clin Infect Dis 2004;38:99 – 103.
17. Sutcliffe J, Tait–Kamradt A, Wondrack L. Streptococcus pneumoniae and Streptococcus pyogenes resistant to macrolides but sensitive to clindamycin: a common resistance pattern mediated by an efflux system. Antimicrob Agents Chemother 1996;40:1817– 24.
18. Descheemaeker P, Chapelle S, Lammens C, et al. Macrolide resistance and erythromycin resistance determinants among Belgian Streptococcus pyogenes and Streptococcus pneumoniae isolates. J Antimicrob Chemother 2000;45:167 – 73.
19. Lynch III JP, Martinez FJ. Clinical relevance of macrolide–resistant Streptococcus pneumoniae for community–acquired pneumonia. Clin Infect Dis 2002:34(Suppl 1 ):S27 – S46.
20. Kelley MA, Weber DJ, Gilligan P, Cohen MS. Breakthrough pneumococcal bacteremia in patients being treated with azithromycin and clarithromycin. Clin Infect Dis 2000:31:1008–11.
21. Lonks JR, Garau J, Gomez L, et al. Failure of macrolide antibiotic treatment in patients with bacteremia due to erythromycin–resistant Streptococcus pneumoniae. Clin Infect Dis 2002;35:556 – 64.
22. Claxton AJ, Cramer J, Pierce C. A systematic review of the associations between dose regimens and medication compliance. Clin Ther 2001:23:12960 10.
23. Kardas R Patient compliance with antibiotic treatment for respiratory tract infections J Antimicrob Chemother 2002;49:897 903.
24. File Jr TM. Clinical efficacy of newer agents in short–duration therapy for community–acquired pneumonia. Clin Infect Dis 2004;39(Suppl 3):S 159–64.
25. Socan M. Treatment of atypical pneumonia with azithromycin: comparison of a 5–day and a 3–day course. J Chemother 1998:10:64–8.
26. 0’ Doherty B, Muller 0. Randomized, multicentre study of the efficacy and tolerance of azithromycin versus clarithromycin in the treatment of adults with mild to moderate community–acquired pneumonia. Azithromycin Study Group. Eur J Clin Microbiol Infect Dis 1998:17:828–33.
27. Socan M. Treatment of atypical pneumonia with azithromycin: comparison of a 5–day and a 3–day course. J Chemother 1998; 10:64–8.
28. Schonwald S, Kuzman I, Oreskovic K, et al. Azithromycin: single 1.5 g dose in the treatment of patients with atypical pneumonia syndrome a randomized study. Infection 1999;27:198 202.
29. Pakistan Multicentre Amoxicillin Short Course Therapy (MASCOT) pneumonia study group. Clinical efficacy of 3 days versus 5 days of oral amoxicillin for treatment of childhood pneumonia: a multicentre double–blind trial. Lancet 2002;360:835M1. Erratum: Lancet 2003; 361:788.
30. The Joint Commission and the Centers for Medicare and Medical Services. Specifications Manual for National Hospital Quality Measures. Version 2.6b. April 2009: http://www.medscape.com/ medline/abstract/17278083
31. Hoban D, Baquero F, Reed V, et al. Demographic analysis of antimicrobial resistance among Streptococcus pneumoniae: worldwide results from PROTECT 1999 2000. Int J Infect Dis 2005:9:262–73.
32. Heffelfinger JD, Dowell SF, Jorgensen JH, et al. Management of community–acquired pneumonia in the era of pneumococcal resistance: a report from the Drug–Resistant Streptococcuspneumoniae Therapeutic Working Group. Arch Intern Med 2000; 160:1399408.
33. Pfaller MA, Ehrhardt AF, Jones RN. Frequency of pathogen occurrence and antimicrobial susceptibility among communityacquired respiratory tract infections in the respiratory surveillance program study: microbiology from the medical office practice environment. Am J Med 2001 ;11 l(Suppl. 9A):4S–12S.











