–Т–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ–Є –Њ—Б—В—А–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –ї–Є–Љ—Д–Њ–Є–і–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А –≥–ї–Њ—В–Ї–Є –Є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є (–°–Ю) –Т–Ф–Я –њ—А–Є–Ј–љ–∞–љ—Л –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П —Д–ї–Њ—А–∞ (30%) –Є –≤–Є—А—Г—Б–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П (70%). –Э–∞–Є–±–Њ–ї–µ–µ –Њ–њ–∞—Б–љ—Л–Љ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–Љ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є —П–≤–ї—П–µ—В—Б—П β-–≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–є —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї –≥—А—Г–њ–њ—Л –Р (–С–У–°–Р, Streptococcus pyogenes). –Ч–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–µ–ґ–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ—Б–љ–Њ–≤–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Њ—Б—В—А–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є –≤—Л–і–µ–ї—П—О—В—Б—П –і—А—Г–≥–Є–µ –≥—А—Г–њ–њ—Л β-–≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є—Е —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –≥—А—Г–њ–њ—Л C –Є G. –Ф–Њ–ї—П –Њ—Б—В–∞–ї—М–љ—Л—Е –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–Њ–≤, –≤ —В. —З. –∞—В–Є–њ–Є—З–љ—Л—Е, –≤ —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 1% –Є –љ–µ —Г—З–Є—В—Л–≤–∞–µ—В—Б—П –њ—А–Є —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Њ–Љ –≤—Л–±–Њ—А–µ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ [12, 18].
–Ъ–∞–Ї –Є –њ—А–Є –Њ—Б—В—А–Њ–Љ —В–Њ–љ–Ј–Є–ї–ї–Є—В–µ, –С–У–°–Р –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —Н—В–Є–Њ–ї–Њ–≥–Є–Є –•–Ґ. –°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ –њ–Њ—Б–ї–µ–і–љ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, Streptococcus pyogenes –≤—Л–і–µ–ї—П–µ—В—Б—П –Є–Ј —В–Ї–∞–љ–Є —Г–і–∞–ї–µ–љ–љ—Л—Е –љ–µ–±–љ—Л—Е –Љ–Є–љ–і–∞–ї–Є–љ —Г 20–30% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ґ [18]. –Ю–і–љ–∞–Ї–Њ –≤–µ–і—Г—Й–Є–Љ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –њ–∞—В–Њ–≥–µ–љ–Њ–Љ –њ—А–Є –•–Ґ –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –њ—А–Є–љ—П—В–Њ —Б—З–Є—В–∞—В—М –Ј–Њ–ї–Њ—В–Є—Б—В—Л–є —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї (Staphylococcus aureus), –≤—Л–і–µ–ї—П–µ–Љ—Л–є, –њ–Њ —А–∞–Ј–љ—Л–Љ –і–∞–љ–љ—Л–Љ, –Є–Ј —В–Ї–∞–љ–Є –љ–µ–±–љ—Л—Е –Љ–Є–љ–і–∞–ї–Є–љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ґ –≤ 30–80% —Б–ї—Г—З–∞–µ–≤ [19, 21, 23]. –Я–Њ–і–∞–≤–ї—П—О—Й–µ–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —Б–ї—Г—З–∞–µ–≤ –њ–∞—А–∞—В–Њ–љ–Ј–Є–ї–ї—П—А–љ—Л—Е –∞–±—Б—Ж–µ—Б—Б–Њ–≤, —А–∞–Ј–≤–Є–≤–∞—О—Й–Є—Е—Б—П –Ї–∞–Ї –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ –•–Ґ, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –Є–Љ–µ–љ–љ–Њ —Н—В–Є–Љ –њ–∞—В–Њ–≥–µ–љ–Њ–Љ [9]. –Э–Њ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –≤—Л—А–∞–ґ–µ–љ–љ—Л–µ —Б—Г–њ–µ—А–∞–љ—В–Є–≥–µ–љ–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –і–∞–љ–љ–Њ–≥–Њ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П, –љ–µ—В –љ–Є–Ї–∞–Ї–Є—Е –і–∞–љ–љ—Л—Е –Њ —А–Њ–ї–Є –Ј–Њ–ї–Њ—В–Є—Б—В–Њ–≥–Њ —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–∞ –≤ —А–∞–Ј–≤–Є—В–Є–Є –Њ—Б—В—А–Њ–є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–є –ї–Є—Е–Њ—А–∞–і–Ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ґ. –Т 10–15% —Б–ї—Г—З–∞–µ–≤ –Є–Ј —В–Ї–∞–љ–Є –љ–µ–±–љ—Л—Е –Љ–Є–љ–і–∞–ї–Є–љ –њ—А–Є –•–Ґ –≤—Л–і–µ–ї—П–µ—В—Б—П –≥–µ–Љ–Њ—Д–Є–ї—М–љ–∞—П –њ–∞–ї–Њ—З–Ї–∞ (Haemophilus influenza–µ), –Њ–і–љ–∞–Ї–Њ –Ј–љ–∞—З–µ–љ–Є–µ –і–∞–љ–љ–Њ–≥–Њ –њ–∞—В–Њ–≥–µ–љ–∞ –≤ —Н—В–Є–Њ–ї–Њ–≥–Є–Є –•–Ґ –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –љ–µ–Є–Ј–≤–µ—Б—В–љ–Њ [19, 21]. –Я–Њ –і–∞–љ–љ—Л–Љ —А—П–і–∞ –∞–≤—В–Њ—А–Њ–≤, –љ–µ–Ї–Њ—В–Њ—А—Л–µ –∞—В–Є–њ–Є—З–љ—Л–µ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–Є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є Mycoplasma pneumoniae, –Є–≥—А–∞—О—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Г—О —А–Њ–ї—М –≤ —Н—В–Є–Њ–ї–Њ–≥–Є–Є –•–Ґ —Г –і–µ—В–µ–є [9, 19, 21, 23].
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б—Г—Й–µ—Б—В–≤—Г—О—В –і–∞–љ–љ—Л–µ –Њ–± —Г—З–∞—Б—В–Є–Є –≤–Є—А—Г—Б–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –Њ—Б—В—А–Њ–Љ –њ—А–Њ—Ж–µ—Б—Б–µ, –љ–Њ –Є –≤ –µ–≥–Њ —Е—А–Њ–љ–Є–Ј–∞—Ж–Є–Є –Є —А–µ—Ж–Є–і–Є–≤–∞—Е. –Э–∞—Г—З–љ—Л–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є –њ–Њ–Ї–∞–Ј–∞–љ–∞ —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —А–Њ–ї—М –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –≤ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–Є –•–Ґ –Є –µ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –њ—А–Є—Б—Г—В—Б—В–≤–Є—П –≤–Є—А—Г—Б–Њ–≤ –≤ —В–Ї–∞–љ–Є –љ–µ–±–љ—Л—Е –Љ–Є–љ–і–∞–ї–Є–љ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –≤ 46,3% —Б–ї—Г—З–∞–µ–≤ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б—Л, –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–Є—А—Г—Б –≠–њ—И—В–µ–є–љ–∞––С–∞—А—А. –Т –µ–і–Є–љ–Є—З–љ—Л—Е —Б–ї—Г—З–∞—П—Е –≤—Л—П–≤–ї—П–µ—В—Б—П —Ж–Є—В–Њ–Љ–µ–≥–∞–ї–Њ–≤–Є—А—Г—Б [1].
–Ф–Є—Б–Ї—Г—Б—Б–Є—П –Њ –≤—Л–±–Њ—А–µ –Љ–µ—В–Њ–і–∞ –ї–µ—З–µ–љ–Є—П –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –љ–µ–±–љ—Л—Е –Љ–Є–љ–і–∞–ї–Є–љ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є XX –≤. –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ 2––Љ—П –і–Є–∞–Љ–µ—В—А–∞–ї—М–љ–Њ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ—Л–Љ–Є –≤–Ј–≥–ї—П–і–∞–Љ–Є. –Я—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–Є –Њ–і–љ–Њ–≥–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П —Б—З–Є—В–∞–ї–Є, —З—В–Њ –ї—О–±–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –љ–µ–±–љ—Л—Е –Љ–Є–љ–і–∞–ї–Є–љ —В—А–µ–±—Г–µ—В –Є—Е —Г–і–∞–ї–µ–љ–Є—П. –≠—В–Њ –Љ–љ–µ–љ–Є–µ —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–ї–Њ—Б—М –љ–∞ –Њ—Б–љ–Њ–≤–µ –≥–Є–њ–Њ—В–µ–Ј—Л –†. –®—В–µ—А–љ–∞ (1882) –Њ «—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —А–∞–љ–∞—Е» –≤ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ–Љ –њ–Њ–Ї—А–Њ–≤–µ –Ї—А–Є–њ—В –љ–µ–±–љ—Л—Е –Љ–Є–љ–і–∞–ї–Є–љ, —З–µ—А–µ–Ј –Ї–Њ—В–Њ—А—Л–µ –Є–љ—Д–µ–Ї—Ж–Є—П –њ—А–Њ–љ–Є–Ї–∞–µ—В –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ, –≤—Л–Ј—Л–≤–∞—П –ї–Њ–Ї–∞–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤ –љ–µ–±–љ—Л—Е –Љ–Є–љ–і–∞–ї–Є–љ–∞—Е –Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –≤–Њ –Љ–љ–Њ–≥–Є—Е –Њ—А–≥–∞–љ–∞—Е –Є —Б–Є—Б—В–µ–Љ–∞—Е. –°—В–Њ—А–Њ–љ–љ–Є–Ї–Є —Н—В–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є —В–µ–Њ—А–Є–Є —Б—З–Є—В–∞–ї–Є, —З—В–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Є–љ—Д–µ–Ї—Ж–Є–є –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—А–≥–∞–љ–∞—Е –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ (–Љ–Є–Њ–Ї–∞—А–і, –њ–Њ—З–Ї–Є, —Б—Г—Б—В–∞–≤—Л, —Н–љ–і–Њ–Ї—А–Є–љ–љ–∞—П —Б–Є—Б—В–µ–Љ–∞ –Є –і—А.) —Б–≤—П–Ј–∞–љ—Л —Б –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Є–Ј–Љ–µ–љ–µ–љ–љ—Л–Љ–Є –љ–µ–±–љ—Л–Љ–Є –Љ–Є–љ–і–∞–ї–Є–љ–∞–Љ–Є [7, 14]. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —В–∞–Ї–Є—Е –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–є –Њ –љ–µ–±–љ—Л—Е –Љ–Є–љ–і–∞–ї–Є–љ–∞—Е –Є—Е —Б—В–∞—А–∞–ї–Є—Б—М —Г–і–∞–ї—П—В—М —Б —Б–∞–Љ–Њ–≥–Њ —А–∞–љ–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Є –і–∞–ґ–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є –і–ї—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –Њ–њ–∞—Б–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Ю–і–љ–∞–Ї–Њ –і–∞–ї—М–љ–µ–є—И–Є–µ –љ–∞–±–ї—О–і–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –≤ —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –љ–µ–±–љ—Л–µ –Љ–Є–љ–і–∞–ї–Є–љ—Л —Г–і–∞–ї—П—О—В—Б—П, —А–µ–Ј–Ї–Њ –љ–∞—А—Г—И–∞–µ—В—Б—П –Є–Љ–Љ—Г–љ–љ–∞—П –Ј–∞—Й–Є—В–∞ –љ–∞ —А–µ–≥–Є–Њ–љ–∞–ї—М–љ–Њ–Љ —Г—А–Њ–≤–љ–µ: –≤ 3 —А–∞–Ј–∞ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —З–∞—Б—В–Њ—В–∞ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –љ–Њ—Б–∞, –≤ 8 —А–∞–Ј – –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Њ–Ї–Њ–ї–Њ–љ–Њ—Б–Њ–≤—Л—Е –њ–∞–Ј—Г—Е, –≤ 12 —А–∞–Ј – —Д–∞—А–Є–љ–≥–Є—В–∞, –≤ 10 —А–∞–Ј –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Њ—Б—В—А—Л–Љ–Є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–Љ–Є –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є [7]. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Є–Ј–±—Л—В–Њ—З–љ—Л–є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–є —А–∞–і–Є–Ї–∞–ї–Є–Ј–Љ –±—Л–ї –њ—А–Є–Ј–љ–∞–љ –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л–Љ.
–Я—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–Є –і—А—Г–≥–Њ–≥–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П, –Њ—Б–љ–Њ–≤—Л–≤–∞—П—Б—М –љ–∞ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —А–Њ–ї–Є –љ–µ–±–љ—Л—Е –Љ–Є–љ–і–∞–ї–Є–љ –≤ —А–µ–∞–Ї—Ж–Є—П—Е –Њ–±—Й–µ–≥–Њ –Є –Љ–µ—Б—В–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞, —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–ї–Є —Г—Б—В–Њ–є—З–Є–≤–Њ–µ –Љ–љ–µ–љ–Є–µ –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є—П —Г–љ–Є–Ї–∞–ї—М–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А –≥–ї–Њ—В–Ї–Є, —В. –Ї. –Є—Е —Г—В—А–∞—В–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –љ–µ–≤–Њ—Б–њ–Њ–ї–љ–Є–Љ–Њ–є –њ–Њ—В–µ—А–µ–є –і–ї—П –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ [19]. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —В–Њ–љ–Ј–Є–ї–ї—Н–Ї—В–Њ–Љ–Є–є —А–µ–Ј–Ї–Њ —Б–Њ–Ї—А–∞—В–Є–ї–Њ—Б—М. –•–Є—А—Г—А–≥–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є –•–Ґ —Б–љ–Є–Ј–Є–ї–∞—Б—М –≤ 2 —А–∞–Ј–∞. –Ю–і–љ–∞–Ї–Њ –њ—А–Є —Н—В–Њ–Љ —З–Є—Б–ї–Њ —Н–Ї—Б—В—А–µ–љ–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є –њ–Њ –њ–Њ–≤–Њ–і—Г –њ–∞—А–∞—В–Њ–љ–Ј–Є–ї–ї—П—А–љ–Њ–≥–Њ –∞–±—Б—Ж–µ—Б—Б–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –≤–Њ–Ј—А–Њ—Б–ї–Њ –≤ 2 —А–∞–Ј–∞ [7, 21]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –∞–±—Б–Њ–ї—О—В–Є–Ј–∞—Ж–Є—П –Ї–∞–Ї —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ, —В–∞–Ї –Є –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –•–Ґ –љ–µ –Љ–Њ–ґ–µ—В —Б—З–Є—В–∞—В—М—Б—П —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є. –Ю–±–∞ –≤–Ј–≥–ї—П–і–∞ –љ–∞ –љ–µ–±–љ—Л–µ –Љ–Є–љ–і–∞–ї–Є–љ—Л – –Є –Ї–∞–Ї –љ–∞ –Є—Б—В–Њ—З–љ–Є–Ї —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Є –Ї–∞–Ї –љ–∞ –Ј–∞—Й–Є—В–љ—Л–є –Њ—А–≥–∞–љ –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л – –і–Њ–ї–ґ–љ—Л —Г—З–Є—В—Л–≤–∞—В—М—Б—П –њ—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є —В–∞–Ї—В–Є–Ї–Є –ї–µ—З–µ–љ–Є—П. –Р–Ї—В—Г–∞–ї—М–љ—Л–Љ –Њ—Б—В–∞–µ—В—Б—П –≤–Њ–њ—А–Њ—Б –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є, –≤ —В. —З. –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –•–Ґ —Г –і–µ—В–µ–є.
–°–Ю –Т–Ф–Я —П–≤–ї—П–µ—В—Б—П —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –±–∞—А—М–µ—А–Њ–Љ –і–ї—П —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–љ—Л—Е –∞–≥–µ–љ—В–Њ–≤. –Р–≥—А–µ—Б—Б–Є–≤–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –Љ–Њ–≥—Г—В —А–µ–∞–ї–Є–Ј–Њ–≤–∞—В—М—Б—П —В–Њ–ї—М–Ї–Њ –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –љ–∞—А—Г—И–µ–љ–Є—П —Н—В–Є—Е –±–∞—А—М–µ—А–Њ–≤. –С–∞—А—М–µ—А–љ–∞—П —Д—Г–љ–Ї—Ж–Є—П –°–Ю –Т–Ф–Я –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —А—П–і–Њ–Љ –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤. –Т—Л–і–µ–ї—П—О—В 2 –±–∞—А—М–µ—А–∞, –Ї–Њ—В–Њ—А—Л–µ —В–µ—Б–љ–Њ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–∞–љ—Л: –≤—А–Њ–ґ–і–µ–љ–љ—Л–є (–љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є) – —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є, —Б–µ–Ї—А–µ—В, —Д–∞–≥–Њ—Ж–Є—В—Л –Є –∞–і–∞–њ—В–Є–≤–љ—Л–є (–Є–Љ–Љ—Г–љ–љ—Л–є) – –ї–Є–Љ—Д–Њ—Ж–Є—В—Л, –∞–љ—В–Є—В–µ–ї–∞ –Є —В. –і. [8].
–Э–∞ –Љ–µ—Б—В–љ–Њ–Љ —Г—А–Њ–≤–љ–µ –Ј–∞—Й–Є—В–љ—Л–µ —Д—Г–љ–Ї—Ж–Є–Є –°–Ю –Ј–∞–Ї–ї—О—З–∞—О—В—Б—П –≤ –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–Є –њ—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–Є—П –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –Ї —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ–Љ—Г —Б–ї–Њ—О, –≤—Л–≤–µ–і–µ–љ–Є–Є —З—Г–ґ–µ—А–Њ–і–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є–Ј –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, —А–∞–Ј—А—Г—И–µ–љ–Є–Є –њ–∞—В–Њ–≥–µ–љ–∞ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –µ–≥–Њ —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–µ–є. –Т –љ–∞–і—Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ–Љ —Б–ї–Њ–µ –Ј–∞—Й–Є—В–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В—М—О –Љ—Г–Ї–Њ—Ж–Є–ї–Є–∞—А–љ–Њ–≥–Њ –Ї–ї–Є—А–µ–љ—Б–∞, –∞–љ—В–Є—В–µ–ї (—Б–µ–Ї—А–µ—В–Њ—А–љ—Л–µ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ—Л (Ig) –Ї–ї–∞—Б—Б–∞ –Р), —Д–∞–≥–Њ—Ж–Є—В–Њ–≤ (–љ–µ–є—В—А–Њ—Д–Є–ї—Л) –Є —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤. –Я—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –њ–∞—В–Њ–≥–µ–љ–∞ –≤ –њ–Њ–і—Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–є —Б–ї–Њ–є –≤–Ї–ї—О—З–∞–µ—В –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –љ–∞ –Њ—В–≥—А–∞–љ–Є—З–µ–љ–Є–µ —Г—З–∞—Б—В–Ї–∞ —Б —З—Г–ґ–µ—А–Њ–і–љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ —А–∞–Ј—А—Г—И–µ–љ–Є–µ–Љ –Є –≤—Л–≤–µ–і–µ–љ–Є–µ–Љ –њ–∞—В–Њ–≥–µ–љ–∞ –Є–Ј –°–Ю. –°–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В—М —Н—В–Є—Е —Д—Г–љ–Ї—Ж–Є–є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –њ–Њ–љ—П—В–Є–µ «–Љ–µ—Б—В–љ—Л–є –Є–Љ–Љ—Г–љ–Є—В–µ—В». –Ь–µ—Б—В–љ—Л–є –Є–Љ–Љ—Г–љ–Є—В–µ—В –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–Љ –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞—Й–Є—В–љ—Л—Е –њ—А–Є—Б–њ–Њ—Б–Њ–±–ї–µ–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –љ–∞—Б—В–Њ–ї—М–Ї–Њ —Б–Њ–≤–µ—А—И–µ–љ–љ—Л, —З—В–Њ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ—А–Є –Є—Е –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —А–∞–±–Њ—В–µ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–∞ [4, 8].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –љ–∞—Г—З–љ—Л—Е —А–∞–±–Њ—В –њ–Њ—Б–≤—П—Й–µ–љ–Њ –Є–Ј—Г—З–µ–љ–Є—О –Є–Љ–Љ—Г–љ–Њ–њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –•–Ґ –Є –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –Є–Љ–Љ—Г–љ–Њ–Ї–Њ—А—А–µ–Ї—Ж–Є–Є. –° —Ж–µ–ї—М—О –Є–Љ–Љ—Г–љ–Њ–Ї–Њ—А—А–µ–Ї—Ж–Є–Є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —Б—А–µ–і—Б—В–≤–∞ –Є–Ј —А–∞–Ј–ї–Є—З–љ—Л—Е –Є—Б—В–Њ—З–љ–Є–Ї–Њ–≤, —В–∞–Ї–Є–µ –Ї–∞–Ї —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–µ —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є–µ, —Н–Ї—Б—В—А–∞–Ї—В—Л —В–Ї–∞–љ–µ–є –Є–ї–Є —Б–Љ–µ—Б—М –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤.
–Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –љ–∞–Ї–Њ–њ–ї–µ–љ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–Љ–Љ—Г–љ–Њ—Б—В–Є–Љ—Г–ї—П—В–Њ—А–Њ–≤ –Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П —Б —Ж–µ–ї—М—О –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Ы–Ю–†-–Њ—А–≥–∞–љ–Њ–≤.
–Ю–і–љ–Є–Љ –Є–Ј –≤–∞–ґ–љ–µ–є—И–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Ј–∞—Й–Є—В—Л –°–Ю —П–≤–ї—П—О—В—Б—П –∞–љ—В–Є—В–µ–ї–∞. –Ю–љ–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –Њ–њ—Б–Њ–љ–Є–Ј–∞—Ж–Є–Є –њ–∞—В–Њ–≥–µ–љ–Њ–≤ (–±–∞–Ї—В–µ—А–Є–є, –≤–Є—А—Г—Б–Њ–≤), –љ–µ–є—В—А–∞–ї–Є–Ј–∞—Ж–Є–Є —В–Њ–Ї—Б–Є–љ–Њ–≤, –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Д–∞–Ї—В–Њ—А–Њ–≤ –≤—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞ – —Д–∞–≥–Њ—Ж–Є—В–Њ–Ј–∞ –Є –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Є—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є –∞–љ—В–Є—В–µ–ї –љ–∞ –°–Ю –Т–Ф–Я –Є –њ–Њ–ї–Њ—Б—В–Є —А—В–∞ —П–≤–ї—П—О—В—Б—П –љ–µ–±–љ—Л–µ –Љ–Є–љ–і–∞–ї–Є–љ—Л –Є –Љ—Г–Ї–Њ–Ј–Њ-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–∞—П –ї–Є–Љ—Д–Њ–Є–і–љ–∞—П —В–Ї–∞–љ—М (–Ь–Р–Ы–Ґ). –°–Њ–≥–ї–∞—Б–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ, –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Њ—В–≤–µ—В –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В—Б—П –ї–Є–Љ—Д–Њ–Є–і–љ—Л–Љ–Є –Њ—А–≥–∞–љ–∞–Љ–Є (–љ–µ–±–љ—Л–µ –Љ–Є–љ–і–∞–ї–Є–љ—Л, –Ь–Р–Ы–Ґ) –Є —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П —З–µ—А–µ–Ј –∞–Ї—В–Є–≤–∞—Ж–Є—О –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –∞–љ—В–Є—В–µ–ї–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Є –Ї–ї–µ—В–Њ–Ї —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ [4, 7, 10].
–С–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –ї–Є–Ј–∞—В—Л, –Є–љ–Њ–≥–і–∞ –µ—Й–µ –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ –Њ—А–∞–ї—М–љ—Л–Љ–Є –≤–∞–Ї—Ж–Є–љ–∞–Љ–Є, –њ–Њ—П–≤–Є–ї–Є—Б—М –≤ 1970-—Е –≥–≥. –Ч–∞ –≥–Њ–і—Л –±—Л–ї–Є –љ–∞–Ї–Њ–њ–ї–µ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Є –±–ї–∞–≥–Њ–і–∞—А—П –ї—Г—З—И–µ–Љ—Г –њ–Њ–љ–Є–Љ–∞–љ–Є—О –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –і–µ–є—Б—В–≤–Є—П –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –ї–Є–Ј–∞—В–Њ–≤ –Є–љ—В–µ—А–µ—Б –Ї –љ–Є–Љ –≤ –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П —Б–љ–Њ–≤–∞ –≤–Њ–Ј—А–Њ—Б. –С–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –ї–Є–Ј–∞—В—Л –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є —Б–Љ–µ—Б—М –∞–љ—В–Є–≥–µ–љ–Њ–≤, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –Є–Ј —А–∞–Ј–ї–Є—З–љ—Л—Е –Є–љ–∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–љ—Л—Е –±–∞–Ї—В–µ—А–Є–є, – –Њ–±—Л—З–љ–Њ –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Я–Њ—Б–ї–µ –Љ–∞—Б—Б–Њ–≤–Њ–≥–Њ –≤—Л—А–∞—Й–Є–≤–∞–љ–Є—П –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ –∞–љ—В–Є–≥–µ–љ—Л –њ–Њ–ї—Г—З–∞—О—В –ї–Є–±–Њ —Б –њ–Њ–Љ–Њ—Й—М—О –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–Є–Ј–Є—Б–∞, –ї–Є–±–Њ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–Є–Ј–Є—Б–∞, —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –ї–Є–Њ—Д–Є–ї–Є–Ј–∞—Ж–Є–µ–є (–≤—Л—Б—Г—И–Є–≤–∞–љ–Є–µ–Љ), –∞ –Ј–∞—В–µ–Љ —Б–Љ–µ—И–Є–≤–∞—О—В –≤ –Ј–∞–і–∞–љ–љ—Л—Е –њ—А–Њ–њ–Њ—А—Ж–Є—П—Е. –≠—Д—Д–µ–Ї—В–Є–≤–љ—Л–є –ї–Є–Ј–Є—Б –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —П–≤–ї—П–µ—В—Б—П –Ї–ї—О—З–µ–≤—Л–Љ —Н—В–∞–њ–Њ–Љ. –Ю–њ—В–Є–Љ–∞–ї—М–љ–∞—П —Д–Њ—А–Љ–∞ –њ—А–µ–Ј–µ–љ—В–∞—Ж–Є–Є –∞–љ—В–Є–≥–µ–љ–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї –µ–≥–Њ –≤–µ—А–љ–Њ–Љ—Г –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—О –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ–Њ–є, –Є —Н—В–Њ –і–Њ—Б—В–Є–ґ–Є–Љ–Њ –њ—А–Є —Б–Њ–±–ї—О–і–µ–љ–Є–Є –µ–≥–Њ —З–Є—Б—В–Њ—В—Л –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є. –Я–Њ —Н—В–Њ–є –њ—А–Є—З–Є–љ–µ –Њ—З–µ–љ—М –≤–∞–ґ–љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Б–Њ—Е—А–∞–љ–Є—В—М –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ —Б—В–µ–љ–Ї–Є —Б—В—А—Г–Ї—В—Г—А–љ–Њ –Є–љ—В–∞–Ї—В–љ—Л–Љ–Є. –Ґ–∞–Ї–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞ —Г–і–∞–µ—В—Б—П –і–Њ—Б—В–Є–≥–љ—Г—В—М –њ—А–Є –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–Љ –ї–Є–Ј–Є—Б–µ, –Ї–Њ—В–Њ—А—Л–є, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ –ї–Є–Ј–Є—Б–Њ–Љ, –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ–±–Є—В—М—Б—П –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є –і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –∞–љ—В–Є–≥–µ–љ–Њ–≤ –і–ї—П –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –∞–љ—В–Є—В–µ–ї, —В. –Ї. —З–∞—Б—В—М –∞–љ—В–Є–≥–µ–љ–Њ–≤ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –≤ –љ–∞—В–Є–≤–љ–Њ–є —Д–Њ—А–Љ–µ [4].
–Я—А–Є —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–Љ –ї–Є–Ј–Є—Б–µ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Ї—Г–ї—М—В—Г—А –Ї–Њ–љ–µ—З–љ—Л–Љ –њ—А–Њ–і—Г–Ї—В–Њ–Љ —П–≤–ї—П—О—В—Б—П –і–µ–љ–∞—В—Г—А–Є—А–Њ–≤–∞–љ–љ—Л–µ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –∞–љ—В–Є–≥–µ–љ—Л —Б–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –±—Л—В—М —А–∞—Б–њ–Њ–Ј–љ–∞–љ–љ—Л–Љ–Є –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ–Њ–є. –С–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–µ –∞–љ—В–Є–≥–µ–љ—Л, –Ї–Њ—В–Њ—А—Л–µ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–Є–Ј–Є—Б–∞ –Њ—Б—В–∞—О—В—Б—П —Б—В—А—Г–Ї—В—Г—А–љ–Њ –Є–љ—В–∞–Ї—В–љ—Л–Љ–Є, –≥–Њ—А–∞–Ј–і–Њ –±—Л—Б—В—А–µ–µ –љ–∞–Ї–∞–њ–ї–Є–≤–∞—О—В—Б—П –Є —А–∞—Б–њ–Њ–Ј–љ–∞—О—В—Б—П –і–µ–љ–і—А–Є—В–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–Љ–Є –љ–∞ –°–Ю –њ–Њ–ї–Њ—Б—В–Є —А—В–∞ (–Љ–µ—Б—В–љ—Л–є –Є–Љ–Љ—Г–љ–љ—Л–є –Њ—В–≤–µ—В) [4, 8].
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е in vitro –ї–Є–Ј–∞—В—Л –±–∞–Ї—В–µ—А–Є–є, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–Љ –њ—Г—В–µ–Љ, –њ—А–Є–≤–Њ–і–Є–ї–Є –Ї –∞–Ї—В–Є–≤–∞—Ж–Є–Є –і–µ–љ–і—А–Є—В–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –њ—А–Є —Н—В–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–∞–ї–Є —Н–Ї—Б–њ—А–µ—Б—Б–Є—П –љ–∞ –Љ–µ–Љ–±—А–∞–љ–µ –Ї–Њ-—Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–Є—Е –Љ–Њ–ї–µ–Ї—Г–ї (CD83, CD80, CD86) –Є –Є–љ–і—Г–Ї—Ж–Є—П —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ – –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞ (–Ш–Ы) -2, –Є–љ—В–µ—А—Д–µ—А–Њ–љ–∞-γ, –Ш–Ы-10, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л—Е –і–ї—П –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ґ- –Є B-–ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ [16]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П in vivo –і–Њ–Ї–∞–Ј–∞–ї–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —А—П–і–∞ Ig (IgM, IgG, IgA) –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Б–µ–Ї—А–µ—Ж–Є–Є IgA –≤ —Б–ї—О–љ–µ –≤ –Њ—В–≤–µ—В –љ–∞ –њ—А–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –ї–Є–Ј–∞—В–∞, –њ–Њ–ї—Г—З–µ–љ–љ–Њ–≥–Њ –њ—Г—В–µ–Љ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–Є–Ј–Є—Б–∞, –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, –≤–Њ—Б–њ—А–Є–Є–Љ—З–Є–≤—Л–Љ–Є –Ї —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–Љ –Є–љ—Д–µ–Ї—Ж–Є—П–Љ [13, 17].
–•–Њ—А–Њ—И—Г—О –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ—Г—О –±–∞–Ј—Г (15 —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б —Г—З–∞—Б—В–Є–µ–Љ 2557 –њ–∞—Ж–Є–µ–љ—В–Њ–≤) –Є–Љ–µ–µ—В –њ—А–µ–њ–∞—А–∞—В –Ш—Б–Љ–Є–≥–µ–љ, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–є —Б–Њ–±–Њ–є –њ–Њ–ї–Є–≤–∞–ї–µ–љ—В–љ—Л–є –∞–љ—В–Є–≥–µ–љ–љ—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б, –≤–Ї–ї—О—З–∞—О—Й–Є–є –ї–Є–Ј–∞—В—Л –±–∞–Ї—В–µ—А–Є–є – –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞—О—Й–Є—Е—Б—П –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є (Staphylococcus aureus, Streptococcus pyogenes, Streptococcus viridans, Streptococcus pneumoniae (—В–Є–њ TY1/EQ11, TY2/EQ22, TY3/EQ14, TY5/EQ15, TY8/EQ23, TY47/EQ24), Klebsiella pneumoniae, Klebsiella ozaenae, Haemophilus influenzae B, Neisseria catarrhalis). –Ы–Є–Ј–∞—В—Л, –≤—Е–Њ–і—П—Й–Є–µ –≤ —Б–Њ—Б—В–∞–≤ –Ш—Б–Љ–Є–≥–µ–љ–∞, –њ–Њ–ї—Г—З–µ–љ—Л –њ—Г—В–µ–Љ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–Є–Ј–Є—Б–∞.
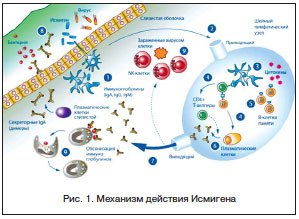
–Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Ш—Б–Љ–Є–≥–µ–љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В—М—О —Б–ї–µ–і—Г—О—Й–Є—Е –Є–Љ–Љ—Г–љ–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є (—А–Є—Б. 1): –Ј–∞—Е–≤–∞—В –∞–љ—В–Є–≥–µ–љ–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е—Б—П –≤ –Ш—Б–Љ–Є–≥–µ–љ–µ, –і–µ–љ–і—А–Є—В–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є –љ–∞ —Г—А–Њ–≤–љ–µ –°–Ю –њ–Њ–ї–Њ—Б—В–Є —А—В–∞; —Б–Њ–Ј—А–µ–≤–∞–љ–Є–µ, –∞–Ї—В–Є–≤–∞—Ж–Є—П –Є –Љ–Є–≥—А–∞—Ж–Є—П –і–µ–љ–і—А–Є—В–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Ї —И–µ–є–љ–Њ–Љ—Г –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Њ–Љ—Г —Г–Ј–ї—Г; –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–µ –∞–љ—В–Є–≥–µ–љ–Њ–≤ –і–µ–љ–і—А–Є—В–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є –Ґ-–ї–Є–Љ—Д–Њ—Ж–Є—В–∞–Љ –Є —Б–µ–Ї—А–µ—Ж–Є—П –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ –і–µ–љ–і—А–Є—В–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є; –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ—Л–µ –і–µ–љ–і—А–Є—В–љ—Л–µ –Ї–ї–µ—В–Ї–Є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ NK-–Ї–ї–µ—В–Њ–Ї; —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —З–Є—Б–ї–∞ –Ґ-—Е–µ–ї–њ–µ—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, —З—В–Њ –і–µ–ї–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–є —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є—О –Т-–Ї–ї–µ—В–Њ–Ї –≤ –њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ –Ї–ї–µ—В–Ї–Є; —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —З–Є—Б–ї–∞ –Т-–Ї–ї–µ—В–Њ–Ї –њ–∞–Љ—П—В–Є; –≤—Л—А–∞–±–Њ—В–Ї–∞ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е Ig (IgA, IgG, IgM) –њ–ї–∞–Ј–Љ–∞—Ж–Є—В–∞–Љ–Є; –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –≤ –Ї—А–Њ–≤—М –Є–Љ–Љ—Г–љ–Њ–Ї–Њ–Љ–њ–µ—В–µ–љ—В–љ—Л—Е –Ї–ї–µ—В–Њ–Ї (–Ґ-—Е–µ–ї–њ–µ—А–Њ–≤, –њ–ї–∞–Ј–Љ–∞—Ж–Є—В–Њ–≤, NK-–Ї–ї–µ—В–Њ–Ї) –Є Ig; —Б–µ–Ї—А–µ—Ж–Є—П –њ–Њ–ї–Є–Ї–ї–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–≥–Њ IgA –љ–∞ —Г—А–Њ–≤–љ–µ –°–Ю –≤–µ—А—Е–љ–Є—Е –Є –љ–Є–ґ–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є; —Д–∞–≥–Њ—Ж–Є—В–Њ–Ј –±–∞–Ї—В–µ—А–Є–є –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–∞–Љ–Є –±–ї–∞–≥–Њ–і–∞—А—П –Њ–њ—Б–Њ–љ–Є–Ј–Є—А—Г—О—Й–Є–Љ Ig –Є —Г–љ–Є—З—В–Њ–ґ–µ–љ–Є–µ –Ј–∞—А–∞–ґ–µ–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї NK-–Ї–ї–µ—В–Ї–∞–Љ–Є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–µ–њ–∞—А–∞—В —Г–Ї—А–µ–њ–ї—П–µ—В –Љ–µ—Б—В–љ—Л–є –Є–Љ–Љ—Г–љ–Є—В–µ—В, —Г—З–∞—Б—В–≤—Г–µ—В –≤ —Б–Є—Б—В–µ–Љ–љ–Њ–Љ –Є–Љ–Љ—Г–љ–љ–Њ–Љ –Њ—В–≤–µ—В–µ.
–Ґ–∞–±–ї–µ—В–Ї–Є –Ш—Б–Љ–Є–≥–µ–љ –њ—А–Є–љ–Є–Љ–∞—О—В—Б—П —Б—Г–±–ї–Є–љ–≥–≤–∞–ї—М–љ–Њ, –њ–Њ—Н—В–Њ–Љ—Г –Љ–Њ–ї–µ–Ї—Г–ї—Л –∞–љ—В–Є–≥–µ–љ–∞ –Љ–Њ–≥—Г—В –ї–µ–≥–Ї–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ—П—В—М—Б—П —З–µ—А–µ–Ј –°–Ю –Т–Ф–Я –Є —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞—В—М –Љ–µ—Б—В–љ—Г—О –Є–Љ–Љ—Г–љ–љ—Г—О —А–µ–∞–Ї—Ж–Є—О, –Љ–∞–Ї—А–Њ–Љ–Њ–ї–µ–Ї—Г–ї—Л –њ—А–Є —Н—В–Њ–Љ –љ–µ –њ–Њ–і–≤–µ—А–≥–∞—О—В—Б—П —А–∞–Ј—А—Г—И–µ–љ–Є—О –ґ–µ–ї—Г–і–Њ—З–љ—Л–Љ —Б–Њ–Ї–Њ–Љ, —З—В–Њ –њ—А–Њ–Є–Ј–Њ—И–ї–Њ –±—Л –њ—А–Є –њ—А–Њ–≥–ї–∞—В—Л–≤–∞–љ–Є–Є —В–∞–±–ї–µ—В–Ї–Є.
–Т —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–∞–±–ї–µ—В–Њ–Ї –Ш—Б–Љ–Є–≥–µ–љ –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –Є–Ј 180 —И–Ї–Њ–ї—М–љ–Є–Ї–Њ–≤ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 5–10 –ї–µ—В —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ–Є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є. –°—А–µ–і–Є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –±—Л–ї–Є —Б–ї–µ–і—Г—О—Й–Є–µ –Є–љ—Д–µ–Ї—Ж–Є–Є –Т–Ф–Я: –Њ—В–Є—В—Л, –ї–∞—А–Є–љ–≥–Є—В—Л, —Б–Є–љ—Г—Б–Є—В—Л –Є —Д–∞—А–Є–љ–≥–Њ—В–Њ–љ–Ј–Є–ї–ї–Є—В—Л. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Њ—Ж–µ–љ–Ї–∞ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –≤ –њ–µ—А–Є–Њ–і –њ–Њ—Б–ї–µ–ї–µ—З–µ–±–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П. –Ю–±–µ –≥—А—Г–њ–њ—Л –њ—А–Њ—Е–Њ–і–Є–ї–Є –ї–µ—З–µ–љ–Є–µ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —Б—Е–µ–Љ–Њ–є –ї–µ—З–µ–љ–Є—П.
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ –ї–µ—З–µ–љ–Є–µ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —В–∞–±–ї–µ—В–Њ–Ї –Ш—Б–Љ–Є–≥–µ–љ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–Љ–µ–љ—М—И–Є–ї–Њ –Њ–±—Й–µ–µ —З–Є—Б–ї–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б—А–µ–і–Є –і–µ—В–µ–є (-54% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ): 374 —Б–ї—Г—З–∞—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ –њ–ї–∞—Ж–µ–±–Њ-–≥—А—Г–њ–њ–µ –Є 169 —Б–ї—Г—З–∞–µ–≤ —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Ш—Б–Љ–Є–≥–µ–љ (—А<0,01).
–Т –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М —В–∞–Ї–ґ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ—А–Њ–њ—Г—Й–µ–љ–љ—Л—Е –і–љ–µ–є –≤ —И–Ї–Њ–ї–µ –њ–Њ –њ—А–Є—З–Є–љ–µ –±–Њ–ї–µ–Ј–љ–Є. –Т –њ–ї–∞—Ж–µ–±–Њ-–≥—А—Г–њ–њ–µ –Њ–±—Й–µ–µ —З–Є—Б–ї–Њ –њ—А–Њ–њ—Г—Й–µ–љ–љ—Л—Е –і–љ–µ–є —Б–Њ—Б—В–∞–≤–Є–ї–Њ 1452, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤ –≥—А—Г–њ–њ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Ш—Б–Љ–Є–≥–µ–љ – 728 –і–љ–µ–є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ш—Б–Љ–Є–≥–µ–љ –њ–Њ–Љ–Њ–≥ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–Є—В—М (-49%) –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —И–Ї–Њ–ї—М–љ—Л—Е –і–љ–µ–є, –њ—А–Њ–њ—Г—Й–µ–љ–љ—Л—Е –і–µ—В—М–Љ–Є —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ–Є –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є (—А<0,01) [11].
–Т –і—А—Г–≥–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –њ–Њ–ї—М–Ј–∞ –Њ—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ш—Б–Љ–Є–≥–µ–љ–∞ –≤ –ї–µ—З–µ–љ–Є–Є 89 –і–µ—В–µ–є (–Њ—В 10 –Љ–µ—Б. –і–Њ 10 –ї–µ—В) —Б —Ж–µ–ї—М—О –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –і—Л—Е–∞—В–µ–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –°—А–∞–≤–љ–µ–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–Њ–є, –њ—А–Є–љ–Є–Љ–∞–≤—И–µ–є –Ш—Б–Љ–Є–≥–µ–љ, –њ–ї–∞—Ж–µ–±–Њ-–≥—А—Г–њ–њ–Њ–є, –∞ —В–∞–Ї–ґ–µ –≥—А—Г–њ–њ–Њ–є, –љ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–µ–є –Ї–∞–Ї–Є—Е-–ї–Є–±–Њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ј–∞ –њ—А–µ–і—Л–і—Г—Й–Є–є –Ј–Є–Љ–љ–Є–є –њ–µ—А–Є–Њ–і. –Я–∞—Ж–Є–µ–љ—В—Л –≤—Б–µ—Е –≥—А—Г–њ–њ –њ—А–Њ—Е–Њ–і–Є–ї–Є –ї–µ—З–µ–љ–Є–µ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —Б—Е–µ–Љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –ї–µ—З–µ–љ–Є–µ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Ш—Б–Љ–Є–≥–µ–љ–∞ –і–∞–ї–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Б–љ–Є–Ј–Є—В—М —З–∞—Б—В–Њ—В—Г —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О –Ї–∞–Ї —Б –њ–ї–∞—Ж–µ–±–Њ-–≥—А—Г–њ–њ–Њ–є, —В–∞–Ї –Є —Б –Ї–Њ–љ—В—А–Њ–ї–µ–Љ. –°—А–µ–і–љ–µ–µ —З–Є—Б–ї–Њ —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П: 7,84/–њ–∞—Ж–Є–µ–љ—В – –Ї–Њ–љ—В—А–Њ–ї—М, 6,78/–њ–∞—Ж–Є–µ–љ—В – –њ–ї–∞—Ж–µ–±–Њ-–≥—А—Г–њ–њ–∞, 4,78/–њ–∞—Ж–Є–µ–љ—В – –Ш—Б–Љ–Є–≥–µ–љ-–≥—А—Г–њ–њ–∞. –Я—А–Є–µ–Љ –Ш—Б–Љ–Є–≥–µ–љ–∞ –њ–Њ–Ј–≤–Њ–ї–Є–ї —Б–љ–Є–Ј–Є—В—М —З–∞—Б—В–Њ—В—Г –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –љ–∞ 39 –Є –љ–∞ 30% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –Є –њ–ї–∞—Ж–µ–±–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (—А–Є—Б. 2) [20].
–Т —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Є–Ј—Г—З–∞–ї—Б—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї –ї–µ—З–µ–љ–Є—П —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Ш—Б–Љ–Є–≥–µ–љ–∞ —Б —Ж–µ–ї—М—О –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є—Е –Є–љ—Д–µ–Ї—Ж–Є–є –Т–Ф–Я. –Ф–µ—В—Б–Ї–∞—П –њ–Њ–њ—Г–ї—П—Ж–Є—П –Є–Ј 120 –і–µ—В–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ 4–9 –ї–µ—В, –±–Њ–ї–µ—О—Й–Є—Е —А–Є–љ–Њ—Д–∞—А–Є–љ–≥–Є—В–Њ–Љ –Є/–Є–ї–Є –Њ—В–Є—В–Њ–Љ —Б—А–µ–і–љ–µ–≥–Њ —Г—Е–∞, –Є/–Є–ї–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ —Д–∞—А–Є–љ–≥–Њ—В–Њ–љ–Ј–Є–ї–ї–Є—В–Њ–Љ, –±—Л–ї–∞ –њ–Њ–і–µ–ї–µ–љ–∞ –љ–∞ 3 –≥—А—Г–њ–њ—Л. 1-—П –≥—А—Г–њ–њ–∞ –њ—А–Њ—Е–Њ–і–Є–ї–∞ –ї–µ—З–µ–љ–Є–µ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Ш—Б–Љ–Є–≥–µ–љ–∞, 2-—П –≥—А—Г–њ–њ–∞ –њ–Њ–ї—Г—З–∞–ї–∞ —Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –ї–Є–Ј–∞—В –±–∞–Ї—В–µ—А–Є–є –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞, –∞ 3-—П –≥—А—Г–њ–њ–∞ –љ–µ –њ–Њ–ї—Г—З–∞–ї–∞ –љ–Є–Ї–∞–Ї–Є—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–≥—А—Г–њ–њ–∞ –Ї–Њ–љ—В—А–Њ–ї—П). –У—А—Г–њ–њ—Л, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є–µ –Ш—Б–Љ–Є–≥–µ–љ –Є —Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –ї–Є–Ј–∞—В—Л, –њ—А–Њ—Е–Њ–і–Є–ї–Є –ї–µ—З–µ–љ–Є–µ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —Б—Е–µ–Љ–Њ–є —В–µ—А–∞–њ–Є–Є.
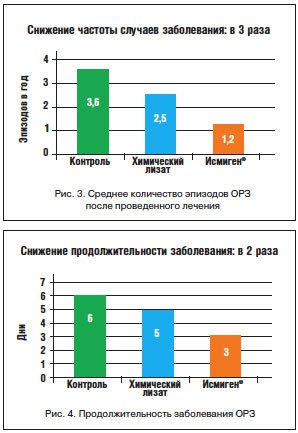
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ–Њ–Љ–Є–Љ–Њ —Б–љ–Є–ґ–µ–љ–Є—П —З–∞—Б—В–Њ—В—Л —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ—А–Є –њ—А–Є–µ–Љ–µ –Ш—Б–Љ–Є–≥–µ–љ–∞ —Б—А–µ–і–љ—П—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —В–∞–Ї–ґ–µ —Б–Њ–Ї—А–∞—В–Є–ї–∞—Б—М –Ї–∞–Ї –≤–Њ –≤—А–µ–Љ—П –Ї—Г—А—Б–∞ –ї–µ—З–µ–љ–Є—П, —В–∞–Ї –Є –≤ –њ–µ—А–Є–Њ–і –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –Є —Б–Њ—Б—В–∞–≤–Є–ї–∞ 6 –і–љ–µ–є –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–љ—В—А–Њ–ї—П, 5 –і–љ–µ–є –≤ –≥—А—Г–њ–њ–µ, –њ—А–Є–љ–Є–Љ–∞–≤—И–µ–є —Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –ї–Є–Ј–∞—В, –Є 3 –і–љ—П –≤ –≥—А—Г–њ–њ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Ш—Б–Љ–Є–≥–µ–љ.
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ш—Б–Љ–Є–≥–µ–љ–∞ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б–Њ–Ї—А–∞—В–Є—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, –ґ–∞—А–Њ–њ–Њ–љ–Є–ґ–∞—О—Й–Є—Е –Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–Њ–є –Є –≥—А—Г–њ–њ–Њ–є, –њ—А–Є–љ–Є–Љ–∞–≤—И–µ–є —Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –ї–Є–Ј–∞—В, –њ—А–Є—З–µ–Љ –і–Њ–≤–Њ–ї—М–љ–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ. –Я–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–Њ–є –Ш—Б–Љ–Є–≥–µ–љ –њ—А–Є–≤–µ–ї –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ 67%, —З—В–Њ –≤ 2 —А–∞–Ј–∞ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є–ї–Њ —А–µ–Ј—Г–ї—М—В–∞—В, –њ–Њ–ї—Г—З–µ–љ–љ—Л–є –≤ –≥—А—Г–њ–њ–µ, –њ—А–Є–љ–Є–Љ–∞–≤—И–µ–є —Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –ї–Є–Ј–∞—В (—А–Є—Б. 3, 4) [15].
–Ю—Б–љ–Њ–≤–љ—Л–µ –љ–∞–±–ї—О–і–∞–µ–Љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Ш—Б–Љ–Є–≥–µ–љ: —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Н–њ–Є–Ј–Њ–і–Њ–≤ —А–µ—Ж–Є–і–Є–≤–Є—А–Њ–≤–∞–љ–Є—П –Њ—Б—В—А—Л—Е –Є –Њ–±–Њ—Б—В—А–µ–љ–Є–є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є —Б–љ–Є–ґ–µ–љ–Є–µ —В—П–ґ–µ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —З–Є—Б–ї–∞ –і–љ–µ–є, –њ—А–Њ–њ—Г—Й–µ–љ–љ—Л—Е –≤ —И–Ї–Њ–ї–µ –њ–Њ –њ—А–Є—З–Є–љ–µ –±–Њ–ї–µ–Ј–љ–Є, –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, —З—В–Њ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Њ—Б–Њ–±–Њ –Ј–љ–∞—З–Є–Љ—Л–є —А–µ–Ј—Г–ї—М—В–∞—В –≤ —Г—Б–ї–Њ–≤–Є—П—Е —А–∞—Б—В—Г—Й–µ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –Ї –љ–Є–Љ.
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —В–∞–±–ї–µ—В–Ї–Є –Ш—Б–Љ–Є–≥–µ–љ –±–µ–Ј–Њ–њ–∞—Б–љ—Л –Є —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б–Є–Љ—Л –≤ –і–µ—В—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ.
–°–Є—Б—В–µ–Љ–∞—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ–±–Ј–Њ—А —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–і–µ–ї–∞—В—М –≤—Л–≤–Њ–і –Њ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –ї–Є–Ј–∞—В–Њ–≤ —Б –Є–љ—В–∞–Ї—В–љ—Л–Љ–Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–Љ–Є –∞–љ—В–Є–≥–µ–љ–∞–Љ–Є, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ—Л—Е –і–ї—П –≤–≤–µ–і–µ–љ–Є—П –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –∞–і—Б–Њ—А–±—Ж–Є–Є —З–µ—А–µ–Ј –°–Ю —А–Њ—В–Њ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є, –і–ї—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–µ—Ж–Є–і–Є–≤–Є—А–Њ–≤–∞–љ–Є—П –Њ—Б—В—А—Л—Е –Є –Њ–±–Њ—Б—В—А–µ–љ–Є–є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Т–Ф–Я –≤ –і–µ—В—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Р–Ј–љ–∞–±–∞–µ–≤–∞ –Ы.–§., –Р—А–µ—Д—М–µ–≤–∞ –Э.–Р., –•–∞—Д–Є–Ј–Њ–≤–∞ –§.–Р., –°–∞–ї–∞—Е–Њ–≤–∞ –Р.–•. –Ш–Љ–Љ—Г–љ–љ–Њ–µ —А–µ–∞–≥–Є—А–Њ–≤–∞–љ–Є–µ –љ–µ–±–љ—Л—Е –Љ–Є–љ–і–∞–ї–Є–љ –њ—А–Є –Є—Е –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≥–µ—А–њ–µ—Б–≤–Є—А—Г—Б–∞–Љ–Є // –†–Њ—Б. –Њ—В–Њ—А–Є–љ–Њ–ї–∞—А. 2008. вДЦ 3.
–°. 3—8.
2. –Р—А–µ—Д—М–µ–≤–∞ –Э.–Р., –Р–Ј–љ–∞–±–∞–µ–≤–∞ –Ы.–§. –Р–і–∞–њ—В–∞—Ж–Є–Њ–љ–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є –љ–µ–±–љ—Л—Е –Љ–Є–љ–і–∞–ї–Є–љ –≤ –љ–Њ—А–Љ–µ –Є –њ—А–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є // –Т–µ—Б—В–љ. –Њ—В–Њ—А–Є–љ–Њ–ї–∞—А. 2010. вДЦ 5. –°. 233—234.
3. –С–µ–ї–Њ–≤ –С.–°., –Э–∞—Б–Њ–љ–Њ–≤–∞ –Т.–Р., –У—А–Є—И–∞–µ–≤–∞ –Ґ.–Я. –†–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л –Њ—Б—В—А–Њ–≥–Њ —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤–Њ–≥–Њ —В–Њ–љ–Ј–Є–ї–ї–Є—В–∞ –Є —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ–Њ–і—Е–Њ–і—Л –Ї –µ–≥–Њ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є // –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–∞—П —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—П. 2000. вДЦ 2. –°. 4–10.
4. –С—Л–Ї–Њ–≤–∞ –Т.–Я. –Ь–Є–љ–і–∞–ї–Є–љ—Л –ї–Є–Љ—Д–∞–і–µ–љ–Њ–Є–і–љ–Њ–≥–Њ –≥–ї–Њ—В–Њ—З–љ–Њ–≥–Њ –Ї–Њ–ї—М—Ж–∞ –≤ —Б–Є—Б—В–µ–Љ–µ –Љ—Г–Ї–Њ–Ј–∞–ї—М–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞ –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є. –Я—А–Њ–±–ї–µ–Љ–∞ —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Є –≤ –Њ—В–Њ—А–Є–љ–Њ–ї–∞—А–Є–љ–≥–Њ–ї–Њ–≥–Є–Є: —В–µ–Ј. –Т—Б–µ—А–Њ—Б. –Ї–Њ–љ—Д. —Б –Љ–µ–ґ–і. —Г—З–∞—Б—В–Є–µ–Љ. –°–∞–Љ–∞—А–∞, 2003. –°. 347—348.
5. –У–∞—А–∞—Й–µ–љ–Ї–Њ –Ґ.–Ш., –С–Њ–≥–Њ–Љ–Є–ї—М—Б–Ї–Є–є –Ь.–†. –Ь–∞–Ї—А–Њ–ї–Є–і—Л –≤ —В–µ—А–∞–њ–Є–Є –Њ—Б—В—А–Њ–≥–Њ —В–Њ–љ–Ј–Є–ї–ї–Є—В–∞ –Є –µ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –і–µ—В–µ–є. –Ь–µ—В–Њ–і–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є. –Ь.: –†–У–Ь–£, 1999. –°. 28.
6. –У–∞—А–∞—Й–µ–љ–Ї–Њ –Ґ.–Ш., –С–Њ–≥–Њ–Љ–Є–ї—М—Б–Ї–Є–є –Ь.–†., –®–Є—И–Љ–∞—А–µ–≤–∞ –Х.–Т. –Э–Њ–≤—Л–µ –њ–Њ–і—Е–Њ–і—Л –Ї –ї–µ—З–µ–љ–Є—О –Њ–±–Њ—Б—В—А–µ–љ–Є–є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Њ–љ–Ј–Є–ї–ї–Є—В–∞ —Г –і–µ—В–µ–є // –Ф–µ—В—Б–Ї–Є–µ –Є–љ—Д–µ–Ї—Ж–Є–Є. 2004. вДЦ 1.
7. –Ъ—А—О–Ї–Њ–≤ –Р.–Ш., –Ш–≤–Њ–є–ї–Њ–≤ –Р.–Ѓ., –Ч–∞—Е–∞—А–Њ–≤–∞ –Р.–§., –Ь–∞—В–≤–µ–µ–≤–∞ –Х.–Т. –Р–љ–∞–ї–Є–Ј –Њ—В–і–∞–ї–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Б–љ–Є–ґ–µ–љ–Є—П —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Г –і–µ—В–µ–є —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ —В–Њ–љ–Ј–Є–ї–ї–Є—В–Њ–Љ // –Т–µ—Б—В–љ. –Њ—В–Њ—А–Є–љ–Њ–ї–∞—А. 2009. вДЦ 5. –°. 7—8.
8. –Ъ—А—О–Ї–Њ–≤ –Р.–Ш. –Ъ–ї–Є–љ–Є–Ї–∞, –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Є –ї–µ—З–µ–љ–Є–µ —В–Њ–љ–Ј–Є–ї–ї—П—А–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є (–њ–Њ—Б–Њ–±–Є–µ –і–ї—П –≤—А–∞—З–µ–є). –Ь., 2011. 32 —Б.
9. –Ъ—А—О–Ї–Њ–≤ –Р.–Ш., –Ґ–Њ–≤–Љ–∞—Б—П–љ –Р.–°., –Ц—Г—Е–Њ–≤–Є—Ж–Ї–Є–є –Т.–У. –С–Є–Њ–њ–ї–µ–љ–Ї–Є –≤ —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Є –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Њ–љ–Ј–Є–ї–ї–Є—В–∞ // –Т–µ—Б—В–љ. –Њ—В–Њ—А–Є–љ–Њ–ї–∞—А. 2008. вДЦ 3. –°.71–74.
10. –¶–≤–µ—В–Ї–Њ–≤ –≠.–Р. –Р–і–µ–љ–Њ—В–Њ–љ–Ј–Є–ї–ї–Є—В—Л –Є –Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П —Г –і–µ—В–µ–є. –°–Я–±: –Є–Ј–і-–≤–Њ –≠–Ы–С 2003. –°. 131.
11. Aksic O.T. et al. Evaluation of the clinical efficacy of a new polyvalent bacterial lysate obtained by mechanical lysis (PMBLTM) in a population of 180 school-aged children with recurrent respiratory infections. European journal of aerobiology environmental medicine and air-borne infections, 2005.
12. Bisno A.L. Acute pharyngitis // N Engl J Med. 2001. Vol. 344 (3). –†. 205–211.
13. Braido F., Schenone G., Pallestrini E. et al. The relationship between mucosal immunoresponse and clinical outcome in patients with recurrent upper respiratory tract infections treated with a mechanical bacterial lysate // J Biol Regul Homeost Agents. 2011. Vol. 25. N 3. P. 477–485.
14. Esposito S., Marchisio P., Capaccio P., Bellasio M., Corti F., Dusi E., Blasi F., Pignataro L., Principi N. Role of atypical bacteria in children undergoing tonsillectomy because of severely recurrent acute tonsillopharyngitis // Eur J Clin Microbiol Infect Dis. 2008. Vol. 27 (12). –†. 1233–1237.
15. La Mantia I. et al. Immunoprophylaxis of recurring bacterial infections of respiratory tracts in pediatric age: clinical experience through a new immune stimulating vaccine. GIMMOC, 2007.
16. Lanzilli G., Falchetti R., Tricarico M. et al. In vitro effects of an immunostimulating bacterial lysate on human lymphocyte function // Int J Immunopathol Pharmacol. 2005. Vol. 18. N 2. P. 245–254.
17. Mevio E., Perano D., Pagani L., Zanella C., Giacobone E., Cardillo A. The role of tissue colonization and bacterial resistance in recurrent tonsillitis // Acta Otolaryngol Suppl. 1996. Vol. 523. –†. 133–137.
18. Pichichero M.E. Group A streptococcal tonsillopharyngitis: cost-effective diagnosis and treatment // Ann Emerg Med. 1995. Vol. 25 (3). –†. 390–403.
19. Piédrola Maroto D., Montiel Quezel N., López Rodríguez I., Monje Vega E., Casado Morente J.C., Povedano Rodríguez V., Fernández Ruiz E., Conde Jiménez M. Present situation of antibiotic resistances in tonsillar infections // Acta Otorrinolaringol Esp. 2006. Vol. 57 (4). –†. 171–175.
20. Rosaschino F. et al. Strategies for optimizing compliance of paediatric patients for seasonal antibacterial vaccination sublingually administrered polyvalent mechanical bacterial lysates (PMBLTM) // Acta bio medica ateneo parmense.2004. 21.Torretta S., Drago L., Marchisio P., Cappadona M., Rinaldi V., Nazzari E., Pignataro L. Recurrences in chronic tonsillitis substained by tonsillar biofilm-producing bacteria in children. Relationship with the grade of tonsillar hyperplasy // Int J Pediatr Otorhinolaryngol. 2013. Vol. 77 (2). –†. 200–204.
22. Tricarico D., Varricchio A., D'Ambrosio S. et al. Prevention of recurrent upper respiratory tract infections in a community of cloistered nuns using a new immunostimulating bacterial lysate. A randomized, double-blind clinical trial // Arzneimittelforschung. 2004. Vol. 54. N 1. P. 57–63.
23. Zautner A.E., Krause M., Stropahl G., Holtfreter S., Frickmann H., Maletzki C., Kreikemeyer B., Pau H.W., Podbielski A. Intracellular persisting Staphylococcus aureus is the major pathogen in recurrent tonsillitis // PLoS One. 2010. Vol. 5 (3). –†. 9452.












