Открытию 3 сентября 1928 года Alexander Fleming пенициллина предшествовало стечение ряда обстоятельств, столь невероятных, что в них почти невозможно поверить. В отличие от своих аккуратных коллег, очищавших чашки с бактериальными культурами после окончания работы, А. Флеминг по неряшливости не выбрасывал культуры по 2–3 недели, пока его лабораторный стол не оказывался загроможденным 40–50 чашками. Тогда он принимался за уборку, просматривал культуры одну за другой, чтобы не пропустить что–нибудь интересное. В одной из чашек он обнаружил плесень, которая, к его удивлению, угнетала высеянную культуру стафилококков. Отделив плесень (вид Penicillium notatum), он установил, что "...бульон, на котором разрослась плесень... приобрел отчетливо выраженную способность подавлять рост микроорганизмов, а также бактерицидные и бактериологические свойства по отношению ко многим распространенным патогенным бактериям"1.
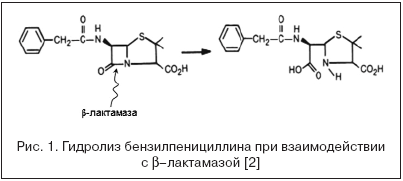
Однако еще до начала клинического применения пенициллина медицина столкнулась с проблемой устойчивости к нему микроорганизмов – первое сообщение об обнаружении штамма Escherichia coli, резистентного к пенициллину, датируется 1940 годом [1]. Именно тогда E.P. Abraham и E. Chain установили, что причиной устойчивости этой грамотрицательной бактерии к пенициллину является ее способность образовывать ферменты, разрушающие структуру антибиотика (рис. 1).
Впоследствии эти ферменты были отнесены к большому классу b–лактамаз, гидролизующих антибактериальные препараты, имеющие в своей структуре b–лактамное кольцо. К настоящему времени известно более 350 b–лактамаз, синтезируемых как грамположительными, так и грамотрицательными микроорганизмами, которые классифицированы на 4 молекулярных класса, в пределах которых ферменты характеризуются общими свойствами и определенным аминокислотным составом [3].
b–лактамазный механизм резистентности микроорганизмов оказался наиболее действенным и распространенным, и дальнейшая эволюция b–лактамов была направлена не только на расширение спектра антибактериальной активности, улучшение фармакокинетических характеристик, но и на преодоление резистентности возбудителей.
В середине 50–х годов было установлено, что основой молекулы пенициллина является 6–аминопенициллиновая кислота, состоящая из двух колец: тиазолидинового и b–лактамного [4]. Модификация b–лактамного кольца путем присоединения боковых цепей послужила отправной точкой для создания новых представителей данного класса антибиотиков (рис. 2). В 1960 году был синтезирован метициллин – первый b–лактамный антибиотик, устойчивый к действию стафилококковых b–лактамаз. Следующий, 1961 год был отмечен появлением на фармацевтическом рынке ампициллина – полусинтетического аминопенициллина широкого спектра, к действию которого оказались чувствительны и некоторые грамотрицательные бактерии (Haemophilus influenzae, Escherichia coli, Proteus mirabilis и др.) [5]. Дальнейшая модификация препарата привела к созданию в 1972 году амоксициллина, отличающегося от своего предшественника значительно улучшенными фармакокинетическими свойствами и большей активностью в отношении ряда микроорганизмов.
Ампициллин и амоксициллин также оказались подвержены ферментативному разрушению, поэтому возникла необходимость в создании веществ, которое помогли бы пенициллинам преодолеть разрушающее действие b–лактамаз.
Амоксициллин/клавуланат –
общая характеристика
Идея о том, что b–лактамные структуры могут ингибировать b–лактамазы, возникла еще в 1956 году, но первый ингибитор b–лактамаз – клавулановая кислота (рис. 2) был получен из культуры Streptomyces clavuligeris только в начале 70–х годов [9]. Клавулановая кислота, как и полученные впоследствии другие ингибиторы b–лактамаз (тазобактам, сульбактам), благодаря наличию в своей структуре b–лактамного кольца образуют стабильный комплекс с b–лактамазой бактерий, что приводит к необратимому подавлению активности фермента и тем самым предотвращает инактивацию антибиотика (табл. 1).
Следует также отметить, что клавулановая кислота является слабым индуктором синтеза хромосомных b–лактамаз, что обусловливает низкие темпы роста резистентности микроорганизмов к препарату [10].
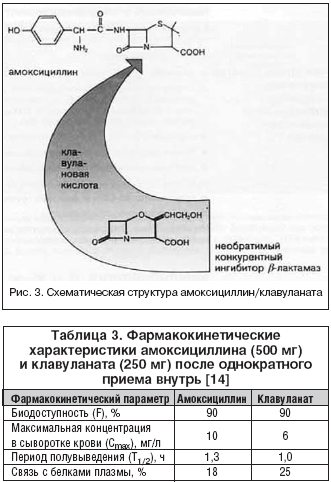
17 сентября 1981 г. в клинической практике появился первый комбинированный препарат, содержащий амоксициллин и клавулановую кислоту – Аугментин, Beecham Pharmaceuticals (Великобритания) (рис. 3).
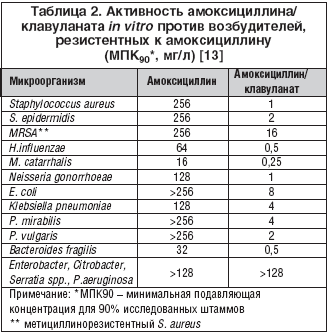
В результате сочетания с клавулановой кислотой амоксициллин восстановил свою природную активность против H. influenzae, Moraxella сatarrhalis, стафилококков, гонококков, неспорообразующих анаэробов. Помимо этого, спектр антимикробной активности амоксициллин/клавуланата расширился за счет действия на ряд грамотрицательных микроорганизмов (Klebsiella spp. и др.) с природной устойчивостью к пенициллинам (табл. 2).
Фармакокинетические параметры амоксициллина и клавуланата сходны (табл. 3) и существенно не изменяются при их комбинированном приеме. Амоксициллин/клавуланат характеризуется высокой биодоступностью при приеме внутрь, хорошим проникновением в различные ткани и жидкости организма (исключение составляют гематоэнцефалический и гематоофтальмический барьеры), что позволяет достичь в них концентраций антибиотика, многократно превосходящих значения МПК для чувствительных микроорганизмов.
Амоксициллин/клавуланат отличается хорошей переносимостью: согласно результатам многочисленных клинических исследований нежелательные явления при применении антибиотика развиваются относительно редко (в 8–14% случаев). В этом плане показательны результаты мета–анализа [15], свидетельствовавшие, что нежелательные явления при применении амоксициллина/клавуланата в большинстве случаев являются дозозависимыми, носят транзиторный характер и не требуют отмены препарата. Среди них чаще всего фигурируют диарея (9%), тошнота (3%), кожная сыпь (3%), изменения со стороны гепатобилиарной системы. По риску применения при беременности амоксициллин/клавуланат относится к категории В (согласно градациям Управления по контролю за лекарствами и пищевыми продуктами; FDA, США), т.е. при изучении у животных не было выявлено риска неблагоприятного действия препарата на плод [16]. Сообщения о токсическом действии амоксициллина/клавуланата на плод человека также отсутствуют. В 2004 году в Израиле было проведено проспективное исследование по оценке безопасности применения амоксициллина/клавуланата в первом триместре беременности у 382 женщин, согласно результатам которого прием препарата оказался безопасным для плода [17].
С целью преодоления устойчивости пневмококков и улучшения переносимости амоксициллина/клавуланата в последние годы были созданы лекарственные формы с повышенным содержанием амоксициллина и сниженным клавулановой кислоты. В современных формах Аугментина для приема внутрь соотношение компонентов составляет 875/125 мг, что позволяет принимать антибиотик 2 раза в сутки и соответственно повышает приверженность пациентов врачебным рекомендациям. Несомненным достоинством амоксициллина/клавуланата является доступность препарата в парентеральной и пероральной лекарственной формах и, как следствие этого – возможность его использования в рамках ступенчатой терапии.
Высокая клиническая эффективность амоксициллина/клавуланата при различных инфекциях доказана в ходе контролированных клинических исследованиях с участием десятков тысяч пациентов на протяжении более чем 25 лет, что делает его, пожалуй, самым изученным антибиотиком в мире.
Широкий спектр антимикробной активности, привлекательная фармакокинетика и приемлемый профиль безопасности позволили амоксициллину/клавуланату (Аугментин) стать одним из наиболее популярных антибактериальных препаратов, применяемых в лечении большого числа инфекционных заболеваний. В числе основных показаний для назначения антибиотика – инфекции дыхательных путей.
Антибиотикорезистентность основных возбудителей инфекций дыхательных путей
В настоящее время подавляющее большинство бактериальных возбудителей за исключением таких клинически значимых микроорганизмов, как Streptococcus pneumoniae и Helicobacter pylori, синтезирует b–лактамазы [18]. По данным исследования TRUST1, в США 30% штаммов Haemophilus influenzae и 90% штаммов Moraxella catarrhalis синтезируют b–лактамазы [19]. Близкие данные были получены и в ходе многоцентрового исследования Alexander Project [20]: продукция b–лактамаз отмечалась у 16,9% исследованных штаммов H. influenzae (n=8523) и у 92,1% M. catarrhalis (n=874). В Alexander Project изучали также чувствительность гемофильной палочки и M. catarrhalis к амоксициллину и амоксициллину/клавуланату. В период с 1992 по 2001 год чувствительность H. influenzae к амоксициллину варьировала от 78 до 86%, что отражает распространенность продуцирующих b–лактамазы штаммов. Чувствительность же к амоксициллину/клавуланату была высокой на протяжении всего исследования (более 97%), а при назначении высоких доз препарата превышала 99%. M. catarrhalis была чувствительна к обычным дозам амоксициллина/клавуланата в 99%, а к высоким – в 100% случаев. Кроме того, чувствительными к действию препарата были 95,5–97,9% штаммов S. pneumoniae (резистентность этого возбудителя к b–лактамам обусловлена модификацией пенициллинсвязывающих белков и не связана с продукцией b–лактамаз) [20].
По данным исследования Пегас I–II, в Российской Федерации в 2003–2005 гг. частота выделения нечувствительных к аминопенициллинам штаммов S. pneumoniae не превышала 0,3%, а уровень устойчивости к ампициллину среди клинических штаммов H. influenzae составил 5%. При этом не было выявлено штаммов, резистентных к амоксициллину/клавуланату [21,22].
Применение амоксициллина/клавуланата
в лечении внебольничных ИДП
Острый тонзиллофарингит (ОТФ). ОТФ является одной из наиболее частых инфекций, встречающихся в амбулаторной практике. В большинстве случаев (в 30–60% случаев у взрослых и в 15–40% случаев у детей) заболевание имеет вирусную этиологию и не требует назначения антибиотиков [23,27]. Среди бактериальных возбудителей ОТФ ведущая роль принадлежит b–гемолитическому стрептококку группы А (БГСА): 15–30% случаев заболевания у детей и 5–17% случаев у взрослых. Относительно редко (<5%) ОТФ могут вызывать и стрептококки групп C и G, а также другие микроорганизмы [23–26]. Наибольшую опасность при стрептококковом ОТФ представляют возможные осложнения, которые подразделяются на ранние (отит, синусит, паратонзиллярный абсцесс) и поздние (острый гломерулонефрит, острая ревматическая лихорадка), что, безусловно, требует назначения антибактериальной терапии (АБТ). Клиническими маркерами бактериальной инфекции являются: передний шейный лимфаденит, лихорадка, гиперемия и экссудат на задней стенке глотки и миндалинах, отсутствие кашля. Показанием для назначения эмпирической АБТ служит наличие всех четырех вышеуказанных критериев. Антибиотики показаны и в том случае, если присутствуют два или три из них в сочетании с положительным результатом тестирования на наличие стрептококкового антигена. Отсутствие этих критериев или наличие одного из них делают антибиотикотерапию тонзиллофарингита недостаточно обоснованной [24–25].
Учитывая высокую чувствительность БГСА к b–лактамным антибиотикам, препаратом выбора для лечения ОТФ является феноксиметилпенициллин [23,24]. При этом у 10–15% пациентов антибиотикотерапия феноксиметилпенициллином не приводит к эрадикации БГСА, что может быть связано с его разрушением b–лактамазами присутствующей в носоглотке ко–патогенной микрофлоры. Вследствие этого при предшествующей (в течение 1 мес.) терапии антибиотиками или при неэффективности феноксиметилпеницилина следует назначать амоксициллин/клавуланат [24,27,30,42].
Хронический (рецидивирующий) тонзиллофарингит. Под рецидивирующим стрептококковым тонзиллофарингитом понимают множественные эпизоды заболевания в течение нескольких месяцев при наличии соответствующих клинических и эпидемиологических данных, положительных результатов бактериологических и/или экспресс–методов диагностики БГСА, отрицательных результатов микробиологических исследований в промежутках между эпизодами заболевания и повышением титров противострептококковых антител после каждого случая болезни [23,24]. При хроническом тонзиллите микрофлора миндалин существенно отличается по своему составу от таковой при ОТФ. В таблице 4 представлен спектр микрофлоры, полученной при тонзиллэктомии у 98 пациентов. Примечательно, что более 70% микроорганизмов, выделенных из глубоких тканей миндалин, продуцировали b–лактамазы.
Таким образом, при наличии хронического рецидивирующего стрептококкового тонзиллофарингита вероятность колонизации очага инфекции микроорганизмами, продуцирующими b–лактамазы, достаточно высока, что требует назначения амоксициллина/клавуланата (Аугментин), цефалоспоринов II поколения или линкозамидов [24,29].
Острый синусит (ОС). ОС – воспаление слизистой оболочки носовой полости и околоносовых пазух носа. ОС является наиболее частым осложнением острой респираторной вирусной инфекции. Согласно эпидемиологическим данным во всем мире от 5 до 15% взрослого населения страдают различными формами синусита. Необходимо отметить, что причиной развития острого синусита в большинстве случаев является вирусная инфекция [30–32]. На бактериальную этиологию заболевания указывает сохранение симптомов (гнойные выделения из носа и/или в ротоглотку, лихорадка, головная боль, боль и болезненность при пальпации в проекции синусов) более 7 дней, что служит показанием к назначению АБТ [31]. При исследовании пунктата из верхнечелюстных пазух у пациентов с ОС бактериальные возбудители выделяются в 70% случаев заболевания, чаще всего это S. pneumoniae (20–43%) и H. influenzae (22–35%); реже встречаются M. catarrhalis, БГСА, S. aureus и другие микроорганизмы [33,35]. Целью антибиотикотерапии при ОС является эрадикация возбудителя инфекции и восстановление стерильности придаточных пазух носа.
При легком течении ОС (если клинические симптомы сохраняются более 10 дней без улучшения или прогрессируют) у пациентов, не получавших антибиотики в предшествующие 4 недели, препаратом выбора является амоксициллин. В качестве альтернативы могут использоваться амоксициллин/клавуланат или цефуроксим аксетил [30–31,34].
Легкое течение ОС у пациентов, получавших антибиотики в предшествующие 4–6 недель, а также у больных со среднетяжелым течением заболевания, не получавших антимикробную терапию в предшествующие 4–6 недель, предполагает назначение амоксициллина/клавуланата или цефуроксима аксетила; альтернативными препаратами являются респираторные фторхинолоны (левофлоксацин, моксифлоксацин, гемифлоксацин). Среднетяжелое течение ОС у пациентов, ранее (в предшествующие 4 недели) получавших антибиотики, предполагает назначение амоксициллина/клавуланата или респираторных фторхинолонов (только у взрослых) [30–34,49]. При тяжелой форме ОС антибиотики назначают парентерально, желательно в режиме ступенчатой терапии. Рекомендуется применять ингибиторозащищенные пенициллины (Аугментин), цефалоспорины II (цефуроксим), III (цефотаксим, цефтриаксон) или IV (цефепим) поколений, а также карбапенемы. Длительность антибактериальной терапии при ОС обычно зависит от формы и степени тяжести заболевания, составляя, как правило, 7–10 дней [31,34,43].
Острый средний отит (ОСО). ОСО – воспаление среднего уха, обычно возникающее как осложнение вирусных инфекций дыхательных путей. Это распространенное заболевание; так, в частности, только в США с развитием ОСО у взрослых пациентов ежегодно связаны около 31 млн. обращений за медицинской помощью и 20–25% назначений антибиотиков [36]. Чаще всего ОСО имеет бактериальную этиологию, основные возбудители – S. pneumoniae и H. influenzae (60–80% всех случаев заболевания). Редкими возбудителями ОСО являются M. catarrhalis, БГСА, S. aureus. При этом около 6% случаев ОСО имеют вирусную этиологию [37,41]. До настоящего времени тактика ведения пациентов с ОСО остается неоднозначной, так как заболевание имеет склонность к самоизлечению без проведения антибиотикотерапии, в особенности, если возбудителем является M. catarrhalis или H. influenzae. При этом саморазрешение ОСО, вызванного S. pneumoniae, отмечается менее чем в 20% случаев. Более того, пневмококковая инфекция чаще других обусловливает такие серьезные осложнения заболевания, как бактериальный менингит, абсцесс мозга, тромбоз сигмовидного синуса, лабиринтит, парез лицевого нерва, сепсис. В этой связи целесообразность назначения антибиотиков при ОСО требует тщательного анализа степени тяжести и длительности сохранения клинических симптомов заболевания [36,39]. При появлении первых признаков болезни рекомендована выжидательная тактика: назначение симптоматической терапии и динамическое наблюдение за состоянием пациента в течение ближайших 24 ч. Абсолютными показаниями к применению антибиотиков считаются возраст до 2 лет, тяжелые формы ОСО, сопровождающиеся выраженным болевым синдромом, температурой тела выше 38°C и сохранением симптомов более одних суток [38,41].
Препаратом выбора при ОСО является амоксициллин. В случае отсутствия положительного эффекта (сохранение клинических симптомов и отоскопической картины ОСО) по прошествии 3 дней терапии рекомендуется отмена амоксициллина и назначение амоксициллина/клавуланата или цефуроксима аксетила внутрь, либо 3–дневное назначение цефтриаксона в/м. Альтернативный режим лечения (особенно у детей, часто получающих АБТ) предполагает использование амоксициллина/клавуланата, цефуроксима аксетила или цефтриаксона в качестве препаратов первого ряда. Продолжительность антибактериальной терапии при ОСО составляет 7–10 дней [37–39,42].
Хронический синусит, хронический средний отит. При хронических синуситах и средних отитах чаще всего являются микробные ассоциации, анаэробов и грамотрицательную флору (E. coli, P. aeruginosa, K. pneumoniae, Proteus spp., Enterobacter spp. и др.). Реже встречаются S. aureus и H. influenzae [30,37]. Лечение как хронического синусита, так и отита предполагает комплексный подход с обязательной пункцией пазухи или взятия мазка из среднего уха с последующим бактериологическим исследованием и проведение антимикробной химиотерапии препаратами расширенного спектра, способными преодолевать действие b–лактамаз и активными против анаэробной флоры. Препаратами выбора являются защищенные аминопенициллины (амоксициллин/клавуланат) и респираторные фторхинолоны (левофлоксацин, моксифлоксацин). Длительность антибактериальной терапии составляет в среднем 3–4 недели [30,31,37,42].
Эпиглоттит – быстро прогрессирующее воспаление надгортанника и окружающих тканей, которое может привести к полной обструкции дыхательных путей. Чаще всего встречается у мальчиков 2–4 лет. Клиническими симптомами заболевания являются: боль в горле, лихорадка, дисфония и дисфагия при отсутствии видимых изменений со стороны ротоглотки. Основной возбудитель эпиглоттита – H. influenzae типа В, реже (у взрослых пациентов) – S. pneumoniae, БГСА, S. aureus и анаэробы [40,42].
Лечение эпиглоттита направлено на поддержание проходимости дыхательных путей (трахеостомия, интубация эндотрахеальной или назотрахеальной трубками) и эрадикацию H. influenzae. Препаратами выбора являются «ингибиторозащищенные» пенициллины (Аугментин), цефалоспорины II (цефуроксим), III (цефотаксим, цефтриаксон) или IV поколений (цефепим). Рекомендован внутривенный путь введения (возможна ступенчатая терапия), длительность антибиотикотерапии составляет 7–10 дней [40].
Обострение хронической обструктивной болезни легких (ХОБЛ). По современным представлениям до 75–80% обострений ХОБЛ имеют инфекционную природу и наиболее вероятными возбудителями обострения заболевания являются H. influenzae, S. pneumoniae и M. catarrhalis, удельный вес которых, по данным различных исследователей, составляет 13–46%, 7–26% и 9–20% соответственно. Реже выделяются H. parainfluenzae, S. aureus, P. aeruginosa и представители семейства Enterobacteriaceae [44].
Классическими признаками, характеризующими обострение заболевания, являются: появление или усиление одышки; увеличение объема отделяемой мокроты; усиление гнойности мокроты. Наличие всех трех вышеуказанных критериев описывается как I тип, двух из них – как II тип, одного – как III тип обострения заболевания [45]. Показаниями для назначения АБТ являются: обострение ХОБЛ I типа; обострение ХОБЛ II типа при наличии гнойной мокроты; тяжелое обострение ХОБЛ, требующее проведения респираторной поддержки [44].
Важнейшее значение имеет разделение на простое (неосложненное) и осложненное обострение ХОБЛ.
К первой группе относятся больные в возрасте до 65 лет с не частыми обострениями заболевания (менее 4 в течение календарного года), отсутствием серьезных сопутствующих заболеваний и незначительными или умеренными нарушениями бронхиальной проходимости (ОФВ1>50%). В этом случае у пациентов отсутствуют факторы риска неэффективности антибиотикотерапии и для этой категории больных наиболее вероятными возбудителями являются H. influenzae, M. сatarrhalis, H. parainfluenzae, S. pneumoniae с природным уровнем чувствительности к антибиотикам. В качестве препаратов выбора рекомендуются амоксициллин или современные макролиды (азитромицин, кларитромицин). Альтернативой им является применение ингибиторозащищенных пенициллинов (амоксициллин/клавуланат) и респираторных фторхинолонов.
К группе пациентов с осложненным обострением ХОБЛ относятся больные в возрасте старше 65 лет и/или с выраженными нарушениями вентиляционной функции легких (ОФВ1<50%), и/или с наличием серьезных сопутствующих заболеваний (сахарный диабет, сердечная недостаточность, хронические заболевания печени и почек, сопровождающиеся органной недостаточностью и др.), и/или с наличием не менее 4 обострений заболевания в течение года. У пациентов с признаками осложненного обострения ХОБЛ высока вероятность выделения полирезистентных микроорганизмов и для лечения рекомендуются "защищенные" аминопенициллины (амоксициллин/клавуланат) или респираторные фторхинолоны [44].
Внебольничная пневмония (ВП). Амоксициллину/клавуланату (Аугментин) отведено значительное место в современных схемах антибиотикотерапии ВП у взрослых. В настоящее время «ингибиторозащищенные» аминопенициллины являются препаратами выбора в лечении нетяжелой ВП у амбулаторных больных в возрасте старше 60 лет и/или при наличии сопутствующих заболеваний (хронический бронхит/ХОБЛ, сахарный диабет, застойная сердечная недостаточность, хроническая почечная недостаточность, заболевания печени, дистрофия) [46]. Именно у такого рода пациентов в возникновении заболевания возрастает роль пенициллинорезистентных S. pneumoniae, а также H. influenzae, S. aureus и грамотрицательных бактерий семейства Enterobacteriaceae.
У госпитализированных пациентов с нетяжелой ВП рекомендуется парентеральное применение амоксициллина/клавуланата (желательна ступенчатая терапия) в сочетании с макролидным антибиотиком (кларитромицин, азитромицин) для приема внутрь. В случае тяжелого течения ВП (лечение в условиях ОРИТ) амоксициллин/клавуланат применяется в/в в комбинации c внутривенным введением макролида [46].
«Ингибиторозащищенные» аминопенициллины относятся к препаратам выбора для лечения ВП в особых клинических ситуациях, а именно – у пациентов, злоупотребляющих алкоголем, страдающих сахарным диабетом, в случаях деструкции легочной ткани или при развитии такого грозного осложнения заболевания, как эмпиема плевры, потенциальными возбудителями которых являются S. aureus, Enterobacteriaceae, K. pneumoniae и анаэробы. Их также рекомендуют больным с ВП, протекающей на фоне ХОБЛ, гриппа и других вирусных инфекций [46]. Кроме того, амоксициллин/клавуланат в виде монотерапии или в комбинации с макролидом применяется для лечения пневмонии у лиц, проживающих в домах престарелых [47,48].



Литература
1. Abraham EP, Chain E. An enzyme from bacteria able to destroy penicillin. Nature 1940; 373: 837.
2. Bush K. Beta–lactamase inhibitors from laboratory to clinic. Clin Microbiol Rev 1988; 1:109–123
3. Du Bois SK, Marriott MS, Amyes SG. TEM– and SHV–derived extended–spectrum b–lactamases: relationship between selection, structure and function. J Antimicrob Chemother 1995; 35:7–22.
4. Rolinson GN. 6–APA and development of the b–lactam antibiotis. J Antimicrob Chemother 1979; 5: 7–14
5. Rolinson GN. Forty years of b–lactam research. J Antimicrob Chemother 1998; 41: 589–603.
6. Van Krimpen P.C., Van Bennekom W.P., Bult A. Penicillins and cephalosporins: Physicochemical properties and analysis in pharmaceutical and biological matrices. Pharmaceut Weekblad 1987; 9: 1–23.
7. Sebek O.K. Antibiotics. V. Michigan 1986; 7: 240–276.
8. Ныс П.С., Курочкина В.Б., Скляренко А.В., Вейнберг Г.А. Беталактамные соединения. Взаимосвязь структуры и биологической активности. Антибиотики и химиотерапия, 2000; 11: стр. 36–42.
9. Reading C, Cole M. Ctavulanic acid: a beta–lactamase–inhibiting beta–lactam from Streptomyces clavuligerus. Antimicrob Agents Chemother 1977; 11 (5): 852–7
Datta N, Kontomichalou P. Penicillinase synthesis controlled by infectious R factor in Enterobacteriaceae. Nature 1965; 208:239–41.
10. Lister PD, Gardner VM, Sanders CC. Clavulanate induces expression of the Pseudomonas aeruginosa AmpC cehalosporinase at physiologically relevant concentrations and antagonizes the antibacterial activity of ticarcillin. Antimicrob Agents Chemother 1999; 43: 882–9.
11. Bush K, Jacoby GA, Medeiros AA. Functional classification scheme for b–lactamases and its correlation with molecular structure. Antimicrob Agents Chemother 1995; 39:1211–33.
12. Сидоренко С. В. Механизмы резистентности микроорганизмов. В кн: Страчунский Л.С., Белоусов Ю.Б., Козлов С.Н., под ред. Практическое руководство по антиинфекционной химиотерапии. М.: Боргес, 2002. с. 21–31.
13. Chambers HF. Other beta–lactam antibiotics. In: Mandell GL, Bennet JE, Dolin R, editors. Principles and Practice of Infectious Diseases. Churchill Livingstone, 6th edition, 2004, p. 311–8.
14. Bush K. Other b–lactam antibiotics. In: Finch RG, Greenwood D, Norrby SR, Whitley RJ, editors. Antibiotic and Chemotherapy. Anti–infective agent and their use in therapy. Churchill Livingstone, 8th edition, 2003, p. 259–78.
15. Neu HC, Wilson, APR. Gruneberg RN. Amoxycillin/clavulanic acid: a review of its efficacy in over 38,500 patients from 1979 to 1992. J Chemother 1993; 5: 67–93.
16. Briggs CG, Freeman RK, Yaffe SJ, editors. Drugs in pregnancy and lactation. Williams & Wilkins, 1994.
17. Berkovitch M, Diav–Citrin O, Greenberg R. Et al. First–trimester exposure to amoxycillin/clavulanic acid: a prospective, controlled study. Br J Clin Pharmacol 2004; 58(3): 298–302.
18. Bush K. The evolution of b–lactamases. Antibiotic Resistance: Origins, Evolution, Selection and Spread. John Willey & Sons 1997; 152–69.
19. Thornsberry C, Sahm DF, Kelly LJ et al. Regional trends in antimicrobial resistance among clinical isolates of Streptococcus pneumoniae, Haemophilus influenzae, and Moraxella catarrhalis in the United States: results from the TRUST Surveillance Program, 1999–2000. Clin Infect Dis 2002; 34 (Suppl. 1): 4–16.
20. Jacobs MR, Felmingham D, Appelbaum PC, et al. The Alexander Project 1998–2000: susceptibility of pathogens isolated from community–acquired respiratory tract infection to commonly used antimicrobial agents. J Antimicrob Chemother 2003; 52 (2):229–46.
21. Козлов Р.С., Сивая О.В., Шпынев К.В. и др. Антибиотикорезистентность Streptococcus pneumoniae в России в 1999–2005 гг.: результаты многоцентровых проспективных исследований Пегас I и Пегас II. Клин Микробиол. Антимикроб. Химиотер 2006; 8 (1): 33–47.
22. Практическое руководство по антиинфекционной химиотерапии. Под редакцией Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. М.: Боргес; 2002; 33–38.
23. Cooper R.J., Hoffman J.R., Bartlett J.G., et al. Principles of appropriate antibiotic use for acute pharyngitis in adults: background. Ann Intern Med 2001; 134: 509–17.
24. Bisno A.L., Gerber M.A., Gwaltney J.M. et al. Practice guidelines for the diagnosis and management of group A streptococcal pharyngitis. Clin Infect Dis 2002; 35: 113–25.
25. Шпынев К.В., Кречиков В.А. Современные подходы к диагностике стрептококкового фарингита. КМАХ 2007; том. 9 (1): 20–33.
26. Насонова В.А., Белов Б.С., Страчунский Л.С. и др. Антибактериальная терапия стрептококкового тонзиллита и фарингита. КМАХ 1999; 1 (1): 78–82.
27. Gwaltney J.M, Bisno A.L. Pharyngitis. In: Principles and Practice of Infectious Diseases. 5th ed. Mandell GL, Bennett JE, Dolin R (eds). Philadelphia 2000:656–62.
28. Timon C., McAlister V.A., Walsh M., Caffercey M.T. Resp Med 1990; 84: 395–400.
29. Tewfik TL, Al Garni M. Tonsillopharyngitis: clinical highlights. J Otolaryngol 2005;34 (Suppl. 1): S45–49.
30. Янов Ю.К., Рязанцев С.В., Страчунский Л.С. и др. Практические рекомендации по антибактериальной терапии синусита (пособие для врачей). КМАХ 2003; 5 (2): 167–74.
31. Sinus and Allergy Health Partner–ship. Antimicrobial treatment guidelines for acute bacterial rhinosinusitis. Otolaryngology – Head and Neck Surgery 2000; 123: 1–32.
32. Hickner J.M., Bartlett J.G., Besser R.E. et al. Principles of appropriate antibiotic use for acute rhinosinusitis in adults: background. Ann Intern Med 2001; 134: 498–505.
33. American Academy of Pediatrics. Clinical practice guidelines: management of sinusitis. Pediatrics 2001; 108: 798–808.
34. Sande M.A., Gwaltney J.M. Acute community–acquired bacterial sinusitis: continuing challenges and current management. Clin Infect Dis 2004; 39 (Suppl 3):151–58
35. Страчунский Л.С., Тарасов А.А., Крюков А.И. и др. Возбудители острого бактериального синусита. Результаты многоцентрового микробиологического исследования SSSR. КМАХ 2005; 7 (4): 337–349.
36. Аcute otitis media in adults. Many unknowns. Prescrire Int 2003;12:108–09.
37. Hendley J.W. Otitis media. N Engl J Med 2002; 347:1169–74.
38. McEwen L.N., Farjo R., Foxman B. Antibiotic prescribing for otitis media: how well does it match published guidelines? Pharmacoepidemiol Drug Safety 2003;12:213–19.
39. Carbutt J., Geme J.W., May A. et al. Development community–specific recommendations for first–line treatment of acute otitis media: is high–dose amoxicillin necessary? Pediatrics 2004;114(2): 342–51.
40. Pichichero M.E., Casey J.R. Tonsillopharyngitis, bacterial tracheitis, epiglottitis, and laryngo–tracheitis. In: Therapy of Infection Diseases. Baddour L, Gorbach SL (eds). Philadelphia, 2003:87–115.
41. Каманин Е.И., Стецюк О.У. Инфекции верхних дыхательных путей и ЛОР–органов. Практическое руководство по антиинфекционной химиотерапии / под ред. Страчунского Л.С., Белоусова Ю.Б., Козлова С.Н. М., 2002. С. 211–219.
42. Козлов С.Н., Егорова О.А. Антибактериальная терапия при инфекциях верхних дыхательных путей. Справочник поликлинического врача 2005; 3 (5).
43. Тарасов А.А., Каманин Е.И., Крюков А.И., Страчунский Л.С. Острый бактериальный риносинусит: современные подходы к диагностике и антибактериальной терапии в амбулаторных условиях. КМАХ 2002; том. 4 (1): 70–82.
44. Синопальников А.И., Козлов Р.С., Романовских А.Г., Рачина С.А. Инфекционное обострение ХОБЛ: практические рекомендации по диагностике, лечению и профилактике. Российские Медицинские Вести 2006; XI (№1): 4–18.
45. Anthonisen N.R., Manfreda J., Warren C.P., et al. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease. Ann Intern Med 1987; 106:196–204
46. "Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике". М.: OOO "Издательский дом "М–Вести", 2006; 76 с.
47. Синопальников А.И., Андреева И.В., Стецюк О.У. Пневмонии в домах престарелых: современный взгляд на проблему КМАХ 2007; том. 9 (1): 4–19.
48. Mylotte J.M., Nursing home–acquired pneumonia: update on treatment options. Drugs Aging 2006; 23: 377–90.












