Классификация и патофизиология
Хронический запор (ХЗ) может быть первичным и вторичным. Запор считается первичным или функциональным, если его причину не удается связать с морфологическими изменениями кишечника. Вторичные запоры развиваются при заболеваниях толстой кишки, фармакологических и нутритивных влияниях, вызывающих нарушения ее структуры и моторики.
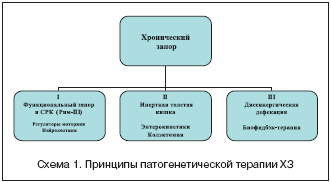
С точки зрения особенностей патогенеза ХЗ делятся на 3 варианта.
Варианты хронических запоров:
1 – запор вследствие дискинезии кишечника (функциональный запор и синдром раздраженного кишечника с преобладанием запоров (СРК–З);
2 – запор вследствие медленного продвижения кишечного содержимого по толстой кишке (инертная толстая кишка);
3 – запор вследствие нарушения координации мышечного аппарата, обеспечивающего дефекацию (диссинергическая дефекация).
Патогенетические и клинические особенности функционального запора и СРК–З подробно изложены в Римских критериях III (2006 г.) [4,5].
Причиной медленного транзита при инертной толстой кишке (второй вариант ХЗ) служат структурные, механические, метаболические и кортико–висцеральные влияния на толстую кишку. Особенно тяжелые нарушения транзита развиваются при болезни Паркинсона, псевдообструкции, обусловленной системной нейропатией [9] и селективной нейропатией толстой кишки [10].
Диссинергическая дефекация в большинстве случаев формируется с детства в процессе поведенческих особенностей дефекации, иногда вследствие парадоксального судорожного сокращения ануса во время дефекации (анисмус). Недостаточность ректоанальной координации включает несколько механизмов, каждый из которых мешает ректальному сокращению, может способствовать парадоксальному анальному сокращению или неадекватному его расслаблению, т.е. вызывает несогласованность или диссинергию мышц, вовлекаемых в дефекацию [6]. Моторно–эвакуаторная функция толстой кишки при диссинергической дефекации не нарушена и обеспечивает поступление кала в прямую кишку. Запор возникает вследствие нарушения содружественной деятельности брюшных мышц, мышц тазового дна и сфинктеров заднего прохода (диссинергия).
Клинические особенности
Больных ХЗ, помимо редкого стула, часто беспокоят чувство неполного опорожнения прямой кишки, затрудненная дефекация, чрезмерно твердый кал в виде шариков, иногда необходимость пальцевого вспоможения, сужение заднепроходного отверстия, а также боли или дискомфорт в животе, метеоризм. Длительный анамнез, отсутствие эффекта от использования пищевых добавок в адекватных количествах, слабительных средств и необходимость систематического очищения кишечника с помощью клизм дают основание предполагать функциональный ХЗ. Короткий анамнез с быстро меняющейся клинической картиной должен нацелить врача на поиск органической патологии, включая колоректальный рак. Подробной характеристике ХЗ помогает уточнение времени, затрачиваемого на опорожнение прямой кишки (в норме не более 1 мин). Следует выяснить количество пищевых волокон и жидкости, потребляемых больными, а также режим питания. Утрата физиологического утреннего рефлекса из–за привычки не завтракать и не посещать туалет по утрам вследствие недостатка времени – одна из основных причин функционального ХЗ.
При осмотре больного следует помнить о системных болезнях, вызывающих ХЗ. Поэтому необходимо оценить неврологический и эндокринный статус, а также лекарственные средства, применяемые для лечения сопутствующих заболеваний.
Аноректальный осмотр позволяет получить следующую ценную информацию. Наличие экскориации кожи вокруг заднего прохода служит косвенным признаком анального зуда, геморроя и анальной трещины. Снижение перианальной чувствительности и отсутствие анально–кожного рефлекса позволит заподозрить нейропатию. При исследовании прямой кишки пальцем нужно попросить больного натужиться. Отсутствие расслабления наружного анального сфинктера – один из симптомов диссинергической дефекации.
Основным клиническим проявлением инертной толстой кишки является постепенно прогрессирующий колостаз с полным отсутствием ответа на пищевые и фармакологические стимуляторы. Особенно тяжелые формы инертной толстой кишки наблюдаются при кишечной псевдообструкции, нейропатии вследствие сахарного диабета, порфирии и болезни Паркинсона. Если причину установить не удается, то приходится говорить об идиопатической инертной толстой кишке.
Для диссинергической дефекации характерно значительное увеличение времени, затрачиваемого на опорожнение прямой кишки. Больной вынужден длительно и безуспешно тужиться, иногда пользоваться ручным пособием для освобождения прямой кишки от кала. У некоторых больных либо появляется чувство неполного опорожнения, либо отсутствуют позывы к дефекации. Возможно образование каловых камней в прямой кишке. Этот вариант ХЗ может развиваться самостоятельно или в сочетании с инертной толстой кишкой, при системной атрофии, болезни Паркинсона и других болезнях нервной и мышечной систем.
Методы диагностики
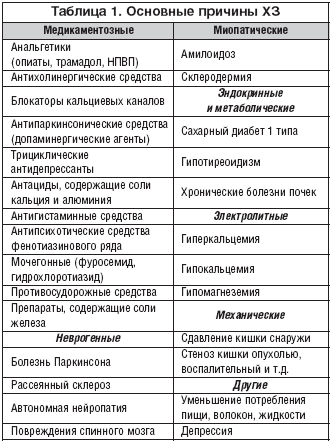
В таблице 1 показаны причины ХЗ. Для того, чтобы предусмотреть каждую из них, следует выполнить клинический анализ крови, исследовать уровень кальция, глюкозы, гормонов щитовидной железы, по показаниям – электрофорез белков сыворотки, гормон паращитовидной железы, кортизол и уровень порфирина в моче.
Обзорная рентгенограмма живота может подтвердить наличие чрезмерно большого количества каловых масс в толстой кишке. Исследование толстой кишки с бариевой взвесью дает возможность выявить избыточно длинную сигмовидную кишку, мегаколон, или мегаректум, дивертикулы, опухоли и болезнь Гирсшпрунга. При колоноскопии можно обнаружить меланоз – доказательство длительного использования слабительных антрохинонового ряда, воспалительные заболевания и опухоли.
Признаки диссинергической дефекации обнаруживают при дефекографии. Ее выполняют, заполняя прямую кишку бариевой взвесью (150 мл), и предлагают больному натужиться. На диссинергическую дефекацию указывает слабое сокращение мышцы, поднимающей задний проход, длительная задержка контрастного вещества в прямой кишке, отсутствие перистальтики и способности к опорожнению прямой кишки.
Для уточнения времени пассажа по толстой кишке применяют рентгеноконтрастные шарики. На следующий день после их приема внутрь на обзорных рентгенограммах подсчитывают количество шариков, находящихся в разных отделах кишки. В норме через 24 ч в толстой кишке остается 10–15% капсул. При запоре через 48 ч наблюдается более или менее равномерное распределение всех шариков по толстой кишке. При медленном пассаже (колостазе) до 70–80% капсул скапливаются в одном из отделов толстой кишки – в правых или левых [11].
Отклонения в механизме дефекации устанавливают с помощью аноректальной манометрии. С помощью этой методики можно измерить внутриректальное давление, анальное остаточное давление, степень анального расслабления и время, затрачиваемое на изгнание силиконового цилиндра [12], или баллона, наполненного водой и помещаемого в прямую кишку. При неспособности больного вытолкнуть баллон в течение 3 минут можно предполагать диссинергическую дефекацию.
Существуют также портативные регистраторы для длительного мониторирования моторики толстой кишки [7]. Этот метод применяют для уточнения показаний к оперативному лечению ХЗ [8]. Наличие мегаколон (колостаза) при отсутствии болезни Гирсшпрунга и дисфункции мышц тазового дна является признаком конечной стадии инертной толстой кишки и является показанием для колэктомии. Больным с нормальной толстокишечной моторной деятельностью показано терапевтическое лечение [8].
Симптоматическое лечение
Лечение запора усложняет привыкание к систематическому употреблению слабительных, часто наблюдающееся у этих больных. Необходимо убедить больного отказаться от привычки систематически делать себе клизмы и попытаться научить регулировать стул с помощью пищевых волокон, от содержания которых в рационе в значительной мере зависит работа кишечника.
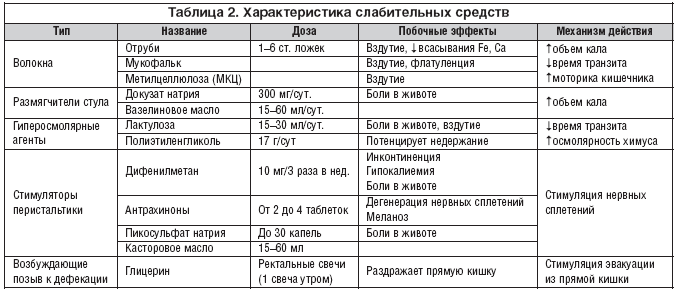
В таблице 2 перечислены слабительные средства, применяющиеся при лечении ХЗ.
Пищевые волокна. Основой программы лечения больных с ХЗ должно быть обогащение рациона стимуляторами моторики, по возможности, пищевого происхождения. К ним относятся пищевые волокна. Для обеспечения нормальной работы кишечника ежедневно необходимо 20–35 г, волокон, что соответствует приблизительно 1 кг фруктов и овощей.
Дополнительное употребление продуктов, содержащих пищевые волокна, широко используют в современной терапии запора. Пищевые волокна содержатся в растениях, в частности, отрубях, и состоят из трудно перевариваемых углеводов, целлюлозы, гемицеллюлозы и лигнина. Они необходимы кишечным бактериям. В результате микробного метаболизма образуются короткоцепочечные жирные кислоты (КЖК), задерживающие в просвете кишки воду и участвующие в пролиферации и дифференциации эпителиоцитов [13].
Пациенты обычно неохотно соглашаются на использование пищевых волокон из–за метеоризма, дискомфорта и повышенного образования газов. Убеждению помогает совет постепенно увеличивать количество продуктов, богатых пищевыми волокнами, дополнять диету отрубями или иными коммерчески пакетированными пищевыми добавками, содержащими волокна.
Пшеничные отруби. Отруби следует залить кипятком и через 30–60 мин добавлять в суп, компот или кефир. В зависимости от степени нарушения функции кишечника суточная доза может варьировать от 1–2 до 6–8 столовых ложек.
Наряду с отрубями применяют приятные на вкус смеси, содержащие пищевые волокна хлебных злаков. К ним относится, например, мукофальк.
Мукофальк – препарат, содержащий семена подорожника. Благодаря высокой гидрофильности мукофальк увеличивает объем кишечного содержимого, улучшает моторно–эвакуаторную функцию кишечника и устраняет запор. Препарат назначают на ночь по 1–2 пакетика, предварительно заварив горячей водой.
Для улучшения консистенции стула надо рекомендовать увеличить потребление жидкости, а при отсутствии эффекта – размягчители стула докузат натрия или вазелиновое масло.
Докузат натрия является анионным сурфактантом и способствует проникновению воды в каловые массы. Его назначают по 100–150 мг х 3 раза в сутки внутрь или ректально 50–100 мг 1 раз в сутки.
Вазелиновое масло обладает лаксирующим свойством и улучшает продвижение кала по толстой кишке. Доза колеблется от 1 до 3 столовых ложек в день.
Стимулирующие слабительные. К этой группе относятся дифенилметан, пикосульфат натрия и антрахиноны. Стимулирование моторики толстой кишки обеспечивается через тактильные рецепторы слизистой оболочки толстой кишки и нервно–мышечные сплетения. Эти препараты часто используют при запорах, но их длительное применение вызывает привыкание.
Осмотические слабительные. Препараты этой группы содержат невсасывающиеся ионы или молекулы, которые создают осмотический градиент в полости кишки и таким образом задерживают воду в кишечнике, поддерживая в полости кишечника изоосмотическое с плазмой давление. Задержка воды в кишечнике способствует размягчению каловых масс, их продвижению и улучшению пропульсии. К осмотическим слабительным относятся лактулоза и полиэтиленгликоль.
Лактулоза является синтетическим дисахаридом, состоящим из галактозы и фруктозы. В кишечнике человека отсутствует дисахаридаза, способная расщеплять лактулозу. Поэтому она не всасывается в тонкой кишке и поступает в ободочную кишку, где ассимилируется микрофлорой. Образующиеся в процессе микробного метаболизма короткоцепочечные карбоновые кислоты алифатического ряда способствуют стимуляции моторики кишечника.
Лактулоза является также осмотическим слабительным средством. Эффект ее основан на повышении осмотического давления в кишечнике и снижении внутрикишечного рН, что способствует задержке жидкости, разжижению химуса, увеличению его объема и активации перистальтики. Послабляющее действие лактулозы наступает обычно через 6–8 ч. В отличие от большинства слабительных лактулоза не оказывает раздражающего влияния на слизистую оболочку толстой кишки и не вызывает привыкания, поэтому может применяться длительное время. Лактулозу назначают на ночь. Дозу подбирают индивидуально в пределах 15–30 г (1–2 дес. ложки).
Полиэтиленгликоль – многоатомный спирт, не расщепляющийся и не всасывающийся в кишечнике. Препарат назначают на ночь по 10–20 г, предварительно растворив в воде.
Следует иметь в виду, что у пациентов с почечной недостаточностью или сердечной дисфункцией осмотические слабительные могут вызывать электролитные нарушения от всасывания натрия, магния или фосфора.
Средства, возбуждающие позыв к дефекации. С целью инициации позыва к дефекации применяют ректальные свечи, содержащие глицерин. Свечу с глицерином назначают утром с целью стимуляции опорожнения прямой кишки.
Патогенетические подходы к лечению
С помощью традиционных терапевтических средств, перечисленных в таблице 2, удается добиться успеха далеко не у всех больных с первичным ХЗ. При утрате условного рефлекса к утренней дефекации (особенно отсутствии позывов к дефекации и самостоятельного стула) лечение или не эффективно или требует систематического применения слабительных средств в постепенно нарастающих дозах. Поэтому стратегия терапии должна зависеть от патогенетического варианта ХЗ. Принципы такой терапии показаны на схеме 1.
Терапия I варианта ХЗ
В стандарте терапии функционального запора и СРК–З должны использоваться спазмолитики и регуляторы моторики.
Спазмолитики. К традиционным антихолинергическим и спазмолитическим препаратам относятся атропин, папаверина гидрохлорид, платифиллина гидротартрат и метацин (0,002 г х 2 раза в сутки), а также гиасцина бутилбромид, назначаемый по 0,01 г х 3 раза в сутки, блокатор м1–холинорецепторов пирензепин (0,05 г х 2–3 раза в сутки), м–холиноблокатор дицикловерин – вводят внутримышечно по 0,02 г.
Регуляторы моторики. В настоящее время чаще применяют блокаторы натриевых и кальциевых каналов, получившие наименование регуляторов моторики.
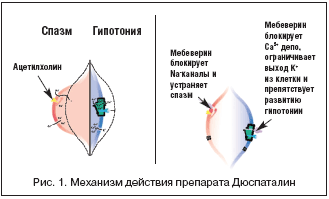
Мебеверин (Дюспаталин). Механизм действия препарата показан на рисунке 1. Мебеверин блокирует натриевые каналы, что ограничивает приток калия и предотвращает таким образом спазм мышц кишки. Ингибирует фосфодиэстеразу, стабилизирует уровень циклической аденозинмонофосфорной кислоты; непосредственно расслабляет гладкую мускулатуру, преимущественно желудочно–кишечного тракта (ЖКТ). Показан при различных вариантах СРК, в частности, с преобладанием запоров и болей в животе спастического характера.
Мебеверин назначают внутрь, за 20 мин до еды по 200 мг (не разжевывая) 2 раза в сутки (утром и вечером).
Дицетел представляет собой спазмолитик миотропного действия. Препарат избирательно блокирует потенциал–зависимые кальциевые каналы L–типа гладкой мускулатуры кишечника и препятствует избыточному поступлению кальция внутрь клетки. Его назначают по 0,05 г 3 раза в сутки, до еды.
Метеоспазмил содержит миотропный спазмолитик цитрат альверина и пеногаситель симетикон. Альверин обладает модулирующим действием на моторику, а симетикон снижает газообразование в кишечнике. Препарат назначают по 1 капсуле 3 раза в сутки перед едой.
Тримебутин. Эффект тримебутина обусловлен влиянием на опиоидные рецепторы энтериновой системы ЖКТ. Он снижает висцеральную гиперчувствительность слизистой оболочки кишечника, восстанавливает нормальную физиологическую активность его мускулатуры при повышенной и сниженной скорости транзита. Препарат назначают по 0,2 г х 3 раза в сутки перед едой, продолжительность лечения – до 3 мес.
Терапия II варианта ХЗ
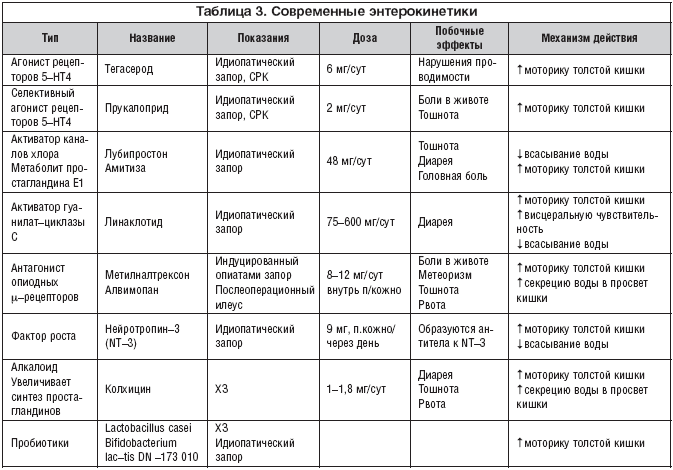
В лечении инертной толстой кишки приоритет принадлежит энтерокинетикам – стимуляторам пропульсивной моторики толстой кишки. Современные энтерокинетики показаны в таблице 3.
Серотонинергические энтерокинетики. Серотонин (5–гидрокси–триптамин; 5–HT) синтезируется в слизистой оболочке ЖКТ энтерохромаффинными клетками. Известно 14 подтипов семейства рецептора 5–HT. Наиболее изучены 5–HT3 и 5–HT4 рецепторы серотонина. Они увеличивают перистальтику, путем стимулирования вторичных мессенджеров (ацетилхолин и кальцитонин). 5–HT3 рецепторы также способствуют секреции воды через механизм цАМФ и повышению висцеральной чувствительности. Антагонисты 5–HT3 рецепторов уменьшают постпрандиальную толстокишечную перистальтику и задерживают толстокишечный транзит [14].
Агонисты 5–HT4 рецепторов.Наиболее известны два агониста 5–HT4 рецепторов: тегазерод и прукалоприд.
Teгазерод – селективный агонист рецепторов 5–HT4. Он эффективен при запорах и метеоризме и назначается внутрь в дозах 2–6 мг в сутки [15]. Но из–за побочных влияний на проводящую систему сердца у больных с ИБС тегазерод разрешен лишь ограниченному контингенту – женщинам моложе 55 лет при отсутствии заболеваний сердечно–сосудистой системы.
Прукалоприд – является суперселективным агонистом рецепторов 5–HT4, с минимальным влиянием на другие рецепторы 5–HT [16]. Он оказался очень эффективным при запорах и при назначении до 2 мг в сутки не имеет нежелательных эффектов, свойственных тегазероду.
Активаторы каналов хлора. Каналы хлора позволяют осуществлять транспорт ионов хлора через межклеточные каналы и играют ведущую роль в транспорте воды и внутриклеточном рН.
Лубипростон является жирной кислотой, которая избирательно активизирует 2 тип хлоридных каналов в апикальной мембране кишечных эпителиальных клеток. Он стимулирует секрецию хлора и, как следствие, вызывает секреторную диарею вследствие увеличения пассивной секреции натрия и воды. Лубипростон оказывает также прямой стимулирующий эффект на гладкую мускулатуру толстой и тонкой кишки благодаря микросомальной карбонильной трансферазе, которая образует в тощей кишке активный метаболит простагландина Е1 [17]. Лубипростон в дозе 24 мг х 2 раза в сутки оказался эффективным в лечении хронических идиопатических запоров [18,19].
Активаторы гуанилата циклазы. Рецепторы гуанилатциклазы (ГЦ), находящиеся на апикальной поверхности кишечного эпителия, поддерживают уровень внутриклеточного циклического гуанидинмонофосфата (цГМФ).
Линаклотид – пептид, активизирующий ГЦ в энтероцитах, увеличивает содержание внутриклеточного и внеклеточного цГМФ. В результате увеличивается секреция хлора, воды и бикарбонатов в просвет кишки, возрастает скорость кишечного транзита [20]. Внеклеточный цГМФ повышает висцеральную гиперчувствительность кишки [21]. Линаклотид назначают по 150–300 мг в сутки.
Антагонисты опиатов. Антагонисты μ–рецепторов являются новым классом агентов, предназначенных для лечения побочных явлений, вызываемых опиатами.
Метилналтрексон – производное антагониста мю–опиодных рецепторов налтрексона. Его применяют для устранения запора, вызванного опиатами, в частности, в послеоперационном периоде [22].
Альвимопан – антагонист μ–опиатных рецепторов. Энтерокинетический эффект альвимопана более мощный, чем у метилналтрексона [23,24]. Альвимопан применяют для устранения послеоперационной кишечной непроходимости.
Фактор роста. К семейству белков факторов роста принадлежит нейротрофин–3. Этот агент играет ведущую роль в обеспечении нервной регуляции моторики и всасывания [25]. В дозе 9 мг подкожно 3 раза в неделю, значительно увеличивает скорость транзита и уменьшает плотность каловых масс при запоре. Лекарство можно вводить только подкожно.
Колхицин – алкалоид, традиционно применяемый при лечении острого подагрического артрита и средиземноморской лихорадки. Побочный эффект колхицина вызывать диарею явился основанием для его использования при запорах. Колхицин увеличивает синтез простагландина и может вызвать секреторную диарею, изменять желудочно–кишечную моторику [26]. В дозе 1 мг/сутки он достоверно увеличивает число дефекаций в неделю и уменьшает время толстокишечного транзита при сравнении с плацебо. Препарат может длительное время применяться в лечении ХЗ. Возможны побочные эффекты – диарея, тошнота, рвота и боль в животе, редко – нейропатия и миопатия [27].
Агонисты мотилина. Мотилин – пептид, состоящий из 22 аминокислот, секретируется энтерохромаффинными клетками, стимулирует подвижность кишки через активацию рецепторов G–белково–связанного мотилина, найденного в нервной системе кишечника и кишечных гладкомышечных волокнах [28]. Созданный недавно митемцинал, находится на 2–й стадии исследования [29].
Пробиотики и пребиотики. Данных об их эффективности пока недостаточно. В единичных исследованиях показано, что Bifidobacterium animalis , Lactobacillus casei и Bifidobacterium lactis DN –173 010 ускоряют толстокишечный транзит и помогают при лечении больных СРК–З. Стимулирующее влияние на моторику толстой кишки связывают с прямым эффектом КЖК и других пробиотических микробных метаболитов [3,30].
Терапия III варианта ХЗ
При диссинергической дефекации необходимо восстановить синергическую моторно–эвакуаторную аноректальную функцию.
Биофидбэк–терапия. Биофидбэк–терапия (БФБТ) – обучение пациента расслаблять мышцы тазового дна в период натуживания и координировать это расслабление с брюшными мышцами для того, чтобы опорожнить прямую кишку, основанное на принципе биологической обратной связи.
БФБТ выполняют с помощью сенсорного датчика с манометром, помещаемого в задний проход и прямую кишку. Наполнение прямой кишки моделируют наполнением воздухом баллона. Биофидбэк–тренинг осуществляют путем мониторинга активности мышц тазового дна и сфинктера заднего прохода при дефекации. Тренировки должны сформировать адекватное расслабление анального сфинктера при растяжении прямой кишки баллоном по принципу обратной связи.
Лечение больного с диссинергической дефекацией должно быть комплексным. Помимо БФБТ, оно включает описанные выше требования к диетическому режиму, применение слабительных средств и попытки выработать условный рефлекс к утренней дефекации. В случае формирования каловых камней в прямой кишке требуется удаление их пальцем. Манипуляции часто болезненные, поэтому может понадобиться анастезия. Для предотвращения образования твердых каловых масс рекомендуется пользоваться свечами с глицерином или бисакодилом в сочетании с клизмами. Дополнительные меры включают солевые растворы, осмотические слабительные или раствор полиэтиленгликоля.
Хирургическое лечение
Больным, невосприимчивым к терапевтическому лечению, можно предложить лапароскопическую колэктомию с илеоректальным анастомозом, если нет диссинергии и других нейромышечных дисфункций кишки. В большинстве случаев при тщательном отборе больных результаты весьма благоприятны, но операцию нужно рассматривать, как последний вариант лечения ХЗ. Это важно подчеркивать, потому что колэктомия с илеоректальным анастомозом не эффективна у больных с диссинергической дефекацией. Точно так же операция не может устранить боли в животе у больных с психосоциальными проблемами. К тому же появлению болей и метеоризма способствуют образовавшиеся спайки в брюшной полости.
Заключение
Стратегия терапии ХЗ должна соответствовать его патогенетическому варианту. В лечении пациентов с запором замедленного транзита приоритет должен принадлежать энтерокинетикам. При диссинергической дефекации следует обязательно использовать возможности биофидбэк–терапии. Пациентов с функциональным запором и СРК–З, соответствующих условиям Римского консенсуса, необходимо лечить регуляторами моторики, устраняющими дискинезию кишечника.
Литература
1. Лазебник Л.Б., Прилепская С.И., Парфенов А.И. и др. Распространенность и факторы риска запоров у взрослого населения Москвы по данным популяционного исследования «МУЗА». Эксперим. и клин. Гастроэнтерология 2011;3:68–73.
2. Tariq S. H. Constipation in Long–Term Care. J Am Med Dir Assoc. 2007; 8: 209–218
3. Siddharth Singh, Satish S.C. Rao. Pharmacologic Management of Chronic Constipation. Gastroenterol.Clin.N.Am. 2010;39:509–527
4. Drossman D. A. The Functional Gastrointestinal Disorders and the Rome III Process. Gastroenterology 2006; 130 (5): 1377–90
5. Longstreth GF, Thompson WG, Chey WD, et al. Functional bowel disorders. Gastroen–terology 2006;130:1480–91
6. Rao SSC. Dyssynergic Defecation. Gastroenterol Clin North Am. 2001;30:97–114
7. Rao SSC, Sadeghi P, Beaty J, et al. Ambulatory 24–h Colonic Manometry in Healthy Humans. Am J Physiol Gastrointest Liver Physiol 2001;280:G629–39
8. Rao SS, Sadeghi P, Beaty J, et al. Ambulatory 24–hour colonic manometry in slow–transit constipation. Am J Gastroenterol 2004;99:2405–16
9. Spiller RC. Upper gut dysmotility in slow–transit constipation: is it evidence for a pan–enteric neurological deficit in severe slow transit constipation? Eur J Gastroenterol Hepa–tol 1999;11:693–6
10. Knowles CH, Scott M, Lunniss PJ. Outcome of colectomy for slow transit constipation. Ann Surg 1999;230:627–38
11. Рогозина В. А. Применение рентгеноконтрастных маркеров с целью изучения моторно–эвакуаторной функции толстой кишки. В сб.: Материалы IV Всесоюзного съезда. М.,Л. 1990;2:530–531
12. Pelsang RE, Rao SSC, Welcher K. FECOM: A New Artificial Stool for Evaluating Defe–cation. Am J Gastroenterol 1999;94:183–6
13. Парфенов А.И. Энтерология: руководство для врачей. 2–е изд. М.: МИА.
14. Cash BD, Chey WD. Review article: the role of serotonergic agents in the treatment of patients with primary chronic constipation. Aliment Pharmacol Ther 2005;22:1047–60
15. Johanson JF, Wald A, Tougas G, et al. Effect of tegaserod in chronic constipation:a ran–domized, double–blind, controlled trial. Clin Gastroenterol Hepatol 2004;2:796–805
16. Camilleri M, Deiteren A. Prucalopride for constipation. Expert Opin Pharmacother 2010;11:451–61
17. Lacy BE, Levy LC. Lubiprostone: a novel treatment for chronic constipation. Clin Interv Aging 2008;3:357–64
18. Johanson JF, Morton D, Geenen J, et al. Multicenter, 4–week, double–blind, randomized, placebo–controlled trial of lubiprostone, a locally–acting type–2 chloride channel activa–tor, in patients with chronic constipation. Am J Gastroenterol 2008;103:170–7
19. Barish CF, Drossman D, Johanson JF, et al. Efficacy and safety of lubiprostone in pa–tients with chronic constipation. Dig Dis Sci 2010;55:1090–7
20. Lembo A, Schneier H, Lavins BJ, et al. Efficacy and safety of once daily linaclotide ad–ministered orally for 12–weeks in patients with chronic constipation: results from 2 ran–domized, double–blind, placebo–controlled phase 3 trials. Gastroenterology 2010;138:S53–4
21. Bueno C, Beaufraud C, Mahajan–Miklos S. Anti–nociceptive actions of MD–1100, a novel therapeutic agent for C–IBS, in animal models of visceral pain. Am J Gastroenterol 2004;99:A283
22. Thomas J, Karver S, Cooney GA, et al. Methylnaltrexone for opioid–induced constipation in advanced illness. N Engl J Med 2008;358:2332–43
23. Buchler MW, Seiler CM, Monson JR, et al. Clinical trial: alvimopan for the management of post–operative ileus after abdominal surgery: results of an international randomized, double–blind, multicentre, placebo–controlled clinical study. Aliment Pharmacol Ther 2008;28:312–25
24. Ludwig K, Enker WE, Delaney CP, et al. Gastrointestinal tract recovery in patients un–dergoing bowel resection: results of a randomized trial of alvimopan and placebo with a standardized accelerated postoperative care pathway. Arch Surg 2008;143:1098–105
25. Coulie B, Szarka LA, Camilleri M, et al. Recombinant human neurotrophic factors accel–erate colonic transit and relieve constipation in humans. Gastroenterology 2000;119:41–50
26. Verne GN, Davis RH, Robinson ME, et al. Treatment of chronic constipation with col–chicine: randomized, double–blind, placebo–controlled, crossover trial. Am J Gastroente–rol 2003;98:1112–6
27. Taghavi SA, Shabani S, Mehramiri A, et al. Colchicine is effective for short–term treat–ment of slow transit constipation: a double–blind placebo–controlled clinical trial. Int J Colorectal Dis 2010;25:389–94
28. Feighner SD, Tan CP, McKee KK, et al. Receptor for motilin identified in the human gastrointestinal system. Science 1999;284:2184–8
29. Peeters TL. GM–611 (Chugai Pharmaceutical). Curr Opin Investig Drugs 2001;2: 555–7
30. Emmanuel AV, Tack J, Quigley EM, et al. Pharmacological management of constipation. Neurogastroenterol Motil 2009;21:41–54












