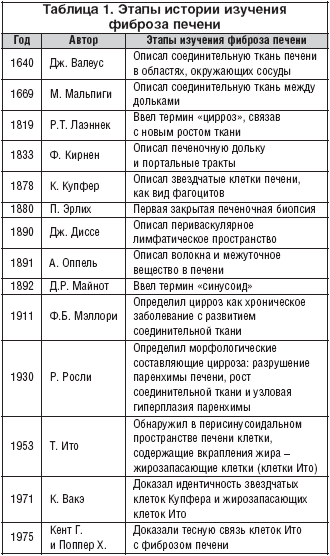
Процессы фиброза в печени изучались в течение многих лет (табл. 1), но только после открытия роли звездчатых клеток в процессах фиброзирования были получены новые возможности для антифибротической терапии.
Патогенез фиброза печени
Синусоидальные клетки – эндотелиальные, клетки Купфера, звездчатые клетки (клетка Ито, стеллатная клетка, ретиноидзапасающая клетка, липоцит), вместе с обращенным в просвет синусоидов участком гепатоцитов образуют функциональную единицу. Кроме клеток, в области синусидов располагается внеклеточный матрикс (ВКМ), видимый только при заболеваниях печени. Все клетки, образующие синусоид, могут участвовать в образовании ВКМ. В норме существует равновесие между факторами фиброгенеза и антифибротическими факторами. Основную роль в фиброзировании играют клетки Ито, вырабатывающие профибротические и антифибротические факторы. К антифибротическим факторам относят матриксные металлопротеазы (ММП), участвующие в разрушении белков ВКМ (коллагеназы, желатиназы, стромолизины). Активность ММП подавляется тканевыми ингибиторами матриксных металлопротеаз (ТИМП), которые также продуцируются клетками Ито [2–4].
При повреждении печени выделяются биологически активные вещества, активирующие макрофаги и эндотелий синусоидов, выделяющих IL–1, TNFα, оксид азота, эндотелин, действующих на клетки Ито. Звездчатые клетки при активации вырабатывают тромбоцитактивирующий фактор PDGF и трансформирующий фактор роста TGFβ1. Под действием TGFβ1 клетки Ито начинают активировать сами себя, мигрируют в участки воспаления. Происходит изменение фенотипа клеток Ито – они трансформируются в миофибробласты, продолжающие выработку TGFβ1, и начинают вырабатывать ВКМ. Нарушение равновесия между фибротическими и антифибротическими факторами ведет к увеличению в 3–10 раз компонентов ВКМ, изменению его состава (преобладанию коллагена I и III типа). Перераспределение матрикса в пространство Диссе, его расширение, капилляризация синусоидов сопровождается нарушением обмена между гепатоцитами и кровью, шунтированием крови из–за развития ложных долек и развитием цирроза печени. В случае прекращения действия медиаторов воспаления клетки Ито вновь начинают продуцировать профибротические вещества и происходит уменьшение компонентов ВКМ в пространстве Диссе. Таким образом, фиброз на ранних стадиях развития – процесс обратимый [2–4].
Патогенез фиброза печени при хронических вирусных гепатитах связан с индукцией инфицированными гепатоцитами активности воспалительных клеток, что ведет к стимуляции клеток Ито. При алкогольной болезни печени ацетальдегид и свободные радикалы кислорода активируют клетки Ито. Кроме этого, этанол способствует росту грамнегативной микрофлоры в кишечнике, повышению уровня липополисахаридов в портальной крови и активации клеток Купфера, продукцирующих TNFα, действующих на клетки Ито. Патогенез фиброза печени при неалкогольной жировой болезни печени связан с гипергликемией и инсулинорезистентностью, ведущих к повышению уровня свободных жирных кислот и стеатозу печени, а свободные радикалы и провоспалительные цитокины – к апоптозу гепатоцитов и активации воспалительных клеток с прогрессированием фиброза печени. При первичном билиарном циррозе билиарные клетки секретируют фиброгенные медиаторы, активирующие клетки Ито, запускающие фиброгенез [5].
Обратимость фиброза печени
Долгое время фиброз печени считался необратимым патологическим состоянием. Однако еще 50 лет назад были описаны случаи обратного развития фиброза после эффективной терапии гемохроматоза и болезни Вильсона–Коновалова, а в последующем неоднократно публиковались данные об обратном развитии фиброза при аутоиммунном гепатите в результате иммуносупрессивной терапии, вторичном билиарном ЦП после хирургической декомпрессии желчевыводящих путей, неалкогольном стеатогепатите при уменьшении массы тела, алкогольном гепатите при абстиненции [6,7].
Обратимость фиброза наблюдалась при длительном воздержании от приема алкоголя, когда через 4–6 недель было выявлено уменьшение содержания коллагена IV типа, ламинина и гиалуроновой кислоты в стенках синусоидов при биопсии и в сыворотке крови – происходила регрессия процесса «капилляризации синусоидов». Были отмечены также изменения, отражающие функцию клеток Ито – повышение уровня ММП–2 и снижение уровня ее ингибитора ТИММП–2. Через определенные временные интервалы наблюдалось уменьшение количества миофибрилл актина в стенках синусоидов, что свидетельствует о падении активности звездчатых клеток Ито и переключение их от синтеза экстрацеллюлярного матрикса к его деградации [7].
В то же время только с внедрением в клиническую практику противовирусной терапии концепция фиброза печени, как динамического процесса с возможностью как прогрессирования, так и регресса, была признана научно доказанным фактом.
Достигнутый прогресс привел к ясному пониманию того, что фиброз печени обратим, и к реалистичным ожиданиям того, что эффективная антифибротическая терапия существенно изменит ведение пациентов с болезнями печени и обеспечит благоприятный прогноз даже при уже развившемся циррозе печени.
Диагностика фиброза печени
Золотым стандартом диагностики фиброза печени является проведение биопсии с гистологическим исследованием. Гистологическая оценка проводится по шкалам Desmet (1984) в модификации Серова; шкале JSHAK или METAVIR. В зависимости от локализации и распространенности различают следующие формы фиброза печени: венулярный и перивенулярный (в центре долек и стенках центральных вен – характерен для хронического алкогольного гепатита); перицеллюлярный (вокруг гепатоцитов при хронических вирусных и алкогольных гепатитах); септальный (концентрическое разрастание фиброзной ткани вокруг желчных канальцев – при вирусном гепатите); портальный и перипортальный (при вирусном, алкогольном, аутоиммунном гепатитах); перидуктальный фиброз (вокруг желчных канальцев при склерозирующем холангите); смешанный (представлены разные формы фиброза).
В связи с инвазивностью, с достаточно большой погрешностью гистологического исследования, связанной с «ошибками попадания» иглы при пункционной биопсии печени, различием в интерпретации результатов, для ранней диагностики патологических процессов в настоящее время уделяют большое внимание неинвазивным методам диагностики фиброза. К ним относят биопрогностические лабораторные тесты; эластометрию печени и МР эластографию; УЗИ, КТ, МРТ печени, УЗДГ сосудов печени и селезенки с расчетом индексов фиброза и портальной гипертензии [8].
Маркеры фиброза разделяют на прямые (биомаркеры), отражающие метаболизм ВКМ, и непрямые, свидетельствующие о печеночной недостаточности. К прямым маркерам относят карбокситерминальный пептид проколлагена I типа, аминотерминальный пептид проколлагена III типа, ТИМП–1, 2, коллаген IV типа, гиалуроновую кислоту, ламинин, ММП–2. Определение этих веществ используется в клинических исследованиях.
Для клинической практики предложены разные расчетные прогностические индексы для оценки тяжести фиброза печени по непрямым маркерам: APRI, ELF, FIB–4, FibroFast, FibroIndex, FibroMeter, FPI, Forns , GUCI, Hepascore, HALT–C, MDA, PGA, PGAA.
Для оценки выраженности фиброза печени используют системы Фибро–тест и Акти–тест, рассматривая их в качестве альтернативы биопсии. Фибро–тест включает 5 биохимических показателей: альфа 2–макроглобуллин (активирует клетки Ито), гаптоглобин (отражает стимуляцию клеток печени интерлейкинами), аполипопротеин А1, гамма–глутамилтранспептидаза, общий билирубин. Акти–тест (оценивается вирусная некровоспалительная активность) в дополнение к перечисленным компонентам включает аланиновую аминотрансферазу – АлАТ. ФиброМакс является сочетанием пяти неинвазивных тестов: ФиброТест и АктиТест, СтеатоТест (диагностируется стеатоз печени), НешТест (диагностируется неалкогольный стеатогепатит), АшТест (диагностируется тяжелый алкогольный стеатогепатит). В ФиброМаксе определяется альфа 2–макроглобуллин, гаптоглобин, аполипопротеин А1, гамма–глутамилтранспептидаза, общий билирубин, АлАТ, АсАТ, глюкоза, триглицериды, холестерин. По полученным данным, с учетом возраста и пола пациента рассчитывается стадия фиброза и уровень активности гепатита. Лимитируют использование тестов признаки холестаза, отрицательно влияющие на диагностическую значимость тестов, и высокая стоимость исследования [8].
Действие аппарата, основанного на ультразвуковой эластографии печени при пропускании волн (вибрации) через печень и улавливании их датчиком, позволяет оценить степень фиброза в печени на ранних стадиях. Аппарат малоинформативен при ожирении и асците.
Магнитно–резонансная элластография – прямой метод определения плотности печени, позволяющий определить F0 в сравнении со здоровыми добровольцами, что до сих пор не удавалось продемонстрировать с помощью других методов оценки фиброза.
В перспективе можно определить наличие и темп прогрессирования фиброза в зависимости от этиологического фактора. Решение этих проблем дает возможность диагностировать ранние стадии фиброза, а следовательно, эффективно лечить.
Лечение
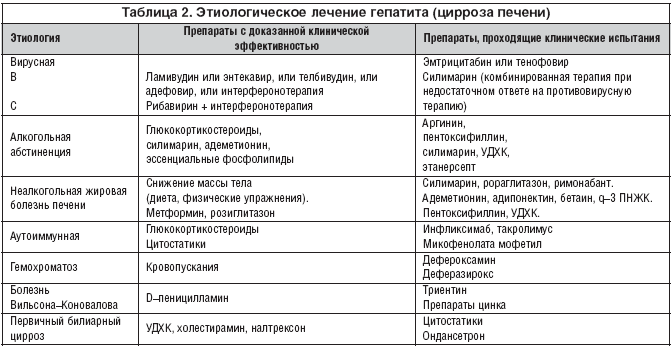
Антифибротическая терапия неотрывно связана с этиологическим и патогенетическим лечением хронических гепатитов (табл. 2). В большинстве случаев препараты для устранения этиологического факторов гепатитов являются и антифибротическими средствами. Выявлено антифибротическое действие у противовирусных препаратов, пентоксифиллина, фосфатидилхолина, глюкокортикостероидов, донаторов оксида азота, витамина Е, антагонистов эндотелиновых рецепторов, антагонистов ангиотензиновых рецепторов, ингибиторов ангиотензинпревращающего фермента, силимарина. Проводится поиск препаратов, тормозящих фиброгенез для применения в ситуациях, когда воздействие на причинный фактор затруднено: антиоксидантов (бетаин, пробукол, N–ацетилцистеин), гепатопротекторов (силимарин, УДХК, S–аденозилметионин, эссенциальные фосфолипиды), снижающие активность фактора некроза опухоли (пентоксифиллин, адипонектин, инфликсимаб).
Идет поиск препаратов с направленным антифибротическим действием:
– элиминация повреждающего агента (интерлейкин 10, ингибиторы TNF – противовоспалительный эффект; антиоксиданты – подавление фибротических процессов в ответ на оксидативный стресс);
– подавление профибротической активности звездчатых клеток (интерфероны, фактор роста гепатоцитов, агонисты PPARγ);
– поддержание активной антифибротической активности звездчатых клеток (антагонисты TGFβ1 – уменьшают синтез матрикса и усиливают его распад; антагонисты PDGF, оксид азота, ингибиторы АПФ – подавляют пролиферацию клеток Ито);
– влияние на секрецию коллагенов звездчатыми клетками печени (ингибиторы АПФ, ингибиторы полигидроксилаз, интерферон γ – уменьшают фиброз; антагонисты эндотелиновых рецепторов – уменьшают фиброз и портальную гипертензию);
– действие на апоптоз клеток Ито (гилотоксин, NGF – фактор роста нейронов – стимулируют апоптоз);
– усиление распада коллагенового матрикса (металлопротеиназы, антагонисты тканевого ингибитора ММП; антагонисты TGFβ1 — снижают активность TИМП и повышают активность ММП; релаксин — снижает активность ТИМП и повышают активность ММП) [9].
Перспективным представляется использование с антифибротической целью лекарственного препарата силимарин (Легалон). Силимарин – официальное наименование группы из четырех изомеров флавонолигнана (силибинин, изосилибинин, силикристин и силидианин), выделенных из экстрактов плодов расторопши пятнистой (Cardui mariae fructus) и входящих в состав Легалона 70 и 140 (доза силимарина).
При проведении клинических исследований было выявлено, что наряду с противовоспалительным, антиоксидантным, антитоксическим, гиполипидемическим и антиканцерогенным действием силимарин обладает выраженным антифибротическим эффектом. Это связано с влиянием на трансформирующий фактор роста β и экспрессию генов в клетках Ито, а также с повышением клиренса свободных радикалов и непосредственным подавлением синтеза коллагена [10].
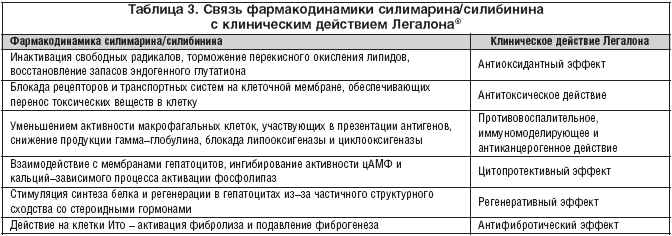
Связь фармакодинамики силимарина/силибинина с клиническим действием Легалона® приведена в таблице 3. Указанные механизмы действия определяют терапевтическое значение Легалона® при диффузных заболеваниях печени. В многочисленных исследованиях показана высокая эффективность Легалона® при длительном его применении в подавлении воспалительно–некротической реакции в печени, торможении развитие фиброза и снижении риска злокачественной трансформации гепатоцитов при циррозах печени [9–12].
На модели алкогольного фиброза печени у обезьян при морфологическом исследовании печени и изучении сывороточных маркеров фиброза было выявлено, что у животных, получавших силимарин, значительно меньше прогрессировал фиброз и реже развивался цирроз печени [10].
Действие Легалона при фиброзе печени было изучено у 792 пациентов с хроническими заболеваниями печени, в том числе циррозом. В качестве маркера фиброгенеза был выбран показатель Р–III–NP. Период наблюдения в среднем составил 107 дней. При исходно повышенном уровне Р–III–NP через 3 месяца лечения Легалоном уровень Р–III–NP снизился до нормального [11].
Результаты 5 международных плацебо–контролируемых исследований (участвовало 600 пациентов) показали, что 4–летняя выживаемость пациентов с алкогольным циррозом печени на фоне приема Легалона оказалась статистически значимо выше по сравнению с группой пациентов, получавших плацебо. При анализе подгрупп выявлено, что лечение Легалоном было эффективным при алкогольном циррозе независимо от его тяжести и стадии цирроза, а в подгруппе с циррозом стадии А по Чайд–Пью независимо от его этиологии. В подгруппе пациентов с алкогольным циррозом на фоне вирусного гепатита за время наблюдения не было зафиксировано ни одного смертельного исхода, в то время как в группе плацебо – 4 смерти от декомпенсации цирроза [12].
Фиброз в настоящее время называют краеугольным камнем хронической патологии печени. Именно он обусловливает формирование цирроза печени, поэтому ранняя диагностика и лечение фиброза чрезвычайно актуальны в настоящее время и являются задачей будущих научных исследований.
Литература
1. Шерлок Ш, Дули Дж. Заболевания печени и желчных путей: Практическое руководство. М.: ГЭОТАР–МЕД, 2002. 864 с.
2. Bataller R., Brenner D. A. Liver fibrosis. J. Clin. Invest. 2005; 115(2):209–218.
3. Iredale J. P. Models of liver fibrosis: exploring the dynamic nature of inflammation and repair in a solid organ. J. Clin. Invest. 2007; 117(3):539–548.
4. Parsons C. J, Takashima M., Rippe RA. Molecular mechanisms of hepatic fibrogenesis. J Gastroenterol Hepatol. 2007; 22(1):79–84.
5. Сторожаков Г.И., Ивкова А.Н. Патогенетические аспекты фиброгенеза при хронических заболеваниях печени. Клин. перспективы гастроэнтерологии, гепатологии 2009; 2:3–10.
6. Павлов Ч.С., Золотаревский В.Б., Томкевич М.С. Возможности обратимости цирроза печени. Росс. журнал гастроэнтерологии, гепатологии и колопроктологии 2006; 1:20–29.
7. Северов М.В. Обратимость фиброза и цирроза печени при HCV–инфекции. Гепатологический форум 2008; 1:2–6.
8. Павлов Ч.С., Глушенков Д.В., Ивашкин В.Т. Современные возможности эластометрии, фибро– и акти–теста в диагностике фиброза печени. Росс. журнал гастроэнтерологии, гепатологии и колопроктологии 2008; 4:43–52.
9. Rockey D.C. Antifibrotic therapy in chronic liver disease Clin. Gastroenterol. Hepatol. 2005; 3:95–107.
10. Dehmlow C., Erhard J. Hepatology 1996; 23:749–754.
11. Lieber et al. Gastroenterol. 2003; 37:336–339.
12. Schuppan, Z. Allg. Med. 1998; 74:577–584.












