Снижение эффективности стандартных схем антихеликобактерной терапии в большой степени обусловлено развитием резистентности микроорганизма к традиционно используемым антибиотикам. Изучению антибиотикорезистентности при проведении эрадикационной терапии посвящено значительное количество зарубежных и отечественных работ.
Мультицентровое исследование, проведенное в странах Европы, свидетельствовало о наличии клинически значимых различий первичной резистентности к кларитромицину в Северной, Восточной и Южной Европе (4,2, 9,3 и 18% соответственно), а также о том, что вторичная устойчивость к данному препарату резко возрастает и достигает 60% [2].
Группа американских ученых в крупномасштабном проспективном исследовании за период 1993–1999 гг. выявила колебания устойчивости к кларитромицину среди H. pylori–позитивных пациентов от 10 до 12,5% [3].
В Германии был зафиксирован удовлетворительный для проведения антихеликобактерной терапии низкий уровень антибиотикорезистентности. К левофлоксацину он составил 3,2%, к кларитромицину – 9,8% [4].
В противовес группа итальянских ученых обнаружила у 232 H. pylori–позитивных пациентов высокий уровень первичной устойчивости к кларитромицину, который составил 26,7% [5]. В другом итальянском исследовании выявлены высокие показатели первичной резистентности к антибиотикам: 16,9% – к кларитромицину, 29,4% – к метронидазолу и 19,1% – к левофлоксацину [6].
Исследование в педиатрической практике, проведенное в странах Европы, в котором приняли участие 1233 пациента, определило устойчивость к кларитромицину на уровне 20%, к метронидазолу – 25% [7].
V. De Francesco et al. сделали обзор печатных научных работ, посвященных проблеме антибиотикорезистентности в различных странах мира за период с января 2006 г. по декабрь 2009 г. По полученным данным, устойчивость к кларитромицину составила 17,2%, к метронидазолу – 26,7%, к амоксициллину – 11,2%, к левофлоксацину – 16,2%, к тетрациклину – 5,9%, к рифабутину – 1,4%. Преобладание антибиотикорезистентности к кларитромицину, метронидазолу и левофлоксацину достоверно повышалось от Европы к Азии, Америке и Африке. Устойчивость к тетрациклину достигла максимального значения в Африке и составила 43,9%. Резистентность к кларитромицину была выше у пациентов с неязвенной диспепсией, в то время как устойчивость к метронидазолу преобладала среди больных с язвенной болезнью. Антибиотикорезистентность к кларитромицину и метронидазолу была значительно выше у женщин [8].
По материалам международных семинаров, организуемых Европейской группой по изучению Helicobacter pylori, за последнее время (2003–2011 гг.) устойчивость микроорганизма к кларитромицину варьирует от 2 до 64% в различных странах. Также наблюдается общемировая, хотя и неоднородная в разных странах и на разных континентах, тенденция к росту резистентности штаммов микроорганизма к кларитромицину. В России в различных регионах резистентность H. pylori к кларитромицину варьирует от 5,3 до 39% [9].
Во многих исследованиях установлено, что высокоэффективными в схемах эрадикации являются препараты нитрофуранового ряда в связи с низкой резистентностью к ним микроорганизма (табл. 1) [10–19].
Схемы с применением фуразолидона были введены в рекомендации Китайским обществом гастроэнтерологов на основании большого опыта применения препарата в Китае [20]. Имеются данные об использовании фуразолидона в следующих комбинациях:
• ингибитор протонной помпы (ИПП), амоксициллин, фуразолидон;
• ИПП, кларитромицин, фуразолидон;
• коллоидный субцитрат висмута, амоксициллин, фуразолидон;
• коллоидный субцитрат висмута, тетрациклин, фуразолидон.
В клинике, возглавляемой нобелевским лауреатом Барри Маршаллом – первооткрывателем H. pylori, при назначении фуразолидона в схеме квадротерапии на основе висмута получен высокий процент эрадикации – 86% [21]. Однако применение этого препарата имеет ряд ограничений. Одним из существенных недостатков фуразолидона являются его побочные эффекты, связанные с проявлениями гепато–, нейро– и гематотоксичности, способность подавлять рост сапрофитной флоры кишечника, а также неудовлетворительные органолептические свойства (при приеме этого препарата многие пациенты жалуются на горечь во рту, тошноту). Кроме того, для достижения оптимальной концентрации препарата в организме его нужно принимать 4 раза/сут. в отличие от других компонентов эрадикационной терапии. Эти качества фуразолидона уменьшают комплаентность всей схемы лечения, что влечет за собой снижение эффективности проводимой эрадикации.
На сегодняшний день из препаратов нитрофуранового ряда оптимальным препаратом выбора для лечения хеликобактериоза является нифурател (Макмирор) – синтетический антибактериальный препарат широкого спектра действия, включенный в стандарты лечения хеликобактериоза (схемы терапии первой и второй линии) [24].
Терапия первой линии:
1. ИПП в стандартной дозе (20–40 мг), амоксициллин (1000 мг 2 раза/сут. или 500 мг 4 раза/сут.) в сочетании с кларитромицином (500 мг 2 раза/сут.) или джозамицином (1000 мг 2 раза/сут.) или Макмирором (400 мг 2 раза/сут.) в течение 10–14 дней.
2. ИПП в стандартной дозе (20–40 мг), амоксициллин (1000 мг 2 раза/сут. или 500 мг 4 раза/сут.) в сочетании с кларитромицином (500 мг 2 раза/сут.) или джозамицином (1000 мг 2 раза/сут.) или Макмирором (400 мг 2 раза/сут.) и висмута трикалия дицитрат (240 мг 2 раза/сут. или 120 мг 4 раза/сут.) в течение 10–14 дней.
3. При наличии атрофии слизистой оболочки желудка и ахлоргидрии, подтвержденной рН–метрией: амоксициллин (1000 мг 2 раза/сут. или 500 мг 4 раза/сут.) в сочетании с кларитромицином (500 мг 2 раза/сут.) или джозамицином (1000 мг 2 раза/сут.) или Макмирором (400 мг 2 раза/сут.) и висмута трикалия дицитрат (240 мг 2 раза/сут. или 120 мг 4 раза/сут.) в течение 10–14 дней.
Терапия второй линии:
1. ИПП (20–40 мг), амоксициллин (1000 мг 2 раза/сут. или 500 мг 4 раза/сут.) в сочетании с Макмирором (400 мг 2 раза/сут.) или фуразолидоном (100 мг 4 раза/сут.) и висмута трикалия дицитрат (240 мг 2 раза/сут. или 120 мг 4 раза/сут.) в течение 10–14 дней.
Нифурател (Макмирор) обладает высокой антихеликобактерной активностью, особенно в отношении штаммов микроорганизма, резистентных к метронидазолу. Еще в 2001 г. один из первооткрывателей H. pylori профессор И.А. Морозов запатентовал способ эрадикации микроорганизма, основанный на включении в схему антихеликобактерной терапии вместо кларитромицина или амоксициллина антибактериального препарата Макмирор. Этот препарат по своему действию напоминает фуразолидон, но, в отличие от последнего, безопасен при длительном применении, принимается 2 раза/сут., как и другие компоненты антихеликобактерной терапии, хорошо переносится пациентами, а также не только не вызывает развития дисбиотических изменений в кишечнике, но и нормализует содержание бифидобактерий и лактобацилл в толстой кишке [25]. Препарат препятствует развитию перекрестной резистентности H. pylori к другим антибиотикам (макролидам, аминогликозидам, линкозамидам, тетрациклинам, стрептопраминам, хлорамфениколу и др.). Эффективность схем, использованных для эрадикации H. pylori, в которые был включен Макмирор, достигает 94,3% [26].
Целью нашей работы явилась сравнительная оценка эффективности и безопасности эрадикации при использовании нифуратела (Макмирора) в различных схемах антихеликобактерной терапии.
Материалы и методы: под наблюдением находилось 67 больных хроническим гастродуоденитом, ассоциированным с H. pylori, подтвержденным эндоскопическим и морфологическим методом. В зависимости от получаемой терапии все больные были разделены на три группы. Пациенты 1–й группы (24 человека) получали висмута трикалия дицитрат 240 мг 2 раза/сут. 28 дней, амоксициллин 1000 мг и нифурател 400 мг 2 раза/сут. 10 дней. Больные 2–й группы (23 человека) принимали омепразол 20 мг, кларитромицин 500 мг и нифурател 400 мг 2 раза/сут. 10 дней. Пациенты 3–й группы (20 человек) получали омепразол 20 мг, амоксициллин 1000 мг и кларитромицин 500 мг 2 раза/сут. 10 дней.
До и через 1,5–2 мес. после лечения всем пациентам проводился комплекс тестов для верификации H. pylori: быстрый уреазный тест, гистологическое и молекулярно–генетическое исследования (полимеразная цепная реакция) биоптатов из антрального отдела желудка. Эрадикация считалась успешной при отрицательных показателях всех трех методов диагностики H. pylori после лечения. Кроме того, все больные до и после лечения участвовали в стандартизированном опросе для оценки динамики жалоб, проводилось также бактериологическое исследование кала с целью оценки частоты встречаемости такого побочного эффекта эрадикационной терапии, как дисбиоз кишечника.
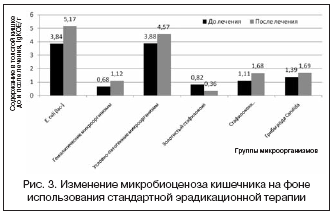
После лечения купирование симптомов желудочной диспепсии наблюдалось во всех группах больных. Обращало на себя внимание то, что у 20% пациентов в 3–й группе появились жалобы на урчание, вздутие живота, а также наметилась тенденция к послаблению стула. В 1–й и 2–й группах подобных жалоб зарегистрировано не было.
Процент успешной эрадикации в 1–й и 2–й группах был достоверно выше, чем в 3–й (рис. 1).
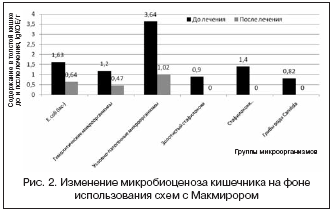
При использовании схем с нифурателом в 1–й и 2–й группах не было отмечено увеличения количества условно–патогенных микроорганизмов, а при назначении стандартной схемы первой линии эрадикации имело место увеличение их представительства в толстой кишке (рис. 2, 3).
Выводы: предложенные схемы лечения с использованием препарата нитрофуранового ряда нифурател (Макмирор) обладают высокой и достаточной эффективностью (эрадикация 84%), а также являются относительно безопасными в отношении развития антибиотико–ассоциированной диареи и дисбиоза кишечника. Следовательно, можно рекомендовать исследуемые схемы эрадикации в качестве терапии первой линии.
![Таблица 1. Данные по резистентности H. pylori к антибактериальным препаратам нитрофуранового ряда [2–11]](/data/articles/Image/t20/n35/1694-1.gif)

Литература
1. Malfertheiner P., Megraud F., O’Morain C.A. et al. Management of Helicobacter pylori infection – the Maastricht IV/ Florence Consensus Report // Gut. 2012. Vol. 61. P. 646–664.
2. Glupczynski Y., Megraud F., Lopez–Brea M. et a. European multicenter survey of in vitro antimicrobial resistance in Helicobacter pylori // Eur J Clin Microbiol Infect Dis. 2000. Vol. 11. P. 820–823.
3. Meyer J.M., Silliman N.P., Wang W. et al. Risk factors for Helicobacter pylori resistance in the United States: the surveillance of H. pylori antimicrobial resistance partnership (SHARP) study, 1993–1999 // Ann Intern Med. 2002. Vol. 136. P. 13–24.
4. Antos D., Schneider–Brachert W., Bastlein E. et al. 7–Day triple therapy of Helicobacter pylori infection with levofloxacin, amoxicillin, and high–dose esomeprazole in patients with known antimicrobial sensitivity // Helicobacter. 2006. Vol. 11. P. 39–46.
5. De Francesco V., Margiotta M., Zullo A. et al. Prevalence of primary clarithromycin resistance in Helicobacter pylori strains over a 15 year period in Italy // J Antimicrob Chemother. 2007. Vol. 59. P. 783–785.
6. Zullo A., Perna F., Hassan C. et al. Primary antibiotic resistance in Helicobacter pylori strains isolated in northern and central Italy // Aliment Pharmacol Ther. 2007. Vol. 25. P. 1429–1434.
7. Koletzko S., Richy F., Bontems P. et al. Prospective multicenter study on antibiotic resistance of Helicobacter pylori strains obtained from children living in Europe // Gut. 2006. Vol. 55 (12). P. 1711–1716.
8. De Francesco V. et al. Worldwide H. pylori Antibiotic Resistance: a Systematic Review // J Gastrointestin Liver Dis. 2010. Vol. 19, № 4. P. 409–414.
9. Успенский Ю.П., Барышникова Н.В., Суворов А.Н. Анализ мировых данных по резистентности Helicobacter pylori к кларитромицину // Вестник практического врача. 2012. № 1. Т. 2. С. 20–27.
10. Sablin O., Mihaylov N., Ilchishina T. et al. Prevalence of antibiotic resistance of helicobacter pylori in Saint–Petersburg // Helicobacter. 2012. Vol. 17, suppl. 1. P. 109–110.
11. Massarrat S., Siavoshi F., Bolandi Z. et al. Helicobacter pylori resistance to common antibiotic in Iran // Helicobacter. 2012. Vol. 17, suppl. 1. P. 109.
12. Milani M., Ghotaslou R., Akhi M.T. et al. The status of antimicrobial resistance of Helicobacter pylori in Eastern Azerbaijan, Iran: comparative study according to demographics [электронный ресурс]: URL: http://www.ncbi.nlm.nih.gov/pubmed/22581031 (дата обращения 30.09.2012).
13. Goh K.L., Navaratnam P. High Helicobacter pylori resistance to metronidazole but zero or low resistance to clarithromycin, levofloxacin, and other antibiotics in Malaysia // Helicobacter. 2011. Vol. 16 (3). P. 241–245.
14. Siavoshi F., Saniee P., Latifi–Navid S. et al. Increase in resistance rates of H. pylori isolates to metronidazole and tetracycline––comparison of three 3–year studies // Arch Iran Med. 2010. Vol. 13 (3). P. 177–187.
15. Sun Q.J., Liang X., Zheng Q. et al. Resistance of Helicobacter pylori to antibiotics from 2000 to 2009 in Shanghai // World Journal of Gastroenterology. 2010. Vol. 16 (40). P. 5118–5121.
16. Boyanova L., Gergova G., Nikolov R. et al. Prevalence and evolution of Helicobacter pylori resistance to 6 antibacterial agents over 12 years and correlation between susceptibility testing methods // Diagnostic Microbiology and Infectious Disease. 2008. Vol. 60 (4). P. 409–415.
17. Rafeey M., Ghotaslou R., Nikvash S., Hafez A.A. Primary resistance in Helicobacter pylori isolated in children from Iran // Infect Chemother. 2007. Vol. 13 (5). P. 291–295.
18. Wang F., Shen S.R., Zhou J.D., Xu C.X. Antibiotic resistance of Helicobacter pylori // Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2007. Vol. 32(3). P. 447–450.
19. Fallahi G.H., Maleknejad S. Helicobacter pylori culture and antimicrobial resistance in Iran // Indian J Pediatr. 2007. Vol. 74 (2). P. 127–130.
20. Захарова Н.В. Эволюция взглядов на проблему эрадикации Helicobacter pylori // Consilium medicum. 2004. Т. 6, № 2. С. 9–11.
21. Tay A., Thirriot F., Marshall B.J. et al. Helicobacter pylori eradication rate for “exotic” quadruple therapies in Western Australia // Helicobacter. 2012. Vol. 17, suppl. 1. P. 105–106.
22. Щербаков П.Л., Эрдес С.И., Щербакова М.Ю. Применение нифуроксазида в эрадикационной терапии хеликобактер–ассоциированных заболеваний у детей // Инфекционные болезни. 2008. Т. 6, № 3. С. 98–101.
23. Аминова А.И. Новые лекарства в лечении хронических гастродуоденитов у детей // Медицинский вестник. 2011. № 12 (553). С. 11.
24. Лазебник Л.Б. Стандарты диагностики и лечения кислотозависимых и ассоциированных с Helicobacter pylori заболеваний // Экспериментальная и клиническая гастроэнтерология. 2010. № 5. С. 113–120.
25. Конаныхина С.Ю., Сердюк О.А. Эффективность применения нифуратела при лечении дисбактериоза у детей // Вопросы практической педиатрии. 2006. Т. 1, № 4. С. 130–133.
26. Успенский Ю.П., Суворов А.Н., Барышникова Н.В. Инфекция Helicobacter pylori в клинической практике. СПб.: ИнформМед, 2011. 572 с.












