В последние годы антисекреторные препараты являются базовыми средствами лечения язвенной болезни (ЯБ) желудка и двенадцатиперстной кишки; инфекции Helicobacter pylori (H. pylori); гастроэзофагеальной рефлюксной болезни (ГЭРБ); гастропатии, ассоциированной с использованием нестероидных противовоспалительных препаратов (НПВП) и ацетилсалициловой кислоты; функциональной диспепсии; для профилактики и лечения желудочно–кишечных кровотечений.
В настоящее время имеется большое количество лекарственных средств, уменьшающих кислотообразование в желудке, отличающихся по механизму действия, клинической эффективности, безопасности и стоимости. Практикующему врачу для лечения кислотозависимых заболеваний зачастую трудно выбрать наиболее эффективный антисекреторный препарат из перечня лекарств, широко представленных на фармацевтическом рынке. Особое значение при выборе антисекреторного препарата имеет перспективная возможность и безопасность длительного его применения, поскольку при эрозивной ГЭРБ, НПВП–ассоциированной гастропатии, синдроме Золлингера–Эллисона и других заболеваниях больные в течение многих лет вынуждены принимать блокаторы желудочной секреции. Поэтому наряду с клинической эффективностью лекарственного средства очень часто врачу приходится учитывать и его безопасность.
За последние 30 лет в лечении кислотозависимых заболеваний желудочно–кишечного тракта произошли существенные изменения, в значительной степени вызванные появлением фармакологических средств, обеспечивающих эффективное подавление секреции соляной кислоты в желудке. До 70–х годов прошлого века это достигалось главным образом за счет применения антацидов и холинолитиков, однако уже в 70–80–х на фармакологическом рынке последовательно появились два класса препаратов, более мощно подавляющих секрецию соляной кислоты: блокаторы Н2–рецепторов для гистамина и ингибиторы протонной помпы (ИПП).
Блокаторы Н2–рецепторов для гистамина действуют достаточно эффективно, устраняя активирующее действие гистамина на секрецию соляной кислоты, однако они имеют ряд недостатков, обусловленных механизмом их действия:
1) Н2–блокаторы связываются с рецептором обратимо, поэтому для обеспечения эффекта необходимо, чтобы в крови постоянно поддерживалась значительная концентрация лекарства;
2) они блокируют только один из путей активации секреции (гистаминовый), оставляя альтернативно способными в активации холиновые, гастриновые и др. рецепторы;
3) после их применения отмечается «рикошетная вспышка» секреции, как правило, отмечается рецидив жалоб;
4) при длительном применении к Н2–блокаторам развивается толерантность, что снижает их эффективность, при этом нарастает токсичность, особенно у препаратов первых поколений.
Наиболее эффективными ингибиторами секреции в настоящее время считаются ИПП, которые подавляют работу системы, непосредственно обеспечивающей секрецию соляной кислоты. Другими словами, не имеет значения, какова плотность экспрессированных рецепторов на мембране париетальной клетки и насколько активны множественные рецепторные системы: ИПП блокируют самое сердце париетальной клетки – протонную помпу.
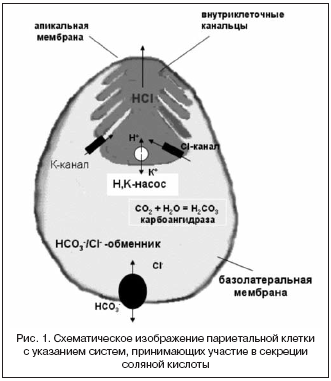
Итак, секреция Н+ в слизистой оболочке желудка обеспечивается Н,К–АТФазой (протонной помпой) – белком, встроенным в апикальную мембрану париетальных клеток (рис. 1). Протонная помпа осуществляет электронейтральный обмен внутриклеточных ионов Н+ на внеклеточные ионы К+. Оба иона переносятся против градиента концентраций. Значения рН в секреторных канальцах составляют 0,8–1,0 (концентрация Н+ 10–1 М), а в клетке – около 7 (концентрация Н+ 10–7 М). Таким образом, разница в концентрации Н+ в растворах, разделенных апикальной мембраной париетальной клетки, обычно превышает 106. Транспорт ионов против градиента концентраций нуждается в энергии: протонная помпа гидролизует АТФ до АДФ неорганического фосфата (то есть является АТФ–азой) и использует освобождающуюся при этом энергию для переноса ионов [1].
Помимо протонной помпы, в секреции соляной кислоты принимают участие также два типа каналов, расположенных в апикальной мембране (калиевый и хлорный канал) и несколько транспортных систем базолатеральной мембраны, в частности, НСО3/Сl– анионообменник (рис. 1). Ионы К+, которые переносятся в клетку протонной помпой, покидают ее по градиенту концентрации вместе с ионами Cl– через К– и Сl–каналы, таким образом суммарно клетка секретирует НСl. В париетальную клетку ионы Сl– входят через базолатеральную мембрану с использованием НСО3–/Сl– анионообменника. Необходимые для этого обмена анионы НСО3– образуются в клетке под действием карбоангидразы, активность которой в париетальных клетках весьма значительна. Секреция НCl осуществляется благодаря сопряженной работе всех этих систем, однако основной движущей силой процесса является протонная помпа (Н,К–АТФаза).
Н,К–АТФаза состоит из двух субъединиц, одна из которых (α–субъединица) имеет молекулярную массу около 114000 Да, а другая (β–субъединица) – около 55000 Да. α–субъединица является каталитической, осуществляя гидролиз АТФ и формируя канал, через который ионы пересекают мембрану. β–субъединица – гликопротеид, не принимающий непосредственного участия в процессе транспорта. Однако эта субъединица, содержащая значительное количество углеводов (до 1/3 от общей массы), играет важную роль в доставке вновь синтезированной α–субъединицы к апикальной мембране и в ее правильном встраивании в мембрану. Полипептидная цепь α–субъединицы встроена в фосфолипидную мембрану так, что ее N– и С–концы находятся внутри клетки, а сама цепь пересекает мембрану 10 раз, образуя 10 трансмембранных фрагментов. Они довольно плотно прилегают друг к другу, формируя внутри мембраны канал для переносимых катионов. Значительная часть полипептидной цепи располагается в цитоплазме – именно здесь находится центр, обеспечивающий гидролиз АТФ. Возникающие при гидролизе АТФ конформации цитоплазматического домена передаются к каналу, что приводит к его последовательному закрыванию и открыванию с внутренней и наружной стороны клетки. Особенно важную роль в формировании функционирующего канала протонной помпы играют 5–й и 6–й трансмембранные фрагменты и область между ними [1].
В начале 80–х годов прошлого века было обнаружено, что сульфиды пиридилметилбензимидазола являются ингибиторами протонной помпы [2]. Позднее они были модифицированы до сульфоксидов, и в 1989 году на рынке появился первый из представителей ИПП – омепразол, который до настоящего времени эффективно применяется клиницистами для подавления секреции соляной кислоты. Позднее семейство ИПП пополнилось другими соединениями – лансопразолом, пантопразолом, эзомепразолом и рабепразолом. Все ИПП представляют собой 2–пиридилметилсульфонилбензимидазолы, которые различаются природой и положением заместителей, расположенных в пиридиновом и бензольном кольцах. Исключение составляет эзомепразол: в отличие от омепразола, который является рацематной смесью двух оптических изомеров (атом серы в молекулах ингибиторов является хиральным), эзомепразол представляет собой чистый S–омепразол. Изменение положения и структуры заместителей в молекулах ИПП приводит к изменениям в пиридиновом кольце, что сказывается на значении рК азота этого кольца.
Все замещенные бензимидазолы являются слабыми основаниями, то есть они способны связывать Н+ в кислой среде. Механизм действия ИПП независимо от их структуры одинаков, все они (а вернее, соединения, образующиеся из них в кислой среде) ковалентно связываются с SH–группами a–субъединицы Н,К–АТФазы за счет образования S–S связи.
Действие всех замещенных бензимидазолов на секрецию соляной кислоты включает следующие этапы:
1) всасывание из желудочно–кишечного тракта;
2) концентрирование в секреторных канальцах париетальных клеток;
3) молекулярная перестройка в кислой среде;
4) ковалентное связывание с SH–группами Н,К–АТФазы.
Лекарственные формы ИПП покрыты оболочкой, которая устойчива в кислой и растворима в слабощелочной среде. Они в неповрежденном виде проходят через желудок и начинают всасываться в тонком кишечнике. Молекулы замещенных бензимидазолов не имеют заряда и достаточно гидрофобны, поэтому они довольно легко проникают через мембраны клеток. Попав в кровь, замещенные бензимидазолы быстро перераспределяются между различными тканями. Если эти соединения попадают в раствор, значение рН которого ниже рК азота пиридинового кольца, то они протонируются, причем Н+ связывается с атомом азота пиридинового кольца. Связывание Н+ делает молекулу положительно заряженной, вследствие этого она не может проникать через мембраны. Вследствие этого протонированные ингибиторы накапливаются в тех компартментах клеток, которые имеют рН ниже значения рК для данного ингибитора. В клеточных канальцах рН составляет 0,8–1,0, поэтому ИПП в первую очередь накапливаются в секреторных канальцах париетальных клеток, причем их концентрации там может в тысячу раз превышать их концентрацию в крови. Концентрирование ИПП в секреторных канальцах париетальных клеток является первой стадией, играющей существенную роль в обеспечении избирательности их действия и объясняющей их высокую безопасность [1].
Таким образом, клиническая безопасность всех ИПП является класс–специфичным свойством, поскольку замещенные бензимидазолы являются предшественниками лекарства, то есть они неактивны в той форме, в которой употребляются. Протонирование приводит к значительным изменениям в структуре соединений, после протонирования происходит превращение относительно стабильной метилсульфенильной группы в высокореактивный циклический сульфенамид. Сульфенамид образуется в результате переноса Н+ от азота пиримидинового цикла к азоту имидазольного кольца, что увеличивает электрофильность второго атома углерода имидазола. Вслед за этим происходит нуклеофильная атака непротонированного азота пиридинового цикла на углерод имидазола, вследствие чего между этими атомами образуется ковалентная связь. В результате между пиридиновым и имидазольным кольцами образуется еще один цикл. Образующийся тетрациклический сульфенамид реагирует с SН–группами Н,К–АТФазы. Поскольку сульфенамид накапливается главным образом в секреторных канальцах, он будет реагировать только с теми частями молекул белков, которые экспонированы в пространство канальцев. Биохимический анализ показал, что единственным белком, связывающимся с замещенными бензимидазолами в секреторных канальцах париетальных клеток, является α–субъединица Н,К–АТФазы [3].
S–S связь ковалентна; по этой причине замещенные бензимидазолы являются необратимыми ингибиторами протонной помпы. Устранение ингибирования после ковалентного связывания тетрациклического сульфенамида происходит лишь после того, как молекула протонного насоса элиминируется путем протеолиза. Однако S–S связь может быть восстановлена под действием такого соединения, как глутатион, который присутствует в секреторных канальцах, поэтому время, в течение которого существует ингибированная форма протонной помпы, уменьшается, причем скорость восстановления зависит от химической структуры ингибитора. У человека ингибирование секреции устраняется наполовину через 15 ч после начала действия лансопразола, через 30 ч после ингибирования секреции омепразолом и рабепразолом и примерно через 46 ч после действия пантопразола [4]. Это свидетельствует о том, что ковалентная связь ингибитора с протонной помпой наиболее прочная у пантопразола, что объясняет большую длительность его антисекреторного эффекта, о чем будет сказано далее.
Кислотозависимые
заболевания и ИПП
Наиболее распространенным кислотозависимым заболеванием в популяции является ГЭРБ – хроническое рецидивирующее заболевание, обусловленное нарушением моторно–эвакуаторной функции гастроэзофагеальной зоны и характеризующееся спонтанным или регулярно повторяющимся забросом в пищевод желудочного и/или дуоденального содержимого, с развитием характерных симптомов вне зависимости от наличия морфологических изменений слизистой оболочки пищевода. Генвальские рекомендации (Бельгия, 1997) предлагают выделять эндоскопически негативную (НЭРБ), эндоскопически позитивную ГЭРБ (эрозивный рефлюкс–эзофагит) и пищевод Барретта [5]. Этиотропной терапии ГЭРБ не существует, наиболее эффективно патогенетическое лечение – снижение желудочной секреции. В настоящее время единственным классом лекарственных средств, способным удержать рН в пищеводе выше 4, являются ИПП. Это тот целевой уровень среднесуточного рН, который позволяет надеяться на эффективное заживление язв и эрозий, осуществлять профилактику их рецидива и минимизировать риск прогрессирования пищевода Барретта. Мета–анализы рандомизированных исследований на рубеже веков показали достоверные преимущества ИПП над Н2–блокаторами в эффективности лечения ГЭРБ, и в последние 10 лет уже не обсуждается, препарат какой группы следует выбирать для лечения [6].
Язвенная болезнь (ЯБ) – это мультифакториальное заболевание, характеризующееся рецидивирующим клиническим течением с чередованием периодов обострения и ремиссии, с формированием локального язвенного дефекта слизистой оболочки желудка и/или двенадцатиперстной кишки. Распространенность ЯБ среди взрослого населения составляет в разных странах от 5 до 15% (в среднем 7–10%) [7]. По имеющимся данным за 2006 г., распространенность и заболеваемость ЯБ, среди всего населения Российской Федерации составили 1 711 509 и 160 512, соответственно (на 100 000 населения – 1198,9 и 112,4) [8].
По данным многочисленных исследований, выполненных с позиций доказательной медицины, проведение эрадикационной терапии способствовало значительному снижению заболеваемости и частоты осложнений ЯБ в большинстве экономически развитых стран. Противорецидивный эффект эрадикационной терапии в 10 раз эффективнее обычной «традиционной» антисекреторной терапии ЯБ двенадцатиперстной кишки [9]. Кроме того, эрадикация инфекции H. pylori уменьшает риск развития рака желудка некардиального типа [10–12].
Главным критерием при выборе антихеликобактерной терапии на сегодняшний день продолжает оставаться ее эффективность. Действующие рекомендации Российской Гастроэнтерологической ассоциации по диагностике и лечению инфекции H. pylori, основанные на 3 Маастрихтском соглашении, определяют, что эрадикация инфекции должна быть достигнута, как минимум, в 80% случаев.
Антихеликобактерная терапия в соответствии с действующими рекомендациями может быть реализована путем назначения ИПП в двойной дозе в сочетании с амоксициллином 1000 мг 2 раза в сутки и кларитромицином 500 мг 2 раза в сутки. При неэффективности схемы из первой линии назначается терапия второй линии.
В многочисленных работах показано, что использование макролидов в комбинации с ИПП наиболее эффективно. Это объясняется в первую очередь существующим синергизмом между этими препаратами [13,14] за счет фармакокинетического взаимодействия кларитромицина и ИПП, реализующегося на уровне изоферментов цитохрома Р450. Что не менее важно, при сочетанном применении кларитромицина с ИПП значительно увеличивается стабильность антибиотика при более высоких значениях рН в желудке. Известно, что при рН более 5 создаются лучшие условия для эрадикации H. pylori, в частности, как было указано выше, за счет усиления эффективности антибиотиков путем минимизации их разрушения в кислой среде желудка. Хотя в схемах, используемых для эрадикации H. pylori, используются антибиотики, устойчивые к гидролизу в кислой среде – амоксициллин и кларитромицин, их период полураспада значительно возрастает при повышении рН желудочного сока. Именно поэтому ИПП и являются базовыми препаратами антихеликобактерных схем.
Синдром Золингера–Эллисона связан с гипергастринемией, обусловленной продукцией гастрина гастриномой (гормонально–активной опухолью). Как правило, гастриномы располагаются в поджелудочной железе, но могут быть выявлены и в подслизистой основе двенадцатиперстной кишки. Заподозрить этот синдром необходимо у пациентов с атипичной язвенной болезнью (множественные язвы, язвы дистального отдела двенадцатиперстной кишки или тощей кишки), при неэффективности предшествующего лечения антисекреторными препаратами, при частом рецидивирующем течении ЯБ, особенно в послеоперационный период, часто синдром Золингера–Эллисона сопровождается диарей. Диагноз должен быть установлен при значительном увеличении уровня гастрина в сыворотке крови.
Различия между ИПП
Как мы отмечали выше, общим для всех ИПП является механизм действия. Накапливаясь в секреторных канальцах париетальной клетки, они конвертируются в сульфенамидные производные, необратимо блокируя фермент, связываясь посредством ковалентной связи в 813–й позиции с молекулами цистеина K+/H+АТФ–азы (протонной помпы). Блокада помпы приводит к приостановлению синтеза соляной кислоты вне зависимости от природы и силы стимулирующих париетальную клетку факторов. Для того чтобы вновь начать секретировать соляную кислоту париетальной клетке необходимо синтезировать новый белок фермента, на что уходит около 18 часов. Все производные бензимидазола обеспечивают длительный период времени в течение суток, когда значения рН становятся благоприятными для лечения кислотозависимых заболеваний. Пантопразол также связывается и с глубоким цистеином в 822–й позиции. Возможно, именно поэтому, в результате более прочной связи с K+/H+АТФ–азой, продолжительность ингибирования желудочной секреции при использовании пантопразола достигает 46 часов (лансопразол 15 часов, рабепразол и омепразол 30 часов), что делает его весьма надежным ИПП для лечения КЗЗ [4]. В ряде проведенных сравнительных исследований, вероятно, именно эти свойства пантопразола и определили большую клиническую эффективность препарата по сравнению с другими ИПП, оцененную по проценту пациентов с купированной изжогой и общему проценту успешного лечения при лечении ГЭРБ [15,16].
Сегодня на фармакологическом рынке ИПП имеется 5 химических разновидностей этой группы препаратов: омепразол, эзомепразол (оптический изомер омепразола), пантопразол (Нольпаза), лансопразол, рабепразол. Первым ИПП был омепразол, синтезированные после него ИПП отличаются от него структурой радикалов на пиридиновом и имидазольном кольцах.
Большинство метаболических биотрансформаций ксенобиотиков происходит в две фазы. В 1 фазу биотранформации все жирорастворимые препараты подвергаются гидроксилированию суперсемейством цитохрома Р450. Во 2 фазу (конъюгация) происходят реакции, приводящие к формированию неактивных метаболитов, которые, собственно, и выводятся из организма с мочой или калом. Наиболее высокие концентрации цитохрома Р–450 определяются в мембранах эндоплазматического ретикулума гепатоцитов, в наружных мембранах митохондрий; меньшие концентрации во внепеченочных тканях (энтероцитах тонкой кишки, очень мало в легких и почках) локализованы в мембранах эндоплазматического ретикулума. На сегодняшний день известно, что более 60% известных препаратов метаболизируются посредством CYP3A4 и CYP2C19 [17].
Различия в метаболизме ИПП и, следовательно, уровень кислотности могут играть весомую роль в лечении КЗЗ. Омепразол полностью метаболизируется и поэтому в неизменном виде почти не выводится из организма [18]. Доказано, что большая часть омепразола метаболизируется посредством фермента CYP2C19, а меньшая (около 10 %) через CYP3A4. У последующих генераций ИПП эта зависимость также сохраняется, но выражена меньше, так например у рабепразола имеется неферментативный путь [19].
Поскольку все ИПП в той или иной степени метаболизируются в печени посредством ферментной системы цитохрома Р450, нельзя исключить их взаимодействий с лекарственными препаратами, которые метаболизируются той же системой. При этом в проведенных клинических исследованиях пантопразол (Нольпаза) практически не оказывает влияния на фармакокинетику других препаратов, метаболизирующихся в печени системой цитохрома P450 [20]. В имеющихся литературных данных не было выявлено значимых взаимодействий с дигоксином, диазепамом, диклофенаком, этанолом, фенитоином, глибенкламидом, карбамазепином, кофеином, метопрололом, напроксеном, нифедипином, пироксикамом, теофиллином и пероральными контрацептивами. Тем не менее у пациентов, получающих кумариновые антикоагулянты, одновременно с пантопразолом рекомендуется регулярно контролировать протромбиновое время или MHO [21–23].
Кроме того, важным для скорости активации и эффективность ИПП является и зависимость от рН среды и значения константы диссоциации (рК), которая определяет проницаемость клеточных мембран и активацию ИПП. Значение рК для азота пиридинового кольца пантопразола (Нольпаза) минимально относительно всех имеющихся на фармакологическом рынке России ИПП, и равняется 3,0.
Режим дозирования пантопразола (Нольпаза). При эрозивной ГЭРБ стадии А и В по Лос–Анджелесской классификации или при НЭРБ рекомендуемая доза составляет 20 мг/сут.; при ГЭРБ – ст. С или D – нольпаза назначается по 40–80 мг/сут. на 1 или 2 приема. Облегчение симптомов наступает обычно в течение первых двух недель. Курс терапии составляет 4–8 недель.
В качестве поддерживающей длительной терапии назначают по 20 мг/сут., при необходимости (например, у больных пищеводом Барретта) дозу повышают до 40–80 мг в сутки. Возможен прием препарата «по требованию» при возникновении симптомов.
При эрозивно–язвенных поражениях желудка и двенадцатиперстной кишки, связанных с приемом НПВП, рекомендуемая доза – 40–80 мг/сут. Курс терапии – 4–8 недель. Для профилактики эрозивных поражений на фоне длительного применения НПВП рекомендуется назначать 20 мг в сутки на длительный прием.
Для лечения язвенной болезни желудка и двенадцатиперстной кишки (в режиме монотерапии, например, при H. pylori – негативной ЯБ) назначают по 40–80 мг/сут. Курс лечения обычно от 2 до 4–8 недель. При необходимости (рефрактерном течении язв желудка) длительность терапии увеличивается.
Для эрадикации Helicobacter pylori рекомендуемая доза 40 мг 2 раза в день в комбинации с двумя антибиотиками, курсом до 14 дней.
При синдроме Золлингера–Эллисона и других патологических состояниях, связанных с повышенной желудочной секрецией, рекомендуемая стартовая доза длительной терапии пантопразолом составляет 80 мг/сут., разделенная на 2 приема. В дальнейшем суточную дозу можно титровать в зависимости от исходного уровня желудочной секреции. Возможно временное увеличение суточной дозы пантопразола до 160 мг с целью адекватного контроля желудочной секреции. Длительность терапии подбирается индивидуально.
Литература
1. Лопина О.Д. Механизм действия ингибиторов протонного насоса. Росс. журн. гастроэнтерол. гепатол. колопроктол. 2002; 2: 38–44.
2. Fellenius E., Berglindh T., Sachs G. et al. Substituted benzimidazoles inhibit gastric acid secretion by blocking (H+K+)ATPase. Nature 1981; 290: 159–161.
3. Lerentzan P., Jackson R., Wallmark B., Sachs G. Inhibition of (H++K+–ATPase by omeprazole by isolated gastric vesicles requires proton transport. Biochim. Biophys. Acta. 1987; 897: 41–51.
4. Sachs G., Shin J.M., Pratha V., Hogan D. Synthesis or rupture: duration of acid inhibition by proton pump inhibitors. Drugs Today (Barc). 2003; 39, Suppl A: 11–14.
5. Dent J., Brun J., Fendrick A. et al. An evidence–based appraisal of reflux disease management – the Genval Workshop Report. Gut 1999; 44(Suppl. 2): S1–16.
6. van Pinxteren B, Numans ME, Bonis PA, Lau J. Short–term treatment with proton pump inhibitors, H2–receptor antagonists and prokinetics for gastro–oesophageal reflux disease–like symptoms and endoscopy negative reflux disease. Cochrane Database Syst Rev. 2001; (4): CD002095.
7. Маев И.В., Оганесян Т.С., Кучерявый Ю.А. Сравнительная эффективность тройной антигеликобактерной терапии I линии при использовании препаратов пантопразола и омепразола. Лечащий врач. 2010; 2: 2–7.
8. http://www.minzdravsoc.ru/docs/mzsr/letters/60
9. Mones J., Rodrigo L., Sancho F. et al. Erradicacion de Helicobacter pylori versus tratamiento de mantenimiento durante un ano: eficacia sobre la recidiva y la gastritis // Rev. Esp. Enferm. Dig. 2001; 93 (6): 372–380.
10. De Vries A., Kuipers E.J. Review article: Helicobacter pylori eradication for the prevention of gastric cancer. Aliment. Pharmacol. Ther. 2007; 26 (2): 25–35.
11. Исаков В.А., Домарадский И.В. Хеликобактериоз. М.: Медпрактика–М, 2003. – 412с.
12. Vergara M., Vallve M., Gisbert J.P., et al. Meta–analysis: Comparative efficacy of different proton–pump inhibitors in triple therapy for Helicobacter pylori eradication. Aliment. Pharmacol. Ther. 2003; 18: 647–654.
13. Исаков В.А. Ингибиторы протонного насоса – основа схем антихеликобактерной терапии. Эксп. клин. гастроэнтерол. 2004; 3: 40–43.
14. Miehlke S., Kirsch C., Schneider–Brachert W. et al. A prospective, randomized study of quadruple therapy and high–dose dual therapy for treatment of Helicobacter pylori resistant to both metronidazole and clarithromycin. Helicobacter 2003; 8: 310–319.
15. Pilotto A, Franceschi M., Leandro G. Comparison of four proton pump inhibitors for the short–term treatment of esophagitis in elderly patients. World J. Gastroenterol. 2007; 13(33): 4467–4472.
16. Naumburger A., Schoffel L., Gillessen A. Comparison of two treatment regimens in symptomatically homogenous GERD patient populations: pantoprazole relieves gastrointestinal symptoms significantly better than omeprazole. Gut 2004; 53.(Suppl VI): A108.
17. Гринстейн Б. Наглядная биохимия: Пер. с англ. / Б. Гринстейн, А. Гринстейн. М.: ГЭОТАР Мед., 2000. – 119 с.
18. Исаков В.А. Фармакогенетический анализ метаболизма и клинической эффективности ингибиторов протонного насоса. Клин. фармакол. тер. 2003; 1: 32–37.
19. Giannini E.G., Savarino V., Testa R. Monitoring cytochrome P–450 activity during rabeprazole treatment in patients with gastresophageal reflux disease. Dig. Dis. Sci. 2006; 51: 1602–1609.
20. Blume H., Donath F., Warnke A., Schug B.S. Pharmacokinetic drug interaction profiles of proton pump inhibitors. Drug Safety 2006; 29(9): 769–784.
21. Naumburger A., Schoffel L., Gillessen A. Comparison of two treatment regimens in symptomatically homogenous GERD patient populations: pantoprazole relieves gastrointestinal symptoms significantly better than omeprazole. Gut. 2004; 53 (Suppl VI): A108.
22. Juurlink D.N., Gomes T., Ko D.T. et al. A population–based study of the drug interaction between proton pump inhibitors and clopidogrel. CMAJ 2009; 180: 713–718.
23. Duursema L. et al. Lack of effect of pantoprazole on the pharmacodynamics and pharmacokinetics of warfarin. Br J Clin Pharmacol 1995; 39(6): 700–703.












