Ожирение представляет собой сложный комплекс метаболических нарушений, включающий избыточный объем жировой ткани, с тенденцией к прогрессированию при отсутствии специфической терапии. Жировая ткань – не просто пассивный накопитель жира – «аккумулятор энергии», но одновременно она является активным ауто–, пара– и эндокринным органом, способным синтезировать и секретировать в кровоток различные биологически активные соединения пептидной и непептидной природы, играющие важную роль в гомеокинезе различных систем. Адипоциты – функциональные единицы жировой ткани – являются источником фактора некроза опухоли – α (ФНО– α), ингибитора активатора плазминогена–1 (ИАП–1), интерлейкина–6 (ИЛ–6), лептина, ангиотензиногена, инсулиноподобного фактора роста–1 (ИФР–1).
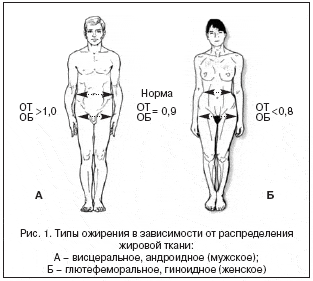
Частота и тяжесть нарушений и заболеваний, сопряженных с морбидным ожирением, зависят не только от степени ожирения, но и от локализации отложения жировой ткани в организме. Описано два типа отложения жира – гиноидный (женский, глютеофеморальный – «грушевидный») и андроидный (мужской – «яблоковидный»), косвенными признаками которого является увеличение окружности живота, увеличение отношения окружности талии (ОТ) к окружности бедер (ОБ) – ОТ/ОБ >0,9. Чаще всего андроидное ожирение сочетается с СД, ИБС, подагрой (рис. 1).
Большое внимание в настоящее время уделяют эндоканнабиноидной системе (ЭКБС), принимающей главное участие в патогенезе морбидного ожирения. Выявлена тесная зависимость рецепторов ЭКБС с биологически активными веществами висцеральной жировой ткани. Доказана регулирующая роль ЭКБС в формировании аппетита и типов пищевого поведения (ПП).
История использования человеком растений рода Cannabis насчитывает более 4000 лет. Во многих странах это растение использовалось для получения масла и волокон. Давно известны психотропные свойства конопли. Cannabis находила широкое применение в качестве обезболивающих, противоэпилептических, противосудорожных средств и противорвотных медицинских средств.
В конопле содержится более 60 каннабиноидов, главным из которых является d–9–тетрагидроканнабинол, исследования которого привели к открытию ЭКБС. Термином «каннабиноиды» принято обозначать хи¬мические соединения, содержащиеся в конопле, про¬дукты их превращения и синтетические аналоги. ЭКБС включает, кроме эндоканнабиноидов, их рецепторы, метаболические пути синтеза и деградации. Эндоканнабиноиды образуются из фосфолипидов–предшественников, находящихся в мембранах клеток, «по требованию». Они действуют локально и немедленно метаболизируются после того, как оказывают свое действие. Эндоканнабиноиды – высоколипофильные соединения, поэтому они не могут, подобно нейротрансмиттерам, депонироваться в везикулах.
Эндоканнабиноидная система определяет под собой совокупность каннабиноидных рецепторов, их лигандов, ферментов и белков, регулирующих концентрацию лигандов. Исторические описания стимулирующих эффектов Cannabis sativa на аппетит сейчас объясняются способностью психоактивного компонента δ–тетрагидроканнабинола (ТНС) взаимодействовать с СВ1 каннабиноидными рецепторами. И ТНС, и эндогенный каннабиноид анандамид (АЕА) увеличивают прием пищи. Более того, ТНС усиливает всасывание жиров, стимулирует аппетит у людей.
При употреблении вкусной, высококалорийной и богатой жирами пищи в гипоталамусе происходит гиперактивация ЭКБС, что ведет к увеличению аппетита и усилению липогенеза, а насыщение и трата энергии соответственно уменьшаются. Жирная пища увеличивает доступность полиненасыщенных жирных кислот для биосинтеза эндоканнабиноидов, что также приводит к гиперактивности ЭКБС (рис. 2).
Эндоканнабиноидная система – общая система восстановления после стресса, обычно находящаяся в неактивном состоянии. Она временно активируется, чтобы вернуть в исходное состояние гомеостаз организма, помогая человеку расслабиться (обеспечивая уменьшение боли и тревоги, модулирование температуры тела, образования гормонов, тонуса гладких мышц и артериального давления), отдохнуть (обеспечивая ингибирование моторного поведения и успокоение), забыть (обеспечивая устранение неприятных воспоминаний), защититься как на клеточном, так и на эмоциональном уровне, поесть (производя эффекты, индуцирующие аппетит и усиливающие удовольствие от пищи).
При некоторых патологических состояниях – ожирении, стимуляции никотином – ЭКБС становится чрезмерно активной. Она индуцирует увеличенное потребление пищи и потребность в табаке, действуя на уровне мозга, и стимулирует отложение жира, действуя на уровне адипоцитов.
При продолжающихся исследованиях постепенно складывается представление о физиологической роли ЭКБС.
Рецепторы ЭКБС были открыты в 1990 году (первый тип – CB1) и в 1993–м (второй тип – CB2). Каннабиноидные рецепторы СВ1 располагаются в головном мозге (кора, гиппокамп, базальные ганглии, мозжечок, гипоталамус, ствол мозга, лимбические структуры) и в периферических тканях (адипоциты, желудочно–кишечный тракт – ЖКТ). Кроме того, рецепторы CB1 обнаружены в миокарде, сосудистом эндотелии и симпатических нервных окончаниях. Каннабиноидные рецепторы СВ2 в основном локализуются в лимфоидной ткани и макрофагах, где они, по–видимому, участвуют в регуляции иммунной системы организма. Обе группы рецепторов являются трансмембранными G–белками. Есть основания предполагать и существование рецепторов CB3, однако пока их не удалось идентифицировать. В настоящее время описаны по крайней мере два лиганда СВ–рецепторов (эндоканнабиноида) – анандамид и 2–арахидоноилглицерол, являющиеся фосфолипидами. В норме ЭКБС активируется «по требованию» в ответ на раздражение. После осуществления эффекта эндоканнабиноиды быстро разрушаются.
Регуляция поступления и усвоения пищи определяется сложным взаимодействием адипоцитов, мезолимфатической системы, гипоталамуса и ЖКТ. По–видимому, ЭКБС играет роль одного из ключевых регуляторов этого взаимодействия.
У больных с избыточным весом и курильщиков ЭКБС постоянно активируется избытком пищи и никотина. В ответ на систематическую выработку эндоканнабиноидов в ЦНС – на уровне гипоталамуса и дугообразного ядра – происходят патологическая активация аппетита и повышение потребности в никотине. На периферии в клетках жировой ткани активируются процессы липогенеза.
В эксперименте на грызунах ожирение вызывало постоянную активацию ЭКБС с повышением содержания эндоканнабиноидов на уровне гипоталамуса и мезолимбических структур, а в периферических тканях – активацию адипоцитов, что приводило к избыточному приему пищи и активному липогенезу.
В культуре адипоцитов, стимулированных эндоканнабиноидами, отмечались активный липогенез и снижение уровня адипонектина. Блокада эндоканнабиноидных рецепторов возвращала липогенез к исходному уровню, и уровень адипонектина повышался.
Постоянная активация ЭКБС вызывалась также длительным назначением никотина, причем местом реализации эффекта в ЦНС было дугообразное ядро. Выброс дофамина в ответ на очередную дозу никотина был фактором, обусловливающим устойчивую потребность в этом веществе.
В последние годы привлекает новая группа препаратов, воздействующих на эндоканнабиноидную систему – блокаторов СВ1 эндоканнабиноидных рецепторов. ЭКБС у здорового человека обычно находится в «немом» состоянии, активируясь «по требованию» под воздействием стресса. Основные последствия активации этой системы состоят в нарушении терморегуляции, регулировании тонуса гладких мышц и АД, ингибировании моторного поведения – усиление боли и тревоги, стимулирование аппетита и никотиновой зависимости (получение удовольствия от приема пищи и курения).
Первый антагонист каннабиноидных рецепторов римонабант был создан в 1994 г. Он является блокатором СВ1. Этот препарат уже применялся в нескольких многоцентровых рандомизированных плацебо–контролируемых исследованиях у больных ожирением и продемонстрировал обнадеживающие результаты в отношении снижения массы тела, улучшения липидного профиля и контроля гликемии у пациентов с СД. Немаловажным фактором является то, что применение СВ1–блокаторов способствует отказу от курения.
Вызываемый римонабантом клинический эффект зависит от анатомической локализации действия. При блокаде эндоканнабиноидных рецепторов гипоталамуса происходит снижение аппетита, а выключение рецепторов дугообразного ядра ведет к уменьшению зависимости от никотина. В периферических тканях блокируется активация адипоцитов, тормозится липогенез и повышается уровень адипонектина, что приводит к снижению концентрации атерогенных фракций липопротеидов и уменьшению инсулинорезистентности.
Максимальная концентрация римонабанта в плазме крови наблюдается через 1–3 ч после приема. Системное действие препарата в целом возрастает с увеличением дозировки. Период полувыведения колеблется от 6 до 10 дней у молодых лиц и увеличивается до 15 дней у полных и пожилых людей. Римонабант хорошо переносится в дозах до 300 мг (в качестве нагрузочной) и до 60 мг (в качестве поддерживающей).
Метаболизм римонабанта происходит с участием CYP3A4. Значимых взаимодействий римонабанта с часто назначаемыми лекарственными средствами (статины, антидиабетические препараты, оральные контрацептивы, варфарин, дигоксин) не зарегистрировано.
Применение блокаторов рецепторов эндоканнабиноидной системы является многообещающим методом лечения абдоминального ожирения. Прямое влияние молекул нового класса на метаболизм жиров и глюкозы, воздействие на аппетит и чувство насыщения, восстановление энергетического гомеостаза путем гармонизации процессов накопления и траты жиров поможет существенно улучшить результаты борьбы с ожирением.
В настоящее время известно множество гормонов, регулирующих ПП: обладающие орексогенным эффектом (увеличивающие потребление пищи) – норадреналин (a2–рецепторы), нейропептид Y, В–эндорфин, соматолиберин, галанин, грелин, соматостатин; обладающие анорексогенным эффектом (уменьшающим потребление пищи) – норадреналин (a2–, b2–рецепторы), серотонин, холецистокинин, меланоцитстимулирующий гормон, кортиколиберин, лептин, энтеростатин, тиреолиберин, глюкагон, вазопрессин, бомбезин.
В формировании пищевых пристрастий человека принимают участие многие гормоны ПП, в частности лептин, грелин, серотонин, эндорфины. При нарушении их соотношения формируется атипичное пищевое поведение.
Результаты собственных наблюдений показали наличие зависимости уровня гормонов ПП и его типов, на фоне лечения получена динамика массы тела и ОТ/ОБ, а также изменение гормонов ПП и модификация пищевого поведения до и после коррекции веса.
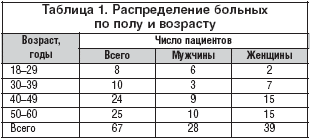
При обследовании 67 больных с абдоминальным ожирением II–III степени в возрасте от 18 до 60 лет, включающих 39 женщин и 28 мужчин (табл. 1), с помощью специально составленного опросника качества жизни пациентов SF 36 были выявлены следующие типы ПП.
• Эмоциогенное: 23%
• Экстернальное: 54%
• Ограничительное: 23%
После коррекции массы тела при применении редуцированной диеты (1600 ккал/сут.) произошла модификация ПП.
• Эмоциогенное: 9%
• Экстернальное: 55%
• Ограничительное: 36% (рис. 3)
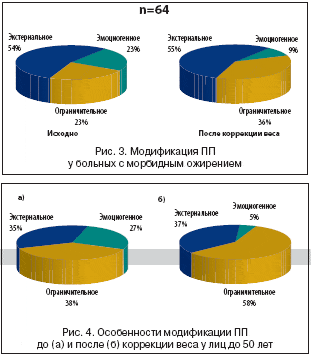
Причем, если разделить группы больных по возрасту на до и после 50 лет, то выявляется следующая особенность: у больных в возрасте до 50 лет до коррекции массы тела преобладает ограничительное ПП (38,46%), экстернальное составляет 34,62%, а эмоциогенное – 26,92%. После снижения веса ограничительное ПП выявляется у 58% больных, экстернальное сохраняется у 37%, а эмоциогенное выявляется у 5% больных (рис. 4).
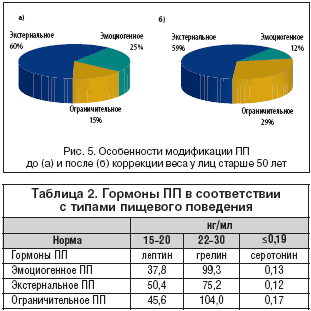
При сравнении типов ПП у больных старше 50 лет отмечается следующая тенденция: до коррекции веса у больных с ожирением преобладает экстернальное (60%), эмоциогенное выявляется у 25% больных, ограничительное – у 15%. После снижения веса: экстернеальное ПП – 58,83%, ограничительное – 29,41%, эмоциогенное – 11,76% (рис. 5).
Таким образом, после снижения веса происходит модификация ПП, но не у всех больных. Четко прослеживается связь между модификацией ПП и возрастом пациента. Вероятно, большое значение у молодежи имеет желание хорошо выглядеть, оставаться активными в социальной среде. Таким образом, достижение долговременного положительного эффекта, включающего снижение массы тела и изменение патологического типа ПП, у данной группы больных более выражено и значимо. А у людей старше 50 лет в формировании типов ПП и в их коррекции важную роль играет наличие сопутствующих заболеваний, полиморбидных проявлений метаболического синдрома и увеличение их числа с возрастом, что снижает качество жизни пациента и затрудняет достижение главной цели – стойкое удержание результата снижения веса совместно с модификацией ПП.
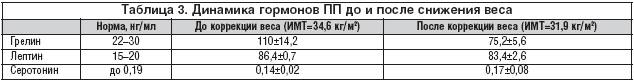
При сравнении типов ПП и уровня гормонов ПП отмечено увеличение цифр лептина и грелина и снижение серотонина при всех трех патологических типах ПП. Наиболее высокое содержание лептина (50,4 нг/мл) при, соответственно, самом низком уровне серотонина (0,12 нг/мл) выявлено при экстернальном типе ПП. Максимальное значение грелина (104,0 нг/мл) отмечается при ограничительном ПП (табл. 2).
При сравнении превышения гормонов ПП относительно нормальных значений видно, что уровень грелина при ограничительном и эмоциогенном типе ПП значительно превышает уровень лептина при низком серотонине. При экстернальном типе ПП лептин и грелин увеличены относительно одинаково при по–прежнему низких цифрах серотонина.
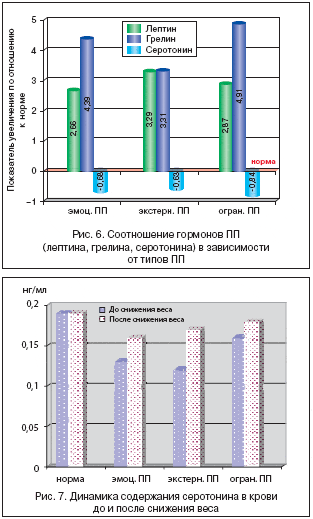
Несмотря на заметную разницу между грелином и лептином, их уровни повышены относительно нормы, т.е. происходит нарушение реципроктных отношений (рис. 6).
При анализе полученных данных исходного уровня гормонов ПП у больных с метаболическим синдромом среднее значение лептина составило 86,4±0,7 нг/мл, грелина – 110±14,2 нг/мл, серотонина – 0,14±0,02 нг/мл (табл. 3 ).
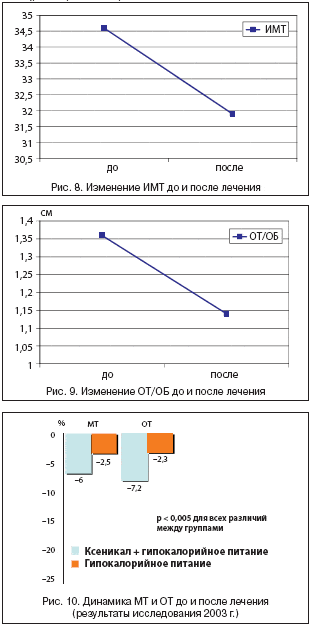
При снижении ИМТ до 28–25 кг/м2 отмечалось статистически достоверное уменьшение содержания лептина, грелина в крови, но достижения нормальных цифр не было отмечено, т.е. оставалось по–прежнему высоким по сравнению с базальным (нормальным) уровнем (табл. 3), а содержание серотонина – низким (рис. 7). Парадоксальный результат такого изменения гормонов ПП, даже после снижения веса, по–видимому, связан с нарушением реципрокных отношений лептина и грелина.
При повторном исследовании содержания пищевых гормонов в крови после снижения веса ИМТ уровень лептина снизился у 71% исследуемых больных, у 20% остался на прежнем уровне (среднее значение составило 83,4±2,6 нг/мл). Кроме того, снизился уровень грелина у 49% обследуемых (среднее значение 75,2±5,6 нг/мл). Снижение цифр всех двух показателей (лептина, грелина) отмечалось у 32% больных. При этом уровень содержания серотонина в крови у всех пациентов оказался ниже нормы (ниже 0,19 нг/мл) при первичном исследовании гормонов ПП и при контроле их динамики после коррекции веса (табл. 3).
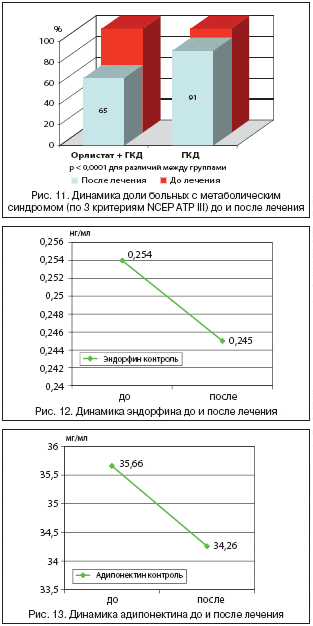
При обследовании больных выявлено снижение индекса массы тела с 34,6 до 31,9 кг/м2 (на 2,7 кг/м2) (рис. 8) и ОТ/ОБ с 1,36 до 1,14 (на 0,22) (рис. 9).
По данным исследования ORLICARDIA, проведенного в 2003 г., выявлено снижение МТ и ОТ на 2,5 кг и 2,3 см соответственно при использовании в качестве терапии низкокалорийной редуцированной диеты. На фоне приема орлистата в дозе по 120 мг 3 раза в сутки после еды совместно с гипокалорийной диетой (ГКД) отмечалось снижение МТ и ОТ на 6 кг и 7,2 см соответственно (рис. 10).
При сравнении 2 групп больных по 3 критериям ATР III до и после лечения отмечается более выраженное снижение показателей при применении в качестве лечения орлистата в дозе по 120 мг 3 раза в сутки совместно с ГКД (рис. 11).
При оценке изменения уровня содержания эндорфина видно, что после снижения веса происходит уменьшение значений этого гормона с 0,254 до 0,245 нг/мл (рис. 12). Также отмечается снижение содержания адипонектина с 25,11 до 24,7 мг/мл (рис. 13).
Продолжение проводимых в настоящее время исследований гормонов ПП в целом и ЭКБС в частности позволит, вероятно, получить существенную дополнительную информацию, даст возможность расширить представления о патогенезе абдоминального ожирения и разработать эффективные методы лечения, обеспечивающие стойкий долговременный эффект.

Литература
1. Бутрова С.А. Ожирение. Глава 2. Метаболический синдром. – М., 2004. – С. 44–46.
2. Вознесенская Т.Г. Церебральное ожирение и истощение (клиническое, нейроэндокринологическое и психофизиологическое исследование). – Дисс. докт. мед. наук. – М., 1990. – С. 472.
3. Вознесенская Т.Г. Ожирение. Глава 9. Типология нарушений ПП и эмоционально–личностные расстройства при первичном ожирении и их коррекция. – М., 2004. – С. 236–256.
4. Вознесенская Т.Г. Расстройства пищевого поведения при ожирении и их коррекция. – Ожирение и метаболизм. – 2004. – №2. – С. 1–4.
5. Вознесенская Т.Г., Вахмистров А.В. Клинико–психологический анализ нарушений пищевого поведения при ожирении // Журн. неврол. и психиатр. – М., 2001. – №12. – С. 19–24.
6. Гинзбург М.М., Крюков Н.Н. Ожирение. – М., 2002. – С. 53–76.
7. Гендлин Г.Е. Статины в лечении сердечно–сосудистых заболеваний. Сердце. 2005. Т4. №3. С.170;
8. Звенигородская Л.А., Кучеренко Т.В. Типы пищевого поведения и гормоны пищевого поведения у больных с метаболическим синдромом // Экспериментальная и клиническая гастроэнтерология. – 2007. – 1. С. 24–27.
9. Карпов Ю.А., Сорокин Е.В. О гиполипидемической терапии при метаболическом синдроме. Сердце. Журнал для практикующих врачей. 2006. Т. 5. №7 (31). С. 356–359.
10. Котовская Ю.В. Метаболический синдром: прогностическое значение и современные подходы к комплексной терапии. Сердце. 2005. Т4. №5. С. 236–241.
11. Манцорос Х. С. Современные представления о роли лептина в развитии ожирения и связанных с ним заболеваний человека // Международный журнал медицинской практики. – 2000. – №9. – С. 57–67.
12. Метаболический синдром. М.: «МЕДпрес–информ», 2007.
13. Миртумян А.М., Бирюкова Е.В. Основной подход к фармакотерапии метаболического синдрома. Consilium medicum. 2006. Т 8. № 5. С. 54–57.
14. Талызин П.А., Затейщиков Д.А. Блокада эндокканнабиноидных рецепторов – новый подход к лечению основных факторов риска атеросклероза. Фарматека. 2006. № 8. С. 10–15.
15. Шевченко О.П., Праскурничий Е.А., Шевчено А.О. Артериальная гипертония и ожирение. М.: «Реофарм», 2006.
16. Allon B. The stigma of overweight in everyday life: obesiti in perspective. Ed. G. A/ Gray. Washington: Fogarta International Center Series on Preventive Medicine. – 1973. – 2(2): 83–102.
17. Barbato J.E., Zuckerbraun B.S., Overbaus M. And all. Nitric oxide modulates vascular inflammation and intimal hyperplasia in insulin resistance and metabolic syndrome. J. Physiol. Heart. Circ. 2005. 289, 228–236.
18. Bray GA, Ryan DH, Gordon D, et al. A double–blind randomized placebocontrolled trial of sibutramine. Obes Res 1996;4:263–70.
19. Caballero A.E. Endothelial dysfunction in obesity and insulin resistance: a road to diabetes and heart disease. Obes. Res. 2003. 11, 1278–1289.
20. Chandran M, Phillips SA, Theodore Ciaraldi T, et al. Adiponectin: More than just another fat cell hormone? Diabetes Care 2003;26:2442–50.
21. Cota D., Tschop M. H. Cannabinoids, opioids and eating behavior: the molecular face of hedonism? – Brain Res Rev. – 2006. – 51:85–107.
22. Cummings D. E., Overduin J. Gastrointestinal regulation of food intake. – J. Clin.invest. – 2007. – V. 117(1) – 13–23 p.
23. Desideri G., De Simone M., Iughetti I. and all. Early activation of vascular endothelial cells and platelets in obese children. J. Clinic. Endocrinol. Metabolic. 2005. 90 (6), 3145–3152.
24. Despres JP, Golay A, Sjostrom L. Effects of rimonabant on metabolic risk factors in overweight patients with dyslipidemia. N Engl J Med 2005; 353:2121–34.
25. Di Marzo V., Matias I. Endocannabinoid control of food intake and energy balance. – Nat Neurosci. – 2005. – 8: 585–589 p.
26. Fryer JD, Lukas RJ. Noncompetitive functional inhibition at diverse,human nicotinic acetylcholine receptor subtypes by bupropion, phencyclidine, and ibogaine. J Pharmacol Exp Ther 1999; 288:88–92.
27. Gelfand EV, Cannon CP. Rimonabant: A Cannabinoid Receptor Type 1 Blocker for Management of Multiple Cardiometabolic Risk Factors. J Am Coll Cardiol 2006;47: 1919–26.
28. Goran M.I., Ball G.D., Cruz M.L. Obesity and risk of type 2 diabetes and cardiovascular disease in children and adolescents. J. C












