Эффективная и безопасная терапия атопического дерматита (АД) представляет собой серьезную проблему для дерматологов и педиатров всего мира. Сегодня, к сожалению, нет способа полностью излечить АД. Большинство из системных методов терапии или недостаточно эффективно, или обладает серьезными побочными эффектами. Выработанная десятилетиями практического опыта стратегия наружного лечения заключается в базовом применении смягчающих индифферентных средств общего ухода за кожей и использовании местных кортикостероидов для купирования обострений заболевания.
Новое направление в лечении АД связано с селективным угнетением продукции воспалительных цитокинов. Специально для наружного лечения заболевания разработан препарат, который блокирует транскрипцию цитокинов в активированных Т–лимфоцитах, играющих ключевую роль в патогенезе АД, – Элидел® (фармацевтическая компания Novartis, Швейцария). Действующим веществом Элидела является пимекролимус – вещество, принадлежащее к классу аскомициновых макролактамов [1,2]. Пимекролимус обладает уникальной молекулярной структурой, которая придает ему липофильные свойства [3], обусловливает высокое сродство к коже [4] и селективность противовоспалительного действия [5]. В Т–лимфоцитах пимекролимус связывается с цитозольным рецептором, макрофиллином–12 и ингибирует кальциневрин–фосфатазу, необходимую для транслокации нуклеарного фактора активированных Т–лимфоцитов в ядро. Это, в свою очередь, предотвращает образование и высвобождение IL–2, IL–3, IL–4, IL–8, IL–10, INF-g, TNF-a и пролиферацию Т–лимфоцитов в ответ на стимуляцию Т–клеточных рецепторов. Кроме того, пимекролимус препятствует высвобождению из активированных тучных клеток целого ряда медиаторов воспаления: гистамина, триптазы, TNF-a [1,6,7,8,9]. Препарат отличается отсутствием влияния на синтез коллагена фибробластами, т.е. не вызывает атрофию кожи в коротких клинических исследованиях [10]. Кроме того, in vivo пимекролимус не влияет на клетки Лангерганса, т.е. не угнетает местный иммунный ответ [11,12]. В экспериментах in vitro обнаружено, что пимекролимус хорошо проникает внутрь кожи, но проходит через кожный барьер в значительно меньшей степени, чем такролимус и кортикостероиды [5,13,14]. Это означает малую вероятность развития системных побочных эффектов при использовании препарата.
Краткосрочные клинические исследования подтвердили изложенные выше экспериментальные данные, однако в связи с хроническим характером АД особый интерес вызывает оценка эффективности и безопасности крема Элидел при длительном применении.
С этой целью в 22 центрах США было проведено 26–недельное многоцентровое исследование эффективности и безопасности Элидела у детей, больных АД [15], которое включало:
– 6–недельное рандомизированное двойное слепое исследование (слепая фаза);
– 20–недельную открытую фазу.
Характеристика больных и методы исследования
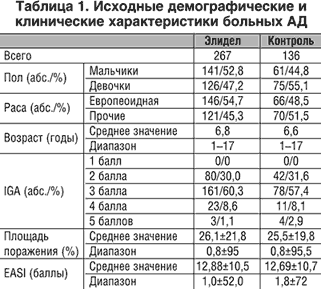
Наблюдали 403 ребенка обоего пола в возрасте от 2 до 17 лет, больных АД. Площадь поражения занимала не менее 5% от площади поверхности тела. Оценка исходного состояния по шкале IGA (IGA (Investigators Global Assessment) - общая оценка тяжести заболевания по 6-балльной шкале: 0 - кожа свободна от высыпаний, 1 - кожа почти свободна от высыпаний, 2 - незначительное поражение, 3 - поражение средней тяжести, 4 - тяжелое, 5 - очень тяжелое поражение.) составляла 2–3 балла (легкая и средняя форма тяжести).
По результатам рандомизации 267 детей были включены в основную, а 136 – в контрольную группу. Статистически значимых демографических и клинических различий между группами не было (табл. 1).
Общий осмотр с оценкой IGA, EASI (EASI (Eczema Area Severity Index) - сочетанная оценка основных симптомов АД: гиперемии, инфильтрации, лихенификации, экскориаций (в баллах от 0 - отсутствие симптома до 3 - сильная выраженность) и площади поражения (в баллах от 0 - отсутствие поражения до 6 - 100%-е поражение всего кожного покрова). EASI выражается суммарно в баллах от 0 до 72.) и интенсивности зуда (интенсивность зуда оценивается по 4-балльной шкале: 0 - отсутствие, 1 - незначительный, 2 - средний, 3 - сильный.) проводили в первый день до первого нанесения препарата, а далее на 8, 15, 22, 29 и 43, 71, 99, 141 и 183-й дни.
Безопасность и переносимость оценивали по результатам клинического обследования, общим клиническим анализам крови и мочи, биохимическим тестам во время визитов.
Результаты и обсуждение
Слепую фазу завершили 233 (87%) больных, получавших Элидел, и 102 (75%) – основу крема. К причинам исключения из исследования относились: нарушения протокола, отказ от участия, неэффективность терапии, зарегистрированная у 7 (2,6%) детей основной и 21 (15,4%) – контрольной группы.
Эффективность
К концу слепой фазы (43 день) у 34,8% пациентов, применявших крем Элидел, отсутствовали или практически отсутствовали признаки заболевания (т.е. IGA=0 или 1), по сравнению с 18,4% пациентов контрольной группы (р<0,001). У больных контрольной группы после начала использования крема Элидел в открытой фазе наблюдалось быстрое улучшение состояния до уровня основной группы.
Динамика EASI в процессе лечения во время слепой фазы была значительно более выраженной в основной группе по сравнению с контрольной. У больных контрольной группы после начала использования крема Элидел в открытой фазе наблюдалось быстрое улучшение показателей EASI.
В области головы и шеи максимальный эффект от лечения (снижение регионального значения EASI на 86%) в группе пациентов, применявших крем Элидел, развивался к концу слепой фазы. Снижение аналогичных значений EASI в контрольной группе составило 25%. У больных контрольной группы после начала использования крема Элидел в открытой фазе наблюдалось быстрое исчезновение симптомов АД.
При всех посещениях клиники, кроме исходного, в ходе слепой фазы в основной группе значительно чаще отмечалось полное или почти полное отсутствие зуда (степень выраженности зуда 0 или 1) по сравнению с контрольной (р<0,001). У больных контрольной группы после начала использования крема Элидел в открытой фазе наблюдалось быстрое исчезновение зуда.
Безопасность и переносимость
Системные побочные эффекты
Системные побочные эффектыВ течение полугода непрерывного применения без ограничения площади обрабатываемой поверхности системные побочные эффекты не зарегистрированы, что согласуется с данными других авторов [16–18], определявших концентрацию препарата в течение года у 58 детей, больных АД, в возрасте от 3 месяцев до 14 лет. Площадь поражения и, соответственно, нанесения препарата составляла 10–92%. Концентрации пимекролимуса в крови находились на стабильно низком уровне: в 97% образцов крови – ниже 2 нг/мл, причем в 60% из них – ниже минимальной определяемой концентрации (0,5 нг/мл). Повышения концентрации препарата в крови в зависимости от площади поражения или длительности применения ни у одного ребенка не зарегистрировано.
Случаев тахифилаксии, атрофии, аллергических реакций, фототоксичности, канцерогенности ни в одном длительном непрерывном клиническом исследовании ни разу не обнаружено [15,19,20].
При изучении атрофогенного потенциала крема Элидел у здоровых добровольцев обнаружено, что препарат по данным эхографии не вызывает уменьшение толщины кожи, в отличие от 0,1% крема бетаметазона валерата и 0,1% крема триамцинолона ацетонида [19].
Местные реакции
Среди побочных явлений отмечено жжение в месте нанесения препарата в течение слепой фазы у 28 (10,5%) пациентов, получавших Элидел, и у 18 (13,2%), использовавших основу крема.
В течение открытой фазы 8 из 335 (2,4%) детей пожаловались на ощущение тепла или жжения. Это были пациенты контрольной группы, применявшие ранее индифферентную основу крема.
Следует отметить, что ощущение тепла или жжения возникало, как правило, при первых нанесениях крема Элидел. Во всех исследованиях отмечены низкая интенсивность этой местной реакции, не требующая отмены лечения, транзиторный характер и самопроизвольный регресс при последующих нанесениях препарата [16,21,22].
По–видимому, возникновение упомянутого побочного эффекта не прогнозируемо, т.е. относится к реакциям, возникающим по типу идиосинкразии, ибо целый ряд исследований [23,24] не выявил зависимости его возникновения от каких–либо демографических, клинических и лабораторных данных.
Особого внимания заслуживает факт, обнаруженный Pariser D. et al. [24]: на лице и шее (1,8%), а также в складках и на опрелых участках (0,3%) жжение в месте аппликации отмечается гораздо реже, чем в других областях кожного покрова (6,9%).
Выводы
1. Продемонстрирована отличная терапевтическая эффективность 1% крема Элидел у детей, больных АД. Препарат быстро и полностью устраняет зуд – основной симптом заболевания, причиняющий пациентам наибольшие страдания.
2. Системные побочные эффекты отсутствуют при любой площади обрабатываемой поверхности и любой длительности лечения.
3. Не зарегистрировано случаев тахифилаксии, атрофии, аллергических реакций, фототоксичности, канцерогенности.
4. Местная реакция – жжение в месте нанесения крема Элидел – возникает при первых аппликациях, отличается низкой интенсивностью (не требующей отмены лечения), транзиторным характером и самопроизвольным регрессом при последующих нанесениях препарата.
5. На лице и шее, а также в складках и на опрелых участках жжение в месте аппликации регистрируется намного реже, чем в других областях кожного покрова.
1. Grassberger M, Baumruker T, Enz A et al. A novel anti–inflammatory drug, SDZ ASM 981, for the treatment of skin diseases: in vitro pharmacology. Br J Dermatol 1999;141:264–73.l
2. Paul C, Graeber M, Stuetz A. Ascomycins: Promising agents for the treatment of inflammatory skin diseases. Expert Opin Invest Drugs 2000;9:69–7.7
3. Aszodi A, Stuetz A. Computational chemistry studies on pimecrolimus (SDZ ASM 981) and tacrolimus (FK506) reveal major differences in surface lipophilicity patterns (conference abstract). Ann Dermatol Venereol 2002;129:18690.
4. Schweitzer A, Figueiredo J, Zehender H, Grassberger M. Pimecrolimus (SDZ ASM 981) has high affinity for the skin – a tissue distribution study in rats in comparison with tacrolimus (FK506) (conference abstract). Ann Dermatol Venereol 2002;129:18704.
5. Stuetz A, Grassberger M, Meingassner JG. Pimecrolimus (Elidel(r), SDZ ASM 981) – Preclinical pharmacological profile and skin selectivity. Seminars in Cutaneous Medicine and Surgery 2001;20:233–41.
6. Kalthoff FS, Chung J, Stuetz A. Pimecrolimus inhibits upregulation of 0X40 and synthesis of inflammatory cytokines upon secondary T cell activation by allogeneic dendritic cells. Clin Exp Immunol 2002:in press.
7. Winiski A, Wang S, Schwendinger B, Stuetz A. Inhibitory activity of pimecrolimus and tacrolimus on induced cytokine mRNA and protein expression in a human T cell line (Jurkat) measured via RT PCR and ELISA. J Invest Dermatol 2002;119:347 abstract 835.
8. Hultsch T, Muller KD, Meingassner JG et al. Ascomycin macrolactam derivative SDZ ASM 981 inhibits the release of granule associated mediators and of newly synthesized cytokines in RBL 2H3 mast cells in an immunophilin–dependent manner. Arch Derm Res 1998;290:501–7.
9. Zuberbier T, Chong SU, Grunow K et al. The ascomycin macrolactam pimecrolimus (Elidel(r), SDZ ASM 981) is a potent inhibitor of mediator release from human dermal mast cells and peripheral blood basophils. J Allergy Clin Immunol 2001;108:275–80.
10. Queille–Roussel C, Paul C, Duteil L et al. The new topical ascomycin derivative SDZ ASM 981 does not induce skin atrophy when applied to normal skin for 4 weeks: a randomized, double–blind controlled study. Br J Dermatol 2001;144:507.
11. Kalthoff FS, Chung J, Musser P, Stuetz A. Pimecrolimus does not affect the expression of surface markers and functions of dendritic cell, in contrast to corticosteroids J Invest Dermatol. 2002;119:311 abstract 621.
12. Meingassner JG, Kowalsky E, Schwendinger H et al. Pimecrolimus does not effect Langerhans’ cells in murine epidermis, in contrast to corticosteroids J Invest Dermatol. 2002;119:347 abstract 837.












