–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ–Њ—П–≤–ї—П–µ—В—Б—П –≤—Б–µ –±–Њ–ї—М—И–µ –і–µ—В–µ–є —Б –ґ–∞–ї–Њ–±–∞–Љ–Є –љ–∞ —Г—А—В–Є–Ї–∞—А–љ—Г—О —Б—Л–њ—М – –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Г. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ 3% –і–Њ—И–Ї–Њ–ї—М–љ–Є–Ї–Њ–≤ –Є 2% —И–Ї–Њ–ї—М–љ–Є–Ї–Њ–≤ —Б—В—А–∞–і–∞—О—В –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є. –Ъ–ї—О—З–µ–≤–Њ–є –њ–Њ–Ј–Є—Ж–Є–µ–є –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Ї—А–∞–њ–Є–≤–љ–Є—Ж —П–≤–ї—П–µ—В—Б—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –µ–µ —В–µ—З–µ–љ–Є—П, –Ї–Њ—В–Њ—А–Њ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ—Б—В—А—Л–Љ (–і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Љ–µ–љ–µ–µ 6 –љ–µ–і–µ–ї—М) –Є–ї–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ (—Г—А—В–Є–Ї–∞—А–љ—Л–µ –≤—Л—Б—Л–њ–∞–љ–Є—П –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—В –Є–ї–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—В –±–Њ–ї–µ–µ 6 –љ–µ–і–µ–ї—М). –Ш–Љ–µ–љ–љ–Њ —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –Њ–±—К–µ–Љ –Є –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ—Б—В—М –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є –Є —В–µ—А–∞–њ–Є–Є. –Ю–±—Й–µ–њ—А–Є–Ј–љ–∞–љ–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –≤ —А–∞–љ–љ–µ–Љ –і–µ—В—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –њ—А–µ–Њ–±–ї–∞–і–∞—О—В –Њ—Б—В—А—Л–µ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л. –Ґ–∞–Ї, —Г –і–µ—В–µ–є –і–Њ 2–—Е –ї–µ—В –≤—Б—В—А–µ—З–∞—О—В—Б—П, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —В–Њ–ї—М–Ї–Њ –Њ—Б—В—А—Л–µ —Д–Њ—А–Љ—Л –Ї—А–∞–њ–Є–≤–љ–Є—Ж (–њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–µ –±–Њ–ї–µ–µ 6 –љ–µ–і–µ–ї—М), –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 2 –і–Њ 12 –ї–µ—В – –Њ—Б—В—А—Л–µ –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ —Б –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ–Љ –Њ—Б—В—А—Л—Е —Д–Њ—А–Љ, –∞ —Г –і–µ—В–µ–є —Б—В–∞—А—И–µ 12 –ї–µ—В –њ—А–µ–≤–∞–ї–Є—А—Г—О—В —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ —Д–Њ—А–Љ—Л –Ї—А–∞–њ–Є–≤–љ–Є—Ж [1]. –£ –і–µ—В–µ–є —А–∞–љ–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (–Њ—В 1 –і–Њ 36 –Љ–µ—Б—П—Ж–µ–≤) –Њ—Б—В—А–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –Љ–Њ–ґ–µ—В —П–≤–ї—П—В—М—Б—П –њ—А–Є—З–Є–љ–Њ–є —Г—А–≥–µ–љ—В–љ—Л—Е —Б–Є—В—Г–∞—Ж–Є–є, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Б—В–∞—Ж–Є–Њ–љ–∞—А–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ (0,4% –Њ—В –≤—Б–µ—Е –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є) [2]. –Ю—Б—В—А–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ —З–∞—Й–µ –≤—Л—П–≤–ї—П–µ—В—Б—П —Г –і–µ—В–µ–є —Б –∞—В–Њ–њ–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є. –Ґ–∞–Ї, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –ХTAC —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л, –Њ—Ж–µ–љ–µ–љ–љ–∞—П –Ј–∞ 18 –Љ–µ—Б—П—Ж–µ–≤, —Б—А–µ–і–Є –і–µ—В–µ–є —А–∞–љ–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Б –∞—В–Њ–њ–Є—З–µ—Б–Ї–Є–Љ –і–µ—А–Љ–∞—В–Є—В–Њ–Љ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 16,2% [3]. –С–Њ–ї–µ–µ —З–µ–Љ —Г 50% –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б—В—А–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –≤—Л—П–≤–ї—П—О—В—Б—П –Є –і—А—Г–≥–Є–µ –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞–Љ –≤ –і–µ—В—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ —Г–і–µ–ї—П–µ—В—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤–љ–Є–Љ–∞–љ–Є—П, –Є—Е —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–ї—П–µ—В 0,1–3% [5]. –•—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є, —З—В–Њ –≤—Л—А–∞–ґ–∞–µ—В—Б—П –≤ —Б–ї–∞–±–Њ—Б—В–Є, –љ–∞—А—Г—И–µ–љ–Є—П—Е —Б–љ–∞, —Б–Њ—Ж–Є–∞–ї—М–љ–Њ–є –Є–Ј–Њ–ї—П—Ж–Є–Є, —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є—П—Е [6,7]. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –і–µ—В—Б–Ї–Є–є –і–µ—А–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Є–љ–і–µ–Ї—Б –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –Є–Љ–µ–µ—В –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ –Ј–љ–∞—З–µ–љ–Є—П —Г –і–µ—В–µ–є —Б –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є, –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –Є –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є [7].
–†–∞–љ–µ–µ —Б—З–Є—В–∞–ї–Њ—Б—М, —З—В–Њ –њ—А–Є—З–Є–љ–∞ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –≤—Л—П–≤–ї—П–µ—В—Б—П –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ —Г 20% –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ґ–∞–Ї, Volonakis –Ь. et al. [8], –Њ–±—Б–ї–µ–і–Њ–≤–∞–≤ 226 –і–µ—В–µ–є —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є, —Г—Б—В–∞–љ–Њ–≤–Є–ї–Є –њ—А–Є—З–Є–љ—Г —Г 21,2% –±–Њ–ї—М–љ—Л—Е. –°—А–µ–і–Є –љ–Є—Е —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –±—Л–ї–Є –њ—А–Є—З–Є–љ–Њ–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Г 6,2% –і–µ—В–µ–є, –Є–љ—Д–µ–Ї—Ж–Є—П – 4,4%, –њ–Є—Й–µ–≤—Л–µ –∞–ї–ї–µ—А–≥–µ–љ—Л – 4%, –њ–Є—Й–µ–≤—Л–µ –і–Њ–±–∞–≤–Ї–Є – 2,6%, –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ—Л–µ –∞–ї–ї–µ—А–≥–µ–љ—Л – 2,2%, –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ – 1,8%. –Т –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –љ–∞–Љ–Є —Г 160 –і–µ—В–µ–є —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є, –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –±–Њ–ї–µ–µ –Њ–њ—В–Є–Љ–Є—Б—В–Є—З–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л. –†–∞–Ј–ї–Є—З–љ—Л–µ –≤–Є–і—Л —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж (—Б—О–і–∞ –ґ–µ –±—Л–ї–∞ –≤–Ї–ї—О—З–µ–љ–∞ –Є –µ–µ –Њ—Б–Њ–±–∞—П —Д–Њ—А–Љ–∞ – —Е–Њ–ї–Є–љ—Н—А–≥–Є—З–µ—Б–Ї–∞—П) –±—Л–ї–Є –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ—Л –≤ 53% —Б–ї—Г—З–∞–µ–≤, –њ—А–Є—З–µ–Љ —Г 1/6 –Є–Ј –љ–Є—Е –≤ —А–∞–Ј–≤–Є—В–Є–Є —Г—А—В–Є–Ї–∞—А–Є–є –њ—А–Є–љ–Є–Љ–∞–ї–Є —Г—З–∞—Б—В–Є–µ –Є IgE––Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є –Ї –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ—Л–Љ –Є –њ–Є—Й–µ–≤—Л–Љ –∞–ї–ї–µ—А–≥–µ–љ–∞–Љ; –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–∞—П –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ – 8,75% –і–µ—В–µ–є; –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–∞—П – 7,5%; –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–∞—П – 6,25%. –Э–µ —Г–і–∞–ї–Њ—Б—М –≤—Л—П–≤–Є—В—М –њ—А–Є—З–Є–љ—Г –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Г 24,4% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є–Љ –±—Л–ї –≤—Л—Б—В–∞–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј – —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ [9].
–Т–Њ–Ј–Љ–Њ–ґ–љ–Њ —Б–Њ—З–µ—В–∞–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Њ—А–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж. –Э–∞–њ—А–Є–Љ–µ—А, —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є —Г 21% –Њ—В–Љ–µ—З–∞–µ—В—Б—П –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–∞—П, —Г 8% —Е–Њ–ї–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–∞—П (–•–Ъ) –Є —Г 1% – —В–µ–њ–ї–Њ–≤–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ [10]. –С–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —В–µ—З–µ–љ–Є–µ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П –љ–∞–ї–Є—З–Є–µ–Љ —Н–Ї—Б–њ–Њ–Ј–Є—Ж–Є–Є –њ—А–Є—З–Є–љ–љ–Њ––Ј–љ–∞—З–Є–Љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤.
–¶–µ–љ—В—А–∞–ї—М–љ—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –Ј–∞–љ–Є–Љ–∞–µ—В —В—Г—З–љ–∞—П –Ї–ї–µ—В–Ї–∞. –Ґ—Г—З–љ—Л–µ –Ї–ї–µ—В–Ї–Є –Љ–Њ–≥—Г—В –±—Л—В—М –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ—Л –Ї –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—О –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Б—В–Є–Љ—Г–ї–∞–Љ–Є (–∞–ї–ї–µ—А–≥–µ–љ, –≥–Є—Б—В–∞–Љ–Є–љ–Њ–ї–Є–±–µ—А–∞—В–Њ—А—Л, –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В—Л –Є —В.–і.). –Э–∞–Є–±–Њ–ї–µ–µ –Є–Ј—Г—З–µ–љ–љ—Л–Љ –Љ–µ–і–Є–∞—В–Њ—А–Њ–Љ —П–≤–ї—П–µ—В—Б—П –≥–Є—Б—В–∞–Љ–Є–љ, –Ї–Њ—В–Њ—А—Л–є –њ—А–Є –≤–љ—Г—В—А–Є–Ї–Њ–ґ–љ–Њ–є –Є–љ—К–µ–Ї—Ж–Є–Є –Є–ї–Є –Є–Њ–љ–Њ—Д–Њ—А–µ–Ј–µ –≤—Л–Ј—Л–≤–∞–µ—В: –Ј—Г–і, –љ–∞—З–Є–љ–∞—О—Й–Є–є—Б—П —З–µ—А–µ–Ј 30–45 —Б–µ–Ї—Г–љ–і, —Б –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–Љ –њ–Є–Ї–Њ–Љ –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ –њ–Њ—Б–ї–µ 2 –Љ–Є–љ—Г—В, –Ј–∞—В–µ–Љ –Љ–µ–і–ї–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —З–µ—А–µ–Ј 10–15 –Љ–Є–љ—Г—В; –Њ—В–µ–Ї, –Ї–Њ—В–Њ—А—Л–є —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –±–Њ–ї–µ–µ —З–µ–Љ —З–µ—А–µ–Ј –≤–Њ—Б–µ–Љ—М –Љ–Є–љ—Г—В, –Є –≥–Є–њ–µ—А–µ–Љ–Є—О –њ–Њ –њ–µ—А–Є—Д–µ—А–Є–Є [11]. –Ю—В–µ–Ї —П–≤–ї—П–µ—В—Б—П –Њ—В–≤–µ—В–Њ–Љ –љ–∞ –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є–µ H1–—А–µ—Ж–µ–њ—В–Њ—А–∞, —В–Њ–≥–і–∞ –Ї–∞–Ї –≥–Є–њ–µ—А–µ–Љ–Є—П – —А–µ–Ј—Г–ї—М—В–∞—В –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П –≤–∞–Ј–Њ–∞–Ї—В–Є–≤–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ –≥–µ–љ–—Б–≤—П–Ј–∞–љ–љ–Њ–≥–Њ –њ–µ–њ—В–Є–і–∞ (CGRP) [12], –Є, –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, —Б —Б—Г–±—Б—В–∞–љ—Ж–Є–µ–є –†) –Є–Ј –Ї–Њ–ї–ї–∞—В–µ—А–∞–ї—М–љ—Л—Е –∞–Ї—Б–Њ–љ–Њ–≤ [13]. –С–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –≤–∞–ґ–љ–Њ–µ –Љ–µ—Б—В–Њ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е —Д–Њ—А–Љ –Ї—А–∞–њ–Є–≤–љ–Є—Ж –Ј–∞–љ–Є–Љ–∞—О—В —Н–є–Ї–Њ–Ј–∞–љ–Њ–Є–і—Л, –Ї–Є–љ–Є–љ—Л –Є –і—А—Г–≥–Є–µ –Љ–µ–і–Є–∞—В–Њ—А—Л –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П [14].
–Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Є –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –≤—Л–і–µ–ї—П—О—В –Є–Љ–Љ—Г–љ–љ—Л–µ, –љ–µ–Є–Љ–Љ—Г–љ–љ—Л–µ –Є –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–µ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л [15]. –°—А–µ–і–Є –Є–Љ–Љ—Г–љ–Њ–Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж –≤—Л–і–µ–ї—П—О—В IgE––Љ–µ–і–Є–Є—А—Г–µ–Љ—Л–µ (–њ–Є—Й–µ–≤–∞—П, –∞—Н—А–Њ–∞–ї–ї–µ—А–≥–µ–љ—Л, –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–∞—П, –Є–љ—Б–µ–Ї—В–љ–∞—П), –Є–Љ–Љ—Г–љ–Њ–Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–µ (–≤–Є—А—Г—Б–љ–∞—П –Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П, –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–∞—П –∞–ї–ї–µ—А–≥–Є—П) –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л, –∞ —В–∞–Ї–ґ–µ —В–µ —Д–Њ—А–Љ—Л –Ї—А–∞–њ–Є–≤–љ–Є—Ж, –Ї–Њ—В–Њ—А—Л–µ –≤–Њ–Ј–љ–Є–Ї–∞—О—В –њ—А–Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е. –С–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –≤–∞–ґ–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –≤—Л–і–µ–ї–µ–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Њ—А–Љ –∞–љ–≥–Є–Њ–Њ—В–µ–Ї–∞, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л–Љ–Є (–Њ–±—Л—З–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –≤ —А–∞–Ј–і–µ–ї–µ –њ–µ—А–≤–Є—З–љ—Л—Е –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–Њ–≤) –Є –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ—Л–Љ–Є –і–µ—Д–Є—Ж–Є—В–∞–Љ–Є —Б–Є—Б—В–µ–Љ—Л –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ—В–і–µ–ї—М–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ —Д–Њ—А–Љ—Л –Ї—А–∞–њ–Є–≤–љ–Є—Ж, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –љ–Њ—Б–Є—В—М —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–µ —В–µ—З–µ–љ–Є–µ. –Я–Њ—Б–ї–µ–і–љ–Є–µ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л —Г–Ї—Г—Б–∞–Љ–Є –љ–∞—Б–µ–Ї–Њ–Љ—Л—Е, —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ–Љ –њ—А–Њ–і—Г–Ї—В–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –≤—Л—Б–Њ–Ї–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≥–Є—Б—В–∞–Љ–Є–љ–∞, –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л–Љ–Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є (–Э–Я–Т–Я) –Є —В.–і.
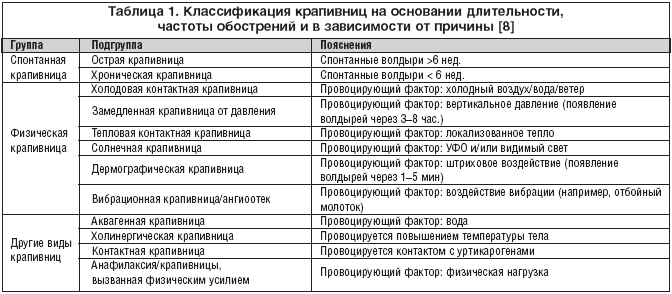
–Ф–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ—А–∞–Ї—В–Є—З–љ–Њ–є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ–∞—П –љ–∞ 2––є –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є —Б–Њ–≥–ї–∞—Б–Є—В–µ–ї—М–љ–Њ–є –Ї–Њ–љ—Д–µ—А–µ–љ—Ж–Є–Є –њ–Њ –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ [16], –Є –Њ—Б–љ–Њ–≤–∞–љ–љ–∞—П –љ–∞ –≤—Л–і–µ–ї–µ–љ–Є–Є —Б–њ–Њ–љ—В–∞–љ–љ—Л—Е, —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –Є –і—А—Г–≥–Є—Е –≤–Є–і–Њ–≤ –Ї—А–∞–њ–Є–≤–љ–Є—Ж (—В–∞–±–ї. 1).
–Я—А–Є—З–Є–љ—Л –Њ—Б—В—А–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Г –і–µ—В–µ–є —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л –Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–Њ–Ј—А–∞—Б—В–∞ –≤ –≥–µ–љ–µ–Ј–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ—А–µ–≤–∞–ї–Є—А—Г—О—В —А–∞–Ј–ї–Є—З–љ—Л–µ —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л. –°—Г—Й–µ—Б—В–≤—Г–µ—В –Љ–љ–µ–љ–Є–µ, —З—В–Њ —Г –і–µ—В–µ–є –њ–µ—А–≤—Л—Е 6 –Љ–µ—Б—П—Ж–µ–≤ –ґ–Є–Ј–љ–Є –Њ—Б—В—А–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –≤ –љ–∞—И–µ–є –Ї–ї–Є–љ–Є–Ї–µ –Є–Љ–µ–µ—В—Б—П —А—П–і –љ–∞–±–ї—О–і–µ–љ–Є–є –Ј–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є –њ–µ—А–≤—Л—Е –Љ–µ—Б—П—Ж–µ–≤ –ґ–Є–Ј–љ–Є, —Б—В—А–∞–і–∞–≤—И–Є—Е –Њ—Б—В—А—Л–Љ–Є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞–Љ–Є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–Љ–Є –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –њ–Є—Й–µ–≤–Њ–є –∞–ї–ї–µ—А–≥–Є–µ–є.
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Є–Љ–µ–љ–љ–Њ –њ–Є—Й–µ–≤–∞—П –∞–ї–ї–µ—А–≥–Є—П –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Њ–≤–Њ—Ж–Є—А—Г–µ—В –Њ—Б—В—А—Г—О –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Г —Г –і–µ—В–µ–є —А–∞–љ–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞. –Ґ–∞–Ї, —Г –і–µ—В–µ–є –њ–µ—А–≤—Л—Е –і–≤—Г—Е –ї–µ—В –ґ–Є–Ј–љ–Є –њ—А–Є—З–Є–љ–Њ–є –Њ—Б—В—А–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –≤ 75% —П–≤–ї—П–µ—В—Б—П –њ–Є—Й–µ–≤–∞—П –∞–ї–ї–µ—А–≥–Є—П [17]. –Т–∞–ґ–љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –≤ –Њ—Б–љ–Њ–≤–µ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –і–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Л –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –ї–µ–ґ–∞—В Ig–Х––Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ —Б—А–µ–і–Є –њ—А–Њ–і—Г–Ї—В–Њ–≤ –њ–Є—В–∞–љ–Є—П –њ—А–Є—З–Є–љ–Њ–є –Њ—Б—В—А–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —П–≤–ї—П—О—В—Б—П –Љ–Њ–ї–Њ–Ї–Њ, —А—Л–±–∞, –Ї—А–∞–±—Л, –±–Њ–±–Њ–≤—Л–µ, –Њ—А–µ—Е–Є –Є —П–є—Ж–∞. –†–∞–Ј–ї–Є—З–љ—Л–µ —Д—А—Г–Ї—В—Л –Є –Њ–≤–Њ—Й–Є –Љ–Њ–≥—Г—В —В–∞–Ї–ґ–µ —П–≤–ї—П—В—М—Б—П –њ—А–Є—З–Є–љ–Њ–є IgE––Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л.
–£ –і–µ—В–µ–є —Б—В–∞—А—И–µ –і–≤—Г—Е –ї–µ—В –љ–∞ –і–Њ–ї—О –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –њ—А–Є—Е–Њ–і–Є—В—Б—П –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ –њ–Њ–ї–Њ–≤–Є–љ–∞ –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л, –љ–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л – 5–10%, –љ–∞ –њ–Є—Й–µ–≤—Л–µ –њ—А–Њ–і—Г–Ї—В—Л – 2–10% [1,18,19]. –Ъ—А–∞–њ–Є–≤–љ–Є—Ж—Г –Љ–Њ–≥—Г—В –њ—А–Њ–≤–Њ—Ж–Є—А–Њ–≤–∞—В—М –≤–Є—А—Г—Б—Л (–≤–Є—А—Г—Б—Л –≥–µ–њ–∞—В–Є—В–Њ–≤ –Т –Є –°, –≤–Є—А—Г—Б –њ—А–Њ—Б—В–Њ–≥–Њ –≥–µ—А–њ–µ—Б–∞ I —В–Є–њ–∞, –¶–Ь–Т, –≤–Є—А—Г—Б—Л –Ъ–Њ–Ї—Б–∞–Ї–Є –Р –Є –Т). –С–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є —П–≤–ї—П—О—В—Б—П –њ—А–Є—З–Є–љ–Њ–є –Њ—Б—В—А–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–µ–ґ–µ, —З–µ–Љ –≤–Є—А—Г—Б–љ—Л–µ. –Х—Б–ї–Є –њ—А–Є—З–Є–љ–Њ–є –Њ—Б—В—А–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Б—В–∞–ї–∞ –Є–љ—Д–µ–Ї—Ж–Є—П, —В–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –Љ–Њ–ґ–µ—В –њ—А–Њ—В–µ–Ї–∞—В—М —Б –ї–Є—Е–Њ—А–∞–і–Ї–Њ–є, –±–Њ–ї—М—О –≤ –≥–Њ—А–ї–µ, –Ї–∞—И–ї–µ–Љ, –і–Є–Ј—Г—А–Є–µ–є, –±–Њ–ї—П–Љ–Є –≤ –ґ–Є–≤–Њ—В–µ. –У–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В –Є –∞—А—В—А–∞–ї–≥–Є–Є –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П –њ—А–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–Љ –≥–µ–љ–µ–Ј–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Я–Њ –і–∞–љ–љ—Л–Љ –љ–∞—И–µ–є –Ї–ї–Є–љ–Є–Ї–Є, —Г –і–µ—В–µ–є –Љ–ї–∞–і—И–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —З–∞—Б—В–Њ –≤—Л—П–≤–ї—П–µ—В—Б—П –Є–µ—А—Б–Є–љ–Є–Њ–Ј–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П. –≠—Д—Д–µ–Ї—В–Є–≤–љ–∞—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є—П –≤ —Б–ї—Г—З–∞–µ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –њ—А–Є–≤–Њ–і–Є—В –Ї –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—О —Г—А—В–Є–Ї–∞—А–љ–Њ–є —Б—Л–њ–Є [1].
–†—П–і –њ–Є—Й–µ–≤—Л—Е –і–Њ–±–∞–≤–Њ–Ї —Б–њ–Њ—Б–Њ–±–µ–љ –≤—Л–Ј—Л–≤–∞—В—М Ig–Х––Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л–µ (–љ–∞–њ—А–Є–Љ–µ—А, —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–µ –Љ–∞—Б–ї–∞, –ї–µ—Ж–Є—В–Є–љ, –±–µ–ї–Ї–Њ–≤—Л–µ –∞—А–Њ–Љ–∞—В–Є–Ј–∞—В–Њ—А—Л, –ґ–µ–ї–∞—В–Є–љ, –≥–Є–і—А–Њ–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–µ –±–µ–ї–Ї–Є) –Є –љ–µ–Ig–Х––Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л–µ (–љ–∞–њ—А–Є–Љ–µ—А, —Б—Г–ї—М—Д–Є—В—Л, —В–∞—А—В—А–∞–Ј–Є–љ, –±–µ–љ–Ј–Њ–∞—В—Л) —А–µ–∞–Ї—Ж–Є–Є. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ–і—Г–Ї—В—Л (–љ–∞–њ—А–Є–Љ–µ—А, –∞–љ–∞–љ–∞—Б, –≤—Л–і–µ—А–ґ–∞–љ–љ—Л–µ —Б—Л—А—Л, —А—Л–±–∞), —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –≥–Є—Б—В–∞–Љ–Є–љ –Є–ї–Є –і—А—Г–≥–Є–µ –≤–∞–Ј–Њ–∞–Ї—В–Є–≤–љ—Л–µ –∞–Љ–Є–љ—Л –Љ–Њ–≥—Г—В –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —А—П–і –њ—А–Њ–і—Г–Ї—В–Њ–≤ (–Ї–ї—Г–±–љ–Є–Ї–∞, –њ–Њ–Љ–Є–і–Њ—А—Л –Є —В.–і.) –≤—Л–Ј—Л–≤–∞–µ—В –њ—А—П–Љ–Њ–µ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –≥–Є—Б—В–∞–Љ–Є–љ–∞ –Є–Ј —В—Г—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –±–µ–Ј —Г—З–∞—Б—В–Є—П IgE, —З—В–Њ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—О —Г—А—В–Є–Ї–∞—А–Є–є [20].
–Ю—Б—В—А–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–∞—П –∞—Н—А–Њ–∞–ї–ї–µ—А–≥–µ–љ–∞–Љ–Є (–њ—Л–ї—М—Ж–µ–≤—Л–Љ–Є, –±—Л—В–Њ–≤—Л–Љ–Є —Н–њ–Є–і–µ—А–Љ–∞–ї—М–љ—Л–Љ–Є), —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Г –і–µ—В–µ–є –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞. –Ґ–∞–Ї, –≤ —Б–ї—Г—З–∞–µ —Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є–Є –Ї –њ—Л–ї—М—Ж–µ –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –Њ–±—Л—З–љ–Њ –Є–Љ–µ–µ—В —Б–µ–Ј–Њ–љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А, –Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Б–Њ—З–µ—В–∞–µ—В—Б—П —Б –і—А—Г–≥–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –њ–Њ–ї–ї–Є–љ–Њ–Ј–∞. –Э–µ—А–µ–і–Ї–Њ –њ–∞—Ж–Є–µ–љ—В—Л –Њ—В–Љ–µ—З–∞—О—В –њ–Њ—П–≤–ї–µ–љ–Є–µ —Г—А—В–Є–Ї–∞—А–Є–є –њ—А–Є –њ—А–Є–µ–Љ–µ –њ—А–Њ–і—Г–Ї—В–Њ–≤, –Є–Љ–µ—О—Й–Є—Е –њ–µ—А–µ–Ї—А–µ—Б—В–љ—Г—О —А–µ–∞–Ї—Ж–Є—О –Ї –њ—Л–ї—М—Ж–µ (–љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–Є —П–±–ї–Њ–Ї –Є–ї–Є –Љ–Њ—А–Ї–Њ–≤–Є –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є–Є –Ї –њ—Л–ї—М—Ж–µ –±–µ—А–µ–Ј—Л).
–°—А–µ–і–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Њ—Б—В—А—Г—О –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Г –≤—Л–Ј—Л–≤–∞—О—В
β––ї–∞–Ї—В–∞–Љ–љ—Л–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є, —Б—Г–ї—М—Д–∞–љ–Є–ї–∞–Љ–Є–і—Л, –Э–Я–Т–Я, –њ–Њ–ї–Є–≤–Є—В–∞–Љ–Є–љ—Л –Є –њ—А–Њ—В–Є–≤–Њ—Б—Г–і–Њ—А–Њ–ґ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞.
–Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –Ї–Њ–љ—В–∞–Ї—В–љ–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л, –Ї–Њ—В–Њ—А–∞—П –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї–Њ–љ—В–∞–Ї—В–∞ –љ–µ–њ–Њ–≤—А–µ–ґ–і–µ–љ–љ–Њ–є –Ї–Њ–ґ–Є —Б –њ–Є—Й–µ–≤—Л–Љ–Є –њ—А–Њ–і—Г–Ї—В–∞–Љ–Є (–љ–∞–њ—А–Є–Љ–µ—А, –Ї–Њ—А–Њ–≤—М–µ –Љ–Њ–ї–Њ–Ї–Њ, —А—Л–±–∞) –Є–ї–Є —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ–Є —Б–Њ–µ–і–Є–љ–µ–љ–Є—П–Љ–Є.
–Ч–∞–њ–Њ–і–Њ–Ј—А–Є—В—М –њ—А–Є—З–Є–љ—Г –Њ—Б—В—А–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Г–і–∞–µ—В—Б—П –≤ 20–90% —Б–ї—Г—З–∞–µ–≤, –Њ–і–љ–∞–Ї–Њ –і–Њ–Ї–∞–Ј–∞—В—М –њ—А–Є—З–Є–љ–љ–Њ–—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Г—О —Б–≤—П–Ј—М –њ—А–Є –і–∞–љ–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є –±–Њ–ї–µ–Ј–љ–Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ—А–µ–∞–ї—М–љ–Њ.
IgE––Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Е–∞—А–∞–Ї—В–µ—А–љ—Л –і–ї—П –і–µ—В–µ–є —А–∞–љ–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, —Б—В—А–∞–і–∞—О—Й–Є—Е –њ–Є—Й–µ–≤–Њ–є –∞–ї–ї–µ—А–≥–Є–µ–є. –Я—А–Є—З–µ–Љ —Г –і–µ—В–µ–є –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ –ґ–Є–Ј–љ–Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ—А–Є—З–Є–љ–љ–Њ––Ј–љ–∞—З–Є–Љ–∞ —Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є—П –Ї –∞–ї–ї–µ—А–≥–µ–љ–∞–Љ –Ї–Њ—А–Њ–≤—М–µ–≥–Њ –Љ–Њ–ї–Њ–Ї–∞. –£ –±–Њ–ї–µ–µ —Б—В–∞—А—И–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—И–µ –≤—Л—П–≤–ї—П–µ—В—Б—П —Б–≤—П–Ј—М –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ—Л–Љ–Є, –∞ –љ–µ –њ–Є—Й–µ–≤—Л–Љ–Є –∞–ї–ї–µ—А–≥–µ–љ–∞–Љ–Є. –Я–Њ –љ–∞—И–Є–Љ –і–∞–љ–љ—Л–Љ, –њ—А–Є –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ —Г 78,6% –і–µ—В–µ–є –Њ—В–Љ–µ—З–∞—О—В—Б—П –∞–љ–≥–Є–Њ–Њ—В–µ–Ї–Є [21]. –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–µ. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Њ–љ–љ—Л—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є, –∞ —В–∞–Ї–ґ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ 2 –њ–Њ–Ї–Њ–ї–µ–љ–Є—П. –Я—А–Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П –Ї–Њ–љ—В–∞–Ї—В–Њ–≤ —Б –њ—А–Є—З–Є–љ–љ–Њ––Ј–љ–∞—З–Є–Љ—Л–Љ–Є –∞–ї–ї–µ—А–≥–µ–љ–∞–Љ–Є (–љ–∞–њ—А–Є–Љ–µ—А, —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–µ –∞–ї–ї–µ—А–≥–µ–љ—Л) –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л 2 –њ–Њ–Ї–Њ–ї–µ–љ–Є—П.
–°—А–µ–і–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —Г –і–µ—В–µ–є –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ–Є —П–≤–ї—П—О—В—Б—П —Е–Њ–ї–Њ–і–Њ–≤–∞—П [22,23] –Є –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л [8], –Њ–і–љ–∞–Ї–Њ –Љ–Њ–≥—Г—В –Є–Љ–µ—В—М –Љ–µ—Б—В–Њ –Є –і—А—Г–≥–Є–µ —Д–Њ—А–Љ—Л —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж.
–Э–∞ —Е–Њ–ї–Њ–і–Њ–≤—Г—О –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Г –њ—А–Є—Е–Њ–і–Є—В—Б—П –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ –Њ—В 2 –і–Њ 8% –≤—Б–µ—Е —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —Г –і–µ—В–µ–є [8,22]. –•–Њ–ї–Њ–і–Њ–≤–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –±—Л–ї–∞ –≤–њ–µ—А–≤—Л–µ –Њ–њ–Є—Б–∞–љ–∞ Bourdon H. –≤ 1866 –≥–Њ–і—Г [24]. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ —Е–Њ–ї–Њ–і–Њ–≤–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –њ–Њ—П–≤–ї—П–µ—В—Б—П —Г –Љ–Њ–ї–Њ–і—Л—Е –ї—О–і–µ–є –Є –њ–µ—А—Б–Є—Б—В–Є—А—Г–µ—В –≤ —В–µ—З–µ–љ–Є–µ 5–9 –ї–µ—В. –£ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –±–Њ–ї—М–љ—Л—Е –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ–Њ–є —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –Љ–Њ–ґ–µ—В —Б–Њ—Б—В–∞–≤–ї—П—В—М –Є –±–Њ–ї–µ–µ 30 –ї–µ—В [10]. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ —Д–Њ—А–Љ—Л —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –Њ—З–µ–љ—М –Љ–љ–Њ–≥–Њ–Њ–±—А–∞–Ј–љ—Л. –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В–Є –≤—Л–і–µ–ї—П—О—В –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ—Л–µ –Є —Б–µ–Љ–µ–є–љ—Л–µ (—З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ —А–µ–і–Ї–Є –Є –љ–∞—Б–ї–µ–і—Г—О—В—Б—П –∞—Г—В–Њ—Б–Њ–Љ–љ–Њ––і–Њ–Љ–Є–љ–∞–љ—В–љ–Њ) —Д–Њ—А–Љ—Л —Е–Њ–ї–Њ–і–Њ–≤—Л—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж. –Т—Л–і–µ–ї—П—О—В –њ–µ—А–≤–Є—З–љ—Л–µ –Є –≤—В–Њ—А–Є—З–љ—Л–µ, –љ–µ–Љ–µ–і–ї–µ–љ–љ—Л–µ –Є –Њ—В—Б—А–Њ—З–µ–љ–љ—Л–µ, –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–µ –Є —Б–Є—Б—В–µ–Љ–љ—Л–µ —Д–Њ—А–Љ—Л. –°—Г—Й–µ—Б—В–≤—Г–µ—В —А—П–і –Њ—Б–Њ–±—Л—Е —Д–Њ—А–Љ —Е–Њ–ї–Њ–і–Њ–≤—Л—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж (—Е–Њ–ї–Њ–і––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–∞—П –•–Ъ, –ї–Њ–Ї–∞–ї—М–љ–∞—П —Е–Њ–ї–Њ–і––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–∞—П —А–µ—Д–ї–µ–Ї—В–Њ—А–љ–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞, —Е–Њ–ї–Њ–і––Ј–∞–≤–Є—Б–Є–Љ—Л–є –і–µ—А–Љ–Њ–≥—А–∞—Д–Є–Ј–Љ), –Ї–Њ—В–Њ—А—Л–µ –Љ–∞–љ–Є—Д–µ—Б—В–Є—А—Г—О—В —В–Њ–ї—М–Ї–Њ –њ—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е –Є –њ—А–Њ—П–≤–ї—П—О—В—Б—П —Е–∞—А–∞–Ї—В–µ—А–љ—Л–Љ–Є –≤—Л—Б—Л–њ–∞–љ–Є—П. –С–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —Е–Њ–ї–Њ–і–Њ–≤—Л—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж –Њ—В–љ–Њ—Б—П—В –Ї –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–Љ –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ—Л–Љ [10,25]. –Ґ–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ Neittaanmaki H., 96% –Є–Ј 220 –±–Њ–ї—М–љ—Л—Е –Є–Љ–µ—О—В –Є–Љ–µ–љ–љ–Њ —Н—В—Г —Д–Њ—А–Љ—Г, —В–Њ–ї—М–Ї–Њ —Г 2 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–∞ –≤—В–Њ—А–Є—З–љ–∞—П –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ–∞—П —Е–Њ–ї–Њ–і–Њ–≤–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞, —Г 2 – —Е–Њ–ї–Њ–і––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–∞—П –•–Ъ, —Г 4 – –Њ—В—Б—А–Њ—З–µ–љ–љ–∞—П —Е–Њ–ї–Њ–і–Њ–≤–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞. –Э–∞–і–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Б—В–Њ–ї—М –Њ–±—К–µ–Љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г –і–µ—В–µ–є –љ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М.
–Т –і–µ—В—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ —Е–Њ–ї–Њ–і–Њ–≤–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –Љ–Њ–ґ–µ—В –≤–Њ–Ј–љ–Є–Ї–∞—В—М –њ–Њ—Б–ї–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Љ–Њ–љ–Њ–љ—Г–Ї–ї–µ–Њ–Ј–∞, –Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ–µ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є, –Ї—А–∞—Б–љ—Г—Е–Є. –Т 1981 –≥–Њ–і—Г Tyson [26] –Њ–њ–Є—Б–∞–ї —Е–Њ–ї–Њ–і–Њ–≤—Г—О –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Г, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –њ—А–Њ—П–≤–ї—П–≤—И—Г—О—Б—П –∞–љ–∞—Д–Є–ї–∞–Ї—Б–Є–µ–є, —А–∞–Ј–≤–Є–≤—И—Г—О—Б—П –њ–Њ—Б–ї–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Љ–Њ–љ–Њ–љ—Г–Ї–ї–µ–Њ–Ј–∞. –Ю–±—Л—З–љ–Њ —В–∞–Ї–Є–µ —Д–Њ—А–Љ—Л —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —В—А–∞–љ–Ј–Є—В–Њ—А–љ—Л –Є –њ—А–Њ–і–Њ–ї–ґ–∞—О—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ 6–12 –Љ–µ—Б—П—Ж–µ–≤. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Е–Њ–ї–Њ–і–Њ–≤–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –Љ–Њ–ґ–µ—В –≤–Њ–Ј–љ–Є–Ї–∞—В—М –Є –њ—А–Є —А—П–і–µ –і—А—Г–≥–Є—Е –Є–љ—Д–µ–Ї—Ж–Є–є (—Б–Є—Д–Є–ї–Є—Б [27], –≥–µ–њ–∞—В–Є—В—Л –Т [28] –Є –° [29], –Т–Ш–І [30], —В–Њ–Ї—Б–Њ–њ–ї–∞–Ј–Љ–Њ–Ј [31]). –Ю–і–љ–∞–Ї–Њ –њ—А–Є —Н—В–Є—Е –Є–љ—Д–µ–Ї—Ж–Є—П—Е –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –Њ–±—Л—З–љ–Њ –Њ–њ–Є—Б—Л–≤–∞—О—В—Б—П —Б–ї—Г—З–∞–Є —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Г –≤–Ј—А–Њ—Б–ї—Л—Е.
–£ –і–µ—В–µ–є —Б–ї—Г—З–∞–Є —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Ї—А–Є–Њ–≥–ї–Њ–±—Г–ї–Є–љ–µ–Љ–Є–є, —П–≤–ї—П—О—В—Б—П —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ —А–µ–і–Ї–Є–Љ–Є. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Е–Њ–ї–Њ–і–Њ–≤–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–∞ —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ —А–∞–љ–љ–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –Ј–∞–Ї–ї—О—З–∞—О—В—Б—П –≤ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–Є –Ј—Г–і–∞ –Є —Г—А—В–Є–Ї–∞—А–Є–є –≤ —В–µ—З–µ–љ–Є–µ –Љ–Є–љ—Г—В –њ–Њ—Б–ї–µ —Е–Њ–ї–Њ–і–Њ–≤–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Є–ї–Є —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ —Б–Њ–≥—А–µ–≤–∞–љ–Є—П –Њ—Е–ї–∞–ґ–і–µ–љ–љ–Њ–є –Ї–Њ–ґ–Є. –Ш—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ —Г—А—В–Є–Ї–∞—А–Є–є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —З–µ—А–µ–Ј 30–60 –Љ–Є–љ—Г—В –њ–Њ—Б–ї–µ —Б–Њ–≥—А–µ–≤–∞–љ–Є—П. –Я—А–Є –њ–Њ—А–∞–ґ–µ–љ–Є–Є –±–Њ–ї—М—И–Є—Е –њ–ї–Њ—Й–∞–і–µ–є –Љ–Њ–≥—Г—В —А–∞–Ј–≤–Є–≤–∞—В—М—Б—П –∞–љ–∞—Д–Є–ї–∞–Ї—В–Њ–Є–і–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є. –°–Є—Б—В–µ–Љ–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –њ—А–Є —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ –≤—Л—П–≤–ї—П—О—В—Б—П —Г —В—А–µ—В–Є –і–µ—В–µ–є [32]. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –Њ—В–µ–Ї–∞ –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е —В—А–µ—Е –Љ–Є–љ—Г—В –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —В–µ—Б—В–∞ —Б –Ї—Г–±–Є–Ї–Њ–Љ –ї—М–і–∞ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —В—П–ґ–µ–ї—Л—Е (–≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є —Б–Є—Б—В–µ–Љ–љ—Л—Е) —А–µ–∞–Ї—Ж–Є–є –љ–∞ —Е–Њ–ї–Њ–і –Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –і–ї—П —Н—В–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–Њ–±–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є–Њ–±—А–µ—В–∞—О—В –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—А–Њ–њ—А–Є—П—В–Є—П [33]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г –і–µ—В–µ–є –њ—А–Є –њ–Є—В–∞–љ–Є–Є —Е–Њ–ї–Њ–і–љ–Њ–є –њ–Є—Й–µ–є (–Љ–Њ—А–Њ–ґ–µ–љ–Њ–µ, –Њ—Е–ї–∞–ґ–і–µ–љ–љ—Л–µ —Д—А—Г–Ї—В—Л) –≤–Њ–Ј–Љ–Њ–ґ–љ—Л –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Њ—А–Њ—Д–∞—А–Є–љ–≥–µ–∞–ї—М–љ–Њ–≥–Њ –Њ—В–µ–Ї–∞ –Є –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л.
–•–Њ–ї–Њ–і––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–∞—П –•–Ъ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —В–Є–њ–Є—З–љ—Л–Љ–Є —В–Њ—З–µ—З–љ—Л–Љ–Є —Г—А—В–Є–Ї–∞—А–Є—П–Љ–Є, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–Љ–Є –њ—А–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–µ, –≤—Л–њ–Њ–ї–љ—П–µ–Љ–Њ–є –≤ —Г—Б–ї–Њ–≤–Є—П—Е —Е–Њ–ї–Њ–і–Њ–≤–Њ–є —Н–Ї—Б–њ–Њ–Ј–Є—Ж–Є–Є. –£ –і–µ—В–µ–є —Б —Е–Њ–ї–Њ–і––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є —А–µ—Д–ї–µ–Ї—В–Њ—А–љ–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є —В–Є–њ–Є—З–љ—Л–µ —В–Њ—З–µ—З–љ—Л–µ –≤—Л—Б—Л–њ–∞–љ–Є—П –≤–Њ–Ј–љ–Є–Ї–∞—О—В –≤–Њ–Ї—А—Г–≥ –Љ–µ—Б—В–∞, –њ–Њ–і–≤–µ—А–≥–љ—Г—В–Њ–≥–Њ –ї–Њ–Ї–∞–ї—М–љ–Њ–Љ—Г —Е–Њ–ї–Њ–і–Њ–≤–Њ–Љ—Г –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О. –•–Њ–ї–Њ–і––Ј–∞–≤–Є—Б–Є–Љ—Л–є –і–µ—А–Љ–Њ–≥—А–∞—Д–Є–Ј–Љ –њ–Њ—П–≤–ї—П–µ—В—Б—П –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є —Е–Њ–ї–Њ–і–∞ –Є –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –Ї–Њ–ґ—Г.
–Ф–Є–∞–≥–љ–Њ–Ј –Њ—Б–Њ–±—Л—Е (–∞—В–Є–њ–Є—З–љ—Л—Е) —Д–Њ—А–Љ —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –≤—Л—Б—В–∞–≤–ї—П–µ—В—Б—П –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –∞—В–Є–њ–Є—З–љ—Л–Љ–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ–Є —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є —В–µ—Б—В–∞ —Б –Ї—Г–±–Є–Ї–Њ–Љ –ї—М–і–∞ (–љ–∞–ї–Є—З–Є–µ —Г—А—В–Є–Ї–∞—А–Є–є –≤–љ–µ –Ј–Њ–љ—Л –ї–Њ–Ї–∞–ї—М–љ–Њ–≥–Њ –Њ—Е–ї–∞–ґ–і–µ–љ–Є—П), –∞ —В–∞–Ї–ґ–µ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ–Љ —Г—А—В–Є–Ї–∞—А–Є–є –њ—А–Є —Б–Є—Б—В–µ–Љ–љ–Њ–Љ –Њ—Е–ї–∞–ґ–і–µ–љ–Є–Є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–Љ—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ (–љ–∞–њ—А–Є–Љ–µ—А, —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ —Г–њ—А–∞–ґ–љ–µ–љ–Є—П).
Zip CM. et al. [34] –Њ–њ—А–µ–і–µ–ї–Є–ї–Є –Ї–ї—О—З–µ–≤—Л–µ —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ—Л–Љ–Є –Є –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є —Е–Њ–ї–Њ–і–Њ–≤—Л—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж. –Ф–ї—П –њ–Њ—Б–ї–µ–і–љ–Є—Е —Е–∞—А–∞–Ї—В–µ—А–љ—Л –ї–Є—Е–Њ—А–∞–і–Ї–∞, –Њ–Ј–љ–Њ–±, –∞—А—В—А–∞–ї–≥–Є—П, –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј, –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Н—А–Є—В–µ–Љ–∞—В–Њ–Ј–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Н–њ–Є–Ј–Њ–і—Л –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л—Е —Е–Њ–ї–Њ–і–Њ–≤—Л—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж –Њ–±—Л—З–љ–Њ –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ—Л –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є.
–Ґ–µ—А–∞–њ–Є—П —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –≤ —Б–Њ–±–ї—О–і–µ–љ–Є–Є —А—П–і–∞ –Њ–±—Й–µ–њ—А–Є–љ—П—В—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є: –љ–µ –Ї—Г–њ–∞—В—М—Б—П –≤ —Е–Њ–ї–Њ–і–љ–Њ–є –≤–Њ–і–µ; –њ–ї–∞–≤–∞–љ–Є–µ –і–∞–ґ–µ –≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —В–µ–њ–ї–Њ–є –≤–Њ–і–µ –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –Њ–≥—А–∞–љ–Є—З–µ–љ–Њ –≤–Њ –≤—А–µ–Љ–µ–љ–Є; —В–µ–њ–ї–∞—П –Њ–і–µ–ґ–і–∞ –≤ –Ј–Є–Љ–љ–µ–µ –≤—А–µ–Љ—П. –Ф–µ—В—П–Љ —Б —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є, –Њ—Б–Њ–±–µ–љ–љ–Њ —Б—В—А–∞–і–∞—О—Й–Є–Љ —В—П–ґ–µ–ї—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є, —А–∞–Ј—А–µ—И–µ–љ–Њ –Ї—Г–њ–∞—В—М—Б—П —В–Њ–ї—М–Ї–Њ –њ–Њ–і –њ—А–Є—Б–Љ–Њ—В—А–Њ–Љ –≤–Ј—А–Њ—Б–ї—Л—Е, –Њ–±—Г—З–µ–љ–љ—Л—Е –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–Љ—Г –≤–≤–µ–і–µ–љ–Є—О –∞–і—А–µ–љ–∞–ї–Є–љ–∞. –Э–µ —Б–ї–µ–і—Г–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Ї–∞–Ї —Б—А–µ–і—Б—В–≤–Њ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –њ–µ—А–µ–і –Ї—Г–њ–∞–љ–Є–µ–Љ. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—Б–Њ–Ї–∞ –Є –Њ–±—Л—З–љ–Њ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –≤ —Г–і–ї–Є–љ–µ–љ–Є–Є –≤—А–µ–Љ–µ–љ–Є —Е–Њ–ї–Њ–і–Њ–≤–Њ–є —Н–Ї—Б–њ–Њ–Ј–Є—Ж–Є–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –і–ї—П –Є–љ–і—Г–Ї—Ж–Є–Є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л.
–†–µ–≥—Г–ї—П—А–љ–Њ–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є –љ–µ—Б–Є—Б—В–µ–Љ–љ–Њ–є —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ–µ—А–µ–і –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Е–Њ–ї–Њ–і–Њ–≤–Њ–є —Н–Ї—Б–њ–Њ–Ј–Є—Ж–Є–µ–є. –£ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –і–µ—В–µ–є —Б —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ 2 –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ. –Ю–і–љ–∞–Ї–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –±–Њ–ї—М–љ—Л–µ —Б —В—П–ґ–µ–ї–Њ–є —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –љ–µ –Њ—В–≤–µ—З–∞—О—В –љ–∞ —В–µ—А–∞–њ–Є—О –і–∞–ґ–µ –≤—Л—Б–Њ–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [35].
–Т —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Є —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ, –≤–Њ–Ј–љ–Є–Ї—И–µ–є –љ–∞ —Д–Њ–љ–µ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –Є–ї–Є –≥—А–Є–±–Ї–Њ–≤–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є, —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –Є–ї–Є –њ—А–Њ—В–Є–≤–Њ–≥—А–Є–±–Ї–Њ–≤—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л [36].
–Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –∞–љ–∞—Д–Є–ї–∞–Ї—В–Њ–Є–і–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є –љ–∞ —Е–Њ–ї–Њ–і –љ–µ –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—О—В—Б—П –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –Ъ–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і—Л –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –≤ –ї–µ—З–µ–љ–Є–Є —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л. –Т–Њ–Ј–Љ–Њ–ґ–љ—Л —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л —А–∞–Ј–≤–Є—В–Є—П —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї —Е–Њ–ї–Њ–і–Њ–≤–Њ–є –љ–∞–≥—А—Г–Ј–Ї–µ.
–Ф–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ – –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–∞—П —Д–Њ—А–Љ–∞ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –Њ–љ–∞ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П —Г 2–5% –љ–∞—Б–µ–ї–µ–љ–Є—П, –њ—А–Є —Н—В–Њ–Љ, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –±–Њ–ї—М—И–Є–љ—Б—В–≤—Г –Њ–љ–∞ –љ–µ –њ—А–Є–љ–Њ—Б–Є—В –Ї–∞–Ї–Є—Е––ї–Є–±–Њ –љ–µ—Г–і–Њ–±—Б—В–≤, –Є –ї–µ—З–µ–љ–Є–µ –љ–µ —В—А–µ–±—Г–µ—В—Б—П. –Э–∞ –і–Њ–ї—О –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –њ—А–Є—Е–Њ–і–Є—В—Б—П 7–13% —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж. –Ф–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –≤ –≤–Є–і–µ –Ј—Г–і–∞ –Є —Б—Л–њ–Є –њ–Њ —Е–Њ–і—Г —А–∞—Б—З–µ—Б–Њ–≤. –§–µ–љ–Њ–Љ–µ–љ –і–µ—А–Љ–Њ–≥—А–∞—Д–Є–Ј–Љ–∞ –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–Њ–і—П—В –њ—А–Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–Љ —И—В—А–Є—Е–Њ–≤–Њ–Љ —А–∞–Ј–і—А–∞–ґ–µ–љ–Є–Є –Ї–Њ–ґ–Є –ї–Є–љ–µ–є–љ—Л–Љ –њ—А–µ–і–Љ–µ—В–Њ–Љ. –Я–∞—В–Њ–≥–µ–љ–µ–Ј –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Б–≤—П–Ј–∞–љ —Б –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ–Љ –≥–Є—Б—В–∞–Љ–Є–љ–∞ —В—Г—З–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є. –Ь–µ–ґ–і—Г —В–µ–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ, –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –Ї–Њ—В–Њ—А–Њ–≥–Њ –Њ–љ–Є –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞—О—В –≥–Є—Б—В–∞–Љ–Є–љ –њ—А–Є –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ —И—В—А–Є—Е–Њ–≤–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є, –љ–µ—П—Б–µ–љ. –°—З–Є—В–∞–µ—В—Б—П (–Є –Љ—Л –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–µ–Љ —Н—В—Г —В–Њ—З–Ї—Г –Ј—А–µ–љ–Є—П), —З—В–Њ –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г—Б–Є–ї–Є–≤–∞–µ—В—Б—П –њ—А–Є –њ—Б–Є—Е–Њ—Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–Љ —Б—В—А–µ—Б—Б–µ [37]. –Ю–і–љ–∞–Ї–Њ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ–µ –Љ–љ–µ–љ–Є–µ, –Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–µ –љ–∞ –Њ—Ж–µ–љ–Ї–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–≥–Њ —В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є—П (–Њ—Б—В—А—Л–є –њ—Б–Є—Е–Њ—Б–Њ—Ж–Є–∞–ї—М–љ—Л–є —Б—В—А–µ—Б—Б) [38]. –Э–∞ –љ–∞—И –≤–Ј–≥–ї—П–і, —В–∞–Ї–Њ–є –њ–Њ–і—Е–Њ–і –љ–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —А–µ–∞–ї—М–љ–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є –Є –љ–µ –Љ–Њ–ґ–µ—В —П–≤–ї—П—В—М—Б—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–Њ–Љ –Њ—В—Б—Г—В—Б—В–≤–Є—П –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г —Б—В—А–µ—Б—Б–Њ–Љ –Є –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є. –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—В 2 –і–Њ 3 –ї–µ—В. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –≤–∞—А–Є–∞–±–µ–ї—М–љ–Њ—Б—В—М —В–µ—З–µ–љ–Є—П –≤—В–Њ—А–Є—З–љ–Њ–є –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —П–≤–ї—П–µ—В—Б—П —Б–ї–µ–і—Б—В–≤–Є–µ–Љ –љ–∞–ї–Є—З–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е —Н—В–Є–Њ–њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ [39].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –Љ–Њ–ґ–љ–Њ –≤—Л–і–µ–ї–Є—В—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Д–Њ—А–Љ –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л: —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Л–є –і–µ—А–Љ–Њ–≥—А–∞—Д–Є–Ј–Љ, –Ї—А–∞—Б–љ—Л–є –і–µ—А–Љ–Њ–≥—А–∞—Д–Є–Ј–Љ, –±–µ–ї—Л–є –і–µ—А–Љ–Њ–≥—А–∞—Д–Є–Ј–Љ, —Е–Њ–ї–Њ–і––Ј–∞–≤–Є—Б–Є–Љ—Л–є –і–µ—А–Љ–Њ–≥—А–∞—Д–Є–Ј–Љ. –Ф–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ —Г—А—В–Є–Ї–∞—А–Є–Є –Љ–Њ–≥—Г—В –њ–Њ—П–≤–ї—П—В—М—Б—П –≤—Б—О–і—Г, –Њ–і–љ–∞–Ї–Њ —А–µ–ґ–µ –≤—Б—В—А–µ—З–∞—О—В—Б—П –љ–∞ –ї–Є—Ж–µ –Є –Ї–Њ–љ–µ—З–љ–Њ—Б—В—П—Е.
–Ь–Њ–ґ–љ–Њ –≤—Л–і–µ–ї–Є—В—М –њ–µ—А–≤–Є—З–љ—Л–µ –Є –≤—В–Њ—А–Є—З–љ—Л–µ —Д–Њ—А–Љ—Л –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л. –Я–µ—А–≤–Є—З–љ—Л–µ —Д–Њ—А–Љ—Л –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –Љ–Њ–ґ–љ–Њ —А–∞–Ј–і–µ–ї–Є—В—М –љ–∞ «–∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–µ» –Є –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–µ. –Т—В–Њ—А–Є—З–љ—Л–µ —Б–≤—П–Ј–∞–љ—Л —Б —А—П–і–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (–Љ–∞—Б—В–Њ—Ж–Є—В–Њ–Ј, –≤–Є—А—Г—Б–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П, —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–∞—П –±–Њ–ї–µ–Ј–љ—М). –Т–µ—А–Њ—П—В–љ–Њ, —Б—Г—Й–µ—Б—В–≤—Г—О—В —Б–µ–Љ–µ–є–љ—Л–µ —Д–Њ—А–Љ—Л –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л (–∞—Г—В–Њ—Б–Њ–Љ–љ–Њ––і–Њ–Љ–Є–љ–∞–љ—В–љ—Л–є —В–Є–њ –љ–∞—Б–ї–µ–і–Њ–≤–∞–љ–Є—П) [40].
–С–Њ–ї—М–љ—Л–Љ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –Є–Ј–±–µ–≥–∞—В—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ї–Њ–љ—В–∞–Ї—В–∞ –Ї–Њ–ґ–Є —Б —И–µ—А—Б—В—П–љ—Л–Љ–Є –≤–µ—Й–∞–Љ–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –ґ–µ–ї–∞—В–µ–ї—М–љ–Њ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—В—М –њ—А–Њ—Е–ї–∞–і–љ—Г—О —В–µ–Љ–њ–µ—А–∞—В—Г—А—Г –≤ –њ–Њ–Љ–µ—Й–µ–љ–Є–Є –≤–Њ –≤—А–µ–Љ—П —Б–љ–∞. –Ы–µ–≥–Ї–Є–µ —Д–Њ—А–Љ—Л –і–µ—А–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –≤ —В–µ—А–∞–њ–Є–Є –љ–µ –љ—Г–ґ–і–∞—О—В—Б—П. –Т —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–≥–Њ –≤–µ—З–µ—А–љ–µ–≥–Њ –њ—А–Є–µ–Љ–∞ –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В—Л –≤ –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –і–Њ–Ј–Є—А–Њ–≤–Ї–∞—Е. –Т—А–µ–Љ—П –Є —З–∞—Б—В–Њ—В–∞ –њ—А–Є–µ–Љ–∞ –і–Њ–ї–ґ–љ—Л –±—Л—В—М —Б–≤—П–Ј–∞–љ—Л —Б —Б—Г—В–Њ—З–љ–Њ–є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М—О —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤.
–Т—Л–і–µ–ї—П—О—В –і–≤–µ —Д–Њ—А–Љ—Л –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л, –≤—Л–Ј—Л–≤–∞–µ–Љ–Њ–є —Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ –і–∞–≤–ї–µ–љ–Є–µ–Љ: –љ–µ–Љ–µ–і–ї–µ–љ–љ—Г—О –Є –Њ—В—Б—А–Њ—З–µ–љ–љ—Г—О. –Э–µ–Љ–µ–і–ї–µ–љ–љ–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤ —В–µ—З–µ–љ–Є–µ –Љ–Є–љ—Г—В –њ–Њ—Б–ї–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П (–ї—П–Љ–Ї–Є –Њ—В —А—О–Ї–Ј–∞–Ї–∞, –љ–Њ—И–µ–љ–Є–µ —В—П–ґ–µ–ї—Л—Е –њ—А–µ–і–Љ–µ—В–Њ–≤). –Ю—В—Б—А–Њ—З–µ–љ–љ–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞, –≤—Л–Ј—Л–≤–∞–µ–Љ–∞—П —Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ –і–∞–≤–ї–µ–љ–Є–µ–Љ, –≤–Њ–Ј–љ–Є–Ї–∞–µ—В —З–µ—А–µ–Ј 3–8 —З–∞—Б–Њ–≤ –њ–Њ—Б–ї–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П. –Ю—В–ї–Є—З–Є—В–µ–ї—М–љ–Њ–є —З–µ—А—В–Њ–є –і–∞–љ–љ–Њ–≥–Њ –≤–Є–і–∞ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —П–≤–ї—П–µ—В—Б—П –≥–ї—Г–±–Њ–Ї–Є–є, –ї–Њ–Ї–∞–ї—М–љ—Л–є, –±–Њ–ї–µ–Ј–љ–µ–љ–љ—Л–є –Њ—В–µ–Ї, –Ї–Њ—В–Њ—А—Л–є –Љ–Њ–ґ–µ—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М—Б—П –ї–Є—Е–Њ—А–∞–і–Ї–Њ–є, —Б–ї–∞–±–Њ—Б—В—М—О, –≥–Њ–ї–Њ–≤–љ–Њ–є –±–Њ–ї—М—О. –Я–Њ—А–∞–ґ–∞—О—В—Б—П –Њ–±—Л—З–љ–Њ –ї–∞–і–Њ–љ–Є, –њ–Њ–і–Њ—И–≤—Л, —П–≥–Њ–і–Є—Ж—Л, –њ–ї–µ—З–Є. –Ю—З–∞–≥–Є –Є—Б—З–µ–Ј–∞—О—В —З–µ—А–µ–Ј —Б—Г—В–Ї–Є. –У–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є —Н—В–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –≤–Ї–ї—О—З–∞—О—В –≤ —Б–µ–±—П –љ–µ–є—В—А–Њ—Д–Є–ї—М–љ—Г—О –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є—О –љ–Є–ґ–љ–Є—Е —Б–ї–Њ–µ–≤ –і–µ—А–Љ—Л –Є –њ–Њ–і–Ї–Њ–ґ–љ—Л—Е —В–Ї–∞–љ–µ–є.
–°–Є—Б—В–µ–Љ–љ—Л–µ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і—Л —П–≤–ї—П—О—В—Б—П —Б—А–µ–і—Б—В–≤–Њ–Љ –≤—Л–±–Њ—А–∞ –њ—А–Є –Њ—В—Б—А–Њ—З–µ–љ–љ–Њ–є —Д–Њ—А–Љ–µ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л. –Ю–і–љ–∞–Ї–Њ —Н—В—Г —В–µ—А–∞–њ–Є—О —Б–ї–µ–і—Г–µ—В –њ—А–Є–Љ–µ–љ—П—В—М —В–Њ–ї—М–Ї–Њ –≤ –Њ—В–і–µ–ї—М–љ—Л—Е —Б–ї—Г—З–∞—П—Е. –≠—Д—Д–µ–Ї—В –Њ—В —В–µ—А–∞–њ–Є–Є –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –љ–µ—Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї–µ–љ [39].
–£ –≤–Ј—А–Њ—Б–ї—Л—Е –±–Њ–ї—М–љ—Л—Е —Б –Њ—В—Б—А–Њ—З–µ–љ–љ–Њ–є, –≤—Л–Ј—Л–≤–∞–µ–Љ–Њ–є —Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ –і–∞–≤–ї–µ–љ–Є–µ–Љ, –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –ї–µ—З–µ–љ–Є–µ –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–Њ–Љ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї —Г—Б—В–Њ–є—З–Є–≤–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є [41]. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –і–∞–љ–љ—Л—Е –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ —Г –і–µ—В–µ–є –љ–µ—В.
–Ъ—А–∞–њ–Є–≤–љ–Є—Ж–∞, —Б–≤—П–Ј–∞–љ–љ–∞—П —Б –≤–Є–±—А–∞—Ж–Є–µ–є, —З–∞—Б—В–Њ –љ–∞—Б–ї–µ–і—Г–µ—В—Б—П –њ–Њ –∞—Г—В–Њ—Б–Њ–Љ–љ–Њ––і–Њ–Љ–Є–љ–∞–љ—В–љ–Њ–Љ—Г —В–Є–њ—Г. –£ –і–µ—В–µ–є –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ—В—Б—П –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ —А–µ–і–Ї–Њ. –Ю–±—Л—З–љ–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Є —В–µ—З–µ–љ–Є–µ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—В –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –≤–Є–±—А–∞—Ж–Є–Є. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –і–∞–љ–љ–∞—П —Д–Њ—А–Љ–∞ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –Љ–∞–љ–Є—Д–µ—Б—В–Є—А—Г–µ—В —З–µ—А–µ–Ј 4–6 —З–∞—Б–Њ–≤ –њ–Њ—Б–ї–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–≥–Њ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П. –С–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ—Б—В—М –Є –Ј—Г–і —Б–Њ—Е—А–∞–љ—П—О—В—Б—П –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є —Б—Г—В–Њ–Ї. –Ю—В—Б—А–Њ—З–µ–љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Б–≤—П–Ј–∞–љ —Б –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–µ–є –і–µ—А–Љ—Л –љ–µ–є—В—А–Њ—Д–Є–ї–∞–Љ–Є, —Н–Њ–Ј–Є–љ–Њ—Д–Є–ї–∞–Љ–Є –Є –Љ–Њ–љ–Њ–љ—Г–Ї–ї–µ–∞—А–∞–Љ–Є. –Т–Њ–Ј–Љ–Њ–ґ–љ–∞ –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М. –≠—Д—Д–µ–Ї—В –Њ—В –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –Э1–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤–∞—А–Є–∞–±–Є–ї–µ–љ. –Т–Њ–Ј–Љ–Њ–ґ–љ–∞ –Є–љ–і—Г–Ї—Ж–Є—П —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—Г—В–µ–Љ –µ–ґ–µ–і–љ–µ–≤–љ–Њ–≥–Њ –≤–Є–±—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П [42].
–•–Њ–ї–Є–љ–µ—А–≥–Є—З–µ—Б–Ї—Г—О –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Г –Њ—В–љ–Њ—Б—П—В –Ї –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ —Д–Њ—А–Љ–∞–Љ —В–µ–њ–ї–Њ–≤—Л—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж. –Ю–і–љ–∞–Ї–Њ –≤ –љ–Њ–≤–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є [43] –•–Ъ, —Б —Г—З–µ—В–Њ–Љ –µ–µ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞, –Њ—В–љ–Њ—Б—П—В –Ї –Њ—Б–Њ–±—Л–Љ —Д–Њ—А–Љ–∞–Љ –Ї—А–∞–њ–Є–≤–љ–Є—Ж. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –•–Ъ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—В 2–7% —Б—А–µ–і–Є –≤—Б–µ—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –•–Ъ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ–Њ–≥–Њ. –Ґ–∞–Ї, —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є, –Њ—Ж–µ–љ–Є–≤–∞–µ–Љ–Њ–µ –њ–Њ –Є–љ–і–µ–Ї—Б—Г –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –і–µ—А–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є (DLQI), –њ—А–Є –•–Ъ –≤—Л—А–∞–ґ–µ–љ–Њ –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, —З–µ–Љ —Г –±–Њ–ї—М–љ—Л—Е —Б –њ—Б–Њ—А–Є–∞–Ј–Њ–Љ, –∞–Ї–љ–µ, –≤–Є—В–Є–ї–Є–≥–Њ [44].
–•–Ъ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤ –Њ—В–≤–µ—В –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л, —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–Є–µ –Љ—Г—Б–Ї–∞—А–Є–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л – —Д–Є–Ј–Є—З–µ—Б–Ї—Г—О –љ–∞–≥—А—Г–Ј–Ї—Г, —В–µ–њ–ї–Њ, —Е–Њ–ї–Њ–і, –њ–Њ—В –Є —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є —Б—В—А–µ—Б—Б [45]. –Т –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –і–Њ–Ї–∞–Ј–∞–љ–∞ —А–Њ–ї—М —Е–Њ–ї–Є–љ—Н—А–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤. –Ґ–∞–Ї, –Њ–±—А–∞–±–Њ—В–Ї–∞ –љ–µ–±–Њ–ї—М—И–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞ –Ї–Њ–ґ–Є —А–∞—Б—В–≤–Њ—А–Њ–Љ –∞—В—А–Њ–њ–Є–љ–∞ –Љ–Њ–ґ–µ—В –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ —Г—А—В–Є–Ї–∞—А–Є–є. –Э–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –і–µ–є—Б—В–≤–Є–µ –њ–Њ—В–∞, –љ–∞–≤–µ—А–љ–Њ–µ, —В–∞–Ї–ґ–µ –љ–µ —П–≤–ї—П–µ—В—Б—П –њ—А–Є—З–Є–љ–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л, —В–∞–Ї –Ї–∞–Ї —Г –±–Њ–ї—М–љ—Л—Е, —Б—В—А–∞–і–∞—О—Й–Є—Е –∞–љ–≥–Є–і—А–Њ–Ј–Њ–Љ, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ–Њ—П–≤–ї–µ–љ–Є–µ –•–Ъ. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Adachi J. et al. (1994) –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –љ–∞–ї–Є—З–Є–µ —Г –±–Њ–ї—М–љ—Л—Е —Б –•–Ъ IgE––Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–є –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–Љ—Г –њ–Њ—В—Г [46]. –Т–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –і–∞–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є–≥—А–∞–µ—В –≥–Є—Б—В–∞–Љ–Є–љ. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–Є—Б—В–∞–Љ–Є–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –±–Њ–ї—М–љ—Л—Е –•–Ъ –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ—А–Њ–≤–Њ–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є –њ—А–Њ–±—Л [47,48]. –Я–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–Є—Б—В–∞–Љ–Є–љ–∞ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б —В—П–ґ–µ—Б—В—М—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є [48]. –•–Ъ —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Г –і–µ—В–µ–є —Б –∞—В–Њ–њ–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є. –Ґ–∞–Ї, –њ–Њ –љ–∞—И–Є–Љ –і–∞–љ–љ—Л–Љ, –Є–Ј 37 –і–µ—В–µ–є, —Б—В—А–∞–і–∞–≤—И–Є—Е –•–Ъ, —Г 14 –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –∞—В–Њ–њ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [49]. –Ю–њ–Є—Б–∞–љ—Л —Б–ї—Г—З–∞–Є –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л—Е –•–Ъ [50].
–•–Ъ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 10 –і–Њ 30 –ї–µ—В. –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –±–Њ–ї–µ–Ј–љ—М –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –ї–µ—В, –∞ –Ј–∞—В–µ–Љ —Б–Є–Љ–њ—В–Њ–Љ—Л —Г–Љ–µ–љ—М—И–∞—О—В—Б—П. –Ю–і–љ–∞–Ї–Њ –±—Л–≤–∞–µ—В –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –•–∞—А–∞–Ї—В–µ—А–љ–Њ–є —П–≤–ї—П–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ —Г—А—В–Є–Ї–∞—А–Є–є, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ—П–≤–ї—П—О—В—Б—П —З–µ—А–µ–Ј 10–20 –Љ–Є–љ—Г—В –њ–Њ—Б–ї–µ –њ–Њ–≤—Л—И–µ–љ–Є—П —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л —В–µ–ї–∞, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є —Д–Є–Ј–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞–≥—А—Г–Ј–Ї–∞–Љ–Є, —В–µ–њ–ї—Л–Љ –і—Г—И–µ–Љ —Б –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–µ–є –љ–∞ —И–µ–µ, –ї–Є—Ж–µ, —В—Г–ї–Њ–≤–Є—Й–µ –Є —В.–і. –Т—Л—Б—Л–њ–∞–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є —В–Њ—З–µ—З–љ—Л–µ —Г—А—В–Є–Ї–∞—А–Є–Є (2–3 –Љ–Љ) –Њ–Ї—А—Г–ґ–µ–љ–љ—Л–µ —И–Є—А–Њ–Ї–Њ–є –Ј–Њ–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–Є (2–4 —Б–Љ), –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —Б–ї–Є–≤–∞–љ–Є–µ –Њ–±–ї–∞—Б—В–µ–є –≥–Є–њ–µ—А–µ–Љ–Є–Є. –Э–∞—А—П–і—Г —Б —В–Є–њ–Є—З–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ–Њ–є –•–Ъ —Г –љ–µ–Ї–Њ—В–Њ—А—Л—Е –і–µ—В–µ–є –≤–Њ–Ј–љ–Є–Ї–∞—О—В —Б–ї–Є–≤–љ—Л–µ —Г—А—В–Є–Ї–∞—А–Є–Є —А–∞–Ј–Љ–µ—А–Њ–Љ –±–Њ–ї–µ–µ 1–2 —Б–Љ. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –•–Ъ, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–∞—П—Б—П –Є–љ—В–µ–љ—Б–Є–≤–љ—Л–Љ –Ј—Г–і–Њ–Љ, –Љ–Њ–ґ–µ—В –љ–Њ—Б–Є—В—М –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А. –Я—А–Є—З–µ–Љ –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —А–∞–Ј–≤–Є—В–Є–µ –∞–љ–≥–Є–Њ–Њ—В–µ–Ї–∞. –Ю–њ–Є—Б–∞–љ—Л —Б–Є—Б—В–µ–Љ–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л, –Ј–∞–Ї–ї—О—З–∞—О—Й–Є–µ—Б—П –≤ —А–∞–Ј–≤–Є—В–Є–Є –±—А–Њ–љ—Е–Њ—Б–њ–∞–Ј–Љ–∞, –≥–Њ–ї–Њ–≤–љ–Њ–є –±–Њ–ї–Є, –Њ–±–Љ–Њ—А–Њ–Ї–Њ–≤, —З—Г–≤—Б—В–≤–µ –і–Є—Б–Ї–Њ–Љ—Д–Њ—А—В–∞ –≤ –≥–Њ—А–ї–µ. –Ш—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ —В–µ—З–µ–љ–Є–µ 20–50 –Љ–Є–љ—Г—В –њ–Њ—Б–ї–µ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –љ–∞–≥—А—Г–Ј–Њ–Ї. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ —Г—Б–Є–ї–µ–љ–Є–µ –Є–ї–Є –њ–Њ—П–≤–ї–µ–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –њ—А–Є —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–Љ –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є–Є, —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–Є –њ—А–Њ–і—Г–Ї—В–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Б–њ–µ—Ж–Є–є, –Є–ї–Є –њ–Є—Й–Є, –Є–Љ–µ—О—Й–µ–є —Б–ї–∞–і–Ї–Є–є –≤–Ї—Г—Б. –°—Г—Й–µ—Б—В–≤—Г—О—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ —В—А—Г–і–љ–Њ—Б—В–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –і–∞–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Г –і–µ—В–µ–є —Б–Њ —Б–Љ—Г–≥–ї–Њ–є –Ї–Њ–ґ–µ–є. –Т —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е –≤–µ–і—Г—Й–Є–Љ–Є –≤ –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–µ –і–Є–∞–≥–љ–Њ–Ј–∞ –±—Г–і—Г—В —П–≤–ї—П—В—М—Б—П –ґ–∞–ї–Њ–±—Л –љ–∞ –Ї–Њ–ґ–љ—Л–є –Ј—Г–і, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–є –њ–Њ—Б–ї–µ —Г–њ—А–∞–ґ–љ–µ–љ–Є–є, —В–µ–њ–ї–Њ–≤–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є, —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є—П.
–° —Ж–µ–ї—М—О –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –•–Ъ –Є–Ј–±–µ–≥–∞—О—В —В—П–ґ–µ–ї—Л—Е —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –љ–∞–≥—А—Г–Ј–Њ–Ї, –±–∞–љ–Є –Є –і—А—Г–≥–Є—Е —В–µ–њ–ї–Њ–≤—Л—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–є. –Ы–µ—З–µ–љ–Є–µ —Е–Њ–ї–Є–љ–Њ–ї–Є—В–Є–Ї–∞–Љ–Є (–±–µ–ї–ї–Њ–Є–і, –±–µ–ї–ї–∞—В–∞–Љ–Є–љ–∞–ї) –Њ–±—Л—З–љ–Њ –љ–µ –њ—А–Є–љ–Њ—Б–Є—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞.
–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є –•–Ъ –љ–µ –≤—Б–µ–≥–і–∞ –і–Њ—Б—В–∞—В–Њ—З–љ–∞. –Я–∞—Ж–Є–µ–љ—В–∞–Љ —Б —В—П–ґ–µ–ї—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є, —Б –∞–љ–∞—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ–∞–Ї—Ж–Є—П–Љ–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –Њ–±—Г—З–µ–љ–Є–µ –∞—Г—В–Њ–Є–љ—К–µ–Ї—Ж–Є—П–Љ –∞–і—А–µ–љ–∞–ї–Є–љ–∞, –∞ —В–∞–Ї–ґ–µ –≤—Л–њ–Њ–ї–љ–µ–љ–Є–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –љ–∞–≥—А—Г–Ј–Њ–Ї —Б–Њ —Б—А–µ–і–љ–µ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М—О. –С—Л—Б—В—А–Њ–µ –Њ—Е–ї–∞–ґ–і–µ–љ–Є–µ (–≤–∞–љ–љ–∞, –і—Г—И) –Є–љ–Њ–≥–і–∞ –њ—А–µ–Ї—А–∞—Й–∞—О—В —А–∞–Ј–≤–Є—В–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є. –Ш–Љ–µ—О—В—Б—П —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ–± –Є–љ–і—Г–Ї—Ж–Є–Є —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –і–Њ–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –њ–Њ–≤—В–Њ—А–љ—Л–Љ–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞–≥—А—Г–Ј–Ї–∞–Љ–Є, –≤—Л–Ј—Л–≤–∞—О—Й–Є–Љ–Є –њ–Њ—В–Њ–Њ—В–і–µ–ї–µ–љ–Є–µ. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М —Б–Њ–Њ–±—Й–µ–љ–Є–µ –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є a–љ—В–Є–IgE –∞–љ—В–Є—В–µ–ї —Г 25––ї–µ—В–љ–µ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ —Б –•–Ъ, —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ–є –Ї —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є [51].
–І—А–µ–Ј–≤—Л—З–∞–є–љ–Њ —А–µ–і–Ї–Њ —Г –і–µ—В–µ–є –≤—Б—В—А–µ—З–∞—О—В—Б—П –і—А—Г–≥–Є–µ («–Њ—Б–Њ–±—Л–µ») —Д–Њ—А–Љ—Л –Ї—А–∞–њ–Є–≤–љ–Є—Ж: —Б–Њ–ї–љ–µ—З–љ–∞—П, –∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–∞—П –Є –∞–Ї–≤–∞–≥–µ–љ–љ–∞—П [52–54].
–Ъ—А–∞–њ–Є–≤–љ–Є—Ж–∞, —Б–≤—П–Ј–∞–љ–љ–∞—П —Б —Б–Њ–ї–љ–µ—З–љ—Л–Љ–Є –Є–љ—Б–Њ–ї—П—Ж–Є—П–Љ–Є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Н–њ–Є–Ј–Њ–і–∞–Љ–Є –Ј—Г–і–∞, —Н—А–Є—В–µ–Љ–Њ–є, –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—П—Е –њ–Њ–і–≤–µ—А–≥—И–Є—Е—Б—П –ї—Г—З–µ–≤–Њ–Љ—Г –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О –≤ —В–µ—З–µ–љ–Є–µ –Љ–Є–љ—Г—В. –Ч—Г–і –љ–∞—З–Є–љ–∞–µ—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е —Б–µ–Ї—Г–љ–і —Б–Њ–ї–љ–µ—З–љ–Њ–є —Н–Ї—Б–њ–Њ–Ј–Є—Ж–Є–Є, –Ј–∞—В–µ–Љ –≤ —В–µ—З–µ–љ–Є–µ 2–3 –Љ–Є–љ—Г—В –њ–Њ—П–≤–ї—П—О—В—Б—П –≥–Є–њ–µ—А–µ–Љ–Є—П, –Њ—В–µ–Ї. –Ъ—А–∞–њ–Є–≤–љ–Є—Ж–∞ –Є—Б—З–µ–Ј–∞–µ—В –≤ —В–µ—З–µ–љ–Є–µ 3–4 —З–∞—Б–Њ–≤, –Є –µ–µ —В—П–ґ–µ—Б—В—М –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Б—В–µ–њ–µ–љ—М—О –Є –≤—А–µ–Љ–µ–љ–µ–Љ —Н–Ї—Б–њ–Њ–Ј–Є—Ж–Є–Є —Б–Њ–ї–љ–µ—З–љ–Њ–≥–Њ –Њ–±–ї—Г—З–µ–љ–Є—П. –Р–Ї—Б–Њ–љ–—А–µ—Д–ї–µ–Ї—Б –≤—Л–Ј—Л–≤–∞–µ—В –њ–Њ–Ї—А–∞—Б–љ–µ–љ–Є–µ –≤–љ–µ –њ–Њ—А–∞–ґ–µ–љ–љ—Л—Е —Г—З–∞—Б—В–Ї–Њ–≤. –Х—Б–ї–Є –њ–ї–Њ—Й–∞–і—М –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–∞, —В–Њ –Љ–Њ–ґ–µ—В —А–∞–Ј–≤–Є—В—М—Б—П –∞–љ–∞—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–∞—П —А–µ–∞–Ї—Ж–Є—П. –У–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –Љ–Њ–ґ–µ—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М—Б—П –±—А–Њ–љ—Е–Њ—Б–њ–∞–Ј–Љ–Њ–Љ, –≥–Є–њ–Њ—В–µ–љ–Ј–Є–µ–є, –њ–Њ—В–µ—А–µ–є —Б–Њ–Ј–љ–∞–љ–Є—П. –†–µ–і–Ї–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л –Њ—В—Б—А–Њ—З–µ–љ–љ—Л–µ —Д–Њ—А–Љ—Л –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б–Њ–ї–љ–µ—З–љ–Њ–є –Є–љ—Б–Њ–ї—П—Ж–Є–µ–є (18–72 —З–∞—Б–∞).
–Я—А–Є –ї–µ—З–µ–љ–Є–Є —Б–Њ–ї–љ–µ—З–љ–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –≤—Л—П—Б–љ–µ–љ–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ —Д–Њ—В–Њ—Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–Є—А—Г—О—Й–µ–≥–Њ —Н—Д—Д–µ–Ї—В–∞, –Ї–Њ—В–Њ—А—Л–є –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ —Б —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –Є–Ј–≤–µ—Б—В–љ—Л —Б–ї—Г—З–∞–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —Б–Њ–ї–љ–µ—З–љ–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —В–µ—В—А–∞—Ж–Є–Ї–ї–Є–љ–∞ [55], —Е–ї–Њ—А–њ—А–Њ–Љ–∞–Ј–Є–љ–∞ [56].
–Я—А–Є –Є–љ—Б–Њ–ї—П—Ж–Є–Њ–љ–љ–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є–Ј–±–µ–≥–∞—В—М —Б–Њ–ї–љ–µ—З–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Ј–∞—Й–Є—В–љ—Л–µ –Ї—А–µ–Љ—Л –Є –љ–µ—Б–µ–і–∞—В–Є–≤–љ—Л–µ –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л. –Ь–µ—Б—В–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ. –Я—А–Є —В—П–ґ–µ–ї–Њ–є —Б–Њ–ї–љ–µ—З–љ–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ [57]. –§–Њ—В–Њ—В–µ—А–∞–њ–Є—П –≤ –і–µ—В—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –љ–µ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П.
–Р–Ї–≤–∞–≥–µ–љ–љ–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —В–Њ—З–µ—З–љ—Л–Љ–Є —Г—А—В–Є–Ї–∞—А–Є—П–Љ–Є, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–Љ–Є –њ—А–Є –Ї–Њ–љ—В–∞–Ї—В–µ —Б –≤–Њ–і–Њ–є –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –µ–µ —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –Є –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞. –Ф–∞–љ–љ–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –Љ–Њ–ґ–µ—В –љ–∞–±–ї—О–і–∞—В—М—Б—П –љ–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е —Г—З–∞—Б—В–Ї–∞—Е —В–µ–ї–∞. –Ю—Й—Г—Й–µ–љ–Є–µ –Ј—Г–і–∞ –Є–ї–Є –ґ–ґ–µ–љ–Є—П –Љ–Њ–ґ–µ—В –±—Л—В—М –љ–∞ –≤–Є–Ј—Г–∞–ї—М–љ–Њ –љ–µ –Є–Ј–Љ–µ–љ–µ–љ–љ—Л—Е —Г—З–∞—Б—В–Ї–∞—Е. –Я–∞—В–Њ–≥–µ–љ–µ–Ј —В–∞–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –љ–µ—П—Б–µ–љ. –Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –і–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Л –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л: –≤–Њ–і–љ—Л–є –Ї–Њ–Љ–њ—А–µ—Б—Б–µ —Б —В–µ–Љ–њ–µ—А–∞—В—Г—А–Њ–є –≤–Њ–і—Л 35°–° –≤ —В–µ—З–µ–љ–Є–µ 30 –Љ–Є–љ—Г—В. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –Є –∞–љ—В–Є—Е–Њ–ї–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞–µ—В —А–∞–Ј–≤–Є—В–Є–µ –∞–Ї–≤–∞–≥–µ–љ–љ–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л. –Ы–µ—З–µ–љ–Є–µ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –≥–Є—Б—В–∞–Љ–Є–љ–∞ –њ—А–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є –њ—А–Њ–≤–Њ–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є –њ—А–Њ–±–µ —Б –≤–Њ–і–Њ–є —Б—В–∞–≤–Є—В –њ–Њ–і —Б–Њ–Љ–љ–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є [58].
–Р–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –≤–њ–µ—А–≤—Л–µ –±—Л–ї–∞ –Њ–њ–Є—Б–∞–љ–∞ Shelley W.B., Shelley E.O. [59] –≤ 1985 –≥–Њ–і—Г. –≠—В–∞ —Д–Њ—А–Љ–∞ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –Љ–∞–љ–Є—Д–µ—Б—В–Є—А—Г–µ—В –≥–Є–њ–µ—А–µ–Љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –њ–∞–њ—Г–ї–∞–Љ–Є, –Њ–Ї—А—Г–ґ–µ–љ–љ—Л–Љ–Є –Ј–Њ–љ–Њ–є –±–Њ–ї–µ–µ —Б–≤–µ—В–ї–Њ–≥–Њ —Ж–≤–µ—В–∞, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–Љ–Є –њ—А–Є –њ—Б–Є—Е–Њ—Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–Љ —Б—В—А–µ—Б—Б–µ, –∞ —В–∞–Ї–ґ–µ –≤ –Њ—В–≤–µ—В –љ–∞ —Д–Є–Ј–Є—З–µ—Б–Ї—Г—О –љ–∞–≥—А—Г–Ј–Ї—Г. –Ф–Є–∞–≥–љ–Њ–Ј –∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –і–Њ–ї–ґ–µ–љ –Њ—Б–љ–Њ–≤—Л–≤–∞—В—М—Б—П –љ–∞ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–Є —Г—А—В–Є–Ї–∞—А–Є–є, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є—Е –њ–Њ—Б–ї–µ —Б—В—А–µ—Б—Б–∞, –Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞ –≤–љ—Г—В—А–Є–Ї–Њ–ґ–љ–Њ–≥–Њ —В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є—П —Б –∞–і—А–µ–љ–∞–ї–Є–љ–Њ–Љ. –Я–∞—В–Њ–≥–µ–љ–µ–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–≤—П–Ј–∞–љ —Б –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –≤ —Б–Є—Б—В–µ–Љ–µ –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–Њ–≤, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л [54].
–Ф–Њ–±–Є—В—М—Б—П —Г—Б—В—А–∞–љ–µ–љ–Є—П –њ—А–Њ–≤–Њ—Ж–Є—А—Г—О—Й–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –њ—А–Є –∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ. –Э–µ–Ї–Њ—В–Њ—А—Л–є –њ–Њ–Ј–Є—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –Њ—В–Љ–µ—З–∞–µ—В—Б—П –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –≤–µ–≥–µ—В–Њ—В—А–Њ–њ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Р–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Љ–∞–ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —В–µ—А–∞–њ–Є—П b––±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞–µ—В —А–∞–Ј–≤–Є—В–Є–µ —Г—А—В–Є–Ї–∞—А–Є–є –њ—А–Є –∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ [60].
–Я–∞—А–∞–Ј–Є—В–∞—А–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є –Љ–Њ–≥—Г—В –±—Л—В—М —Б–≤—П–Ј–∞–љ—Л —Б —Г—А—В–Є–Ї–∞—А–љ—Л–Љ–Є –≤—Л—Б—Л–њ–∞–љ–Є—П–Љ–Є, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –≤ —А–µ–≥–Є–Њ–љ–∞—Е —Б –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–є —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б–Є—В—Г–∞—Ж–Є–µ–є [61,62]. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–∞—А–∞–Ј–Є—В–∞—А–љ–Њ–є –Є–љ–≤–∞–Ј–Є–Є –љ–∞–і–Њ —Г—З–Є—В—Л–≤–∞—В—М, –≤ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –њ—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –і–µ—В–µ–є —Б –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л–Љ–Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є, —Н–Њ–Ј–Є–љ–Њ—Д–Є–ї–Є–µ–є –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є –Є –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –Њ–±—Й–µ–≥–Њ IgE.
–Ф–∞–љ–љ—Л—Е, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є—Е –Њ–± —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —А–Њ–ї–Є H. pylori –≤ –≥–µ–љ–µ–Ј–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —Г –і–µ—В–µ–є, –њ–Њ–Ї–∞ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ. –≠—А–∞–і–Є–Ї–∞—Ж–Є—П Helicobacter pylori —Г —З–∞—Б—В–Є –±–Њ–ї—М–љ—Л—Е –≤–µ–і–µ—В –Ї –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—О –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —Н—А–∞–і–Є–Ї–∞—Ж–Є—П Helicobacter pylori –і–∞–ї–µ–Ї–Њ –љ–µ –≤—Б–µ–≥–і–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —В–µ—А–∞–њ–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж [63]. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤ —Б–ї—Г—З–∞–µ –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≥–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –і–µ—В–µ–є —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –≤ –µ–і–Є–љ–Є—З–љ—Л—Е —Б–ї—Г—З–∞—П—Е –Њ—В–Љ–µ—З–∞–µ—В—Б—П –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ —Г—А—В–Є–Ї–∞—А–Є–є [1]. –Э–∞—И–Є –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П –≥–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є —Г –і–µ—В–µ–є —Б –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–Є–Љ —В–µ—З–µ–љ–Є–µ–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л.
–Т –≥–µ–љ–µ–Ј–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —Г –і–µ—В–µ–є, –≤–µ—А–Њ—П—В–љ–Њ, –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–µ –Љ–µ—Б—В–Њ –Ј–∞–љ–Є–Љ–∞—О—В –Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ —Д–Њ—А–Љ—Л. –Т–њ–µ—А–≤—Л–µ –љ–∞ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Б –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –Њ–±—А–∞—В–Є–ї–Є –≤–љ–Є–Љ–∞–љ–Є–µ Leznoff A, Sussman GL. [64]. –Ю–љ–Є —Г—Б—В–∞–љ–Њ–≤–Є–ї–Є, —З—В–Њ —Г 14% –Є–Ј 624 –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –≤—Л—П–≤–ї—П–ї–Є—Б—М –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л. –†–∞–Ј–ї–Є—З–љ—Л–µ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ–њ–Є—Б–∞–љ—Л —Г –і–µ—В–µ–є —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞–Љ–Є –Є –≤–Ї–ї—О—З–∞—О—В –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–є —В–Є—А–µ–Њ–Є–і–Є—В [65], —О–≤–µ–љ–Є–ї—М–љ—Л–є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –∞—А—В—А–Є—В [66], –Є–љ—Б—Г–ї–Є–љ––Ј–∞–≤–Є—Б–Є–Љ—Л–є —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В [66] –Є —Ж–µ–ї–Є–∞–Ї–Є—О [67]. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –Љ–Њ–ґ–µ—В –њ—А–µ–і—И–µ—Б—В–≤–Њ–≤–∞—В—М –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–Є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –і–µ—В—П–Љ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –і–Њ–ї–ґ–µ–љ –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ –ї—О–±—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є–ї–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є—Е –Ј–∞–њ–Њ–і–Њ–Ј—А–Є—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–µ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, —Б –і–∞–ї—М–љ–µ–є—И–µ–є –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Њ–є –њ–µ—А–µ–Њ—Ж–µ–љ–Ї–Њ–є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
–Ф–Є–∞–≥–љ–Њ–Ј –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞ –Є–љ—В—А–∞–і–µ—А–Љ–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –∞—Г—В–Њ—Б—Л–≤–Њ—А–Њ—В–Ї–Є. –Я—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є —В–µ—Б—В–∞ —Б –∞—Г—В–Њ—Б—Л–≤–Њ—А–Њ—В–Ї–Њ–є –≤–Њ–Ј–Љ–Њ–ґ–љ—Л –њ—А–Њ–±–ї–µ–Љ—Л —Б –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–Њ–і–Є–Љ–Њ—Б—В—М—О [68]. –Я–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ–Љ –њ—А–Є—Б—Г—В—Б—В–≤–Є—П anti–Fc
εRI –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї —П–≤–ї—П–µ—В—Б—П –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є–µ –≤—Л–±—А–Њ—Б–∞ –≥–Є—Б—В–∞–Љ–Є–љ–∞ –Є–Ј –±–∞–Ј–Њ—Д–Є–ї–Њ–≤ –Ј–і–Њ—А–Њ–≤—Л—Е –і–Њ–љ–Њ—А–Њ–≤, –Є–Љ–µ—О—Й–Є—Е –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ IgE. –Ф–∞–љ–љ—Л–є –Љ–µ—В–Њ–і –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ —Б–ї–Њ–ґ–µ–љ –і–ї—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є [69]. –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –±–∞–Ј–Њ—Д–Є–ї–Њ–≤ –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є —Б–љ–Є–ґ–µ–љ–Њ —Г –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є, –Є–Љ–µ—О—Й–Є—Е –≥–Є—Б—В–∞–Љ–Є–љ––≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞—О—Й–Є–µ –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞ [70,71]. –≠—В–Њ –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ –Љ–∞—А–Ї–µ—А–Њ–Љ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л.
–•—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–∞—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –њ–Њ–ї–Є–Љ–Њ—А—Д–љ—Г—О –≥—А—Г–њ–њ—Г –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Я—А–Є—З–µ–Љ –љ–∞–і–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ, –њ–Њ –љ–∞—И–Є–Љ –і–∞–љ–љ—Л–Љ, —Г —А—П–і–∞ –і–µ—В–µ–є —Б –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –њ—А–Є –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –љ–∞–±–ї—О–і–µ–љ–Є–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —А–∞–Ј–≤–Є—В–Є–µ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л [72]. –Ч—Г–і –Њ–±—Л—З–љ–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ –≤–µ—З–µ—А–Њ–Љ –Є –љ–Њ—З—М—О. –Т–µ—А–Њ—П—В–љ–Њ, —Г –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –і–Њ–ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –Ј–љ–∞—З–Є–Љ—Г—О —А–Њ–ї—М –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Є–≥—А–∞—О—В —А–∞–Ј–ї–Є—З–љ—Л–µ –њ–Є—Й–µ–≤—Л–µ –Є–љ–≥—А–µ–і–Є–µ–љ—В—Л, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –њ–Є—Й–µ–≤—Л–µ –і–Њ–±–∞–≤–Ї–Є –Є –≥–Є—Б—В–∞–Љ–Є–љ–Њ–ї–Є–±–µ—А–∞—В–Њ—А—Л. –Ґ–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ –љ–µ–Љ–µ—Ж–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є [4], —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Њ–љ–љ—Л–µ –і–Є–µ—В—Л, –Є—Б–Ї–ї—О—З–∞—О—Й–Є–µ –њ–Є—Й–µ–≤—Л–µ –і–Њ–±–∞–≤–Ї–Є, –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —В–µ—З–µ–љ–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж: —Г 73% –±–Њ–ї—М–љ—Л—Е –Њ—В–Љ–µ—З–∞–ї–∞—Б—М —Б—В–Њ–є–Ї–∞—П –і–ї–Є—В–µ–ї—М–љ–∞—П (–±–Њ–ї–µ–µ 6 –Љ–µ—Б) –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —А–µ–Љ–Є—Б—Б–Є—П, –љ–∞—З–Є–љ–∞–≤—И–∞—П—Б—П –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 3 –љ–µ–і–µ–ї—М –њ–Њ—Б–ї–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –і–Є–µ—В—Л. –°–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–µ—Б—П –њ–Њ–і—К–µ–Љ–Њ–Љ —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л, –њ–Њ—З—В–Є –љ–µ–Є–Ј–Љ–µ–љ–љ–Њ –≤—Л–Ј—Л–≤–∞—О—В –Њ–±–Њ—Б—В—А–µ–љ–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л.
–Ю—Б–љ–Њ–≤–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ї–∞–Ї –Њ—Б—В—А—Л—Е, —В–∞–Ї –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —П–≤–ї—П–µ—В—Б—П —Г—Б—В—А–∞–љ–µ–љ–Є–µ –њ—А–Є—З–Є–љ–љ–Њ––Ј–љ–∞—З–Є–Љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ (–∞–ї–ї–µ—А–≥–µ–љ—Л, –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ –Є —В.–і.). –Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –Є –Њ—Б–Њ–±—Л—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —Н—В–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –≤ —В–Њ–є –Є–ї–Є –Є–љ–Њ–є —Б—В–µ–њ–µ–љ–Є. –Ю–і–љ–∞–Ї–Њ, –љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є –∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ —Н—В–Њ–≥–Њ –і–Њ–±–Є—В—М—Б—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ. –Т —Б–ї—Г—З–∞–µ –њ–Њ–і–Њ–Ј—А–µ–љ–Є—П –љ–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Г—О –∞–ї–ї–µ—А–≥–Є—О –Є—Б–Ї–ї—О—З–∞–µ—В—Б—П –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ—Л–є –њ—А–Њ–≤–Њ—Ж–Є—А—Г—О—Й–Є–є –њ—А–µ–њ–∞—А–∞—В. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —А—П–і–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–љ–∞–њ—А–Є–Љ–µ—А, –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ–Њ–ї–Є–≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Є —В.–і.) —Г –і–µ—В–µ–є —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –і–Њ–ї–ґ–љ–Њ –Њ–њ—А–µ–і–µ–ї—П—В—М—Б—П –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б–Њ —Б—В—А–Њ–≥–Є–Љ–Є –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є.
–≠–ї–Є–Љ–Є–љ–∞—Ж–Є–Њ–љ–љ–∞—П –і–Є–µ—В–∞ —Г –і–µ—В–µ–є —Б –Њ—Б—В—А–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є —Б–Њ—Б—В–Њ–Є—В –≤ –Є—Б–Ї–ї—О—З–µ–љ–Є–Є –њ—А–Є—З–Є–љ–љ–Њ––Ј–љ–∞—З–Є–Љ—Л—Е –њ–Є—Й–µ–≤—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤, –≥–Є—Б—В–∞–Љ–Є–љ–Њ–ї–Є–±–µ—А–∞—В–Њ—А–Њ–≤ (—И–Њ–Ї–Њ–ї–∞–і, —Ж–Є—В—А—Г—Б–Њ–≤—Л–µ, —П–є—Ж–∞, —А—Л–±–∞, –Ї–Њ–љ—Б–µ—А–≤—Л, –Ї–Њ–љ—Б–µ—А–≤–∞–љ—В—Л) –Є –њ—А–Њ–і—Г–Ї—В–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –≤—Л—Б–Њ–Ї–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤–∞–Ј–Њ–∞–Ї—В–Є–≤–љ—Л—Е –∞–Љ–Є–љ–Њ–≤. –Я—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤—Л–Ј–≤–∞–≤—И–µ–≥–Њ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Г, –њ—А–Њ–≤–Њ–і–Є—В—Б—П –µ–≥–Њ —В–µ—А–∞–њ–Є—П.
–Я—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–є —П–≤–ї—П–µ—В—Б—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –њ–Њ–і–Њ–±—А–∞–љ–љ–∞—П –і–Є–µ—В–∞, —Д–Њ—А–Љ–Є—А—Г–µ–Љ–∞—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –∞–ї–ї–µ—А–≥–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –∞ —В–∞–Ї–ґ–µ —Б —Г—З–µ—В–Њ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П –њ—А–Њ–і—Г–Ї—В–Њ–≤, –Њ–±–ї–∞–і–∞—О—Й–Є—Е —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –Ї –Є–љ–і—Г–Ї—Ж–Є–Є –і–µ–≥—А–∞–љ—Г–ї—П—Ж–Є–Є —В—Г—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї. –Ґ–∞–Ї, –њ—А–Є –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Њ–є (IgE––Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–є) –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Л—П–≤–ї—П–µ—В—Б—П —Б–≤—П–Ј—М —Б –њ–Є—Й–µ–≤—Л–Љ–Є (—П–є—Ж–Њ, —А—Л–±–∞, –Љ–Њ–ї–Њ–Ї–Њ, –Њ—А–µ—Е–Є) –∞–ї–ї–µ—А–≥–µ–љ–∞–Љ–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г –і–µ—В–µ–є —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞–Љ–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Њ–љ–љ–Њ–є –і–Є–µ—В—Л —Б –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –њ—А–Њ–і—Г–Ї—В–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –њ–Є—Й–µ–≤—Л–µ –і–Њ–±–∞–≤–Ї–Є, –≥–Є—Б—В–∞–Љ–Є–љ–Њ–ї–Є–±–µ—А–∞—В–Њ—А—Л, –≤—Л—Б–Њ–Ї–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≥–Є—Б—В–∞–Љ–Є–љ–∞. –Ф–∞–љ–љ–∞—П –і–Є–µ—В–∞ –Њ—Б–Њ–±–µ–љ–љ–Њ –∞–Ї—В—Г–∞–ї—М–љ–∞ —Г –і–µ—В–µ–є —Б –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є –њ—Б–µ–≤–і–Њ–∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ–∞–Ї—Ж–Є—П–Љ–Є. –Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –Њ—В –і–Є–µ—В—Л —Б –љ–Є–Ј–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ «–њ—Б–µ–≤–і–Њ–∞–ї–ї–µ—А–≥–µ–љ–Њ–≤» –Љ–Њ–ґ–љ–Њ –Њ–ґ–Є–і–∞—В—М –љ–µ —А–∞–љ–µ–µ, —З–µ–Љ —З–µ—А–µ–Ј 14 –і–љ–µ–є –њ–Њ—Б–ї–µ –µ–µ –љ–∞—З–∞–ї–∞. –£ –і–µ—В–µ–є —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Њ–љ–љ–Њ–є –і–Є–µ—В—Л –і–Њ–ї–ґ–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П—В—М –љ–µ –Љ–µ–љ–µ–µ 3 –Љ–µ—Б—П—Ж–µ–≤ –Є –і–∞–ї–µ–µ –Њ–њ—А–µ–і–µ–ї—П—В—М—Б—П —Б —Г—З–µ—В–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –±–Њ–ї—М–љ—Л—Е. –Х—Б–ї–Є –≤ —В–µ—З–µ–љ–Є–µ —Н—В–Њ–≥–Њ —Б—А–Њ–Ї–∞ –љ–µ –≤—Л—П–≤–ї—П–µ—В—Б—П –њ–Њ–Ј–Є—В–Є–≤–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Њ—В —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Њ–љ–љ–Њ–є –і–Є–µ—В—Л, —В–Њ –Њ–љ–∞ —А–∞—Б—И–Є—А—П–µ—В—Б—П.
–§–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П –Њ—Б—В—А—Л—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —Г –і–µ—В–µ–є –Њ—Б–љ–Њ–≤–∞–љ–∞ –љ–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –і–Њ–Ј–∞—Е, —А–∞–Ј—А–µ—И–µ–љ–љ—Л—Е –Є–љ—Б—В—А—Г–Ї—Ж–Є–µ–є.
–Т –њ–µ—А–≤—Л–є –і–µ–љ—М –њ—А–Є –Њ—Б—В—А–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –љ–∞–Ј–љ–∞—З–∞—О—В –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ (–≤ —Б–ї—Г—З–∞–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –њ–ї–Њ—Й–∞–і–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –Є/–Є–ї–Є –љ–∞–ї–Є—З–Є—П –∞–љ–≥–Є–Њ–Њ—В–µ–Ї–∞) –Є–ї–Є –њ–µ—А–Њ—А–∞–ї—М–љ–Њ –≤ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –і–Њ–Ј–Є—А–Њ–≤–Ї–µ. –Р–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Ї–∞–Ї 1, —В–∞–Ї –Є 2 –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –≤ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞–љ–Є–Є –Ј—Г–і–∞, —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞, —А–∞–Ј–Љ–µ—А–∞ –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Г—А—В–Є–Ї–∞—А–Є–є. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є –Њ—Б—В—А–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —В–µ—З–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—В 7 –і–Њ 14 –і–љ–µ–є. –Ю–і–љ–∞–Ї–Њ –µ—Б–ї–Є —Г—А—В–Є–Ї–∞—А–Є–Є –њ–Њ—П–≤–ї—П—О—В—Б—П –њ–Њ—Б–ї–µ –Њ—В–Љ–µ–љ—Л –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —В–Њ –ї–µ—З–µ–љ–Є–µ –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї—П–µ—В—Б—П.
–Я—А–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Э1––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ (–љ–∞—А–∞—Б—В–∞–љ–Є–µ –Њ—В–µ–Ї–∞, –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ) –љ–∞–Ј–љ–∞—З–∞—О—В—Б—П –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ –≤ –і–Њ–Ј–µ 1–2 –Љ–≥/–Ї–≥, –≤/–Љ).
–Я—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Њ—Б—В—А–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л (–љ–∞–њ—А–Є–Љ–µ—А, –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П) –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є —В–µ—А–∞–њ–Є–Є.
–Т –ї–µ—З–µ–љ–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Г –і–µ—В–µ–є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤—Л–±–Њ—А–∞ —П–≤–ї—П—О—В—Б—П –Э1––±–ї–Њ–Ї–∞—В–Њ—А—Л. –Р–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Ї–∞–Ї 1, —В–∞–Ї –Є 2 –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –≤ —В–Њ–є –Є–ї–Є –Є–љ–Њ–є —Б—В–µ–њ–µ–љ–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –≤ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞–љ–Є–Є –Ј—Г–і–∞ –Є —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞, —А–∞–Ј–Љ–µ—А–∞ –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Г—А—В–Є–Ї–∞—А–Є–є. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Э1––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ 1 –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –≤—А–∞—З –і–Њ–ї–ґ–µ–љ –Њ—Б–Њ–Ј–љ–∞–≤–∞—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —П–≤–ї–µ–љ–Є–є (—Б–µ–і–∞—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В; —Б—Г—Е–Њ—Б—В—М —Б–ї–Є–Ј–Є—Б—В—Л—Е –Њ–±–Њ–ї–Њ—З–µ–Ї –њ–Њ–ї–Њ—Б—В–Є —А—В–∞, –љ–Њ—Б–∞, –≥–Њ—А–ї–∞; –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є—П; –≤—П–ї–Њ—Б—В—М; –љ–∞—А—Г—И–µ–љ–Є—П –∞–њ–њ–µ—В–Є—В–∞ –Є —В.–і.), –∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М—О 2–3––Ї—А–∞—В–љ–Њ–≥–Њ –µ–ґ–µ–і–љ–µ–≤–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞. –Ю—Б–Њ–±–µ–љ–љ–Њ —Б–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –Э1––±–ї–Њ–Ї–∞—В–Њ—А—Л 1 –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –Њ–Ї–∞–Ј—Л–≤–∞—О—В –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л–µ —Д—Г–љ–Ї—Ж–Є–Є, –Є —Н—В–Њ —В–∞–Ї–ґ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞—Е —Г –і–µ—В–µ–є.
–Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –≤ –ї–µ—З–µ–љ–Є–Є –і–µ—В–µ–є —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞–Љ–Є, –љ–∞—И–Є –Ј–љ–∞–љ–Є—П –±–∞–Ј–Є—А—Г—О—В—Б—П –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –љ–∞ –і–∞–љ–љ—Л—Е, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —Г –≤–Ј—А–Њ—Б–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —Г –і–µ—В–µ–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–µ—В–Њ–і–Њ–≤ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л, –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –Љ–∞–ї–Њ [73,74]. –≠—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –њ–Њ–і—Е–Њ–і —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ «–њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–∞–≤–Є–ї–∞», –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –љ–∞ –і–µ—В–µ–є —Н–Ї—Б—В—А–∞–њ–Њ–ї–Є—А—Г—О—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е —Г –≤–Ј—А–Њ—Б–ї—Л—Е, –µ—Б–ї–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –њ—А–Њ—В–µ–Ї–∞—О—В —Б—Е–Њ–і–љ–Њ (–њ–∞—В–Њ–≥–µ–љ–µ–Ј, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Є —В.–і.) –Є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ–Њ–і–Њ–±–љ—Л–є —Н—Д—Д–µ–Ї—В —Г –≤–Ј—А–Њ—Б–ї—Л—Е –Є –і–µ—В–µ–є. –Ю—Б–Њ–±–Њ–≥–Њ –≤–љ–Є–Љ–∞–љ–Є—П –Ј–∞—Б–ї—Г–ґ–Є–≤–∞—О—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л–µ —Г –≤–Ј—А–Њ—Б–ї—Л—Е, —Б—В—А–∞–і–∞—О—Й–Є—Е —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞–Љ–Є, —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї—А–Є—В–µ—А–Є–µ–≤ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л.
–Т —Н—В–Њ–є —Б–≤—П–Ј–Є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Є–љ—В–µ—А–µ—Б –љ–µ–і–∞–≤–љ–Њ –Ј–∞–≤–µ—А—И–µ–љ–љ–Њ–µ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –і–≤–Њ–є–љ–Њ–µ —Б–ї–µ–њ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ Potter P.C. et al. (–≤ –њ–µ—З–∞—В–Є), –≤ –Ї–Њ—В–Њ—А–Њ–µ –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 886 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М 4––љ–µ–і–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –ї–µ–≤–Њ—Ж–µ—В–Є—А–Є–Ј–Є–љ–Њ–Љ 5 –Љ–≥/—Б—Г—В. –Є –і–µ–Ј–ї–Њ—А–∞—В–∞–і–Є–љ–Њ–Љ 5 –Љ–≥/—Б—Г—В. —Г –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є.
–С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –ї–µ–≤–Њ—Ж–µ—В–Є—А–Є–Ј–Є–љ –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є —Г–Љ–µ–љ—М—И–∞–ї –Ј—Г–і –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –і–µ–Ј–ї–Њ—А–∞—В–∞–і–Є–љ–Њ–Љ —Г–ґ–µ –љ–∞ –њ–µ—А–≤–Њ–є –љ–µ–і–µ–ї–µ —В–µ—А–∞–њ–Є–Є (—И–Ї–∞–ї–∞ —В—П–ґ–µ—Б—В–Є –Ј—Г–і–∞ 1,02 –Є 1,18 –і–ї—П –ї–µ–≤–Њ—Ж–µ—В–Є—А–Є–Ј–Є–љ–∞ –Є –і–µ–Ј–ї–Њ—А–∞—В–∞–і–Є–љ–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, p<0,001). –Ф–∞–љ–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П —Б–Њ—Е—А–∞–љ—П–ї–Є—Б—М –Є –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ 4––љ–µ–і–µ–ї—М–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ —В–µ—А–∞–њ–Є–Є (p=0,004). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —В—П–ґ–µ—Б—В—М —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Г–Љ–µ–љ—М—И–∞–ї–∞—Б—М –≤ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –њ—А–Є –њ—А–Є–µ–Љ–µ –ї–µ–≤–Њ—Ж–µ—В–Є—А–Є–Ј–Є–љ–∞ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –і–µ–Ј–ї–Њ—А–∞—В–∞–і–Є–љ–Њ–Љ –Ї–∞–Ї –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤–Њ–є –љ–µ–і–µ–ї–Є, —В–∞–Ї –Є –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ю–±—Й–µ–µ —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є —В–µ—А–∞–њ–Є–µ–є –±—Л–ї–Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–Њ –≤ –≥—А—Г–њ–њ–µ, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –ї–µ–≤–Њ—Ж–µ—В–Є—А–Є–Ј–Є–љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і–µ–Ј–ї–Њ—А–∞—В–∞–і–Є–љ–Њ–Љ –њ–Њ—Б–ї–µ 1 –Є 4 –љ–µ–і–µ–ї—М (p=0,012 –Є p=0,021, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). –С–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –±—Л–ї–∞ —Б—А–∞–≤–љ–Є–Љ–Њ–є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е. –Т –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –ї–µ–≤–Њ—Ж–µ—В–Є—А–Є–Ј–Є–љ, —З–∞—Й–µ –Њ—В–Љ–µ—З–∞–ї—Б—П —Б–µ–і–∞—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В (5,9%), —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–∞—Е–Њ–і–Є–≤—И–Є—Е—Б—П –љ–∞ —В–µ—А–∞–њ–Є–Є –і–µ–Ј–ї–Њ—А–∞—В–∞–і–Є–љ–Њ–Љ – 2,9%. –≠—В–Њ—В —Н—Д—Д–µ–Ї—В –±—Л–ї –Њ–ґ–Є–і–∞–µ–Љ –Є —Б–Њ–≤–њ–∞–і–∞–ї —Б —А–∞–љ–µ–µ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є [74].
–Я–Њ–і–±–Њ—А —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П —Б —Г—З–µ—В–Њ–Љ —Д–Њ—А–Љ—Л –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л, –≤–Њ–Ј—А–∞—Б—В–∞ —А–µ–±–µ–љ–Ї–∞, –∞ —В–∞–Ї–ґ–µ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Б—А–µ–і—Б—В–≤–∞. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –≤ —В–µ—З–µ–љ–Є–µ –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –Ґ–∞–Ї, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Э1––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ 2 –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –Љ–Њ–ґ–µ—В —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М—Б—П –њ—А–Є –Є—Е –Ї—Г—А—Б–Њ–≤–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є. –Т —Б–≤—П–Ј–Є —Б —И–Є—А–Њ–Ї–Њ–є –≤–∞—А–Є–∞—Ж–Є–µ–є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –љ–∞ –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –њ—А–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ–і–љ–Њ–≥–Њ –Э1––±–ї–Њ–Ї–∞—В–Њ—А–∞ –ґ–µ–ї–∞—В–µ–ї—М–љ–Њ –њ–Њ–њ—Л—В–∞—В—М—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –і—А—Г–≥–Њ–є –њ—А–µ–њ–∞—А–∞—В. –Т —В—П–ґ–µ–ї—Л—Е —Б–ї—Г—З–∞—П—Е —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —Б–Њ—З–µ—В–∞–љ–Є–µ –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ 1 –Є 2 –њ–Њ–Ї–Њ–ї–µ–љ–Є—П. –Я—А–Є —Н—В–Њ–Љ —Г—В—А–Њ–Љ –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–є –њ—А–µ–њ–∞—А–∞—В, –∞ –њ–µ—А–µ–і —Б–љ–Њ–Љ – –њ—А–µ–њ–∞—А–∞—В 1 –њ–Њ–Ї–Њ–ї–µ–љ–Є—П.
–£ –≤–Ј—А–Њ—Б–ї—Л—Е –њ—А–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Э1––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –Э1– –Є –Э2––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤. –Ф–∞–љ–љ—Л—Е –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–Њ—З–µ—В–∞–љ–Є—П –Э1– –Є –Э2––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –≤ –і–µ—В—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –љ–µ—В.
–Я—А–Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Э1––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –≤ —В–µ—А–∞–њ–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ –Ї—А–∞–њ–Є–≤–љ–Є—Ж –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –Є –і—А—Г–≥–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л. –°—А–µ–і–Є –љ–Є—Е –≤ –і–µ—В—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –њ—А–Є–Љ–µ–љ—П—О—В –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і—Л, –Ї–Њ—В–Њ—А—Л–µ –Њ–±—Л—З–љ–Њ –љ–∞–Ј–љ–∞—З–∞—О—В—Б—П –Ї–Њ—А–Њ—В–Ї–Є–Љ –Ї—Г—А—Б–Њ–Љ –µ–ґ–µ–і–љ–µ–≤–љ–Њ –Є–ї–Є —З–µ—А–µ–Ј –і–µ–љ—М. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї—Г—А—Б–∞ –і–Њ–ї–ґ–љ–∞ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—В—М—Б—П —Б —Г—З–µ—В–Њ–Љ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤.
–Ф–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е –і–∞–љ–љ—Л—Е –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Э2––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤, –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Ж–Є—Б—В–µ–љ–Є–ї––ї–µ–є–Ї–Њ—В—А–Є–µ–љ–Њ–≤, —Б—Г–ї—М—Д–∞—Б–∞–ї–∞–Ј–Є–љ–∞, —В—А–Є—Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Є—Е –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В–Њ–≤, –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –Ї–∞–ї—М—Ж–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ї—А–∞–њ–Є–≤–љ–Є—Ж –≤ –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –љ–µ—В.
–£ –±–Њ–ї—М–љ—Л—Е —Б –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї–∞–Љ–Є –Ї FceRI –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ [76]. –Т —Б–ї—Г—З–∞–µ –Њ—В—Б—Г—В—Б—В–≤–Є—П –∞–љ—В–Є—В–µ–ї –Ї FceRI —Г –≤–Ј—А–Њ—Б–ї—Л—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ–∞ [77]. –Ф–∞–љ–љ—Л—Е –Њ–± —Г—Б–њ–µ—И–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ –Є —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ–∞ —Г –і–µ—В–µ–є –љ–µ—В.
–Т —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –≤—Л—П–≤–ї—П–µ—В—Б—П —Б–≤—П–Ј—М —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —Б –њ–∞—А–∞–Ј–Є—В–∞—А–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є [78,79], –Њ—З–∞–≥–∞–Љ–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є (–љ–∞–њ—А–Є–Љ–µ—А, —Б–Є–љ—Г—Б–Є—В). –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –ї–µ—З–µ–љ–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ—Г—Б–Є—В–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –∞–љ–≥–Є–Њ–Њ—В–µ–Ї–Њ–Љ –њ—А–Є–≤–Њ–і–Є—В –Ї —А–µ–Љ–Є—Б—Б–Є–Є –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ [80]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –і–Њ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –љ–µ—В –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —Г—Б—В–∞–љ–Њ–≤–Є–≤—И–Є—Е —А–Њ–ї—М –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є –≤ —А–∞–Ј–≤–Є—В–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж –Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є [81].
–Я—А–Њ–≥–љ–Њ–Ј —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —Г –і–µ—В–µ–є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤–∞—А–Є–∞–±–µ–ї–µ–љ, —З—В–Њ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ–Є —А–∞–Ј–ї–Є—З–Є—П–Љ–Є –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ґ–∞–Ї, Harris et al. [22] –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є, —З—В–Њ —З–µ—А–µ–Ј 1 –≥–Њ–і —Г 58% –і–µ—В–µ–є –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є —Б–Є–Љ–њ—В–Њ–Љ—Л –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л. –£ 42% –і–µ—В–µ–є —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М —Б–Њ—Е—А–∞–љ–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –±–Њ–ї–µ–µ 1 –≥–Њ–і–∞ [8]. –Т –њ–Њ–і–≥—А—Г–њ–њ–µ, –≥–і–µ –±—Л–ї –Є–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ—Л–є —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —Д–∞–Ї—В–Њ—А —Г 73% (11/15) —Б–Њ—Е—А–∞–љ–Є–ї–∞—Б—М –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞, —З—В–Њ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –±–Њ–ї–µ–µ —В—П–ґ–µ–ї—Л–Љ –њ—А–Њ–≥–љ–Њ–Ј–Њ–Љ —Г –±–Њ–ї—М–љ—Л—Е —Б —Д–Є–Ј–Є—З–µ—Б–Ї–Є–Љ–Є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–∞–Љ–Є [23].
–Т–µ—А–Њ—П—В–љ–Њ, –±–Њ–ї–µ–µ –њ—А–∞–≤–Є–ї—М–љ–Њ –Њ—Ж–µ–љ–Є–≤–∞—В—М –љ–µ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л –≤–Њ–Њ–±—Й–µ, –∞ –і–Є–љ–∞–Љ–Є–Ї—Г —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤. –Ґ–∞–Ї, –њ–Њ –љ–∞—И–Є–Љ –і–∞–љ–љ—Л–Љ, —З–µ—А–µ–Ј 1 –≥–Њ–і –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П —Г 28,6% –і–µ—В–µ–є —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж–µ–є –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –њ–Њ–ї–љ–Њ–µ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, —Г 57,1% – —А–µ—Ж–Є–і–Є–≤—Л —Б—В–∞–љ–Њ–≤–Є–ї–Є—Б—М —А–µ–ґ–µ –Є –њ—А–Њ—В–µ–Ї–∞–ї–Є –≤ –±–Њ–ї–µ–µ –ї–µ–≥–Ї–Њ–є —Д–Њ—А–Љ–µ, 14,3% – –љ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Є —В–µ—З–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –њ—А–Њ–≥–љ–Њ–Ј —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Г –і–µ—В–µ–є –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –≤–∞—А—М–Є—А—Г–µ—В –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –µ–µ —Д–Њ—А–Љ—Л. –Э–∞–Є–±–Њ–ї–µ–µ —Г–њ–Њ—А–љ–Њ –њ—А–Њ—В–µ–Ї–∞—О—В –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ, –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –Є —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ (—З–µ—А–µ–Ј –≥–Њ–і –љ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Є —Г 70, 43 –Є 36,5% –і–µ—В–µ–є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ) –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л, —В–Њ–≥–і–∞ –Ї–∞–Ї –і–ї—П –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Њ–є –Є –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Е–∞—А–∞–Ї—В–µ—А–µ–љ –±–Њ–ї–µ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј [72].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –±–∞–Ј–Є—Б–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є –Ї–∞–Ї –Њ—Б—В—А—Л—Е, —В–∞–Ї –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —Г –і–µ—В–µ–є —П–≤–ї—П—О—В—Б—П –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Њ—А–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —Г –і–µ—В–µ–є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —В–Њ—З–љ–Њ—Б—В—М—О –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –і–Є–∞–≥–љ–Њ–Ј–∞, –±–∞–Ј–Є—А—Г—О—Й–µ–≥–Њ—Б—П –љ–∞ —В—Й–∞—В–µ–ї—М–љ–Њ–Љ —Б–±–Њ—А–µ –∞–љ–∞–Љ–љ–µ–Ј–∞, —Д–Є–Ј–Є–Ї–∞–ї—М–љ–Њ–Љ –Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –∞ —В–∞–Ї–ґ–µ –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –њ—А–Њ–≤–Њ–Ї–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ —В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є—П.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Sackesen C, Sekerel BE, Orhan F, Kocabas CN, Tuncer A, Adalioglu G. The etiology of different forms of urticaria in childhood. Pediatr Dermatol., 2004, v.21(2), p.102–8.
2. Mortureux P, Le?aute?–Labre`ze C, Legrain–Lifermann V, Lamireau T, Sarlangue J, Taieb A. Acute urticaria in infancy and early childhood: a prospective study. Arch Dermatol 1998; 134: 319–323.
3. Simons FER. Prevention of acute urticaria in young children with atopic dermatitis. J Allergy Clin Immunol 2001;107:703–706
4. Zuberbier T, Munzberger C, Haustein U, Trippas E, Burtin B, Mariz SD, Henz BM. Double–blind crossover study of high–dose cetirizine in cholinergic urticaria. Dermatology, 1996, v.193(4), p.324–7.
5. Kaplan AP. Clinical practice. Chronic urticaria and angioedema. N Engl J Med., 2002, v.346, p.175–179.
6. O’Donnell BF, Lawlor F, Simpson J, Morgan M, Greaves MW. The impact of chronic urticaria on the quality of life. Br J Dermatol 1997; 136:197–201.
7. –Я–∞–Љ–њ—Г—А–∞ –Р.–Э., –°–Њ–ї–Њ–≤–µ–є –Ґ.–Э. –°–њ–µ–Ї—В—А —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —Г –і–µ—В–µ–є. // –Ь–∞—В–µ—А–Є–∞–ї—Л VIII –Ъ–Њ–љ–≥—А–µ—Б—Б–∞ «–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ—А–Њ–±–ї–µ–Љ—Л –∞–ї–ї–µ—А–≥–Њ–ї–Њ–≥–Є–Є, –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є–Є –Є –Є–Љ–Љ—Г–љ–Њ—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є». –Ь. – 2007).
8. Volonakis M, Katsarou–Katsari A, Stratigos J. Etiologic factors in childhood chronic urticaria. Ann Allergy, 1992, v.69, p.61–65.
9. –Я–∞–Љ–њ—Г—А–∞ –Р.–Э., –°–Њ–ї–Њ–≤–µ–є –Ґ.–Э. –°–њ–µ–Ї—В—А —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–∞–њ–Є–≤–љ–Є—Ж —Г –і–µ—В–µ–є. –Ь–∞—В–µ—А–Є–∞–ї—Л VI —А–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –Ї–Њ–љ–≥—А–µ—Б—Б–∞ «–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є –≤ –њ–µ–і–Є–∞—В—А–Є–Є –Є –і–µ—В—Б–Ї–Њ–є —Е–Є—А—Г—А–≥–Є–Є». –Ь., 2007, —Б.43–44.
10. Neittaanmaki H. Cold urticaria. Clinical findings in 220 patients. J Am Acad Dermatol., 1985, v.13(4), p.636–44.
11. R. Twycross1,, M.W. Greaves2, H. Handwerker3, E.A. Jones4, S.E. Libretto5, J.C. Szepietowski6 and Z. Zylicz7 Itch: scratching more than the surface. Q J Med 2003; 96: 7–26.
12. Schmelz M, Luz O, Averbeck B, Bickel A. Plasma extravasation and neuropeptide release in human skin as measured by intradermal microdialysis. Neurosci Letters 1997; 230:117–20.
13. Weidner C, Klede M, Rukwied R, Lischetzki G, Neisius U, Skov PS, Petersen LJ, Schmelz M. Acute effects of substance P and calcitonin gene–related peptide in human skin: a microdialysis study. J Invest Dermatol 2000; 115:1015–20.
14. K. Kontou–Fili Clinical advantages of dual activity in urticaria Allergy 2000: 55: 28–33.
15. Fineman S. M. Urticaria and Angioedema. Manual of Allergy and Immunology, 1988, p.214–24.
16. Zuberbier –Ґ., Bindslev–Jensen –°., Canonica W. et al. EAACI/GA2.L–ХN/EDF guideline: definition, classification and diagnosis of urticaria. Allergy, 2006, v.61, p.316–320.
17. Dalal I, Levine A, Somekh E, Mizrahi A, Hanukoglu A. Chronic urticaria in children: expanding the «autoimmune kaleidoscope». Pediatrics. 2000 Nov;106 (5):1139–41.
18. Henz BM, Zuberbier T. Causes of urticaria. In: Henz BM, Zuberbier T, Grabbe J, et al., editors. Urticaria: clinical, diagnostic and therapeutic aspects. Berlin: Springer Verlag, 1998: 18–38 15.
19. Legrain V, Taieb A, Sage T, Maleville J. Urticaria in infants: a study of forty patients. Pediatr Dermatol 1990: 7: 101–107
20. Berdick AE, Mathias CG. The contact urticaria syndrome. Dermatol Clin. 1985 Jan 3(1) 71–84.
21. –Я–∞–Љ–њ—Г—А–∞ –Р.–Э., –°–Њ–ї–Њ–≤–µ–є –Ґ.–Э., –Ф–µ–µ–≤–∞ –Ґ.–§. –°–Њ—З–µ—В–∞–љ–Є–µ –∞–љ–≥–Є–Њ–Њ—В–µ–Ї–∞ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л —Г –і–µ—В–µ–є. // –Ь–∞—В–µ—А–Є–∞–ї—Л VI —А–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –Ї–Њ–љ–≥—А–µ—Б—Б–∞ «–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є –≤ –њ–µ–і–Є–∞—В—А–Є–Є –Є –і–µ—В—Б–Ї–Њ–є —Е–Є—А—Г—А–≥–Є–Є». –Ь.–2007. – —Б. 42–43.
22. Harris A, Twarog FJ, Geha RS. Chronic urticaria in childhood: natural course and etiology. Ann Allergy, 1983, v.51, p.161–165.
23. Kauppinen K, Juntunen K, and Lanki H. Urticaria in children. Retrospective evaluation and follow–up. Allergy, 1984, v.39, p.469–472.
24. Bourdon H. Note sur l’urticaire intermittente. Bull Mem Soc Med Hop. Paris, 1866, v.3, p.259–62.
25. Santaolalla Montoya M, Martinez Molero M, Santaolalla San Juana Baeza ML, et al. Cold urticaria: review of 12 cases. Allergol Immunopathol., 2002, v.30, p.259–62.
26. Tyson CJ, Czarny D. Cold–induced urticaria in infectious mononucleosis. Med J Aust., 1981, v.1, p.33–5.
27. Wanderer AA. Cold urticaria syndromes: Historical background, diagnostic classification, clinical and laboratory characteristics, pathogenesis, and management. J Allergy Clin Immunol., 1990, v.85,, p.965–81.
28. Barranco Sanz P, L—Гpez Serrano C. Urticaria por fr–љo asociada con marcadores serol—Гgicos de hepatitis B y crioglobulinemia. Allergol Immunopathol., 1987, v.15, p.167–9.
29. Ito A, Kazama T, Ito K, Ito M. Purpura with cold urticaria in a patient with hepatitis C virus infection–associated mixed cryoglobulinemia type III: successful treatment with interferon–beta. J Dermatol., 2003, v.30, p.321–5.
30. Lin RY, Schwartz RA. Cold urticaria and HIV infection. Br J Dermatol., 1993, v.129, p.465–7.
31. Miralles Lopez JC, Lopez Andreu FR, Sanchez–Gascon F, Lopez Rodriguez C, Negro Alvarez JM. Cold urticaria associated with acute serologic toxoplasmosis. Allergol Immunopathol., 2005, v.33(3), p.172–4.
32. Alangari A.; Twarog Frank J. Mei–Chiung Shih; Lynda C. Schneider, Clinical Features and Anaphylaxis in Children With Cold Urticaria. Pediatrics, 2004, v.113, p.e313–e317.
33. Wanderer AA, Grandel KE, Wasserman SI, Farr RS. Clinical characteristics of cold–induced systemic reactions in acquired cold urticaria syndromes: recommendations for prevention of this complication and a proposal for a diagnostic classification of cold urticaria. J Allergy Clin Immunol., 1986, v.78, p.417–23.
34. Zip, C. M., Ross, J. B., Greaves, M. W., Scriver, C. R., Mitchell, J. J., Zoar S. Familial cold urticaria. Clin. Exp. Derm., 1993, v.18, p.338–341.
35. Dubertret L, Pecquet C, Murrieta–Aguttes M, Leynadier F. Mizolastine in primary acquired cold urticaria. J Am Acad Dermatol., 2003, v.48(4), p.578–83.
36. Moller A, Henning M, Zuberbier T, Czarnetzki–Henz BM. Epidemiology and clinical aspects of cold urticaria. Hautarzt., 1996, v.47(7), p.510–4.
37. Taskapan O, Harmanyeri Y. Evaluation of patients with symptomatic dermographism., J Eur Acad Dermatol Venereol., 2006, v.20(1), p.58–62.
38. Wallengren J, Isaksson A. Urticarial dermographism: clinical features and response to psychosocial stress. Acta Derm Venereol., 2007, v.87(6), p.493–8.
39. Orfan NA, Kolski GB. Physical urticarias. Ann Allergy, 1993, v.71, p.205–212.
40. Jedele KB, Michels VV. Familial dermographism. Am J Med Genet, 1991, v.39(2), p.201–3.
41. Dawn G, Urcelay M, Ah–Weng A, O’Neill SM, Douglas WS. Effect of high–dose intravenous immunoglobulin in delayed pressure urticaria. Br J Dermatol., 2003, v.149(4), p.836–40.
42. Ting S, Reimann BE, Rauls DO, Mansfield LE Nonfamilial, vibration–induced angioedema. J Allergy Clin Immunol., 1983, v.71(6), p.546–51.
43. Zuberbier T, Greaves MW, Juhlin L, Kobza–Black A, Maurer D, Stingl G et al. Definition, classification and routine diagnosis of urticaria– a consensus report. J Invest Dermatol Symp Proc., 2001, v.6, p.123–127.
44. Poon E, Seed PT, Greaves MW, Kobza–Black A. The extent and nature of disability in different urticarial conditions. Br J Dermatol., 1999, v.140(4), p.667–714.
45. Niv Y, Elkan I; Fraser GM. Transient hepatocellular injury during attacks of cholinergic urticaria Isr J Med Sci., 1997, v.33(1), p.50–2.
46. Adachi J, Aoki T, Yamatodani A. Demonstration of sweat allergy in cholinergic urticaria J Dermatol Sci., 1994, v.7(2), p.142–9.
47. Kato T, Komatsu H; Tagami H. Exercise–induced urticaria and angioedema: reports of two cases. J Dermatol., 1997, v.24(3), p.189–92.
48. Mijailovic B, Mladenovic T, Karadaglic D, Ninkovic M Jovic P, Pavlovic M Klinickai. laboratorijska studija holinergijske urtikarije. Vojnosanit Pregl., 1996, v.53(6), p.497–501.
49. Pampura A, Cheburkin A, Pogomiy N, Morozova O, Svjatkina O. Cholinergic urticaria in children: clinical signs, therapeutic aspects and prognosis. Allergy, 2002, v.57, Issue s73, A1023, Page 314–315.
50. Onn A, Levo Y, Kivity S. Familial cholinergic urticaria. J Allergy Clin Immunol., 1996, v.98 (4), p.847–9.
51. M. Metz, P. Bergmann, T. Zuberbier, M. Maure Successful treatment of cholinergic urticaria with anti–immunoglobulin E therapy. Allergy 2008: 63: 247–249).
52. Frances AM et al. Aquagenic urticaria: report of a case. Allergy Asthma Proc., 2004, v.25(3), p.195–7.
53. Harris A, Burge S, George S. Solar urticaria in an infant. British Journal of Dermatology, 1997, v.136 (1), p.105–7.
54. –Я–∞–Љ–њ—Г—А–∞ –Р.–Э., –°–Њ–ї–Њ–≤–µ–є –Ґ.–Э. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–є –Є —Е–Њ–ї–Є–љ—Н—А–≥–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л (–∞–љ–∞–ї–Є–Ј –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–ї—Г—З–∞—П). –†–Њ—Б—Б–Є–є—Б–Ї–Є–є –∞–ї–ї–µ—А–≥–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –ґ—Г—А–љ–∞–ї, 2005 (3), c.68–72.
55. Yap LM, Foley PA, Crouch RB, Baker CS. Drug–induced solar urticaria due to tetracycline. Australas J Dermatol., 2000, v.41 (3), p.181–4.
56. Uetsu N, Miyauchi–Hashimoto H, Okamoto H, Horio T. The clinical and photobiological characteristics of solar urticaria in 40 patients. Br J Dermatol., 2000, v.142(1), p.32–8.
57. Millard TP, Hawk JL. Photosensitivity disorders: cause, effect and management. Am J Clin Dermatol., 2002, v.3 (4), p.239–46.
58. Luong K, Nguyen LTH: Aquagenic urticaria: Report of a case and review of the literature. Ann Allergy Asthma Immunol 80:483–5, 1998.
59. Shelley WB, Shelley ED. Adrenergic urticaria: a new form of stress–induced hives. Lancet 1985; 2: 1031–3.
60. Howard PJ, Lee MR. Beware beta–adrenergic blockers in patients with severe urticaria! Scott Med J 1988; 33: 344–5.
61. Habte–Gabr E, Tiruneh M, Hailu M. Chronic urticaria: its relationship to intestinal aspects. Clin Exp Allergy, 2001, v.31, p.1105–10.
62. Oteifa NM, Moustafa MA, Elgozamy BM. Toxocariasis as a possibile cause of allergic diseases in children. J Egypt Soc Parasitol., 1998, v.28, p.365–72.
63. Moreira A, Rodrigues J, Delgado L, Fonseca J, Vaz M. Is Helicobacter pylori infection associated with chronic idiopathic urticaria? Allergol Immunopathol., 2003, v.31(4), p.209–14.
64. Leznoff A, Sussman GL. Syndrome of idiopathic chronic urticaria and angioedema with thyroid autoimmunity: a study of 90 patients. J Allergy Clin Immunol., 1989, v.84, p.66–71.
65. Levy Y, Segal N, Weintrob N et al. Chronic urticaria: Association with thyroid autoimmunity. Arch Dis Child., 2003, v.88, p.517–519.
66. Dalal I, Levine A, Somekh E et al. Chronic urticaria in children: Expanding the “autoimmune kaleidoscope.” Pediatrics, 2000, v.106, p.1139–1141.
67. Levine A, Dalal I, and Bujanover Y. Celiac disease associated with familial chronic urticaria and thyroid autoimmunity in a child. Pediatrics, 1999, v.104, p.e25.
68. Sabroe RA, Grattan CEH, Francis DM, Barr RM, Black AK, Greaves MW. The autologous serum sin test: a screening test for autoantibodies in chronic idiopathic urticaria. Br J Dermatol., 1999, v.140, p.446–52.
69. Niimi N, Francis DM, Kermani F, O’Donnell BF, Hide M, Kobza–Black A et al. Dermal mast cell activation by autoantibodies against the high affinity IgE receptor in chronic urticaria. J Invest Dermatol., 1996, v.106, p.1001–6.
70. Grattan CEH, Walpole D, Francis DM, Niimi N, Dootson G, Edler S et al. Flow cytometric analysis of basophil numbers in chronic urticaria: basopenia is related to serum histamine releasing activity. Clin Exp Allergy, 1997, v.27, p.1417–24.
71. Sabroe RA, Seed PT, Francis DM, Barr RM, Black AK, Greaves MW. Chronic idiopathic urticaria: comparison of the clinical features of patients with and without anti–FcepsilonRI or anti–IgE autoantibodies. J Am Acad Dermatol., 1999, v.40, p.443–50.
72. –°–Њ–ї–Њ–≤–µ–є –Ґ.–Э. –Я–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П —Е–∞—А–∞–Ї—В—А–Є—З—В–Є–Ї–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Ї—А–∞–њ–Є–≤–љ–Є—Ж—Л, –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–Є–µ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–∞–Ї—В–Є–Ї–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П —Г –і–µ—В–µ–є. –Р–≤—В–Њ—А–µ—Д–µ—А–∞—В. –Ь–Њ—Б–Ї–≤–∞ – 2008.
73. Simons FE. Prospective, long–term safety evaluation of the H1–receptor antagonist cetirizine in very young children with atopic dermatitis. ETAC Study Group. Early treatment of the atopic child. J Allergy Clin Immunol 104:433– 440, 1999;
74. Bloom M, Staudinger H, and Herron J. Safety of desloratadine syrup in children. Curr Med Res Opin 20:1959 –1965, 2004.
75. Xyzal 5 mg film–coated tablets, Xyzal 0.5 mg/ml oral solution, short product characteristics; 4.8 Undesirable effects. electronic Medicines Compendium http://emc.medicines.org.uk/emc/assets/c/html/DisplayDoc.asp?DocumentID=19877
76. O`Donnell BF., Barr RM, Black AK et al. Intravenous immunoglobulin in chronic autoimmune urticaria. Br J Dermatol., 1998, v.138, p.101–106.
77. Di Gioacchino M, Di Stefano F, Cavallucci E, Verna N, Ramondo S, Paolini F, Caruso R, Schiavone C, Masci S, Santucci B, Paganelli R, Conti P. Treatment of chronic idiopathic urticaria and positive autologous serum skin test with cyclosporine: clinical and immunological evaluation. Allergy Asthma Proc., 2003, v.24(4), p.285–90.
78. Del Poso MD et al. Anisakis simplex, a relevant etiologic factor in acute urticaria. Allergy, 1997, v.52 (5), p.576–9.
79. Oteifa NM, Moustafa MA, Elgozamy BM. Toxocariasis as a possible cause of allergic diseases in children. J Egypt Soc Parasitol., 1998, v.28(2), p.365–72.
80. Watson RD, Gershwin ME. Acquired angioedema associated with sinusitis. J Investig Allergol Clin Immunol., 2000, v.10(3), p.129–34.
81. Carvalho P. In which circumstances does the description of an etiology affect the treatment and the course of chronic urticaria? Ann Dermatol Venereol., 2003, v.130, p.121–8.












