–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ј–≤–Њ–ї—П—О—В —А–∞–Ј—А–∞–±–Њ—В–∞—В—М –њ–µ—А—Б–Њ–љ–∞–ї—М–љ—Г—О –і–Є–µ—В—Г –љ–∞ –Њ—Б–љ–Њ–≤–µ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –њ–Є—Й–µ–≤–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –њ–∞—Ж–Є–µ–љ—В–∞, –≤–Ї–ї—О—З–∞—О—Й–µ–є —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ–Њ–і—Е–Њ–і—Л –Ї –≥–µ–љ–Њ–Љ–љ–Њ–Љ—Г –Є –њ–Њ—Б—В–≥–µ–љ–Њ–Љ–љ–Њ–Љ—Г –∞–љ–∞–ї–Є–Ј—Г.
–Ъ–ї—О—З–µ–≤—Л–µ —Б–ї–Њ–≤–∞: —Д–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –њ–Є—В–∞–љ–Є–µ, –њ–Є—Й–µ–≤–Њ–є —Б—В–∞—В—Г—Б, –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є—П, –њ–ї–Њ—В–љ–Њ—Б—В—М –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ –≥–µ–љ–Њ–≤.
The study of the association of polymorphism obesity among residents of Russia
A.K. Baturin, A.V. Pogozheva, E.Y. Sorokina, E.V. Peskov–∞, O.N Makurina., V.A. Tutelian
Institute of Nutrition, Moscow, Russia
Resume. In a consultative and diagnostic center «Healthy Nutrition» of Institute of Nutrition the nutritional status of 3580 patients (mean age 48,4±0,3 years), including genomic analysis has been examined.
30,0% of patients were overweight and 34,1% were obese. The frequency of the occurrence of risk alleles of genes associated with the development of obesity was: 47,8% – for the polymorphism rs9939609 (FTO gene), 7,8% – for polymorphism rs4994 (gene ADRB3), 60,2% – for the polymorphism rs659366 (gene UCP2), 36,6% – for the rs5219 polymorphism in the gene of ATP-dependent potassium channel.
These results can be used for the development of a personalized diet based on diagnostic patient nutritional status, including genomic analysis has been examined.
Keywords: dietary intake, nutritional status, hyperglycemia, bone density, gene polymorphism.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ–ґ–Є—А–µ–љ–Є–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –∞–Ї—В—Г–∞–ї—М–љ—Г—О –њ—А–Њ–±–ї–µ–Љ—Г, —З—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –µ–≥–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–Љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ–Љ –Є —В—П–ґ–µ—Б—В—М—О –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –љ–µ—А–µ–і–Ї–Њ —Б—В–∞–љ–Њ–≤—П—В—Б—П –њ—А–Є—З–Є–љ–Њ–є —Б–Љ–µ—А—В–Є –±–Њ–ї—М–љ—Л—Е –≤ –Љ–Њ–ї–Њ–і–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ. –Я–Њ –і–∞–љ–љ—Л–Љ –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є —Ж–µ–ї–µ–≤–Њ–є –≥—А—Г–њ–њ—Л –њ–Њ –±–Њ—А—М–±–µ —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –Њ–Ї–Њ–ї–Њ 1 –Љ–ї—А–і –≤–Ј—А–Њ—Б–ї—Л—Е –Є–Љ–µ—О—В –Є–Ј–±—Л—В–Њ—З–љ—Г—О –Љ–∞—Б—Б—Г —В–µ–ї–∞, –∞ 475 –Љ–ї–љ –Є–Ј –љ–Є—Е —Б—В—А–∞–і–∞—О—В —Н—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є. –° –Ї–Њ–љ—Ж–∞ –•–• –≤. –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ —З–Є—Б–ї–Њ –ї–Є—Ж —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –±–Њ–ї–µ–µ —З–µ–Љ —Г–і–≤–Њ–Є–ї–Њ—Б—М [1, 2].
–≠—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –Ї–∞–Ї –≤–љ–µ—И–љ–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є (–љ–µ–њ—А–∞–≤–Є–ї—М–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –ґ–Є–Ј–љ–Є, –≤ —В. —З. —А–∞–Ј–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ –њ–Є—В–∞–љ–Є–µ–Љ), —В–∞–Ї –Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є. –°—З–Є—В–∞—О—В, —З—В–Њ —Б—А–µ–і–Њ–≤—Л–µ —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ —Е–∞—А–∞–Ї—В–µ—А–∞ –њ–Є—В–∞–љ–Є—П –Є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –Љ–Њ–≥—Г—В —А–µ–∞–ї–Є–Ј–Њ–≤–∞—В—М—Б—П —В–Њ–ї—М–Ї–Њ –љ–∞ —Д–Њ–љ–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ [3, 4]. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –±–Њ–ї—М—И–Њ–є –Є–љ—В–µ—А–µ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Є–і–µ–љ—В–Є—Д–Є–Ї–∞—Ж–Є—П –≥–µ–љ–Њ–≤-–Ї–∞–љ–і–Є–і–∞—В–Њ–≤ –Њ–ґ–Є—А–µ–љ–Є—П. –Я—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –і–µ—В–µ–є –Є –≤–Ј—А–Њ—Б–ї—Л—Е –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–Њ–њ—Г–ї—П—Ж–Є—П—Е –≤—Л—П–≤–ї–µ–љ–Њ –±–Њ–ї–µ–µ 100 –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–Њ–≤, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б —Н—В–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ [5–7].
–Ґ–∞–Ї, –њ–Њ–Ї–∞–Ј–∞–љ–∞ –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞ rs9939609 –≥–µ–љ–∞ FTO —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Є–љ–і–µ–Ї—Б–∞ –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ш–Ь–Ґ), –ґ–Є—А–Њ–≤–Њ–є –Љ–∞—Б—Б—Л, –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ —З—Г–≤—Б—В–≤–∞ –љ–∞—Б—Л—Й–µ–љ–Є—П –њ–Є—Й–µ–є –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ (–≤ 1,5–2 —А–∞–Ј–∞) —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Њ–ґ–Є—А–µ–љ–Є—П [8, 9]. –Э–∞–Є–±–Њ–ї–µ–µ —В–µ—Б–љ–∞—П —Б–≤—П–Ј—М —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –Љ–µ–ґ–і—Г –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –Є –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–Њ–Љ —Н—В–Њ–≥–Њ –≥–µ–љ–∞ –≤ –µ–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є, —П–њ–Њ–љ—Б–Ї–Њ–є –Є –Љ–µ–Ї—Б–Є–Ї–∞–љ—Б–Ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є—П—Е. –І–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –Љ—Г—В–∞–љ—В–љ–Њ–≥–Њ –∞–ї–ї–µ–ї—П FTO —Б–Њ—Б—В–∞–≤–ї—П–µ—В 46–51% —Б—А–µ–і–Є –ґ–Є—В–µ–ї–µ–є –Ч–∞–њ–∞–і–љ–Њ–є –Є –¶–µ–љ—В—А–∞–ї—М–љ–Њ–є –Х–≤—А–Њ–њ—Л, –Ч–∞–њ–∞–і–љ–Њ–є –Р—Д—А–Є–Ї–Є –Є —В–Њ–ї—М–Ї–Њ 16% – –≤ –Ъ–Є—В–∞–µ [10, 11].
–Т–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –≤–µ–ї–Є—З–Є–љ—Л –ґ–Є—А–Њ–≤–Њ–є –Љ–∞—Б—Б—Л –Є–≥—А–∞–µ—В –Є –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ –≥–µ–љ–∞ b3-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (ADRB3), –Ї–Њ—В–Њ—А—Л–є —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –≥–µ–љ–∞-–Ї–∞–љ–і–Є–і–∞—В–∞ –Њ–ґ–Є—А–µ–љ–Є—П. –Ь—Г—В–∞—Ж–Є—П –≤ –Ї–Њ–і–Њ–љ–µ 64 –Є–Ј ADRB3 –њ—А–Є–≤–Њ–і–Є—В –Ї –Ј–∞–Љ–µ–љ–µ —В—А–Є–њ—В–Њ—Д–∞–љ–∞ –љ–∞ –∞—А–≥–Є–љ–Є–љ (Trp64Arg) –≤ –±–µ–ї–Ї–µ —А–µ—Ж–µ–њ—В–Њ—А–∞ –Є –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ 11 —В—Л—Б. —З–µ–ї–Њ–≤–µ–Ї —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –Љ—Г—В–∞—Ж–Є—П Trp64Arg –≥–µ–љ–∞ ADRB3 —И–Є—А–Њ–Ї–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–∞ –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —Н—В–љ–Є—З–µ—Б–Ї–Є—Е –≥—А—Г–њ–њ–∞—Е –Є —Б–≤—П–Ј–∞–љ–∞ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Љ–∞—Б—Б—Л —В–µ–ї–∞, –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л–Љ –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М—О –Ї –Є–љ—Б—Г–ї–Є–љ—Г –Є –±–Њ–ї–µ–µ —А–∞–љ–љ–Є–Љ (–љ–∞ 22 –≥–Њ–і–∞ —А–∞–љ—М—И–µ) —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞ (–°–Ф) 2-–≥–Њ —В–Є–њ–∞ [12, 13].
–Ч–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ—Б–≤—П—Й–µ–љ–Њ –≥–µ–љ–∞–Љ, —Б–≤—П–Ј–∞–љ–љ—Л–Љ —Б —Н–љ–µ—А–≥–Њ—В—А–∞—В–∞–Љ–Є, —В–∞–Ї–Є–Љ –Ї–∞–Ї –≥–µ–љ—Л, –Ї–Њ–і–Є—А—Г—О—Й–Є–µ –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ—Л–µ —А–∞–Ј–Њ–±—Й–∞—О—Й–Є–µ –±–µ–ї–Ї–Є (UCPs), –Ї–Њ—В–Њ—А—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є —Б–µ–Љ–µ–є—Б—В–≤–Њ –Љ–µ–Љ–±—А–∞–љ–љ—Л—Е –±–µ–ї–Ї–Њ–≤, –љ–Њ—Б–Є—В–µ–ї–µ–є –∞–љ–Є–Њ–љ–Њ–≤, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –љ–∞ –≤–љ—Г—В—А–µ–љ–љ–µ–є –Љ–µ–Љ–±—А–∞–љ–µ –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–є [14]. –Э–∞–Є–±–Њ–ї–µ–µ –Є–Ј—Г—З–µ–љ–љ—Л–Љ –≤ —Н—В–Њ–Љ –њ–ї–∞–љ–µ —П–≤–ї—П–µ—В—Б—П –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ rs659366 –≥–µ–љ–∞ —А–∞–Ј–Њ–±—Й–∞—О—Й–µ–≥–Њ –±–µ–ї–Ї–∞ 2 (UCP2) – –Ї–ї—О—З–µ–≤–Њ–≥–Њ —А–µ–≥—Г–ї—П—В–Њ—А–∞ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –±–∞–ї–∞–љ—Б–∞. –Ю–љ –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В –љ–∞ –≤–љ—Г—В—А–µ–љ–љ–µ–є –Љ–µ–Љ–±—А–∞–љ–µ –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–є, –Њ–њ–Њ—Б—А–µ–і—Г–µ—В —Г—В–µ—З–Ї—Г –њ—А–Њ—В–Њ–љ–Њ–≤ —З–µ—А–µ–Ј –≤–љ—Г—В—А–µ–љ–љ—О—О –Љ–µ–Љ–±—А–∞–љ—Г –њ—Г—В–µ–Љ —А–∞–Ј–Њ–±—Й–µ–љ–Є—П –Њ–Ї–Є—Б–ї–µ–љ–Є—П –Р–Ґ–§, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ —Г–Љ–µ–љ—М—И–∞—П –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–Њ –Р–Ґ–§ –≤ –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ–Њ–є –і—Л—Е–∞—В–µ–ї—М–љ–Њ–є —Ж–µ–њ–Є. –≠—Д—Д–µ–Ї—В–Њ–Љ UCP2 –Љ–Њ–ґ–µ—В –±—Л—В—М –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≥–ї—О–Ї–Њ–Ј–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–∞ [15].
–Ь–µ—В–∞–∞–љ–∞–ї–Є–Ј, –≤–Ї–ї—О—З–∞—О—Й–Є–є 12 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞ rs659366 –≥–µ–љ–∞ UCP2, —Б –Њ–±—Й–Є–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е 7390 (–Ї–Њ–љ—В—А–Њ–ї—М–љ–∞—П –≥—А—Г–њ–њ–∞) –Є 9890 (–њ–∞—Ж–Є–µ–љ—В—Л —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ), –њ–Њ–Ї–∞–Ј–∞–ї —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Г—О –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—О —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ —Г –≤—Л—Е–Њ–і—Ж–µ–≤ –Є–Ј –Х–≤—А–Њ–њ—Л, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –≤—Л—Е–Њ–і—Ж–µ–≤ –Є–Ј –Р–Ј–Є–Є, –≥–і–µ —Б–≤—П–Ј–Є —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ [16].
–Я–∞—В–Њ–≥–µ–љ–µ–Ј –Њ–ґ–Є—А–µ–љ–Є—П —Б–≤—П–Ј–∞–љ —Б –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є –Њ–±–Љ–µ–љ–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є, –љ–∞—А—Г—И–µ–љ–љ–Њ–є —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї –≥–ї—О–Ї–Њ–Ј–µ –Є —А–∞–Ј–≤–Є—В–Є—О –°–Ф 2-–≥–Њ —В–Є–њ–∞, –Ї–Њ—В–Њ—А—Л–є –≤–Ї–ї—О—З–∞–µ—В –Ї–Њ–Љ–њ–ї–µ–Ї—Б –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є—Е—Б—П –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ —Б–µ–Ї—А–µ—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–∞ –Є –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М—О. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —Б–µ–Ї—А–µ—Ж–Є—О –Є–љ—Б—Г–ї–Є–љ–∞ β-–Ї–ї–µ—В–Ї–∞–Љ–Є –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —А–µ–≥—Г–ї–Є—А—Г–µ—В –Р–Ґ–§-–Ј–∞–≤–Є—Б–Є–Љ—Л–є –Ї–∞–ї–Є–µ–≤—Л–є –Ї–∞–љ–∞–ї –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –≤–ї–Є—П–љ–Є—П –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –≥–ї—О–Ї–Њ–Ј—Л –љ–∞ —Г—А–Њ–≤–љ–µ –Љ–µ–Љ–±—А–∞–љ –Ї–ї–µ—В–Њ–Ї. –Э–∞–Є–±–Њ–ї–µ–µ –Є–Ј—Г—З–µ–љ–љ—Л–Љ –≤ —Ж–µ–ї–Њ–Љ —А—П–і–µ —Н—В–љ–Є—З–µ—Б–Ї–Є—Е –≥—А—Г–њ–њ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —П–≤–ї—П–µ—В—Б—П –њ–Њ–ї–Є–Љ–Њ—А—Д–љ—Л–є –Љ–∞—А–Ї–µ—А —Н—В–Њ–≥–Њ –≥–µ–љ–∞ rs5219, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Ј–∞–Љ–µ–љ–∞ —Ж–Є—В–Њ–Ј–Є–љ–∞ –љ–∞ —В–Є–Љ–Є–љ –≤ –њ–Њ–Ј–Є—Ж–Є–Є 67, –њ—А–Є–≤–Њ–і—П—Й–∞—П –Ї –Ј–∞–Љ–µ–љ–µ –≥–ї—Г—В–∞–Љ–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤ –њ–Њ–Ј–Є—Ж–Є–Є 23 –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–љ–Њ–є –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–Є –±–µ–ї–Ї–∞ –љ–∞ –ї–Є–Ј–Є–љ [17–20].
–Я–Њ–Ї–∞–Ј–∞–љ–∞ –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П —Н—В–Њ–≥–Њ –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞ —Б —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –°–Ф 2-–≥–Њ —В–Є–њ–∞ —Г –µ–≤—А–Њ–њ–µ–є—Ж–µ–≤, –≤ –Є–љ–і–Њ–µ–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є —Н—В–љ–Є—З–µ—Б–Ї–Њ–є –≥—А—Г–њ–њ–µ, —Г –∞–Љ–µ—А–Є–Ї–∞–љ—Ж–µ–≤ –µ–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П, —П–њ–Њ–љ—Ж–µ–≤ –Є –Ї–Є—В–∞–є—Ж–µ–≤ [21–25]. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —Б–≤—П–Ј—М –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞ rs5219 –≥–µ–љ–∞ KCNJ11 —Б —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –°–Ф 2-–≥–Њ —В–Є–њ–∞ —Г –ґ–Є—В–µ–ї–µ–є –∞—А–∞–±—Б–Ї–Є—Е –≥–Њ—Б—Г–і–∞—А—Б—В–≤, –∞ —Г –ґ–Є—В–µ–ї–µ–є –ѓ–њ–Њ–љ–Є–Є –Є –Ѓ–ґ–љ–Њ–є –Ъ–Њ—А–µ–Є – —В–∞–Ї–ґ–µ —Б–≤—П–Ј—М –Є —Б —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є [26–28]. –Т —В—Г—А–µ—Ж–Ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –≤—Л—П–≤–ї–µ–љ–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–∞—П —Б–≤—П–Ј—М –∞–ї–ї–µ–ї—П –Ґ —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П —Б–µ–Ї—А–µ—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–∞ [29].
–†–∞–љ–µ–µ –љ–∞–Љ–Є –±—Л–ї–∞ –Є–Ј—Г—З–µ–љ–∞ —Б–≤—П–Ј—М –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–Њ–≤ rs9939609 –≥–µ–љ–∞ FTO –Є Trp64Arg –≥–µ–љ–∞ ADRB3 —Б —А–Є—Б–Ї–Њ–Љ –Њ–ґ–Є—А–µ–љ–Є—П —Г –ґ–Є—В–µ–ї–µ–є —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–≥–Є–Њ–љ–Њ–≤ –†–Њ—Б—Б–Є–Є [30–33].
–¶–µ–ї—М—О –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —П–≤–Є–ї–Њ—Б—М –Є–Ј—Г—З–µ–љ–Є–µ –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞ 4 –≥–µ–љ–Њ–≤ c –Њ–ґ–Є—А–µ–љ–Є–µ–Љ —Г –ґ–Є—В–µ–ї–µ–є –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є.
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л
–Т –Ї–Њ–љ—Б—Г–ї—М—В–∞—В–Є–≤–љ–Њ-–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–Љ —Ж–µ–љ—В—А–µ «–Ч–і–Њ—А–Њ–≤–Њ–µ –њ–Є—В–∞–љ–Є–µ» –§–У–С–Э–£ «–Э–Ш–Ш –њ–Є—В–∞–љ–Є—П» –њ—А–Њ–≤–µ–і–µ–љ–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Є—Й–µ–≤–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ 3580 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В – 48,4±0,3 –≥–Њ–і–∞), –њ—А–Њ–ґ–Є–≤–∞—О—Й–Є—Е –≤ –†–§, –Є–Ј –љ–Є—Е 34,1% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ–ї–Є –Ш–Ь–Ґ >30 –Ї–≥/–Љ2.
–С–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –ї–Є–њ–Є–і–љ–Њ–≥–Њ, –±–µ–ї–Ї–Њ–≤–Њ–≥–Њ –Є —Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, –Њ–њ—А–µ–і–µ–ї—П–ї–Є c –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–∞ «ABX PENTRA 400» (HORIBA ABX SAS, –§—А–∞–љ—Ж–Є—П) –≤ –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ —А–µ–ґ–Є–Љ–µ.
–Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Б–Њ—Б—В–∞–≤–∞ —В–µ–ї–∞ (—Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≤–Њ–і—Л, –∞–±—Б–Њ–ї—О—В–љ–Њ–є –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є –Љ–∞—Б—Б—Л –Љ—Л—И–µ—З–љ–Њ–є –Є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є) –њ—А–Њ–≤–Њ–і–Є–ї–Є –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –њ—А–Њ–≥—А–∞–Љ–Љ–љ–Њ–≥–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П «Looking`Body» –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–∞ «InBody 720» (Biospac, –Ъ–Њ—А–µ—П).
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Н–љ–µ—А–≥–Њ—В—А–∞—В –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є –њ–Њ–Ї–Њ—П –≤—Л–њ–Њ–ї–љ—П–ї–Є –Љ–µ—В–Њ–і–Њ–Љ –љ–µ–њ—А—П–Љ–Њ–є –Ї–∞–ї–Њ—А–Є–Љ–µ—В—А–Є–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ—А—В–∞—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Њ–≥—А–∞—Д–∞ «VO2000» (MedGraphics, C–®–Р).
–Ф–ї—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞ –≥–µ–љ–Њ–≤ –Ф–Э–Ъ –≤—Л–і–µ–ї—П–ї–Є –Є–Ј –Ї—А–Њ–≤–Є —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–љ–Њ–≥–Њ–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–љ–Њ–≥–Њ –ї–Є–Ј–Є—А—Г—О—Й–µ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞, —А–∞–Ј—А—Г—И–∞—О—Й–µ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б –Ф–Э–Ъ —Б –±–µ–ї–Ї–Њ–Љ –Є —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —Б–Њ—А–±—Ж–Є–µ–є –љ–∞ –Љ–∞–≥–љ–Є—В–љ—Л–µ —З–∞—Б—В–Є—Ж—Л, –њ–Њ–Ї—А—Л—В—Л–µ —Б–Є–ї–Є–Ї–∞–≥–µ–ї–µ–Љ, –Є –љ–∞–±–Њ—А–∞ —А–µ–∞–≥–µ–љ—В–Њ–≤ «–†–µ–∞–ї–С–µ—Б—В –Ф–Э–Ъ-—Н–Ї—Б—В—А–∞–Ї—Ж–Є—П 3» (–Ч–Р–Ю «–Т–µ–Ї—В–Њ—А-–С–µ—Б—В», –Э–Њ–≤–Њ—Б–Є–±–Є—А—Б–Ї, –†–§). –Т—Л–і–µ–ї–µ–љ–Є–µ –Ф–Э–Ъ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є –љ–∞ –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —Б—В–∞–љ—Ж–Є–Є «epMotion 5075» (Eppendorf, –У–µ—А–Љ–∞–љ–Є—П).
–У–µ–љ–Њ—В–Є–њ–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –∞–ї–ї–µ–ї—М-—Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ–є –∞–Љ–њ–ї–Є—Д–Є–Ї–∞—Ж–Є–Є —Б –і–µ—В–µ–Ї—Ж–Є–µ–є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –≤ —А–µ–ґ–Є–Љ–µ —А–µ–∞–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ TaqMan-–Ј–Њ–љ–і–Њ–≤, –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞—А–љ—Л—Е –њ–Њ–ї–Є–Љ–Њ—А—Д–љ—Л–Љ —Г—З–∞—Б—В–Ї–∞–Љ –Ф–Э–Ъ [23]. –Ф–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –∞–Љ–њ–ї–Є—Д–Є–Ї–∞—Ж–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –∞–Љ–њ–ї–Є—Д–Є–Ї–∞—В–Њ—А «CFX96 Real Time System» (BIO-RAD, –°–®–Р).
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї—Г—О –Њ–±—А–∞–±–Њ—В–Ї—Г –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б–Є—Б—В–µ–Љ—Л PASW Statistics 20. –Ґ–µ—Б—В—Л –љ–∞ —Б–Њ–±–ї—О–і–µ–љ–Є–µ —А–∞–≤–љ–Њ–≤–µ—Б–Є—П –•–∞—А–і–Є – –Т–∞–є–љ–±–µ—А–≥–∞ –Є –≤—Л—П–≤–ї–µ–љ–Є–µ –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–є –Љ–µ—В–Њ–і–Њ–Љ –Я–Є—А—Б–Њ–љ–∞ χ2 –≤—Л–њ–Њ–ї–љ—П–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –њ—А–Њ–≥—А–∞–Љ–Љ—Л DeFinetti –љ–∞ —Б–∞–є—В–µ –Ш–љ—Б—В–Є—В—Г—В–∞ –≥–µ–љ–µ—В–Є–Ї–Є —З–µ–ї–Њ–≤–µ–Ї–∞ (–Ь—О–љ—Е–µ–љ, –У–µ—А–Љ–∞–љ–Є—П).
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Р–љ–∞–ї–Є–Ј —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–Њ–≤ –≥–µ–љ–Њ–≤: rs9939609 –≥–µ–љ–∞ –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є FTO, rs4994 –≥–µ–љ–∞ β3-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–∞ (ADRB3), rs659366 –≥–µ–љ–∞ —А–∞–Ј–Њ–±—Й–∞—О—Й–µ–≥–Њ –±–µ–ї–Ї–∞ 2 (UCP2), rs5219 –≥–µ–љ–∞ –Р–Ґ–§-–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ –Ї–∞–ї–Є–µ–≤–Њ–≥–Њ –Ї–∞–љ–∞–ї–∞ (KCNJ11) —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї –Њ –љ–∞–ї–Є—З–Є–Є —Б–≤—П–Ј–Є —Н—В–Є—Е –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–Њ–≤ —Б —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Њ–ґ–Є—А–µ–љ–Є—П —Г –љ–∞—Б–µ–ї–µ–љ–Є—П –†–Њ—Б—Б–Є–Є.
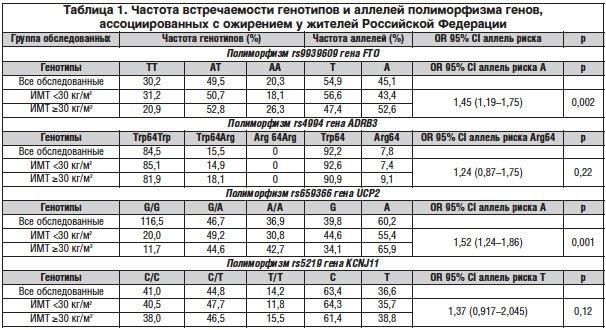
–Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј —В–∞–±–ї–Є—Ж—Л 1, —Г –ґ–Є—В–µ–ї–µ–є –љ–µ–Ї–Њ—В–Њ—А—Л—Е —А–µ–≥–Є–Њ–љ–Њ–≤ –†–§ (–Ь–Њ—Б–Ї–Њ–≤—Б–Ї–Њ–≥–Њ –Є –°–≤–µ—А–і–ї–Њ–≤—Б–Ї–Њ–≥–Њ) –Њ—В–Љ–µ—З–∞–ї–∞—Б—М –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —З–∞—Б—В–∞—П –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В—М –Љ—Г—В–∞–љ—В–љ–Њ–≥–Њ –∞–ї–ї–µ–ї—П rs9939609 –≥–µ–љ–∞ FTO (47,8%). –Я—А–Є —Н—В–Њ–Љ —Г –ґ–µ–љ—Й–Є–љ –љ–∞–ї–Є—З–Є–µ –Љ—Г—В–∞–љ—В–љ–Њ–≥–Њ –∞–ї–ї–µ–ї—П –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —З–∞—Й–µ, —З–µ–Љ —Г –Љ—Г–ґ—З–Є–љ (48,4 –њ—А–Њ—В–Є–≤ 42,5%). –У–µ–љ–Њ—В–Є–њ –Ґ–Ґ –±—Л–ї –≤—Л—П–≤–ї–µ–љ –≤ 30,2% —Б–ї—Г—З–∞–µ–≤, –Р–Ґ – –≤ 49,5%, –Р–Р – –≤ 20,3%.
–£ –ї–Є—Ж —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б–њ—Л—В—Г–µ–Љ—Л–Љ–Є —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П —З–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є (—Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 52,9 –Є 45%) –∞–ї–ї–µ–ї—П —А–Є—Б–Ї–∞ –Р (OR – 1,67, CI 1,20–2,31, p=0,02). –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–Љ –Ш–Ь–Ґ —Г –ї–Є—Ж —Б –Р–Ґ- (—А<0,01) –Є –Њ—Б–Њ–±–µ–љ–љ–Њ –Р–Р- (—А<0,001) –≥–µ–љ–Њ—В–Є–њ–Њ–Љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ґ–Ґ-—В–Є–њ–Њ–Љ –≥–µ–љ–∞ FTO, —З—В–Њ —Б–Њ—З–µ—В–∞–ї–Њ—Б—М —Г –љ–Є—Е —Б –±–Њ–ї—М—И–µ–є –≤–µ–ї–Є—З–Є–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є –Љ–∞—Б—Б—Л –Є —Г—А–Њ–≤–љ–µ–Љ —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є.
–°—А–µ–і–Є –љ–∞—Б–µ–ї–µ–љ–Є—П –Ь–Њ—Б–Ї–Њ–≤—Б–Ї–Њ–≥–Њ –Є –°–≤–µ—А–і–ї–Њ–≤—Б–Ї–Њ–≥–Њ —А–µ–≥–Є–Њ–љ–Њ–≤ –љ–∞–ї–Є—З–Є–µ –Љ—Г—В–∞–љ—В–љ–Њ–≥–Њ –∞–ї–ї–µ–ї—П –≥–µ–љ–∞ ADRB3 –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –≤ 7,8% —Б–ї—Г—З–∞–µ–≤. –Я—А–Є —Н—В–Њ–Љ 15,5% –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –Є–Љ–µ–ї–Є –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ—Л–є Trp64Arg –≥–µ–љ–Њ—В–Є–њ ADRB3, —З—В–Њ —Б–Њ–≥–ї–∞—Б—Г–µ—В—Б—П —Б –і–∞–љ–љ—Л–Љ–Є –Ј–∞—А—Г–±–µ–ґ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –І–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –∞–ї–ї–µ–ї—П —А–Є—Б–Ї–∞ Arg64 –Є –≥–µ–љ–Њ—В–Є–њ–∞ Trp64Arg —Г –ґ–µ–љ—Й–Є–љ (—Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 9,3 –Є 18,5%) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–∞–Ї–Њ–≤–Њ–є —Г –Љ—Г–ґ—З–Є–љ (6,2 –Є 12,2%) –±—Л–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ.
–£ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –љ–∞–ї–Є—З–Є–µ –Љ—Г—В–∞–љ—В–љ–Њ–≥–Њ –∞–ї–ї–µ–ї—П –Є Trp64Arg –≥–µ–љ–Њ—В–Є–њ–∞ ADRB3 (—Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 9,1 –Є 18,1%) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –ї–Є—Ж–∞–Љ–Є —Б –Ш–Ь–Ґ <30 –Ї–≥/–Љ2 (7,4 –Є 14,9%), –Њ–і–љ–∞–Ї–Њ —Н—В–Є —А–∞–Ј–ї–Є—З–Є—П –±—Л–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л. –Я—А–Є —Н—В–Њ–Љ —Г –љ–Њ—Б–Є—В–µ–ї–µ–є –Љ—Г—В–∞–љ—В–љ–Њ–≥–Њ –∞–ї–ї–µ–ї—П –≤ –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–ї–Є—Б—М –Њ–ґ–Є—А–µ–љ–Є–µ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є—Е —Б—В–µ–њ–µ–љ–µ–є, –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ –Є –°–Ф 2-–≥–Њ —В–Є–њ–∞, –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б—А–µ–і–љ–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ш–Ь–Ґ, –ґ–Є—А–Њ–≤–Њ–є –Љ–∞—Б—Б—Л (—А<0,05), –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л –Є –Љ–Њ—З–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є.
–Я—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є –≥–µ–љ–Њ—В–Є–њ–∞ Trp64Arg —Б –Р–Ґ- –Є –Р–Р-–≥–µ–љ–Њ—В–Є–њ–∞–Љ–Є FTO —Г –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ –Ш–Ь–Ґ, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –љ–∞ 11% (—А<0,05) –Є 12% (—А<0,001), –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–µ–Љ–Є –ї–Є—Ж–∞–Љ–Є, —Г –Ї–Њ—В–Њ—А—Л—Е –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–∞ –Љ—Г—В–∞—Ж–Є—П –Њ–±–Њ–Є—Е –≥–µ–љ–Њ–≤ (Trp64/–Ґ–Ґ).
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞ rs659366 –≥–µ–љ–∞ UCP2 –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ 36,9% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ–ї–Є –≥–µ–љ–Њ—В–Є–њ –Р–Р, 46,7% – –≥–µ–љ–Њ—В–Є–њ AG –Є —В–Њ–ї—М–Ї–Њ 16,5% – –≥–µ–љ–Њ—В–Є–њ GG. –І–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –∞–ї–ї–µ–ї—П –Р —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 60,2%, –∞–ї–ї–µ–ї—П G – 39,8%. –Я—А–Є —Н—В–Њ–Љ —Г –љ–Њ—Б–Є—В–µ–ї–µ–є –∞–ї–ї–µ–ї—П –Р –≤ –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–Њ–Љ –Є –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є –Ш–Ь–Ґ –≤–µ–ї–Є—З–Є–љ–∞ –ґ–Є—А–Њ–≤–Њ–є –Љ–∞—Б—Б—Л, –њ–ї–Њ—Й–∞–і—М –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –ґ–Є—А–∞, –∞ —В–∞–Ї–ґ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –≥–ї—О–Ї–Њ–Ј—Л –Є —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ –±—Л–ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ, —З–µ–Љ —Г –љ–Њ—Б–Є—В–µ–ї–µ–є –∞–ї–ї–µ–ї—П G –≤ –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є. –І–∞—Б—В–Њ—В–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є—П –Љ—Г—В–∞–љ—В–љ–Њ–≥–Њ –∞–ї–ї–µ–ї—П –Р –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б «–і–Є–Ї–Є–Љ» –∞–ї–ї–µ–ї–µ–Љ G —Г –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ (–Ш–Ь–Ґ >30 –Ї–≥/–Љ2) —Б–Њ—Б—В–∞–≤–Є–ї–∞: OR – 1,52, CI 1,24–1,86, p=0,001.
–І–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –Љ—Г—В–∞–љ—В–љ–Њ–≥–Њ –∞–ї–ї–µ–ї—П –Ґ rs5219 –≥–µ–љ–∞ KCNJ11 —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 36,6%. –£ –Љ—Г–ґ—З–Є–љ, –Є–Љ–µ—О—Й–Є—Е –≥–µ–љ–Њ—В–Є–њ –Ґ–Ґ, –њ—А–Є –≥–Њ–Љ–Њ- –Є –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ–Њ–Љ —В–Є–њ–∞—Е –≤–µ–ї–Є—З–Є–љ–∞ —Н–љ–µ—А–≥–Њ—В—А–∞—В –≤ –њ–Њ–Ї–Њ–µ, —А–∞—Б—Б—З–Є—В–∞–љ–љ–∞—П –љ–∞ 1 –Ї–≥ –Љ—Л—И–µ—З–љ–Њ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞, –±—Л–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–Є–ґ–µ. –£ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ (–Ш–Ь–Ґ ≥30 –Ї–≥/–Љ2) —З–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –Љ—Г—В–∞–љ—В–љ–Њ–≥–Њ –∞–ї–ї–µ–ї—П –Ґ –±—Л–ї–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≤—Л—И–µ, –љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–∞—Б—М –Њ—В —З–∞—Б—В–Њ—В—Л —Г –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е —Б –Ш–Ь–Ґ <30 –Ї–≥/–Љ2 (—Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 38,8 –Є 35,7%), OR – 1,14, CI 0,907–1,439, p=0,26. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤–µ–ї–Є—З–Є–љ–∞ —Н–љ–µ—А–≥–Њ—В—А–∞—В –≤ –њ–Њ–Ї–Њ–µ, —А–∞—Б—Б—З–Є—В–∞–љ–љ–∞—П –љ–∞ 1 –Ї–≥ –Љ—Л—И–µ—З–љ–Њ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞, –±—Л–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–Є–ґ–µ —Г –Љ—Г–ґ—З–Є–љ, –Є–Љ–µ—О—Й–Є—Е –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ rs5219 –≥–µ–љ–∞ KCNJ11, –Ї–∞–Ї –њ—А–Є –≥–Њ–Љ–Њ-, —В–∞–Ї –Є –њ—А–Є –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ–Њ–Љ —В–Є–њ–µ.
–Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–µ–є —З–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –∞–ї–ї–µ–ї—П –Ґ rs5219 –≥–µ–љ–∞ KCNJ11 –±—Л–ї–∞ –≤—Л—И–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П, –љ–∞ 7,6%, –∞ –≥–µ–љ–Њ—В–Є–њ–∞ –Ґ–Ґ – –љ–∞ 13,0%. –Т—Л—П–≤–ї–µ–љ–∞ –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –≥–µ–љ–Њ—В–Є–њ–∞ –Ґ–Ґ —Б —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –°–Ф 2-–≥–Њ —В–Є–њ–∞ (OR=2,35, CI 1,018–5,43, p=0,04).
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ –Є–Ј—Г—З–µ–љ–љ—Л—Е –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –≤–∞—А–Є–∞–љ—В–Њ–≤: rs9939609 –≥–µ–љ–∞ –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є FTO, rs4994 –≥–µ–љ–∞ β3-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–∞ (ADRB3), rs659366 –≥–µ–љ–∞ —А–∞–Ј–Њ–±—Й–∞—О—Й–µ–≥–Њ –±–µ–ї–Ї–∞ 2 (UCP2), rs5219 –≥–µ–љ–∞ KCNJ11 –≤–љ–Њ—Б–Є—В —Б–≤–Њ–є –≤–Ї–ї–∞–і –≤ —А–∞–Ј–≤–Є—В–Є–µ –Њ–ґ–Є—А–µ–љ–Є—П –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є —Г –ґ–Є—В–µ–ї–µ–є –†–§. –Я—А–Є —Н—В–Њ–Љ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Њ–ґ–Є—А–µ–љ–Є—П —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –≤ —Б–ї—Г—З–∞–µ –љ–∞–ї–Є—З–Є—П —Б–Њ—З–µ—В–∞–љ–љ–Њ–≥–Њ –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞ —Н—В–Є—Е –≥–µ–љ–Њ–≤.
–І–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –∞–ї–ї–µ–ї–µ–є —А–Є—Б–Ї–∞ –Њ–ґ–Є—А–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 7,8–60,2%, —З—В–Њ —Б–Њ—З–µ—В–∞–ї–Њ—Б—М —Б —А–∞–Ј–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ—Б—В—М—О –Є—Е —А–∞—Ж–Є–Њ–љ–∞ –њ–Є—В–∞–љ–Є—П –Є –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –њ–Є—Й–µ–≤–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ (—Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ш–Ь–Ґ, –ґ–Є—А–Њ–≤–Њ–є –Љ–∞—Б—Б—Л –Є –њ–ї–Њ—Й–∞–і–Є –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –ґ–Є—А–∞, —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–ї—О–Ї–Њ–Ј—Л, —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤, –Љ–Њ—З–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є).
–Я—А–Њ–≤–µ–і–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П—О—В –Њ—Б—Г—Й–µ—Б—В–≤–Є—В—М –њ–µ—А—Б–Њ–љ–∞–ї—М–љ—Г—О –∞–ї–Є–Љ–µ–љ—В–∞—А–љ—Г—О –Ї–Њ—А—А–µ–Ї—Ж–Є—О –љ–∞—А—Г—И–µ–љ–Є–є –њ–Є—Й–µ–≤–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. International Obesity Taskforce: Obesity the global epidemic [http://www.iaso.org/iotf/ obesity/obesitytheglobalepidemic].
2. Shaw J.E., Sicree R.A., Zimmet P.Z. Global estimates of the prevalence of diabetes for 2010 and 2030 // Res Clin Pract. 2010. Vol. 87. –†. 4–14.
3. McCarthy M.I. Genomics, type 2 diabetes, and obesity // N Engl J Med. 2010. Vol. 363. –†. 2339–2350.
4. Wang C.P., Chung F.M., Shin S.J., Lee Y.J. Congenital and environmental factors associated with adipocyte dysregulation as defects of insulin resistance // Rev Diabet Stud. 2007. Vol. 4. –†. 77–84.
5. Carlos F., Silva-Nunes –°.J et al. Association of FTO and PPARG polymorphisms with obesity in Portuguese women // Diabetes, Metabolic Syndrome and Obesity // Targets and Therapy. 2013. Vol. 6. –†. 241–245.
6. Marcadenti –Р., Fuchs F.D. Effects of FTO rs9939609 and MC4R rs17782313 on obesity, type 2 diabetes mellitus and blood pressure in patients with hypertension // Cardiovascular Diabetology. 2013. Vol. 12. –†. 103.
7. Silva –°.F., Zandoná M.R. et al. Association between a frequent variant of the FTO gene and anthropometric phenotypes in Brazilian children // BMC Medical Genetics. 2013. Vol. 14. –†. 34.
8. Mitchell J., Church T., Rankinen T. et al. FTO Genotype and the Weight Loss Benefits of Moderate Intensity Exercise // Obesity. 2010. Vol. 18. –†. 641–643.
9. Zimmermann E., Skogstrand K., Hougaar D.M. et al. Influences of the Common FTO rs9939609 Variant on Inflammatory Markers Throughout a Broad Range of Body Mass Index // PLoS One. 2011. Vol. 5. –†. 5958.
10. Hennig B., Fulford A., Sirugo G. et al. Prentice A. M. FTO gene variation and measures of body mass in an African population // BMC Medical Genetics. 2009. Vol. 10. –†. 21.
11. Legry V., Cottela D, Ferrieresb J. et al. Effect of an FTO polymorphism on fat mass, obesity, and type 2 diabetes mellitus in the French MONICA Study // Metabolism Clinical and Experimental. 2009. –†. 971–975.
12. De Luis D., Sagrado –Ь., Aller R. et al. Influence of the Trp64Arg polymorphism in the beta 3 adrenoreceptor gene on insulin resistance, adipocytokine response, and weight loss secondary to lifestyle modification in obese patients // European J. of Internal Medicine. 2007. Vol. 18. –†. 587–592.
13.Thomas G., Tomlinson B., Chang J. et al. The Trp64Arg polymorphism of the beta 3 adrenergic receptor gene and obesity in Chinese subjects with components of the metabolic syndrome // Int. J.Obes. Relat. Metab. Disord. 2000. Vol. 25. –†. 545–551.
14. Dalgaard L.T. Genetic Variance in Uncoupling Protein 2 in Relation to Obesity, Type 2 Diabetes, and RelatedMetabolic Traits: Focus on the Functional −866G>A Promoter Variant (rs659366) // Journal of Obesity. 2011. вДЦ 2. P. 1–12.
15. Chan C.B., Kashemsant N. Regulation of insulin secretion by uncoupling protein // Biochem Soc Trans. 2006. Vol. 34. –†. 802–805.
16. Li Qian, Kuanfeng X., Xinyu X. et al. UCP2 -866G/A, Ala55Val and UCP3 -55C/T Polymorphisms in Association with Obesity Susceptibility — A Meta-Analysis Study // PLoS One. 2013. Vol. 8, вДЦ 4. –†. 58939.
17. Mao H., Li. Q, Gao S. Meta-Analysis of the Relationship between Common Type 2 Diabetes Risk Gene Variants with Gestational Diabetes Mellitus // PLoS One. 2012. Vol. 7. Issue 9. –†. 45882.
18. Omar A. Genetics of type 2 diabetes // World J Diabetes. 2013. Vol. 4. P. 114–123.
19. Qiu L., Na R., Xu R. et al. Quantitative Assessment of the Effect of KCNJ11 Gene Polymorphism on the Risk of Type 2 Diabetes // PLoS One. 2014. Vol. 9. –†. 93961.
20. Qin L., Lv Y., Huang Q. Meta-analysis of association of common variants in the KCNJ11-ABCC8 region with type 2 diabetes // Genetics and Molecular Research. 2013. Vol. 12. вДЦ 3. P. 2990–3002.
21. Cejkova´ P., Novota P., Cerna´ M. et al. KCNJ11 E23K polymorphism and diabetes mellitus with adult onset in Czech patients // Folia Biol (Praha). 2007. Vol. 53. P. 173–175.
22. Chauhan G., Spurgeon C., Tabassum R. et al. Impact of common variants of PPARG, KCNJ11, TCF7L2, SLC30A8, HHEX, CDKN2A, IGF2BP2 and CDKAL1 on the risk of type 2 diabetes in 5164 Indians // Diabetes. 2010. Vol. 59. P. 2068–2074.
23. Lyssenko V., Jonsson A., Almgren P. et al. Clinical risk factors, DNA variants, and the development of type 2 diabetes // N Engl J Med. 2008. Vol. 359. P. 2220–2232.
24. Takeuchi F., Serizawa M., Yamamoto K. et al. Confirmation of multiple risk Loci and genetic impacts by a genome-wide association study of type 2 diabetes in the Japanese population // Diabetes. 2009. Vol. 58. P. 1690–1699.
25. Hu C., Zhang R., Wang C. et al. PPARG, KCNJ11, CDKAL1, CDKN2A-CDKN2B, IDE-KIF11-HHEX, IGF2BP2 and SLC30A8 are associated with type 2 diabetes in a Chinese population // PLoS One 4. 2009. –†. 7643.
26. Ezzidi I., Mtiraoui N., Cauchi S. et al. Contribution of type 2 diabetes associated loci in the Arabic population from Tunisia: a case-control study // BMC Med Genet. 2009. Vol. 15. P. 10–33.
27. Koo B., Cho Y., Park B. et al. Polymorphisms of KCNJ11 (Kir6.2 gene) are associated with Type 2 diabetes and hypertension in the Korean population // Diabet Med. 2007. Vol. 24. P. 178–186.
28. Sakamoto Y., Inoue H., Keshavarz P. et al. SNPs in the KCNJ11-ABCC8 gene locus are associated with type 2 diabetes and blood pressure levels in the Japanese population // J Hum Genet. 2007. Vol. 52. P. 781–793.
29. Gonen M., Arikoglu H., Erkoc K. et al. Effects of single nucleotide polymorphisms in K(ATP) channel genes on type 2 diabetes in a Turkish population // Arch Med Res. 2012. Vol. 43. P. 317–323.
30. –С–∞—В—Г—А–Є–љ –Р.–Ъ., –Я–Њ–≥–Њ–ґ–µ–≤–∞ –Р.–Т., –°–Њ—А–Њ–Ї–Є–љ–∞ –Х.–Ѓ., –Ь–∞–Ї—Г—А–Є–љ–∞ –Ю.–Э., –Ґ—Г—В–µ–ї—М—П–љ –Т.–Р. –Ш–Ј—Г—З–µ–љ–Є–µ –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞ rs9939609 –≥–µ–љ–∞ FTO —Г –ї–Є—Ж —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –Є –Њ–ґ–Є—А–µ–љ–Є–µ–Љ // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. 2011. вДЦ 3. –°. 13–17.
31. –С–∞—В—Г—А–Є–љ –Р.–Ъ., –Я–Њ–≥–Њ–ґ–µ–≤–∞ –Р.–Т., –°–Њ—А–Њ–Ї–Є–љ–∞ –Х.–Ѓ., –Ь–∞–Ї—Г—А–Є–љ–∞ –Ю.–Э., –Ґ—Г—В–µ–ї—М—П–љ –Т.–Р. –Ш–Ј—Г—З–µ–љ–Є–µ Trp64Arg –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞ –≥–µ–љ–∞ ß3-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Г –ї–Є—Ж —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –Є –Њ–ґ–Є—А–µ–љ–Є–µ–Љ // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. 2012. вДЦ 2. –°. 23–27.
32. –С–∞—В—Г—А–Є–љ –Р.–Ъ., –°–Њ—А–Њ–Ї–Є–љ–∞ –Х.–Ѓ., –Я–Њ–≥–Њ–ґ–µ–≤–∞ –Р.–Т., –Ґ—Г—В–µ–ї—М—П–љ –Т.–Р. –У–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –њ–Њ–і—Е–Њ–і—Л –Ї –њ–µ—А—Б–Њ–љ–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–Є—В–∞–љ–Є—П // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. 2012. вДЦ 6. –°. 4–11.
33. –С–∞—В—Г—А–Є–љ –Р.–Ъ., –°–Њ—А–Њ–Ї–Є–љ–∞ –Х.–Ѓ., –Я–Њ–≥–Њ–ґ–µ–≤–∞ –Р.–Т., –Я–µ—Б–Ї–Њ–≤–∞ –Х.–Т., –Ь–∞–Ї—Г—А–Є–љ–∞ –Ю.–Э., –Ґ—Г—В–µ–ї—М—П–љ –Т.–Р. –Ш–Ј—Г—З–µ–љ–Є–µ —А–µ–≥–Є–Њ–љ–∞–ї—М–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞ rs9939609 –≥–µ–љ–∞ FTO –Є Trp64Arg –≥–µ–љ–∞ ADRB3 —Г –љ–∞—Б–µ–ї–µ–љ–Є—П –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є // –Т–Њ–њ—А–Њ—Б—Л –њ–Є—В–∞–љ–Є—П. 2014. вДЦ 2. –°. 35–41.












