–≠–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П (–≠–Ф) – —А–∞–љ–љ–Є–є –Љ–∞—А–Ї–µ—А –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–є —Б–Њ—Б—В–Њ—П–љ–Є—П, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–µ —Б –≤—Л—Б–Њ–Ї–Є–Љ –Ї–∞—А–і–Є–Њ––≤–∞—Б–Ї—Г–ї—П—А–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ, —В–∞–Ї–Є–µ –Ї–∞–Ї –Ї—Г—А–µ–љ–Є–µ [1], –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є—П [2], –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П [3], –Њ–ґ–Є—А–µ–љ–Є–µ [4], –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є [5], –Ј–∞—Б—В–Њ–є–љ–∞—П —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М [6] –Є —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В 1 [7] –Є 2 [8] —В–Є–њ–Њ–≤. –Я–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–∞—П —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ —П–≤–ї—П–µ—В—Б—П –Ј–≤–µ–љ–Њ–Љ –Љ–µ–ґ–і—Г –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ [9] –Є –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –љ–µ —В–Њ–ї—М–Ї–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ [10] –Є–ї–Є –і–Є–∞–±–µ—В–Њ–Љ [11], –љ–Њ –і–∞–ґ–µ –Є —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж [12]. –Я–Њ–Ї–∞–Ј–∞–љ—Л —Б–њ–µ—Ж–Є—Д–Є—З–љ—Л–µ –Є –Њ–±—Й–Є–µ —Н—Д—Д–µ–Ї—В—Л –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–Є (–У–У) [13] –Є –≥–Є–њ–µ—А—В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–µ–Љ–Є–Є (–У–Ґ–Х) [14] –љ–∞ –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Г—О –≠–Ф (–Я–≠–Ф).
–Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Г —З–µ–ї–Њ–≤–µ–Ї–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –±–Њ–ї—М—И—Г—О —З–∞—Б—В—М —Б—Г—В–Њ–Ї, –і–µ–є—Б—В–≤–Є—П, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ –Я–≠–Ф, –Љ–Њ–≥—Г—В –Є–≥—А–∞—В—М —А–µ—И–∞—О—Й—Г—О —А–Њ–ї—М –≤ –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞. –Ф–ї—П –ї–µ—З–µ–љ–Є—П –Я–≠–Ф –±—Л–ї–Њ –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –њ–Њ–і—Е–Њ–і–Њ–≤, –≤–Ї–ї—О—З–∞—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є–љ—Б—Г–ї–Є–љ–∞, —Д–Њ–ї–Є–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, —В–µ—В—А–∞–≥–Є–і—А–Њ–±–Є–Њ–њ—В–µ—А–Є–љ–∞, –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –°, –Х, –Є —Б—В–∞—В–Є–љ–Њ–≤ [11]. –≠—В–Є –њ–Њ–і—Е–Њ–і—Л –љ–∞—Ж–µ–ї–µ–љ—Л –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–≥–Њ –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞ (–≤–Є—В–∞–Љ–Є–љ—Л –° –Є –Х, —Б—В–∞—В–Є–љ—Л –Є —З–∞—Б—В–Є—З–љ–Њ —Д–Њ–ї–Є–µ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞), –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–Є (–Є–љ—Б—Г–ї–Є–љ), –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–µ–Љ–Є–Є (—Б—В–∞—В–Є–љ—Л) –Є–ї–Є –Њ–±–ї–∞–і–∞—О—В –њ—А—П–Љ—Л–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ –њ—А–Њ–і—Г–Ї—Ж–Є—О —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–≥–Њ –Њ–Ї—Б–Є–і–∞ –∞–Ј–Њ—В–∞ (NO) (—Д–Њ–ї–Є–µ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ –Є —В–µ—В—А–∞–≥–Є–і—А–Њ–±–Є–Њ–њ—В–µ—А–Є–љ) [15–17].
–Я–Њ –њ–Њ—Б–ї–µ–і–љ–Є–Љ –і–∞–љ–љ—Л–Љ, –Ї–Њ–љ–µ—З–љ—Л–µ –њ—А–Њ–і—Г–Ї—В—Л –љ–µ—Д–µ—А–Љ–µ–љ—В–љ–Њ–≥–Њ –≥–ї–Є–Ї–Є—А–Њ–≤–∞–љ–Є—П (–Ъ–Я–Э–У) —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В –Є–≥—А–∞—В—М —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –≠–Ф [18], –њ—А–Є–≤–Њ–і—П—Й–µ–є –Ї –Њ—В–і–∞–ї–µ–љ–љ—Л–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ –і–Є–∞–±–µ—В–∞ –Є —Б—В–∞—А–µ–љ–Є—О [19]. –Ъ–Я–Э–У – –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–∞—П –≥—А—Г–њ–њ–∞, –љ–∞–Є–±–Њ–ї–µ–µ —П—А–Ї–Є–Љ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–Љ –Ї–Њ—В–Њ—А–Њ–є —П–≤–ї—П–µ—В—Б—П –Ї–∞—А–±–Њ–Ї—Б–Є–Љ–µ—В–Є–ї–ї–Є–Ј–Є–љ (–Ъ–Ь–Ы). –Я–Є—Й–∞ – –≥–ї–∞–≤–љ—Л–є –Є—Б—В–Њ—З–љ–Є–Ї —Н–Ї–Ј–Њ–≥–µ–љ–љ—Л—Е –Ъ–Я–Э–У. –°–Њ–і–µ—А–ґ–∞–љ–Є–µ –ґ–µ –Ъ–Я–Э–У –≤ –њ–Є—Й–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Ј–∞–≤–Є—Б–Є—В –Ї–∞–Ї –Њ—В –љ—Г—В—А–Є–µ–љ—В–Њ–≤, –≤—Е–Њ–і—П—Й–Є—Е –≤ –µ–µ —Б–Њ—Б—В–∞–≤, —В–∞–Ї –Є –Њ—В —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л, –Љ–µ—В–Њ–і–∞ –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є —В–µ–њ–ї–Њ–≤–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –≤–Њ –≤—А–µ–Љ—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П [20]. –Ю–Ї–Њ–ї–Њ 10% –њ–Њ—Б—В—Г–њ–Є–≤—И–Є—Е –Ъ–Я–Э–У –±—Л—Б—В—А–Њ –≤—Б–∞—Б—Л–≤–∞—О—В—Б—П –Є —З–∞—Б—В–Є—З–љ–Њ —Б–Њ—Е—А–∞–љ—П—О—В—Б—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, –≥–і–µ –Њ–љ–Є –Њ–Ї–∞–Ј—Л–≤–∞—О—В —А–∞–Ј–ї–Є—З–љ—Л–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л, [21] –≤–Ї–ї—О—З–∞—П —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ –Є –∞–Ї—В–Є–≤–∞—Ж–Є—О —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Ї –Ъ–Я–Э–У. –Я—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Є –Ъ–Я–Э–У, —В–∞–Ї–Є–µ –Ї–∞–Ї –Љ–µ—В–Є–ї–≥–ї–Є–Њ–Ї—Б–∞–ї (–Ь–У), —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞—В—М —А–µ—Ж–µ–њ—В–Њ—А—Л –Ї –Ъ–Я–Э–У. –°–Є–љ—В–µ–Ј —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ –Ь–У —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –њ–∞—А–∞–ї–ї–µ–ї—М–љ–Њ —Б –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–µ–є in vivo [23]. –Я–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ, –∞–±—Б–Њ—А–±–Є—А–Њ–≤–∞–љ–љ—Л–µ –Є —Н–љ–і–Њ–≥–µ–љ–љ–Њ —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –Ъ–Я–Э–У –Є –Ь–У –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—О—В —Б–Є–љ–µ—А–≥–Є—З–љ–Њ, —Г—Е—Г–і—И–∞—П —Д—Г–љ–Ї—Ж–Є–Є —Б–Њ—Б—Г–і–Њ–≤ —З–µ—А–µ–Ј –њ—А—П–Љ–Њ–µ –њ–Њ–≥–ї–Њ—Й–µ–љ–Є–µ NO –Є–ї–Є —Б—В–Є–Љ—Г–ї—П—Ж–Є—О –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞. –І–∞—Б—В—М —Н—В–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Љ–Њ–ґ–µ—В –±—Л—В—М –љ–µ–є—В—А–∞–ї–Є–Ј–Њ–≤–∞–љ–∞ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–Њ–Љ, – –≤–µ—Й–µ—Б—В–≤–Њ–Љ —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О, —З–µ–Љ —В–Є–∞–Љ–Є–љ [24]. –С–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ, –Њ–±—Л—З–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–є –≤ –ї–µ—З–µ–љ–Є–Є –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є [25], – —Н—В–Њ –∞–Ї—В–Є–≤–∞—В–Њ—А —В—А–∞–љ—Б–Ї–µ—В–Њ–ї–∞–Ј—Л, –Ї–Њ—В–Њ—А—Л–є –љ–∞–њ—А–∞–≤–ї—П–µ—В –≥–ї—О–Ї–Њ–Ј–љ—Л–є —Б—Г–±—Б—В—А–∞—В –љ–∞ –њ–µ–љ—В–Њ–Ј–Њ–—Д–Њ—Б—Д–∞—В–љ—Л–є –њ—Г—В—М. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Њ–љ –±–ї–Њ–Ї–Є—А—Г–µ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—Г—В–µ–є, –Њ–і–љ–Є–Љ –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П–µ—В—Б—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —Н–љ–і–Њ–≥–µ–љ–љ—Л—Е –Ъ–Я–Э–У –Є –і–Є–Ї–∞—А–±–Њ–љ–Є–ї–Њ–≤ [26]. –С–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Г—О –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї—Г—О —А–µ—В–Є–љ–Њ–њ–∞—В–Є—О [26] –Є in vitro –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Г—О –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–µ–є –≠–Ф [27,28]. –≠—Д—Д–µ–Ї—В—Л –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–∞ –љ–∞ –≠–Ф in vivo –њ–Њ–Ї–∞ –љ–µ–Є–Ј–≤–µ—Б—В–љ—Л.
–Т –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Љ—Л –Є–Ј—Г—З–Є–ї–Є —Н—Д—Д–µ–Ї—В—Л –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–є, –њ–Њ—В—А–µ–±–ї—П–µ–Љ–Њ–є –≤ –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –ґ–Є–Ј–љ–Є –±–Њ–≥–∞—В–Њ–є –Ъ–Я–Э–У –њ–Є—Й–Є –љ–∞ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О (–≠–§) —Б –Є –±–µ–Ј –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–∞ —Б—А–µ–і–Є 13 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ (–°–Ф) 2 —В–Є–њ–∞. –≠–§ –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –љ–∞ –Љ–∞–Ї—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–Љ —Г—А–Њ–≤–љ–µ —Б –њ–Њ–Љ–Њ—Й—М—О –≤—Л—Б–Њ–Ї–Њ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ–≥–Њ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–≥–Њ –Є–Ј–Љ–µ—А–µ–љ–Є—П –њ–Њ—В–Њ–Ї––Ј–∞–≤–Є—Б–Є–Љ–Њ–є –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є (–Я–Ч–Т), –Є –љ–∞ –Љ–Є–Ї—А–Њ—Б–Њ—Б—Г–і–Є—Б—В–Њ–Љ —Г—А–Њ–≤–љ–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –ї–∞–Ј–µ—А–љ–Њ–є –і–Њ–њ–њ–ї–µ—А–Њ–≥—А–∞—Д–Є–Є –і–ї—П –Њ—Ж–µ–љ–Ї–Є —А–µ–∞–Ї—В–Є–≤–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–Є. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Љ—Л –Є–Ј–Љ–µ—А—П–ї–Є –Љ–∞—А–Ї–µ—А—Л –≠–§ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є (–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л –Ї–ї–µ—В–Њ—З–љ–Њ–є –∞–і–≥–µ–Ј–Є–Є (–Т–Ь–Ъ–Р) – 1, –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ—Л–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л –∞–і–≥–µ–Ј–Є–Є (–Ь–Ь–Р) – 1, –Є —А–∞—Б—В–≤–Њ—А–Є–Љ—Л–є –Х–—Б–µ–ї–µ–Ї—В–Є–љ), –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (—Д–∞–Ї—В–Њ—А –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є [–§–Э–Ю]–a?, –°–—А–µ–∞–Ї—В–Є–≤–љ—Л–є –±–µ–ї–Њ–Ї (–°–†–С), –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ (–Ш–Ы)–6, –Ш–Ы–8 –Є —Д–Є–±—А–Є–љ–Њ–≥–µ–љ), –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞ (—А–µ–∞–Ї—В–Є–≤–љ—Л–µ —Б—Г–±—Б—В–∞–љ—Ж–Є–Є —В–Є–Њ–±–∞—А–±–Є—В—Г—А–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л – (–Ґ–С–Ъ–†–°), –њ–ї–∞–Ј–Љ–µ–љ–љ—Л–µ –Ъ–Я–Э–У –Є –Ь–У.
–Ф–Є–Ј–∞–є–љ –Є –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 13 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ф 2?—В–Є–њ–∞ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 56,9±2,8 –≥–Њ–і–∞, –±–µ–Ј –Њ—Б—В—А–Њ–є –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е 6 –Љ–µ—Б—П—Ж–µ–≤. –Ь—Л –≤—Л–±—А–∞–ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ–љ–љ–Њ —Б –°–Ф 2 —В–Є–њ–∞, –њ–Њ—В–Њ–Љ—Г —З—В–Њ –Њ–љ–Є —Б–Њ—Б—В–∞–≤–ї—П—О—В –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –ї–Є—Ж —Б –і–Є–∞–±–µ—В–Њ–Љ (>90%) –Є –Є—Е —З–Є—Б–ї–Њ –њ–Њ—Б—В–Њ—П–љ–љ–Њ —А–∞—Б—В–µ—В [29], –∞ —В–∞–Ї–ґ–µ –Є–Ј––Ј–∞ –Є—Е –Є–Ј–≤–µ—Б—В–љ–Њ–є –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В–Є –Ї –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ [30]. –Т—Л—З–Є—Б–ї–µ–љ–Є–µ —А–∞–Ј–Љ–µ—А–Њ–≤ –≤—Л–±–Њ—А–Ї–Є –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Њ –љ–∞ –Њ—Б–љ–Њ–≤–µ —А–∞–љ–µ–µ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е –і–∞–љ–љ—Л—Е [31]. –•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Є —Б–ї–µ–і—Г—О—Й–Є–Љ–Є (—Б—А–µ–і–љ–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ ± —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–µ): –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –і–Є–∞–±–µ—В–∞ 9,6±2,5 –ї–µ—В; –Є–љ–і–µ–Ї—Б –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ш–Ь–Ґ) 30,3±0,9 –Ї–≥/–Љ2; HbA1C 8,5±0,5%; —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ 136,5±6,0 –Љ–Љ —А—В.—Б—В.; –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ – 79,1±3,7 –Љ–Љ —А—В.—Б—В.; —З–∞—Б—В–Њ—В–∞ —Б–µ—А–і–µ—З–љ—Л—Е —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є (–І–°–°) 67,9±3,1 —Г–і–∞—А–Њ–≤ –≤ –Љ–Є–љ—Г—В—Г; –Ї—Г—А—П—Й–Є–µ/–љ–µ–Ї—Г—А—П—Й–Є–µ 3/10; —Г 4 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ –љ–µ–њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ–∞—П —А–µ—В–Є–љ–Њ–њ–∞—В–Є—П, —Г 2 – –љ–µ—Д—А–Њ–њ–∞—В–Є—П (–Љ–Є–Ї—А–Њ–∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є—П), —Г 5 – –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–∞—П –љ–µ–є—А–Њ–њ–∞—В–Є—П –Є —Г 10 – –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П. –Ь–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Њ –њ–µ—А–Њ—А–∞–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л/–њ–µ—А–Њ—А–∞–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л + –Є–љ—Б—Г–ї–Є–љ (n=9/4), –∞—Б–њ–Є—А–Є–љ (n=11), –Є–Р–Я–§ (n=1), –±–ї–Њ–Ї–∞—В–Њ—А—Л –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (n=1), –Є–љ–≥–Є–±–Є—В–Њ—А—Л –≥–Є–і—А–Њ–Ї—Б–Є–Љ–µ—В–Є–ї–≥–ї—Г—В–∞—А–Є–ї (n=6), b––±–ї–Њ–Ї–∞—В–Њ—А—Л (n=5) –Є –±–ї–Њ–Ї–∞—В–Њ—А—Л –Ї–∞–ї—М—Ж–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤ (n=3).
–Ъ—А–Є—В–µ—А–Є—П–Љ–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П —В–∞–Ї–ґ–µ —П–≤–ї—П–ї–Є—Б—М HbA1C? 13%, –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М, —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М III–IV –§–Ъ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б New York Heart Association, –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, –љ–µ—Б—В–∞–±–Є–ї—М–љ–∞—П —Б—В–µ–љ–Њ–Ї–∞—А–і–Є—П, –Є–љ—Б—Г–ї—М—В, –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –∞—А—В–µ—А–Є–є II–Т —Б—В–∞–і–Є–Є –Є –±–Њ–ї–µ–µ, –њ–Њ—З–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М (–Ї—А–µ–∞—В–Є–љ–Є–љ –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є >1,2 –Љ–≥/–і–ї), —А–∞–Ї, —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–∞—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М, –≥–Є–њ–Њ– –Є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П (–∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ –њ–Њ—Б–ї–µ –Њ—В–і—Л—Е–∞ <90/50 –Є–ї–Є >180/110 –Љ–Љ —А—В.—Б—В.), –ї–µ—З–µ–љ–Є–µ –±–Њ–ї–µ–µ —З–µ–Љ —В—А–µ–Љ—П –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –љ–Є—В—А–∞—В–∞–Љ–Є, –∞ —В–∞–Ї–ґ–µ —В—П–ґ–µ–ї—Л–µ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П (–њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ–∞—П –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П —А–µ—В–Є–љ–Њ–њ–∞—В–Є—П, –Љ–∞–Ї—А–Њ–∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є—П, –±–Њ–ї–µ–≤–∞—П –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–∞—П –љ–µ–є—А–Њ–њ–∞—В–Є—П, —В—А–µ–±—Г—О—Й–∞—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е –Љ–Њ—А—Д–Є–љ–∞, –Є «–і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П —Б—В–Њ–њ–∞»).
–Я–∞—Ж–Є–µ–љ—В—Л –Њ–±—Б–ї–µ–і–Њ–≤–∞–ї–Є—Б—М –њ–Њ—Б–ї–µ –њ–Њ–і–њ–Є—Б–∞–љ–Є—П –Є–Љ–Є –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–Њ–≥–ї–∞—Б–Є—П. –Ь–µ—Б—В–љ—Л–є —Н—В–Є—З–µ—Б–Ї–Є–є –Ї–Њ–Љ–Є—В–µ—В –Њ–і–Њ–±—А–Є–ї –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –њ—А–Є–љ—Ж–Є–њ–∞–Љ–Є –•–µ–ї—М—Б–Є–љ–Ї—Б–Ї–Њ–є –Ф–µ–Ї–ї–∞—А–∞—Ж–Є–Є.
–Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –њ–µ—А–µ–Ї—А–µ—Б—В–љ—Л–є –і–Є–Ј–∞–є–љ. –Т—Б–µ –њ—А–µ–њ–∞—А–∞—В—Л –±—Л–ї–Є –Њ—В–Љ–µ–љ–µ–љ—Л –љ–µ –њ–Њ–Ј–ґ–µ 12 —З–∞—Б–Њ–≤ –і–Њ –Ї–∞–ґ–і–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –љ–Њ –Є—Е –њ—А–Є–µ–Љ –љ–µ –Њ—В–Љ–µ–љ—П–ї—Б—П –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Я–∞—Ж–Є–µ–љ—В—Л –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –љ–∞ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –і–Є–µ—В–µ –і–Є–∞–±–µ—В–Є–Ї–Њ–≤ –≤—Б–µ 9 –і–љ–µ–є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Э–∞ 4––є (n=6) –Є–ї–Є 6––є (n=7) –і–µ–љ—М –Љ—Л –Њ—Ж–µ–љ–Є–≤–∞–ї–Є «–Њ—Б—В—А—Л–µ» —Н—Д—Д–µ–Ї—В—Л –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–є —В–µ—Б—В–Њ–≤–Њ–є –њ–Є—Й–Є —Б –≤—Л—Б–Њ–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –Ъ–Я–Э–У (–Т–Ъ–Я–Э–У) –љ–∞ –≠–§ –Є –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ—Л–є —Б—В—А–µ—Б—Б. –С–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ (–Ь–Є–ї—М–≥–∞–Љ–Љ–∞, Woerwag Pharma, Boeblingen, –У–µ—А–Љ–∞–љ–Є—П) –њ—А–Є–љ–Є–Љ–∞–ї–Є per os –љ–∞ 7, 8 (3*350 –Љ–≥/—Б—Г—В.) –Є 9––є –і–µ–љ—М (1050 –Љ–≥, –Ј–∞ 1 —З–∞—Б –і–Њ –µ–і—Л, –љ–∞–њ—А–Є–Љ–µ—А, –Т–Ъ–Я–Э–У –њ–ї—О—Б –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ [–Т–Ъ–Я–Э–У + –С–Ґ]).
–Т –і–љ–Є —Б —В–µ—Б—В–Њ–≤–Њ–є –њ–Є—Й–µ–є –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –Љ–Є–Ї—А–Њ– –Є –Љ–∞–Ї—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П —Д—Г–љ–Ї—Ж–Є—П –љ–∞—В–Њ—Й–∞–Ї (7.00 —Г—В—А–∞) –Є–ї–Є —Б–њ—Г—Б—В—П 2,4 –Є 6 —З–∞—Б–Њ–≤ –њ–Њ—Б–ї–µ —В–µ—Б—В–∞. –Т –Ї–∞–ґ–і–Њ–Љ —Б–ї—Г—З–∞–µ –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї—Б—П –Ј–∞–±–Њ—А –≤–µ–љ–Њ–Ј–љ–Њ–є –Ї—А–Њ–≤–Є. –Ь–µ–ґ–і—Г —В–µ—Б—В–∞–Љ–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ —А–∞–Ј—А–µ—И–∞–ї–Њ—Б—М –≤—Б—В–∞–≤–∞—В—М –Є –≥—Г–ї—П—В—М, –љ–Њ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–ї–Є—Б—М –Ї–∞–Ї–Є–µ––ї–Є–±–Њ –∞–Ї—В–Є–≤–љ—Л–µ –≤–Є–і—Л –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є. –Я–Њ—Б–ї–µ –њ–Є—Й–µ–≤–Њ–≥–Њ —В–µ—Б—В–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —А–∞–Ј—А–µ—И–∞–ї–Њ—Б—М –њ–Є—В—М —В–Њ–ї—М–Ї–Њ –Љ–Є–љ–µ—А–∞–ї—М–љ—Г—О –≤–Њ–і—Г –≤ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ 50 –Љ–ї/—З –і–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ —В–µ—Б—В–∞ (—Б–њ—Г—Б—В—П 6 —З–∞—Б–Њ–≤).
–Я–Є—Й–µ–≤–Њ–є —В–µ—Б—В
–Э–∞ –Њ–±–Њ–Є—Е –≤–Є–Ј–Є—В–∞—Е –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Г—О —В–µ—Б—В–Њ–≤—Г—О –њ–Є—Й—Г —Б –Т–Ъ–Я–Э–У, –Ї–Њ—В–Њ—А—Г—О –Є—Е –њ—А–Њ—Б–Є–ї–Є —Б—К–µ—Б—В—М –≤ —В–µ—З–µ–љ–Є–µ 30 –Љ–Є–љ—Г—В (–і–Њ 8.30 —Г—В—А–∞). –Х–і–∞ —Б–Њ—Б—В–Њ—П–ї–∞ –Є–Ј 200 –≥ –Ї—Г—А–Є—Ж—Л, 250 –≥ –Ї–∞—А—В–Њ—И–Ї–Є, 100 –≥ –Љ–Њ—А–Ї–Њ–≤–Є, 200 –≥ –њ–Њ–Љ–Є–і–Њ—А –Є 15 –≥ —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –Љ–∞—Б–ї–∞ –Њ–±—Й–µ–є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–є —Ж–µ–љ–љ–Њ—Б—В—М—О 580 –Ї–Ї–∞–ї –Є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–ї–∞ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ 54 –≥ –±–µ–ї–Ї–∞, 17 –≥ –ґ–Є—А–∞, 48 –≥ –Ї–∞—А–±–Њ–≥–Є–і—А–∞—В–Њ–≤. –Я–Є—Й—Г –ґ–∞—А–Є–ї–Є/–≤–∞—А–Є–ї–Є –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ 230°–° –≤ —В–µ—З–µ–љ–Є–µ 20 –Љ–Є–љ—Г—В –і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ъ–Я–Э–У (15100 kU –Ъ–Я–Э–У/–њ–Є—Й–Є). –°–Њ–і–µ—А–ґ–∞–љ–Є–µ –Ъ–Я–Э–У –±—Л–ї–Њ –≤—Л—З–Є—Б–ї–µ–љ–Њ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –љ–µ–і–∞–≤–љ–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–µ–є [20].
–Ш–Ј–Љ–µ—А–µ–љ–Є–µ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є
–Ъ–Ю–Р–—А–µ–і—Г–Ї—В–∞–Ј–∞ –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –≤ –њ—А–∞–≤–Њ–є –њ–ї–µ—З–µ–≤–Њ–є –∞—А—В–µ—А–Є–Є (–њ—А–Є –њ–Њ–Љ–Њ—Й–Є –Я–Ч–Т –њ—А–Њ—В–Њ–Ї–Њ–ї–∞, –≤–њ–µ—А–≤—Л–µ –Њ–њ–Є—Б–∞–љ–љ–Њ–Љ –¶–µ–ї–µ—А–Љ–∞–≥–µ—А–Њ–Љ –Є –і—А. [32]) –њ—Г—В–µ–Љ –Њ—Ж–µ–љ–Ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –і–Є–∞–Љ–µ—В—А–∞ –∞—А—В–µ—А–Є–є –њ—А–Є —А–µ–∞–Ї—В–Є–≤–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–Є, –≤—Л–Ј—Л–≤–∞—О—Й–µ–є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ––Ј–∞–≤–Є—Б–Є–Љ—Г—О –і–Є–ї–∞—В–∞—Ж–Є—О. –Ш–Ј–Љ–µ—А–µ–љ–Є—П –і–Є–∞–Љ–µ—В—А–∞ –∞—А—В–µ—А–Є–є –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –і–≤—Г—Е–Љ–µ—А–љ–Њ–є —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–Є—А—Г—О—Й–µ–є —Б–Є—Б—В–µ–Љ—Л —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–∞–Ј—А–µ—И–µ–љ–Є–µ–Љ ATL HDI 5000 (–Я–µ—А–µ–і–Њ–≤—Л–µ —В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є, –У–µ—А–Љ–∞–љ–Є—П), —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤—Л—Е –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–є, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —Б –њ–Њ–Љ–Њ—Й—М—О 7–15 –Ь–У—Ж –ї–Є–љ–µ–є–љ–Њ–≥–Њ —В—А–∞–љ—Б–і—Г–Ї—В–Њ—А–∞.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ 22–24°–° –≤ —В–µ–Љ–љ–Њ–є —В–Є—Е–Њ–є –Ї–Њ–Љ–љ–∞—В–µ. –Я–∞—Ж–Є–µ–љ—В—Л –Њ—В–і—Л—Е–∞–ї–Є –љ–µ –Љ–µ–љ–µ–µ 10 –Љ–Є–љ—Г—В –њ–µ—А–µ–і –њ–µ—А–≤—Л–Љ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Є –Њ—Б—В–∞–≤–∞–ї–Є—Б—М –≤ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є –ї–µ–ґ–∞ –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–є –њ—А–Њ—Ж–µ–і—Г—А—Л. –Ф–ї—П –Є—Б–Ї–ї—О—З–µ–љ–Є—П –∞—А—В–µ—Д–∞–Ї—В–Њ–≤ –і–≤–Є–ґ–µ–љ–Є—П —А—Г–Ї–∞ –Њ–±—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –њ–Њ–Љ–µ—Й–∞–ї–∞—Б—М –љ–∞ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Г—О –њ–Њ–і—Б—В–∞–≤–Ї—Г. –°–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ –њ–ї–µ—З–µ–≤–Њ–є –∞—А—В–µ—А–Є–Є –≤—Л–њ–Њ–ї–љ—П–ї–Њ—Б—М –љ–∞ 3–10 —Б–Љ –≤—Л—И–µ –ї–Њ–Ї—В–µ–≤–Њ–≥–Њ —Б–≥–Є–±–∞. –Т—Л–њ–Њ–ї–љ—П–ї–Є—Б—М –љ–∞—З–∞–ї—М–љ—Л–µ –Є–Ј–Љ–µ—А–µ–љ–Є—П (–њ–µ—А–µ–і –Є—И–µ–Љ–Є–µ–є), –Ї–Њ—В–Њ—А—Л–µ –Ј–∞–њ–Є—Б—Л–≤–∞–ї–Є—Б—М –≤ —Ж–Є—Д—А–Њ–≤–Њ–Љ –≤–Є–і–µ. –Т–Њ–Ј–і—Г—И–љ–∞—П –Љ–∞–љ–ґ–µ—В–∞, –љ–∞–ї–Њ–ґ–µ–љ–љ–∞—П –љ–∞ –њ—А–µ–і–њ–ї–µ—З—М–µ –њ–∞—Ж–Є–µ–љ—В–∞, –Ј–∞—В–µ–Љ –љ–∞–і—Г–≤–∞–ї–∞—Б—М –і–Њ 250 –Љ–Љ —А—В.—Б—В. –љ–∞ 4,5 –Љ–Є–љ—Г—В—Л. –Я—Г–ї—М—Б––і–Њ–њ–њ–ї–µ—А–Њ–≥—А–∞—Д–Є—П –Ј–∞–њ–Є—Б—Л–≤–∞–ї–∞—Б—М –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 15 —Б–µ–Ї—Г–љ–і –њ–Њ—Б–ї–µ —А–∞—Б—Б–ї–∞–±–ї–µ–љ–Є—П –Љ–∞–љ–ґ–µ—В—Л, –Ј–∞ —З–µ–Љ —Б–ї–µ–і–Њ–≤–∞–ї–∞ –љ–µ–њ—А–µ—А—Л–≤–љ–∞—П —Ж–Є—Д—А–Њ–≤–∞—П –Ј–∞–њ–Є—Б—М (–≤ —А–µ–ґ–Є–Љ–µ –Т–mode) –і–Є–∞–Љ–µ—В—А–∞ –∞—А—В–µ—А–Є–Є –≤ —В–µ—З–µ–љ–Є–µ 120 —Б –њ–Њ—Б–ї–µ –і–µ—Д–ї—П—Ж–Є–Є. –Ш—Б—Е–Њ–і–љ–Њ –Є —З–µ—А–µ–Ј 4 —З–∞—Б–∞, —Б–ї–µ–і—Г—О—Й–Є–µ 10 –Љ–Є–љ—Г—В –Њ—В–≤–Њ–і–Є–ї–Є—Б—М –і–ї—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Б–Њ—Б—Г–і–∞, –∞ –Ј–∞—В–µ–Љ –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М –љ–Њ–≤—Л–µ –Є—Б—Е–Њ–і–љ—Л–µ –Є–Ј–Љ–µ—А–µ–љ–Є—П. –°–њ—Г—Б—В—П 5 –Љ–Є–љ—Г—В –њ–Њ—Б–ї–µ —Б—Г–±–ї–Є–љ–≥–≤–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –≥–ї–Є—Ж–µ—А–Њ–ї—В—А–Є–љ–Є—В—А–∞—В–∞ (0,4 –Љ–≥) –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –њ–Њ—Б–ї–µ–і–љ—П—П –Ј–∞–њ–Є—Б—М –і–∞–љ–љ—Л—Е.
–≠–љ–і–Њ—В–µ–ї–Є–є––Ј–∞–≤–Є—Б–Є–Љ–∞—П –і–Є–ї–∞—В–∞—Ж–Є—П (–≠–Ч–Ф) –Њ–њ—А–µ–і–µ–ї—П–ї–∞—Б—М, –Ї–∞–Ї –њ—А–Њ—Ж–µ–љ—В–љ–Њ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –і–Є–∞–Љ–µ—В—А–∞ –∞—А—В–µ—А–Є–Є –њ—А–Є —А–µ–∞–Ї—В–Є–≤–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ –і–Є–∞–Љ–µ—В—А–Њ–Љ. –≠–љ–і–Њ—В–µ–ї–Є–є––љ–µ–Ј–∞–≤–Є—Б–Є–Љ–∞—П –і–Є–ї–∞—В–∞—Ж–Є—П (–≠–Э–Ф) —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–∞—Б—М –Ї–∞–Ї –њ—А–Њ—Ж–µ–љ—В–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Є–∞–Љ–µ—В—А–∞ –∞—А—В–µ—А–Є–Є —Б–њ—Г—Б—В—П 5 –Љ–Є–љ—Г—В –њ–Њ—Б–ї–µ –≤–≤–µ–і–µ–љ–Є—П –≥–ї–Є—Ж–µ—А–Њ–ї—В—А–Є–љ–Є—В—А–∞—В–∞.
–Т—Б–µ –Ј–∞–њ–Є—Б–∞–љ–љ—Л–µ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–Є –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–є –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є—Б—М —Б—В–Њ—А–Њ–љ–љ–Є–Љ –Њ–њ—Л—В–љ—Л–Љ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–Љ, «–Њ—Б–ї–µ–њ–ї–µ–љ–љ—Л–Љ» –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ф–ї—П —В–µ—Б—В–∞ —Б —А–µ–∞–Ї—В–Є–≤–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–µ–є –Є–Ј–Љ–µ—А–µ–љ–Є—П –і–Є–∞–Љ–µ—В—А–∞ –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–Є—Б—М —Б–њ—Г—Б—В—П 60 —Б –њ–Њ—Б–ї–µ —А–∞—Б—Б–ї–∞–±–ї–µ–љ–Є—П –Љ–∞–љ–ґ–µ—В—Л (–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–є –і–Є–∞–Љ–µ—В—А –∞—А—В–µ—А–Є–Є –њ—А–Є —А–µ–∞–Ї—В–Є–≤–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–Є). –І–µ—В—Л—А–µ —Б–µ—А–і–µ—З–љ—Л—Е —Ж–Є–Ї–ї–∞ –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є—Б—М –≤ –Ї–Њ–љ—Ж–µ –і–Є–∞—Б—В–Њ–ї—Л –Є –і–Є–∞–Љ–µ—В—А –∞—А—В–µ—А–Є–Є –±—Л–ї –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є –Є–Ј–Љ–µ—А–µ–љ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ–є –њ—А–Њ–≥—А–∞–Љ–Љ—Л (ATL Ul, –≤–µ—А—Б–Є—П 1.91; HDI Lab), –∞ –Ј–∞—В–µ–Љ —Г—Б—А–µ–і–љ–µ–љ—Л. –Ґ–∞–Ї–∞—П –ґ–µ –њ—А–Њ—Ж–µ–і—Г—А–∞ –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–∞—Б—М –Є –і–ї—П –Ј–љ–∞—З–µ–љ–Є–є –≠–Э–Ф. –Я–Њ –і–∞–љ–љ—Л–Љ –њ–Њ–≤—В–Њ—А–љ—Л—Е –Є–Ј–Љ–µ—А–µ–љ–Є–є –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –≤–∞—А–Є–∞–±–µ–ї—М–љ–Њ—Б—В–Є —Б–Њ—Б—В–∞–≤–Є–ї 5,41%.
–Ы–∞–Ј–µ—А–љ–∞—П –і–Њ–њ–њ–ї–µ—А–Њ–≥—А–∞—Д–Є—П
(–Љ–Є–Ї—А–Њ—Б–≤–µ—В–Њ–≤–∞—П —Б–њ–µ–Ї—В—А–Њ—Д–Њ—В–Њ–Љ–µ—В—А–Є—П)
–Ь–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—П –≤ –Ї–Њ–ґ–µ –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б –Я–Ч–Т —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–Є–Ї—А–Њ—Б–≤–µ—В–Њ–≤–Њ–≥–Њ —Б–њ–µ–Ї—В—А–Њ—Д–Њ—В–Њ–Љ–µ—В—А–∞ (–Ю2–°; LEA Medizintechnik; –У–Є–µ—Б—Б–µ–љ, –У–µ—А–Љ–∞–љ–Є—П). –Ы–∞–Ј–µ—А–љ–∞—П –і–Њ–њ–њ–ї–µ—А––њ—А–Њ–±–∞ –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —В–µ–љ–∞—А–∞ –њ—А–∞–≤–Њ–є —А—Г–Ї–Є. –Э–µ–њ—А–µ—А—Л–≤–љ—Л–є –≤–Њ–ї–љ–Њ–≤–Њ–є –ї–∞–Ј–µ—А–љ—Л–є —Б–≤–µ—В (830 –Љ–Љ –Є 30 –Љ–Т) –њ–µ—А–µ–і–∞–≤–∞–ї—Б—П –љ–∞ —В–Ї–∞–љ—М, –≥–і–µ –Њ–љ —А–∞—Б—Б–µ–Є–≤–∞–ї—Б—П –Є —Б–Њ–±–Є—А–∞–ї—Б—П –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ї–Њ–ґ–Є –≤ –Ј–Њ–љ–і. –Ъ—А–Њ–≤—П–љ–Њ–є –њ–Њ—В–Њ–Ї –Є–Ј–Љ–µ—А—П–ї—Б—П –љ–∞ –≥–ї—Г–±–Є–љ–µ 2 –Љ–Љ –Є –≤—Л—А–∞–ґ–∞–ї—Б—П –≤ –њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ—Л—Е –µ–і–Є–љ–Є—Ж–∞—Е. –Э–∞ –Њ—Б–љ–Њ–≤–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –≤–∞—А–Є–∞–±–µ–ї—М–љ–Њ—Б—В–Є –∞–±—Б–Њ–ї—О—В–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –Ї—А–Њ–≤—П–љ–Њ–≥–Њ –њ–Њ—В–Њ–Ї–∞, –±—Л–ї —А–∞–Ј—А–∞–±–Њ—В–∞–љ –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–Њ–і–Є–Љ—Л–є —В–µ—Б—В, –Ї–Њ—В–Њ—А—Л–є –Њ—Ж–µ–љ–Є–≤–∞–µ—В —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї—А–Њ–≤—П–љ–Њ–≥–Њ –њ–Њ—В–Њ–Ї–∞, —Б–ї–µ–і—Г—О—Й–µ–≥–Њ –Ј–∞ 4,5––Љ–Є–љ—Г—В–љ–Њ–є –Є—И–µ–Љ–Є–µ–є [33]. –†–µ–∞–Ї—В–Є–≤–љ–∞—П –≥–Є–њ–µ—А–µ–Љ–Є—П –±—Л–ї–∞ –≤—Л—Б—З–Є—В–∞–љ–∞ –Ї–∞–Ї –Њ—В–љ–Њ—И–µ–љ–Є–µ –Љ–µ–ґ–і—Г –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–Љ –њ–Њ—Б—В–Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є –Є—Б—Е–Њ–і–љ—Л–Љ –Ї—А–Њ–≤—П–љ—Л–Љ –њ–Њ—В–Њ–Ї–Њ–Љ.
–Р–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є
–Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є
–Ч–∞–±–Њ—А –Ї—А–Њ–≤–Є –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї—Б—П —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ (—З–µ—А–µ–Ј 10 –Љ–Є–љ—Г—В) –Ї–∞–ґ–і–Њ–≥–Њ –Є–Ј–Љ–µ—А–µ–љ–Є—П –≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Є–Ј –Ї–Њ–љ—В—А–∞–ї–∞—В–µ—А–∞–ї—М–љ–Њ–є —А—Г–Ї–Є. –Я–ї–∞–Ј–Љ–∞ –Є–ї–Є —Б—Л–≤–Њ—А–Њ—В–Ї–∞ –њ–Њ–ї—Г—З–∞–ї–Є—Б—М –њ–Њ—Б–ї–µ —Ж–µ–љ—В—А–Є—Д—Г–≥–Є—А–Њ–≤–∞–љ–Є—П –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ 1, 500 –≥ –Ј–∞ 20 –Љ–Є–љ—Г—В –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ 4°–°.
–У–ї—О–Ї–Њ–Ј–∞ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Є–Ј–Љ–µ—А—П–ї–∞—Б—М –≥–ї—О–Ї–Њ–Ј–Њ––Њ–Ї—Б–Є–і–∞–Ј–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ (Architect ci8200; Abbot Diagnostics. Wiesbaden, –У–µ—А–Љ–∞–љ–Є—П). Hb–Р1–° –Њ—Ж–µ–љ–Є–≤–∞–ї—Б—П —Б –њ–Њ–Љ–Њ—Й—М—О –≤—Л—Б–Њ–Ї–Њ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–љ–Њ–є —Е—А–Њ–Љ–∞—В–Њ–≥—А–∞—Д–Є–Є (Menarini, –С–µ—А–ї–Є–љ, –У–µ—А–Љ–∞–љ–Є—П). –•–Њ–ї–µ—Б—В–µ—А–Є–љ, —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і—Л –Є —Е–Њ–ї–µ—Б—В–µ—А–Є–љ –Ы–Я–Э–Я –Є –Ы–Я–Т–Я –Є–Ј–Љ–µ—А—П–ї–Є—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–∞ Architect ci8200 (Abbot Diagnostics). –Я–ї–∞–Ј–Љ–µ–љ–љ—Л–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Т–Ь–Ъ–Р–1, –Ь–Ь–Р–1, –Є —А–∞—Б—В–≤–Њ—А–Є–Љ—Л–є –Х–—Б–µ–ї–µ–Ї—В–Є–љ –Њ–њ—А–µ–і–µ–ї—П–ї–Є—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –њ—А–µ–і–Њ—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Є–Љ–Љ—Г–љ–Њ—Б–Њ—А–±–µ–љ—В–љ—Л—Е —П—З–µ–µ–Ї (R&D Systems, –Т–Є–µ—Б–±–∞–і–µ–љ, –У–µ—А–Љ–∞–љ–Є—П –Є Technoclone, –Т–µ–љ–∞, –Р–≤—Б—В—А–Є—П).
–≠—В–Є –њ—А–Њ–±—Л –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М –і–ї—П –Є–Ј–Љ–µ—А–µ–љ–Є—П –Ґ–С–Ъ–†–° (Alexis Biochemicals, –У—А—О–љ–±–µ—А–≥, –®–≤–µ–є—Ж–∞—А–Є—П), —Д–Є–±—А–Є–љ–Њ–≥–µ–љ–∞, –°–†–С (Architect ci8200; Abbot Diagnostics), –§–Э–Ю–a, –Ш–Ы–6, –Ш–Ы–8 (ImmuLite 2000; DPC Biermann, Bad Nauheim, –У–µ—А–Љ–∞–љ–Є—П).
–Я–ї–∞–Ј–Љ–µ–љ–љ—Л–µ —Г—А–Њ–≤–љ–Є –Ъ–Я–Э–У –Є–Ј–Љ–µ—А—П–ї–Є—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї–∞—А–±–Њ–Ї—Б–Є–Љ–µ—В–Є–ї–ї–Є–Ј–Є–љ (–Ъ–Ь–Ы)–—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –Є–Љ–Љ—Г–љ–Њ—Б–Њ—А–±–µ–љ—В–љ—Л—Е –Њ–±—А–∞–Ј—Ж–Њ–≤ [34]. –Ю–±—Й–Є–є —Г—А–Њ–≤–µ–љ—М –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е –Љ–µ—В–Є–ї–≥–ї–Є–Њ–Ї—Б–∞–ї–∞ (–Ь–У) –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –Њ—Ж–µ–љ–Є–≤–∞–ї—Б—П —Б –њ–Њ–Љ–Њ—Й—М—О –Є–Љ–Љ—Г–љ–Њ—Б–Њ—А–±–µ–љ—В–љ—Л—Е –Њ–±—А–∞–Ј—Ж–Њ–≤ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л—Е –∞–љ—В–Є––Ь–У–BSA –∞–љ—В–Є—В–µ–ї (–ЬG3D11) –њ—А–Њ—В–Є–≤ –Ь–У––Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е BSA.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј
–Ф–∞–љ–љ—Л–µ –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ SPSS –і–ї—П Windows 12,0. –Э–µ–њ—А–µ—А—Л–≤–љ—Л–µ –≤–∞—А–Є–∞–љ—В—Л –≤—Л—А–∞–ґ–µ–љ—Л –Ї–∞–Ї —Б—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П ± —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–µ, –µ—Б–ї–Є –Њ–љ–Є –љ–µ –±—Л–ї–Є –≤—Л—З–Є—Б–ї–µ–љ—Л –і—А—Г–≥–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ. –Р–ї–≥–Њ—А–Є—В–Љ Shapiro–Wilk –њ—А–Є–Љ–µ–љ—П–ї—Б—П –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П, –Ї–∞–ґ–і–∞—П –ї–Є –≤–∞—А–Є–∞–љ—В–∞ –Є–Љ–µ–ї–∞ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–µ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ. –Я–∞—А–љ—Л–є –Ї—А–Є—В–µ—А–Є–є –°—В—М—О–і–µ–љ—В–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –і–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Њ–≤ –Т–Ъ–Я–Э–У –Є –Т–Ъ–Я–Э–У + –С–Ґ –љ–∞ –Я–Ч–Т. –Я–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Н—В–Є—Е –≤–∞—А–Є–∞–љ—В –њ–Њ—Б–ї–µ –Ї–∞–ґ–і–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –њ–Њ–≤—В–Њ—А–љ—Л—Е –Є–Ј–Љ–µ—А–µ–љ–Є–є ANOVA. –Х—Б–ї–Є —А–∞–Ј–љ–Є—Ж–∞ –і–Њ—Б—В–Є–≥–∞–ї–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є, —В–Њ –њ–∞—А–љ—Л–є t —В–µ—Б—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –і–ї—П –Њ—Ж–µ–љ–Ї–Є —А–∞–Ј–ї–Є—З–Є–є –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ –Љ–Њ–Љ–µ–љ—В—Л –≤—А–µ–Љ–µ–љ–Є, —Б –Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–Ї–Њ–є –њ–Њ –С–Њ–љ—Д–µ—А—А–Њ–љ–Є –і–ї—П –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л—Е —Б—А–∞–≤–љ–µ–љ–Є–є. –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–∞ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–∞, –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤–∞—А–Є–∞–љ—В —Б—А–∞–≤–љ–Є–≤–∞–ї–Є—Б—М –Љ–µ–ґ–і—Г –і–≤—Г–Љ—П –і–љ—П–Љ–Є —Б —В–µ—Б—В–Њ–≤–Њ–є –µ–і–Њ–є. –С—Л–ї–Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л —Г–љ–Є–≤–∞—А–Є–∞–љ—В–љ—Л–µ –ї–Є–љ–µ–є–љ—Л–µ —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ—Л–µ –Љ–Њ–і–µ–ї–Є –і–ї—П –Њ—Ж–µ–љ–Ї–Є –Њ—В–љ–Њ—И–µ–љ–Є—П –Љ–µ–ґ–і—Г –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ –≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ (–Я–Ч–Т, —А–µ–∞–Ї—В–Є–≤–љ–∞—П –≥–Є–њ–µ—А–µ–Љ–Є—П, –Ь–Ь–Р–1, –Т–Ь–Ъ–Р–1 –Є –Х–—Б–µ–ї–µ–Ї—В–Є–љ) –Є –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л –Є —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є. –£—А–Њ–≤–µ–љ—М –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є —А–∞–≤–µ–љ 0,05.
–†–µ–Ј—Г–ї—М—В–∞—В—Л
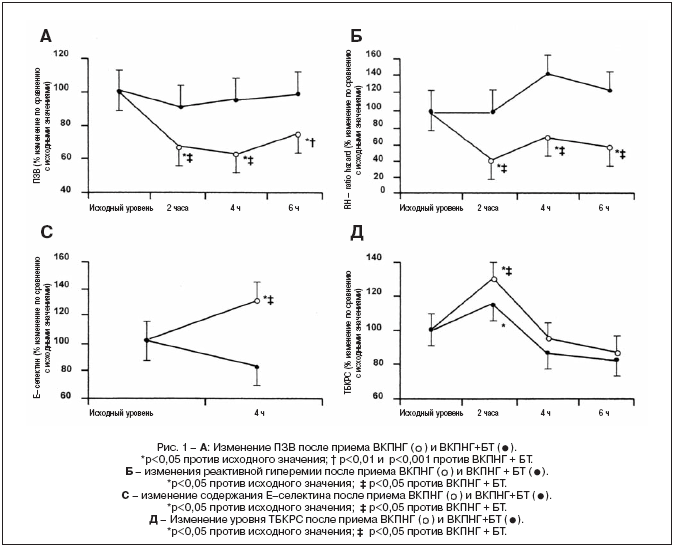
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1.
–Т–ї–Є—П–љ–Є–µ –љ–∞ –Љ–∞–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—О
–Т–Ъ–Я–Э–У –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г—Е—Г–і—И–µ–љ–Є–µ –Я–Ч–Т —Б 6,39±0,91 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ) –і–Њ 4,40±0,67 (—З–µ—А–µ–Ј 2?—З–∞—Б–∞), 4,15±0,53 (4 —З–∞—Б–∞) –Є 4,89±0,79% (6 —З–∞—Б–Њ–≤) (p<0,01). –≠—Д—Д–µ–Ї—В –Т–Ъ–Я–Э–У –њ–Њ–ї–љ–Њ—Б—В—М—О –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–ї—Б—П –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–Њ–Љ, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П (–Т–Ъ–Я–Э–У + –С–Ґ) —Б–Њ—Б—В–∞–≤–Є–ї–Є: 6,21±0,85 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ), 5,73±0,71 (2 —З–∞—Б–∞), 5,84±0,83 (4 —З–∞—Б–∞) –Є 6,30±0,85% (6?—З–∞—Б–Њ–≤) (p<0,01).
–°—В–µ–њ–µ–љ—М –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є –њ–ї–µ—З–µ–≤–Њ–є –∞—А—В–µ—А–Є–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ –њ–Њ—Б–ї–µ –Т–Ъ–Я–Э–У, —Н—Д—Д–µ–Ї—В –Ї–Њ—В–Њ—А—Л—Е –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–ї—Б—П —Б–њ—Г—Б—В—П 2 —З–∞—Б–∞ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–Њ–Љ. –Ф–Є–∞–Љ–µ—В—А –њ–ї–µ—З–µ–≤–Њ–є –∞—А—В–µ—А–Є–Є (–і–Њ –Є—И–µ–Љ–Є–Є) –Є–Ј–Љ–µ–љ–Є–ї—Б—П –њ–Њ—Б–ї–µ –Т–Ъ–Я–Э–У —Б 4,01±0,14 –Љ–Љ (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ) –і–Њ 4,10±0,14 (2 —З–∞—Б), 4,11±0,15 (4 —З–∞—Б–∞), –Є 4,29±0,15 (6?—З–∞—Б–Њ–≤) (p<0,01) –Є –њ–Њ—Б–ї–µ –Т–Ъ–Я–Э–У + –С–Ґ —Б 4,00±0,14 –Љ–Љ (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ) –і–Њ 4,04±0,14 (2 —З–∞—Б–∞) (p<0,01) –Є 4,07±0,13 (4 —З–∞—Б–∞) –Є 4,17±0,14 (6 —З–∞—Б–Њ–≤) (p<0,01). –†–∞–Ј–љ–Є—Ж—Л –Љ–µ–ґ–і—Г –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –і–Є–∞–Љ–µ—В—А–∞ –∞—А—В–µ—А–Є–Є –њ—А–Є —А–µ–∞–Ї—В–Є–≤–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–Є, –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ –≤ —В–µ—З–µ–љ–Є–µ –і–≤—Г—Е –і–љ–µ–є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–≠–Э–Ф –Њ—Б—В–∞–≤–∞–ї–∞—Б—М –љ–µ–Є–Ј–Љ–µ–љ–љ–Њ–є –≤–Њ –≤—А–µ–Љ—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ –Њ–±–Њ–Є—Е —Б–ї—Г—З–∞—П—Е, –Є—Б—Е–Њ–і–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П –Є —Б–њ—Г—Б—В—П 4 —З–∞—Б–∞ —Б–Њ—Б—В–∞–≤–Є–ї–Є 14,51±1,46 –Є 14,55±1,68% (–Т–Ъ–Я–Э–У), —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –Є 14,86±1,52 –Є 14,47±1,53% (–Т–Ъ–Я–Э–У + –С–Ґ), —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ.
–Т–ї–Є—П–љ–Є–µ –љ–∞ –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—О
–†–µ–∞–Ї—В–Є–≤–љ–∞—П –≥–Є–њ–µ—А–µ–Љ–Є—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М –њ–Њ—Б–ї–µ –Т–Ъ–Я–Э–У —Б 2,87±0,50 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ) –і–Њ 1,15±0,09 (2 —З), –Є 1,60±0,27 (6 —З) (p<0,05). –≠—Д—Д–µ–Ї—В –Т–Ъ–Я–Э–У –±—Л–ї —Б–љ–Њ–≤–∞ –љ–µ–є—В—А–∞–ї–Є–Ј–Њ–≤–∞–љ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л–Љ –њ—А–Є–µ–Љ–Њ–Љ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–∞; –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ (–Т–Ъ–Я–Э–У+–С–Ґ) —А–µ–∞–Ї—В–Є–≤–љ–∞—П –≥–Є–њ–µ—А–µ–Љ–Є—П –±—Л–ї–∞ 1,97±0,31 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ), 1,93±0,28 (2 —З), 2,71±0,81 (4 —З), –Є 2,36±0,44 (6 —З) (p<0,05 –њ—А–Њ—В–Є–≤ –Т–Ъ–Я–Э–У).
–Ъ—А–Њ–≤—П–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ
–Є —З–∞—Б—В–Њ—В–∞ —Б–µ—А–і–µ—З–љ—Л—Е —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є
–Ш—Б—Е–Њ–і–љ–Њ–µ —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –Ї—А–Њ–≤—П–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ, –Ї–∞–Ї –Є –І–°–°, –±—Л–ї–Є —Б—А–∞–≤–љ–Є–Љ—Л –Љ–µ–ґ–і—Г –і–≤—Г–Љ—П —В–µ—Б—В–Њ–≤—Л–Љ–Є –і–љ—П–Љ–Є, –Є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –Ї—А–Њ–≤—П–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–Ј–Є–ї–Њ—Б—М —З–µ—А–µ–Ј 4 —З–∞—Б–∞ –њ–Њ—Б–ї–µ –Њ–±–Њ–Є—Е –њ—А–Є–µ–Љ–Њ–≤ –њ–Є—Й–Є – –љ–∞ 6,8±2,3 –Љ–Љ —А—В.—Б—В. (–Т–Ъ–Я–Э–У) –Є 6,6±2,55 –Љ–Љ —А—В.—Б—В. (–Т–Ъ–Я–Э–У + –С–Ґ). –Ш–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–є –І–°–° –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ.
–Ь–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П
–Я–ї–∞–Ј–Љ–µ–љ–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П –≥–ї—О–Ї–Њ–Ј—Л —Б–Њ—Б—В–∞–≤–Є–ї–Є –Є—Б—Е–Њ–і–љ–Њ, —З–µ—А–µ–Ј 2, 4 –Є 6 —З –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Т–Ъ–Я–Э–У —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 153±14, 194±19*, 136±12, –Є 115±9* –Љ–≥/–і–ї, –∞ –њ–Њ—Б–ї–µ –Т–Ъ–Я–Э–У + –С–Ґ – 138±13, 164±14*, 117±9, –Є 1066*–Љ–≥/–і–ї (*p<0,05) (—А–Є—Б. 1).
–£—А–Њ–≤–µ–љ—М —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ –Є—Б—Е–Њ–і–љ–Њ, —З–µ—А–µ–Ј 2, 4 –Є 6 —З –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Т–Ъ–Я–Э–У —Б–Њ—Б—В–∞–≤–Є–ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 153±24, 162±26, 176±28*, –Є 172±25* –Љ–≥/–і–ї, –∞ –њ–Њ—Б–ї–µ –Т–Ъ–Я–Э–У + –С–Ґ – 138±21, 146±18, 157±17*, –Є 151±19* –Љ–≥/–і–ї (*p<0,05). –Ч–љ–∞—З–Є—В–µ–ї—М–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –љ–∞—З–∞–ї—М–љ—Л–Љ–Є –Є –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л –Є —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ –Ї—А–Њ–≤–Є –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ (–Љ–µ–ґ–і—Г –і–≤—Г–Љ—П —В–µ—Б—В–Њ–≤—Л–Љ–Є –і–љ—П–Љ–Є). –Ш–Ј–Љ–µ–љ–µ–љ–Є–є —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Ы–Я–Э–Я –Є –Ы–Я–Т–Я –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ.
–Т–ї–Є—П–љ–Є–µ –љ–∞ –њ–ї–∞–Ј–Љ–µ–љ–љ—Л–µ –Љ–∞—А–Ї–µ—А—Л
—Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є
–£—А–Њ–≤–µ–љ—М –≤—Б–µ—Е —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–Є—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –≠–Ф –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–ї—Б—П –њ–Њ—Б–ї–µ –Т–Ъ–Я–Э–У: –Х–—Б–µ–ї–µ–Ї—В–Є–љ, 39,5±3,6 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ) –Є 53,3±5,2* –љ–≥/–Љ–ї (4 —З); –Ь–Ь–Р–1, 213,9±11,3 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ), 231,8±11,5 (2 —З), 228,5±12,5* (4 —З), –Є 221,6±9,9 –љ–≥/–Љ–ї (6 —З), –Є –Т–Ь–Ъ–Р–1, 607,4±53,0 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ), 741,3±95,9* (2 —З), 650,1±89,8 (4 —З), –Є 575,4,6± 48,3 –љ–≥/–Љ–ї (6 —З) (*p<0,05).
–≠—В–Є —Н—Д—Д–µ–Ї—В—Л –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–ї–Є—Б—М –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л–Љ –ї–µ—З–µ–љ–Є–µ–Љ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–Њ–Љ: –Х–—Б–µ–ї–µ–Ї—В–Є–љ, 44,1±4,6 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ), –Є 35,9±3,3* –љ–≥/–Љ–ї (4 —З), –Ь–Ь–Р–1, 221,3±15,4 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ), 220,0±11,7 (2 —З), 210,2±10,4* (4 —З), –Є 211,1±9,9 –љ–≥/–Љ–ї (6 —З), –Є –Т–Ь–Ъ–Р–1, 621,3±61,3 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ), 611,4±65,0* (2 —З), 614,6±52,8 (4 —З), –Є 650,1±76,3 –љ–≥/–Љ–ї (6 —З) (*p<0,05).
–Т–ї–Є—П–љ–Є–µ –љ–∞ –Љ–∞—А–Ї–µ—А—Л –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П
–Т–Ъ–Я–Э–У –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –°–†–С —Б 0,260±0,087 –Є—Б—Е–Њ–і–љ–Њ –і–Њ 0,273±0,092 –Љ–≥/–і–ї —З–µ—А–µ–Ј 6 —З (p=0,043), –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –њ—А–Є –њ—А–Є–µ–Љ–µ –Т–Ъ–Я–Э–У + –С–Ґ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ C–†–С –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –љ–µ –Є–Ј–Љ–µ–љ–Є–ї–Њ—Б—М (0,254±0,103 –Є—Б—Е–Њ–і–љ–Њ, –і–Њ 0,259±0,101 –Љ–≥/–і–ї —З–µ—А–µ–Ј 6 —З–∞—Б–Њ–≤, p=NS –њ—А–Њ—В–Є–≤ –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П –Є –њ—А–Њ—В–Є–≤ –Т–Ъ–Я–Э–У). –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е —Д–Є–±—А–Є–љ–Њ–≥–µ–љ–∞, –§–Э–Ю–a, –Ш–Ы–6 –Є –Ш–Ы–8 –љ–µ –њ—А–Њ–Є–Ј–Њ—И–ї–Њ.
–Т–ї–Є—П–љ–Є–µ –љ–∞ –њ–ї–∞–Ј–Љ–µ–љ–љ—Л–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є
–Ъ–Я–Э–У –Є –і–Є–Ї–∞—А–±–Њ–љ–Є–ї–Њ–≤
–£—А–Њ–≤–µ–љ—М –Ъ–Ь–Ы –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї—Б—П —З–µ—А–µ–Ј 4 —З –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Т–Ъ–Я–Э–У. –Ч–љ–∞—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–Є: 9,46±1,59 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ), 8,75±1,49 (2 —З), 13,28±1,83* (4 —З) –Є 7,09±1,44 –µ–і/–Љ–ї (6 —З) (*p<0,05). –≠—В–Њ—В —Н—Д—Д–µ–Ї—В –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–ї—Б—П –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–Њ–Љ: 11,79±1,48 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ), 12,35±1,93 (2 —З), 11,57±1,90 (4 —З), –Є 8,05±2,16 –µ–і/–Љ–ї (6 —З) (p=NS –њ—А–Њ—В–Є–≤ –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П –Є –њ—А–Њ—В–Є–≤ –Т–Ъ–Я–Э–У –і–ї—П –≤—Б–µ—Е). –Я–Њ–і–Њ–±–љ–Њ —Н—В–Њ–Љ—Г —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–Њ—Б—М —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Ь–У —З–µ—А–µ–Ј 4 —З–∞—Б–∞ –њ–Њ—Б–ї–µ –Т–Ъ–Я–Э–У, –≤–∞—А—М–Є—А—Г—П –Њ—В 3,41±0,31 (2 —З) –і–Њ 4,16±0,41 (4 —З), –Є 3,02±0,45 –љ–Љ–Њ–ї—М/–ї (6 —З) (*p<0,05), –љ–Њ –љ–µ –њ–Њ—Б–ї–µ –Т–Ъ–Я–Э–У + –С–Ґ: 3,76±0,56 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ), 3,61±0,38 (2 —З), 3,51±0,54 (4 —З), –Є 2,68±0,44 –љ–Љ–Њ–ї—М/–ї (6 —З) (p=NS –њ—А–Њ—В–Є–≤ –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П –Є –њ—А–Њ—В–Є–≤ –Т–Ъ–Я–Э–У –і–ї—П –≤—Б–µ—Е).
–Т–ї–Є—П–љ–Є–µ –љ–∞ –Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–є —Б—В—А–µ—Б—Б
–Т–Ъ–Я–Э–У –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–ї–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ґ–С–Ъ–†–°: 8,14±0,47 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ) –і–Њ 10,53±0,97* (2?—З), 7,57±0,61 (4 —З), –Є 7,02±0,49 –љ–Љ–Њ–ї—М/–Љ–ї (6 —З) (*p<0,05). –≠—Д—Д–µ–Ї—В –±—Л–ї —Г–Љ–µ–љ—М—И–µ–љ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–Њ–Љ; –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–Є 7,35±0,41 (–Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ), 8,62±0,66 (2 —З) (p<0,05), 6,37±0,46 (4 —З), –Є 6,12±0,31 –љ–Љ–Њ–ї—М/–Љ–ї (6 —З). –Т—Б–µ –њ–∞—А–∞–Љ–µ—В—А—Л –љ–∞—В–Њ—Й–∞–Ї (–Я–Ч–Т, —А–µ–∞–Ї—В–Є–≤–љ–∞—П –≥–Є–њ–µ—А–µ–Љ–Є—П, –Х–—Б–µ–ї–µ–Ї—В–Є–љ, –Ь–Ь–Р–1, –Т–Ь–Ъ–Р–1, –°–†–С, –§–Є–±—А–Є–љ–Њ–≥–µ–љ, –Ъ–Ь–Ы, –Ь–У –Є –Ґ–Т–Ъ–†–°) –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –Љ–µ–ґ–і—Г —В–µ—Б—В–Њ–≤—Л–Љ–Є –і–љ—П–Љ–Є.
–Ъ–Њ—А—А–µ–ї—П—Ж–Є—П
–Э–∞–Љ–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ –Ј–љ–∞—З–Є–Љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –Љ–µ–ґ–і—Г –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є —Б–ї–µ–і—Г—О—Й–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤: –Ъ–Ь–Ы –Є —А–µ–∞–Ї—В–Є–≤–љ–∞—П –≥–Є–њ–µ—А–µ–Љ–Є—П (–њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Т–Ъ–Я–Э–У, –і–Њ 4 —З: r=–0,782, p=0,004), –Я–Ч–Т –Є —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і—Л (–њ–Њ—Б–ї–µ –Т–Ъ–Я–Э–У, –Є—Б—Е–Њ–і–љ–Њ –і–Њ 2 —З: r = –0,751, p=0,005, –Є –њ–Њ—Б–ї–µ –Т–Ъ–Я–Э–У + –С–Ґ: r =–0,708, p=0,010), –Ь–У –Є –Ъ–Ь–Ы (–њ–Њ—Б–ї–µ –Т–Ъ–Я–Э–У + –С–Ґ, –Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ – 2 —З–∞—Б–∞: r=0,726, p=0,008). –Ю–±–љ–∞—А—Г–ґ–µ–љ–∞ –њ–Њ–≥—А–∞–љ–Є—З–љ–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М, –Њ–±—А–∞—В–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –Љ–µ–ґ–і—Г –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ –Ь–У –Є –Я–Ф –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Т–Ъ–Я–Э–У (–Є—Б—Е–Њ–і–љ–Њ–µ –Ї 4 —З: r= –0,532, p=0,075). –Ґ–∞–Ї–ґ–µ –≤—Л—П–≤–ї–µ–љ–∞ –њ—А—П–Љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –Љ–µ–ґ–і—Г –Є—Б—Е–Њ–і–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –Ь–У –Є –Ґ–Т–Ъ–†–° (r=0,701, p=0,011). –Ф–∞–ї—М–љ–µ–є—И–Є—Е –Ї–Њ—А—А–µ–ї—П—Ж–Є–є –Љ–µ–ґ–і—Г –∞–±—Б–Њ–ї—О—В–љ—Л–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є –Є —А–∞–Ј–ї–Є—З–Є–є –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ.
–Т—Л–≤–Њ–і—Л
–У–ї–∞–≤–љ–Њ–є –љ–∞—Е–Њ–і–Ї–Њ–є –љ–∞—И–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —П–≤–Є–ї–Њ—Б—М —В–Њ, —З—В–Њ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ —Б–њ–Њ—Б–Њ–±–µ–љ –њ–Њ–ї–љ–Њ—Б—В—М—О –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—В—М –Љ–Є–Ї—А–Њ– –Є –Љ–∞–Ї—А–Њ—Б–Њ—Б—Г–і–Є—Б—В—Г—О –і–Є—Б—Д—Г–љ–Ї—Ж–Є—О, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Г—О –±–Њ–≥–∞—В–Њ–є –Ъ–Я–Э–У —В–µ—Б—В–Њ–≤–Њ–є –њ–Є—Й–µ–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ф 2 —В–Є–њ–∞. –Ь—Л –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є–ї–Є, —З—В–Њ –≥–ї–∞–≤–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ —П–≤–Є–ї–Њ—Б—М —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ —Н–љ–і–Њ–≥–µ–љ–љ—Л—Е –Ъ–Я–Э–У –Є –њ—А–Њ–і—Г–Ї—Ж–Є–Є –і–Є–Ї–∞—А–±–Њ–љ–Є–ї–Њ–≤, –∞ —В–∞–Ї–ґ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞.
–°–љ–Є–ґ–µ–љ–Є–µ –Я–Ч–Т –≤–Њ–Ј–љ–Є–Ї–∞–µ—В —Г–ґ–µ —З–µ—А–µ–Ј 2 —З–∞—Б–∞ –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Т–Ъ–Я–Э–У, –і–Њ—Б—В–Є–≥–∞–µ—В –Љ–∞–Ї—Б–Є–Љ—Г–Љ–∞ —З–µ—А–µ–Ј 4 —З–∞—Б–∞ –Є –і–ї–Є—В—Б—П –љ–µ –Љ–µ–љ–µ–µ 6 —З–∞—Б–Њ–≤ –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ. –Я—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–Њ–Љ –љ–µ —В–Њ–ї—М–Ї–Њ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–ї–Њ –њ–∞–і–µ–љ–Є–µ –Я–Ч–Т –≤ –Ї–∞–ґ–і—Л–є –њ—А–Њ–Љ–µ–ґ—Г—В–Њ–Ї –≤—А–µ–Љ–µ–љ–Є, –љ–Њ –њ–Њ–ї–љ–Њ—Б—В—М—О –Є–Ј–Љ–µ–љ—П–ї–Њ –і–Є–љ–∞–Љ–Є–Ї—Г, —Б 6 —З–∞—Б–Њ–≤ –Я–Ч–Т –±—Л–ї–∞ –њ–Њ–ї–љ–Њ—Б—В—М—О –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞.
–Т –Ї—А–∞—В–Ї–Њ—Б—А–Њ—З–љ–Њ–Љ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–Є –Я–Ч–Т –Љ–Њ–≥—Г—В –њ—А–Є–љ–Є–Љ–∞—В—М —Г—З–∞—Б—В–Є–µ —В—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞: —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Є–љ—В–µ–Ј–∞ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–≥–Њ NO, –њ–Њ–≥–ї–Њ—Й–µ–љ–Є–µ (–љ–∞–њ—А–Є–Љ–µ—А, –Ъ–Я–Э–У, –і–Є–Ї–∞—А–±–Њ–љ–Є–ї–∞–Љ–Є, —А–µ–∞–Ї—В–Є–≤–љ—Л–Љ–Є –Ї–Є—Б–ї–Њ—А–Њ–і–љ—Л–Љ–Є —А–∞–і–Є–Ї–∞–ї–∞–Љ–Є) –Є–ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є NO –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї. –Ь—Л –Љ–Њ–ґ–µ–Љ –Є—Б–Ї–ї—О—З–Є—В—М –њ–Њ—Б–ї–µ–і–љ–Є–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –≥–ї–Є—Ж–µ—А–Њ–ї—В—А–Є–љ–Є—В—А–∞—В––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–∞—П –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є—П –Њ—Б—В–∞–≤–∞–ї–∞—Б—М –љ–µ–Є–Ј–Љ–µ–љ–љ–Њ–є –≤–Њ –≤—А–µ–Љ—П –≤—Б–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –њ–ї–∞–Ј–Љ–µ–љ–љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є (–Х–—Б–µ–ї–µ–Ї—В–Є–љ, –Ь–Ь–Р–1 –Є –Т–Ъ–Ь–Р–1) –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –≠–§, –∞ –Ј–љ–∞—З–Є—В, –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ–µ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ –њ—А–Њ–і—Г–Ї—Ж–Є–Є NO. –Т —Б–≤—П–Ј–Є —Б –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –Ґ–С–Ъ–†–° —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞–ї—Б—П –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ—Л–є —Б—В—А–µ—Б—Б, —З—В–Њ, –≤–µ—А–Њ—П—В–љ–Њ, –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –њ—А–Њ–≤–Њ—Ж–Є—А–Њ–≤–∞–ї–Њ «–Њ–±–Ї—А–∞–і—Л–≤–∞–љ–Є–µ» NO. –Ф–∞–ї–µ–µ, –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Я–Ч–Т –Љ–Њ–ґ–µ—В –±—Л—В—М —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ —Б–Њ–Ї—А–∞—Й–µ–љ–Є—П –њ—А–Њ–і—Г–Ї—Ж–Є–Є NO –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—П –µ–≥–Њ «–Њ–±–Ї—А–∞–і—Л–≤–∞–љ–Є—П», —З—В–Њ —Б–љ–Є–ґ–∞–µ—В –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М NO.
–Э–∞–Љ–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–∞—П –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є—П –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Т–Ъ–Я–Э–У, –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–∞ –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Т–Ъ–Я–Э–У + –С–Ґ —З–µ—А–µ–Ј 2 —З–∞—Б–∞. –Я–Њ–і–Њ–±–љ—Л–µ –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –і–Є–∞–Љ–µ—В—А–∞ –∞—А—В–µ—А–Є–Є –њ—А–Є —А–µ–∞–Ї—В–Є–≤–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–Є –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –≤–Њ –≤—А–µ–Љ—П –Њ–±–Њ–Є—Е —В–µ—Б—В–Њ–≤—Л—Е –і–љ–µ–є. –Ю–і–љ–∞–Ї–Њ –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –Я–Ч–Т –љ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ—В–љ–µ—Б–µ–љ–Њ –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –Ї –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є (–Є–Ј–Љ–µ—А–µ–љ–љ–Њ–є –Ї–∞–Ї –і–Є–∞–Љ–µ—В—А –∞—А—В–µ—А–Є–Є –і–Њ –Є—И–µ–Љ–Є–Є), –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –љ–∞—И–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Њ—З–µ–≤–Є–і–љ–Њ –њ–Њ–Ї–∞–Ј–∞–ї–Њ –њ–∞—А–∞–ї–ї–µ–ї—М–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–ї–∞–Ј–Љ–µ–љ–љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є –Љ–∞—А–Ї–µ—А–Њ–≤, –Њ—В—А–∞–ґ–∞—О—Й–Є—Е –≠–Ф.
–Ю–±—К—П—Б–љ–µ–љ–Є–µ–Љ –љ–∞–±–ї—О–і–∞–µ–Љ–Њ–є –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–є –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є –Љ–Њ–≥–ї–∞ –±—Л—В—М –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–∞—П –њ—А–Є–µ–Љ–Њ–Љ –њ–Є—Й–Є —Б–µ–Ї—А–µ—Ж–Є—П –Є–љ—Б—Г–ї–Є–љ–∞. –Ґ–∞–Ї–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Є–љ—Б—Г–ї–Є–љ–∞ –Љ–Њ–ґ–µ—В —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞—В—М –њ—А–Њ–і—Г–Ї—Ж–Є—О NO, —З—В–Њ –≤–µ–і–µ—В –Ї –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є –љ–∞ –Љ–∞–Ї—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–Љ —Г—А–Њ–≤–љ–µ [36] –Є –Љ–Њ–ґ–µ—В –ї–Є—И—М —З–∞—Б—В–Є—З–љ–Њ –љ–µ–є—В—А–∞–ї–Є–Ј–Њ–≤—Л–≤–∞—В—М—Б—П –њ—А–Њ–і—Г–Ї—Ж–Є–µ–є —Б—Г–њ–µ—А–Њ–Ї—Б–Є–і–∞ –≤ –Њ—В–≤–µ—В –љ–∞ –Т–Ъ–Я–Э–У. –С–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ, –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—П –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ—Л–є —Б—В—А–µ—Б—Б (—Г–Љ–µ–љ—М—И–∞–µ—В —Г—А–Њ–≤–µ–љ—М –Ґ–С–Ъ–†–° —З–µ—А–µ–Ј 2 —З–∞—Б–∞), –Љ–Њ–ґ–µ—В –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ –њ–Њ–≤–ї–Є—П—В—М –љ–∞ –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М. –Я–Њ—Н—В–Њ–Љ—Г –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П –≤–ї–Є—П–љ–Є–µ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–Њ–Љ –љ–∞ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ —Б–µ–Ї—А–µ—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–∞ –Є –і–∞–ї—М–љ–µ–є—И—Г—О –Љ–∞–Ї—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Г—О –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є—О (–њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ–ї–∞–Ј–Љ–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Є–љ—Б—Г–ї–Є–љ–∞ –љ–µ –Њ—Ж–µ–љ–Є–≤–∞–ї—Б—П).
–Ъ–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –љ–Є—В—А–Є—В–Њ–≤ –Є –љ–Є—В—А–∞—В–Њ–≤ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П NO, –љ–µ –Є–Ј–Љ–µ—А—П–ї–∞—Б—М, –≤–Љ–µ—Б—В–Њ —Н—В–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ—Л —Г—А–Њ–≤–љ–Є –Љ–Њ–ї–µ–Ї—Г–ї –∞–і–≥–µ–Ј–Є–Є (–Ь–Ь–Р–1, –Т–Ь–Ъ–Р–1) –Є –Х–—Б–µ–ї–µ–Ї—В–Є–љ–∞. –Ю–љ–Є –љ–∞–њ—А—П–Љ—Г—О –Њ—В—А–∞–ґ–∞—О—В –≠–Ф –Є –Ї–Њ—А—А–µ–ї–Є—А—Г—О—В —Б —Г—А–Њ–≤–љ–µ–Љ –њ–ї–∞–Ј–Љ–µ–љ–љ—Л—Е –љ–Є—В—А–Є—В–Њ–≤ –Є –љ–Є—В—А–∞—В–Њ–≤, –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ, –њ–Њ–і –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –њ–Њ—В—А–µ–±–ї—П–µ–Љ–Њ–є –њ–Є—Й–Є [37,38]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—П «–њ—А–Њ—А–µ–∞–≥–Є—А–Њ–≤–∞–ї–∞» —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–Њ —Б –Я–Ч–Т, –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј–ї–Є—З–Є–є: —А–µ–∞–Ї—В–Є–≤–љ–∞—П –≥–Є–њ–µ—А–µ–Љ–Є—П –±—Л–ї–∞ —Г–ґ–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –љ–∞—А—Г—И–µ–љ–∞ —Б–њ—Г—Б—В—П 2 —З–∞—Б–∞ –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Т–Ъ–Я–Э–У (–Я–Ч–Т – —Б–њ—Г—Б—В—П 4 —З–∞—Б–∞) –Є –љ–µ –і–Њ—Б—В–Є–≥–ї–∞ –љ–∞—З–∞–ї—М–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Б–њ—Г—Б—В—П 6 —З–∞—Б–Њ–≤ (–њ–Њ–і–Њ–±–љ–Њ –Я–Ч–Т). –С–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ —Б–љ–Њ–≤–∞ –њ—А–µ–і–Њ—В–≤—А–∞—В–Є–ї –љ–∞—А—Г—И–µ–љ–Є–µ —А–µ–∞–Ї—В–Є–≤–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–Є, –Є –њ–Њ–ї–љ–Њ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –њ—А–Њ–Є–Ј–Њ—И–ї–Њ —З–µ—А–µ–Ј 4?—З–∞—Б–∞. –Я–Ч–Т —Б—З–Є—В–∞–µ—В—Б—П –њ—А–µ–і–Њ–Љ–Є–љ–∞–љ—В–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є NO (–µ—Б–ї–Є –њ–∞—А–∞–ї–ї–µ–ї—М–љ–Њ –Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П –≥–ї–Є—Ж–µ—А–Њ–ї—В—А–Є–љ–Є—В—А–∞—В), –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —А–µ–≥—Г–ї—П—Ж–Є—П –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є – —Б–ї–Њ–ґ–љ–∞—П —Б–Є—Б—В–µ–Љ–∞, –≥–і–µ, –њ–Њ –Љ–љ–µ–љ–Є—О –љ–µ–Ї–Њ—В–Њ—А—Л—Е –∞–≤—В–Њ—А–Њ–≤, –њ—А–Є–љ–Є–Љ–∞—О—В —Г—З–∞—Б—В–Є–µ –≤–∞–Ј–Њ–і–Є–ї–∞—В–Є—А—Г—О—Й–Є–µ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ—Л [39], —З—В–Њ —Б—В–∞–≤–Є—В—Б—П –њ–Њ–і —Б–Њ–Љ–љ–µ–љ–Є–µ –і—А—Г–≥–Є–Љ–Є [40]. –Ь–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—П —А–µ–∞–≥–Є—А—Г–µ—В –±—Л—Б—В—А–µ–µ –љ–∞ –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, —З–µ–Љ –Љ–∞–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—П: –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤ –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–µ –љ–∞—А—Г—И–µ–љ–Є–µ —А–µ–∞–Ї—В–Є–≤–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–Є –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –љ–∞ 2?—З–∞—Б—Г, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –Я–Ч–Т –±—Л–ї–∞ —Б–∞–Љ–Њ–є –љ–Є–Ј–Ї–Њ–є –љ–∞ 4 —З–∞—Б—Г. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–Њ–Љ —Г–ґ–µ –њ—А–Є–≤–µ–ї–Њ –Ї –њ–Њ–ї–љ–Њ–Љ—Г –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О —А–µ–∞–Ї—В–Є–≤–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–Є —Б–њ—Г—Б—В—П 4 —З–∞—Б–∞, –∞ –Я–Ч–Т –љ–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–ї–∞—Б—М –ї–Є—И—М —Б–њ—Г—Б—В—П 6 —З–∞—Б–Њ–≤.
–£—А–Њ–≤–µ–љ—М —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–Є—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –≠–Ф, –Х–—Б–µ–ї–µ–Ї—В–Є–љ, –Ь–Ь–Р–1 –Є –Т–Ь–Ъ–Р–1 –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–ї—Б—П –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Т–Ъ–Я–Э–У. –Я—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –С–Ґ –≤ —В–µ—З–µ–љ–Є–µ 3?–і–љ–µ–є –њ–Њ–ї–љ–Њ—Б—В—М—О —Г—Б—В—А–∞–љ–Є–ї–Њ —Г–Ї–∞–Ј–∞–љ–љ—Л–µ –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л. –•–Њ—В—П –С–Ґ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Є–Ј–Љ–µ–љ–Є–ї –њ–Њ—Б–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л–є –Њ—В–≤–µ—В, –Њ–љ –љ–µ —Г–ї—Г—З—И–Є–ї –љ–Є –Њ–і–Є–љ –Є–Ј –њ–∞—А–∞–Љ–µ—В—А–Њ–≤, –Є–Ј–Љ–µ—А–µ–љ–љ—Л—Е –љ–∞—В–Њ—Й–∞–Ї (–Я–Ч–Т, —А–µ–∞–Ї—В–Є–≤–љ–∞—П –≥–Є–њ–µ—А–µ–Љ–Є—П, –Х–—Б–µ–ї–µ–Ї—В–Є–љ, –Ь–Ь–Р–1, –Т–Ь–Ъ–Р–1, –Ъ–Ь–Ы –Є–ї–Є —Д–Є–±—А–Є–љ–Њ–≥–µ–љ). –≠—В–Њ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –Љ–∞–ї–Њ–є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –ї–µ—З–µ–љ–Є—П, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –і–ї—П –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Є—Б—Е–Њ–і–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є, –љ–Њ –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ–Њ–µ –Њ–±—К—П—Б–љ–µ–љ–Є–µ – —В–Њ, —З—В–Њ –С–Ґ––Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –Ј–∞—Й–Є—Й–∞—О—В –Њ—В –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–є –≠–Ф –≤–љ–µ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї. –С–Ґ, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –і–µ–є—Б—В–≤—Г–µ—В –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –њ—Г—В–µ–Љ –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤, –Є–љ–і—Г—Ж–Є—А—Г—О—Й–Є—Е –≠–Ф (—В–∞–Ї–Є–µ –Ї–∞–Ї –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ—Л–є —Б—В—А–µ—Б—Б, –Ъ–Я–Э–У, –Є –њ—А–Њ–і—Г–Ї—Ж–Є—П –і–Є–Ї–∞—А–±–Њ–љ–Є–ї–Њ–≤), —З–µ–Љ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Г–ї—Г—З—И–µ–љ–Є—П –≠–§. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ Beisswenger –Є –і—А. [23], –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є–∞–±–µ—В–Њ–Љ, –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є—П –±—Л—Б—В—А–Њ –Є–љ–і—Г—Ж–Є—А—Г–µ—В in vivo —Б–Є–љ—В–µ–Ј –і–Є–Ї–∞—А–±–Њ–љ–Є–ї–Њ–≤ (–≤—Л—Б–Њ–Ї–Њ—А–µ–∞–Ї—В–Є–≤–љ—Л—Е –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ –Ъ–Я–Э–У), —В–∞–Ї–Є—Е –Ї–∞–Ї –Ь–У –Є 3––і–µ–Њ–Ї—Б–Є–≥–ї—О–Ї–Њ–Ј–Њ–љ [41]. –Т –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л–є —Г—А–Њ–≤–µ–љ—М —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–Є—Е –Ь–У —Г–≤–µ–ї–Є—З–Є–ї—Б—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –љ–∞ 4 —З–∞—Б—Г, –Є –і–∞–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –±—Л–ї –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ –С–Ґ. –Ф–Є–Ї–∞—А–±–Њ–љ–Є–ї—Л –Љ–Њ–≥—Г—В –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞—В—М –Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–є —Б—В—А–µ—Б—Б, –њ—А–Њ–≤–Њ—Ж–Є—А–Њ–≤–∞—В—М –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ [42] –Є –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞—В—М —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л–є –∞–њ–Њ–њ—В–Њ–Ј [43] –Є –і–Є—Б—Д—Г–љ–Ї—Ж–Є—О [44].
–Э–∞—И–Є –і–∞–љ–љ—Л–µ –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ –С–Ґ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–ї –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Г—А–Њ–≤–љ–µ–є —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–Є—Е –Ь–У –Є –Ъ–Ь–Ы —Г —З–µ–ї–Њ–≤–µ–Ї–∞. –Т —Б–≤—П–Ј–Є —Б–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –С–Ґ —Г–Љ–µ–љ—М—И–∞—В—М –∞–±—Б–Њ—А–±—Ж–Є—О –Ъ–Я–Э–У —Б—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –њ—А–Є –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є –Љ–Њ–ґ–µ—В –±—Л—Б—В—А–Њ –љ–∞—З–Є–љ–∞—В—М—Б—П –њ—А–Њ–і—Г–Ї—Ж–Є—П –љ–µ —В–Њ–ї—М–Ї–Њ –Ь–У, –љ–Њ –Є —Н–љ–і–Њ–≥–µ–љ–љ—Л—Е –Ъ–Ь–Ы [45], –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –С–Ґ –Љ–Њ–ґ–µ—В —Б–љ–Є–ґ–∞—В—М –Ї–∞–Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —Н–љ–і–Њ–≥–µ–љ–љ—Л—Е –Ъ–Я–Э–У, —В–∞–Ї –Є –і–Є–Ї–∞—А–±–Њ–љ–Є–ї–Њ–≤. –Ю–Ї—Б–Є–і–∞–љ—В–љ–Њ–µ –Њ–Ї—А—Г–ґ–µ–љ–Є–µ, –Ї–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, —Г—Б–Ї–Њ—А—П–µ—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –Ъ–Я–Э–У –Є, –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, —Г—А–Њ–≤–µ–љ—М –Ґ–С–Ъ–Р–† —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ —Б–њ—Г—Б—В—П 2 —З–∞—Б–∞ (—Б –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–Є–Љ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Ь–У –Є –Ъ–Ь–Ы). –Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –љ–∞—И–µ–є –≥–Є–њ–Њ—В–µ–Ј–Њ–є –С–Ґ —Б–Њ–Ї—А–∞—Й–∞–µ—В –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Ъ–Ь–Ы –Є –Ь–У –і–≤—Г–Љ—П —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є: –∞–Ї—В–Є–≤–Є—А—Г—П —Д–µ—А–Љ–µ–љ—В–љ—Г—О —В—А–∞–љ—Б–Ї–µ—В–Њ–ї–∞–Ј—Г (–њ–µ—А–µ–љ–∞–њ—А–∞–≤–ї—П–µ—В –≥–ї—О–Ї–Њ–Ј—Г —Б –Ъ–Я–Э–У––≥–µ–љ–µ—А–Є—А—Г—О—Й–µ–≥–Њ –њ—Г—В–Є) –Є —Г–Љ–µ–љ—М—И–∞—П –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ—Л–є —Б—В—А–µ—Б—Б. –≠—В–Є–Љ–Є –њ—Г—В—П–Љ–Є –С–Ґ –Љ–Њ–ґ–µ—В –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ —Б–Њ–Ї—А–∞—Й–∞—В—М –Ъ–Я–Э–У –Є —А–µ–∞–Ї—В–Є–≤–љ—Г—О –Ї–Є—Б–ї–Њ—А–Њ–і–љ—Г—О —А–∞–і–Є–Ї–∞–ї––Ј–∞–≤–Є—Б–Є–Љ—Г—О —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Г—О –Ї–ї–µ—В–Њ—З–љ—Г—О –і–Є—Б—Д—Г–љ–Ї—Ж–Є—О, –Є «–Њ–±–Ї—А–∞–і—Л–≤–∞–љ–Є–µ» NO.
–Ь—Л –≤—Л—П–≤–Є–ї–Є –Ј–љ–∞—З–Є–Љ—Г—О –Њ–±—А–∞—В–љ—Г—О –Ї–Њ—А—А–µ–ї—П—Ж–Є—О –Љ–µ–ґ–і—Г —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Ъ–Ь–Ы –Є –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Љ–Є–Ї—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Г—О –Њ–±—А–∞—В–љ—Г—О –Ї–Њ—А—А–µ–ї—П—Ж–Є—О –Љ–µ–ґ–і—Г –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Ь–У –Є –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Я–Ч–Т. –≠—В–Њ—В —Д–∞–Ї—В –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В –њ—А—П–Љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Ъ–Ь–Ы –Є –Ь–У –љ–∞ –≤–∞—Б–Ї—Г–ї—П—А–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О, –њ—А–Є—З–µ–Љ –Ъ–Ь–Ы –Є–≥—А–∞–µ—В –±–Њ–ї–µ–µ –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є. –Ф–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П —Н—В–Њ–є –≥–Є–њ–Њ—В–µ–Ј—Л –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Ю–±—А–∞—В–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –Љ–µ–ґ–і—Г –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –Ъ–Ь–Ы –Є –Ґ–У, –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –±–Њ–ї—М—И–µ–Љ –≤–ї–Є—П–љ–Є–Є –≥–Є–њ–µ—А—В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–µ–Љ–Є–Є –љ–∞ –≤–∞—Б–Ї—Г–ї—П—А–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О, —З–µ–Љ –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–Є (–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –њ—Г—В–µ–Љ –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–Є—П –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞). –Ф–∞–љ–љ–∞—П –≥–Є–њ–Њ—В–µ–Ј–∞ –њ–Њ–і–Ї—А–µ–њ–ї—П–µ—В—Б—П –і–∞–љ–љ—Л–Љ–Є –Њ —В–Њ–Љ, —З—В–Њ —Б –њ—А–Њ–≤–Њ—Ж–Є—А–Њ–≤–∞–љ–љ–∞—П –њ—А–Є–µ–Љ–Њ–Љ –њ–Є—Й–Є —Б–Њ—Б—Г–і–Є—Б—В–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П –Є–Љ–µ–µ—В –Њ–±—А–∞—В–љ–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ –њ—А–Є –ї–µ—З–µ–љ–Є–Є —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–Њ–Љ [11].
–Т–Ъ–Я–Э–У —Б–∞–Љ–Є –њ–Њ —Б–µ–±–µ –≤—Л–Ј—Л–≤–∞—О—В –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –°–†–С —З–µ—А–µ–Ј 6 —З–∞—Б–Њ–≤, –і–∞–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –њ—А–µ–і–Њ—В–≤—А–∞—В–Є–Љ –С–Ґ. –Я—А—П–Љ—Л–µ –Є–ї–Є –љ–µ–њ—А—П–Љ—Л–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–∞ –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л —А–∞–љ–µ–µ [46] –Є –Њ—З–µ–≤–Є–і–љ—Л –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В—Л.
–Ф–ї—П –Њ–±–Њ–Є—Е –і–љ–µ–є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Е–∞—А–∞–Ї—В–µ—А–љ—Л —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–µ –Є—Б—Е–Њ–і–љ—Л–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –њ–∞—А–∞–Љ–µ—В—А—Л. –Я–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л–µ –њ–µ—А–Є–Њ–і—Л (–њ–Њ—Б–ї–µ –Њ–±–Њ–Є—Е –њ—А–Є–µ–Љ–Њ–≤ –њ–Є—Й–Є) —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Є—Б—М –Ј–љ–∞—З–Є–Љ—Л–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–ї—О–Ї–Њ–Ј—Л –Ї—А–Њ–≤–Є —Б–њ—Г—Б—В—П 2 —З–∞—Б–∞ –Є —Б–љ–Є–ґ–∞–ї–Є—Б—М —Б–њ—Г—Б—В—П 6 —З–∞—Б–Њ–≤ (–њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ). –£—А–Њ–≤–µ–љ—М —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї—Б—П –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ —З–µ—А–µ–Ј 4 –Є 6?—З–∞—Б–Њ–≤ –њ–Њ—Б–ї–µ –і–≤—Г—Е –њ—А–Є–µ–Љ–Њ–≤ –њ–Є—Й–Є.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞—И–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Њ, —З—В–Њ —В–µ—А–Љ–Є—З–µ—Б–Ї–Є –Њ–±—А–∞–±–Њ—В–∞–љ–љ–∞—П —В–µ—Б—В–Њ–≤–∞—П –њ–Є—Й–∞ —Б –Т–Ъ–Я–Э–У –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–ї–∞ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Г—О –і–Є—Б—Д—Г–љ–Ї—Ж–Є—О –Є –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ—Л–є —Б—В—А–µ—Б—Б –Є –њ–Њ–≤—Л—Б–Є–ї–∞ –њ–ї–∞–Ј–Љ–µ–љ–љ—Л–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ъ–Я–Э–У –Є –Ь–У, –њ—А–Є—З–µ–Љ —Н—В–Њ—В —Н—Д—Д–µ–Ї—В –њ—А–µ–і–Њ—В–≤—А–∞—В–Є–Љ –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ–Њ–Љ. –Ь—Л –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ, —З—В–Њ –С–Ґ –Љ–Њ–ґ–µ—В –Є–≥—А–∞—В—М –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –њ—А–µ–≤–µ–љ—В–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є–∞–±–µ—В–Њ–Љ.
–Ю–≥—А–∞–љ–Є—З–µ–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Э–∞—И–Є –њ–∞—Ж–Є–µ–љ—В—Л –Є–Љ–µ–ї–Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М Hb–Р1–° (8,5±0,5%) —Б –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–Є–Ј–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –≥–ї–Є–Ї–µ–Љ–Є–Є –љ–∞—В–Њ—Й–∞–Ї. –≠—В–Њ –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ—П—В—М—Б—П –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л–Љ –Ї–Њ–ї–µ–±–∞–љ–Є–µ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–ї—О–Ї–Њ–Ј—Л –Ї—А–Њ–≤–Є [47].
–•–Њ—В—П —З–Є—Б–ї–Њ –Њ–±—К–µ–Ї—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (n=13), –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –љ–µ–≤–µ–ї–Є–Ї–Њ, —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞—И–µ–є —А–∞–±–Њ—В—Л —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —А–∞–Ј–Љ–µ—А –≤—Л–±–Њ—А–Ї–Є –Њ—Б–љ–Њ–≤–∞–љ –љ–∞ –≤—Л—З–Є—Б–ї–µ–љ–Є—П—Е —А–∞–љ–µ–µ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е —А–∞–±–Њ—В [31].
–Ґ–µ—А–Љ–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ –њ–Є—Й–Є –Љ–Њ–ґ–µ—В –њ—А–Њ–≤–Њ—Ж–Є—А–Њ–≤–∞—В—М –і—А—Г–≥–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –Њ—В–ї–Є—З–љ—Л–µ –Њ—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Ъ–Я–Э–У, —В–∞–Ї–Є–µ –Ї–∞–Ї –Є–љ–∞–Ї—В–Є–≤–∞—Ж–Є—П –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Є –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–Њ–≤ [48) –Є–ї–Є —Б–Њ–Ј–і–∞–љ–Є–µ –і—А—Г–≥–Є—Е —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ [49]. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –љ–µ –Љ–Њ–ґ–µ—В –Є—Б–Ї–ї—О—З–∞—В—М—Б—П –≤–Ї–ї–∞–і –≤ –љ–∞–±–ї—О–і–∞–µ–Љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –≤–µ—Й–µ—Б—В–≤, –Њ—В–ї–Є—З–љ—Л—Е –Њ—В –Ъ–Я–Э–У. –Ф–Њ —Б–Є—Е –њ–Њ—А –≥–ї–∞–≤–љ–∞—П –Љ—Л—Б–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—Б—В–∞–µ—В—Б—П –љ–µ–Є–Ј–Љ–µ–љ–љ–Њ–є, –∞ –Є–Љ–µ–љ–љ–Њ: —В–µ—А–Љ–Є—З–µ—Б–Ї–Є —Б–Є–ї—М–љ–Њ –Њ–±—А–∞–±–Њ—В–∞–љ–љ–∞—П –њ–Є—Й–∞ –Є–љ–і—Г—Ж–Є—А—Г–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Г—О –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Г—О –≠–Ф –љ–Њ —Н—В–Њ—В —Н—Д—Д–µ–Ї—В –Љ–Њ–ґ–µ—В –њ—А–µ—В–µ—А–њ–µ–≤–∞—В—М –Њ–±—А–∞—В–љ–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ –С–Ґ. –Э–∞—И–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ—Б–≤–µ—Й–∞–µ—В –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л, –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –Ї–Њ—В–Њ—А—Л—Е –±–µ–љ—Д–Њ—В–Є–∞–Љ–Є–љ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Г—О –≤–∞—Б–Ї—Г–ї—П—А–љ—Г—О –і–Є—Б—Д—Г–љ–Ї—Ж–Є—О, –љ–Њ –њ—А–µ–і–ї–∞–≥–∞–µ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≥–Є–њ–Њ—В–µ–Ј. –Ф–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П —Б—В—А—Г–Ї—В—Г—А—Л —Н—В–Є—Е —В–Њ–љ–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —В—А–µ–±—Г–µ—В—Б—П –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –і–∞–ї—М–љ–µ–є—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Celermajer DS, Adams MR, Clarkson P, RobinsonJ, McCredie R, Donald A, Dean–
field JE: Passive smoking and impaired endothelium–dependent arterial dilatation in healthy young adults. N Engl] Med 334:150–154, 1996
2. Sorensen KE, Celermajer DS, Georgakopoulos D, Hatcher G, Betteridge DJ, Deanfield JE: Impairment of endotheliui dependent dilation is an early event children with familial hypercholesten emia and is related to the lipoprotein( level. J Clin Invest 93:50–55, 1994
3. Panza JA: Endothelium–dependent vas dilatation and essential hypertensii (Letter). N Engl] Med 331:951, 1994
4. Tack CJ, Ong MK, Lutterman JA, Smits Insulin–induced vasodilatation and end thelial function in obesity/insulin res tance: effects of troglitazone. Diabetolog 41:569–576, 1998
5. Tousoulis D, Charakida M, Stefanadis Endothelial function and inflammation coronary artery disease (Review). Hec 92:441–444, 2005
6. Zelis R, Mason DT, Braunwald E: A coi parison of the effects of vasodilator stimi on peripheral resistance vessels in norrr subjects and in patients with congesti heart failure. J Clin Invest 47:960–97 1968
7. Clarkson P, Celermajer DS, Donald A Sampson M, Sorensen KE, Adams M, Y DK, Betteridge DJ, DeanfieldJE: Impair vascular reactivity in insulin–depende diabetes mellitus is related to disease d ration and low density lipoprotein chols terol levels. J Am Coll Cardiol 28:573–57 1996
8. Tooke JE, Goh KL: Vascular function type 2 diabetes mellitus and pre–diabeti the case for intrinsic endotheiopathy (F view). DiabetMed 16:710–715, 1999
9. Ceriello A: The post–prandial state a: cardiovascular disease: relevance to d betes mellitus (Review). Diabetes Met Res Rev 16:125–132, 2000
10. Ling L, Zhao SP, Gao M, Zhou QC, Li ^i Xia B: Vitamin C preserves endothel function in patients with coronary he; disease after a high–fat meal. Clin Card 25:219–224, 2002
11. Ceriello A, Taboga C, Tonutti L, Quag aro L, Piconi L, Bais B, Da RR, M( E: Evidence for an independent a cumulative effect of postprandial hyp< triglyceridemia and hyperglycemia endothelial dysfunction and oxidati stress generation: effects of short– a long–term simvastatin treatment. Circ lation 106:1211–1218, 2002
12. Schinkovitz A, Dittrich P, Wascher 1 Effects of a high–fat meal on resistar vessel reactivity and on indicators of o dative stress in healthy volunteers. C Physio! 21:404–410, 2001
13. Akbari CM, Saouaf R, Bamhill DF, Ne man PA, LoGerfo FW, Veves A: Endotl lium–dependent vasodilatation is i paired in both microcirculation a macrocirculation during acute hyperg cemia.; Vase Surg 28:687–694, 1998
14. Lee IK, Kim HS, Bae JH: Endothelial d; function: its relationship with acute 1 perglycaemia and hyperlipidemia. Int ] Clin Pract Suppl 59–64, 2002
15. Mangoni AA, Sherwood RA, Asonganyi B, Swift CG, Thomas S, Jackson SH: Shortterm oral folic acid supplementation enhances endothelial function in patients with type 2 diabetes. Am] Hypertens 18:220–226, 2005
16. Lind L, Fugmann A, Branth S, Vessby B, Millgard J, Berne C, Lithell H: The impair
ment^ endothelial function induced by non–esterified fatty acids can be reversed
by insulin. Clin Sci (Lond) 99:169–174, 2000
17. Paolisso G, Tagliamonte MR, Barbieri M, Zito GA, Gambardella A, Varricchio G, Ragno E, Varricchio M: Chronic vitamin E administration improves .brachial reactiv¬ity and increases intracellular magnesium concentration in type II diabetic patients. J din Endocrinol Metab 85:109 –115,2000
18. Vlassara H, Cai W, Crandall J, Goldberg T, Oberstein R, Dardaine V, Peppa M, Rayfield EJ: Inflammatory mediators are induced by dietary glycotoxins, a major risk factor for diabetic angiopathy. Proc Natl Acad Sci U S A 99:15596–15601, 2002
19. Vlassara H, Uribarri J: Glycoxidation and diabetic complications: modem lessons and a warning? (Review). Rev Endocr Metab Disord 5:181–188, 2004
20. GoldbergT, Cai W, Peppa M, Dardaine V, Baliga BS, Uribarri J, Vlassara H: Ad
vanced glycoxidation end products in commonly consumed foods. J Am Diet As–
soc 104:1287–1291, 2004
21. Koschinsky T, He CJ, Mitsuhashi T, Bucala R, Liu C, Buenting C, Heitmann K,
Vlassara H: Orally absorbed reactive glycation products (glycotoxins): an envi¬ronmental risk factor in diabetic nephropathy. Proc Natl Acad SciUSA 94: 6474–6479, 1997
22. Bierhaus A, Humpert PM, Morcos M, Wendt T, Chavakis T, Arnold B, Stern DM, Nawroth PP: Understanding RAGE, the receptor for advanced glycation end products (Review). J Mol Med 83:876–886, 2005
23. Beisswenger PJ, Howell SK, O’Dell RM, Wood ME, Touchette AD, Szwergold BS: a–Dicarbonyls increase in the postprandial period and reflect the degree of hyperglycemia. Diabetes Care 24:726–732,2001
24. Schreeb KH, Freudenthaler S, Vormfelde SV, Gundert–Remy U, Gleiter CH: Com¬parative bio vailability of two vitamin Bl preparations: benfotiamine and thiamine mononitrate (Letter). Eur] Clin Pharmacol 52:319–320, 1997
25. Haupt E, Ledermann H, Kopcke W: Benfotiamine in the treatment of diabetic polyneuropathy: a three–week randomized, controlled pilot study (BEDIP study). Int] Clin Pharmacol Ther 43:71–
77, 2005
26. Hammes HP, Du X, Edelstein D, Taguchi T, Matsumura T, Ju Q, LinJ, Bierhaus A, Nawroth P, Hannak D, Neumaier M, Bergfeld R, Giardino 1, Brownlee M: Ben fotiamine blocks three major pathways of hyperglycemic damage and prevents ex perimental diabetic retinopathy. Nat Med
9:294–299, 2003
27. Pomero F, Molinar MA, La SM, Allione A, Molinatti GM, Porta M: Benfotiamine is similar to thiamine in correcting endothelial cell defects induced by high glucose. Acta Diabetol 38:135–138, 2001
28. Beltramo E, Berrone E, Buttiglieri S, Porta M: Thiamine and benfotiamine prevent increased apoptosis in endothelial cells and pericytes cultured in high glucose. Diabetes Metab Res Rev 20:330–336,2004
29. King H, Aubert RE, Herman WH: Global burden of diabetes, 1995–2025: preva¬lence, numerical estimates, and projections. Diabetes Care 21:1414–1431,1998
30. Starrier J, Vaccaro O, Neaton JD, Wentworth D: Diabetes, other risk factors, and 12–yr cardivascular mortality for men screened in the Multiple Risk Factor In tervention Trial. Diabetes Care 16:434–444, 1993
31. West SG, Wagner P, Schoemer SL, Hecker KD, Hurston KL, Likos Krick A, Boseska L, UlbrechtJ, Hinderliter AL: Bi¬ological correlates of day–to–day variation in flow–mediated dilation in individuals with type 2 diabetes: a study of test–retest reliability. Diabetologia 47:1625–1631,2004
32. Celermajer DS, Sorensen KE, Gooch VM, Spiegelhalter DJ, Miller OI, Sullivan ID,
Lloyd JK, DeanfieldJE: Non–invasive de¬tection of endothelial dysfunction in chil¬dren and adults at risk of atherosclerosis. Lancet 340:1111–1115, L992
33. Tee GB, Rasool AH, Halim AS, Rahman AR: Dependence of human forearm skin
postocclusive reactive hyperemia on oc¬clusion time. J Pharmacol Toxicol Methods
50:73–78, 2004
34. Mitsuhashi T, Vlassara H, Founds HW, Li YM: Standardizing the immunological
measurement of advanced glycation end–products using normal human serum. ] Immunol Methods 207:79–88, 1997
35. Oya T, Hattori N, Mizuno Y, Miyata S, Maeda S, Osawa T, Uchida K: Methyl–
glyoxal modification of protein: chemical and immunochemical characterization of methylglyoxal–arginine adducts. J Bio! Chem 26:18492–18502, 1999
36. Steinberg HO, Brechtel G, Johnson A, Fineberg N, Baron AD: Insulin–mediated
skeletal muscle vasodilation is nitric oxide dependent: a novel action of insulin to increase nitric oxide release. ] Clin Invest 94:1172–1179, 1994
37. Desideri G, Marinucci MC, Tomassoni G, Masci PG, Santucci A, Ferri C: Vitamin E
supplementation reduces plasma vascular cell adhesion molecule–1 and von Willebrand factor levels and increases nitric oxide concentrations in hypercholes–terolemic patients. J Clin Endocrinol Me tab 87:2940–2945, 2002
38. Deanfield J, Donald A, Ferri C, Giannat– tasio C, Halcox J, Halligan S, Lerman A,
Mancia G, Oliver JJ, Pessina AC, Rizzoni D, Rossi GP, Salvetti A, Schiffnn EL, Taddei S, Webb DJ: Endothelial function and dysfunction: part I: methodological issues for assessment in the different vascular beds: a statement by the Working Group on Endothelin and Endothelial Factors of the European Society of Hypertension. J Hypertens 23:7–17, 2005
39. Holowatz LA, Thompson CS, Minson CT, Kenney WL: Mechanisms of acetylcholine–mediated vasodilatation in young and aged human skin. J Physio! 563:965–973, 2005
40. Houben AJ, Nieuwenhuijzen Kruseman AC, Bouhouch E, Slaaf DW, Schaper NC: Peripheral macro– and microcirculation in short–term insulin–dependent diabetes mellitus: the role of prostaglandins in early haemodynamic changes. Eur J Clin Invest 23:662–667, 1993
41. Karachalias N, Babaei–Jadidi R, Kupich C, Ahmed N, Thomalley PJ: High–dose thia¬ mine therapy counters dyslipidemia and advanced glycation of plasma protein in streptozotocin–induced diabetic rats. Ann N YAcad Sci 1043:777–783, 2005
42. Cai W, Gao QD, Zhu L, Peppa M, He C, Vlassara H: Oxidative stress–inducing carbonyl compounds from common foods: novel mediators of cellular dysfunction. Mol Med 8:337–346, 2002
43. Nagaraj RH, Oya–Ito T, Bhat M, Liu B: Dicarbonyl stress and apoptosis of vascu¬lar cells: prevention by alphaB–crystallin. Ann N YAcad Sci 1043:158–165, 2005
44. Wang X, Desai K, Chang T, Wu L: Vascu¬lar methylglyoxal metabolism and the de¬velopment of hypertension. ] Hypertens 23:1565–1573, 2005
45. Schiekofer S, Andrassy M, ChenJ, Rudofsky G, Schneider J, Wendt T, Stefan N, Humpert P, Fritsche A, Stumvoll M, Schleicher E, Haring HU, Nawroth PP, Bierhaus A: Acute hyperglycemia causes intracellular formation of CML and acti¬vation of ras, p42/44 MAPK, and nuclear factor kB in PBMCs. Diabetes 52:621–633,2003
46. Ceriello A, Assalom R, Da RR, Maier A, Piconi L, Quagliaro L, Esposito K, Giugliano D: Effect of atorvastatm and irbesartan, alone and in combination, on postprandial endothelial dysfunction, ox¬idative stress, and inflammation in type 2 diabetic patients. Circulation 111:2518—
2524, 2005
47. Monnier L, Lapinski H, Colette C: Contri¬butions of fasting and postprandial plasma glucose increments to the overall diurnal hyperglycemia of type 2 diabetic patients: variations with increasing levels of HbAlc. Diabetes Care 26:881–885, 2003
48. Klopotek Y, Otto K, Bohm V: Processing strawberries to different products alters contents of vitamin C, total phenolics, to¬tal anthocyanins, and antioxidant capac¬ity. J Agiic Food Chem 53:5640–5646, 2005
49. Elvevoll EO, Osterud B: Impact of pro¬cessing on nutritional quality of marine food items (Review). Forum Nutr 56:337–340, 2003












