ALADIN–I было показано, что внутривенное введение 600 мг Тиоктацида в течение 3 недель привело к уменьшению клинических проявлений полинейропатии на 65% по сравнению с плацебо. В исследовании ALADIN–II, продолжающемся в течение 2 лет, при применении тиоктовой кислоты в дозе 600 или 1200 мг выявлено существенное улучшение проведения возбуждения по двигательным и чувствительным нервам по сравнению с плацебо, а также отмечена хорошая переносимость препарата при долговременной пероральной терапии. В исследовании ALADIN–III после 3 недель внутривенного лечения Тиоктацидом наблюдалось значительное уменьшение неврологического дефицита, улучшение чувствительности и рефлексов. После последующего перорального лечения тиоктовой кислотой в дозе 600 мг 3 раза в сутки отмечалась тенденция к такому же улучшению по сравнению с плацебо [7]. Результаты исследования ORPIL показали, что у 24 пациентов, участвующих в исследовании, при использовании тиоктовой кислоты в дозе 1800 мг в сутки в течение 3 недель уменьшались нейропатические симптомы и неврологический дефицит, в то время как частота развития побочных эффектов была сопоставима с плацебо. В исследовании DECAN лечение в течение 4 мес. пациентов с СД, страдающих кардиальной нейропатией, хорошо переносимой дозой Тиоктацида 800 мг в сутки привело к значительному улучшению функции нервных волокон вегетативной нервной системы, что проявилось увеличением вариабельности сердечного ритма [9].
Исследование SYDNEY I показало, что внутривенное введение тиоктовой кислоты в дозе 600 мг в сутки в течение 3 недель приводит к клинически значимому снижению позитивной нейропатической симптоматики [2].
При проведении мета–анализа исследований ALADIN, ALADIN–III, SYDNEY–I, NATHAN–II (неопубликованное), включающего 1258 пациентов, показано, что внутривенное введение тиоктовой кислоты в дозе 600 мг в течение 3 недель значительно уменьшает позитивную нейропатическую симптоматику и неврологический дефицит [8].
Но для пациентов старшей возрастной группы, работающих больных СД внутривенное применение Тиоктацида не всегда приемлемо. Биодоступность таблетированной формы значительно повышается при использовании тиоктовой кислоты быстрого высвобождения (Тиоктацид БВ).
Это сделало актуальными вопросы об эффективной терапевтической дозировке Тиоктацида БВ и возможности назначения таблетированной формы тиоктовой кислоты быстрого высвобождения без предварительного проведения инфузий, что раньше было обязательным условием терапии.
Для изучения эффективности влияния тиоктовой кислоты на клинические проявления диабетической полинейропатии в рамках многоцентрового рандомизированного двойного слепого исследования SYDNEY II было обследовано 87 пациентов с сахарным диабетом 1 и 2 типа, проходивших стационарное лечение в эндокринологических отделениях НУЗ ЦКБ №1 ОАО «РЖД» и обратившихся на амбулаторный прием на кафедру эндокринологии ГОУ ДПО РМАПО Росздрава в период с 2004 по 2006 г.
Критериями включения в исследование являлись: стаж сахарного диабета 1 и 2 типа более 1 года; симметричная сенсомоторная периферическая полинейропатия, по крайней мере, стадии 2, связанная с диабетом (после тщательной оценки других причин нейропатии); уровень НвА1с<10%; возраст от 18 до 74 лет; оценка по шкале TSS>7,5 баллов. Из исследования исключались пациенты, принимавшие антиоксиданты в течение последнего месяца до начала исследования; с нейропатией любого другого генеза; с наличием тяжелых заболеваний периферических кровеносных сосудов, пролиферативной ретинопатии, клинически значимых сердечных, легочных, желудочно–кишечных заболеваний, язвенных поражений стоп, беременности, кормления грудью; с отягощенным аллергологическим анамнезом; злоупотребляющие алкоголем.
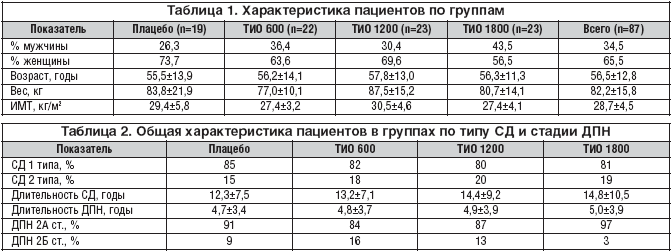
Учитывая критерии включения, критерии исключения, 87 пациентов были случайным образом рандомизированы и разделены на 4 группы, 1–я из которых получала плацебо (n=19), 2–я – Тиоктацид 600 мг (n=22), 3–я – Тиоктацид 1200 мг (n=23), 4–я – Тиоктацид 1800 мг (n=23) (табл. 1). Все пациенты в течение 5 недель получали препарат по 3 таблетки утром за 30 минут до завтрака. Каждые 7 дней у них производилась оценка TSS. NISLL и электромиографическое исследование проводились до и после лечения. Соотношение СД 1 и 2 типа, а также длительность СД и ДПН представлены в таблице 2.
При сравнительном анализе между 4 группами пациентов не наблюдались достоверные различия по показателям возраста, веса, ИМТ, длительности сахарного диабета, длительности ДПН, что говорит об однородности этих групп.
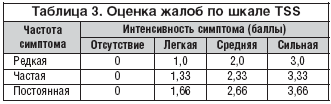
Для оценки диабетической периферической дистальной полинейропатии учитывались жалобы пациентов и проводились исследования, результаты которых заносились в специально разработанные таблицы. У пациентов оценивались следующие субъективные симптомы: «стреляющие» боли, жжение, парестезии, онемение. Количественный анализ жалоб осуществлялся по шкале TSS, представленный в таблице 3.
Количественно объективные симптомы оценивались по шкале NISLL (Neuropathy Impairment Score of lower limbs–объективный невропатический счет для нижних конечностей), так как у абсолютного большинства пациентов наиболее рано симптомы появляются на нижних конечностях. По шкале NISLL мышечную силу оценивали по следующим показателям: сгибание бедра, разгибание бедра, сгибание в коленном суставе, разгибание в коленном суставе, сгибание в голеностопном суставе, разгибание в голеностопном суставе, сгибание пальцев стопы, разгибание пальцев стопы. Оценивали коленный и ахиллов рефлексы. Тестирование порога болевой, тактильной и вибрационной чувствительности осуществляли в области дорсальной поверхности у основания ногтевого ложа концевой фаланги большого пальца стопы. Исследование функционального состояния периферических нервов проводили методом стимуляционной ЭМГ на приборе «Нейроэлектромиограф–2» фирмы МБН (Россия). Тестировали функцию двигательных (n. рeroneus, n. tibialis) и чувствительного (n. suralis) нервов. Изучение проводящей функции моторных нервов проводилось на основе анализа миограммы, а сенсорных нервов – на основе анализа нейрограммы. При этом анализировались следующие параметры: скорость распространения возбуждения (СРВ) по сенсорным и моторным волокнам, амплитуда моторного ответа и сенсорного потенциала, резидуальная латенция. За нормальные показатели принимали скорость распространения возбуждения по двигательным волокнам малоберцового и большеберцового нервов >40 метров в секунду (м/с). СРВ по чувствительным волокнам икроножного нерва >40 м/с. Амплитуда М–ответа: малоберцовый, большеберцовый нервы >3,5 милливольт (мВ); амплитуда потенциала действия икроножного нерва >5 микровольт (мкВ). Верхняя граница нормы резидуальной латентности (РЛ) составляет для малоберцового, большеберцового нервов – 3,0 миллисекунды (мс).
Результаты собственных наблюдений
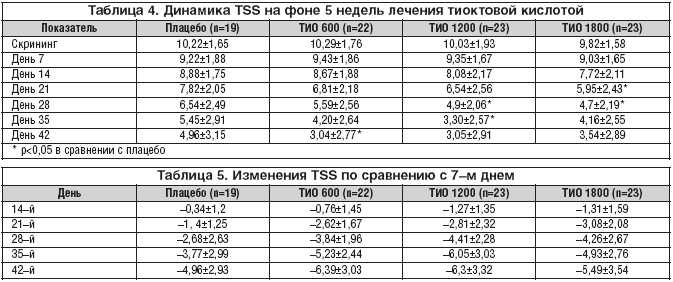
Основополагающей при анализе эффективности терапии тиоктовой кислотой у пациентов с сахарным диабетом 1 и 2 типа в проводимом исследовании являлась оценка клинических проявлений ДПН по данным шкалы TSS (табл. 4).
Таким образом, в группе пациентов, принимающих Тиоктацид 600 мг, достоверные различия (р<0,05) по сравнению с плацебо появились на 5–й неделе лечения (день 42) и составили 3,04±2,77, хотя и до этого отмечалось клинически значимое снижение суммы общих симптомов по шкале TSS на 3–й неделе лечения, но эти изменения были статистически недостоверны (р>0,05). При использовании Тиоктацида 1200 мг достоверные различия появились к 3–й неделе приема препарата (день 28) и составили 4,94±2,06 по сравнению с плацебо 6,54±2,49 (р<0,005). И, наконец, при оценке лечения самой большой из исследуемых доз препарата – 1800 мг статистически значимые различия появились уже ко 2–й неделе приема Тиоктацида (день 21) и составили 5,95±2,43 против 7,82±2,05 при использовании плацебо (р<0,05).
Учитывая, что первая неделя наблюдения представляла собой односторонний плацебо – период для выявления и исключения плацебо–респондеров, оценку изменений шкалы TSS в каждой группе производили с 7–го дня лечения (табл. 5).
На первой неделе лечения (день 7 – день 14) происходило достоверное снижение общего счета TSS в каждой группе (р<0,005), кроме плацебо (р>0,05). Со 2–й недели приема препарата и до конца лечения достоверное уменьшение жалоб по шкале TSS происходило в каждой группе (р<0,005) и в конце лечения (день 42) составило в группе плацебо 4,96±3,15, в группе, принимающей Тиоктацид 600 мг, 3,04±2,77, 1200 мг – 3,05±2,91, 1800 мг – 3,54±2,89.
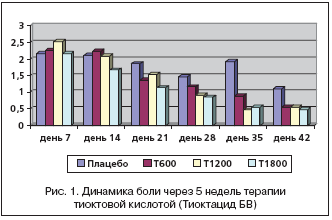
Несомненно интересной стала оценка динамического изменения каждого симптома на фоне лечения различными дозами Тиоктацида БВ в сравнении с плацебо. На скрининге жалобы на боль в стопах с учетом частоты возникновения и интенсивности за последние 24 часа в группе, получающей плацебо, составили 2,65±0,55 баллов, при приеме Тиоктацида 600 мг – 2,83±0,47, 1200 мг – 2,82±0,19, 1800 мг – 2,54±0,20. Достоверных различий между группами выявлено не было (р>0,05). Оценка изменений проводилась также с 7–го дня приема препарата, учитывая однонедельный односторонний слепой плацебо–период (рис. 1).
Статистически значимое уменьшение боли отмечалось к концу 2–й недели (день 21) приема препарата и составило 1,36±0,75 (p=0,04). Но при дальнейшем лечении достоверной разницы в сравнении с плацебо не получено (при оценке боли на 28, 35, 42–й дни р>0,05). Достоверные различия при приеме Тиоктацида 1200 мг наблюдались с 4–й недели приема (день 35, 42–й р<0,05). До этого со 2–й недели выявлялось клиническое улучшение, но которое не было статистически значимым (р>0,05). На фоне приема Тиоктацида 1800 мг достоверное уменьшение болей в стопах произошло на 2–й неделе (день 21) и составило 1,14±0,17 балла по сравнению с 1,86±0,82 балла на плацебо (р<0,05). В дальнейшем каждые 7 дней лечения разница при использовании Тиоктацида 1800 мг оказывалась статистически значимой по отношению к плацебо и по окончании лечения к концу 5–й недели (день 42) составила 0,47±0,15 балла против 1,10±1,08 балла на плацебо (р<0,05). Таким образом, при оценке боли также как и в общем счете TSS наблюдается дозозависимый эффект Тиоктацида.
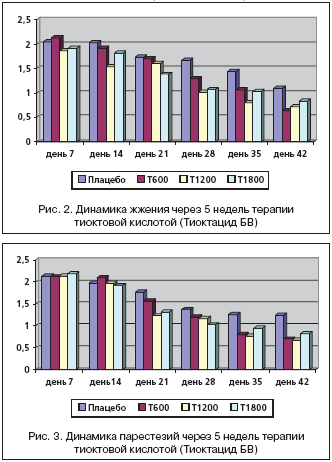
Следующим оцениваемым симптомом явилось жжение, которое на скрининге в группе, получащей плацебо, составило 2,34±1,30 балла, Тиоктацид 600 мг – 2,22±1,22 балла, 1200 мг – 1,96±0,28 балла, 1800 мг – 2,04±0,24 балла. Достоверных различий в группах по оценке данного симптома выявлено не было (р>0,05) (рис. 2).
На фоне приема Тиоктацида 600 мг отмечалось клинически значимое ослабление симптоматики к 4–5–й неделям лечения (день 35, 42), достоверное в данной группе пациентов (р<0,05), но статистически незначимое по сравнению с плацебо (р>0,05). На фоне лечения Тиоктацидом 1200 мг отмечается клинически значимое снижение жжения с 1,87 ± 0,26 балла на начало приема активного препарата до 0,72 ± 0,22 балла к 42–му дню (5–я неделя ) (р<0,05), но которое не является достоверным при сравнении с плацебо (р>0,05). При приеме Тиоктацида 1800 мг жжение снизилось с 1,91±0,23 балла на 7–й день наблюдения до 0,83±0,20 баллов к 42–му дню, что является достоверным (р<0,05), но статистически незначимо по сравнению с плацебо (р>0,05).
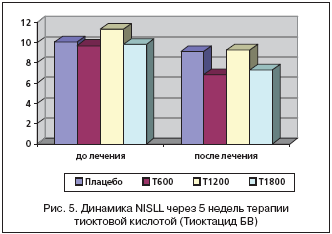
Третьим оцениваемым симптомом шкалы TSS являются парестезии, которые на скрининге составляли в группе, принимающей плацебо 2,37±0,73 балла, Тиоктацид 600 мг 2,30±0,96 баллов, 1200 мг 2,37±0,16 балла, 1800 мг 2,32±0,16 балла и не имели достоверных различий между собой (р>0,05) (рис. 3).
На фоне приема Тиоктацида 600 мг жалобы на покалывание снизились с 2,13±0,99 баллов (день 7) до 0,70±1,02 (день 42) и были статистически значимы между собой (р<0,05), но не имели достоверных различий в сравнении с плацебо (р>0,05). При приеме Тиоктацида 1200 мг в начале лечения (день 7) парестезии составляли 2,14±0,14 балла, снизившись к окончанию лечения (день 42) до 0,67±0,22 балла (р<0,05). Статистически достоверная разница по сравнению с плацебо наблюдалась на 2–й неделе лечения (р<0,05). На фоне лечения Тиоктацидом 1800 мг жалобы на парестезии снизились с 2,19±0,12 баллов (день 7) до 0,82±0,20 баллов (день 42). Достоверные различия между группами получены ко 2–й неделе наблюдения (р<0,05).
Последним оцениваемым симптомом явилось онемение, которое на скрининге в группе плацебо составило 2,93±0,87 балла, Тиоктацид 600 мг 2,94±0,70 балла, 1200 мг 2,86±0,14 балла, 1800 мг 2,93±0,16 балла. Статистически значимых отличий между группами не выявлено (р>0,05) (рис. 4).
При лечении Тиоктацидом 600 мг онемение снизилось с 2,72±0,66 баллов (день 7) до 1,21±1,15 балла (день 42) (р<0,05). Но достоверных различий по сравнению с плацебо не получено на протяжении 5 недель лечения (р>0,05). На фоне терапии Тиоктацидом 1200 мг онемение снизилось с 2,81±0,15 балла (день 7) до 1,13±0,24 балла (день 42), что оказалось также статистически достоверно, как и в предыдущей группе (р<0,05), но незначимо по сравнению с плацебо (р>0,05). В группе, получающей Тиоктацид 1800 мг, онемение в начале терапии (день 7) составило 2,62±0,19 балла, уменьшившись до 1,42±0,27 балла в конце лечения (день 42) (р<0,05). Но достоверных отличий по отношению к плацебо не выявлено (р>0,05).
После оценки TSS исследовалась в динамике шкала NISLL, включающая определение мышечной силы, коленного и ахиллова рефлексов, тактильной, болевой, вибрационной видов чувствительности и мышечно–суставного чувства на фоне применения различных дозировок Тиоктацида в сравнении с плацебо (табл. 6).
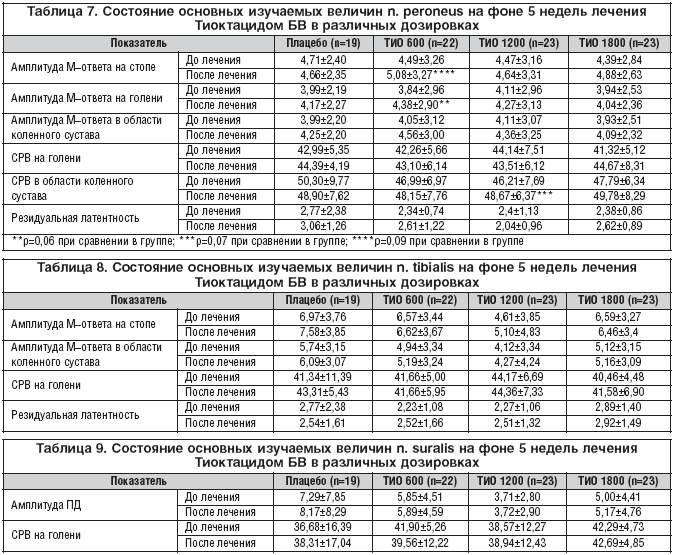
Суммарный счет NISLL в группе, получающей плацебо, составил 10,06±2,35 балла, Тиоктацид 600 мг 9,73±6,02 балла, 1200 мг 11,36±4,27 баллов, 1800 мг 9,85±3,08 балла. Достоверных различий между группами не выявлено (р>0,05) (рис. 5).
На фоне лечения значимые отличия выявлены в группе, принимающей Тиоктацид 600 мг, и составили 6,82±4,44 балла (р<0,05). Близкие к достоверным показатели в группе, использующей Тиоктацид 1800 мг – 7,29±2,52 (p=0,052). Статистически незначимо изменение NISLL при лечении 1200 мг Тиоктацида (р>0,05) и составило 9,29±4,2 балла.
Таким образом, в проведенном исследовании показано, что быстрейшее наступление клинического эффекта происходило при приеме Тиоктацида 1800 мг (со 2 недели, р<0,05 в сравнении с плацебо), на фоне приема 1200 мг Тиоктацида с 3 недели, 600 мг к окончанию лечения – 5 неделе (р<0,05 в сравнении с плацебо). Снижение общего счета TSS на 62% произошло в группе Тиоктацида 600 мг, на 63,5% 1200 мг, на 53% 1800 мг в сравнении на 38% на плацебо (р<0,05). В изменении NISLL различий не было между Тиоктацидом 1200 мг и плацебо, но имелись достоверные отличия между Тиоктацидом 600 мг и плацебо (р<0,05) и близкие к достоверным значения между Тиоктацидом 1800 мг и плацебо (p=0,052).
Также для оценки эффективности лечения использовали электромиографическое обследование 2–х двигательных (n. peroneus – малоберцовый нерв, n. tibialis – большеберцовый нерв) и 1–го чувствительного нерва (n. suralis – икроножный нерв). В качестве исследуемых показателей малоберцового нерва сравнивались амплитуда М–ответа на стопе, амплитуда М–ответа на голени, амплитуда М–ответа в области коленного сустава, СРВ на голени, СРВ в области коленного сустава, резидуальная латентность на фоне лечения в каждой группе и в сравнении с плацебо (табл. 7).
На фоне лечения улучшение амплитуды М–ответа на стопе, амплитуды М–ответа на голени отмечено при приеме Тиоктацида 600 мг, но оно не достигло достоверных значений. Увеличение СРВ в области коленного сустава, близкое к достоверному, наблюдалось в группе, принимающей Тиоктацид 1200 мг. На основании полученных данных установлено, что при ДПН у больных СД 1 и 2 типа наиболее часто страдает амплитуда М–ответа, затем снижается скорость распространения возбуждения и нарушается резидуальная латентность, что подтверждается ранее проведенными исследованиями.
При электромиографическом исследовании n. tibialis исследовались амплитуда М–ответа на стопе, амплитуда М–ответа в области коленного сустава, СРВ на голени, резидуальная латентность на фоне лечения в каждой группе на фоне терапии тиоктовой кислотой (табл. 8).
Таким образом, статистически значимых изменений электромиографических параметров n. tibialis на фоне 5 недель лечения Тиоктацидом БВ выявлено не было. При исследовании икроножного нерва у пациентов с ДПН оценивались в динамике амплитуда ПД, СРВ на голени (табл. 9).
Отмечено повышение амплитуды М–ответа во всех группах, но оно не достигло уровня статистической значимости. Для оценки влияния метаболических и других факторов на развитие дистальной диабетической полинейропатии проведен корреляционный многофакторный анализ между ЭМГ параметрами n. рeroneus, n. tibialis n. suralis, с одной стороны, и такими значениями, как возраст больных, вес, ИМТ, длительность СД, НвА1с, гликемией натощак, TSS, NISLL, с другой стороны. Умеренная достоверная связь наблюдается между РЛ n. peroneus и весом пациентов. Связь средней силы, но не достигшая уровня достоверности, имелась между РЛ n. peroneus, амплитудой М–ответа на стопе, на колене и возрастом. СРВ на голени n. tibialis и амплитуда ПД n. suralis имеют обратную среднюю связь средней силы с длительностью СД, но также не достигают статистически значимых различий. Обратная достоверная умеренная связь имеется между амплитудой М–ответа на колене n. tibialis, СРВ на голени n. tibialis и NISLL. Амплитуда М–ответа на голени n. peroneus, СРВ на голени n. peroneus, СРВ в области колена n. peroneus, амплитуда ПД n. suralis также имели обратную умеренную связь с TSS, но не достигли статистически значимых различий. Также нами оценивалась корреляционная связь между контролем углеводного обмена (НвА1с) и TSS. Отмечена связь средней силы (r 0,12), недостоверная (р=0,59).
Таким образом, в результате комплексного клинико–нейрофизиологического исследования у пациентов с СД 1 и 2 типа было показано, что наиболее ранним электромиографическим показателем поражения чувствительного нерва при сахарном диабете является снижение потенциала действия; поражения двигательного нерва – снижение амплитуды М–ответа; скорость распространения возбуждения обоих нервов нарушаются позднее. Снижение общего счета TSS произошло в группах пациентов, принимавших Тиоктацид в суточной дозе 600 мг – на 62%, 1200 мг – на 63,5%, 1800 мг – на 53%, и лишь на 38% в группе плацебо. Уменьшение боли происходило со второй недели приема Тиоктацида в суточной дозе дозе 1800 мг, с четвертой недели приема в дозе 1200 мг и только к пятой неделе на фоне приема 600 мг Тиоктацида. Достоверное уменьшение неврологических симптомов в динамике выявлено в группе, принимающей Тиоктацид 600 мг в сутки; в группе, использующей Тиоктацид 1800 мг, отмечена тенденция к положительной динамике неврологической симптоматики. При наличии боли, как преобладающего симптома шкалы TSS, целесообразно начинать лечение с 1800 мг Тиоктацида БВ. Учитывая дозозависимый эффект развития побочных явлений, во всех остальных случаях оптимальной является дозировка 600 мг Тиоктацида БВ.


Литература
1. Аметов А.C., Строков И.А., Самигуллин Р. Антиоксидантная терапия диабетической полинейропатии // РМЖ. 2005. Т. 13. № 6. С. 339–43.
2. Аметов А.С., Строков И.А., Баринов А.Н. и др. Альфа–липоевая кислота в лечении симптомной диабетической полиневропатии: symptomatic diabetic neuropathy (SYDNEY) trial // Фарматека. 2004. № 11 (88). С. 69–73.
3. Балаболкин МИ, Креминская ВМ, Клебанова ЕМ Роль окислительного стресса в патогенезе диабетической нейропатии и возможность его коррекции препаратами α–липоевой кислоты т.51 №3 22–33 2005.
4. Диабетическая периферическая сенсомоторная полинейропатия. Патогенез, клиника, диагностика. Методические рекомендации. М., 2000.
5. Котов С.В. Диабетическая нейропатия. М., 2000. 228 с.
6. Окислительный стресс. Биохимические и патофизиологические аспекты / НК. Зенков,
В.З. Лапкин, Е.Б. Меныцикова. – М.: Наука, Интерпериодика, 2001. – 343 с.
7. Ziegler D, Hanefeld M, Ruhnau KJ, et al. Treatment of symptomatic diabetic peripheral neuropathy with the antioxidant α–lipoic acid. A 3–week multicentre randomized controlled trial (ALADIN Study). Diabetologia 1995;38:1425–33.
8. Ziegler D, Nowak H, Kempler P, et al. Treatment of symptomatic diabetic polyneuropathy with antioxidant α–lipoic acid: a meta–analysis. Diaberic Medicine 2004;21:114–21.
9. Ziegler D, Schatz H, Conrad F, et al. Effect of treatment with the antioxidant α–lipoid acid in cardiac autonomic neuropathy in NIDDM patiemts (DECAN Study). Diab Care 1997;20: 369–73.












