–Э–∞—Г—З–љ—Л–µ –Є–Ј—Л—Б–Ї–∞–љ–Є—П –њ–Њ—Б–ї–µ–і–љ–Є—Е –і–µ—Б—П—В–Є–ї–µ—В–Є–є –і–Њ–Ї–∞–Ј–∞–ї–Є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Њ—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —В–Ї–∞–љ–µ–є –Ї –Є–љ—Б—Г–ї–Є–љ—Г [3]. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –њ–Њ—З—В–Є –њ–Њ–ї–Њ–≤–Є–љ–∞ –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П –њ–ї–∞–љ–µ—В—Л –Є–Љ–µ–µ—В —В—Г –Є–ї–Є –Є–љ—Г—О —Б—В–µ–њ–µ–љ—М –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є. –Ш–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –ї–µ–ґ–Є—В –≤ –Њ—Б–љ–Њ–≤–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є–Љ–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ–Є –Ї–Њ—В–Њ—А–Њ–≥–Њ —П–≤–ї—П—О—В—Б—П —В–∞–Ї–ґ–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П, –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є—П, –≥–Є–њ–µ—А—Г—А–Є–Ї–µ–Љ–Є—П, –њ–Њ–ї–Є–Ї–Є—Б—В–Њ–Ј —П–Є—З–љ–Є–Ї–Њ–≤ –Є –і—А. [15]. –Ф–Њ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В—Л –њ—А–Њ–і–Њ–ї–ґ–∞—О—В –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ —А–∞–Ј—А–∞–±–∞—В—Л–≤–∞—В—М –Ї–Њ–љ—Ж–µ–њ—Ж–Є—О –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, –њ–Њ–њ–Њ–ї–љ—П—П –Њ–±—К–µ–Љ –њ–Њ–љ—П—В–Є—П –љ–Њ–≤—Л–Љ–Є —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є–Љ–Є. –Ю–і–љ–Є–Љ –Є–Ј –≤–∞–ґ–љ–µ–є—И–Є—Е –Љ–∞—А–Ї–µ—А–Њ–≤ —Б–Є–љ–і—А–Њ–Љ–∞ –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —П–≤–ї—П–µ—В—Б—П –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–µ –Њ–ґ–Є—А–µ–љ–Є–µ [12,14]. –Ц–Є—А–Њ–≤–∞—П —В–Ї–∞–љ—М –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –Є–љ—Б—Г–ї–Є–љ–Њ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–Љ —В–Ї–∞–љ—П–Љ –Є —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Њ–є –Є–Ј –≥–ї–∞–≤–љ—Л—Е —Г—З–∞—Б—В–љ–Є—Ж –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–љ–Њ–≥–Є—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ [7,10,11,13]. –Т–Є—Б—Ж–µ—А–∞–ї—М–љ–∞—П –ґ–Є—А–Њ–≤–∞—П —В–Ї–∞–љ—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —Б–Њ–Њ–±—Й–∞–µ—В—Б—П —Б –њ–Њ—А—В–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ–Њ–є, –µ–µ –∞–і–Є–њ–Њ—Ж–Є—В—Л –љ–∞ –њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –Љ–µ–Љ–±—А–∞–љ–µ –Є–Љ–µ—О—В –≤—Л—Б–Њ–Ї—Г—О –њ–ї–Њ—В–љ–Њ—Б—В—М b3––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є –љ–Є–Ј–Ї—Г—О –њ–ї–Њ—В–љ–Њ—Б—В—М –Є–љ—Б—Г–ї–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, —З–µ–Љ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –ї–Є–њ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤ –љ–µ–є. –Ш–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Љ–Њ–ґ–µ—В –±—Л—В—М –Ї–∞–Ї –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –і–µ—В–µ—А–Љ–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є, —В–∞–Ї –Є –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ–Њ–є [3]. –Т –љ–∞—А—Г—И–µ–љ–Є–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї –Є–љ—Б—Г–ї–Є–љ—Г –љ–∞—А—П–і—Г —Б –і—А—Г–≥–Є–Љ–Є –Љ—Г—В–∞—Ж–Є—П–Љ–Є –Љ–Њ–ґ–µ—В –Є–Љ–µ—В—М –Ј–љ–∞—З–µ–љ–Є–µ –Љ—Г—В–∞—Ж–Є—П –≥–µ–љ–Њ–≤ b3––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ [6]. –Ь–∞–ї–Њ–Є–Ј—Г—З–µ–љ–љ–Њ–є –Њ—Б—В–∞–µ—В—Б—П —А–Њ–ї—М —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –≤ –Њ–±–Љ–µ–љ–µ –ґ–Є—А–Њ–≤ –њ—А–Є –Ь–°. –ѓ—Б–љ–Њ, —З—В–Њ –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –±—Г–і–µ—В –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤–ї–Є—П—В—М –љ–∞ —Д—Г–љ–Ї—Ж–Є—О –Є–љ—Б—Г–ї—П—А–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л. –Ґ–∞–Ї, —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –Љ–µ–Љ–±—А–∞–љ–љ—Л–є —А–µ—Ж–µ–њ—В–Њ—А –љ–∞ –њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –Љ–µ–Љ–±—А–∞–љ–µ b––Ї–ї–µ—В–Ї–Є —Б–≤—П–Ј—Л–≤–∞–µ—В –љ–µ–є—А–Њ–Љ–µ–і–Є–∞—В–Њ—А—Л –∞–і—А–µ–љ–∞–ї–Є–љ, –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ, –і–Њ—Д–∞–Љ–Є–љ, –∞ —В–∞–Ї–ґ–µ —Н—Б—В—А–∞–і–Є–Њ–ї. –≠—В–Њ—В —А–µ—Ж–µ–њ—В–Њ—А –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В b– –Є–ї–Є b––∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–∞. –°—В—А—Г–Ї—В—Г—А–љ–Њ —А–µ—Ж–µ–њ—В–Њ—А –љ–µ –њ—А–Њ—П–≤–ї—П–µ—В –∞–љ—В–∞–≥–Њ–љ–Є–Ј–Љ–∞ –љ–Є –Ї b–, –љ–Є –Ї b–—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, –њ–Њ—Н—В–Њ–Љ—Г –±—Л–ї –Њ–њ—А–µ–і–µ–ї–µ–љ, –Ї–∞–Ї b––∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Є–є —А–µ—Ж–µ–њ—В–Њ—А. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ–њ—А–µ–і–µ–ї—П—О—В —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ –њ–Њ–і–Њ–±–љ–Њ–≥–Њ —В–Є–њ–∞ –Љ–µ–Љ–±—А–∞–љ–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—В —В–µ–Њ—А–Є—О –Њ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г –љ–µ–Ї–Њ—В–Њ—А—Л–Љ–Є –≥–Њ—А–Љ–Њ–љ–∞–Љ–Є –Є –±–Є–Њ–≥–µ–љ–љ—Л–Љ–Є –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–∞–Љ–Є [5], —Г—З–∞—Б—В–≤—Г—О—Й–Є–Љ–Є –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –Ї–∞–Ї –љ–µ—А–≤–љ–Њ–є, —В–∞–Ї –Є —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —А–µ–≥—Г–ї—П—Ж–Є–Є —Д—Г–љ–Ї—Ж–Є–Є —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л. –Я—А–Є —В–∞–Ї–Њ–є «–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–є –Ї–∞—В–∞—Б—В—А–Њ—Д–µ», –Ї–∞–Ї–Њ–є —П–≤–ї—П–µ—В—Б—П —Б–Є–љ–і—А–Њ–Љ –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є, —А–Њ–ї—М –∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—Ж–Є–Є –≤ –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е –Ї–ї–µ—В–Њ–Ї (–∞–і–Є–њ–Њ—Ж–Є—В—Л, –Љ–Є–Њ—Ж–Є—В—Л, b––Ї–ї–µ—В–Ї–∞) —П–≤–ї—П–µ—В—Б—П –Ј–љ–∞—З–Є–Љ–Њ–є, –Њ–і–љ–∞–Ї–Њ –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ –Є–Ј—Г—З–µ–љ–∞. –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –љ–µ—В –і–∞–љ–љ—Л—Е –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –љ–∞—А—Г—И–µ–љ–љ–Њ–є –∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—Ж–Є–Є —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –≤–µ—Б–∞ —Г –±–Њ–ї—М–љ—Л—Е –Ь–°. –≠—В–Њ –і–µ–ї–∞–µ—В –њ—А–Њ–±–ї–µ–Љ—Г –Є–Ј—Г—З–µ–љ–Є—П –і–∞–љ–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Є –≤–Њ–Ј–Љ–Њ–ґ–љ—Г—О –Ї–Њ—А—А–µ–Ї—Ж–Є—О –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –Њ–і–љ–Њ–є –Є–Ј –≤–∞–ґ–љ–µ–є—И–Є—Е –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ –Є —В—А–µ–±—Г–µ—В –і–∞–ї—М–љ–µ–є—И–Є—Е —Г–≥–ї—Г–±–ї–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
–Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ b––∞–і—А–µ–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –њ–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—О –Њ—Б–Љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–∞ —П–≤–ї—П–µ—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —В—А—Г–і–Њ–µ–Љ–Ї–Є–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–Љ –Є —В—А–µ–±—Г–µ—В –Њ—Б–Њ–±–Њ–є —В—Й–∞—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [6].
–Э–∞–±–Њ—А —А–µ–∞–≥–µ–љ—В–Њ–≤ –±–µ—В–∞––Р–†–Ь––Р–≥–∞—В –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П b––∞–і—А–µ–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –љ–∞ –Љ–Њ–і–µ–ї–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –≤ –Љ–∞–ї–Њ–Љ –Њ–±—К–µ–Љ–µ –≤–µ–љ–Њ–Ј–љ–Њ–є –Є–ї–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є (0,2 –Љ–ї) –Љ–µ—В–Њ–і–Њ–Љ, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–Љ –љ–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–Є –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–∞. –≠—В–Њ—В –Љ–µ—В–Њ–і –Њ—Ж–µ–љ–Ї–Є –∞–і—А–µ–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ –љ–∞–Љ–Є –≤ —Ж–µ–ї—П—Е –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≥–Є–њ–µ—А–∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е –Ь–° –Є —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ.
–Я—А–Є–љ—Ж–Є–њ –і–µ–є—Б—В–≤–Є—П –Њ—Б–љ–Њ–≤–∞–љ –љ–∞ —Д–∞–Ї—В–µ —В–Њ—А–Љ–Њ–ґ–µ–љ–Є—П –≥–µ–Љ–Њ–ї–Є–Ј–∞ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, –њ–Њ–Љ–µ—Й–µ–љ–љ—Л—Е –≤ –≥–Є–њ–Њ–Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї—Г—О —Б—А–µ–і—Г, –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–∞ – 1–(1––Є–Ј–Њ–њ—А–Њ–њ–Є–ї–∞–Љ–Є–љ–Њ)–3–(1––љ–∞—Д—В–∞–ї–µ–љ–Є–ї––Њ–Ї—Б–Є)–2––њ—А–Њ–њ–∞–љ–Њ–ї–∞ –≥–Є–і—А–Њ—Е–ї–Њ—А–Є–і–∞. –≠—А–Є—В—А–Њ—Ж–Є—В—Л –±–Њ–ї—М–љ–Њ–≥–Њ, –њ–Њ–Љ–µ—Й–µ–љ–љ—Л–µ –≤ –≥–Є–њ–Њ–Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї—Г—О —Б—А–µ–і—Г, –њ–Њ–і–≤–µ—А–≥–∞—О—В—Б—П –≥–µ–Љ–Њ–ї–Є–Ј—Г, —Б—В–µ–њ–µ–љ—М –Ї–Њ—В–Њ—А–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї—П—О—В –њ–Њ –≤–µ–ї–Є—З–Є–љ–µ –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –љ–∞–і–Њ—Б–∞–і–Њ—З–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –њ—А–Є –і–ї–Є–љ–µ –≤–Њ–ї–љ—Л 540 –Љ–љ (–Ї–Њ–љ—В—А–Њ–ї—М). –Т –Њ–њ—Л—В–љ—Г—О –њ—А–Њ–±—Г —Б –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ –≥–Є–њ–Њ–Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –±—Г—Д–µ—А–∞ –і–Њ–±–∞–≤–ї—П—О—В —А–∞—Б—В–≤–Њ—А b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–∞, –Ї–Њ—В–Њ—А—Л–є —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П —Б b–—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –Ї–ї–µ—В–Њ—З–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л, —Б–љ–Є–ґ–∞—П —Б—В–µ–њ–µ–љ—М –≥–µ–Љ–Њ–ї–Є–Ј–∞. –Т–µ–ї–Є—З–Є–љ—Г –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –љ–∞–і–Њ—Б–∞–і–Њ—З–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –Њ–њ—Л—В–љ–Њ–є –њ—А–Њ–±—Л –њ—А–Є –і–ї–Є–љ–µ –≤–Њ–ї–љ—Л 540 –Љ–љ –≤—Л—А–∞–ґ–∞—О—В –≤ –њ—А–Њ—Ж–µ–љ—В–∞—Е –Њ—В –≤–µ–ї–Є—З–Є–љ—Л –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –њ—А–Њ–±—Л; –µ–і–Є–љ–Є—Ж—Л –њ—А–Њ—Ж–µ–љ—В–Њ–≤ –њ—А–Є–љ–Є–Љ–∞—О—В –Ј–∞ —Г—Б–ї–Њ–≤–љ—Л–µ –µ–і–Є–љ–Є—Ж—Л b––Р–†–Ь (—Г—Б–ї. –µ–і.).
–Т–µ–ї–Є—З–Є–љ—Г b––Р–†–Ь —А–∞—Б—Б—З–Є—В–∞–ї–Є –њ–Њ —Д–Њ—А–Љ—Г–ї–µ:
b––Р–†–Ь = –Х–Њ1 + –Х–Њ2 / –Х–Ї1 + –Х–Ї2 x 100%, –≥–і–µ:
b––Р–†–Ь – –≤–µ–ї–Є—З–Є–љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –∞–і—А–µ–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, —Г—Б–ї. –µ–і.;
–Х–Њ1 –Є –Х–Њ2 – –Њ–њ—В–Є—З–µ—Б–Ї–Є–µ –њ–ї–Њ—В–љ–Њ—Б—В–Є –Њ–њ—Л—В–љ—Л—Е –њ—А–Њ–±, –µ–і. –Њ–њ—В. –њ–ї–Њ—В–љ.;
–Х–Ї1 –Є –Х–Ї2 – –Њ–њ—В–Є—З–µ—Б–Ї–Є–µ –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л—Е –њ—А–Њ–±, –µ–і. –Њ–њ—В. –њ–ї–Њ—В–љ.
–Р–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—Ж–Є—П –Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ (–Р–†–Ь) – —Н—В–Њ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –љ–Њ–≤–Њ–µ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ, –Є—Б–њ–Њ–ї—М–Ј—Г—О—Й–µ–µ —В–Њ–љ–Ї–Є–µ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –Є–љ—Б—В—А—Г–Љ–µ–љ—В—Л –і–ї—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≥–ї—Г–±–Є–љ–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–є –Є –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –љ–∞ –Є—Е —А–∞–љ–љ–µ–є —Д–∞–Ј–µ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–µ –љ–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ–Ї –њ–Њ—Б–ї–µ –Ї–Њ–љ—В–∞–Ї—В–∞ —Б –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–∞–Љ–Є. –Ю—Б–љ–Њ–≤—Л–≤–∞—П—Б—М –љ–∞ —Д–∞–Ї—В–µ, —З—В–Њ –∞–і—А–µ–љ–Њ–Љ–Є–Љ–µ—В–Є–Ї–Є –Є –∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л, —Б–≤—П–Ј—Л–≤–∞—П—Б—М —Б b––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —З–µ–ї–Њ–≤–µ–Ї–∞, –Є–Ј–Љ–µ–љ—П–ї–Є —Б—В–µ–њ–µ–љ—М –≥–Є–њ–Њ–Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–Љ–Њ–ї–Є–Ј–∞, –±—Л–ї —А–∞–Ј—А–∞–±–Њ—В–∞–љ –Є –≤–љ–µ–і—А–µ–љ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г —Н–Ї—Б–њ—А–µ—Б—Б––Љ–µ—В–Њ–і –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –∞–і—А–µ–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ [6].
–Я–Њ–ї–љ–Њ–µ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —А–∞–±–Њ—В, –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–µ –∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ –Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ –њ—А–Є –Ь–°, –њ–Њ—Б–ї—Г–ґ–Є–ї–Њ –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–¶–µ–ї—М—О –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —П–≤–ї—П–µ—В—Б—П –Њ—Ж–µ–љ–Ї–∞ —Б—В–∞—В—Г—Б–∞ –∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—Ж–Є–Є —Г 70 –±–Њ–ї—М–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ (–Љ—Г–ґ—З–Є–љ 28, –ґ–µ–љ—Й–Є–љ 45, —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 55,8±12,0 –ї–µ—В).
–Р–і—А–µ–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –њ–Њ –≤–µ–ї–Є—З–Є–љ–µ –Р–†–Ь –љ–∞–±–Њ—А–Њ–Љ —А–µ–∞–Ї—В–Є–≤–Њ–≤ «–Р–†–Ь––Р–У–Р–Ґ» (000 «–Р–≥–∞—В––Ь–µ–і», –Ь–Њ—Б–Ї–≤–∞, 2005). –§—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –Њ–њ—А–µ–і–µ–ї—П–ї–Є –њ–Њ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–Љ—Г —Б–Њ–і–µ—А–ґ–∞–љ–Є—О –Љ–Њ–љ–Њ–≤–∞–ї–µ–љ—В–љ—Л—Е –Ї–∞—В–Є–Њ–љ–Њ–≤ Na+ –Є K+ –Љ–µ—В–Њ–і–Њ–Љ –њ–ї–∞–Љ–µ–љ–љ–Њ–є —Д–Њ—В–Њ–Љ–µ—В—А–Є–Є –Є –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –Т.–Ѓ. –•—А–µ–љ–љ–Є–Ї–Њ–≤–∞ –Є –Р.–Ш. –Ф–µ–µ–≤–∞. –Ъ–Њ–љ—В—А–Њ–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г —Б–Њ—Б—В–∞–≤–Є–ї–Є 30 –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж —В–Њ–≥–Њ –ґ–µ –≤–Њ–Ј—А–∞—Б—В–∞ –±–µ–Ј –љ–∞—А—Г—И–µ–љ–Є—П —Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞.
–Я–Њ —Г—А–Њ–≤–љ—О –±–∞–Ј–∞–ї—М–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Є–љ—Б—Г–ї–Є–љ–∞ (–Ш–†–Ш) –≤—Б–µ –±–Њ–ї—М–љ—Л–µ –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ –і–≤–µ –≥—А—Г–њ–њ—Л: —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ–Є (32,7±4,0 –Х/–ї) – –≥—А—Г–њ–њ–∞ 1 –Є–Ј 49 –±–Њ–ї—М–љ—Л—Е –Є –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ–Є (10,6±0,9 –Х/–ї) –≤–µ–ї–Є—З–Є–љ–∞–Љ–Є –Ш–†–Ш —Г 24 –±–Њ–ї—М–љ—Л—Е. –Я–Њ –њ–Њ–ї—Г, –≤–Њ–Ј—А–∞—Б—В—Г, –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–Љ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ –Њ–±–µ –≥—А—Г–њ–њ—Л –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л. –Т–µ–ї–Є—З–Є–љ–∞ b––Р–†–Ь –Є –∞–љ–∞–ї–Є–Ј–Є—А—Г–µ–Љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Г –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е –±—Л–ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ (—А<0,001) –Є–Ј–Љ–µ–љ–µ–љ—Л –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –ї–Є—Ж–∞–Љ–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л (—В–∞–±–ї. 1).
–Ґ–∞–±–ї–Є—Ж–∞ 1 –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г–µ—В –і–≤—Г–Ї—А–∞—В–љ–Њ–µ, –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Ј–љ–∞—З–Є–Љ–Њ–µ (—А<0,001) —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Р–†–Ь —Г –±–Њ–ї—М–љ—Л—Е –Ь–°, —З—В–Њ —П–≤–ї—П–µ—В—Б—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–Љ —А–Њ–ї–Є –Љ–µ–Љ–±—А–∞–љ–љ–Њ–є –∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—Ж–Є–Є –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Ь–°.
–Т–∞—А–Є–∞–±–µ–ї—М–љ–Њ—Б—В—М –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П b––Р–†–Ь —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –і–Њ–Љ–Є–љ–Є—А–Њ–≤–∞–љ–Є—П –Њ–і–љ–Њ–≥–Њ –Є–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е –Ь–°, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Њ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Њ–љ–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –Љ–Є–Њ–Ї–∞—А–і–∞, –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –Ї—А–Њ–≤–Є, —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Ї –∞–і—А–µ–љ–Њ—Б—В–Є–Љ—Г–ї—П—В–Њ—А–∞–Љ, –∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ –Є –і—А—Г–≥–Є–Љ —Д–∞–Ї—В–Њ—А–∞–Љ.
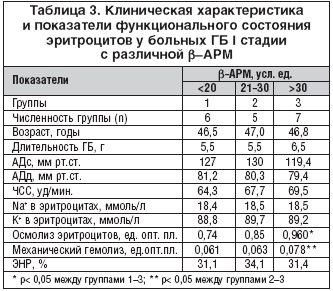
–Э–∞–Љ–Є –њ—А–Њ–≤–µ–і–µ–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤ –љ–∞—В—А–Є—П –≤ —Н—А–Є—В—А–Њ—Ж–Є—В–∞—Е —Г 70 –±–Њ–ї—М–љ—Л—Е –Є —Г 30 –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж. –Т –њ–ї–∞–Ј–Љ–µ —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –±—Л–ї –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–Љ —Г –≤—Б–µ—Е –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е. –Т —Н—А–Є—В—А–Њ—Ж–Є—В–∞—Е –±–Њ–ї—М–љ—Л—Е –Ь–° –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П (–≤ –Љ–Љ–Њ–ї—М/–ї) –љ–∞—В—А–Є—П –Ї–Њ–ї–µ–±–∞–ї–∞—Б—М –Њ—В 15,5 –і–Њ 21,0, —Б–Њ—Б—В–∞–≤–Є–≤ –≤ —Б—А–µ–і–љ–µ–Љ —Г –±–Њ–ї—М–љ—Л—Е –≥—А—Г–њ–њ—Л 1: 19,2±0,8–18,4, —З—В–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–∞–Ї–Њ–≤–Њ–є —Г –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж.
–Я–Њ–≤—Л—И–µ–љ–Є–µ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –љ–∞—В—А–Є—П, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Б–≤—П–Ј–∞–љ–Њ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ—З–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л –і–ї—П —Н—В–Њ–≥–Њ –Ї–∞—В–Є–Њ–љ–∞ –Є–ї–Є —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є Na+/K+––Р–Ґ–§–∞–Ј—Л, –≤—Б–ї–µ–і—Б—В–≤–Є–µ —З–µ–≥–Њ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –≤—Л—Е–Њ–і –љ–∞—В—А–Є—П –Є–Ј –Ї–ї–µ—В–Ї–Є.
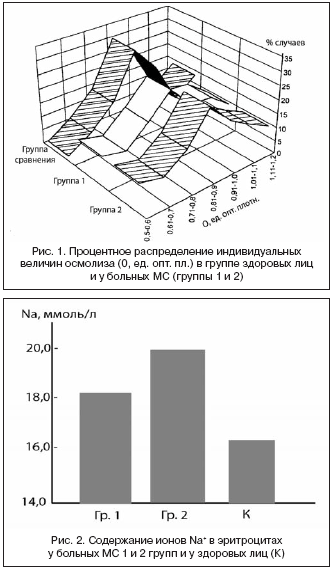
–Ю–±–љ–∞—А—Г–ґ–µ–љ–љ–Њ–µ –љ–∞–Љ–Є –њ–Њ–≤—Л—И–µ–љ–Є–µ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Љ–Њ–љ–Њ–≤–∞–ї–µ–љ—В–љ–Њ–≥–Њ –Ї–∞—В–Є–Њ–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е –Ь–°, —П–≤–ї—П—П—Б—М –Њ–і–љ–Є–Љ –Є–Ј –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Є–Ј–Љ–µ–љ–µ–љ–љ–Њ–≥–Њ –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј–∞ –Ї–ї–µ—В–Њ–Ї, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М –Є –і—А—Г–≥–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Ї–ї–µ—В–Њ–Ї. –Ґ–∞–Ї, —Г –±–Њ–ї—М–љ—Л—Е –Ь–° –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л–Љ–Є –ї–Є—Ж–∞–Љ–Є –Њ—В–Љ–µ—З–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ (—А–Є—Б. 1).
–£ –±–Њ–ї—М–љ—Л—Е I –Є II –≥—А—Г–њ–њ –њ–Є–Ї –Њ—Б–Љ–Њ–ї–Є–Ј–∞, —Е–∞—А–∞–Ї—В–µ—А–љ—Л–є –і–ї—П –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж, —Б–љ–Є–ґ–µ–љ –љ–∞ 20%, –љ–Њ —Г—Б–Є–ї–µ–љ–Њ –њ—А–∞–≤–Њ–µ –Ї—А—Л–ї–Њ –≥–Є—Б—В–Њ–≥—А–∞–Љ–Љ—Л —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ–Є –≤–µ–ї–Є—З–Є–љ–∞–Љ–Є –Њ—Б–Љ–Њ–ї–Є–Ј–∞ (–Њ—В 0,9 –і–Њ 1,1). –°—А–µ–і–љ–µ–≥—А—Г–њ–њ–Њ–≤—Л–µ –Ј–љ–∞—З–µ–љ–Є—П —Н—В–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П —Г –±–Њ–ї—М–љ—Л—Е –Њ–±–µ–Є—Е –≥—А—Г–њ–њ —Б–Њ—Б—В–∞–≤–Є–ї–Є 0,898 –Є 0,915, —З—В–Њ –Њ—В—А–∞–ґ–∞–µ—В –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –≤ —Н—В–Є—Е –≥—А—Г–њ–њ–∞—Е –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–∞–Ї–Њ–≤–Њ–є —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж.
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Г –±–Њ–ї—М–љ—Л—Е –Ь–° –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Ј–і–Њ—А–Њ–≤—Л–Љ–Є –ї–Є—Ж–∞–Љ–Є –Є–Љ–µ—О—В—Б—П –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Ї–ї–µ—В–Њ–Ї –Є –Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ, –њ—А–Њ—П–≤–ї—П—О—Й–Є–µ—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Є–Њ–љ–Њ–≤ –љ–∞—В—А–Є—П –Є —Б–љ–Є–ґ–µ–љ–Є—П –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤. –≠—В–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Є–Љ–µ–ї–Є —В–µ–љ–і–µ–љ—Ж–Є—О –Ї —А–Њ—Б—В—Г –њ–Њ –Љ–µ—А–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ь–°.
–Ш–Ј —В–∞–±–ї–Є—Ж—Л 2 —Б–ї–µ–і—Г–µ—В, —З—В–Њ –≤–µ–ї–Є—З–Є–љ–∞ b––Р–†–Ь –Є –∞–љ–∞–ї–Є–Ј–Є—А—Г–µ–Љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е I –≥—А—Г–њ–њ—Л –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ –±–Њ–ї—М–љ—Л—Е II –≥—А—Г–њ–њ—Л (–љ–Њ—А–Љ. –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ш–†–Ш) –±—Л–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Є–Ј–Љ–µ–љ–µ–љ—Л. –Ґ–∞–Ї, –≤ I –≥—А—Г–њ–њ–µ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Є–Њ–љ–Њ–≤ Na+ (19,2±0,8 –Љ–Љ–Њ/–ї—М) –Є, –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Н—В–Њ–≥–Њ, –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–∞—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ (0,91±0,06 –µ–і. –Њ–њ—В. –њ–ї.) –±—Л–ї–Є 0,80±0,06 –µ–і. –Њ–њ—В. –њ–ї.; p<0,05) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (—А–Є—Б. 2).
–≠—В–Є –і–∞–љ–љ—Л–µ –≤–њ–µ—А–≤—Л–µ –њ—Г–±–ї–Є–Ї—Г—О—В—Б—П –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Љ–љ–Њ–≥–Њ—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤ –љ–∞ —Д–Њ–љ–µ –Ь–° —Б —Е–∞—А–∞–Ї—В–µ—А–љ—Л–Љ–Є –і–ї—П –љ–µ–≥–Њ –≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є–µ–є –Є –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М—О [6].
–Р–љ–∞–ї–Є–Ј–Є—А—Г—П —Б–Є–Љ–њ—В–Њ–Љ—Л —Г –±–Њ–ї—М–љ—Л—Е –Ь–° —Б –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є b––Р–†–Ь, –Љ—Л –Њ—В–Љ–µ—В–Є–ї–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Г—О —В–Є–њ–Є—З–љ–Њ—Б—В—М –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ь–°. –Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Н—В–Є –±–Њ–ї—М–љ—Л–µ –±—Л–ї–Є —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ –ї–∞–±–Є–ї—М–љ—Л–Љ–Є —Е–Њ–ї–µ—А–Є–Ї–∞–Љ–Є, –њ–Њ–≤—Л—И–µ–љ–Є–µ –Р–Ф —Г –љ–Є—Е –њ—А–Њ–≤–Њ—Ж–Є—А–Њ–≤–∞–ї–Њ—Б—М –њ–µ—А–µ–Љ–µ–љ–Њ–є –њ–Њ–≥–Њ–і—Л, –њ—Б–Є—Е–Њ—Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ –њ–µ—А–µ–љ–∞–њ—А—П–ґ–µ–љ–Є–µ–Љ –Є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–ї–Њ—Б—М –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ–Љ –љ–µ–є—А–Њ–≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–Њ –≥–Є–њ–µ—А–∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–Љ—Г —Б–Њ—Б—В–Њ—П–љ–Є—О –Ь–°. –Я–Њ—Б–ї–µ–і–љ–Є–є –±—Л–ї –і–Є–∞–≥–љ–Њ—Б—В–Є–Њ–≤–∞–љ —Г –≤—Б–µ—Е 70 –±–Њ–ї—М–љ—Л—Е –Ь–° (45 –ґ–µ–љ—Й–Є–љ –Є 25 –Љ—Г–ґ—З–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 16–74 –ї–µ—В), —Г –Ї–Њ—В–Њ—А—Л—Е –≤–µ–ї–Є—З–Є–љ—Л b––Р–†–Ь –Ї–Њ–ї–µ–±–∞–ї–Є—Б—М –Њ—В 20,0 –і–Њ 60,0 —Г—Б–ї. –µ–і. –У–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ї—А–Є–Ј—Л —Г 51 –±–Њ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—П–≤–ї—П–ї–Є—Б—М —Б–µ—А–і—Ж–µ–±–Є–µ–љ–Є–µ–Љ, –Ї–Њ–ї—О—Й–Є–µ –Є–ї–Є –і–∞–≤—П—Й–Є–µ –±–Њ–ї–Є –≤ –Њ–±–ї–∞—Б—В–Є –≤–µ—А—Е—Г—И–Ї–Є —Б–µ—А–і—Ж–∞ –Њ—В–Љ–µ—З–µ–љ—Л —Г 52, –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–Є–µ—Б—П –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П –і–∞–ґ–µ –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –Р–Ф; —Г 40 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤–Њ–Ј–љ–Є–Ї–∞–ї–Є —З—Г–≤—Б—В–≤–Њ –≤–љ—Г—В—А–µ–љ–љ–µ–≥–Њ –љ–∞–њ—А—П–ґ–µ–љ–Є—П –Є —Б—В—А–∞—Е–∞, –Љ—Л—И–µ—З–љ–∞—П –і—А–Њ–ґ—М, –Њ–Ј–љ–Њ–± –±—Л–ї –Њ—В–Љ–µ—З–µ–љ —Г 10, –∞ –Њ—Й—Г—Й–µ–љ–Є–µ –ґ–∞—А–∞ –≤ —В–µ–ї–µ –Њ—В–Љ–µ—В–Є–ї–Є 25 –±–Њ–ї—М–љ—Л—Е. –Я—А–Є –Њ—Б–Љ–Њ—В—А–µ —Г 59 –Є–Ј –љ–Є—Е –Њ—В–Љ–µ—З–∞–ї–Є –њ–Њ–Ї—А–∞—Б–љ–µ–љ–Є–µ –ї–Є—Ж–∞, –њ–Њ—В–ї–Є–≤–Њ—Б—В—М –њ—А–Њ—П–≤–ї—П–ї–∞—Б—М —Г 50, –Р–Ф –њ–Њ–≤—Л—И–∞–ї–Њ—Б—М –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Ј–∞ —Б—З–µ—В —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, –∞ —В–∞—Е–Є–Ї–∞—А–і–Є—П –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ —Г 52 –±–Њ–ї—М–љ—Л—Е. –У–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ї—А–Є–Ј—Л –±—Л–ї–Є —З–∞—Б—В–Њ–є –њ—А–Є—З–Є–љ–Њ–є —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є, –∞ –≤ –Љ–µ–ґ–Ї—А–Є–Ј–Њ–≤–Њ–Љ –њ–µ—А–Є–Њ–і–µ —В–∞–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е –Њ—В–ї–Є—З–∞–ї–Є —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П –ї–∞–±–Є–ї—М–љ–Њ—Б—В—М, —З–∞—Б—В–∞—П –љ–µ—Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М —Б–љ–∞, –±—Л—Б—В—А–Њ –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–µ–µ –њ–µ—А–µ—Г—В–Њ–Љ–ї–µ–љ–Є–µ. –Ъ–∞–Ї –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М, –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —В–∞–Ї–Њ–є —Д–Њ—А–Љ—Л –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–Є –Ь–° –Є–≥—А–∞–µ—В –њ–Њ–≤—Л—И–µ–љ–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Є–Љ–њ–∞—В–Њ––∞–і—А–µ–љ–∞–ї–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л (–°–Р–°) –Є –≥–Є–њ–µ—А–∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М.
–Я—А–Є –±–Њ–ї–µ–µ –њ–Њ–і—А–Њ–±–љ–Њ–Љ —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є, —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –≥–Є–њ–µ—А–∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ–µ –Ь–°, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –љ–µ–Ї–Њ—В–Њ—А—Г—О –Њ–±—Й—Г—О —В–Є–њ–Є—З–љ–Њ—Б—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–є, –љ–∞–Љ–Є –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –љ–µ–Ї–Њ—В–Њ—А—Л–µ —А–∞–Ј–ї–Є—З–Є—П –≤ –љ–µ–є—А–Њ–≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–µ, —З—В–Њ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–ї–Њ —А–∞–Ј–ї–Є—З–љ—Л–є —Г—А–Њ–≤–µ–љ—М –њ–Њ–≤—Л—И–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –°–Р–°. –Я–Њ—Н—В–Њ–Љ—Г –Љ—Л –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є–ї–Є, —З—В–Њ —А–∞–Ј–ї–Є—З–Є—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є –У–С –і–Њ–ї–ґ–љ—Л –±—Л—В—М —Б–≤—П–Ј–∞–љ—Л —Б –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –Љ–µ–Љ–±—А–∞–љ–љ–Њ––Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞. –Т —Н—В–Њ–Љ –Ї–Њ–љ—В–µ–Ї—Б—В–µ –Є–Ј—Г—З–µ–љ–∞ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є —Г 58 (83%) –Є–Ј 70 –±–Њ–ї—М–љ—Л—Е –Ь–°, —А–∞–Ј–і–µ–ї–µ–љ–љ—Л—Е –љ–∞ –≥—А—Г–њ–њ—Г 1 –Є–Ј 18 –±–Њ–ї—М–љ—Л—Е –Є –≥—А—Г–њ–њ—Г 2 –Є–Ј 40 –±–Њ–ї—М–љ—Л—Е —Б –У–С II —Б—В–∞–і–Є–Є. –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–µ–ї–Є—З–Є–љ—Л b––Р–†–Ь –≤—Б–µ 58 –±–Њ–ї—М–љ—Л—Е —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 2 –≥—А—Г–њ–њ—Л —Б–Њ –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є –і–Њ 20,0 —Г—Б–ї. –µ–і. (–њ–Њ–≤—Л—И–µ–љ–љ–∞—П –∞–і—А–µ–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В—М) –Є –≤—Л—И–µ 20,0 —Г—Б–ї. –µ–і., —З—В–Њ —А–∞—Б—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М, –Ї–∞–Ї —Б–љ–Є–ґ–µ–љ–љ–∞—П –∞–і—А–µ–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В—М, –Є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–ї–Њ –≥–Є–њ–µ—А–∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Є–є –≤–∞—А–Є–∞–љ—В –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є.
–£ 40 –±–Њ–ї—М–љ—Л—Е –У–С II —Б—В–∞–і–Є–Є —Б –≤–µ–ї–Є—З–Є–љ–∞–Љ–Є b––Р–†–Ь –і–Њ 20,0 —Г—Б–ї. –µ–і. –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ –Є–Љ–µ–ї–∞ –Є–љ–Њ–є —Е–∞—А–∞–Ї—В–µ—А. –У–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ї—А–Є–Ј—Л —Г –љ–Є—Е –љ–Њ—Б–Є–ї–Є —З–µ—В–Ї–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–є –Є–ї–Є –≤–Њ–і–љ–Њ–—Б–Њ–ї–µ–≤–Њ–є —Е–∞—А–∞–Ї—В–µ—А –Є –њ—А–Њ–≤–Њ—Ж–Є—А–Њ–≤–∞–ї–Є—Б—М —З–∞—Й–µ –≤—Б–µ–≥–Њ –њ–Њ–≥—А–µ—И–љ–Њ—Б—В—М—О –≤ –і–Є–µ—В–µ —Б —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ–Љ –±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Б–Њ–ї–Є –Є –ґ–Є–і–Ї–Њ—Б—В–Є (10 –±–Њ–ї—М–љ—Л—Е), –љ–µ—А–≤–љ–Њ–—Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ –њ–µ—А–µ–љ–∞–њ—А—П–ґ–µ–љ–Є–µ–Љ (6 –±–Њ–ї—М–љ—Л—Е), –њ–µ—А–µ–Љ–µ–љ–Њ–є –њ–Њ–≥–Њ–і—Л (5 –±–Њ–ї—М–љ—Л—Е) –Є–ї–Є –≤–Њ–Ј–љ–Є–Ї–∞–ї–Є –±–µ–Ј –≤–Є–і–Є–Љ–Њ–є –њ—А–Є—З–Є–љ—Л (2 –±–Њ–ї—М–љ—Л—Е). –Т–Њ –≤—А–µ–Љ—П –Ї—А–Є–Ј–∞ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –±–Њ–ї—М–љ—Л—Е –ґ–∞–ї–Њ–≤–∞–ї–Є—Б—М –љ–∞ —Б–Є–ї—М–љ—Л–µ –≥–Њ–ї–Њ–≤–љ—Л–µ –±–Њ–ї–Є –≤ –Ј–∞—В—Л–ї–Њ—З–љ–Њ–є (15 –±–Њ–ї—М–љ—Л—Е) –Є–ї–Є —В–µ–Љ–µ–љ–љ–Њ––≤–Є—Б–Њ—З–љ–Њ–є –Њ–±–ї–∞—Б—В–Є (4 –±–Њ–ї—М–љ—Л—Е), –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ (18 –±–Њ–ї—М–љ—Л—Е), –Љ–µ–ї—М–Ї–∞–љ–Є–µ –њ–µ—А–µ–і –≥–ї–∞–Ј–∞–Љ–Є (10 –±–Њ–ї—М–љ—Л—Е), –љ–µ—З–µ—В–Ї–Њ—Б—В—М –≤–Њ—Б–њ—А–Є—П—В–Є—П –Њ–Ї—А—Г–ґ–∞—О—Й–µ–≥–Њ (6 –±–Њ–ї—М–љ—Л—Е), –і–∞–≤—П—Й–Є–µ –Є–ї–Є –Ї–Њ–ї—О—Й–Є–µ –±–Њ–ї–Є –≤ –Њ–±–ї–∞—Б—В–Є –≤–µ—А—Е—Г—И–Ї–Є —Б–µ—А–і—Ж–∞, –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–Є–µ—Б—П –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П – –Њ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —З–∞—Б–Њ–≤ (9 –±–Њ–ї—М–љ—Л—Е) –і–Њ —Б—Г—В–Њ–Ї –Є –±–Њ–ї–µ–µ (4 –±–Њ–ї—М–љ—Л—Е), —Б–µ—А–і—Ж–µ–±–Є–µ–љ–Є–µ (3 —З–µ–ї.). –Я—А–Є –Њ—Б–Љ–Њ—В—А–µ –Њ–±—А–∞—Й–∞–ї–Є –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ –Њ—В–µ–Ї–Є –≤ –њ–∞—А–∞–Њ—А–±–Є—В–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є (3 –±–Њ–ї—М–љ—Л—Е), –њ–∞—Б—В–Њ–Ј–љ–Њ—Б—В—М –ї–Є—Ж–∞ –Є –Ї–Є—Б—В–µ–є (4 –±–Њ–ї—М–љ—Л—Е); –±–ї–µ–і–љ–Њ—Б—В—М –Ї–Њ–ґ–љ—Л—Е –њ–Њ–Ї—А–Њ–≤–Њ–≤ (17 –±–Њ–ї—М–љ—Л—Е), –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ї–∞–Ї —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ, —В–∞–Ї –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф, —А–µ–і–Ї–Њ —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–∞—Б—М —В–∞—Е–Є–Ї–∞—А–і–Є—П (3 –±–Њ–ї—М–љ—Л—Е). –Я–Њ –љ–∞—И–µ–Љ—Г –Љ–љ–µ–љ–Є—О, —В–∞–Ї–Њ–µ —В–µ—З–µ–љ–Є–µ –У–С –±–Њ–ї–µ–µ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –і–ї—П —А–µ–љ–Є–љ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е —Д–Њ—А–Љ –≥–Є–њ–µ—А—В–Њ–љ–Є–Є, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –≤–µ–і—Г—Й–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –њ–Њ–≤—Л—И–µ–љ–Є—П –Р–Ф —П–≤–ї—П–µ—В—Б—П —А–µ–љ–Є–љ––∞–љ–≥–Є–Њ¬—В–µ–љ–Ј–Є–љ––∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤–∞—П —Б–Є—Б—В–µ–Љ–∞.
–Ґ–∞–±–ї–Є—Ж–∞ 3 —А–∞—Б–Ї—А—Л–≤–∞–µ—В –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е –У–С I —Б—В–∞–і–Є–Є —Б —А–∞–Ј–ї–Є—З–љ–Њ–є b––Р–†–Ь.
–Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–є –Є –Ї–Є—Б–ї–Њ—В–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, –Ї–∞–Ї –Є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Љ–Њ–љ–Њ–≤–∞–ї–µ–љ—В–љ—Л—Е –Ї–∞—В–Є–Њ–љ–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е –У–С I –Є II —Б—В–∞–і–Є–є –≤ –≥—А—Г–њ–њ–∞—Е —Б —А–∞–Ј–ї–Є—З–љ–Њ–є b––Р–†–Ь —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М. –Ь–µ—Е–∞–љ–Є—З–µ—Б–Ї–∞—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е —Б –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є b––Р–†–Ь —Г –±–Њ–ї—М–љ—Л—Е –У–С I –Є II —Б—В–∞–і–Є–є –±—Л–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–µ–љ–∞. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–µ –Ї–Њ–ї–µ–±–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е —Б —А–∞–Ј–ї–Є—З–љ–Њ–є b––Р–†–Ь, –∞ —В–∞–Ї–ґ–µ –љ–∞–ї–Є—З–Є–µ –њ—А—П–Љ–Њ–є —Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –Ї–ї–µ—В–Њ–Ї –Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ –Ї –∞–і—А–µ–љ–Њ–∞–Ї—В–Є–≤–љ—Л–Љ –≤–µ—Й–µ—Б—В–≤–∞–Љ, –њ–Њ—Б–ї—Г–ґ–Є–ї–Є –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П –±–Њ–ї–µ–µ –і–µ—В–∞–ї—М–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —Н—В–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є. –° —Н—В–Њ–є —Ж–µ–ї—М—О –њ–∞—Ж–Є–µ–љ—В—Л —Б –У–С I —Б—В–∞–і–Є–Є –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 3 –≥—А—Г–њ–њ—Л. –У—А—Г–њ–њ—Г 1 —Б–Њ—Б—В–∞–≤–Є–ї–Є –±–Њ–ї—М–љ—Л–µ —Б b––Р–†–Ь –і–Њ 20,0 —Г—Б–ї. –µ–і., –≥—А—Г–њ–њ—Г 2 – –Њ—В 21 –і–Њ 30 —Г—Б–ї. –µ–і., –≥—А—Г–њ–њ—Г 3 – –≤—Л—И–µ 30,0. –Я–Њ –≤–Њ–Ј—А–∞—Б—В—Г, –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –У–С, –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –Р–Ф –Є –І–°–° –±–Њ–ї—М–љ—Л–µ –≤—Б–µ—Е —В—А–µ—Е –≥—А—Г–њ–њ –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М (—В–∞–±–ї. 3).
–Р–љ–∞–ї–Є–Ј –і–∞–љ–љ—Л—Е –≤—Л—П–≤–Є–ї –њ—А—П–Љ—Г—О —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –≤–µ–ї–Є—З–Є–љ–∞–Љ–Є b––Р–†–Ь, –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–є –Є –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М—О —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤. –Ґ–∞–Ї, –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–∞—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е –У–С I —Б—В–∞–і–Є–Є —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є b––Р–†–Ь –љ–µ –Њ—В–ї–Є—З–∞–ї–∞—Б—М –Њ—В —В–∞–Ї–Њ–≤–Њ–є —Г –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л—Е –ї–Є—Ж. –Я–Њ –Љ–µ—А–µ –µ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–ї–∞—Б—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є, –Є —Г –±–Њ–ї—М–љ—Л—Е —Б b––Р–†–Ь –≤—Л—И–µ 30,0 —Г—Б–ї. –µ–і. —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –±—Л–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–Є–ґ–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–∞—Е I –Є II. –Ь–µ—Е–∞–љ–Є—З–µ—Б–Ї–∞—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е –≤—Б–µ—Е —В—А–µ—Е –≥—А—Г–њ–њ –±—Л–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–µ–љ–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–∞–Ї–Њ–≤–Њ–є –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П, –Є —Н—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –љ–∞—А–∞—Б—В–∞–ї–Њ –њ–∞—А–∞–ї–ї–µ–ї—М–љ–Њ b––Р–†–Ь.
–£ –±–Њ–ї—М–љ—Л—Е –У–С II —Б—В–∞–і–Є–Є —Б –≤–Њ–Ј—А–∞—Б—В–∞—О—Й–µ–є b––Р–†–Ь –≤—Л—П–≤–ї—П–ї–Є—Б—М –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–є –Є –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ (—В–∞–±–ї. 4).
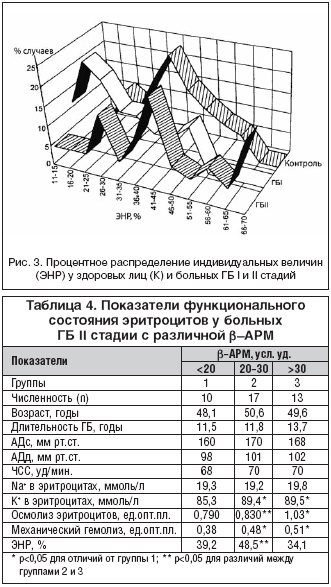
–І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Ї–Є—Б–ї–Њ—В–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, —В–Њ –Њ–љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ —А–∞–Ј–ї–Є—З–∞–ї—Б—П (—А–Є—Б. 3), –Њ–і–љ–∞–Ї–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–µ –Ї–Њ–ї–µ–±–∞–љ–Є—П –і–Њ–ї–Є –≠–Э–† –≤ –Ї–∞–ґ–і–Њ–є –Є–Ј –≥—А—Г–њ–њ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Є –±–Њ–ї–µ–µ –і–µ—В–∞–ї—М–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —Г –±–Њ–ї—М–љ—Л—Е –У–С I –Є II —Б—В–∞–і–Є–є. –Э–∞ –≥–Є—Б—В–Њ–≥—А–∞–Љ–Љ–µ –њ—А–Њ—Ж–µ–љ—В–љ–Њ–≥–Њ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–є –і–Њ–ї–Є –≠–Э–† —Г –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж –≤–Є–і–љ–Њ, —З—В–Њ –њ–Є–Ї –њ—А–Є—Е–Њ–і–Є—В—Б—П –љ–∞ 40%, –∞ —Б—А–µ–і–љ–µ–≥—А—Г–њ–њ–Њ–≤–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Г –љ–Є—Е —Б–Њ—Б—В–∞–≤–Є–ї–Њ 41,7%. –£ –±–Њ–ї—М–љ—Л—Е –У–С I —Б—В–∞–і–Є–Є –њ–Є–Ї –Ї—А–Є–≤–Њ–є —Б–Љ–µ—Й–µ–љ –≤–ї–µ–≤–Њ –Ї 20%, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—П –Њ —В–Њ–Љ, —З—В–Њ –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є —Ж–Є—А–Ї—Г–ї–Є—А—Г–µ—В –Љ–Њ–ї–Њ–і–Њ–є –њ—Г–ї —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤. –У–Є—Б—В–Њ–≥—А–∞–Љ–Љ–∞ –±–Њ–ї—М–љ—Л—Е –У–С II —Б—В–∞–і–Є–Є –Є–Љ–µ–ї–∞ –±–Њ–ї–µ–µ —Б–ї–Њ–ґ–љ—Г—О –Ї—А–Є–≤—Г—О –Є, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –љ–µ–Њ–і–љ–Њ–Ј–љ–∞—З–љ—Г—О —В—А–∞–Ї—В–Њ–≤–Ї—Г. –≠—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–Њ, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, —Б –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ—Б—В—М—О –∞–љ–∞–ї–Є–Ј–Є—А—Г–µ–Љ–Њ–є –≥—А—Г–њ–њ—Л (–±–Њ–ї—М—И–Є–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –±–Њ–ї—М–љ—Л–Љ–Є –У–С I —Б—В–∞–і–Є–Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–є —А–∞–Ј–±—А–Њ—Б –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–Њ—Ж–µ—Б—Б–∞), –∞ —Б –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, —Б –µ–µ –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–Њ—Б—В—М—О –њ–Њ —Б—В–µ–њ–µ–љ–Є —Г—З–∞—Б—В–Є—П –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –Р–Ф –Є —Ж–Є—В–Њ–і–µ—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–Њ–≤.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤—Л—Б–Њ–Ї–Є–µ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–µ –≤–µ–ї–Є—З–Є–љ—Л b––Р–†–Ь, –Њ—В—А–∞–ґ–∞—П –њ–Њ–≤—Л—И–µ–љ–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –°–Р–°, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В –≥–Є–њ–µ—А–∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Є–є –≤–∞—А–Є–∞–љ—В –У–С –Є —Б–Њ—З–µ—В–∞—О—В—Б—П —Б–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М—О —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, –≤—Л—П–≤–ї—П–µ–Љ–Њ–є —Б –њ–Њ–Љ–Њ—Й—М—О —А–∞–Ј–ї–Є—З–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –њ—А–Њ–±. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –љ–∞—А—Г—И–µ–љ–Є—П —В—А–∞–љ—Б–Љ–µ–Љ–±—А–∞–љ–љ–Њ–≥–Њ –њ–µ—А–µ–љ–Њ—Б–∞ –Ї–∞—В–Є–Њ–љ–Њ–≤ –Є –Є—Е –Є–Њ–љ–љ–Њ–є –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Љ–Њ—Й–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–µ–ї–Ї–Њ–≤–Њ––ї–Є–њ–Є–і–љ–Њ–є –Љ–∞—В—А–Є—Ж—Л.
–Ф–µ—Д–Њ—А–Љ–Є—А—Г–µ–Љ–Њ—Б—В—М —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –љ–µ—Б–ґ–Є–Љ–∞–µ–Љ—Л–Љ –ї–Є–њ–Є–і–љ—Л–Љ –±–Є—Б–ї–Њ–µ–Љ –Є –њ–Њ—Б—В–Њ—П–љ—Б—В–≤–Њ–Љ –µ–≥–Њ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є —Б –±–µ–ї–Ї–Њ–≤—Л–Љ–Є —Б—В—А—Г–Ї—В—Г—А–∞–Љ–Є –Ї–ї–µ—В–Њ—З–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л. –Т–µ–і—Г—Й—Г—О —А–Њ–ї—М –≤ —Н—В–Њ–Љ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–Є –Є–≥—А–∞–µ—В —Б–њ–µ–Ї—В—А–Є–љ––∞–Ї—В–Є–љ–Њ–≤—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б —Н—А–Є—В—А–Њ—Ж–Є—В–∞—А–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л, —Б —Г—З–∞—Б—В–Є–µ–Љ –њ—А–Њ—В–µ–Є–љ–Ї–Є–љ–∞–Ј –Љ–µ–Љ–±—А–∞–љ—Л –Є –Р–Ґ–§ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Д–Њ—Б—Д–Њ—А–Є–ї–Є—А–Њ–≤–∞–љ–Є–µ —Б–њ–µ–Ї—В—А–Є–љ–∞. –§–Њ—Б—Д–Њ—А–Є–ї–Є—А–Њ–≤–∞–љ–љ—Л–є —Б–њ–µ–Ї—В—А–Є–љ, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –∞–Ї—В–Є–≤–Є—А—Г–µ—В –њ—А–Њ—Ж–µ—Б—Б—Л –≤ —Б–њ–µ–Ї—В—А–Є–љ––∞–Ї—В–Є–љ–Њ–≤–Њ–Љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ, –њ—А–Є–≤–Њ–і—П –Ї –Є–Ј–Љ–µ–љ–µ–љ–Є—О —Б–њ–µ–Ї—В—А–Є–љ–—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ–Њ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П, —Б–Њ–Ї—А–∞—Й–µ–љ–Є—О –Є–ї–Є —Б–≥–Є–±–∞–љ–Є—О —Н—А–Є—В—А–Њ—Ж–Є—В–∞—А–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л.
–Ю–њ–Є—Б–∞–љ–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –њ–Њ–Ј–≤–Њ–ї—П—О—В —Н—А–Є—В—А–Њ—Ж–Є—В—Г –њ—А–Є—Б–њ–Њ—Б–∞–±–ї–Є–≤–∞—В—М—Б—П –Ї —Б–Є–ї–∞–Љ –њ–Њ—В–Њ–Ї–∞ –≤ –Ї—А–Њ–≤—П–љ–Њ–Љ —А—Г—Б–ї–µ, –Ї–∞–Ї –Ї–∞–њ–ї–µ –ґ–Є–і–Ї–Њ—Б—В–Є, –Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –µ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞ –Є–Ј–Љ–µ–љ—П—В—М —Б–≤–Њ—О —Д–Њ—А–Љ—Г, –∞ —Н—А–Є—В—А–Њ—Ж–Є—В–∞—А–љ–∞—П –Љ–µ–Љ–±—А–∞–љ–∞ –Љ–Њ–ґ–µ—В –≤—А–∞—Й–∞—В—М—Б—П –≤–Њ–Ї—А—Г–≥ —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ –Ї–ї–µ—В–Ї–Є, –Ї–∞–Ї –≥—Г—Б–µ–љ–Є—Ж–∞ —В–∞–љ–Ї–∞. –С–µ–ї–Ї–Є –њ–ї–∞–Ј–Љ—Л (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Д–Є–±—А–Є–љ–Њ–≥–µ–љ), —Б–Њ–±–Є—А–∞—П—Б—М –љ–∞ —Н—А–Є—В—А–Њ—Ж–Є—В–∞—А–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ–µ, –њ—А–Є–≤–Њ–і—П—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –і–µ—Д–Њ—А–Љ–Є—А—Г–µ–Љ–Њ—Б—В–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤.
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ—Л –≤—Л–Ј—Л–≤–∞—О—В –∞–Ї—В–Є–≤–∞—Ж–Є—О —Б–Є–љ—В–µ–Ј–∞ –±–µ–ї–Ї–∞ –≤ –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–∞—Е –Є –Є–љ–Ї–Њ—А–њ–Њ—А–∞—Ж–Є—О –љ—Г–Ї–ї–µ–Є–љ–Њ–≤—Л—Е –Ї–Є—Б–ї–Њ—В –≤ –Ї–Њ–ї–ї–∞–≥–µ–љ –Є –†–Э–Ъ. –Я—А–Є —Н—В–Њ–Љ –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ –і–Њ–Ј—Л –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–Њ–≤, –≤—Л–Ј—Л–≤–∞—О—Й–Є–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –Ї–Њ–ї–ї–∞–≥–µ–љ–∞, –Љ–Є–Њ–Ї–∞—А–і–Є–∞–ї—М–љ—Л–є —Д–Є–±—А–Њ–Ј –Є –≥–Є–њ–µ—А—В—А–Њ—Д–Є—О –Љ–Є–Њ–Ї–∞—А–і–∞, —П–≤–ї—П—О—В—Б—П —Б—Г–±–њ—А–Њ—Ж–µ—Б—Б–Њ—А–љ—Л–Љ–Є. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –љ–µ–≥–∞—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–Њ–≤ –љ–∞ —Б–µ—А–і—Ж–µ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —А–µ–≥—Г–ї—П—Ж–Є–Є b––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Љ–Є–Њ–Ї–∞—А–і–∞, –Є—Е –њ—А—П–Љ—Л–Љ–Є –Ї–∞—А–і–Є–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є.
–†–µ–Ј—О–Љ–Є—А—Г—П –≤—Л—И–µ—Б–Ї–∞–Ј–∞–љ–љ–Њ–µ, —Б–ї–µ–і—Г–µ—В –њ—А–Є–Ј–љ–∞—В—М –њ—А–∞–≤–Њ–Љ–µ—А–љ–Њ–є —Б—Г—Й–µ—Б—В–≤—Г—О—Й—Г—О —В–µ—Б–љ—Г—О –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–µ–ґ–і—Г –≥–Є–њ–µ—А–∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Є–Љ —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, –°–Р–° –±–Њ–ї—М–љ—Л—Е –Ь–° –Є –Є—Е –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Љ–Є–Њ–Ї–∞—А–і–∞, –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М, –≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є—О.


–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –С–∞–ї–∞–±–Њ–ї–Ї–Є–љ –Ь.–Ш. // –≠–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Є—П. – –Ь., 1998. – 385 —Б.
2. –У–Є–љ–Ј–±—Г—А–≥ –Ь.–Ь., –Ъ–Њ–Ј—Г–њ–Є—Ж–∞ –У.–°. –°–Є–љ–і—А–Њ–Љ –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є // –Я—А–Њ–±–ї–µ–Љ—Л —Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Є–Є. – 1997. – вДЦ 1. – –°.40–43.
3. –Ф–µ–і–Њ–≤ –Ш.–Ш., –Ь–µ–ї—М–љ–Є—З–µ–љ–Ї–Њ –Т.–Т. –≠–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Є—П. –£—З–µ–±–љ–Є–Ї. –Ь.: –Ь–µ–і–Є—Ж–Є–љ–∞, 2007. – 400 —Б.
4. –Ч–Є–Љ–Є–љ –Ѓ.–Т. –Я—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є–µ, –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Б–Є–љ–і—А–Њ–Љ–∞ –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Є–ї–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –• // –Ъ–∞—А–і–Є–Њ–ї–Њ–≥–Є—П. – 1998. – вДЦ 6. – –°.71–81.
5. –Ь–Є—Е–∞–є–ї–Њ–≤ –Ш.–С. –§–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П –Њ–ґ–Є—А–µ–љ–Є—П. – Terra med. – 2006, вДЦ 1. – –°.16–17, 19–20.
6. –°—В—А—О–Ї –†.–Ш., –Ф–ї—Г—Б—Б–Ї–∞—П –Ш.–У. –Р–і—А–µ–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–∞—П —Б–Є—Б—В–µ–Љ–∞. – –Ь.: –Ь–µ–і–Є—Ж–Є–љ–∞, 2003. – 160 —Б.
7. Diez J.J., Iglesias P. The role of the novel adipocyte–derived hormone adiponectin in human disease // Europ. J. Endocrinol. – 2003. – Vol.148. – P.293–300.
8. Goldsland J.F., Stevensen J.C. Insulin resistance: syndrome or tendency // Lancet. – 1995. – N 8967. – P.100–103.
9. Jung R.T. Obesity as a disease // Brit. Med. Bull. – 1997. – Vol.53, N 2. – P.307–321.
10. Lopez–Bermejo A. Adiponectin, hepatocellular dysfunction and insulin sensitivity. // Clin. Endocrinol. – 2004. – Vol.60, N 2. – P.256–263.
11. Lustig R.H. Autonomic dysfunction of the b–cell and the pathogenesis of obesity // Rev. Endocrin. Metab. Disord. – 2003. – Vol.4, 7. – P.23–32.
12. Novak S., Stapleton L.M., Litaker J.R. A confirmatory factor analysis evaluation of the coronary heart disease risk factors of metabolic syndrome with emphasis on the insulin resistance factor // Diabetes, Obesity and Metab. – 2003. – Vol.5, N 6. – P.388–396.
13. Oral E.A. Lipoatrophic diabetes and other related syndromes // Rev. Endocrin. Med. Disorders. – 2003. – Vol.4, N 1. – P.61–77.
14. Perseghin G., Petersen K., Shulman G.I. Cellular mechanism of insulin resistance: Potential lings with inflammation. // Int. J. Obesity. – 2003. – Vol.27. – Suppl.3. – P.6–11.
15. Reaven G.M. Role of insulin resistance in human disease // Diabetes. – 1988. – Vol.37. – P.1595–1607.
16. Stockigt R. Guidelines for diagnosis and monitoring of thyroid disease: nonthyroidal illness // Clin. Chem. – 1996. – Vol.42, N 1. – P.188–192.












