–Ъ –±–Њ–ї—М—И–Њ–Љ—Г —Е–Њ—А—Г —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ –Є —Н–Ї—Б–њ–µ—А—В–Њ–≤ –Т–Ю–Ч, –≤—Л—А–∞–ґ–∞—О—Й–Є—Е —В—А–µ–≤–Њ–≥—Г –њ–Њ —А–Њ—Б—В—Г –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ 2 —В–Є–њ–∞ (–°–Ф–2) —Б—А–µ–і–Є –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П –њ–ї–∞–љ–µ—В—Л, –њ—А–Є—Б–Њ–µ–і–Є–љ–Є–ї–∞—Б—М –Ї—А—Г–њ–љ–µ–є—И–∞—П –њ–Њ–ї–Є—В–Є—З–µ—Б–Ї–∞—П –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є—П –Љ–Є—А–∞ – –Ю–Ю–Э, –Ј–∞—П–≤–Є–≤—И–∞—П, —З—В–Њ –і–Є–∞–±–µ—В –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Г–≥—А–Њ–Ј—Г —З–µ–ї–Њ–≤–µ—З–µ—Б—В–≤—Г. –Т –°–®–Р –і–Є–∞–±–µ—В –њ—А–Њ—З–љ–Њ –Ј–∞–љ–Є–Љ–∞–µ—В —З–µ—В–≤–µ—А—В–Њ–µ –Љ–µ—Б—В–Њ –њ–Њ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О —Б–µ—А–і—Ж–∞ (–Ш–С–°) [1,17,21]. –°–Ф–2 —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —А–Є—Б–Ї –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤ 4 —А–∞–Ј–∞, —З—В–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —Б—А–µ–і–Є –ґ–µ–љ—Й–Є–љ––і–Є–∞–±–µ—В–Є–Ї–Њ–≤ [15]. –Т —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ —Г –±–Њ–ї—М–љ—Л—Е –°–Ф–2 —А–Є—Б–Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Є–љ—Б—Г–ї—М—В–∞ –њ–Њ–≤—Л—И–µ–љ –≤ 2–3 —А–∞–Ј–∞, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є – –≤ 15–20 —А–∞–Ј, –∞ —Б–ї–µ–њ–Њ—В—Л – –≤ 10–20 —А–∞–Ј [4,8,11]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є —Г –±–Њ–ї—М–љ—Л—Е –°–Ф–2 –≤ 2,5 —А–∞–Ј–∞ –≤—Л—И–µ, —З–µ–Љ —Г –ї–Є—Ж –±–µ–Ј –°–Ф. –°–Ф–2 —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Є β––Ї–ї–µ—В–Њ–Ї –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –љ–∞ —Д–Њ–љ–µ —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є [4,8]. –Я—А–Є –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–Є –°–Ф–2 —Б–µ–Ї—А–µ—Ж–Є—П –Є–љ—Б—Г–ї–Є–љ–∞ —Б–љ–Є–ґ–∞–µ—В—Б—П –љ–∞ 50%, —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –Є–љ—Б—Г–ї–Є–љ—Г – –љ–∞ 70% [13]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є–Ј–≤–µ—Б—В–љ–Њ –±–Њ–ї–µ–µ 40 —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е —Д–Њ—А–Љ–Є—А—Г–µ—В—Б—П –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М —В–Њ–є –Є–ї–Є –Є–љ–Њ–є —Б—В–µ–њ–µ–љ–Є. –Ш–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М —Б–Њ–њ—Г—В—Б—В–≤—Г–µ—В —Б—В—А–µ—Б—Б–∞–Љ, –Є–љ—Д–µ–Ї—Ж–Є—П–Љ, —Г–Љ–µ–љ—М—И–µ–љ–Є—О —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –њ–Њ–ґ–Є–ї–Њ–Љ—Г –≤–Њ–Ј—А–∞—Б—В—Г, –њ—А–Є–µ–Љ—Г –∞–ї–Ї–Њ–≥–Њ–ї—П, –Њ–ґ–Є—А–µ–љ–Є—О –Є –Љ–љ–Њ–≥–Є–Љ –і—А—Г–≥–Є–Љ —Б–Њ—Б—В–Њ—П–љ–Є—П–Љ [13]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –љ–∞—А—Г—И–µ–љ–Є–µ —Б–µ–Ї—А–µ—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–∞ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞ β––Ї–ї–µ—В–Њ–Ї –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –≤—Б—В—А–µ—З–∞–µ—В—Б—П –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –њ—А–Є –°–Ф–2. –Ю–і–љ–Є–Љ –Є–Ј —А–∞–љ–љ–Є—Е –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –і–µ—Д–µ–Ї—В–Њ–≤ —Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є β––Ї–ї–µ—В–Њ–Ї –њ—А–Є –°–Ф–2 —П–≤–ї—П–µ—В—Б—П –љ–∞—А—Г—И–µ–љ–Є–µ —А–∞–љ–љ–µ–є —Д–∞–Ј—Л —Б–µ–Ї—А–µ—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–∞, –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—О—Й–µ–є –њ–Њ–і—К–µ–Љ –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–Є –≤ –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ—Л–є –њ–µ—А–Є–Њ–і. –†–∞–љ–љ—П—П —Д–∞–Ј–∞ –њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –Є–љ—Б—Г–ї–Є–љ–∞ –≤—Л–Ј—Л–≤–∞–µ—В –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ —Н–љ–і–Њ–≥–µ–љ–љ–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–Є –≥–ї—О–Ї–Њ–Ј—Л –њ–µ—З–µ–љ—М—О, –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В –і–∞–ї—М–љ–µ–є—И–Є–є —А–Њ—Б—В –≥–ї–Є–Ї–µ–Љ–Є–Є, –њ–Њ–і–∞–≤–ї—П–µ—В –ї–Є–њ–Њ–ї–Є–Ј –Є —Б–µ–Ї—А–µ—Ж–Є—О –≥–ї—О–Ї–∞–≥–Њ–љ–∞, –∞ —В–∞–Ї–ґ–µ –њ–Њ–≤—Л—И–∞–µ—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —В–Ї–∞–љ–µ–є –Ї –і–µ–є—Б—В–≤–Є—О –Є–љ—Б—Г–ї–Є–љ–∞, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—П —Г—В–Є–ї–Є–Ј–∞—Ж–Є–Є –Є–Љ–Є –≥–ї—О–Ї–Њ–Ј—Л. –Я—А–Є –°–Ф–2 —Б–µ–Ї—А–µ—Ж–Є—П –Є–љ—Б—Г–ї–Є–љ–∞ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–∞ –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –љ–∞—А–∞—Б—В–∞—О—Й–µ–є –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–Є. –Э–∞–Є–±–Њ–ї—М—И–∞—П –і–Є—Б–њ—А–Њ–њ–Њ—А—Ж–Є—П –Љ–µ–ґ–і—Г —Б–µ–Ї—А–µ—Ж–Є–µ–є –Є–љ—Б—Г–ї–Є–љ–∞ –Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М—О –≤ –љ–µ–Љ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є. –Ф—А—Г–≥–Є–Љ –≤–∞–ґ–љ—Л–Љ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ —П–≤–ї—П–µ—В—Б—П –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —В–Ї–∞–љ–µ–є – –њ–µ—З–µ–љ–Є, –Љ—Л—И–µ—З–љ–Њ–є –Є –ґ–Є—А–Њ–≤–Њ–є. –Ш–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –њ–µ—З–µ–љ–Є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Б–Є–љ—В–µ–Ј–∞ –≥–ї–Є–Ї–Њ–≥–µ–љ–∞, –∞–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–µ–є –≥–ї–Є–Ї–Њ–≥–µ–љ–Њ–ї–Є–Ј–∞ –Є –≥–ї—О–Ї–Њ–љ–µ–Њ–≥–µ–љ–µ–Ј–∞. –§–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —А–µ–∞–Ї—Ж–Є—П –њ–µ—З–µ–љ–Є –љ–∞ –≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є—О –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —Б–љ–Є–ґ–µ–љ–Є–Є –њ—А–Њ–і—Г–Ї—Ж–Є–Є –≥–ї—О–Ї–Њ–Ј—Л. –Ф–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї–Њ–Љ–њ–µ–љ—Б–Є—А—Г–µ—В—Б—П –љ–µ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є–µ–є. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ —Н—В–Њ—В –Љ–µ—Е–∞–љ–Є–Ј–Љ —Г—В—А–∞—З–Є–≤–∞–µ—В—Б—П –Є –њ–µ—З–µ–љ—М –Є–Ј–±—Л—В–Њ—З–љ–Њ –њ—А–Њ–і—Г—Ж–Є—А—Г–µ—В –≥–ї—О–Ї–Њ–Ј—Г, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–Є –љ–∞—В–Њ—Й–∞–Ї. –Я—А–Є –°–Ф–2 –њ—А–Њ–і—Г–Ї—Ж–Є—П —Н–љ–і–Њ–≥–µ–љ–љ–Њ–є –≥–ї—О–Ї–Њ–Ј—Л –њ–µ—З–µ–љ—М—О –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ–Є—Й–µ–≤—Г—О –љ–∞–≥—А—Г–Ј–Ї—Г, –Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О –≤—Л–±—А–Њ—Б–∞ –Є–љ—Б—Г–ї–Є–љ–∞ —В–∞–Ї–ґ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–Є.
–Ю–±—Л—З–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї –ї–µ—З–µ–љ–Є—О –°–Ф–2 –≤–Ї–ї—О—З–∞–µ—В –і–Є–µ—В—Г –Є —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ –љ–∞–≥—А—Г–Ј–Ї–Є, –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –њ–Њ–≤–µ–і–µ–љ–Є—П, —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—О, –Њ–±—Г—З–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е, –∞ —В–∞–Ї–ґ–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г –Є –ї–µ—З–µ–љ–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є [1,4,20]. –Ю–і–љ–∞–Ї–Њ –≤ –і–µ–Ї–∞–±—А–µ 2006 –≥–Њ–і–∞ –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–∞—П –і–Є–∞–±–µ—В–Є—З–µ—Б–∞—П –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П (ADA) –Є –Х–≤—А–Њ–њ–µ–є—Б–Ї–∞—П –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –°–Ф (EASD) –њ—А–Є—И–ї–Є –Ї —Б–Њ–≥–ї–∞—И–µ–љ–Є—О (–Ї–Њ–љ—Б–µ–љ—Б—Г—Б—Г), —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї–Њ—В–Њ—А–Њ–Љ—Г –љ–∞ —Н—В–∞–њ–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –і–Є–∞–≥–љ–Њ–Ј–∞ –°–Ф –≤—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б–ї–µ–і—Г–µ—В –љ–∞–Ј–љ–∞—З–Є—В—М –Љ–µ—В—Д–Њ—А–Љ–Є–љ –љ–∞—А—П–і—Г —Б –њ—А–Є–љ—Ж–Є–њ–∞–Љ–Є –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –Њ–±—А–∞–Ј–∞ –ґ–Є–Ј–љ–Є. –Я—А–Є –љ–µ—Г–і–∞—З–µ —В–µ—А–∞–њ–Є–Є, –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є –љ–∞ –ї—О–±–Њ–Љ —Н—В–∞–њ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –°–Ф–2, –≤–∞–ґ–љ–Њ —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ –њ—А–Њ–≤–Њ–і–Є—В—М –µ–µ –Ї–Њ—А—А–µ–Ї—Ж–Є—О –Є –≤—Л–±–Є—А–∞—В—М –љ–∞–Є–±–Њ–ї–µ–µ –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–є –≤–∞—А–Є–∞–љ—В. –Ь–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—П –Њ–±—А–∞–Ј–∞ –ґ–Є–Ј–љ–Є –≤–Ї–ї—О—З–∞–µ—В —Б–Њ–±–ї—О–і–µ–љ–Є–µ –њ—А–∞–≤–Є–ї—М–љ–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П, —Б–љ–Є–ґ–µ–љ–Є–µ –Є –Ї–Њ–љ—В—А–Њ–ї—М –Ј–∞ –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –њ—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –Ї—Г—А–µ–љ–Є—П, –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ –Є–ї–Є –Є—Б–Ї–ї—О—З–µ–љ–Є–µ —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –∞–ї–Ї–Њ–≥–Њ–ї—П, —Г–Ї–ї–Њ–љ–µ–љ–Є–µ, —А–µ—И–µ–љ–Є–µ —Б–Њ—Ж–Є–∞–ї—М–љ—Л—Е –Є —Б–µ–Ї—Б—Г–∞–ї—М–љ—Л—Е –њ—А–Њ–±–ї–µ–Љ.
–Я—А–Є –Є–Ј–±—Л—В–Њ—З–љ–Њ–Љ –≤–µ—Б–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В—Б—П: –љ–Є–Ј–Ї–Њ–Ї–∞–ї–Њ—А–Є–є–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ —Б –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –ї–µ–≥–Ї–Њ—Г—Б–≤–Њ—П–µ–Љ—Л—Е —Г–≥–ї–µ–≤–Њ–і–Њ–≤, –і–Њ–ї—П –ґ–Є—А–Њ–≤ –≤ —Б—Г—В–Њ—З–љ–Њ–Љ —А–∞—Ж–Є–Њ–љ–µ –љ–µ –і–Њ–ї–ґ–љ–∞ –њ—А–µ–≤—Л—И–∞—В—М 30%, –∞ –љ–∞—Б—Л—Й–µ–љ–љ—Л–µ –ґ–Є—А—Л –і–Њ–ї–ґ–љ—Л —Б–Њ—Б—В–∞–≤–ї—П—В—М –љ–µ –±–Њ–ї–µ–µ 1/3 –Њ—В –≤—Б–µ–≥–Њ –њ–Њ—В—А–µ–±–ї—П–µ–Љ–Њ–≥–Њ –ґ–Є—А–∞; —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ (–Љ–µ–љ–µ–µ 300 –Љ–≥ –≤ —Б—Г—В–Ї–Є); —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –њ—А–Њ–і—Г–Ї—В–Њ–≤ —Б –≤—Л—Б–Њ–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –њ–Є—Й–µ–≤—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ; —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ –њ—А–Є–µ–Љ–∞ –∞–ї–Ї–Њ–≥–Њ–ї—П (–Љ–µ–љ–µ–µ
–Ь–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –Њ–і–љ–Є–Љ –Є–Ј –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Я–°–°–Я) –Є–Љ–µ–µ—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–µ–њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П –Є –Њ–±—Л—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –≤ –њ–µ—А–≤—Л–µ 5–6 –ї–µ—В –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Є–Ј –і–≤—Г—Е –Є –±–Њ–ї–µ–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П. –Ґ–∞–Ї, —А–µ–Ј—Г–ї—М—В–∞—В—Л UKPDS –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —З–µ—А–µ–Ј 3 –≥–Њ–і–∞ –Њ—В –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П —В–Њ–ї—М–Ї–Њ —Г 50% –±–Њ–ї—М–љ—Л—Е –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –і–Є–µ—В–Њ–є –Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Я–°–°–Я –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М HbA1c –Љ–µ–љ–µ–µ 7,0%, –∞ —Б–њ—Г—Б—В—П 9 –ї–µ—В —В–Њ–ї—М–Ї–Њ 25% –і–Њ—Б—В–Є–≥–∞—О—В —В–∞–Ї–Њ–є —Ж–µ–ї–Є [9]. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –°–Ф –њ–Њ—П–≤–ї—П–µ—В—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Є–Ј –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —А–∞–Ј–љ—Л—Е –≥—А—Г–њ–њ, –Ї–Њ—В–Њ—А—Л–µ –і–Њ–њ–Њ–ї–љ—П—О—В –і—А—Г–≥ –і—А—Г–≥–∞ –њ–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Г –і–µ–є—Б—В–≤–Є—П. –Т —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є –Я–°–°–Я –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П —Б–њ–Њ—Б–Њ–±–љ–∞ —Б–љ–Є–Ј–Є—В—М —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ HbA1—Б –љ–∞ 2–2,5% [4] (—В–∞–±–ї. 1).
–Ю–і–љ–Є–Љ –Є–Ј –Њ—Б–љ–Њ–≤–Њ–њ–Њ–ї–∞–≥–∞—О—Й–Є—Е –њ—А–Є–љ—Ж–Є–њ–Њ–≤ —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –°–Ф–2 —Б —Г—З–µ—В–Њ–Љ –µ–≥–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є –њ—А–Є—А–Њ–і—Л —П–≤–ї—П–µ—В—Б—П —А–µ–≥—Г–ї—П—А–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —Е–Њ—А–Њ—И–Є–є –≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є–є –Ї–Њ–љ—В—А–Њ–ї—М —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –°–Ф–2 [3,19]. –Т —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ —В–µ—А–∞–њ–Є–Є –°–Ф–2 –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–µ –≥—А—Г–њ–њ—Л –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤:
• –Я—А–Њ–Є–Ј–≤–Њ–і–љ—Л–µ —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л
• –С–Є–≥—Г–∞–љ–Є–і
• –Ь–µ–≥–ї–Є—В–Є–љ–Є–і—Л
• –Ь–Є–Љ–µ—В–Є–Ї–Є –≥–ї—О–Ї–∞–≥–Њ–љ–њ–Њ–і–Њ–±–љ–Њ–≥–Њ –њ–µ–њ—В–Є–і–∞ 1 (–У–Я–Я 1)
• –Ш–љ–≥–Є–±–Є—В–Њ—А—Л –і–Є–њ–µ–њ—В–Є–і–Є–ї –њ–µ–њ—В–Є–і–∞–Ј—Л IV (DPP IV)
• –Ґ–Є–∞–Ј–Њ–ї–Є–і–Є–љ–і–Є–Њ–љ—Л
• –Ш–љ–≥–Є–±–Є—В–Њ—А—Л α––≥–ї—О–Ї–Њ–Ј–Є–і–∞–Ј—Л
• –Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л
• –Ш–љ—Б—Г–ї–Є–љ
–Я—А–µ–њ–∞—А–∞—В—Л —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л
–≠—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –Њ—В–љ–Њ—Б—П—В—Б—П –Ї —Б–µ–Ї—А–µ—В–Њ–≥–µ–љ–∞–Љ –Є–љ—Б—Г–ї–Є–љ–∞. –Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л (–Я–°–Ь) –Њ—Б–љ–Њ–≤–∞–љ –љ–∞ –Є—Е —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞—В—М –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Є —Б–µ–Ї—А–µ—Ж–Є—О —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ –Є–љ—Б—Г–ї–Є–љ–∞ β––Ї–ї–µ—В–Ї–∞–Љ–Є –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є –≥–ї—О–Ї–Њ–Ј—Л [4,8,9]. –°—А–µ–і–Є –Я–°–Ь –≤—В–Њ—А–Њ–є –≥–µ–љ–µ—А–∞—Ж–Є–Є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і, –≥–ї–Є–њ–Є–Ј–Є–і, –≥–ї–Є–Ї–ї–∞–Ј–Є–і, –≥–ї–Є–Ї–≤–Є–і–Њ–љ –Є –≥–ї–Є–Љ–µ–њ–Є—А–Є–і. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Я–°–Ь —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П —А–∞–Ј–ї–Є—З–љ–Њ–є —Б–Є–ї–Њ–є —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–µ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Б–µ–Ї—А–µ—Ж–Є—О –Є–љ—Б—Г–ї–Є–љ–∞, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є β––Ї–ї–µ—В–Њ–Ї (–Р–Ґ–§––Ј–∞–≤–Є—Б–Є–Љ—Л–Љ–Є –Ї–∞–ї–Є–µ–≤—Л–Љ–Є –Ї–∞–љ–∞–ї–∞–Љ–Є) –Ј–∞ —Б—З–µ—В —А–∞–Ј–љ–Њ–є —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л –Љ–Њ–ї–µ–Ї—Г–ї—Л. –Я–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Я–°–Ь –Є–Љ–µ–µ—В –≤—В–Њ—А–Є—З–љ—Г—О –њ—А–Є—А–Њ–і—Г. –≠—В–Њ –і–µ–є—Б—В–≤–Є–µ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є–Є –Є —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –≥–ї—О–Ї–Њ–Ј–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є, —З—В–Њ –≤—Л–Ј—Л–≤–∞–µ—В —Г–ї—Г—З—И–µ–љ–Є–µ —Г—В–Є–ї–Є–Ј–∞—Ж–Є–Є –≥–ї—О–Ї–Њ–Ј—Л —В–Ї–∞–љ—П–Љ–Є –Є —Г–≥–љ–µ—В–µ–љ–Є–µ –њ—А–Њ–і—Г–Ї—Ж–Є–Є –≥–ї—О–Ї–Њ–Ј—Л –њ–µ—З–µ–љ—М—О. –Я—А–Є –µ–і–Є–љ–Њ–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–µ –і–µ–є—Б—В–≤–Є—П –Ї–∞–ґ–і—Л–є –Є–Ј –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л –Є–Љ–µ–µ—В –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Д–∞—А–Љ–Њ–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є –Є —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є–Ї–Є –Є —А—П–і –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤, –Ї–Њ—В–Њ—А—Л–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М, –њ—А–Њ–≤–Њ–і—П –ї–µ—З–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е —Б –°–Ф–2 [5,9]. –Я–°–Ь —Б–≤—П–Ј—Л–≤–∞—О—В—Б—П —Б–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ–Є –±–µ–ї–Ї–∞–Љ–Є–—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –љ–∞ –Ї–ї–µ—В–Њ—З–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ–µ β––Ї–ї–µ—В–Њ–Ї –Є —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В —Б–µ–Ї—А–µ—Ж–Є—О –Є–љ—Б—Г–ї–Є–љ–∞ –њ—Г—В–µ–Љ –Ј–∞–Ї—А—Л—В–Є—П –Ї–∞–ї–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤ –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ —Н—В–Њ–≥–Њ, –Њ—В–Ї—А—Л—В–Є—П –Ї–∞–ї—М—Ж–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –њ—А–Є—В–Њ–Ї –Ї–∞–ї—М—Ж–Є—П –≤–љ—Г—В—А—М β––Ї–ї–µ—В–Њ–Ї, –≤ –Ї–Њ—В–Њ—А—Л—Е –µ–≥–Њ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –Ј–∞–њ—Г—Б–Ї–∞–µ—В —Б–µ–Ї—А–µ—Ж–Є—О –Є–љ—Б—Г–ї–Є–љ–∞. –Я–°–Ь —Б–≤—П–Ј—Л–≤–∞—О—В—Б—П –љ–∞ –Ї–ї–µ—В–Њ—З–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ–µ β––Ї–ї–µ—В–Ї–Є —Б —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ–љ—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–Њ–Љ, –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–∞—П –Љ–∞—Б—Б–∞ –Ї–Њ—В–Њ—А–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 149 –Ї–Ф–Р. –Ш—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ —П–≤–ї—П–µ—В—Б—П –≥–ї–Є–Љ–µ–њ–Є—А–Є–і, —Б–≤—П–Ј—Л–≤–∞—О—Й–Є–є—Б—П —Б —Б—Г–±—К–µ–і–Є–љ–Є—Ж–µ–є —Н—В–Њ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–∞ —Б –Љ–µ–љ—М—И–µ–є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б–Њ–є (65 –Ї–Ф–Р). –Я–°–Ь –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –≥–µ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–Є –≥–ї—О–Ї–Њ–Ј—Л –Є –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є. –Э–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –Є–Ј –Я–°–Ь —П–≤–ї—П–µ—В—Б—П –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і, –Ї–Њ—В–Њ—А—Л–є –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Њ–Ї–Њ–ї–Њ 40 –ї–µ—В. –Ь–µ—В–∞–±–Њ–ї–Є–Ј–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≤ –њ–µ—З–µ–љ–Є –њ—Г—В–µ–Љ –њ—А–µ–≤—А–∞—Й–µ–љ–Є—П –≤ –і–≤–∞ –љ–µ–∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–∞, –Њ–і–Є–љ –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —Н–Ї—Б–Ї—А–µ—В–Є—А—Г–µ—В—Б—П —Б –Љ–Њ—З–Њ–є, –∞ –≤—В–Њ—А–Њ–є –≤—Л–і–µ–ї—П–µ—В—Б—П —З–µ—А–µ–Ј –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ—Л–є —В—А–∞–Ї—В. –У–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і –Њ–±–ї–∞–і–∞–µ—В –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ —Б—А–µ–і–Є –≤—Б–µ—Е –Я–°–Ь –Є –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—Б—П –≤ –≤–Є–і–µ –і–≤—Г—Е —Д–Њ—А–Љ: –љ–µ–Љ–Є–Ї—А–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є –Є –Љ–Є–Ї—А–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є. –Э–µ–Љ–Є–Ї—А–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–∞—П —Д–Њ—А–Љ–∞ –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤—Л–±–Њ—А–∞ –≤ –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е –°–Ф–2 –њ—А–Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –і—А—Г–≥–Є—Е –Я–°–Ь. –Ф–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ –њ–Њ—Б—В–µ–њ–µ–љ–љ—Л–є –њ–Њ–і–±–Њ—А –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –Є –њ—А–Є —Н—В–Њ–Љ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є –і–Њ–Ј–Є—А–Њ–≤–Ї–Є. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–µ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –≤—Б–µ—Е —Д–Њ—А–Љ –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 24 —З–∞—Б–∞. –С–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М —Н—В–Њ–є —Д–Њ—А–Љ—Л –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –≤—Б–µ–≥–Њ 24–69%, –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤ –Ї—А–Њ–≤–Є –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П —З–µ—А–µ–Ј 4–6 —З –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞. –°—Г—В–Њ—З–љ–∞—П –і–Њ–Ј–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 2,5–20 –Љ–≥, –µ–µ –љ–∞–Ј–љ–∞—З–∞—О—В –≤ 2 –њ—А–Є–µ–Љ–∞ –Ј–∞ 30–40 –Љ–Є–љ. –і–Њ –µ–і—Л. –У–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і –Њ–±–ї–∞–і–∞–µ—В –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–Љ —Б—А–Њ–і—Б—В–≤–Њ–Љ –Ї –Р–Ґ–§––Ј–∞–≤–Є—Б–Є–Љ—Л–Љ K+––Ї–∞–љ–∞-–ї–∞–Љ b––Ї–ї–µ—В–Њ–Ї, –њ–Њ—Н—В–Њ–Љ—Г –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–Є–є —Н—Д—Д–µ–Ї—В. –Т —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ —В–∞–Ї–Њ–є —Н—Д—Д–µ–Ї—В –Љ–Њ–ґ–µ—В —П–≤–Є—В—М—Б—П –њ—А–Є—З–Є–љ–Њ–є –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є –≤ –љ–Њ—З–љ–Њ–µ –≤—А–µ–Љ—П, –≤ —Б–ї—Г—З–∞–µ –Є–Ј––Ј–∞ –њ—А–Њ–њ—Г—Б–Ї–∞ –Њ—З–µ—А–µ–і–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –њ–Є—Й–Є –Є–ї–Є –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ—Б—В–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –љ–∞–≥—А—Г–Ј–Њ–Ї, —З—В–Њ –љ–∞–Є–±–Њ–ї–µ–µ –Њ–њ–∞—Б–љ–Њ —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞. –С–Њ–ї–µ–µ —З–∞—Б—В–Њ–µ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є—Е —Н–њ–Є–Ј–Њ–і–Њ–≤ –Њ—В–Љ–µ—З–µ–љ–Њ —Г –±–Њ–ї—М–љ—Л—Е –°–Ф–2, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і, –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –±–Њ–ї—М–љ—Л–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є –і—А—Г–≥–Є–µ –Я–°–Ь (–≥–ї–Є–Љ–µ–њ–Є—А–Є–і, –≥–ї–Є–Ї–ї–∞–Ј–Є–і) [7]. –У–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є, –Ї–∞–Ї —П–≤–љ—Л–µ, —В–∞–Ї –Є —Б–Ї—А—Л—В—Л–µ, –Љ–Њ–≥—Г—В –≤–Њ–Ј–љ–Є–Ї–∞—В—М –њ—А–Є –љ–µ–њ—А–∞–≤–Є–ї—М–љ–Њ–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ (–љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ –±–Њ–ї—М—И–Є–µ –і–Њ–Ј—Л, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —А–µ–ґ–Є–Љ–∞ –њ—А–Є–µ–Љ–∞ 3 —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є). –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Г –±–Њ–ї—М–љ–Њ–≥–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –∞–њ–њ–µ—В–Є—В, —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –Љ–∞—Б—Б–∞ —В–µ–ї–∞ –Є –љ–∞—А–∞—Б—В–∞–µ—В –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М. –Э–Њ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –°–Ф –љ–µ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П, —З—В–Њ –Њ—И–Є–±–Њ—З–љ–Њ –Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П –≤—А–∞—З–Њ–Љ, –Ї–∞–Ї –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П, –Є –≤–љ–Њ–≤—М —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Б—Г—В–Њ—З–љ–∞—П –і–Њ–Ј–∞ –њ—А–µ–њ–∞—А–∞—В–∞. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –Є–Ј–≤–µ—Б—В–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–є, –Я–°–Ь –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –њ—А–Њ–і–Њ–ї–ґ–∞—О—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Є–Ј––Ј–∞ –Є—Е –≤—Л—Б–Њ–Ї–Њ–є —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–µ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є. –≠–њ–Є–Ј–Њ–і—Л –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є —З–∞—Й–µ –≤—Б—В—А–µ—З–∞—О—В—Б—П —Г –±–Њ–ї—М–љ—Л—Е –њ–Њ–ґ–Є–ї–Њ–≥–Њ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –љ–∞—А—Г—И–µ–љ–Є—П —А–µ–ґ–Є–Љ–∞ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ј–∞ —Б—З–µ—В —Г—Е—Г–і—И–µ–љ–Є—П –њ–∞–Љ—П—В–Є. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ—А–∞–Ї—В–Є–Ї–∞, –њ–Њ–ґ–Є–ї—Л–µ –±–Њ–ї—М–љ—Л–µ —З–∞—Б—В–Њ –љ–µ –њ–Њ–Љ–љ—П—В, –њ—А–Є–љ–Є–Љ–∞–ї–Є –ї–Є –Њ–љ–Є –ї–µ–Ї–∞—А—Б—В–≤–Њ –Њ—В –і–Є–∞–±–µ—В–∞ –≤ —Г—В—А–µ–љ–љ–Є–µ –Є–ї–Є –≤–µ—З–µ—А–љ–Є–µ —З–∞—Б—Л, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –њ–µ—А–µ–і —Г–ґ–Є–љ–Њ–Љ –Є–ї–Є –Ј–∞–≤—В—А–∞–Ї–Њ–Љ –њ—А–Є–љ–Є–Љ–∞—О—В –і–Њ–Ј—Г, –≤ 2 —А–∞–Ј–∞ –±–Њ–ї—М—И–µ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ–Њ–є, –љ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞—П –њ—А–Є —Н—В–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–Њ—В—А–µ–±–ї—П–µ–Љ—Л—Е —Г–≥–ї–µ–≤–Њ–і–Њ–≤, —З—В–Њ —З–∞—Б—В–Њ –њ—А–Њ–≤–Њ—Ж–Є—А—Г–µ—В –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—О.
–Ь–Є–Ї—А–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ —Д–Њ—А–Љ—Л –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї—М—И–µ–є –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–µ–Љ–Є–Ї—А–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є —Д–Њ—А–Љ–Њ–є, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –≤ –Љ–µ–љ—М—И–µ–є –і–Њ–Ј–µ. –Ь–Є–Ї—А–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–∞—П —Д–Њ—А–Љ–∞ –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –њ–Њ–ї–љ–Њ–µ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –і–µ–є—Б—В–≤—Г—О—Й–µ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –≤ —В–µ—З–µ–љ–Є–µ 5 –Љ–Є–љ. –њ–Њ—Б–ї–µ —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П –Є –±—Л—Б—В—А–Њ–µ –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ, –њ–Њ—Н—В–Њ–Љ—Г –µ–≥–Њ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Є–љ–Є–Љ–∞—В—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–µ—А–µ–і –њ—А–Є–µ–Љ–Њ–Љ –њ–Є—Й–Є. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Љ–Є–Ї—А–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е —Д–Њ—А–Љ –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П —З–µ—А–µ–Ј 1,7 —З–∞—Б–∞ (1,75 –Љ–≥) –Є 2,5 —З (3,5 –Љ–≥). –†–Є—Б–Ї –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є—Е —Н–њ–Є–Ј–Њ–і–Њ–≤ –≤ –њ–µ—А–Є–Њ–і—Л –≤—А–µ–Љ–µ–љ–Є –Љ–µ–ґ–і—Г –њ—А–Є–µ–Љ–∞–Љ–Є –њ–Є—Й–Є –Є –љ–Њ—З—М—О –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–ґ–µ–љ.
–С–Є–≥—Г–∞–љ–Є–і
–Х–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –Є–Ј –≥—А—Г–њ–њ—Л –±–Є–≥—Г–∞–љ–Є–і–Њ–≤, —А–∞–Ј—А–µ—И–µ–љ–љ—Л–Љ –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О, —П–≤–ї—П–µ—В—Б—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ [3]. –Ю–і–љ–Њ –Є–Ј —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –Љ–µ—В–Њ—Д–Њ—А–Љ–Є–љ–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –Я–°–°–Я —Б–≤—П–Ј–∞–љ–Њ —Б –њ—А–µ–њ—П—В—Б—В–≤–Є–µ–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–∞ –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –Њ–љ –і–∞–ґ–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –µ–µ —Б–љ–Є–ґ–µ–љ–Є—О).
–Ю–і–љ–Є–Љ –Є–Ј –≤–∞–ґ–љ–µ–є—И–Є—Е –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є–Є –њ—А–Є –°–Ф–2 —П–≤–ї—П–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ –≥–µ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–Є –≥–ї—О–Ї–Њ–Ј—Л –≤ –љ–Њ—З–љ—Л–µ –Є —А–∞–љ–љ–Є–µ —Г—В—А–µ–љ–љ–Є–µ —З–∞—Б—Л, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О —Г—А–Њ–≤–љ—П –≥–ї–Є–Ї–µ–Љ–Є–Є –љ–∞—В–Њ—Й–∞–Ї. –Ю—Б–љ–Њ–≤—Г —Н—В–Њ–≥–Њ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ —Б–Њ—Б—В–∞–≤–ї—П—О—В –љ–∞—А—Г—И–µ–љ–љ–∞—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤ –Ї –і–µ–є—Б—В–≤–Є—О –Є–љ—Б—Г–ї–Є–љ–∞, –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–∞—П –њ–Њ—А—В–∞–ї—М–љ–∞—П –≥–Є–њ–Њ–Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є—П –Є –≥–Є–њ–µ—А–≥–ї—О–Ї–∞–≥–Њ–љ–µ–Љ–Є—П [3,17]. –Ф–∞–≤–љ–Њ –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Є —Б–Њ—Б—Г–і–Њ–≤ [14,20]. –С–Є–≥—Г–∞–љ–Є–і –Љ–µ—В—Д–Њ—А–Љ–Є–љ –њ–Њ–≤—Л—И–∞–µ—В –њ–µ—З–µ–љ–Њ—З–љ—Г—О –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї —Н–љ–і–Њ–≥–µ–љ–љ–Њ–Љ—Г –Є–љ—Б—Г–ї–Є–љ—Г, –љ–µ –≤–ї–Є—П—П –љ–∞ –µ–≥–Њ —Б–µ–Ї—А–µ—Ж–Є—О [3,9]. –Э–µ –Њ–Ї–∞–Ј—Л–≤–∞—П –њ—А—П–Љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –љ–∞ β––Ї–ї–µ—В–Ї–Є, –Љ–µ—В—Д–Њ—А–Љ–Є–љ –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ —Г–ї—Г—З—И–∞–µ—В —Б–µ–Ї—А–µ—Ж–Є—О –Є–љ—Б—Г–ї–Є–љ–∞, —Б–љ–Є–ґ–∞—П –≥–ї—О–Ї–Њ–Ј–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О —Б–≤–Њ–±–Њ–і–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В (–ї–Є–њ–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М). –Я–µ—А–≤–Є—З–љ—Л–є –∞–љ—В–Є–≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –≤—Л–Ј–≤–∞–љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –њ—А–Њ–і—Г–Ї—Ж–Є–Є –≥–ї—О–Ї–Њ–Ј—Л –њ–µ—З–µ–љ—М—О (–≥–ї—О–Ї–Њ–љ–µ–Њ–≥–µ–љ–µ–Ј), –∞ —В–∞–Ї–ґ–µ –њ—А–Њ–і—Г–Ї—Ж–Є–Є —Б–≤–Њ–±–Њ–і–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В (–°–Ц–Ъ), –Њ–Ї–Є—Б–ї–µ–љ–Є—П –ґ–Є—А–∞ –Є —З–∞—Б—В–Є—З–љ–Њ – —Г—Б–Є–ї–µ–љ–Є–µ–Љ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Ј–∞—Е–≤–∞—В–∞ –≥–ї—О–Ї–Њ–Ј—Л [11].
–Ю—Б–љ–Њ–≤–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ —П–≤–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –њ—А–Њ–і—Г–Ї—Ж–Є–Є –≥–ї—О–Ї–Њ–Ј—Л –њ–µ—З–µ–љ—М—О, –Ї–Њ—В–Њ—А–∞—П –≤ 2–3 —А–∞–Ј–∞ –њ–Њ–≤—Л—И–µ–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е –°–Ф–2 [3]. –Т –Њ–і–љ–Њ–Љ –Є–Ј –љ–µ–і–∞–≤–љ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Г –±–Њ–ї—М–љ—Л—Е –°–Ф–2 –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є—П –љ–∞—В–Њ—Й–∞–Ї –Њ—В—З–∞—Б—В–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ —В—А–Њ–µ–Ї—А–∞—В–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Б–Ї–Њ—А–Њ—Б—В–Є –≥–ї—О–Ї–Њ–љ–µ–Њ–≥–µ–љ–µ–Ј–∞ [13]. –Ґ–∞–Ї–Њ–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ —Б–≤—П–Ј–∞–љ —Б –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≥–ї—О–Ї–Њ–љ–µ–Њ–≥–µ–љ–µ–Ј–∞ –Є –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –≥–ї–Є–Ї–Њ–≥–µ–љ–Њ–ї–Є–Ј–∞, —З—В–Њ –≤ –Є—В–Њ–≥–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—О –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≥–ї–Є–Ї–µ–Љ–Є–Є –љ–∞—В–Њ—Й–∞–Ї. –Э–∞—А—П–і—Г —Б —Н—В–Є–Љ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –њ–Њ–≥–ї–Њ—Й–µ–љ–Є–µ –≥–ї—О–Ї–Њ–Ј—Л —Б–Ї–µ–ї–µ—В–љ—Л–Љ–Є –Љ—Л—И—Ж–∞–Љ–Є –Є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ—М—О. –Ь–µ—В—Д–Њ—А–Љ–Є–љ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Є–љ—Б—Г–ї–Є–љ––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–Љ—Г –њ–Њ–і–∞–≤–ї–µ–љ–Є—О –≥–ї—О–Ї–Њ–љ–µ–Њ–≥–µ–љ–µ–Ј–∞ –Є–Ј —В–∞–Ї–Є—Е –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ –≥–ї—О–Ї–Њ–Ј—Л, –Ї–∞–Ї –ї–∞–Ї—В–∞—В, –њ–Є—А—Г–≤–∞—В, –≥–ї–Є—Ж–µ—А–Њ–ї, –љ–µ–Ї–Њ—В–Њ—А—Л–µ –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В—Л, –Є –њ—А–Њ—В–Є–≤–Њ–і–µ–є—Б—В–≤—Г–µ—В –≥–ї—О–Ї–Њ–љ–µ–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–Љ—Г –і–µ–є—Б—В–≤–Є—О –≥–ї—О–Ї–∞–≥–Њ–љ–∞. –Т –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Н—В–Њ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤—Б–ї–µ–і—Б—В–≤–Є–µ —В–Њ—А–Љ–Њ–ґ–µ–љ–Є—П –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е —Б—Г–±—Б—В—А–∞—В–Њ–≤ –≥–ї—О–Ї–Њ–љ–µ–Њ–≥–µ–љ–µ–Ј–∞ –≤ –≥–µ–њ–∞—В–Њ—Ж–Є—В—Л –Є –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –µ–≥–Њ –Ї–ї—О—З–µ–≤—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ – –њ–Є—А—Г–≤–∞—В–Ї–∞—А–±–Њ–Ї—Б–Є–ї–∞–Ј—Л, —Д—А—Г–Ї—В–Њ–Ј–Њ–1,6––±–Є—Д–Њ—Б—Д–∞—В–∞–Ј—Л –Є –≥–ї—О–Ї–Њ–Ј–Њ–6–—Д–Њ—Б—Д–∞—В–∞–Ј—Л [10,13,17].
–Я–Њ–≤—Л—И–µ–љ–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —В–Ї–∞–љ–µ–є –Ї –і–µ–є—Б—В–≤–Є—О –Є–љ—Б—Г–ї–Є–љ–∞ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ —А—П–і–∞ –Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤. –°–Њ —Б—В–Њ—А–Њ–љ—Л —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є–љ—Б—Г–ї–Є–љ–∞ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ –Є—Е —З–Є—Б–ї–∞ –Є –∞—Д—Д–Є–љ–љ–Њ—Б—В–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Б—В–Є–Љ—Г–ї—П—Ж–Є—П —В–Є—А–Њ–Ј–Є–љ–Ї–Є–љ–∞–Ј–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–µ—Ж–µ–њ—В–Њ—А–∞ –Є–љ—Б—Г–ї–Є–љ–∞, –∞ —В–∞–Ї–ґ–µ —Б—В–Є–Љ—Г–ї—П—Ж–Є—П —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —В—А–∞–љ—Б–њ–Њ—А—В–µ—А–Њ–≤ –≥–ї—О–Ї–Њ–Ј—Л, –Є—Е —В—А–∞–љ—Б–ї–Њ–Ї–∞—Ж–Є—П –Є–Ј –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –њ—Г–ї–∞ –љ–∞ –Ї–ї–µ—В–Њ—З–љ—Г—О –Љ–µ–Љ–±—А–∞–љ—Г [17]. –Т—Л—И–µ–њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –њ—А–Є–≤–Њ–і—П—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –њ–Њ–≥–ї–Њ—Й–µ–љ–Є—П –≥–ї—О–Ї–Њ–Ј—Л –Њ—А–≥–∞–љ–∞–Љ–Є––Љ–Є—И–µ–љ—П–Љ–Є –Є–љ—Б—Г–ї–Є–љ–∞ – –њ–µ—З–µ–љ—М—О, –Љ—Л—И–µ—З–љ–Њ–є –Є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ—П–Љ–Є, —Г—Б–Є–ї–Є–≤–∞–µ—В—Б—П —Б–Є–љ—В–µ–Ј –≥–ї–Є–Ї–Њ–≥–µ–љ–∞ –≤ –њ–µ—З–µ–љ–Є. –Ь–µ—В—Д–Њ—А–Љ–Є–љ —В–∞–Ї–ґ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤–ї–Є—П–љ–Є–µ –љ–∞ –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ —Г–≥–ї–µ–≤–Њ–і–Њ–≤ –≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–Љ —В—А–∞–Ї—В–µ, –Ј–∞–Љ–µ–і–ї—П—П –µ–≥–Њ —Б–Ї–Њ—А–Њ—Б—В—М, –∞ —В–∞–Ї–ґ–µ —Б–љ–Є–ґ–∞–µ—В –∞–њ–њ–µ—В–Є—В, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ —Б–љ–Є–ґ–∞–µ—В—Б—П –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–∞—П –≥–ї–Є–Ї–µ–Љ–Є—П. –Э–∞—А—П–і—Г —Б —Н—В–Є–Љ –Љ–µ—В—Д–Њ—А–Љ–Є–љ –Є–Љ–µ–µ—В —А—П–і –і—А—Г–≥–Є—Е –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤, –≤–Ї–ї—О—З–∞—П –Є –≤–ї–Є—П–љ–Є–µ –љ–∞ –ґ–Є—А–Њ–≤–Њ–є –Њ–±–Љ–µ–љ [3,4]. –Ы–µ—З–µ–љ–Є–µ –±–Є–≥—Г–∞–љ–Є–і–Њ–Љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є —Н—Д—Д–µ–Ї—В –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –ї–Є–њ–Є–і–Њ–≤ –њ–ї–∞–Ј–Љ—Л –≤ —Б–≤—П–Ј–Є —Б –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ (—В–∞–±–ї. 2). –Я–Њ–≤—Л—И–µ–љ–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –°–Ц–Ъ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –±–Њ–ї—М–љ—Л—Е –°–Ф–2, –∞ –Љ–µ—В—Д–Њ—А–Љ–Є–љ –Њ–±–ї–∞–і–∞–µ—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —Б–љ–Є–ґ–∞—В—М –љ–∞ 10–30% –Њ–Ї–Є—Б–ї–µ–љ–Є–µ –°–Ц–Ъ. –°–љ–Є–ґ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –°–Ц–Ъ (–љ–∞ 10–17%), –Њ–љ –љ–µ —В–Њ–ї—М–Ї–Њ —Г–ї—Г—З—И–∞–µ—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –Є–љ—Б—Г–ї–Є–љ—Г, –љ–Њ –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –љ–∞—А—Г—И–µ–љ–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–∞ [3,9].
–Т–∞–ґ–љ–Њ –Ј–∞–Љ–µ—В–Є—В—М, —З—В–Њ —Г –±–Њ–ї—М–љ—Л—Е –°–Ф–2 –Љ–µ—В—Д–Њ—А–Љ–Є–љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –ї–Є—И—М –Њ—В—З–∞—Б—В–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –µ–≥–Њ –∞–љ—В–Є–≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —Б–≤—П–Ј–∞–љ—Л —Б –≤–ї–Є—П–љ–Є–µ–Љ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –љ–∞ –ї–Є–њ–Є–і–љ—Л–є –Њ–±–Љ–µ–љ, —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О, —Б–Њ—Б—Г–і–Є—Б—В—Г—О —А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В—М, —Б–Є—Б—В–µ–Љ—Г –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ –Є —А–µ–Њ–ї–Њ–≥–Є—О –Ї—А–Њ–≤–Є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –≥–Є–њ–µ—А–Ї–Њ–∞–≥—Г–ї—П—Ж–Є—О, –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–љ–Њ—Б—В—М —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –Є –і—А. (—В–∞–±–ї. 2).
–Т –љ–µ–і–∞–≤–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е –°–Ф–2 –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –≤–ї–Є—П–љ–Є–µ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –Є –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ –љ–∞ –і–Є—Б–њ–µ—А—Б–Є—О –Є–љ—В–µ—А–≤–∞–ї–∞ Q–Ґ, –Ї–Њ—В–Њ—А—Л–є —П–≤–ї—П–µ—В—Б—П –Љ–∞—А–Ї–µ—А–Њ–Љ —А–Є—Б–Ї–∞ –∞—А–Є—В–Љ–Є–Є –Є –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є —Б–Љ–µ—А—В–Є [8]. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –ї–µ—З–µ–љ–Є–µ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤–ї–Є—П–љ–Є—П –љ–∞ –і–Є—Б–њ–µ—А—Б–Є—О –Є–љ—В–µ—А–≤–∞–ї–∞ Q–Ґ, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –њ—А–Є–µ–Љ –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї –і–Є—Б–њ–µ—А—Б–Є—О Q–Ґ.
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –њ–Њ—П–≤–Є–ї–Њ—Б—М –Љ–љ–Њ–≥–Њ –Є–љ—В–µ—А–µ—Б–љ—Л—Е –і–∞–љ–љ—Л—Е –Њ –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–∞—Е –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –Ј–љ–∞—З–Є–Љ–Њ–є —А–Њ–ї–Є –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є –Ї–Њ–љ—В—А–Њ–ї—П –≥–ї–Є–Ї–µ–Љ–Є–Є, –љ–Њ –Є –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є –Ј–∞–Љ–µ–і–ї–µ–љ–Є–Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П —Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –°–Ф–2. –Ъ–∞–Ї —Г –±–Њ–ї—М–љ—Л—Е –°–Ф–2 —Б—А–µ–і–љ–µ–≥–Њ, —В–∞–Ї –Є —Г –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –±–Є–≥—Г–∞–љ–Є–і –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –≤–ї–Є—П–µ—В –љ–∞ —Б–Є—Б—В–µ–Љ—Г –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ –Є —А–µ–Њ–ї–Њ–≥–Є—О –Ї—А–Њ–≤–Є. –£ –±–Њ–ї—М–љ—Л—Е –°–Ф–2 –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г—Б–Є–ї–µ–љ—Л –њ—А–Њ—Ж–µ—Б—Б—Л —В—А–Њ–Љ–±–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Є –≤—Л—Б–Њ–Ї —А–Є—Б–Ї —В—А–Њ–Љ–±–Њ–Ј–∞. –Ґ–µ—А–∞–њ–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ –≤ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ 1700 –Љ–≥ —Г–Љ–µ–љ—М—И–∞–µ—В –∞–≥—А–µ–≥–∞—Ж–Є—О —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е –°–Ф–2 [9]. –Ь–µ—В—Д–Њ—А–Љ–Є–љ –љ–µ —В–Њ–ї—М–Ї–Њ –Њ–±–ї–∞–і–∞–µ—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —В–Њ—А–Љ–Њ–Ј–Є—В—М –∞–≥—А–µ–≥–∞—Ж–Є—О —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, –љ–Њ –Є —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ —В—А–Њ–Љ–±–Њ–≤ [3,11]. –Т —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–љ–Њ —Г–ї—Г—З—И–µ–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —Д–Є–±—А–Є–љ–Њ–ї–Є–Ј–∞ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ [13,17]. –Ь–µ—Е–∞–љ–Є–Ј–Љ —Г–ї—Г—З—И–µ–љ–Є—П —Д–Є–±—А–Є–љ–Њ–ї–Є–Ј–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞–1 (–Ш–Р–Я–1), –Є–љ–∞–Ї—В–Є–≤–Є—А—Г—О—Й–µ–≥–Њ —В–Ї–∞–љ–µ–≤–Њ–є –∞–Ї—В–Є–≤–∞—В–Њ—А –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Љ–µ—В—Д–Њ—А–Љ–Є–љ –Њ–±–ї–∞–і–∞–µ—В –Є –љ–µ–њ—А—П–Љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Ш–Р–Я–1. –Р–і–Є–њ–Њ—Ж–Є—В—Л –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є –њ—А–Њ–і—Г—Ж–Є—А—Г—О—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї—М—И–µ –Ш–Р–Я–1, —З–µ–Љ –∞–і–Є–њ–Њ—Ж–Є—В—Л –њ–Њ–і–Ї–Њ–ґ–љ–Њ––ґ–Є—А–Њ–≤–Њ–є –Ї–ї–µ—В—З–∞—В–Ї–Є, –∞ –Љ–µ—В—Д–Њ—А–Љ–Є–љ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Љ–∞—Б—Б—Л –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–є –ґ–Є—А–∞.
–Т–∞–Ј–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –Ј–∞–Ї–ї—О—З–∞—О—В—Б—П –≤ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є —Ж–Є–Ї–ї–∞ —Б–Њ–Ї—А–∞—Й–µ–љ–Є—П/—А–∞—Б—Б–ї–∞–±–ї–µ–љ–Є—П –∞—А—В–µ—А–Є–Њ–ї, —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є –Є —В–Њ—А–Љ–Њ–ґ–µ–љ–Є–Є –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –љ–µ–Њ–∞–љ–≥–Є–Њ–≥–µ–љ–µ–Ј–∞.
–Ю–Ї–Є—Б–ї–Є—В–µ–ї—М–љ—Л–є —Б—В—А–µ—Б—Б –њ—А–Є –°–Ф–2, –≤—Л–Ј–≤–∞–љ–љ—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–Љ –Њ—Б–ї–∞–±–ї–µ–љ–Є–µ–Љ –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Б–Є–љ—В–µ–Ј–Њ–Љ —Б–≤–Њ–±–Њ–і–љ—Л—Е —А–∞–і–Є–Ї–∞–ї–Њ–≤ –Њ–і–љ–∞ –Є–Ј –њ—А–Є—З–Є–љ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є. –Ь–µ—В—Д–Њ—А–Љ–Є–љ –Њ–±–ї–∞–і–∞–µ—В –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–є —В–Њ—А–Љ–Њ–ґ–µ–љ–Є–µ–Љ –Ї–ї–µ—В–Њ—З–љ—Л—Е –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≥–ї–Є–Ї–Њ–Ј–Є–ї–Є—А–Њ–≤–∞–љ–Є—П –±–µ–ї–Ї–Њ–≤ [15,17].
–Т —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–µ–є –Є —Д–Є–Ј–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞–≥—А—Г–Ј–Ї–∞–Љ–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ —Б–љ–Є–ґ–∞–µ—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –≥–ї—О–Ї–Њ–Ј—Л –љ–∞—В–Њ—Й–∞–Ї –љ–∞ 2,78–3,90 –Љ–Љ–Њ–ї—М/–ї, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П HbA1c –љ–∞ 1,3–2,0% [3,10]. –Т–∞—А–Є–∞–±–µ–ї—М–љ–Њ—Б—В—М —Б—В–µ–њ–µ–љ–Є —Б–љ–Є–ґ–µ–љ–Є—П –≥–ї–Є–Ї–µ–Љ–Є–Є —Б–≤—П–Ј–∞–љ–∞ —Б –Є—Б—Е–Њ–і–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –≥–ї–Є–Ї–µ–Љ–Є–Є –і–Њ –Є–љ–Є—Ж–Є–∞—Ж–Є–Є –ї–µ—З–µ–љ–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ. –Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ –љ–µ –Ј–∞–≤–Є—Б–Є—В –Њ—В –≤–Њ–Ј—А–∞—Б—В–∞, –Љ–∞—Б—Б—Л —В–µ–ї–∞, –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –°–Ф, —Г—А–Њ–≤–љ—П –Є–љ—Б—Г–ї–Є–љ–∞ –Є –°––њ–µ–њ—В–Є–і–∞ –Ї—А–Њ–≤–Є.
–Я—А–Є –≤—Л–±–Њ—А–µ –њ—А–µ–њ–∞—А–∞—В–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ —Б –°–Ф–2, –Њ—Б–Њ–±–µ–љ–љ–Њ —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞, –≤—Б–µ–≥–і–∞ –љ—Г–ґ–љ–Њ –њ–Њ–Љ–љ–Є—В—М –Њ –і–Њ–Ї–∞–Ј–∞–љ–љ—Л—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞—Е –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ —Г —В–∞–Ї–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –±–Њ–ї—М–љ—Л—Е. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л, –Є–љ—Б—Г–ї–Є–љ–∞ –Є —В–Є–∞–Ј–Њ–ї–Є–і–Є–љ–і–Є–Њ–љ–Њ–≤ –Љ–µ—В—Д–Њ—А–Љ–Є–љ –Њ–±–ї–∞–і–∞–µ—В —Г–љ–Є–Ї–∞–ї—М–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ – —Б–љ–Є–ґ–∞–µ—В –Љ–∞—Б—Б—Г —В–µ–ї–∞. –Ь–µ—В—Д–Њ—А–Љ–Є–љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Є –њ–Њ–ї–љ–Њ—Б—В—М—О –≤—Л–≤–Њ–і–Є—В—Б—П –њ–Њ—З–Ї–∞–Љ–Є –≤ –љ–µ–Є–Ј–Љ–µ–љ–µ–љ–љ–Њ–Љ –≤–Є–і–µ (–њ–µ—А–Є–Њ–і –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П 1,5–4,9 —З). –Я—А–Є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –≤—Л–і–µ–ї–Є—В–µ–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї (–Њ—Б–Њ–±–µ–љ–љ–Њ —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ) —Б–Ї–Њ—А–Њ—Б—В—М –≤—Л–≤–µ–і–µ–љ–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ —Б–љ–Є–ґ–∞–µ—В—Б—П –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Ї–ї–Є—А–µ–љ—Б–∞ –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ –Є –Љ–Њ–ґ–µ—В –≤–Њ–Ј—А–∞—Б—В–∞—В—М —А–Є—Б–Ї –ї–∞–Ї—В–∞—Ж–Є–і–Њ–Ј–∞. –Ы–µ—З–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –Є–љ–Є—Ж–Є–Є—А—Г—О—В —Б 500–850 –Љ–≥, –њ—А–Є–љ–Є–Љ–∞–µ–Љ—Л—Е –≤ —Г–ґ–Є–љ –Є–ї–Є –љ–∞ –љ–Њ—З—М. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –і–Њ–Ј–∞ –њ—А–µ–њ–∞—А–∞—В–∞ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –љ–∞ 500–850 –Љ–≥ –Ї–∞–ґ–і—Г—О 1–2 –љ–µ–і–µ–ї–Є. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ–∞—П –і–Њ–Ј–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 2550–3000 –Љ–≥/—Б—Г—В. –≤ —А–µ–ґ–Є–Љ–µ 2–3 –њ—А–Є–µ–Љ–Њ–≤. –Ю–Ї–Њ–љ—З–∞—В–µ–ї—М–љ—Л–є –∞–љ—В–Є–≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —З–µ—А–µ–Ј 3–4 –љ–µ–і–µ–ї–Є –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П (—В–∞–±–ї. 2).
–І–∞—Б—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ф–2 –љ–µ –њ–µ—А–µ–љ–Њ—Б—П—В –Љ–µ—В—Д–Њ—А–Љ–Є–љ –≤ —Б–≤—П–Ј–Є —Б –њ–Њ–±–Њ—З–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞ (–і–Є–∞—А–µ—П, –Љ–µ—В–µ–Њ—А–Є–Ј–Љ, –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л–є –і–Є—Б–Ї–Њ–Љ—Д–Њ—А—В). –≠—В–Є –і–Њ-–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–µ —Н—Д—Д–µ–Ї—В—Л, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, —Б–≤—П–Ј–∞–љ—Л —Б –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Є –ї–Њ–Ї–∞–ї—М–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –≤—Л—А–∞–±–Њ—В–Ї–Є –ї–∞–Ї—В–∞—В–∞ [3,10]. –Т–Њ –Є–Ј–±–µ–ґ–∞–љ–Є–µ —В–∞–Ї–Є—Е —П–≤–ї–µ–љ–Є–є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞ –њ–Њ—Б—В–µ–њ–µ–љ–љ–∞—П —В–Є—В—А–∞—Ж–Є—П –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞, –∞ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е –≤—А–µ–Љ–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ–Ј—Л –і–Њ –њ—А–µ–і—Л–і—Г—Й–µ–є.
–†–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–µ–њ–∞—А–∞—В –љ–µ —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –Є–љ—Б—Г–ї–Є–љ–∞ β––Ї–ї–µ—В–Ї–∞–Љ–Є [13]. –Ш–і–µ–∞–ї—М–љ—Л–є –њ–∞—Ж–Є–µ–љ—В –і–ї—П –Є–љ–Є—Ж–Є–∞—Ж–Є–Є —В–µ—А–∞–њ–Є–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ – —Н—В–Њ –±–Њ–ї—М–љ–Њ–є –°–Ф–2 —Б –Є–Ј–±—Л—В–Њ—З–љ—Л–Љ –≤–µ—Б–Њ–Љ –Є–ї–Є –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–µ–є –њ–Њ—З–µ–Ї (–Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ –Ї—А–Њ–≤–Є <133 –Љ–Љ–Њ–ї—М/–ї —Г –Љ—Г–ґ—З–Є–љ –Є <124 –Љ–Љ–Њ–ї—М/–ї —Г –ґ–µ–љ—Й–Є–љ). –Ь–µ—В—Д–Њ—А–Љ–Є–љ —Б–ї–µ–і—Г–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —Б –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М—О —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ —Г –Ї–Њ—В–Њ—А—Л—Е –Њ–±–Љ–∞–љ—З–Є–≤–Њ –љ–Є–Ј–Ї–∞ –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ї–Њ—В–Њ—А–Њ–≥–Њ –љ–µ –Њ—В—А–∞–ґ–∞–µ—В –Є—Б—В–Є–љ–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П —Б–Ї–Њ—А–Њ—Б—В–Є –≥–ї–Њ–Љ–µ—А—Г–ї—П—А–љ–Њ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є. –Ю—В—Б—Г—В—Б—В–≤–Є–µ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–є –≥–ї–Є–Ї–µ–Љ–Є–Є –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ –љ–∞—А—Г—И–µ–љ–Є–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є β––Ї–ї–µ—В–Њ–Ї, –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–Љ –і–µ—Д–Є—Ж–Є—В–µ –Є–љ—Б—Г–ї–Є–љ–∞ –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞ —Б –і—А—Г–≥–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П. –Я—А–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ –љ–∞–Ј–љ–∞—З–∞—О—В —Б –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–Љ–Є —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л, –Љ–µ–≥–ї–Є—В–Є–љ–Є–і–∞–Љ–Є, —В–Є–∞–Ј–Њ–ї–Є–і–Є–љ–і–Є–Њ–љ–∞–Љ–Є –Є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ, —З—В–Њ –њ–Њ–≤—Л—И–∞–µ—В —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–ї—Г—З—И–∞–µ—В –≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є–є –Ї–Њ–љ—В—А–Њ–ї—М. –Ь–µ—В—Д–Њ—А–Љ–Є–љ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л —П–≤–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є —Д–Њ—А–Љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Ї–Њ—В–Њ—А–∞—П –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –Ї–ї–Є–љ–Є—Ж–Є—Б—В–∞–Љ–Є —Г–ґ–µ –Љ–љ–Њ–≥–Њ –ї–µ—В –Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ–±–Є—В—М—Б—П —Б–љ–Є–ґ–µ–љ–Є—П –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л [24]. –¶–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л –љ–µ –њ–Њ–і–ї–µ–ґ–Є—В —Б–Њ–Љ–љ–µ–љ–Є—О, –Є–±–Њ –≤–∞–ґ–љ–µ–є—И–Є–Љ –Ј–≤–µ–љ–Њ–Љ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –°–Ф–2 —П–≤–ї—П–µ—В—Б—П —Б–µ–Ї—А–µ—В–Њ—А–љ—Л–є –і–µ—Д–µ–Ї—В b––Ї–ї–µ—В–Ї–Є. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –њ–Њ—З—В–Є –њ–Њ—Б—В–Њ—П–љ–љ—Л–є –њ—А–Є–Ј–љ–∞–Ї –°–Ф–2, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞. –Я–Њ –Љ–љ–µ–љ–Є—О –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є [25], –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —В–µ—А–∞–њ–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ –Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л —В–∞–Ї–ґ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞, –Ї–∞–Ї –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —В–µ—А–∞–њ–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ–Љ –Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л –Є–ї–Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–ї–Њ—Е–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –Њ—В –њ—А–µ–і—И–µ—Б—В–≤–Њ–≤–∞–≤—И–µ–є —В–µ—А–∞–њ–Є–Є. –≠—В–Њ —Е–Њ—А–Њ—И–Њ –≤–Є–і–љ–Њ –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –њ–µ—А–µ–Ї—А–µ—Б—В–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П 50 –±–Њ–ї—М–љ—Л—Е –°–Ф–2 —Б –≤—В–Њ—А–Є—З–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М—О –Ї –њ—А–µ–њ–∞—А–∞—В–∞–Љ —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л [26], –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 2 –≥—А—Г–њ–њ—Л. –Я–∞—Ж–Є–µ–љ—В–∞–Љ –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ—Л –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –±—Л–ї –љ–∞–Ј–љ–∞—З–µ–љ –Љ–µ—В—Д–Њ—А–Љ–Є–љ —В—А–Є —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є, –∞ –±–Њ–ї—М–љ—Л–Љ –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ—Л –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –±—Л–ї–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Њ –≤–µ—З–µ—А–љ–µ–µ –≤–≤–µ–і–µ–љ–Є–µ –Є–љ—Б—Г–ї–Є–љ–∞ NPH. –Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –Ї–Њ–љ—Б—В–∞—В–Є—А–Њ–≤–∞–љ–Њ –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≥–ї–Є–Ї–µ–Љ–Є–Є –њ—А–Є –Њ–±–Њ–Є—Е –≤–∞—А–Є–∞–љ—В–∞—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є. –£—А–Њ–≤–µ–љ—М —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–Ј–Є–ї—Б—П –њ—А–Є –њ—А–Є–µ–Љ–µ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ (p<0,005), –љ–Њ –љ–µ –љ–∞ —Д–Њ–љ–µ –Є–љ—Б—Г–ї–Є–љ–Њ—В–µ—А–∞–њ–Є–Є. –С—Л–ї–Њ –Ј–∞–Љ–µ—З–µ–љ–Њ, —З—В–Њ –≤—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –Є–љ—Б—Г–ї–Є–љ–Њ—В–µ—А–∞–њ–Є–Є –њ—А–µ–і–њ–Њ—З–Є—В–∞–ї–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞. –Я–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ –љ–∞–±–ї—О–і–µ–љ–Є–є –Њ —В–Њ–Љ, —З—В–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —В–µ—А–∞–њ–Є—П —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ–Њ–є –Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ –Є–Љ–µ–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –њ–µ—А–µ–і –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Є —Б–Њ–Ј–і–∞–љ–Є—О –Њ—Д–Є—Ж–Є–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л –њ—А–µ–њ–∞—А–∞—В–∞, —Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ –Њ–±–∞ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞. –Я–Њ–і–Њ–±–љ—Л–Љ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ —П–≤–ї—П–µ—В—Б—П –У–ї—О–Ї–Њ–≤–∞–љ—Б, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–Є–є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–є –њ–Њ–і—Е–Њ–і –Ї –ї–µ—З–µ–љ–Є—О –°–Ф–2. –У–ї—О–Ї–Њ–≤–∞–љ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ—Г—О –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ 500 –Љ–≥ –Є –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ 2,5 –Љ–≥ –Є–ї–Є 5 –Љ–≥ –≤ –Њ–і–љ–Њ–є —В–∞–±–ї–µ—В–Ї–µ (—А–Є—Б. 1).
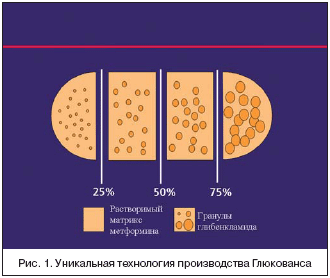
–Т –Њ—В–ї–Є—З–Є–µ –Њ—В –њ–Њ—Е–Њ–ґ–µ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –≤ –і—А—Г–≥–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–µ –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і –≤ –У–ї—О–Ї–Њ–≤–∞–љ—Б–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –≤ –≤–Є–і–µ –Љ–Є–Ї—А–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Л, –∞ —Г–љ–Є–Ї–∞–ї—М–љ–∞—П —Б–Є—Б—В–µ–Љ–∞ –і–Њ—Б—В–∞–≤–Ї–Є —З–∞—Б—В–Є—Ж –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ —А–∞–Ј–љ–Њ–≥–Њ —А–∞–Ј–Љ–µ—А–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –±–Њ–ї–µ–µ –±—Л—Б—В—А–Њ–Љ—Г –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—О –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ –њ–Њ—Б–ї–µ –µ–і—Л. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–Є–Ї –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ –≤ –њ–ї–∞–Ј–Љ–µ –љ–∞—Б—В—Г–њ–∞–µ—В —А–∞–љ—М—И–µ, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Є–љ–Є–Љ–∞—В—М –њ—А–µ–њ–∞—А–∞—В –≤–Љ–µ—Б—В–µ —Б –µ–і–Њ–є (—А–Є—Б. 2).
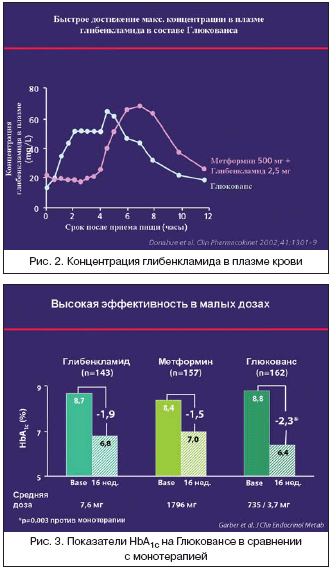
–°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –У–ї—О–Ї–Њ–≤–∞–љ—Б–∞ –Є–і–µ–љ—В–Є—З–љ–∞ —Б–≤–Њ–±–Њ–і–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Њ–±–Њ–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤, –∞ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–∞ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –љ–µ–Є–Ј–Љ–µ–љ–љ–∞, –Є –ї–Є—И—М –њ–Є–Ї –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ –љ–∞—Б—В—Г–њ–∞–µ—В —А–∞–љ—М—И–µ, —З—В–Њ, –њ–Њ —Б—Г—В–Є, —П–≤–ї—П–µ—В—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–∞. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В —Б–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤, –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є –Є–ї–Є –ї—О–±–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–µ–є –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–Є—Е —Б—А–µ–і—Б—В–≤ (—А–Є—Б. 3).
–Э–∞ —А–Є—Б—Г–љ–Ї–µ 3 –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Љ–µ–љ—М—И–Є–µ –і–Њ–Ј—Л –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –≤ –њ—А–µ–њ–∞—А–∞—В–µ –У–ї—О–Ї–Њ–≤–∞–љ—Б –і–Њ—Б—В–Є–≥–љ—Г—В–∞ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—О –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є —Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, —З–µ–Љ –њ—А–Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ –Є –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–Њ–Љ.
–Ґ–∞–Ї–Є–µ –Љ–∞–ї—Л–µ –і–Њ–Ј—Л –њ–Њ–Ј–≤–Њ–ї—П—О—В –Њ–±–µ—Б–њ–µ—З–Є—В—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є. –С–ї–∞–≥–Њ–і–∞—А—П –љ–Є–Ј–Ї–Њ–є –і–Њ–Ј–µ –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞ –≤ –У–ї—О–Ї–Њ–≤–∞–љ—Б–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В—Б—П:
• –Љ–µ–љ—М—И–µ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ β––Ї–ї–µ—В–Ї–Є
• –љ–Є–Ј–Ї–Є–є —А–Є—Б–Ї –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–є
• –љ–Є–Ј–Ї–∞—П —З–∞—Б—В–Њ—В–∞ –Њ—Б—В—А—Л—Е –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —В–µ—А–∞–њ–Є–Є –°–Ф–2
–Э–µ –Љ–µ–љ–µ–µ –≤–∞–ґ–љ–Њ —Г—З–µ—Б—В—М, —З—В–Њ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–∞ —Н—В–Њ —Г–і–Њ–±–љ–∞—П —Д–Њ—А–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞, –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—Й–∞—П –љ–∞ –Њ–±–∞ –і–µ—Д–µ–Ї—В–∞ –°–Ф–2 –Њ–і–љ–Њ–є —В–∞–±–ї–µ—В–Ї–Њ–є –Є –Є–Љ–µ—О—Й–∞—П —Г–ї—Г—З—И–µ–љ–љ—Г—О –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М.
–Я–Њ–Ї–∞–Ј–∞–љ–Є—П –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –У–ї—О–Ї–Њ–≤–∞–љ—Б–∞ –Љ–Њ–≥—Г—В –±—Л—В—М –њ–µ—А–≤–Є—З–љ—Л–Љ–Є, —В–∞–Ї –Є –≤—В–Њ—А–Є—З–љ—Л–Љ–Є.
–Я–µ—А–≤–Є—З–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –У–ї—О–Ї–Њ–≤–∞–љ—Б–∞:
• –њ—А–Є –њ–Њ–Ј–і–љ–µ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –і–Є–∞–±–µ—В–∞
• –њ—А–Є –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є –і–Є–∞–±–µ—В–∞
• –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –Я–°–°–Я
–Т—В–Њ—А–Є—З–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –У–ї—О–Ї–Њ–≤–∞–љ—Б–∞:
• –њ—А–Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤—Л—Б—И–Є—Е –і–Њ–Ј –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є
• —Г –ї–Є—Ж —Б —Б–Њ—Е—А–∞–љ–µ–љ–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–µ–є –Є–љ—Б—Г–ї–Є–љ–∞ –њ—А–Є –≤—В–Њ—А–Є—З–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –њ—А–µ–њ–∞—А–∞—В–∞–Љ —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л
• –њ—А–Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–Є –Ї –≤—Л—Б—И–Є–Љ –і–Њ–Ј–∞–Љ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –≤ –≤–Є–і–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–∞–љ–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –±–Њ–ї–µ–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ—Б—В–Є—З—М –ї—Г—З—И–µ–≥–Њ –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –≥–ї–Є–Ї–µ–Љ–Є–Є –Є —Б–љ–Є–Ј–Є—В—М —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –°–Ф–2. –Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ —Б –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–Љ–Є —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ–Њ–≤—Л—И–∞–µ—В –Њ–±—Й—Г—О —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–ї—Г—З—И–∞–µ—В –Ї–Њ–љ—В—А–Њ–ї—М –≥–ї–Є–Ї–µ–Љ–Є–Є, –∞ —Б –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ—А–µ–њ–∞—А–∞—В—Л –≤ –Њ–і–љ–Њ–є —В–∞–±–ї–µ—В–Ї–µ –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В –≤ –Љ–µ–љ—М—И–µ–є –і–Њ–Ј–µ, –љ–Њ —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О.
–Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є —Б—Е–µ–Љ–Њ–є —П–≤–ї—П–µ—В—Б—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –Є –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–ї—Г—З—И–∞–µ—В—Б—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї —Б–µ–Ї—А–µ—В–Є—А—Г–µ–Љ–Њ–Љ—Г –Є–љ—Б—Г–ї–Є–љ—Г, –±–µ–Ј —А–Є—Б–Ї–∞ –њ—А–Є–±–∞–≤–Ї–Є –Љ–∞—Б—Б—Л —В–µ–ї–∞.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. California Healthcare Foundation/ American Geriatrics Society Panel on Improving Care for Elders with Diabetes. Guidelines for Improving the care of the older person with diabetes mellitus // J Am Geriatr Soc.–2003; 51:S265–280.
2. Castaneda C., Layne J.E., Munoz–Orians L. et al. A randomized controlled trial of resistance exercise training to improve glycemic control in older adults with type 2 diabetes. // Diabetes Care.–2002; 25(12):2335–2341.
3. Davidson M.B., Peters A.L. An overview of metformin in the treatment of type 2 diabetes mellitus // Am. J Med –1997; 102: 99–110.
4. DeFronzo R.A. Pharmacologic therapy for type 2 diabetes mellitus // Ann Intern. Med. –1999; 131: 281–303.
5. Droin P. Diamicron MR once daily is effective and well tolerated in type 2 diabetes: double–blind, randomized, multinational study. // J Diabetes Complications. – 2000; 14(4): 185–191.
6. Festa A., Williams K., Tracy R.S. Progression of Plasminogen Activator Inhibitor–1 and Fibrinogen Levels in Relation to Incident in type Diabetes // Circulation .–2006; 113(14):1753–9.
7. Holstein A., Plaschke F., Egberts E.H. Lower incidence of severe hypoglycaemia in patients with type 2 diabetes treated with glimepiride versus glibenclamid. // Diabetes Metab Res Rev.–2001; 17(6): 467–473.
8. Gregori F., Ambrosi F., Manfrini S. et al. Poorly controlled elderly Type 2 diabetic patients: the effects of increasing sulphonylurea dosages or adding metformin. // Diabet Med. –1999; 16(12): 1016–1024.
9. Kimmel B., Inzucchi E.M. Oral Agents for Type 2 Diabetes: An Update // Clin. Diabetes. – 2005; 23(2): 64 – 76.
10. Kirpichnikov D., McFarlane S.I., Sowers J.R, Metformin:An Update //Ann Intern Med 2002; 137: 25 –33
11. Klip A., Leiter L.A Cellular mechanism of action of metformin // Diabetes Care 1990; 13 (6): 696–704
12. Kuusisto J., Mykkanen J., Pyorala K., Laakso M. Non– insulin dependent diabetes and its metabolic control are important predictors of stroke in elderly subjects. // Stroke. – 1994; 25(6): 1157–1164
13. Matthaei S., Hamann A., Klein H.H., Benecke H. et al. Association of Metformin‘s effect to increase insulin–stimulated glucose transport with potentiation of insulin–induced translocation of glucose transporters from intracellular pool to plasma membrane in rat adipocytes // Diabetes. –1999; 40(7): 850–857
14. McFarlane S.I., Banerij M., Sowers J.R. Insulin resistance and cardiovascular disease. // J Clin Endocrinol Metab. – 2001; 86: 713–8
15. Nathan D.M.,Meigs J, Singer D.E. The epidemiology of cardiovascular disease in type 2 diabetes mellitus: how sweet it is... or is it?// Lancet. – 1997; 350 (suppl 1): 4–9.
16. Naor M., Steingruber H.J., Westhoff K. et al. Congitive function in elderly non– insulin–dependent diabetic patients before and after inpatient treatment for metabolic control. // J Diabetes Complications. – 1997; 11(1): 40–46.
17. Patane G., Piro S., Rabuazzo A.M. , Anello M. et al. Metformin restores insulin secretion altered by chronic exposure to free fatty acids or high glucose: a direct metformin effect on pancreatic beta–cells // Diabetes. –2001; 49(5): 735–740
18. Olson D.E., Norris. Diabetes in older adults. Overview of AGS guidelines for the treatment of diabetes mellitus in geriatric population/ //Geriatrics.– 2004; 59(4): 18–24.
19. Rosenstock J. Management of type 2 diabetes mellitus in the elderly: special considerations. // Drugs Aging. – 2001; 18(1): 31–44.
20. Ruigomez A., Rodrigues L.A. Presence of diabetes related complication at the time of NIDDM diagnosis: an important prognostic factor // Eur. J. Epidemiol. . – 1998; 14(15): 439 –445.
21. Ramachandran A, Snehalatha C. Epidemiology of heart disease in type 2 diabetes // Medicographia, 2007; vol.29 No.3,207–212.
22. Ubink–Veltman L.J., Bilo H.J., Groenier K.H. et al. Prevalens, incidence and mortality of type 2 diabetes mellitus revisited: a prospective populacion–based study in the Netterlands (ZODIAC–1).// Eur JEpidemiol.–2003;18(8):793–800.
23. Wolffenbuttel B.H., Sels J.P., Rondas–Colbers G.J. et al. Comparison of different insulin regimens in elderly patients with NIDDM. // Diabetes Care.–1996; 19(12):1326–1332
24. Edelman S.V, Henry R.R. Diagnosis and management of type II diabetes,1998, PCI, chapter 7: Oral agens.
25. Charles M, Clark J. Oral therapy in type 2 diabetes: Pharmacological properties and clinical use of currently available agents. Diabetes spectrum, 1998, 211–221.
26. Trischitta V, Italia S, Raimondo M, Guardabasso V. et al. Efficacy of combined treatments in NIDDM patients with secondary failure to sulphonylureas. Is it predictable? J Endocrinol Invest, 1998, 21(11), 744–747.












