Важной особенностью ожирения у мужчин является не только тяжесть заболевания, ведущего к снижению продолжительности жизни из–за развития тяжелых сопутствующих заболеваний, но и изменения метаболизма половых гормонов, влияющих на половую функцию [15,29,31].
Патогенетические особенности
ожирения и метаболизма
жировой ткани
Ожирением является избыточное отложение жира в организме, как правило, приводящее к увеличению массы тела и ведущее не только к инвалидизации, но и к снижению продолжительности жизни из–за развития тяжелых сопутствующих заболеваний.
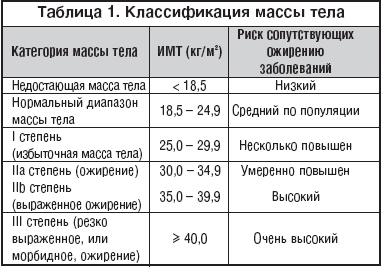
Для характеристики массы тела наибольшее распространение в настоящее время получил индекс массы тела (ИМТ), который представляет собой отношение массы тела, выраженной в килограммах, к квадрату роста, выраженного в метрах [75]. Классификация Международной группы по изучению ожирения (International Obesity Task Force – IOTF) недостаточного, избыточного веса и ожирения в зависимости от ИМТ представлена в таблице 1.
Результаты проспективных исследований свидетельствуют о том, что у людей, имеющих значения ИМТ в пределах 19–24 кг/м2 для женщин и 20–25 кг/м2 для мужчин, т.е. нормальные показатели массы тела, наблюдается наибольшая продолжительность жизни [80].
В последние годы в исследованиях в качестве индикаторов риска патологии, связанной с ожирением, кроме ИМТ, используются показатели, характеризующие распределение жира, – индекс «талия/бедро», окружность талии, кожно–жировые складки лопатки и живота. Ряд данных свидетельствует о том, что распределение жира – это более достоверный показатель риска развития большинства патологических изменений, связанных с ожирением, в том числе включая риск повышенной смертности [21,74].
Распределение жира в организме не является равномерным. Преимущественное отложение жира в области бедер и ягодиц более характерно для женщин, поэтому оно получило название «гиноидное», или ожирение нижнего типа. Избыточное накопление жира в области туловища и особенно живота (центральное, или «верхнее», или абдоминальное ожирение) с его преимущественным отложением в брюшной полости более типично для мужчин, вследствие чего его часто называют «андроидным» [9].
A.H. Kissebah и P. Bjorntorp показали, что при одинаковом показателе ИМТ абдоминальное ожирение сопровождается более высоким риском развития сопутствующих заболеваний, чем периферическое ожирение [21,52]. Именно поэтому выраженность осложнений ожирения является более высокой у мужчин, чем у женщин. По данным некоторых исследователей, зависимость осложнений ожирения от распределения жира выражена сильнее, чем зависимость от степени ожирения [20,33].
Механизмы развития ожирения являются предметом многочисленных научных и экспериментальных исследований [41,45,57]. В последнее время большое значение придают генетическим факторам в развитии ожирения [22,23,55]. При проведении экспериментальных исследований были обнаружены мутации в генах, с одной стороны, приводящие к нарушению поведенческих и гормонально–метаболических реакций, связанных с приемом пищи, с другой стороны, изменяющие механизм регуляции расхода энергии. Установлены гены, кодирующие белок–лептин (регулятор аппетита), рецептор к лептину (3 – адренорецептор, принимающий участие в регуляции термогенеза), a–фактор некроза опухоли. Предполагается, что для поддержания постоянной массы тела в гипоталамусе вырабатывается нейропептид Y, который стимулирует поведенческие реакции, направленные на прием пищи, повышает уровень инсулина в крови путем активации системы n. vagus и секрецию кортизола. Конечным эффектом действия нейропептида Y является накопление жировой ткани [45]. Было выдвинуто предположение, что лептин регулирует уровень нейропептида Y и вызванные им поведенческие, гормональные и метаболические изменения путем взаимодействия в гипоталамусе со специфическими рецепторами [41,57,71].
У лиц с общим ожирением наблюдаются высокие концентрации нейропептида Y в гипоталамусе вследствие возможной неспособности лептина блокировать его синтез из–за дисфункции лептиновых рецепторов либо из–за дефектной структуры самого лептина [28,57,62]. Состояние лептинорезистентности сопровождается повышением концентрации лептина, инсулина, кортизола и гиперфагией, что приводит к дальнейшему увеличению массы жировой ткани [41].
Жировая ткань имеет сложную организацию, в которой адипоциты взаимодействуют с кровеносными сосудами, нервами, что обусловливает их высокую гормонально–метаболическую активность [14]. В жировой клетке происходят следующие циклы метаболических реакций:
– цикл синтеза жирных кислот и фосфолипидов;
– цикл окисления жирных кислот;
– действие специфических липаз;
– действие ферментов, принимающих участие в метаболизме фосфолипидов;
– цикл Эмбдена–Мейерхофа–Парнаса;
– пентозный цикл;
– цикл Кребса;
– уридиновый цикл, являющийся циклом синтеза гликогена;
– действие ферментов синтеза белков;
– ароматизация половых гормонов (конверсия тестостерона в эстрадиол).
Кроме основной функции накопления жира, адипоциты жировой ткани секретируют ряд пептидов, включая лептин, a–фактор некроза опухоли, ангиотензиноген, адипсин и активатор ингибитора плазминогена [26].
Жировая ткань играет важную роль в регуляции фосфорно–кальциевого обмена (начальные этапы образования витамина D) и метаболизме половых стероидов (ароматаза жировых клеток способствует превращению надпочечниковых андрогенов в эстрогены)[11].
Являясь гормонально–активным органом, жировая ткань сама находится под воздействием различных гормонов [14], важное место среди которых занимает инсулин [6]. Известно, что повышение концентрации инсулина активирует липопротеидлипазу, которая стимулирует поглощение свободных жирных кислот (СЖК) из липопротеидов очень низкой плотности (ЛПОНП), содержащихся в крови; увеличивает транспорт глюкозы и ускоряет гликогенез; возрастает превращение глюкозо–6–фосфата по всем метаболическим путям: окисление в СО2, синтез жирных кислот и окисление по пентозному пути, который поставляет восстановительные эквиваленты в форме НАДФН. Образуется большое количество a–глицерола, необходимого для синтеза триглицеридов (ТГ), в котором используются жирные кислоты, как поступающие из ЛПОНП, так и новообразующиеся в клетке (т.е. липогенез). Одновременно с этими процессами инсулином ингибируется гормоночувствительная липаза, которая катализирует гидролиз накопленных ТГ и высвобождение жирных кислот (т.е. липолиз). В результате эти вещества накапливаются в адипоците [7]. На фоне гиперинсулинемии наблюдается увеличение содержания ТГ, ЛПОНП, холестерина липопротеидов низкой плотности (ХС ЛПНП), СЖК и снижение уровня холестерина липопротеидов высокой плотности ХС ЛПВП [36]. Обнаружена прямая корреляция между содержанием уровня инсулина и уровнем ТГ и обратная связь концентрации инсулина и величины ХС ЛПВП [43].
Различные адипоциты реагируют на инсулин по разному. Исследователи выделили особую разновидность адипоцитов, расположенных внутри брюшной полости и отличающихся большей метаболической активностью вследствие низкой активности липопротеидлипазы, высокой чувствительности к b–липолитической стимуляции адреналином, высокой плотности кортикостероидных и андрогенных рецепторов, низкой плотности рецепторов к инсулину в сравнении с бедренными адипоцитами [59,72,73]. Жировые клетки, расположенные в области бедер, более чувствительны к a–стимуляции, чем абдоминальные; a–стимуляция (подобно инсулину) дает антилиполитический эффект, т.е. способствует задержке ТГ в жировых клетках [73].
Таким образом, гиперинсулинемия может способствовать нарушению толерантности к глюкозе, развитию ожирения, артериальной гипертонии и сахарного диабета второго типа [38]. У больных с повышенным артериальным давлением при избыточной массе тела отмечается значимое снижение чувствительности тканей к инсулину по сравнению с больными ожирением, имеющими нормальное артериальное давление. При этом наблюдается прямая корреляция между величиной инсулинорезистентности и артериальным давлением [49]. Также при абдоминальном ожирении чаще встречается нарушение толерантности к углеводам и сахарный диабет второго типа, что подтверждает патогенетическую значимость инсулинорезистентности при ожирении [51]. Кроме того, экспериментальные исследования свидетельствуют об отчетливом нарушении функции инсулярного аппарата при ожирении [67]. Имеются исследования, показывающие, что при уменьшении избыточной массы тела при ожирении уменьшается концентрация инсулина в крови, восстанавливается чувствительность тканей к углеводам, нормализуется спектр липидов плазмы и артериальное давление [2].
Однако не все исследователи выявили взаимосвязь между базальным уровнем инсулина и ожирением [8], хотя в большинстве исследований корреляции между степенью абдоминального ожирения и базальной гиперинсулинемией были очевидны [13]. В одном из исследований продемонстрировано, что секреция инсулина непосредственно связана со степенью ожирения [1]. Также показано, что гиперинсулинемия может являться стимулом продукции жировыми клетками лептина [45]. Хотя предполагается, что инсулинорезистентность первична и генетически детерминирована [32,35,39], известно, что избыточная масса тела, в свою очередь, может способствовать развитию инсулинорезистентности и компенсаторной гиперинсулинемии [50].
Поскольку при ожирении регистрируется повышенный уровень СЖК в крови, предполагается, что в цитоплазме адипоцитов не только увеличены размеры капель ТГ, но и повышена концентрация СЖК или Ацил–КоА [2]. Это приводит к ингибированию фермента липогенеза, глюкозо–6–фосфатдегидрогеназы, а также синтеза и транспорта цитрата в митохондриях [76]. В результате происходит торможение тех процессов метаболизма (липогенез, превращение глюкозо–6–фосфата), которые активируют инсулин, и таким образом жировая клетка может приобретать инсулинорезистентность. В ряде исследований продемонстрировано, что и гиперинсулинемия, и инсулинорезистентность более выражены при абдоминальном ожирении, чем при глютеофеморальном [40,56,63,68]. Согласно точке зрения исследователей, гиперинсулинемия при абдоминальном ожирении обусловлена снижением деградации инсулина в печени [70]. Авторы показали обратную корреляцию между клиренсом инсулина и величиной Т/Б. Инсулинорезистентность, по их мнению, развивается вторично, как реакция тканей на гиперинсулинемию. Таким образом, при ожирении возникает так называемый «порочный круг» гормонально–метаболических изменений, способствующих поддержанию и прогрессированию ожирения. Кроме того, в настоящее время считается доказанным, что наряду с вышеописанными механизмами большое влияние на адипоциты оказывают мужские половые гормоны – андрогены [11].
Особенности метаболизма половых гормонов при ожирении
У мужчин с ожирением практически всегда выявляются нарушения секреции, инактивации и связывания с белками плазмы половых гормонов [17]. В последние годы большое внимание уделяется изучению содержания тестостерона в крови больных ожирением. Одни авторы обнаруживают низкий базальный уровень тестостерона в плазме при наличии ожирения [18]. По мнению других, уровень тестостерона не зависит от степени выраженности ожирения [76]. Также в некоторых работах отмечается положительная связь между содержанием тестостерона и отношением Т/Б у мужчин [4]. По мнению Peiris A.N. и соавт., большое влияние на увеличение висцеральных адипоцитов и количество рецепторов к ИРИ оказывает сниженная андрогенная активность плазмы у мужчин. Этими исследователями найдена отрицательная корреляция между ИРИ и свободным тестостероном [70].
Тестостерон оказывает влияние на инсулинорезистентность через жиромобилизующий эффект – выход из жирового депо СЖК [20]. Экспериментальные данные показывают, что введение тестостерона крысам приводит к увеличению СЖК [25].
Существует точка зрения, что снижение концентрации тестостерона при висцеральном ожирении обусловлено возрастными изменениями данного гормона [79]. В настоящее время общепризнано, что у мужчин с возрастом постепенно снижается уровень половых гормонов (в первую очередь тестостерона), начало этого процесса приходится на возраст 30–40 лет. Отмечено, что после 30–40 лет уровень тестостерона снижается примерно на 1–2% в год [37]. Известно, что основное количество (более 98%) тестостерона циркулирует в плазме в связанном состоянии: до 58–60% – в связи с альбумином, около 40% – в связи с глобулином, связывающим половые стероиды (ГСПС), который также называют тестостерон–эстрадиолсвязывающий глобулин, и только около 1–2% тестостерона находится в несвязанной, свободной форме.
Биологически активной, или «биодоступной» фракцией тестостерона является свободно циркулирующая фракция и часть гормона, находящаяся в слабой связи с альбумином, в то время как часть тестостерона, связанная с ГСПС, не проявляет своей биологической активности. Возрастное снижение содержания общего тестостерона происходит одновременно с возрастным увеличением концентрации ГСПС [37]. Возрастное увеличение секреции ГСПС ведет к незначительному снижению содержания общего тестостерона в сыворотке крови, в то время как в результате снижения секреции тестостерона в яичках, снижается содержание биологически активного и свободного тестостерона, что усиливает андрогенодефицит в организме. Так, по данным Массачусетского исследования пожилых мужчин, уровень биодоступного тестостерона снижался уже с 30–35 лет со скоростью около 2–3% в год, а общего – с 50–55 лет на 0,8–1,6% в год [37].
Однако остается дискуссионным вопрос – является ли нарушение секреции тестостерона первичным или вторичным по отношению к ожирению? По поводу этого имеются противоречивые мнения. Одни авторы считают гормональные нарушения вторичными, так как снижение веса тела приводит к нормализации показателей тестостерона [69]. По мнению других, первичность гормональных изменений подтверждает экзогенное введение тестостерона: у мужчин при этом значительно снижается количество висцерального жира [60]. Как показали плацебо–контролируемые исследования, коррекция гипогонадизма у мужчин с ожирением путем назначения препаратов тестостерона ведет к снижению ИМТ за счет уменьшения количества висцерального жира, уменьшения инсулинорезистентности, снижения диастолического давления, улучшения липидного профиля [48,60]. Исследования, проведенные у мужчин с ожирением старше 45 лет, показали улучшение чувствительности к инсулину, гликемии натощак и диастолического АД во время терапии андрогенами [60,61]. В ряде исследований низкое содержание тестостерона являлось фактором риска развития сахарного диабета 2 типа и атеросклероза [42,44,46,77].
По мере накопления жировой ткани физиологические особенности адипоцитов, сопряженные с гормональными изменениями в виде гиперинсулинемии, ускоренной продукции кортизола, снижением уровней тестостерона, способствуют определенным нарушениям липидного обмена в печени и развитию дислипопротеидемии, что в дальнейшем может приводить к манифестации атеросклеротических сердечно–сосудистых заболеваний [24,27]. Показано, что дислипидемия, прогрессирование атеросклероза и ишемической болезни сердца (ИБС) более характерны для больных с андроидным типом ожирения [63]. Нарушения в обмене липидов и липопротеидов крови у этих пациентов выражаются в повышении уровня ТГ, особенно фракции, связанной с ЛПОНП, в повышении уровня холестерина, связанного с липопротеидами низкой плотности, и в снижении холестерина, связанного с ЛПВП [5,12].
Кроме вышеописанных метаболических эффектов тестостерона при ожирении, в ряде исследований продемонстрирована нормализация показателей ЛГ наряду с уменьшением гиперинсулинемии при снижении веса у больных с ожирением [54]. Нарушение секреции ЛГ приводит к изменению секреции андрогенов, в свою очередь изменение секреции тестостерона влияет на содержание иммунореактивного инсулина посредством повышения инсулинорезистентности. Доказано, что гипотестостеронемия является мощным стимулирующим фактором роста висцеральных адипоцитов [30,72]. Таким образом, гипогонадизм у мужчин с ожирением является важным фактором поддержания и прогрессирования ожирения. Поскольку тестостерон является основным анаболическим гормоном, при его дефиците значительно снижается физическая активность, роль которой в снижение веса очень велика [11].
Кроме того, полагают, что причиной гипогонадизма у тучных пациентов является абдоминальный тип ожирения. Ароматаза избыточной жировой ткани в повышенных количествах превращает андрогены (тестостерон и андростендион) в эстрогены (E1 и E2 соответственно), которые подавляют (по амплитуде и частоте) секрецию, как гонадотропин рилизинг–гормона, так и ЛГ, что, в конечном счете, проявляется снижением уровня тестостерона в крови, т.е. вторичным гипогонадизмом [10]. Данное расстройство часто вызывает нарушения половой функции у мужчин, значительно снижающее качество их жизни.
Важность ожирения, как одного из ведущих факторов риска развития гипогонадизма и нарушений половой функции, подтверждена в Массачусетском исследовании старения мужчин [37]. Показано, что более 30% больных ожирением страдают эректильной дисфункцией (ЭД) [58].
Поскольку фактором риска ЭД у больных ожирением в первую очередь являются гормональные и сосудистые нарушения, развивающиеся при артериальной гипертензии, ЭД при ожирении является органической (преимущественно эндокринной) [34]. В качестве ведущей причины эндокринной ЭД традиционно признается дефицит тестостерона, а также гиперпролактинемия, реже – гипо– и гипертиреоз [65]. У пациентов с низким уровнем тестостерона в крови количество ночных эрекций уменьшается [66]. Введение тестостерона мужчинам, страдающим гипогонадизмом, увеличивает частоту ночных эрекций, усиливает половую мотивацию и сексуальные фантазии [16,19].
Взаимосвязь между эрекцией и тестостероном обусловлена тем, что снижение уровня тестостерона ведет к снижению синтеза окиси азота (NO) [78], являющегося основным химическим медиатором расслабления гладкой мускулатуры пещеристых тел [37], при недостаточном расслаблении которой невозможно возникновение эрекции.
Кроме того, вышеописанная связь ожирения и андрогенодефицита с нарушениями липидного спектра крови, атеросклерозом и сосудистой патологией ещё более осложняет проблему ЭД [53]. Атеросклероз половых и кавернозных артерий является наиболее частой органической причиной развития нарушений эрекции в общей популяции и одной из причин ЭД у больных с ожирением [64]. У ряда больных ожирением ЭД может быть обусловлена местными патологическими изменениями в кавернозных телах, которые во многом сходны с проявлениями диабетической микроангиопатии. Дополнительным фактором усугубления ЭД может быть гиперхолестеринемия, выявляемая у многих больных СД и приводящая к структурным изменениям в кавернозной ткани [47]. Следовательно, ожирение не только обусловливает нарушения метаболизма половых гормонов, но и отягощает расстройства половой функции, вызванные снижением секреции андрогенов, посредством развития вторичных сосудистых осложнений.
Таким образом, патологическая роль ожирения в формировании нарушений гормонального метаболизма является очевидной. Опыт отечественных и зарубежных исследователей по патогенезу ожирения свидетельствует о значительном прогрессе в плане выявления механизмов развития патологических процессов. Вместе с тем некоторые аспекты гормонального метаболизма и нарушений половой функции у мужчин с ожирением требуют дальнейшего изучения.
Литература
1. Абдурахманова A.M., Носовский М.И., Рахимов Н.Р., Гулямов Т.Д.Патогенетическая связь между инсулинорезистентностью, секрецией и нарушением толерантности к глюкозе у больных ожирением // Пробл. эндокринол. – 1988. – Т. 43, №2. – С. 21–24
2. Байдалин С.Д., Тритэк B.C., Югай Л.А. и др. Синтез жирных кислот в печени и жировой ткани при инсулиннезависимом сахарном диабете и наследственном ожирении у мышей // Сб. стат.: Вопросы эндокринологии. – Алма–Ата, 1989. – С. 56–57
3. Бутрова С.А. Лечение ожирения // Мат. 1–го Московского съезда эндокринологов: Современные концепции клинической эндокринологии. – М., 1997. – С. 172–177.
4. Гинзбург М.М., Козупица Г.С. Значение распределения жира при ожирении // Consilium Medicum. – 1996 – с. 30–33
5. Гинзбург М.М., Козупица Г.С. Синдром инсулинорезистентности // Пробл. эндокринол. – 1997. – Т.43, № 1. – С. 40–43
6. Дедов И.И., Мельниченко Г.А., Романцова Т.И. Патогенетические аспекты ожирения // Ожирение и метаболизм. – 2004. – №1. – с.4
7. Дворяшина И.В. Состояние липид–транспортной системы и ее гормональных регуляторов как факторов риска атеросклероза у юношей при ожирении // Дис....канд. мед. наук. – М., 1994. – 156 с
8. Доборджгинидзе Л.М., Нечаев А.С., Коннов M.B., Грацианский Н.А. Уровень инсулина в плазме крови и коронарные факторы риска сердца у больных, не страдающих сахарным диабетом.// Кардиология.– 1997.–№7.–P.23–27.
9. Ивлева А.Я., Старостина Е.Г. Ожирение – проблема медицинская, а не косметическая. М.: 2002, с.22.
10. Калинченко С.Ю., Козлов Г.И. Эректильная дисфункция у больных с сахарным диабетом. Диагностика. Дифференциальная диагностика. Лечение. – М., 2003.
11. Калинченко С.Ю. Ожирение и нарушения репродуктивной функции у мужчин /Ожирение // под ред. И.И. Дедова, Г.А. Мельниченко. – Москва, 2004.–с. 185–216.
12. Мамедов М.Н., Перова Н.В., Метельская В.А., Оганов Р.Г. Взаимосвязь абдоминального типа ожирения и синдрома инсулинорезистентности у больных артериальной гипертензией // Кардиология. – 1999.–Т.39, №9. –С.18–22
13. Соколов Е.И., Старкова Н Т., Дворяшина И.В. и др. Гиперинсулинемия у юношей с ожирением. // Рос. Мед. Журн.– 1997.–№ 3.– C.20–24.
14. Теппермен Д., Теппермен X. Физиология обмена веществ и эндокринной системы. – М.: Мир, 1989. – 653 с
15. Aversa A., Isidori A.M., De Martino M.U., Caprio M., Fabbrini E., Rocchietti–March M., Frajese G., Fabbri A. Androgens and penile erection: evidence for direct relationship between free testosterone and cavernous vasodilatation in men with erectile dysfunction.// Clin Endocrinol (Oxf).–2000.–Vol. 53.–P 517–522.
16. Bankroft J., Wu F.С. // Arch. of Sexual Behaviour. – 1983.– Vol 12. – P. 59–66
17. Bacon C.G., Mittleman M.A., Kawachi I., Giovannucci E., Glasser D.B., Rimm E.B.// Sexual Function in Men Older Than 50 Years of Age: Results from the Health Professionals Follow–up Study// Ann Intern Med.–2003.–Vol. 139.–P. 161 – 168.
18. Benet A.E., Melman A. The epidemiology of erectile dysfunction.// A. J.Clin. North. Am. – 1995.–Vol. 22, N. 4.–P. 699–709
19. Benkert O., Witt W., Adam W. et al. // Arch. of Sexual Behaviour. – 1979. – Vol. 8. – P. 471–479
20. Bjorntrop P. // Arteriosclerosis. – 1990. – Vol. 10. – P. 493–496.
21. Bjorntorp P. Visceral fat accumulation: the missing link between psychosocial factors and cardiovascular disease? // J. Intern. Med. – 1991. –Vol. 230. –P. 195–201
22. Bouchard C., Despres J.P., Mauriege P. Genetic and non–genetic determinants of regional fat distribution // Endocr. Rev. – 1993. – Vol.14. –P.72–93
23. Bouchard C., Perusse L. Genetics of obesity // Annu. Rev. Nutr. – 1993. – Vol. 13. – P. 337–354.
24. Bradley W.A., Gianturco S.H. Triglyceride–rich lipoproteins and atherosclerosis, pathophysiological considerations // J. Intern. Med. – 1995. – Vol.19, Suppl.l. – P. S69–S75
25. Bray G.A. Health hazards associated with overweight. In: Contemporary diagnosis and management of obesity. Bray G.A. (ed.), 1998, 68–103
26. Bray G.A. Contemporary diagnosis and management of obesity./ Newton.: Handbooks in Health Care CO, 2000. – 289 p.
27. Bridley D.N. Role of glucocorticoids and fatty acids in the impairment of lipid metabolism observed in metabolic syndrome // Int. J. of Obes. – 1998. – Vol.22, Suppl. 4. – P. S4
28. Campfield L.A. Multiple facets of ob protein (Leptin) physiology: integration of central and peripheral mechanisms in the regulation of energy balance // Int. J. of Obes. – 1998.– Vol. 22, Suppl. 4. – P. S4
29. Carbone D.J., Seftel A.D. Erectile dysfunction. Diagnosis and treatment in older men.// Geriatrics.–2002.–V.57, (9)–P. 18–24.
30. Carey D.G. Abdominalobesity // Curr Opin Lipidol.–1998.–Vol.9, N.1.–P. 35–40.
31. Chung W.S., Sohn J.H., Park Y.Y. Is obesity an underlying factor in erectile dysfunction? // Eur Urol.–1999–V.36(1)–P. 68–70.
32. De Fronzo R, FerraniniE. Insulin resistance: a multyfasetid syndrome responsible for NIDDM, obesity, hypertension, dislipidemia and atherosclerotic cardiovascular disease.// Diabet Care.–1991.–Vol. 14. –P. 173–194.
33. Despres J.P., Moorjani S., Lupien P.J. et al. // Arteriosclerosis. – 1990. – Vol. 10. – P. 497–511.
34. Esposito K., Giugliano F., Di Palo C, Giugliano G., Marfella R., D’Andrea F., D’Armiento M., Giugliano D. //JAMA.– 2004– Jun 23.–Vol. 291,N. 24.–P. 2978–2984
35. Facchini F., Chen Y.D., Clinkeingbeard C. et al Insulin resistance, hyperinsulinemia and dyslipidemiain nonobese individuals with family history of hypertension.// Am. J. Hypertension.–1992.–Vol.5.–P.694– 699.
36. Ferland M., Despres J. P., Nadeau A. et al. // Int. J. Obes. – 1991. – Vol. 15. – P. 677–688.
37. Feldman H.A., Goldstein I., Hatzichristou D.G., Krane R.J., McKinlay J.B. Impotence and its medical and psychosocial correlates: results of the Massachusetts male Aging Study // J.Urology – 1994 – Vol.151 – P.54–61
38. Ferranini E., Natali A. Essential hypertension, metabolik disorders and insulin resistance. // Am Heart J.– 1991.–Vol. 121.–P.1274–1282.
39. Ferrari P., Wiedmann P., Shaw S. G. et al Altered insulin sensitivity, hyperinsulinemia and dyslipidemia in individuals with a hypertensive parent. // Am J Med– 1991.–Vol.91.–P.589–596.
40. Freedman D.S., Srinivasan S.R., Burke G.L. et al. //Amer. J. Clin. Nutr. – 1987. – Vol. 46 – P. 403–410.
41. Grundy S.M. Multifactorial causation of obesity: implications for prevention // Am. J. Clin. Nutr. – 1998. – Vol. 67, Suppl. 1. – P. 563S–572S
42. Haffner S.M., Stern M.P., Hazuda H.P. et al. // Diabet. Care – 1986. – Vol. 9. – P. 153–161.
43. Haffner S.M., Fong D., Hazuda H.P. et al. // Metabolism. – 1988. – Vol. 37. – P. 338–345.
44. Haffner S.M., Shaten J., Stern M.P., Smith G.A., Kuller L.H. Low levels of sex hormone–binding globulin and testosterone predict the development of non–insulin–dependent diabetes mellitus in men.// Am. J. Epidemiol.–1996.–Vol. 143.–P. 889–897
45. Haffner S.M., Miettinen H., Mykkanen L., Stern M.P. Leptin concentrations are associated with higher proinsulin and insulin concentrations but a lower proinsulin/insulin ratio in non–diabetic subjects // Int. J. Obes. Relat. Metab. Disord. – 1998. – Vol. 22, № 9. – P. 899–905.
46. Hak A.E., Wittemann J.C., De Jong F.H., Geerlings M.I., Hofman A., Pols H.A.P. Low levels of endogenous androgens increase the risk of atherosclerosis in elderly men: the Rotterdam study. // J. Clin. Endocrinol. Metab. –2002.–Vol. 87.–P.3632–3639
47. Hayashi К., Takamizawa К., Nakamura Т., et al. // Atherosclerosis. –1987.–Vol. 66.–P. 259–267.
48. Jockenhovel F. Male hypogonadism. UNI–MED, 2004, p.103–112.
49. Johnson D., Prudhomme D., Despres J.P. et al. // Int. J. Obes. – 1992. – Vol. 16. – P. 881–890.
50. Kaplan M. Hyperinsulinemia in diabetes and hypertension.// Clin. Diabet.–1991.–Vol. 9, N.1.–P. 2–9.
51. Kissebah A.H., Peiris A. // Diabet. Metab. Rev. – 1989. – Vol. 5, N 2. – P. 83–108.
52. Kissebah A.H., Krakower G.R. Regional adiposity and morbidity // Physiol. Rev. – 1994. – Vol.74. – P. 761–811
53. Kloner R.A., Speakman M. Erectile dysfunction and atherosclerosis. // Curr Atheroscler Rep.– 2002.–Vol.4, N.5.–P.397–401.
54. Leenen R., van der Kooy K., Seidell J.C.et al Visceral fat accumulation in relation to sex hormones in obese men and women undergoing weight loss therapy // J. Clin. Endocrinol. Metab.–1994.–Vol.78.–P.1515 – 1520.
55. Lemieux S. Genetic susceptibility to visceral obesity and related clinical implications // Int. J. of Obes. – 1997. – Vol.21, №10.– P.831– 838
56. Leonetti D.L., Bergstrom R.., Shuman W.P. et al. // Int. J. Obes. – 1991. – Vol. 15 – P. 345–357.
57. Levine A.S., Giraudo S.Q., Kotz С.М. Billington C.J. Neuropeptides: regulators of energy–, stress– and «reward»–induced feeding // Int. J. of Obes. – 2000. – Vol.24, Suppl.l – P. S6
58. Lunenfeld B. Aging male: editorial article// The aging Male.– 1998. – V.1.–P.1–7
59. Marin P., Andersson В., Ottosson M. The morphology and metabolism of intra–abdominal adipose tissue in men // Metabolism. – 1992. –Vol. 41. – P. 1242–1248
60. Marin P., Holmang S., Jonsson L., Sjostrom L., Kvist H., Holm G., Lindstedt G., Bjorntorp P. The effects of testosterone treatment on body composition and metabolism in middle–aged obese men.// Int. J. Obesity.–1992.–Vol. 16.–P. 991–997
61. Marin P., Holmang S., Gustafsson C., Jonsson L., Kvist H., Elander A., Eldh J., Sjostrom L., Holm G., Bjorntorp P. Androgen treatment of abdominally obese men. // Obes. Res. 1993.–Vol.1.–P. 245–251
62. Misra A., Garg A. Leptin, its receptor and obesity // J. Invest. Med. – 1996. – Vol. 44. – P.540–545
63. Modan M.M., Or J., Karasik A. et al. // Circulation. – 1991. – Vol. 84 – P. 1165–1175.
64. Nisen N.О., Alfthan O.S., Lindstrom B.L, et al. // Int. J. Impotence Res. –1990.–Vol.2,Suppl.2.–P. 136.
65. Noldus J., Huland H. Erectyle Disfunktion und hypogonadismus // Urologie A.– 1994.–Jr.33, NL– S.73–75
66. O’ Carrol R., Bancroft J. // Brit. J. Psychiatr. – 1984. – Vol. 145 – P. 146
67. Ortlepp J.R., Kluge R., Giesen K., et al A metabolic syndrome of hypertension, hyperinsulinaemia and hypercholesterolaemia in the New Zealand obese mouse.// Eur J Clin Invest.–2000.–Vol.30, N.3.–P.195–202.
68. Parker D.R., Weiss S.T., Troisi R. et al. // Amer. J. Clin. Nutr. – 1993. – Vol. 58, N 2. – P. 129–136.
69. Pasquali R., Casimirri F., De Iasio R., Mesini P. et al
Insulin regulates testosterone and sex hormone–binding globulin concentrations in adult normal weight and obese men // J. Clin. Endocrinol. Metab.–1995.–Vol.80.–P.654 – 658.
70. Peiris A.N., Struve M.F., Kissebah A.H. // Int. J. Obes. –1987. –Vol. 11.–P. 581–589.
71. Raben A., Astrup A. Leptin is influenced both by predisposition to obesity and diet composition // Int. J. of Obesity. – 2000. – Vol. 24, №4. – P. 450–459
72. Rissanen J., Hudson R., and Ross R. Visceral adiposity, androgens, and plasma lipids in obese men. // Metabolism.–1994.–Vol.43, N10.–P.1318–1323.
73. Sadur C.N., Eckel B. Insulin stimulation of adipose tissue lipoprotein lipase by use of euglycemic clamp technique // J. Clin. invest. – 1982. –Vol. 69. –P. 1119–1125
74. Sjostrom C.D., Hakangard A.C., Lissner L., Sjostrom L. Body compartment and subcutaneous adipose tissue distribution – risk factor patterns in obese subjects // Obesity Res. – 1995. – Vol. 3. – P.9–22
75. Solomon C.G., Manson J.E. Obesity and mortality: a review of the epidemiological data. // Am. J. Clin. Nutr. – 1997. – Vol. 66.(suppl) – P.1044S–1050S
76. Stein D.T., Esser V., Stevenson B.E. et al. Essentially of circulating fatty acids for glucosestimulated insulin secretion in the fasted rat // J. Clin. Invest. – 1996. – Vol. 97. – P.1–8
77. Stellato R.K., Feldman H.A., Hamdy N.A.T., Horton E.S., McKinlay J.B. Testosterone, sex hormone–binding globulin and the development of type 2 diabetes in middle–aged men: prospective results from the Massachusetts male aging study.// Diabetes Care.–2000.–Vol 23.–P. 490–494.
78. Vernet D., Cai L., Garban H., Babbitt M.L., Murray F.T. et al.// Endocrinology.–1995.–Vol. 136.– P. 5709–5717
79. Vermeulen A. Androgens in the aging male // J. Clin. Endocr. Metab. – 1991. – Vol. 73. – P.221–224
80. Waaler H.T. Height Weight and mortality: the Norwegian experience. // Acta. Med. Scand. Suppl. – 1984. – Vol. 679. – P.1–56








.gif)



