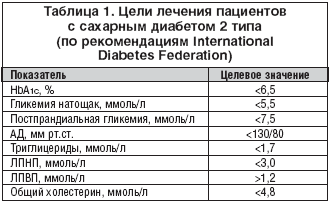
К настоящему времени накоплены доказательства того, что эффективный контроль диабета предотвращает развитие осложнений. Основой управления сахарным диабетом является достижение хорошей компенсации углеводного и липидного обмена, а также снижение уровня АД до целевых значений [2,3] (табл. 1). Все направления в равной степени важны, однако достижение нормогликемии считается первоочередной задачей лечения СД 2 типа. Крупнейшее исследование UKPDS (United Kingdom Prospective Diabetes Study) показало, что при уменьшении уровня HbA1c на 1% общая летальность при СД 2 типа снижается на 21%, риск развития микрососудистых осложнений – на 37%, а инфаркта миокарда – на 14% [4]. Результаты этого исследования подчеркивают необходимость строгой компенсации углеводного обмена. Согласно рекомендациям International Diabetes Federation целью лечения больных СД 2 типа является снижение гликозилированного гемоглобина (HbA1c) до уровня 6,5%. В консенсусе, принятом в 2006 г. Американской диабетологической ассоциацией и Европейской ассоциацией по изучению сахарного диабета, указано, что показатель HbA1c>7,0% следует рассматривать как недостаточную компенсацию углеводного обмена, и рекомендована дальнейшая коррекция сахароснижающей терапии до достижения цели лечения [5]. Тем не менее, по данным NHNES, только 50% пациентов с СД 2 типа достигают цели лечения HbA1c≤7,0%, 20% больных поддерживают уровень HbA1c между 7 и 8%, остальные 30% больных СД 2 типа имеют HbA1c>8% [6].
Согласно современным принципам ведения пациентов с СД 2 типа терапия должна быть патогенетически обоснованной и учитывать гетерогенность метаболических нарушений. Как известно, в развитии СД 2 типа принимают участие два основных патофизиологических дефекта: инсулинорезистентность и дисфункция β–клеток поджелудочной железы [7]. Инсулинорезистентность – самый ранний метаболический дефект и наиболее мощный фактор развития СД 2 типа. Чтобы преодолеть ИР периферических тканей и поддержать нормальный гомеостаз глюкозы, происходит постепенное повышение концентрации инсулина в крови. При адекватной способности β–клеток компенсировать повышение уровня глюкозы избыточной продукцией инсулина сохраняется состояние нормогликемии. Со временем происходит истощение инсулиносекреторной способности β–клеток, хроническая гиперинсулинемия уже не может компенсировать ИР, концентрация глюкозы крови повышается. В результате хронической гипергликемии развивается глюкозотоксичность, которая оказывает прямое неблагоприятное воздействие на скелетную мускулатуру и β–клетки поджелудочной железы: происходит усугубление имеющейся ИР и дальнейшее нарушение секреции инсулина. Таким образом, вследствие нарушения чувствительности к инсулину развивается хроническая гипергликемия и компенсаторная гиперинсулинемия, что приводит со временем к декомпенсации функции β–клеток.
ИР рассматривается в настоящее время, как основополагающее патофизиологическое нарушение в развитии СД 2 типа, и, соответственно, коррекция ИР приобретает ведущую роль в терапии СД 2 типа. Среди используемых в настоящее время пероральных сахароснижающих препаратов тиазолидиндионы обладают наиболее мощным воздействием на инсулинорезистентность. Тиазолидиндионы (ТЗД) разработаны, как лекарственные средства, улучшающие чувствительность к инсулину. Препараты этой группы являются синтетическими лигандами ядерных γ–рецепторов, активируемых пролифератором пероксисом – PPARγ (peroxisome proliferator–activated receptor), относящихся к семейству транскрипционных факторов, которые контролируют экспрессию генов, регулирующих углеводный и липидный обмен в мышцах и жировой ткани. Известно несколько изоформ PPAR: PPARα, PPARγ (подтипы 1, 2) и PPARβ/PPARδ. PPARα, PPARγ и PPARδ играют важную роль в регуляции адипогенеза и ИР. Рецептор PPARγ преимущественно экспрессируется в жировых клетках и моноцитах, меньше в скелетных мышцах, печени, почках. PPARγ регулирует дифференцировку адипоцитов, способствует экспрессии белка, транспортирующего жирные кислоты, увеличивает экспрессию гена адипонектина, транспортера глюкозы ГЛЮТ–4 и субстратов инсулиновых рецептов СИР–1 и 2, участвует в регуляции белков, разобщающих окислительное фосфорилирование, а также подавляет экспрессию гена лептина и ингибирует экспрессию в жировой ткани ФНО–α, что сопровождается снижением инсулинорезистентности и улучшением секреции инсулина β–клетками [8]. Наиболее значимой ролью PPARγ является дифференцировка жировой ткани. Активация PPARγ–рецепторов стимулирует дифференцировку преадипоцитов в относительно мелкие зрелые адипоциты, которые лучше накапливают свободные жирные кислоты, что способствует снижению их концентрации в крови.
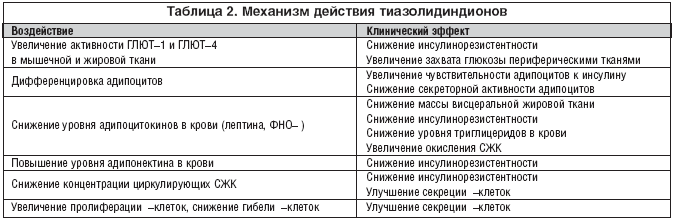
Основной терапевтический эффект ТЗД заключается в увеличении чувствительности периферических тканей к инсулину и, как следствие – улучшении утилизации глюкозы. Действие препаратов связано с их влиянием на экспрессию генов в адипоцитах и активизацию дифференцировки преадипоцитов в адипоциты, что приводит к образованию популяции более чувствительных к инсулину жировых клеток [9]. Под влиянием ТЗД в жировой ткани наряду с ускорением дифференцировки адипоцитов, на их мембранах происходит увеличение количества рецепторов к инсулину и повышение экспрессии генов транспортеров глюкозы GLUT–1 и GLUT–4. Также ТЗД уменьшают экспрессию лептина, влияя таким образом опосредованно на массу жировой ткани. Кроме того, назначение ТЗД приводит к снижению уровня свободных жирных кислот и уменьшению экспрессии в жировой ткани фактора некроза опухоли–α (ФНО–α), которые способствуют развитию инсулинорезистентности, и ингибирует секрецию инсулина β–клетками поджелудочной железы [10]. Кроме того, назначение ТЗД приводит к повышению уровня адипонектина и снижению уровней интерлейкина–6 и резистина, что способствует снижению ИР [11]. Таким образом, ТЗД улучшают чувствительность тканей к инсулину, что проявляется в печени угнетением образования глюкозы, в жировой ткани – торможением липолиза, накоплением триглицеридов и снижением концентрации СЖК, в мышцах – улучшением усвоения глюкозы. Кроме того, уменьшение концентрации СЖК и глюкозы в крови снижает эффекты липо– и глюкозотоксичности и способствует восстановлению секреторной активности β–клеток поджелудочной железы [12]. Также продемонстрировано, что ТЗД (росиглитазон) обладают непосредственным защитным действием в отношении β–клеток, способствуя пролиферации β–клеток и препятствуя их гибели [13]. Основные эффекты ТЗД приведены в таблице 2.
Таким образом, ТЗД характеризуются мощным сахароснижающим действием, которое реализуется в улучшении чувствительности периферических тканей к инсулину. Помимо этого, ТЗД обладают также рядом негипогликемических эффектов, что играет немаловажную роль в поддержании эффективного контроля СД 2 типа. Среди негипогликемических эффектов ТЗД особое значение имеет воздействие препаратов на липидный профиль крови. Показано, что ТЗД способствуют повышению уровня холестерина липопротеидов высокой плотности (ЛПВП) и снижению концентрации триглицеридов [14]. Влияние ТЗД на ЛПНП более сложное: глитазоны снижают экспрессию генов, способствующих окислению мелких, плотных ЛПНП, что является ключевым событием в прогрессировании атеросклероза; кроме того, прием ТЗД приводит к увеличению содержания более крупных частиц липопротеидов низкой плотности (ЛПНП), обладающих менее выраженным атерогенным эффектом [15]. Известно, что улучшение чувствительности к инсулину может снижать уровень АД. Другие механизмы влияния ТЗД на уровень АД включают улучшение эндотелий–зависимой вазолилатации, регулировку Са потоков и снижение экспрессии эндотелина–1 [16]. Одним из факторов прогрессирования ССЗ у больных СД 2 типа служит нарушение синтеза оксида азота. Инсулин увеличивает выработку оксида азота в организме и способствует расширению артериол, кровоснабжающих скелетные мышцы. У пациентов с СД 2 типа вследствие ИР нарушается продукция оксида азота и эндотелий–зависимая вазодилатация. Поскольку поражение эндотелия служит ранним признаком развития атеросклероза, нарушение дилатации сосудов предшествует развитию структурных изменений в сосудистой стенке [17]. Терапия ТЗД способствует нормализации функции эндотелия и реактивности сосудов. В экспериментальных исследованиях продемонстрировано замедление прогрессирования атеросклероза под воздействием ТЗД: было доказано, что ТЗД подавляют пролиферацию и миграцию гладкомышечных клеток сосудов [18]. Кроме того, ТЗД сдерживают развитие атеросклеротической бляшки, подавляя миграцию моноцитов и макрофагов [19].
Таким образом, терапия ТЗД способствует снижению риска развития осложнений ССЗ, что реализуется в результате воздействия ТЗД на основные факторы риска осложнений ССЗ: гипергликемию (снижение уровня гликозилированного гемоглобина на фоне терапии ТЗД), гипертонию (снижение АД), дислипидемию (снижение уровня триглицеридов, повышение уровня холестерина ЛПВП, увеличение размера частиц ЛПНП), маркеры эндотелиального воспаления (снижение уровня С–реактивного белка, фибриногена, фактора некроза опухоли–α), маркеры повышенного тромбообразования (снижение уровня ингибитора активатора плазминогена–1 и уменьшение агрегации тромбоцитов) [20]. Помимо этого, ТЗД, улучшая чувствительность к инсулину, воздействуют на факторы риска осложнений ССЗ, обусловленные инсулинорезистентностью. Уменьшение степени выраженности резистентности к инсулину у больных СД 2 типа под влиянием терапии ТЗД снижает на 27% риск развития сердечно–сосудистых заболеваний [21]. Известно, что даже при отсутствии гипергликемии ИР ассоциируется с 2–3–кратным увеличением риска осложнений ССЗ [22]. ИР способствует развитию основных факторов риска сердечно–сосудистых осложнений (таких как артериальная гипертензия и атеросклероз), а также приводит к увеличению содержания протромботических и провоспалительных факторов в крови [20].
Таким образом, ТЗД оказывают воздействие на основные патофизиологические нарушения, в первую очередь на выраженность ИР и функцию β–клеток, а также способствуют снижению риска возникновения осложнений ССЗ, что соответствует современным задачам лечения СД 2 типа.
ТЗД были испытаны во многих клинических исследованиях, подтвердивших их эффективность для лечения и профилактики СД 2 типа. Наиболее известные исследования, оценивающие клиническую эффективность ТЗД и росиглитазона – ADOPT (A Diabetes Outcome Progression Trial) и DREAM (The Diabetes Reduction Assessment with Ramipril and Rosiglitazone Medication). Исследование ADOPT сравнивало эффективность и длительность монотерапии росиглитазоном, метформином и глибуридом при лечении больных СД 2 типа с недавно установленным диагнозом [23]. В исследовании принимали участие 4360 пациентов с длительностью СД 2 типа не более 3 лет. Оценивалась длительность эффективности монотерапии указанными препаратами в максимальной суточной дозе (росиглитазон 8 мг, метформин 2 г, глибурид 15 мг). Первичной конечной точной была длительность лечения, когда монотерапия становилась неэффективной – уровень глюкозы крови натощак более 10 ммоль/л. Результаты исследования показали, что длительность эффективной монотерапии росиглитазоном была больше, чем в группах сравнения. Общее число случаев неэффективности монотерапии в течение 5 лет лечения составило 15% для росиглитазона, 21% для метформина и 34% для глибурида. Отмечено снижение риска неэффективности монотерапии росиглитазоном на 32% в сравнении с метформином и на 63% в сравнении с глибуридом (p<0,001 для всех сравнений). Лучший результат росиглитазона исследователи объясняют в первую очередь снижением ИР вследствие перераспределения жировой ткани и снижения секреции адипокинов.
Исследование DREAM (The Diabetes Reduction Assessment with Ramipril and Rosiglitazone Medication) проводилось для оценки снижения риска развития СД 2 типа у пациентов высокого риска на фоне длительной терапии росиглитазоном или рамиприлом, кроме того, оценивался риск развития осложнений сердечно–сосудистых заболеваний [24]. В исследовании принимали участие 5269 пациентов с нарушением гликемии натощак или нарушением толерантности к глюкозе без каких–либо ССЗ в анамнезе, которые были рандомизированы в группы приема росиглитазона (8 мг/сут.) или плацебо и рамиприла (15 мг/сут.), или плацебо. Первичной конечной точкой была манифестация СД 2 типа или смерть от любых причин. Оценивалась частота развития сердечно–сосудистых событий (инфаркт миокарда, инсульт, смерть в результате сердечно–сосудистых причин, реваскуляризация, сердечная недостаточнсть, впервые возникшая стенокардия) и поражения почек (развитие и прогрессирование микроальбуминурии, снижение клиренса креатинина). Вторичные конечные точки включали также изменение функций β–клеток, оцениваемое по индексу HOMA, изменение ИР, нормализацию толерантности к глюкозе и нормализацию уровней глюкозы натощак. Период наблюдения составил в среднем 3 года.
В результате исследования СД 2 типа манифестировал у 11,6% пациентов, принимавших росиглитазон, и у 26% пациентов из группы плацебо. Относительный риск развития сахарного диабета составил 0,40 (95% ДИ 0,35–0,46, p<0,0001), т.е. на фоне приема росиглитазона риск развития СД 2 типа снижается на 60% в сравнении с плацебо. В группе приема росиглитазона у 51% пациентов наблюдалась нормализация гликемии, в группе плацебо подобных результатов достигли 30% больных. Вероятность нормогликемии на 70% выше при назначении росиглитазона по сравнению с плацебо (p<0,0001). Частота развития сердечно–сосудистых событий поражения почек была сравнимой в обеих группах, однако на фоне приема росиглитазона у 14 пациентов (0,5%) развилась сердечная недостаточность. В группе плацебо сердечная недостаточность зарегистрирована у 2 пациентов (0,1%), p=0,01. Таким образом, исследователи делают вывод, что прием росиглитазона в течение 3 лет снижает риск развития СД 2 типа и способствует нормализации углеводного обмена у пациентов с НТГ или нарушением гликемии натощак. В ходе исследования DREAM не проводилось прямого сравнения эффективности препаратов рамиприла и росиглитазона.
Эффективность применения росиглитазона (препарат «Роглит» фармацевтической компании «Гедеон Рихтер») была подтверждена в российском исследовании, проведенном на кафедре эндокринологии ММА имени И.М. Сеченова. В исследовании приняли участие 30 пациентов с СД 2 типа с уровнем гликозилированного гемоглобина 6,5–11% без тяжелых ССЗ. Оценвалась степень снижения гликемии натощак и HbA1c, изменение параметров липидного обмена, а также уровня иммунореактивного инсулина натощак и индекса инсулинорезистентности НОМА. Помимо этого, проводилась оценка безопасности терапии росиглитазоном (Роглит): оценивалась частота возникновения эпизодов гипогликемии, периферических отеков, динамика массы тела, изменения ЭКГ и биохимических показателей крови. Пациенты были распределены в группы приема росиглитазона (Роглит) в суточной дозе 4 или 8 мг (10 чел.) и комбинированной терапии росиглитазоном (Роглит) в сочетании с метформином и препаратами сульфонилмочевины (20 чел.). Наблюдение длилось 24 нед.
В результате приема росиглитазона (Роглит) большинство пациентов (77%) достигли компенсации углеводного обмена. Уровень гликозилированного гемоглобина снизился на 0,9% (с 6,9 до 6,0%), также отмечено статистически значимое снижение уровня гликемии натощак (с 7,1 до 6,4 ммоль/л) и улучшение показателей инсулинорезистентности и гиперинсулинемии: индекс НОМА уменьшился с 3,9 до 2,5, уровень ИРИ снизился с 11,8 до 9,0 мЕд/мл. Не отмечалось статистически значимого ухудшения липидного спектра. Также не наблюдалось прибавки массы тела, появления периферических отеков, патологических изменений ЭКГ и печеночных ферментов.
Литература
1. Cleary P, Orhard T, Zinman B et al. Coronary calcification in the diabetes Control and Complication trial (DCCT/EDIC) cohort for the DCCT/EDIC study group program and abstract of the ADA 63rd Annual Scientific sessions; June 13–17 2003; New Orlean, Louisiana.
2. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood glucose control with sulphonylureas or insulin compared with conventional treatment of risk of complications in patients with type 2 diabetes (UKPDS 33) // Lancet. – 1998. – Vol. 352. – P. 837–853
3. UK Prospective Diabetes Study (UKPDS) Group. Effects of intensive blood glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34) // Lancet. – 1998. – Vol. 352. – P. 854–865
4. Stratton I. M., Adler A. L., Neil H. A. et al., Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study// B M J. – 2000. – Vol. 321. – 405–412
5. Nathan D.M., Buse J.B., Davidson M.B. et al., Management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy // Diabetologia – 2006 – Vol. 49 – P. 1711–1721
6. Resnik NE, Foster GL, Bardsley G, Ratner E, Achievement of American Diabetes Association clinical practice recommendations among U.S. adults with diabetes, 1999–2002: the National Health and Nutrition Examination Survey// Diabetes care – 2006 – 29(3) – p. 531–537
7. Аметов А.С. Инсулиносекреция и инсулинорезистентность: две стороны одной медали// Проблемы эндокринологии – 2002 – т. 48, №3 – стр.31–36
8. Клебанова Е.М., Балаболкин М.И., Креминская В.М. Инсулинорезистентность: ее роль в патогенезе сахарного диабета 2 типа и возможности коррекции. Лечащий врач, 2005,№5.
9. Arner P., Free fatty acids–do they play a central role in type 2 diabetes? // Diabetes Obes Metab. – 2001. – Vol. 3. – P. 11–19
10. Bloomgarden Z. Thiazolidinediones // Diabetes Care, Vol. 28, N.2, Feb. 2005, 488–493.
11. Phillips S.A., Ciaraldi T.P., Kong A.P., Bandukwala R., Aroda V., Carter L., Baxi S., Mudaliar S.R., Henry R.R. Modulation of circulating and adipose tissue adiponectin levels by antidiabetic therapy.Diabetes Mar;52(3):667–74 2003
12. Shimabukuro M, Zhou YT, Lee Y, Unger RH. Troglitazone lowers islet fat and restores ? cell function of Zucker diabetic fatty rats. J Biol Chem. 1998;273:3547–50.
13. Buckingham RE, Al–Barazanji KA, Toseland CD, Slaughter M, Connor SC, West A, et al. Peroxisome proliferator–activated receptor– agonist, rosiglitazone, protects against nephropathy and pancreatic islet abnormalities in Zucker fatty rats Diabetes. 1998;47:1326–34.
14. Choi D, Kim SK, Choi SH, Ko YG, Ahn CW, Jang Y, Lim SK, Lee HC, Cha BS: Preventative effects of rosiglitazone on restenosis after coronary stent implantation in patients with type 2 diabetes. Diabetes Care 27:2654–2660, 2004.
15. Nagy L, Tontonoz P, Alvarez JG, Chen H, Evans RM. Oxidized LDL regulates macrophage gene expression through ligand activation of PPAR Cell. 1998;93:229–40.
16. Satoh H, Tsukamoto K, Hashimoto Y, Hashimoto N, Togo M, Hara M, et al. Thiazolidinediones suppress endothelin–1 secretion from bovine vascular endothelial cells: a new possible role of PPAR on vascular endothelial function. Biochem Biophys Res Commun. 1999;254:757–63.
17. Lehmann ED, Riley WA, Clarkson P, Gosling RG. Non–invasive assessment of cardiovascular disease in diabetes mellitus. Lancet. 1997;350(Suppl 1):SI14–9.
18. Law RE, Goetze S, Xi XP, Jackson S, Kawano Y, Demer L, et al. Expression and function of PPAR in rat and human vascular smooth muscle cells. Circulation. 2000;101:1311–8.
19. Jokl R, Colwell JA. Arterial thrombosis and atherosclerosis in diabetes. Diabetes Reviews. 1997;5:316.
20. Kendall DM, Sobel BE, Coulston AM, Peters Harmel AL, McLean BK, Peragallo–Dittko V, Buse JB, Fonseca VA, Hill JO, Nesto RW, Sunyer FX: The insulin resistance syndrome and coronary artery disease. Coron Artery Dis 14:335–348, 2003.
21. Leonard T. B., Bakst A., Warsi G. et al., Rosiglitazone may reduce insulin resistance related cardiovascular disease risk in patients with type 2 diabetes // Diabetes. – 2001. – Vol. 50. – Suppl. 2. – P. 44
22. Howard G, O’Leary DH, Zaccaro D, Haffner S, Rewers M, Hamman R, Selby JV, Saad MF, Savage P, Bergman R: Insulin sensitivity and atherosclerosis. Circulation 93:1809–1817, 1996
23. Kahn SE, Haffner SM, Heise MA, et al, for the ADOPT study groupe. Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy. N Engl J Med. 2006; 355:2427–43.
24. The DREAM (Diabetes reduction assessment with ramipril and rosiglitazone medication) trial investigators. Effect of rosiglitazone on the frequency of diabetes in patients with impaired glucose tolerance or impaired fasting glucose: a randomized controlled trial. Lancet. 2006; 368:1096–1105.












