Количество больных сахарным диабетом в США только за период с 1990 по 2001 г. увеличилось на 61% [1]. Как указывает Z.T. Bloomgarden [2], в США в 2003 г. зарегистрировано 13,8 млн. больных, страдающих сахарным диабетом; дополнительно к этому у 5 млн. человек имеется недиагностированный сахарный диабет, а 41 млн. жителей США имеют предиабет (нарушенная гликемия натощак и нарушенная толерантность к глюкозе). Самыми ранними метаболическими нарушениями, которые предшествуют сахарному диабету, являются нарушенная гликемия натощак и нарушенная толерантность к глюкозе, наличие которых может регистрироваться в течение нескольких лет. Как установлено многочисленными исследованиями, у большинства больных развитие сахарного диабета (почти 70% больных) включает наличие указанных стадий предиабета [3–5]. По данным Центра по контролю заболеваемости и профилактики заболеваний, в США ежегодно регистрируется 1,5 млн. новых случаев сахарного диабета и в 2005 г. его распространенность составила около 21 млн. человек [6]. Увеличение частоты и распространенности сахарного диабета сопровождается повышением частоты сосудистых осложнений, являющихся, в свою очередь, причиной слепоты, хронической почечной недостаточности, ИБС и инфаркта миокарда, инсульта, нейропатии и диабетической гангрены, приводящих к ранней инвалидизации и высокой летальности. Более того, высокий риск начала развития сосудистых осложнений имеется уже на стадии предиабета, о чем свидетельствуют данные проведенных исследований [7–9]. Высокие расходы, связанные с лечением сосудистых осложнений диабета, намного превосходят средства, необходимые для лечения и контроля нарушенного углеводного обмена. Эти расходы действительно являются тяжким бременем национальных служб здравоохранения. Реального снижения указанных расходов можно добиться лишь в случае проведения активной профилактики сахарного диабета, достигая при этом уменьшения распространенности и заболеваемости сахарным диабетом.
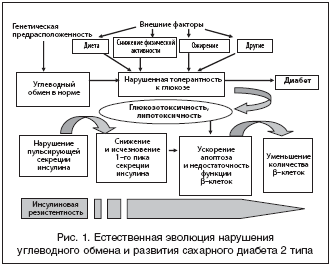
Общепризнано, что в патогенезе сахарного диабета участвуют две большие группы факторов: внутренние (генетические), обусловливающие предрасположенность к развитию сахарного диабета, и внешние (средовые) факторы, реализующую генетическую или наследственную предрасположенность к сахарному диабету. Генетическая предрасположенность к развитию сахарного диабета 2 типа обеспечивается набором генов, контролирующих чувствительность периферических тканей к инсулину и отвечающих, таким образом, за состояние инсулиновой резистентности, которая в соответствии с полученными убедительными данными различных авторов является первичной, приводя к необходимости повышенной секреции инсулина b–клетками островка поджелудочной железы и способствуя истощению их функциональной активности. Эти патогенетические механизмы развития сахарного диабета и его осложнений представлены на рисунке 1.
Что касается времени развития сосудистых осложнений сахарного диабета, приводящих к инвалидизации и преждевременному летальному исходу, то эти взаимоотношения представлены на рисунке 2.
Данные на рисунках 1 и 2 показывают, что внешнесредовыми или факторами, реализующими генетическую предрасположенность к сахарному диабету 2 типа являются: нарушение образа жизни, сопровождающееся перееданием, излишнее поступление энергии в виде принятой пищи, что, в свою очередь, способствует избыточному весу, а затем и ожирению, которое прогрессирует на фоне сниженной физической активности. Все перечисленные этапы, приводящие к развитию сахарного диабета, сопровождаются появлением объективных признаков, являющихся факторами высокого риска развития диабета. Профилактику сахарного диабета следует начинать не тогда, когда произошла его манифестация, требующая для коррекции нарушенного углеводного обмена применения наряду с диетой и физической активностью и медикаментозной терапии. Ее следует начинать уже на стадиях предиабета, т.е. на стадии нарушенной гликемии натощак и нарушенной толерантности к глюкозе.
В соответствии с классификацией сахарного диабета ВОЗ (1999) нарушения углеводного обмена подразделяются на: нарушенную гликемию натощак (уровень глюкозы цельной венозной и капиллярной крови натощак >5,6–<6,1; в плазме венозной и капиллярной крови >6,1–<7,0 ммоль/л); нарушенную толерантность к глюкозе (уровень глюкозы цельной венозной крови натощак <6,1 и через 2 часа после нагрузки глюкозой >6,7–<10,0 и в плазме венозной крови натощак – <7,0 и через 2 часа после нагрузки >7,8–<11,1 ммоль/л).
За последние годы опубликовано 8 широкомасштабных исследований, в которых проводилась оценка эффективности в профилактике сахарного диабета 2 типа изменений в образе жизни и применения медикаментозной терапии [3,4,10–15]. Проведенные исследования продемонстрировали снижение частоты на 20–60% развития сахарного диабета 2 типа. Наилучшие показатели профилактики сахарного диабета (до 60%) отмечались в группах больных, находившихся в период наблюдения на диете и физических нагрузках (изменение образа жизни), что сопровождалось снижением веса у наблюдаемых больных, а также у больных, получавших росиглитазон [3,4,12,14,15], тогда как применение для профилактики сахарного диабета других лекарственных препаратов (метформин, акарбоза) сопровождалось снижением частоты развития сахарного диабета на 25–30% [4,11,13,14]. Из представленных данных видно, что из всех используемых для профилактики сахарного диабета 2 типа медикаментозных средств наиболее эффективным является росиглитазон, представитель группы глитазонов, тиазолидиндионов или сеситайзеров инсулина, основным эффектом действия которых является повышение чувствительности к инсулину и снижение степени выраженности инсулиновой резистентности. Несмотря на то, что метформин по механизму его действия также можно отнести к сенситайзерам, его влияние на снижение степени выраженности инсулиновой резистентости проявляется в основном на уровне печени, тогда как глитазоны повышают чувствительность к инсулину (в основном в жировой и мышечной тканях).
Медикаментозная терапия
Тиазолидиндионы являются препаратами, сахароснижающее действие которых опосредуется механизмом, отличающимся от других препаратов, применяемых для лечения сахарного диабета. Они усиливают действие инсулина в мышцах скелета, жировой ткани и в печени. Механизм действия тиазолидиндионов заключается в способности этих препаратов взаимодействовать с определенным недавно идентифицированным классом ядерных рецепторов PPARg (активируемый пролифератором пероксисом рецептор–g), играющим основную роль в регуляции дифференцировки адипоцитов и обмена липидов. Модулируя инсулиновую чувствительность периферических тканей к инсулину, тиазолидиндионы участвуют также в регуляции эндокринной функции жировой ткани, изменяя секрецию соответствующих гормонов жировой ткани (ФНО–a, ингибитор 1 типа активатора плазминогена, адипонектин, лептин и др.), что влияет на снижение скорости развития сосудистых осложнений диабета, вплоть до возможности их обратного развития.
У лиц с нарушенной толерантностью к глюкозе троглитазон замедлял прогрессирование сахарного диабета 2 типа посредством предупреждения снижения функциональной активности b–клеток и уменьшения степени выраженности инсулиновой резистентности. При этом как троглитазон, так и росиглитазон восстанавливали до нормы секрецию инсулина у пациентов с нарушенной толерантностью к глюкозе [17,18].
Пиоглитазон, подобно другим глитазонам, улучшает секрецию инсулина у больных, страдающих ожирением и нарушением у них углеводного обмена, проявляющегося наличием нарушенной гликемии натощак и нарушенной толерантности к глюкозе [19]. Несмотря на то, что росиглитазон и пиоглитазон относятся к группе сенситайзеров инсулина или тиазолидиндионов, клинические и другие исследования показали, что росиглитазон является «чистым» агонистом PPARg, тогда как пиоглитазон оказывает эффекты и как агонист PPARa [20]. Гены PPARa регулируют поглощения и окисления свободных жирных кислот (СЖК) тканями (почки, печень, сердце, скелетные мышцы), а также процессы воспаления и функцию сосудов, тогда как PPARg вовлечены в регуляцию процессов как поглощения СЖК и их хранения в жировых депо, так и в процессы воспаления и гомеостаза глюкозы [21]. Видимо, этим фактом можно объяснить наличие определенных различий в биологических эффектах этих двух представителей группы глитазонов.
Для профилактики сахарного диабета, как отмечалось выше, применялось несколько лекарственных препаратов, но наилучшие результаты были при применении глитазонов. Первым опытом применения глитазонов для профилактики сахарного диабета было исследование под названием TRIPOD (Troglitazone in the prevention diabetes – Трогитазон в профилактике сахарного диабета), которое заключалось в применении троглитазона у 266 испаноговорящих женщин, имеющих в анамнезе гестационный диабет, наличие которого является риском высокой степени для развития в последующие годы сахарного диабета 2 типа [12]. Указанные пациенты были рандомизированы на 2 группы (по 133 пациентки в каждой группе), получавшие троглитазон или плацебо. Указанная терапия проводилась в течение 30 мес. и ежегодная заболеваемость сахарным диабетом в указанных группах составляла 12,1 и 5,4 соответственно в группе пациентов, получавших плацебо или троглитазон (p<0,001). Через 8 мес. после прекращения терапии троглитазоном у 15% лиц, получавших плацебо, и у 2,3% лиц, получавших троглитазон, развился сахарный диабет в последующие 4,3 года наблюдения. Наибольший профилактический эффект троглитазона в отношении профилактики сахарного диабета наблюдался у лиц, у которых отмечалось значительное снижении секреции инсулина в ответ на внутривенный глюкозотолерантный тест. Авторы исследования справедливо предположили, что такое снижение функции b–клеток является ответной реакцией островкового аппарата поджелудочной железы на уменьшение степени выраженности инсулиновой резистентности, наступившей под влиянием терапии троглитазоном. Уменьшение потребности в инсулине и снижение его секреции сопровождается сохранением функциональной активности b–клеток на протяжении длительного периода и профилактикой развития сахарного диабета, по крайней мере, в течение 4–5 лет. К сожалению, троглитазон, который был разрешен для клинического применения в США в 1997 г., был исключен из списка препаратов, применяемых в клинической практике уже в 2000 г., из–за высокой гепатотоксичности.
Следующим исследованием [23] по применению глитазонов и других средств для профилактики сахарного диабета 2 типа было исследование под названием DPP (The Diabetes Prevention Program – Программа профилактики сахарного диабета). В исследование было включено 2343 человека с нарушенной толерантностью к глюкозе, которые после рандомизации были разделены на 4 группы: получавших плацебо (582 пациента), метформин (587 человек), троглитазон (585 человек) и значительное изменение образа жизни – диета, физическая активность и др. (589 человек). Частота развития сахарного диабета 2 типа за период наблюдения (2,8 года, т.е. в 1996–1998 гг.) составляла 11,0; 7,8 и 4,8 случая на 100 человек в год, соответственно, в группе плацебо, метформина и значительного изменения образа жизни. Частота заболеваемости сахарным диабетом была ниже на 58% в группе лиц, находившихся на внедрении интенсивного образа жизни; на 31% – в группе лиц, получавших метформин, по сравнению с группой лиц, находившихся на стандартном образе жизни и получавших плацебо. Во время терапии троглитазоном в среднем в течение 0,9 года заболеваемость сахарным диабетом 2 типа составила 3,0 на 100 человек в год по сравнению с 12,0; 6,7 и 5,1 человек в год в группе плацебо, метформина и значительного изменения образа жизни (p<0,001, троглитазон против плацебо; p<0,02 троглитазон против метформина и p=0,18 троглитазон против интенсивного образа жизни). Интересно, что через 3 года после прекращения терапии троглитазоном, заболеваемость сахарным диабетом 2 типа в этой группе была такой же, как в группе больных, получавших плацебо.
Одним из значительных и широкомасштабных исследований [15] по медикаментозной терапии для профилактики сахарного диабета 2 типа является исследование под названием DREAM (The diabetes reduction assessment with ramipril and rosiglitazone medication – Оценка снижения частоты сахарного диабета с применением рамиприла и росиглитазона). В исследование были включены 5269 взрослых в возрасте 30 и более лет с нарушенной гликемией натощак или с нарушенной толерантностью к глюкозе и не имевших в анамнезе сердечно–сосудистых заболеваний. Основной целью исследования являлось определение вероятности развития сахарного диабета 2 типа у лиц, находящихся в течение 3–летнего периода наблюдения на терапии росиглитазоном – 8 мг ежедневно (n=2365) и рамиприлом по 15 мг ежедневно или плацебо (n=2634). Первичная оценка исходов лечения проводилась по частоте случаев развития сахарного диабета 2 типа или летального исхода в течение наблюдаемого периода, т.е. в течение 3 лет. В группе больных, получавших росиглитазон, летальный исход был зарегистрирован у 1,1%; у 10,6% развился сахарный диабет. Тогда как в группе больных, получавших плацебо, летальный исход зарегистрирован у 1,3%; у 24,7% наблюдаемых больных развился сахарный диабет 2 типа (p<0,0001). Что касается летальных случаев в период проведения исследования, то в группе больных, получавших росиглитазон, было зарегистрировано 30 летальных исходов, а в группе плацебо – 33 (p=0,7). Следует отметить, что у больных, получавших терапию росиглитазоном, чаще отмечались случаи сердечной недостаточности (14 случаев или 0,5%), тогда как в группе пациентов, получавших плацебо, было зарегистрировано 2 случая летального исхода (0,1%; p=0,01). Помимо этого, средняя масса тела у пациентов, получавших терапию росиглитазоном, незначительно увеличилась (на 2,2 кг) по сравнению с группой больных, получавших плацебо.
Из общего количества больных, получавших росиглитазон, у 50,5% пациентов углеводный обмен (состояние нормогликемии) на конец наблюдения оставался в пределах нормы, тогда как в группе плацебо только 30,3% больных были способны поддерживать состояние углеводного обмена в пределах нормальных показателей (p<0,0001).
Недавно опубликованы результаты [25] многоцентрового, рандомизированного, двойного слепого и контролируемого исследования ADOPT (Diabetes Outcome Progression Trial) применения монотерапии росиглитазоном (1456 пациентов), метформином (1454 пациента) или глибенкламидом (1441 пациента) у 4360 больных (в последующем 9 больных были исключены из исследования) с вновь выявленным сахарным диабетом 2 типа, которые получали соответствующую терапию в среднем в течение 4 лет. Целью исследования являлось определение возможности поддержания в течение длительного времени состояния компенсации углеводного обмена на фоне монотерапии, оцениваемое по сохранению гликемии натощак ниже 7,8 ммоль/л. К критериям исключения относили клинически выраженную недостаточность функции печени, почек, наличие в анамнезе лактат ацидоза, нестабильную или выраженную форму ИБС, сердечную недостаточность I, II, III или IV класса по классификации Ассоциации кардиологов г. Нью–Йорка, а также наличие неконтролируемой гипертензии. Первичные исходы лечения оценивались по невозможности достичь компенсации углеводного обмена у больных, получавших различную монотерапию, и критерием этого являлись показатели гликемии натощак, превышающие 10 ммоль/л для лиц, получавших терапию росиглитазоном, по сравнению с пациентами, находившимися на терапии метформином или глибенкламидом. Оценка вторичных исходов лечения проводилась по показателям гликемии натощак, уровню гликозилированного гемоглобина в крови (HbA1c), чувствительности тканей к инсулину и функциональной активности b–клеток. Результаты исследования показали, что невозможность достичь компенсации углеводного обмена на монотерапии росиглитазоном составляла 15%, метформином – 21% и на монотерапии глибенкламидом – 34%. Анализ полученных данных показал, что росиглитазон статистически значимо (p<0,001) улучшает чувствительность к инсулину по сравнению с метформином и глибенкламидом и уменьшает степени нарушения функции b–клеток (p=0,02 по сравнению с метформином и p<0,001 по сравнению с глибенкламидом) островкового аппарата поджелудочной железы, что диктует целесообразность раннего применения росглитазона в терапии сахарного диабета 2 типа. Эта рекомендация подтверждается также более длительным периодом (60 месяцев) компенсации углеводного обмена (уровень гликогемоглобина <7%) у больных диабетом на фоне терапии росиглитазоном по сравнению с метформином (45 мес.) или глибенкламидом (33 мес.).
Несмотря на то, что в цели настоящего исследования не входили вопросы профилактики сахарного диабета (только лечение впервые выявленных клинических форм сахарного диабета 2 типа), полученные результаты четко свидетельствуют о том, что росиглитазон статистически достоверно сохраняет в течение длительного времени функцию b–клеточного аппарата поджелудочной железы, что подтверждает возможность применения росиглитазона для профилактики сахарного диабета 2 типа, что было подтверждено исследованиями, результаты которых были представлены выше.
Изменение образа жизни
Как уже отмечалось ранее, исследованием DPP было установлено, что наиболее эффективной мерой в профилактике сахарного диабета 2 типа является изменение образа жизни, включая диетотерапию и адекватную физическую нагрузку, способствующие снижению массы тела, уменьшению степени выраженности инсулиновой резистентности и улучшению функциональной активности b–клеточного аппарата поджелудочной железы. Особый интерес в этом плане представляет недавно опубликованная работа [26], в которой авторы исследования, используя специально разработанную компьюторную программу, провели оценку 10 проспективных когортных исследований эффективности применения у 301221 пациента умеренно интенсивной физической нагрузки в целях профилактики сахарного диабета 2 типа. Установлено, что регулярная физическая нагрузка (пешие прогулки в течение >2,5 часов в неделю) снижает риск развития сахарного диабета 2 типа на 30% по сравнению с лицами, не проявляющими достаточной физической активности. Особенно отчетливые обратные взаимоотношения между умеренной интенсивности физической нагрузкой и относительным риском развития сахарного 2 типа были установлены при включении показателей индекса массы тела. Физические нагрузки стимулируют синтез гликогена посредством стимуляции активности ГЛЮТ–4 в скелетных мышцах и других тканях, обеспечивая увеличение транспорта глюкозы через мембрану клеток при одновременном повышении активности гликогенсинтазы. Причем умеренно интенсивные физические нагрузки сопровождаются повышением скорости пролиферации капилляров в мышцах, увеличением объема и массы мышечной ткани и повышением чувствительности периферических тканей и мышц к инсулину.
Антиоксиданты и микронутриенты
Следует указать еще на один аспект, недостаточно освещенный в литературе, как в отношении профилактики сахарного диабета 2 типа, так и его поздних сосудистых осложнений, заключающийся в снижении и уменьшении выраженности окислительного стресса, который имеется уже на стадии нарушенной гликемии натощак и нарушенной толерантности к глюкозе. Роль окислительного стресса в патогенезе развития сахарного диабета и его сосудистых осложнений общепризнана и доказана многочисленными клиническими и экспериментальными исследованиями [27–29]. Улучшение компенсации углеводного обмена у больных сахарным диабетом сопровождается уменьшением степени выраженности окислительного стресса и повышением активности ферментной антиоксидантной системы [30].
Представленные данные свидетельствуют о необходимости применения антиоксидантов и микроэлементов в комплексной терапии сахарного диабета, профилактике диабета и его осложнений. Исходя из этого нами [М.И. Балаболкин и Е.М. Клебанова, кафедра эндокринологии ФППО ММА имени И.М. Сеченова] был разработан витаминно–минеральный препарат (АЛФАВИТ Диабет), для больных сахарным диабетом, состоящий из 3 таблеток, каждая из которых включает несколько витаминов и микроэлементов, необходимых для нормальной функции организма вообще и особенно больных сахарным диабетом, у которых в связи с наличием заболевания и нарушенным обменом веществ имеется их дефицит.
В состав таблетки 1 входят (в мг): витамин А – 0,5; вит. В1 – 4; вит. С – 50; вит. В9 – 0,25; железо сульфат – 15; медь сульфат – 1; янтарная кислота – 50; липоевая кислота – 15; черника (побеги) – 30.
Таблетка 2 представлена следующими соединениями (в мг): вит. А – 0,5; вит. В2 – 3; вит. В3 – 30; вит. В6 – 3; вит. С – 50; вит. Е – 30; марганец сульфат – 3; селен – 18; магния оксид – 40; йод – 0,15; лопух (репей) – 30; одуванчик – 30.
Компонентами таблетки 3 являются (в мг): вит. D3 – 0,005; вит. К – 0,12; вит. В5 (пантотенат кальция) – 7; вит. В9 – 0,25; вит. В12 – 0,004; биотин – 0,07; кальций – 150; хром (пиколинат) – 0,15.
Составляющими компонентами АЛФАВИТ Диабет являются в первую очередь вещества, обладающие антиоксидантным действием, а также витамины и микроэлементы, усиливающие антиоксидантные эффекты или непосредственно влияющие на нарушенные при сахарном диабете метаболические процессы. Так, микроэлемент марганец играет исключительную роль в патогенезе сахарного диабета.
При разработке состава комплекса АЛФАВИТ Диабет мы исходили из того, что помимо витаминов и микроэлементов, недостаточность которых имеется при диабете, в комплексном препарате должны содержаться вещества растительного происхождения, обладающие определенным сахароснижающим эффектом (черника, одуванчик, лопух) и осуществляющих это влияние на рецепторном и пострецепторном уровнях, а также, вероятнее всего, и своим антиоксидантным действием. Указанные компоненты способствуют снижению потребности в инсулине на периферии, что сопровождается уменьшением его секреции b–клетками поджелудочной железы, создавая таким образом условия для сохранения их функции в течение длительного времени. Эффект подобен таковому, наблюдаемому при применении росиглитазона, но их механизмы различны.
С учетом возможного взаимодействия различных лекарственных веществ, а также необходимости сохранения соответствующего интервала между приемом лекарственных веществ и с учетом периода их полураспада в организме, а также для усиления синергизма действия компонентов комплекса предложена новая форма выпуска витаминно–минерального комплекса, в которой эффективная суточная доза необходимых для организма витаминов и минералов разделена на 3 приема. Применение комплекса АЛФАВИТ Диабет восполняет недостаточность витаминов и микроэлементов, наблюдаемую у больных сахарным диабетом, и позволяет нормализовать состояние углеводного, липидного и других видов обмена, что способствует профилактике и снижению прогрессирования сосудистых осложнений диабета.
В заключение необходимо подчеркнуть, что применение витаминов вообще, а особенно витаминов, обладающих антиоксидантным действием, должно быть обязательным условием не только для проведения рациональной и комплексной терапии сахарного диабета, но и как его профилактики, так и профилактики сосудистых осложнений.

Литература
1. Mokdad A.H., Ford E.S., Bowman B.A. et al., Prevalence of obesity, diabetes, and obesity–related health risk factors, 2001 // JAMA – 2003 – Vol. 289 – P. 76–79
2. Bloomgarden Z. T, Developments in diabetes and insulin resistance // Diabetes Care – 2006 – Vol. 29 – P. 161–167
3. Tuomilehto J., Lindstrom H., Laakso M. et al., The Finnish diabetes prevention study groop: prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance // N Engl J Med – 2001 – Vol. 344 – P.1343–1350
4. Knowler W.C., Barrett–Conner E., Fowler S.E. et al., The diabetes prevention program research groop: reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin // N Engl J Med – 2002 – Vol. 346 – P. 393–403
5. Larson H., Lindgarde F., Berglund G., Ahren B., Prediction of diabetes using ADA or WHO criteria in post–menopausal women: a 10–year follow –up study // Diabetologia – 2004 – Vol. 43 – P. 1224–1228
6. Center for Disease Control and Prevention. National Diabetes Surveillance System. (Acccessed November 14, 2006, at http:// www.cdc.gov/diabetes/statistics.).
7. Coutinho M., Gerstein H.C., Wang Y. et al., The relationship between glucose and incident cardiovascular events^ a metaregression analysis of published data from 20 studies 0f 95783 individuals followed for 12,4 years // Diabetes Care – 1999 – Vol. 22 – P. 233–240
8. Decode study group, on behalf of the European Diabetes Epidemiology Group: is the current definition for diabetes relevant to mortality risk from all causes and cardiovascular and noncardiovascular diseases? // Diabetes Care – 2003 – Vol. 26 – P. 688–696
9. Levitan E.B., Song Y., Ford E.S., Liu S., Is non–diabetic hyperglycemia a risk factor for cardiovascular disease? A meta–analysis of prospective studies // Arch Intern Med – 2004 – Vol. 164 – P. 2147–2155
10. Pan X.R., Li G.W., Hu Z.X. et al., Effects of diet and exercise in preventing NIDDM in people with impaired glucose tolerance: the Da Qing IGT and diabetes study // Diabetes Care – 1997 – Vol. 20 – P. 537–544
11. Chiasson J.L., Josse R.D., Gomis R. et al., The STOP–NIDDM trial research group: acarbose for prevention of type 2 diabetes mellitus: the STOP–NIDDM randomized trial // Lancet – 2002 – Vol. 359 – P. 2072–2077
12. Buchanan T.A., Xiang A.H., Peters R.K. et al., Prevention of pancreatic ?–cell function and prevention of type 2 diabetes by pharmacological treatment of insulin resistance in high–risk Hispanic women // Diabetes – 2002 – Vol. 51 – P. 2796–2803
13. Torgerson J.S., Hauptman J., Boldrin M.N. et al., Xenical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study for the prevention of type 2 diabetes in obese patients // Diabetes Care – 2004 – Vol. 27 – P. 151–161
14. Ramachandrian A., Snehalatha C., Mary S. et al., Indian diabetes prevention programme (IDPP): the Indian diabetes prevention programme shows that lifestyle modification and metformin prevent type 2 diabetes in Asian Indian subjects with impaired glucose tolerance (IDPP–1) // Diabetologia – 2006 – Vol. 49 – P. 289–297
15. Gerstein H.C., Yusuf S., Boxch J. et al., DREAM (Diabetes reduction assesment with ramipril and rosiglitazone medication) trial investigatiors: Effects of rosiglitazone on the frequency of diabetes in patients with impaired glucose tolerance or impaired fasting glucose: a randomized controlled trial // Lancet – 2006 – P. 368 – P. 1096–1105
16. Kahn S.E., Haffner S.M., Heise M.A. et al., Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy // N Engl J Med – 2006 – Vol. 355 – P.2427–2443
17. Cavaghan M.K., Ehrmann D.A., Byrne M.M., Polonsky K.S., Treatment with the oral antidiabetic agent troglitazone improves beta cell responses to glucose in subjects with impaired glucose tolerance // J Clin Invest – 1997 – Vol. 100 – P. 530–537
18. Juhl C.B., Hollingdal M., Porksen N. et al., Influence of rosiglitazone treatment on beta–cell function in type 2 diabetes: evidence of an increased ability of glucose to entrain high frequency insulun pulsatility // J Clin Endocrinol Metab – 2003 – Vol. 88 – P. 3794–3800
19. Gonzalez–Ortiz M., Hernandez–Salazar E., Kam–Ramos A.M., Martinez–Abundis E., Effect of pioglitazone on insulin secretion in patients with both impaired fasting glucose and impaired glucose tolerance // Diabetes Res Clin Pract – 2007 – Vol. 75 – P.115–118
20. Sakamoto J., Kimura H., Moriyama S. et al., Activation of human peroxisome proliferator–activated receptor (PPAR) subtypes by pioglitazone // Biochem iophys Res Commun – 2000 – Vol. 278 – P. 704–711
21. Staels B., Fruchart J.C., Therapeutic roles of peroxisome proliferator–activated receptor agonists // Diabetes – 2005 – Vol. 54 – P. 2460–2470
22. Xiang A.H., Peters R.K., Kjos S.L. et al., Effect of pioglitazone on pancreatic ?–cell function and diabetes risk in Hispanic women with prior gestational diabetes // Diabetes – 2006 – Vol.55 – P. 517–522
23. The Diabetes Prevention Program Research Group, Reduction in the incidence of type 2 diabetes in patients with lifestyle intervention or metformine // N Engl J Med – 2005 – Vol.346 – P. 393–403
24. Durbin R.J., Thiazolidinedinone therapy in the prevention/delay of type 2 diabetes in patients with impaired glucose tolerance and insulin resistance // Diabetes Obes Metab – 2004 – Vol. 6 – P. 280–285
25. Kahn S.E., Haffner S.M., Heise M.A. et al., Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy // N Engl J Med – 2006 – Vol. 355 – P.2427–2443
26. Jeon C.Y., Lokken R.P., Hu F.B., Van Dam B.M. Physical activity of moderate intensity and risk of type 2 diabetes // Diabetes Care – 2007 – Vol. 30 – P. 744–752
27. Olejnicka B.T., Andersson A., Tyrberg B. et al., Beta–cells, oxidative stress, lysosomal stability, and apoptotic/necrotic cell death // Antioxid Redox signal – 1999 – Vol. Vol. 1 – P. 305–315
28. Packer L., Obermuller–Jevic U.C., Vitamin E: An introduction // In: “The antioxidant vitamins C and E”, Eds. L.Packer, M.G.Traber, K.Kraemer, B.Frei, AOCS Press, Illinois, 2002, P 133–151
29. Skyrme Jones R.A., O’Brien R.C., Berry K.L., Meredith I.T., Vitamin E supplementation improves endothelial function in type I diabetes mellitus: a randomized, placebo–controlled study // J Am Coll Cardiol – 2000 – Vol. 36 – P. 94–102
30. Балаболкин М.И., Михайлова Е.В., Князева А.П., Панкова С.С., Влияние больших доз токоферола на процессы перекисного окисления липидов и секрецию инсулина у больных инсулиннезависимым сахарным диабетом // Прообл эндокринол – 1994 – №3 – С.10–12
31. Балаболкин М.И., Клебанова Е.М., Креминская В.М., Лечение сахарного диабета и его сосудистых осложнений (руководство для врачей) // Медицина – Москва – 2005 – Стр. 511












