–Т–≤–µ–і–µ–љ–Є–µ
–°–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В (–°–Ф) 2-–≥–Њ —В–Є–њ–∞ –Є –µ–≥–Њ –њ–Њ—З–µ—З–љ–Њ–µ –Љ–Є–Ї—А–Њ—Б–Њ—Б—Г–і–Є—Б—В–Њ–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ вАУ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П –љ–µ—Д—А–Њ–њ–∞—В–Є—П (–Ф–Э) —П–≤–ї—П—О—В—Б—П —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ї–∞—В–∞—Б—В—А–Њ—Д [1]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Є–Ј—Г—З–∞—О—Й–Є—Е –≤–ї–Є—П–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–µ –Є—Б—Е–Њ–і—Л, –Љ–µ—В—Д–Њ—А–Љ–Є–љ –њ–Њ–Ї–∞ —П–≤–ї—П–µ—В—Б—П –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ —Б—А–µ–і–Є –љ–Є—Е, —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–≤—И–Є–Љ –≤ –Ї—А—Г–њ–љ—Л—Е —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Г–Љ–µ–љ—М—И–∞—В—М —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Љ–∞–Ї—А–Њ—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –°–Ф 2-–≥–Њ —В–Є–њ–∞ [2, 3].–Я–ї–µ–є–Њ—В—А–Њ–њ–љ—Л–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–µ —Н—Д—Д–µ–Ї—В—Л –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –Њ—В—З–∞—Б—В–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –µ–≥–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —Г–Љ–µ–љ—М—И–∞—В—М –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М, –Є–Ј–±—Л—В–Њ—З–љ—Л–є –≤–µ—Б, –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є—О, —Г–ї—Г—З—И–∞—В—М —А–µ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ –Ї—А–Њ–≤–Є, –Њ—Б–ї–∞–±–ї—П—В—М –њ—А–Њ—П–≤–ї–µ–љ–Є—П —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Є –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞ [4]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –Њ–њ–Є—Б–∞–љ–љ—Л–Љ –љ–∞—А—Г—И–µ–љ–Є—П–Љ –Њ—В–≤–Њ–і–Є—В—Б—П –≤–∞–ґ–љ–∞—П —А–Њ–ї—М –Є –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Ф–Э [1, 4], –і–∞–љ–љ—Л–µ –Њ –≤–ї–Є—П–љ–Є–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –љ–∞ –њ–Њ—З–µ—З–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –њ—А–Є –°–Ф 2-–≥–Њ —В–Є–њ–∞ –љ–µ —Б—В–Њ–ї—М –Њ–і–љ–Њ–Ј–љ–∞—З–љ—Л. –Ґ–∞–Ї, –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Г–Љ–µ—А–µ–љ–љ–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–µ–є –њ–Њ—З–µ–Ї (–Ї–ї–Є—А–µ–љ—Б –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ < 60 –Љ–ї/–Љ–Є–љ) –±—Л–ї–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ–Њ –Є–Ј-–Ј–∞ –љ–µ–Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–≥–Њ –Љ–љ–µ–љ–Є—П –Њ–± —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –ї–∞–Ї—В–∞—В-–∞—Ж–Є–і–Њ–Ј–∞ [5]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Г—А–Њ–≤–љ–µ–Љ –Њ—Д–Є—Ж–Є–∞–ї—М–љ–Њ –і–Њ–њ—Г—Б—В–Є–Љ–Њ–≥–Њ –Ї–ї–Є—А–µ–љ—Б–∞ –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ –њ—А–Є –њ–µ—А–≤–Є—З–љ–Њ–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ —П–≤–ї—П–µ—В—Б—П вЙ• 45 –Љ–ї/–Љ–Є–љ [6].
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ —А–µ–Ј—Г–ї—М—В–∞—В—Л —А—П–і–∞ –Ї—А—Г–њ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –љ–∞ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Ф–Э –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –°–Ф 2-–≥–Њ —В–Є–њ–∞ –≤ –і–µ–±—О—В–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [7вАУ9], –≤ –њ–Њ—Б–ї–µ–і–љ–µ–µ –і–µ—Б—П—В–Є–ї–µ—В–Є–µ —Б—В–∞–ї–Є –њ–Њ—П–≤–ї—П—В—М—Б—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ –љ–∞–ї–Є—З–Є—П —Г –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –љ–µ—Д—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞ –Ј–∞ —Б—З–µ—В —Г–Љ–µ–љ—М—И–µ–љ–Є—П –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –≥–ї–Є–Ї–Њ- –Є –ї–Є–њ–Њ–Њ–Ї—Б–Є–і–∞—Ж–Є–Є –≤ –њ–Њ—З–µ—З–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А–∞—Е [10вАУ12]. –£—З–Є—В—Л–≤–∞—П –≤—Л—Б–Њ–Ї—Г—О —З–∞—Б—В–Њ—В—Г –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ—В–µ—А–∞–њ–Є–Є –њ—А–Є –°–Ф 2-–≥–Њ —В–Є–њ–∞ [1, 13], –≤–∞–ґ–љ–Њ –Њ—Ж–µ–љ–Є—В—М —Н—Д—Д–µ–Ї—В—Л –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–Њ—В–µ—А–∞–њ–Є–Є –Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –љ–∞ –њ–Њ—З–µ—З–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О, –≤ —В. —З. —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, –Ї–Њ—В–Њ—А—Л–µ –Љ–∞–ї–Њ –Ј–∞–≤–Є—Б—П—В –Њ—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Љ–∞—Б—Б—Л —В–µ–ї–∞, –Њ–ґ–Є–і–∞–µ–Љ–Њ–≥–Њ –љ–∞ —В–µ—А–∞–њ–Є–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ [2вАУ4, 7вАУ9].
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –Њ–і–Њ–±—А–µ–љ–Њ –ї–Њ–Ї–∞–ї—М–љ—Л–Љ —Н—В–Є—З–µ—Б–Ї–Є–Љ –Ї–Њ–Љ–Є—В–µ—В–Њ–Љ, –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –•–µ–ї—М—Б–Є–љ–Ї—Б–Ї–Њ–є –і–µ–Ї–ї–∞—А–∞—Ж–Є–µ–є. –Т—Б–µ —Г—З–∞—Б—В–љ–Є–Ї–Є –њ–Њ–і–њ–Є—Б—Л–≤–∞–ї–Є –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ.–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –Љ—Г–ґ—З–Є–љ—Л –Є –ґ–µ–љ—Й–Є–љ—Л –µ–≤—А–Њ–њ–µ–Њ–Є–і–љ–Њ–є —А–∞—Б—Л –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 45 –і–Њ 70 –ї–µ—В —Б –°–Ф 2-–≥–Њ —В–Є–њ–∞, –њ–Њ–ї—Г—З–∞—О—Й–Є–µ —В–µ—А–∞–њ–Є—О –Є–љ—Б—Г–ї–Є–љ–Њ–Љ (–≤ –±–∞–Ј–Є—Б-–±–Њ–ї—О—Б–љ–Њ–Љ –Є–ї–Є –±–∞–Ј–∞–ї-–њ–ї—О—Б —А–µ–ґ–Є–Љ–µ) –≤ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ –і–Њ 0,5 –µ–і/–Ї–≥ –Є —Б —Г—А–Њ–≤–љ–µ–Љ –≥–ї–Є–Ї–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ (HbA1c), –ї–Є–њ–Є–і–Њ–≤ –Ї—А–Њ–≤–Є –Є —Ж–Є—Д—А–∞–Љ–Є –Р–Ф –љ–µ –≤—Л—И–µ 10% –Њ—В –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е —Ж–µ–ї–µ–≤—Л—Е –Ј–љ–∞—З–µ–љ–Є–є, —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ —В—П–ґ–µ–ї—Л—Е –Љ–Є–Ї—А–Њ—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –°–Ъ–§ вЙ• 60 –Љ–ї/–Љ–Є–љ/1,73 –Љ2 –Є –∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є–µ–є < 200 –Љ–≥/–ї.
–Ъ—А–Є—В–µ—А–Є—П–Љ–Є –љ–µ–≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є: –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ, –≤—Е–Њ–і—П—Й–Є–Љ –≤ —Б–Њ—Б—В–∞–≤ —В–∞–±–ї–µ—В–Ї–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞, –ї–∞–Ї—В–∞—В-–∞—Ж–Є–і–Њ–Ј –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –њ–µ—З–µ–љ–Њ—З–љ–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П, –ї—О–±—Л–µ –Њ—Б—В—А—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П, –њ–µ—А–≤–Є—З–љ–Њ-–њ–Њ—З–µ—З–љ–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П –љ–µ–і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞, –∞–љ–µ–Љ–Є—П —Б—А–µ–і–љ–µ–є –Є —В—П–ґ–µ–ї–Њ–є —Б—В–µ–њ–µ–љ–Є, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–µ—Д—А–Њ—В–Њ–Ї—Б–Є—З–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ–µ–љ–µ–µ —З–µ–Љ –Ј–∞ 6 –Љ–µ—Б. –і–Њ –љ–∞—З–∞–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —А–µ–≥—Г–ї—П—А–љ—Л–є –њ—А–Є–µ–Љ –Э–Я–Т–Я, —В—П–ґ–µ–ї–∞—П —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–∞—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П, —Б–Є—Б—В–µ–Љ–љ—Л–µ –Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —В–µ—А–∞–њ–Є—П –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Њ—А–∞–Љ–Є.
–£—З–∞—Б—В–љ–Є–Ї–∞–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є –і–∞–љ—Л —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ —Б–Њ–±–ї—О–і–µ–љ–Є—О –њ—А–µ–ґ–љ–µ–≥–Њ –≤–Њ–і–љ–Њ-—Б–Њ–ї–µ–≤–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞ –Є —А–µ–ґ–Є–Љ–∞ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤–Ї–ї—О—З–∞–ї–Њ –∞–љ–∞–ї–Є–Ј –ґ–∞–ї–Њ–± –Є –Є—Б—В–Њ—А–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Њ—Б–Љ–Њ—В—А, –Є–Ј–Љ–µ—А–µ–љ–Є–µ –Р–Ф, —В–Њ—Й–∞–Ї–Њ–≤–Њ–≥–Њ –Є –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л –Ї—А–Њ–≤–Є, —А–∞—Б—З–µ—В –Є–љ–і–µ–Ї—Б–∞ –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ш–Ь–Ґ).
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 46 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ф 2-–≥–Њ —В–Є–њ–∞, —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–Є 1:1 –њ–Њ–ї—Г—З–∞—В—М –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Ї –Є–љ—Б—Г–ї–Є–љ—Г —В–µ—А–∞–њ–Є—О –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ –≤ –і–Њ–Ј–µ 1500 –Љ–≥/—Б—Г—В –Є–ї–Є –њ—А–Њ–і–Њ–ї–ґ–∞—В—М –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О –Є–љ—Б—Г–ї–Є–љ–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і—Г—О—Й–Є—Е 6 –Љ–µ—Б.
–Х–ґ–µ–Љ–µ—Б—П—З–љ–Њ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї—Б—П —В–µ–ї–µ—Д–Њ–љ–љ—Л–є –Њ–њ—А–Њ—Б –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –Ї–Њ—А—А–µ–Ї—Ж–Є—П –і–Њ–Ј –Є —А–µ–ґ–Є–Љ–∞ –≤–≤–µ–і–µ–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–∞. –Т —В–µ—З–µ–љ–Є–µ —Н—В–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –±—Л–ї–∞ –Њ—Ж–µ–љ–µ–љ–∞ –і–Є–љ–∞–Љ–Є–Ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞: —В–Њ—Й–∞–Ї–Њ–≤–∞—П –Є –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–∞—П –≥–ї–Є–Ї–µ–Љ–Є—П, HbA1c (—Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Т–≠–Ц–• –љ–∞ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–µ Bio Rad d10 (–°–®–Р)). –§–Є–Ї—Б–Є—А–Њ–≤–∞–ї–Є—Б—М —З–∞—Б—В–Њ—В–∞ —А–∞–Ј–≤–Є—В–Є—П –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є—Е —Н–њ–Є–Ј–Њ–і–Њ–≤ (—Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є –Є/–Є–ї–Є –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –≥–ї–Є–Ї–µ–Љ–Є–Є <3,9 –Љ–Љ–Њ–ї—М/–ї) –Є –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –і–Њ–Ј—Л –Є–љ—Б—Г–ї–Є–љ–∞. –Ю—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –і–Є–љ–∞–Љ–Є–Ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ (–Њ–±—Й–Є–є —Е–Њ–ї–µ—Б—В–µ—А–Є–љ, —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і—Л), —Ж–Є—Б—В–∞—В–Є–љ –° –Є –Ї—А–µ–∞—В–Є–љ–Є–љ —Б—Л–≤–Њ—А–Њ—В–Ї–Є, —Г—А–Њ–≤–љ–Є –∞–ї—М–±—Г–Љ–Є–љ–∞ –Є –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ –≤ —Г—В—А–µ–љ–љ–µ–є –њ–Њ—А—Ж–Є–Є –Љ–Њ—З–Є (—Б —А–∞—Б—З–µ—В–Њ–Љ –∞–ї—М–±—Г–Љ–Є–љ-–Ї—А–µ–∞—В–Є–љ–Є–љ–Њ–≤–Њ–≥–Њ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П (–Р–Ъ–°)), –Њ–њ—А–µ–і–µ–ї—П–µ–Љ—Л—Е —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —А–µ–∞–Ї—В–Є–≤–Њ–≤ –Є –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–∞ Cobas Integra 400 plus —Д–Є—А–Љ—Л Roch–µ (–У–µ—А–Љ–∞–љ–Є—П). –Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є—Б—М –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —А–°–Ъ–§ –њ–Њ –Ї—А–µ–∞—В–Є–љ–Є–љ—Г (—А–°–Ъ–§–Ї—А) –њ–Њ —Д–Њ—А–Љ—Г–ї–µ –Ъ–Њ–Ї—А–Њ—Д—В–∞ вАУ –У–Њ–ї—В–∞ [6, 14], —А–°–Ъ–§–Ї—А –Є —А–°–Ъ–§ –њ–Њ —Ж–Є—Б—В–∞—В–Є–љ—Г –° (—А–°–Ъ–§—Ж–Є—Б) –њ–Њ —Д–Њ—А–Љ—Г–ї–µ CKD-EPI [15].
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–∞–Ї–µ—В–Њ–≤ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ–≥—А–∞–Љ–Љ Statistica 6.0 (StatSoft, –°–®–Р) –Є SPSS 20.0 (SPSS Inc., –°–®–Р) —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е —В–µ—Б—В–Њ–≤ (–£–Є–ї–Ї–Њ–Ї—Б–Њ–љ–∞, –Ь–∞–љ–љ–∞ вАУ –£–Є—В–љ–Є); –і–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –Ї—А–Є—В–µ—А–Є–є ѕЗ2; —Б–≤—П–Ј—М –і–Є–љ–∞–Љ–Є–Ї–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В–∞ —А–∞–љ–≥–Њ–≤–Њ–є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –°–њ–Є—А–Љ–µ–љ–∞. –Ч–љ–∞—З–Є–Љ—Л–Љ–Є —Б—З–Є—В–∞–ї–Є—Б—М —А–∞–Ј–ї–Є—З–Є—П –њ—А–Є —Г—А–Њ–≤–љ–µ —А < 0,05.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Є—Е –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
43 –њ–∞—Ж–Є–µ–љ—В–∞ –Ј–∞–≤–µ—А—И–Є–ї–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ (21 вАУ –≤ –≥—А—Г–њ–њ–µ —В–µ—А–∞–њ–Є–Є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ (–Ш–У) –Є 22 вАУ –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ –Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ (–Ь–Ш–У)).–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л—Е –≥—А—Г–њ–њ
–°—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л–µ –≥—А—Г–њ–њ—Л –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –њ–Њ –њ–Њ–ї–Њ–≤–Њ–Ј—А–∞—Б—В–љ—Л–Љ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ –Є –∞–љ—В—А–Њ–њ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ: –≤ –≥—А—Г–њ–њ–µ –Ш–У —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤, 42,9% –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П–ї–Є—Б—М –Љ—Г–ґ—З–Є–љ–∞–Љ–Є, —Б–Њ—Б—В–∞–≤–Є–ї 60,05¬±6,13 –≥–Њ–і–∞, –Ш–Ь–Ґ вАУ 31,6¬±4,3 –Ї–≥/–Љ2, –≤ –≥—А—Г–њ–њ–µ –Ь–Ш–У вАУ 45,5% (—А = 0,86), 60,14¬±5,95 –≥–Њ–і–∞ (—А = 0,75) –Є 32,0¬±3,1 –Ї–≥/–Љ2 (—А = 0,59), —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –°—В–∞–ґ –°–Ф 2-–≥–Њ —В–Є–њ–∞ c –Љ–Њ–Љ–µ–љ—В–∞ –≤—Л—П–≤–ї–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–Є–ї 10 –ї–µ—В (–≤ –Ш–У вАУ 10,52¬±4,84 –≥–Њ–і–∞, –≤ –Ь–Ш–У вАУ 9,7¬±3,6 –≥–Њ–і–∞, —А = 0,35). –Р–±—Б–Њ–ї—О—В–љ–Њ–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї–∞ –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П (–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–Є–ї–∞ –Њ–Ї–Њ–ї–Њ 70% –≤ –Њ–±–µ–Є—Е —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л—Е –≥—А—Г–њ–њ–∞—Е), –њ–Њ–ї—Г—З–∞–ї–Є —А–∞–Ј–ї–Є—З–љ—Л–µ –≥—А—Г–њ–њ—Л –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ —А–µ–љ–Є–љ-–∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ-–∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л (–≤ –≥—А—Г–њ–њ–µ –Ш–У вАУ 76,2% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є вАУ 63,6%, —А = 0,37). –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б –Ф–Э –≤ —Б—В–∞–і–Є–Є –∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є–Є (–•–С–Я, —Б—В–∞–і–Є—П –Р2), —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А–Њ–є –≤ –≥—А—Г–њ–њ–µ —В–µ—А–∞–њ–Є–Є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ –±—Л–ї–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≤—Л—И–µ (–≤ –Ш–У вАУ 57,1%, –≤ –Ь–Ш–У вАУ 42,9%, —А = 0,88), –њ–Њ–ї—Г—З–∞–ї–Є –љ–µ—Д—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Г—О —В–µ—А–∞–њ–Є—О –Є–Р–Я–§ –Є–ї–Є —Б–∞—А—В–∞–љ–∞–Љ–Є. –Ш–Ј –і—А—Г–≥–Є—Е —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –°–Ф 2-–≥–Њ —В–Є–њ–∞ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Л—П–≤–ї—П–ї–∞—Б—М –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П –і–Є—Б—В–∞–ї—М–љ–∞—П –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є—П –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є (–≤ –Ш–У вАУ —Г 81,0%, –≤ –Ь–Ш–У вАУ —Г 77,3% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —А = 0,77). –Э–µ–њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ–∞—П —Б—В–∞–і–Є—П –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —А–µ—В–Є–љ–Њ–њ–∞—В–Є–Є –±—Л–ї–∞ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –≤ 38,1% —Б–ї—Г—З–∞–µ–≤ –≤ –≥—А—Г–њ–њ–µ –Ш–У –Є –≤ 31,8% вАУ –≤ –≥—А—Г–њ–њ–µ –Ь–Ш–У, —А=0,69. –°–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–µ —Б–Њ–±—Л—В–Є—П –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, —В–∞–Ї–Є–µ –Ї–∞–Ї —Б—В–∞–±–Є–ї—М–љ–∞—П —Б—В–µ–љ–Њ–Ї–∞—А–і–Є—П –і–Њ II —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞, –±–Њ–ї–µ–µ 6 –Љ–µ—Б. –љ–∞–Ј–∞–і –њ–µ—А–µ–љ–µ—Б–µ–љ–љ—Л–µ –Ю–Ъ–°, –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞, –Ю–Э–Ь–Ъ, –∞ —В–∞–Ї–ґ–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј –Љ–∞–≥–Є—Б—В—А–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є–є –±–µ–Ј –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —Б—В–µ–љ–Њ–Ј–Њ–≤ –Є —В. –њ., —В–∞–Ї–ґ–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —З–∞—Й–µ –≤—Л—П–≤–ї—П–ї–Є—Б—М –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–Њ–і–Њ–ї–ґ–∞—В—М –Є–љ—Б—Г–ї–Є–љ–Њ—В–µ—А–∞–њ–Є—О (52,4% –њ—А–Њ—В–Є–≤ 45,5% –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, —А = 0,65). –Я–Њ—З—В–Є –≤—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б –∞–љ–∞–Љ–љ–µ–Ј–Њ–Љ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –њ–Њ–ї—Г—З–∞–ї–Є —В–µ—А–∞–њ–Є—О —Б—В–∞—В–Є–љ–∞–Љ–Є. –Ъ—Г—А–Є–ї—М—Й–Є–Ї–Є —В–∞–Ї–ґ–µ –њ—А–µ–Њ–±–ї–∞–і–∞–ї–Є –≤ –≥—А—Г–њ–њ–µ –Ш–У (33,3%) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –Ь–Ш–У (22,7%, —А = 0,44).
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –≤ —Ж–µ–ї–Њ–Љ –љ–µ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–∞—В —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –њ—А–Њ–≤–Њ–і–Є–Љ—Л—Е —Б–Ї—А–Є–љ–Є–љ–≥–Њ–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤ –†–§, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є—Е –Њ –љ–∞–Є–±–Њ–ї—М—И–µ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ф 2-–≥–Њ —В–Є–њ–∞ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є, –њ—А–Є—З–µ–Љ —Г–ґ–µ –љ–∞ —Б—В–∞–і–Є–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —Н–Ї—Б–Ї—А–µ—Ж–Є–Є –∞–ї—М–±—Г–Љ–Є–љ–∞ —Б –Љ–Њ—З–Њ–є, –Є –≤—Л—Б–Њ–Ї–Њ–Љ –њ—А–Њ—Ж–µ–љ—В–µ –≤—Л—П–≤–ї–µ–љ–Є—П —Б—В–∞–і–Є–Є –Љ–Є–Ї—А–Њ–∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є–Є (–і–Њ 40%) –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –°–Ф 2-–≥–Њ —В–Є–њ–∞ –љ–µ –Љ–µ–љ–µ–µ 10 –ї–µ—В [1]. –°—В–Њ–Є—В —В–∞–Ї–ґ–µ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є–µ–є > 20 –Љ–≥/–ї –Є–Љ–µ–ї–Є –Љ–Є–Ї—А–Њ—Б–Њ—Б—Г–і–Є—Б—В—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –љ–∞ –≥–ї–∞–Ј–љ–Њ–Љ –і–љ–µ, —З—В–Њ –Ї–Њ—Б–≤–µ–љ–љ–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–Љ –≥–µ–љ–µ–Ј–µ –њ–Њ—З–µ—З–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, –њ–Њ–і—В–≤–µ—А–ґ–і–∞—П —Б–Є—Б—В–µ–Љ–љ–Њ—Б—В—М –њ–Њ—А–∞–ґ–µ–љ–Є—П –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–≥–Њ —А—Г—Б–ї–∞ –њ—А–Є –°–Ф 2-–≥–Њ —В–Є–њ–∞ [1].
–Ф–Є–љ–∞–Љ–Є–Ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є —Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞
–°—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л–µ –≥—А—Г–њ–њ—Л –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –њ–Њ –Њ—Б–љ–Њ–≤–љ—Л–Љ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–Љ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–є —Б—В–∞—В—Г—Б –Є —Б–Њ—Б—В–Њ—П–љ–Є–µ —Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ (—В–∞–±–ї. 1). –Т –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Њ–±—Й–µ–≥–Њ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ (–Ю–•) –Є —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ (–Ґ–У) –Њ—В–Љ–µ—З–∞–ї–Є—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞–љ–∞–Љ–љ–µ–Ј–Њ–Љ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –і–∞–љ–љ–∞—П –Ї–Њ–≥–Њ—А—В–∞ –Є–Љ–µ–ї–∞ –±–Њ–ї–µ–µ –ґ–µ—Б—В–Ї–Є–µ –Ї—А–Є—В–µ—А–Є–Є —Ж–µ–ї–µ–≤—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –ї–Є–њ–Є–і–Њ–≥—А–∞–Љ–Љ—Л –Є –њ–Њ–ї—Г—З–∞–ї–∞ –ї–Є–њ–Є–і—Б–љ–Є–ґ–∞—О—Й—Г—О —В–µ—А–∞–њ–Є—О.
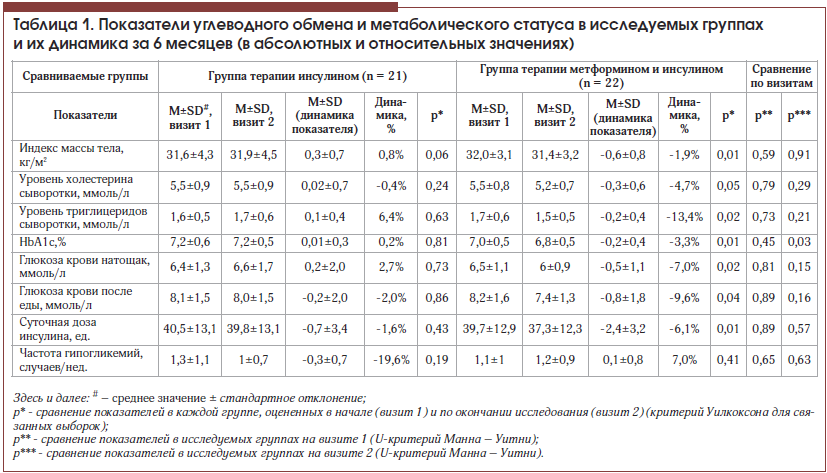
–Т —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤ –≥—А—Г–њ–њ—Г –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є—П –њ—А–µ–ґ–љ–µ–є —В–µ—А–∞–њ–Є–Є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ (–Ш–У), –љ–µ –њ—А–Њ–Є–Ј–Њ—И–ї–Њ –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ—Ж–µ–љ–Є–≤–∞–µ–Љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –Ї–Њ—А—А–µ–Ї—Ж–Є—П —А–µ–ґ–Є–Љ–∞ –≤–≤–µ–і–µ–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–∞ –і–∞–ґ–µ –≤ –њ—А–µ–і–µ–ї–∞—Е –њ—А–µ–ґ–љ–µ–є –і–Њ–Ј—Л –±–µ–Ј —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –µ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П (—Б–љ–Є–ґ–µ–љ–Є–µ –љ–∞ 1,6¬±7,8%, —А = 0,43) –њ—А–Є–≤–µ–ї–∞ –Ї —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–Љ—Г —Б–Њ–Ї—А–∞—Й–µ–љ–Є—О —З–∞—Б—В–Њ—В—Л –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є—Е —Н–њ–Є–Ј–Њ–і–Њ–≤ –њ–Њ—З—В–Є –љ–∞ 20%, –Ї–Њ—В–Њ—А–Њ–µ, –Њ–і–љ–∞–Ї–Њ, –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –љ–µ–Ј–љ–∞—З–Є–Љ—Л–Љ. –≠—В–Є –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –≤–∞–ґ–љ–Њ—Б—В–Є —З–∞—Б—В–Њ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–∞ –Є –њ–∞—Ж–Є–µ–љ—В–∞ —Б –°–Ф 2-–≥–Њ —В–Є–њ–∞ –і–∞–ґ–µ –њ—А–Є –њ–Њ–і–Њ–±—А–∞–љ–љ–Њ–є –і–Њ–Ј–µ –Є–љ—Б—Г–ї–Є–љ–∞, –∞ —В–∞–Ї–ґ–µ –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В —В–Њ—В —Д–∞–Ї—В, —З—В–Њ —А–µ–ґ–Є–Љ –≤–≤–µ–і–µ–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ—В–µ—А–∞–њ–Є–Є (—А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –і–Њ–Ј –≤ —В–µ—З–µ–љ–Є–µ —Б—Г—В–Њ–Ї, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤—Л–і–µ—А–ґ–Є–≤–∞–љ–Є—П —А–∞–Ј–љ—Л—Е –њ–Њ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є–љ—В–µ—А–≤–∞–ї–Њ–≤ –њ–µ—А–µ–і –µ–і–Њ–є –њ–Њ—Б–ї–µ –≤–≤–µ–і–µ–љ–Є—П –Ї–Њ—А–Њ—В–Ї–Є—Е/—Г–ї—М—В—А–∞–Ї–Њ—А–Њ—В–Ї–Є—Е –Є–љ—Б—Г–ї–Є–љ–Њ–≤ –Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Г—А–Њ–≤–љ—П –≥–ї–Є–Ї–µ–Љ–Є–Є, —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ —З–∞—Б—В–Њ–є —Б–Љ–µ–љ–µ –Љ–µ—Б—В –≤–≤–µ–і–µ–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–∞ –Є —В. –њ.), –∞ –љ–µ —В–Њ–ї—М–Ї–Њ –і–Њ–Ј–∞ –Є–љ—Б—Г–ї–Є–љ–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –і–Њ—Б—В–Є–ґ–µ–љ–Є—О –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Т –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–Љ –Ї –Є–љ—Б—Г–ї–Є–љ–Њ—В–µ—А–∞–њ–Є–Є –±—Л–ї –і–Њ–±–∞–≤–ї–µ–љ –Љ–µ—В—Д–Њ—А–Љ–Є–љ (–Ь–Ш–У), –њ—А–Њ–Є–Ј–Њ—И–ї–Њ –Ј–љ–∞—З–Є–Љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞, —Г—А–Њ–≤–љ—П –Ґ–У, –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≥–ї–Є–Ї–µ–Љ–Є–Є –Є –≥–ї–Є–Ї–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –њ—А–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –Є–љ—Б—Г–ї–Є–љ–µ (—В–∞–±–ї. 1). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –±–ї–Є–Ј–Ї–Є–Љ –Ї –Ј–љ–∞—З–Є–Љ–Њ–Љ—Г –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ю–•. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В –Є–Ј–≤–µ—Б—В–љ—Л–µ –њ–Њ–Ј–Є—В–Є–≤–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ—А–µ–Њ–і–Њ–ї–µ–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є, –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Њ–ґ–Є—А–µ–љ–Є—П –Є –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є–Є, –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л–µ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ [3, 8, 9, 16вАУ18].
–Ф–Є–љ–∞–Љ–Є–Ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ–Њ—З–µ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї –Є –і–Є–љ–∞–Љ–Є–Ї–Є –Р–Ф –њ—А–Є–≤–µ–і–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 2. –°—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л–µ –≥—А—Г–њ–њ—Л –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –њ–Њ —Г—А–Њ–≤–љ—П–Љ –Ј–љ–∞—З–µ–љ–Є–є –Њ—Б–љ–Њ–≤–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ–Њ—З–µ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є, –Њ—Ж–µ–љ–Є–≤–∞–µ–Љ—Л—Е –≤ —А—Г—В–Є–љ–љ–Њ–є –і–Є–∞–±–µ—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. –Ь–µ–ґ–і—Г —В–µ–Љ –≤–љ—Г—В—А–Є –≥—А—Г–њ–њ—Л –Њ–±—А–∞—Й–∞–ї–∞ –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ –Ј–љ–∞—З–Є–Љ–∞—П —А–∞–Ј–љ–Є—Ж–∞, –≤—Л—П–≤–ї–µ–љ–љ–∞—П –њ—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –°–Ъ–§, —А–∞—Б—Б—З–Є—В–∞–љ–љ–Њ–є —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Љ–µ—В–Њ–і–Є–Ї–∞–Љ–Є вАУ –њ–Њ –Ї—А–µ–∞—В–Є–љ–Є–љ—Г –Є —Ж–Є—Б—В–∞—В–Є–љ—Г –°. –≠—В–Њ —Б–Њ–≥–ї–∞—Б—Г–µ—В—Б—П —Б –Є–Љ–µ—О—Й–Є–Љ–Є—Б—П –ї–Є—В–µ—А–∞—В—Г—А–љ—Л–Љ–Є –і–∞–љ–љ—Л–Љ–Є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Г—А–Њ–≤–µ–љ—М —Ж–Є—Б—В–∞—В–Є–љ–∞ –° –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —Г—А–Њ–≤–љ–µ–Љ –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ —П–≤–ї—П–µ—В—Б—П –±–Њ–ї–µ–µ –љ–∞–і–µ–ґ–љ—Л–Љ –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ–і–Є–Ї–∞—В–Њ—А–Њ–Љ –љ–∞—А—Г—И–µ–љ–Є—П —Д–Є–ї—М—В—А–∞—Ж–Є–Њ–љ–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –њ–Њ—З–µ–Ї, –Ј–љ–∞—З–Є–Љ–Њ –љ–µ –Ј–∞–≤–Є—Б—П—Й–Є–Љ –Њ—В —А–∞—Б—Л, –њ–Њ–ї–Њ-–≤–Њ–Ј—А–∞—Б—В–љ—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї, –Њ–±—К–µ–Љ–∞ –Љ—Л—И–µ—З–љ–Њ–є –Љ–∞—Б—Б—Л, —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –њ–Є—В–∞–љ–Є—П [19].
–Т –≥—А—Г–њ–њ–µ —В–µ—А–∞–њ–Є–Є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –Њ—Ж–µ–љ–Є–≤–∞–µ–Љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ј–љ–∞—З–Є–Љ–Њ –љ–µ –Є–Ј–Љ–µ–љ–Є–ї–Є—Б—М (—В–∞–±–ї. 2). –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ј–∞ 6 –Љ–µ—Б. –њ—А–Њ–Є–Ј–Њ—И–ї–Њ –±–ї–Є–Ј–Ї–Њ–µ –Ї –Ј–љ–∞—З–Є–Љ–Њ–Љ—Г –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ –љ–∞ 2,3¬±5,9% (—А = 0,07), —З—В–Њ –љ–∞—И–ї–Њ –Њ—В—А–∞–ґ–µ–љ–Є–µ –≤ –Ј–љ–∞—З–Є–Љ–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–Є —А–°–Ъ–§–Ї—А, —А–∞—Б—Б—З–Є—В–∞–љ–љ–Њ–є –њ–Њ —Д–Њ—А–Љ—Г–ї–µ –Ъ–Њ–Ї—А–Њ—Д—В–∞ вАУ –У–Њ–ї—В–∞ (-4,3¬±8,5%, —А = 0,024). –Ю–і–љ–∞–Ї–Њ —Б—В–Њ–Є—В –љ–∞–њ–Њ–Љ–љ–Є—В—М, —З—В–Њ –≤ —Н—В–Њ–є –≥—А—Г–њ–њ–µ –њ—А–Њ–Є–Ј–Њ—И–ї–Њ –Ј–љ–∞—З–Є–Љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–љ–∞ -1,8¬±2,3 –Ї–≥, —А=0,0028), –≤—Е–Њ–і—П—Й–µ–≥–Њ –≤ —А–∞—Б—З–µ—В–љ—Г—О —Д–Њ—А–Љ—Г–ї—Г, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ—Г—О –Ф. –Ъ–Њ–Ї—А–Њ—Д—В–Њ–Љ –Є –У. –У–Њ–ї—В–Њ–Љ –≤ 1976 –≥. [14]. –≠—В–Њ –њ–Њ–і—В–≤–µ—А–і–Є–ї –Є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј, –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–≤—И–Є–є —З–µ—В–Ї—Г—О —Б–≤—П–Ј—М –і–Є–љ–∞–Љ–Є–Ї–Є —А–°–Ъ–§–Ї—А (–њ–Њ –Ъ–Њ–Ї—А–Њ—Д—В—Г вАУ –У–Њ–ї—В—Г) –Є –і–Є–љ–∞–Љ–Є–Ї–Є –Љ–∞—Б—Б—Л —В–µ–ї–∞ (r=0,61, p=0,0068). –Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –Љ–Њ–Љ–µ–љ—В—Г —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ –і–∞–љ–љ–∞—П —Д–Њ—А–Љ—Г–ї–∞ –љ–∞–Є–±–Њ–ї–µ–µ —В–Њ—З–љ–Њ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б –Ї–ї–Є—А–µ–љ—Б–Њ–≤—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –°–Ъ–§ —В–Њ–ї—М–Ї–Њ –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ —Б–љ–Є–ґ–µ–љ–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –њ–Њ—З–µ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є [14, 19]. –Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ, —З—В–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –°–Ъ–§ –љ–µ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Б—З–Є—В–∞—О—Й–µ–є—Б—П –±–Њ–ї–µ–µ —В–Њ—З–љ–Њ–є —Д–Њ—А–Љ—Г–ї—Л CKD-EPI —А–°–Ъ–§—Ж–Є—Б [15]. –Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Ж–Є—Б—В–∞—В–Є–љ–∞ –° –Њ—Б–Њ–±–µ–љ–љ–Њ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ—А–Є —Г–Љ–µ—А–µ–љ–љ–Њ —Б–љ–Є–ґ–µ–љ–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є—П—Е –°–Ъ–§ (–Њ—В 45 –і–Њ 60 –Љ–ї/–Љ–Є–љ), –Ї–Њ–≥–і–∞ –Њ—В—Б—Г—В—Б—В–≤—Г—О—В –і—А—Г–≥–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–Њ—З–µ–Ї [19].
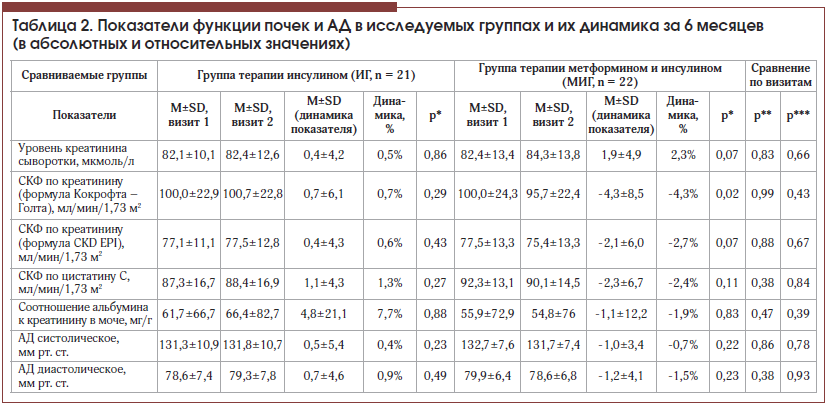
–Т –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –і–Њ–±–∞–≤–ї–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ –љ–∞ —А–°–Ъ–§ –њ–Њ —Ж–Є—Б—В–∞—В–Є–љ—Г –° –Є –∞–ї—М–±—Г–Љ–Є–љ-–Ї—А–µ–∞—В–Є–љ–Є–љ–Њ–≤–Њ–µ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–µ–Ј–љ–∞—З–Є–Љ—Л–Љ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –≤–ї–Є—П–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ –і–Є–љ–∞–Љ–Є–Ї—Г –Ї–∞–Ї —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ, —В–∞–Ї –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф –Ј–∞ 6 –Љ–µ—Б. –љ–∞–±–ї—О–і–µ–љ–Є—П, –Њ–і–љ–∞–Ї–Њ –Њ–±–∞ —Н—В–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П —Б–љ–Є–Ј–Є–ї–Є—Б—М —В–Њ–ї—М–Ї–Њ –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Т —А—П–і–µ –Ї—А—Г–њ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —В–∞–Ї–ґ–µ –Њ—Ж–µ–љ–Є–≤–∞–ї—Б—П —Н—Д—Д–µ–Ї—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –њ–Њ—З–µ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є. –Ґ–∞–Ї, –∞–љ–∞–ї–Є–Ј —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ 5-–ї–µ—В–љ–µ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –Ј–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є —Б –°–Ф 2-–≥–Њ —В–Є–њ–∞ —Б —Г–Љ–µ—А–µ–љ–љ—Л–Љ –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, —Г—З–∞—Б—В–≤—Г—О—Й–Є–Љ–Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є ADOPT, 1454 –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –њ–Њ–ї—Г—З–∞—В—М –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—В–∞—А—В–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ –≤ –і–Њ–Ј–µ 2000 –Љ–≥/—Б—Г—В, –љ–µ –њ–Њ–Ї–∞–Ј–∞–ї –Ј–љ–∞—З–Є–Љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–µ—А–∞–њ–Є–µ–є —А–Њ—Б–Є–≥–ї–Є—В–∞–Ј–Њ–љ–Њ–Љ, –Ј–∞–Љ–µ–і–ї—П—В—М —Б–љ–Є–ґ–µ–љ–Є–µ –°–Ъ–§ (—А–∞—Б—Б—З–Є—В–∞–љ–љ–Њ–є –њ–Њ —Д–Њ—А–Љ—Г–ї–µ MDRD) –Є–ї–Є –љ–∞—А–∞—Б—В–∞–љ–Є–µ –∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є–Є, –Ї–Њ—В–Њ—А–∞—П –љ–∞ –Љ–Њ–Љ–µ–љ—В –љ–∞—З–∞–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤—Л—П–≤–ї—П–ї–∞—Б—М –њ–Њ—З—В–Є –≤ 20% —Б–ї—Г—З–∞–µ–≤ [8]. –°—Е–Њ–ґ–Є–µ –і–∞–љ–љ—Л–µ –њ–Њ–ї—Г—З–µ–љ—Л –≤ —Е–Њ–і–µ –∞–љ–∞–ї–Є–Ј–∞ 10-–ї–µ—В–љ–µ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г—З–∞—Б—В–≤–Њ–≤–∞–≤—И–Є—Е –≤ UKPDS: –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ —Г—А–Њ–≤–µ–љ—М –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ –Є –∞–ї—М–±—Г–Љ–Є–љ-–Ї—А–µ–∞—В–Є–љ–Є–љ–Њ–≤–Њ–µ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Љ–Њ–љ–Њ–і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–µ–є [7]. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –≤ —Н—В–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –Є —Г—Е—Г–і—И–µ–љ–Є–µ –њ–Њ—З–µ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –љ–∞ —В–µ—А–∞–њ–Є–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ. –Т —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –і–∞–љ–љ—Л—Е –±–Њ–ї–µ–µ 60 —В—Л—Б. –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї—Г—О –±–∞–Ј—Г –і–∞–љ–љ—Л—Е –≤–µ—В–µ—А–∞–љ–Њ–≤, –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ —В–µ—А–∞–њ–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—В–∞—А—В–Њ–≤–Њ–≥–Њ —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–µ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≥—А—Г–њ–њ—Л —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л, –љ–µ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–∞ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ–Є —А–Є—Б–Ї–∞–Љ–Є —Б–љ–Є–ґ–µ–љ–Є—П –°–Ъ–§ –Є/–Є–ї–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —В–µ—А–Љ–Є–љ–∞–ї—М–љ–Њ–є —Б—В–∞–і–Є–Є –•–Я–Э [9]. –Р –≤ –љ–µ–±–Њ–ї—М—И–Њ–Љ –њ–Њ –Њ–±—К–µ–Љ—Г –≤—Л–±–Њ—А–Ї–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Amador вАУ Licona et al. –і–∞–ґ–µ –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞, –љ–∞–Ј–љ–∞—З–µ–љ–љ–Њ–≥–Њ –≤ —Б—Г–±–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –і–Њ–Ј–µ –љ–∞ 12 –љ–µ–і. –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–∞, –Ј–љ–∞—З–Є–Љ–Њ —Б–љ–Є–ґ–∞—В—М –∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є—О [20]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є —Б–≤—П–Ј–∞–ї–Є –љ–∞–±–ї—О–і–∞–µ–Љ—Л–є —Н—Д—Д–µ–Ї—В —Б –њ–Њ–Ј–Є—В–Є–≤–љ—Л–Љ –≤–ї–Є—П–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–є —Б—В–∞—В—Г—Б –Є —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Р–Ф, –Њ—В–Љ–µ—З–µ–љ–љ—Л–Љ –≤ –≥—А—Г–њ–њ–µ —В–µ—А–∞–њ–Є–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ.
–Т –љ–∞—И–µ–є —А–∞–±–Њ—В–µ —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –і–Њ–±–∞–≤–ї–µ–љ–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≤–µ—Б–∞, –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≥–ї–Є–Ї–µ–Љ–Є–Є –Є –ї–Є–њ–Є–і–Њ–≥—А–∞–Љ–Љ—Л. –Э–Њ, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –≤—Л—И–µ—Г–њ–Њ–Љ—П–љ—Г—В—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–µ–њ–∞—А–∞—В –њ—А–Є–Љ–µ–љ—П–ї–Є –њ–∞—Ж–Є–µ–љ—В—Л —Б –°–Ф 2-–≥–Њ —В–Є–њ–∞ –љ–∞ –Є–љ—Б—Г–ї–Є–љ–Њ—В–µ—А–∞–њ–Є–Є, –Љ–љ–Њ–≥–Є–Љ –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –Њ–љ–∞ –љ–∞–Ј–љ–∞—З–∞–ї–∞—Б—М –њ–Њ—Б–ї–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б—В–∞–ґ–∞ –њ—А–Є–µ–Љ–∞ –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є–ї–Є –љ–∞ —Д–Њ–љ–µ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Њ—Б—В—А—Л—Е —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є (–Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞, –Ю–Э–Ь–Ъ –Є —В. –њ.). –Т —Б—Е–Њ–ґ–µ–Љ –њ–Њ –і–Є–Ј–∞–є–љ—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є D–µ Jager et al. —Б —Г—З–∞—Б—В–Є–µ–Љ 353 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ф 2-–≥–Њ —В–Є–њ–∞ –љ–∞ –Є–љ—Б—Г–ї–Є–љ–Њ—В–µ—А–∞–њ–Є–Є, —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–Њ–і–Њ–ї–ґ–∞—В—М –µ–µ –Є–ї–Є –њ–Њ–ї—Г—З–∞—В—М –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Љ–µ—В—Д–Њ—А–Љ–Є–љ –≤ –і–Њ–Ј–µ 2550 –Љ–≥/—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 4 –Љ–µ—Б., –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї–Њ—Б—М –≤–ї–Є—П–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ –Љ–∞—А–Ї–µ—А—Л —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Є —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П [21]. –Ю–±—А–∞—Й–∞–ї–Њ –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ, —З—В–Њ –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≥–ї–Є–Ї–µ–Љ–Є–Є, —Г–ї—Г—З—И–µ–љ–Є–µ –≤ –ї–Є–њ–Є–і–Њ–≥—А–∞–Љ–Љ–µ –Є —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –Є–љ—Б—Г–ї–Є–љ–µ, –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –±–ї–Є–Ј–Ї–Њ–µ –Ї –Ј–љ–∞—З–Є–Љ–Њ–Љ—Г –њ–Њ–≤—Л—И–µ–љ–Є–µ –∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є–Є –Ј–∞ –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П (–љ–∞ 21%, —А = 0,06). –Ю–і–љ–∞–Ї–Њ, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –љ–∞—И–µ–є —А–∞–±–Њ—В—Л, –≤ –і–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –њ–∞—Ж–Є–µ–љ—В—Л —Б –љ–µ—Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ—Л–Љ –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –≥–ї–Є–Ї–µ–Љ–Є–Є (—В–Њ—Й–∞–Ї–Њ–≤–∞—П –≥–ї–Є–Ї–µ–Љ–Є—П > 10 –Љ–Љ–Њ–ї—М/–ї), –Є–Љ–µ—О—Й–Є–µ –њ–ї–Њ—Е–Њ —Б–Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞–љ–љ—Г—О –∞—А—В–µ—А–Є–∞–ї—М–љ—Г—О –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—О (–Р–Ф > 160/85 –Љ–Љ —А—В. —Б—В.) –њ—А–Є –љ–Є–Ј–Ї–Њ–Љ –њ—А–Њ—Ж–µ–љ—В–µ –њ—А–Є–µ–Љ–∞ –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є, —З—В–Њ —Б–∞–Љ–Њ –њ–Њ —Б–µ–±–µ –Љ–Њ–≥–ї–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –њ—А–Њ–≥—А–µ—Б—Б–Є–Є –∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є–Є [21]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ –і–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –љ–µ —Г—В–Њ—З–љ—П–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —В–µ—А–∞–њ–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ –≤ —Б—Г–±–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –і–Њ–Ј–∞—Е –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–∞ —Б –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ–Љ –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ –Т12, —З—В–Њ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—О –∞–љ–µ–Љ–Є–Є [22]. –Ь–µ–ґ–і—Г —В–µ–Љ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ –∞–љ–µ–Љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –њ–Њ—З–µ–Ї —В–µ—Б–љ–Њ —Б–≤—П–Ј–∞–љ–∞ —Б –і–∞–ї—М–љ–µ–є—И–Є–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ—З–µ—З–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є [1, 23].
–Т—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є–Љ–µ–µ—В —А—П–і –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –µ–≥–Њ –љ–µ–њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О, –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –њ–µ—А–µ–Ї—А–µ—Б—В–љ–Њ–≥–Њ –і–Є–Ј–∞–є–љ–∞ –Є –Њ—Ж–µ–љ–Ї–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —А–∞—Б—И–Є—А–µ–љ–љ–Њ–є –ї–Є–њ–Є–і–Њ–≥—А–∞–Љ–Љ—Л, –∞ —В–∞–Ї–ґ–µ —Б –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О —Г—З–µ—В–∞ –≤–ї–Є—П–љ–Є—П –≤–Є–і–∞ –њ–Њ–ї—Г—З–∞–µ–Љ–Њ–≥–Њ –Є–љ—Б—Г–ї–Є–љ–∞ –Є–Ј-–Ј–∞ –љ–µ–Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є –≥—А—Г–њ–њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤ —А—П–і–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е —А–∞–±–Њ—В –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ —Г–Љ–µ–љ—М—И–∞—В—М –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ —Н–њ–Є—В–µ–ї–Є—П –њ–Њ—З–µ—З–љ—Л—Е –Ї–∞–љ–∞–ї—М—Ж–µ–≤ [24, 25], —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л–Љ –Љ–Њ–≥–ї–Њ –±—Л —П–≤–ї—П—В—М—Б—П –≤–Ї–ї—О—З–µ–љ–Є–µ –≤ —А–∞–±–Њ—В—Г –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, –њ–Њ–Љ–Є–Љ–Њ —А—Г—В–Є–љ–љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –Њ—Ж–µ–љ–Є–≤–∞—О—Й–Є—Е –Ї–∞–љ–∞–ї—М—Ж–µ–≤—Г—О –і–Є—Б—Д—Г–љ–Ї—Ж–Є—О.
–Т—Л–≤–Њ–і—Л:
1) –і–Њ–±–∞–≤–ї–µ–љ–Є–µ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –≤ –і–Њ–Ј–µ 1500 –Љ–≥ –љ–∞ 6 –Љ–µ—Б. –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –°–Ф 2-–≥–Њ —В–Є–њ–∞ –љ–∞ –Є–љ—Б—Г–ї–Є–љ–Њ—В–µ—А–∞–њ–Є–Є –±–µ–Ј –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –њ–Њ—З–µ—З–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —А—Г—В–Є–љ–љ—Л–µ –њ–Њ—З–µ—З–љ—Л–µ –Љ–∞—А–Ї–µ—А—Л –Є —Г—А–Њ–≤–µ–љ—М –Р–Ф;2) –і–Њ–±–∞–≤–ї–µ–љ–Є–µ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –Ї –Є–љ—Б—Г–ї–Є–љ–Њ—В–µ—А–∞–њ–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –±–ї–Є–Ј–Ї–Є–Љ–Є –Ї —Ж–µ–ї–µ–≤—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–љ–Є–Ј–Є—В—М –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –Є–љ—Б—Г–ї–Є–љ–µ –њ—А–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ —Г–ї—Г—З—И–µ–љ–Є–Є –Ї–∞–Ї —Г—А–Њ–≤–љ—П –≥–ї–Є–Ї–µ–Љ–Є–Є, —В–∞–Ї –Є –і—А—Г–≥–Є—Е –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤.












