Известно, что антибиотики приводят к дисбалансу во внутренней экологической системе человека, которая представлена в организме на коже, в дыхательных путях, мочеполовых органах, но главным образом – в различных отделах желудочно–кишечного тракта (ЖКТ), особенно в толстой кишке. В свою очередь, колебание динамического равновесия микробиоты видоизменяет устойчивые взаимоотношения микроорганизм–макроорганизм и, как следствие, не только нарушает функции органов, являющихся естественным резервуаром соответствующей микрофлоры, но и приводит к формированию болезни в организме хозяина. В настоящее время доказано, что нарушение микробиоты кишки способствует развитию гастроинтестинальных симптомов (абдоминального болевого синдрома, метеоризма, нарушений стула и др.), многих других патологических состояний организма и ослаблению иммунной системы [1].
В литературе такие патологические изменения получили название антибиотик–ассоциированных состояний, а нозологические формы – антибиотик–ассоциированных колитов или антибиотик–ассоциированной диареи (ААД) [2–8].
Согласно современному определению, ААД представляет собой наличие трех или более эпизодов неоформленного стула в течение двух или более последовательных дней, развившихся на фоне или в течение 2 мес. после применения антибактериальных препаратов. В общей популяции населения появление симптомов ААД встречается у 5–30% лиц, получающих антибиотики [9].
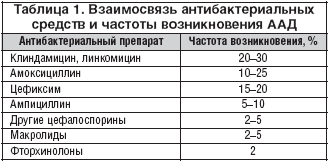
Степень риска развития антибиотик–ассоциированных состояний при применении различных антибактериальных препаратов разная [10,11] (табл. 1).
ААД подразделяется на 2 варианта: идиопатическую ААД и диарею, обусловленную микроорганизмом Clostridium difficile.
ААД неинфекционной природы, или идиопатическая ААД, вызывает до 80% всех случаев антибиотик–ассоциированных состояний. Согласно МКБ–10 вариант диагноза: К52.9 – неинфекционный гастроэнтерит и колит неуточненный. Термин «идиопатическая» подчеркивает, что при этом состоянии в большинстве случаев не удается выявить конкретного возбудителя, вызывающего развитие диареи. В качестве возможных этиологических факторов рассматриваются Clostridium perfrigens, бактерии рода Salmonella, стафилококк, протей, энтерококк, а также дрожжевые грибы.
Факторами риска развития идиопатической ААД являются:
• возраст до 5 и старше 65 лет;
• тяжелые соматические заболевания в анамнезе;
• хронические заболевания органов пищеварения;
• несоблюдение режима приема антибиотиков (слишком короткий или длительный курс, частая смена препаратов);
• высокие дозы антибиотиков.
Патогенетические механизмы развития идиопатической ААД остаются недостаточно изученными. Диарея может развиваться из–за стимуляции собственно антибактериальным препаратом (например, клавулановой кислотой) двигательной активности кишечника (гиперкинетическая диарея); за счет неполного всасывания некоторых антибиотиков (цефоперазон и цефиксим) из просвета кишечника (гиперосмолярная диарея). Наиболее вероятным патогенетическим механизмом возникновения идиопатической ААД считается нарушение состава кишечной микрофлоры, в результате которого развивается чрезмерная деконъюгация желчных кислот, поступающих в просвет толстой кишки и стимулирующих секрецию хлоридов и воды (секреторная диарея) [12–14].
Риск развития идиопатической ААД зависит от дозы применяемого препарата. Как правило, клинически данный вариант ААД протекает с умеренным послаблением стула, наличие патологических примесей в кале, лихорадки, лейкоцитоза не характерно. Иногда нарушение стула сопровождается болевым абдоминальным синдромом, связанным с усилением двигательной активности кишечника. При эндоскопическом исследовании воспалительные изменения слизистой оболочки толстой кишки не выявляются. Развитие осложнений для идиопатической ААД не характерно.
ААД инфекционной природы (10–20% случаев) принципиально отличается от идиопатической ААД, обусловлена колонизацией кишечника условно–патогенными штаммами различных бактерий. Наиболее тяжелое острое воспалительное заболевание кишечника, вызванное микроорганизмом Clostridium difficile и, как правило, связанное с применением антибиотиков, носит название «псевдомембранозный колит» (ПМК). Причиной развития данного заболевания почти в 100% случаев является инфекция C. difficile. Впервые подобный клинический случай был описан в 1893 г. американским хирургом J. Finney, однако этиологическая роль C. difficile в развитии ПМК была установлена только в 1997 г. J.G. Bartlett. По МКБ–10 диагноз: А04.7 – энтероколит, вызванный C. difficile.
C. difficile является облигатно–анаэробной грамположительной спорообразующей бактерией с природной резистентностью к большинству антибиотиков, токсинообразующие штаммы которой являются основным возбудителем госпитальных колитов, в том числе и наиболее тяжелого ПМК с высокой летальностью (до 15–30% случаев) [2,3,5,15].
Впервые данный микроорганизм был описан в 1935 г. американскими микробиологами I. Hall и E. O’Tool при исследовании кишечной микрофлоры новорожденных [16]. Частота бессимптомного носительства C. difficile у новорожденных достигает 50%, среди взрослого населения – 3–15%, существенно возрастает (до 15–40%) при приеме антибиотиков. Роль антибиотиков в патогенезе диареи сводится к подавлению нормальной микрофлоры кишечника, в частности к резкому снижению количества нетоксигенных клостридий, и к созданию условий для размножения C. difficile и для перехода их в токсинообразующие формы. C. difficile продуцирует несколько токсинов, не инвазируя слизистую оболочку кишечника. Токсин А (энтеротоксин) инициирует повреждение колоноцитов и вызывает диарею, обладает просекреторным и провоспалительным действием, способен активировать провоспалительные клетки, высвобождая медиаторы воспаления и субстанцию Р. Токсин В (цитотоксин) оказывает повреждающее действие на колоноциты и мезенхимальные клетки. Провоспалительное и дезагрегирующее действие токсинов А и В приводит к значительному повышению проницаемости слизистой оболочки кишечника [17–19].
К доказанным факторам риска развития диареи, обусловленной микроорганизмом C. difficile, относятся:
• пожилой возраст пациента;
• перенесенная ранее ААД;
• длительное пребывание в стационаре;
• пребывание в отделении интенсивной терапии;
• пребывание в одной палате с пациентом, страдающим диареей, вызванной C. difficile (микроорганизм сохраняется в палатах более 40 дней после выписки инфицированного больного);
• антибактериальная терапия;
• иммуносупрессивная терапия;
• применение назогастрального зонда;
• недавно перенесенное хирургическое вмешательство.
В отличие от идиопатической ААД риск развития ПМК не зависит ни от дозы антибиотика, ни от кратности, ни от способа введения препарата. Клиническая картина ПМК характеризуется наличием интенсивных, схваткообразных болей в животе (до развития диареи или на фоне развития пареза кишечника, наблюдается клиническая картина «острого живота») [20], жидкого стула до 20–25 раз в сутки с патологическими примесями крови, слизи, фебрильной лихорадкой. Кроме того, у пациента прогрессируют признаки интоксикации, в случае выраженного диарейного синдрома на первый план выходят проявления, связанные с дегидратацией организма и нарушением водно–электролитного баланса. В ряде случаев ПМК осложняется развитием кишечного кровотечения, токсического мегаколона, перфорации толстой кишки, сепсиса, электролитных нарушений, дегидратации, шока.
Для установления диагноза ААД, обусловленного микроорганизмом C. difficile, необходимы тщательный сбор анамнеза пациента, обнаружение токсинов А или В в анализе кала, применение цитотоксинового метода с использованием тканевой культуры (недостатки – длительный период ожидания результатов исследования, высокая стоимость), постановка реакции латекс–агглютинации для выявления токсина А (быстрая диагностика – менее чем за 1 ч, чувствительность метода – около 80%, специфичность – более 86%), применение иммуноферментного анализа (обладает высокой специфичностью, ложноотрицательные результаты фиксируются в 10–20% случаев, недостаток – данный метод не позволяет дифференцировать непатогенные и патогенные штаммы, чувствительность составляет 63–89%, специфичность – 95–100%).
При эндоскопическом исследовании кишечника выявляют псевдомембраны – морфологический признак ПМК. Это фибринозные пленки, образовавшиеся на участках некроза клеток эпителия слизистой кишки, макроскопически выглядящие, как бледные, серовато–желтые или желтовато–белые бляшки размером 0,2–2,0 см и более в диаметре на слегка приподнятом основании, покрывающие язвы слизистой кишечника. При среднетяжелой и тяжелой формах течения заболевания псевдомембраны могут полностью обтурировать просвет кишечника. При микроскопическом исследовании биоптата определяется, что псевдомембрана содержит некротизированный эпителий, обильный клеточный инфильтрат и слизь. В мембране происходит размножение микроорганизмов. Ультразвуковое исследование выявляет значительное утолщение стенок толстой кишки [21]. По данным рутинного бактериологического исследования определяется, как правило, рост Staphylococcus, Proteus или Pseudomonas.
Терапия идиопатической ААД требует полной отмены антибактериальных препаратов, применения препаратов с минимальным риском развития ААД (табл. 1) или изменения пути введения «виновного» антибиотика (отмена перорального назначения и перевод на парентеральное введение препарата), а также диктует необходимость назначения препаратов для восстановления микробной экосистемы кишки.
Лечение ПМК включает следующие основные направления [19,22,23]:
• назначение этиотропной терапии, направленной на борьбу с C. difficile в кишечнике;
• сорбция и удаление из просвета кишки микробных тел и их токсинов;
• дезинтоксикационная терапия, устранение дегидратации и нарушений водно–электролитного баланса;
• коррекция микробиоценоза кишечника.
Первое направление терапии обеспечивается назначением одного из двух нижеперечисленных препаратов. При среднетяжелой и тяжелой формах заболевания данные средства назначаются в комбинации [24,25]:
– метронидазол перорально по 500 мг 3 раза/сут. или по 250 мг 4 раза/сут., длительность терапии – до 14 сут., максимально до 21 дня;
– ванкомицин во флаконах по 125–500 мг 4 раза/ сут., курс проводимого лечения – до 10 сут.
Второе терапевтическое направление реализуется назначением различных энтеросорбентов (активированный уголь, лигнин гидролизный, диоксид кремния) и препаратов цитопротективного действия, уменьшающих адгезию микроорганизмов на колоноцитах (диосмектит). Энтеросорбция проводится в течение 7–10 дней и, как правило, прекращается после нормализации стула.
С целью адекватной регидратационной терапии, восстановления нарушенного водно–электролитного баланса назначают парентеральные препараты: раствор Рингера, раствор Хартмана, лактосоль, ацесоль, мафусол, поляризующую смесь, пероральные – регидрон, глюкосолан, оралит. Длительность терапии – до 10–14 дней в зависимости от выраженности интоксикационного синдрома и степени нарушений водно–электролитного баланса.
Восстановление микробной экологии кишки может осуществляться [25–34]:
– препаратами микроорганизмов или непатогенных грибов «эубиотиков», проходящих транзитом по ЖКТ и при этом ликвидирующих метаболические ниши для энтеропатогенных микроорганизмов (B. subtilus, S. boulardii) [8,12];
– препаратами микроорганизмов, относящихся к «пробиотикам», нормальным обитателям кишки, создающим благоприятные условия для восстановления резидентной микрофлоры (некоторые штаммы Lactobacillus, Bifidobacteria и т.д.).
С практических позиций важным является оценка состава пробиотического препарата. Принято подразделение на три типа пробиотических продуктов: одноштаммовые, содержащие один штамм; мультиштаммовые, в состав которых входят несколько штаммов одного вида микроорганизмов; мультивидовые (многовидовые), состоящие из штаммов различных видов, принадлежащих к одному или, что более предпочтительно, к разным семействам бактерий. В 2004 г. группа исследователей из Нидерландов под руководством H.M. Timmerman, исследуя эффекты одноштаммовых, мультиштаммовых и многовидовых препаратов, доказала, что мультивидовые пробиотики обладают явным преимуществом [35].
В 2011 г. арсенал современных препаратов для коррекции микробиоценоза пополнился еще одним лекарственным средством: им стал относительно новый для отечественных специалистов препарат группы пробиотиков – РиоФлора Баланс, который был разработан на основе инновационных технологий в Winclove Bio Industries (Нидерланды).
Препарат РиоФлора Баланс является комплексным и содержит 8 штаммов пробиотических микроорганизмов: 2 штамма бифидобактерий – Bifidobacterium lactis, Bifidobacterium bifidum, и 6 штаммов лактобацилл – Lactobacillus plantarum, Lactobacillus acidophilus W37, Lactobacillus acidophilus W55, Lactobacillus rhamnosus, Lactobacillus paracasei, Lactobacillus salivarius. Важно, что данный препарат относится к числу многовидовых пробиотиков, т.к. в его составе присутствуют штаммы различных кишечных бактерий. Таким образом, пробиотик должен воспроизводить эффекты разных видов и штаммов полезных микроорганизмов, присутствующих в кишечнике здорового человека.
Препарат РиоФлора Баланс, являясь мультивидовым, оказывает влияние на трех уровнях организма: в просвете кишечника (защита от патогенных микробов), на стенке кишечника (восстановление плотного соединения клеток эпителия), в иммунной системе (активизация выработки секреторного иммуноглобулина класса А (sIgA) здоровой микрофлорой).
Препарат РиоФлора Баланс обладает широким спектром положительных эффектов на организм человека:
• нормализует баланс микрофлоры кишечника;
• способствует улучшению функционального состояния кишечника при нарушениях стула (диарея, запор, неустойчивый стул);
• снижает риск развития кишечных расстройств, вызванных приемом антибактериальных препаратов;
• способствует нормальному пищеварению, усиливает естественную иммунную защиту организма.
С целью коррекции микробного пейзажа кишечника при терапии идиопатической ААД и инфекции C. difficile препарат РиоФлора Баланс рекомендуется назначать по 2 капсулы 2 раза/сут. в течение 14 дней, максимально – до 1 мес. с целью профилактики рецидива диареи.
В заключение хотелось бы еще раз подчеркнуть, что проблема антибиотик–ассоциированных состояний является актуальной. С целью профилактики данных патологических состояний необходимо обеспечить снижение частоты бесконтрольного и необоснованного использования антибиотиков, просвещение врачей различных медицинских специальностей, назначение препаратов пробиотического ряда. РиоФлора Баланс является важным компонентом комплексной терапии ПМК, необходимым для предотвращения его рецидивов. Кроме того, данный препарат может успешно применяться для профилактики идиопатической ААД и ее коррекции.
Литература
1. Marteau P., Pochart P., Bouhnik Y., Rambaud J.C. Fate and effects of some transiting microorganisms in the human gastrointestinal tract // World Rev. Nutr.Diet. 1993. № 74. P. 1–24.
2. Иванов Г.А., Лебедев В.Ф., Федоров В.Г., Шляпников С.А.. Антибиотик–ассоциированные колиты у пострадавших с тяжелой сочетанной травмой // Актуальные проблемы гнойно–септических инфекций. СПб., 1996. 44 с.
3. Малов В.А., Бондаренко В.М., Пак С.Г. Роль Clostridium difficile в патологии человека // Журнал микробиологии. 1996. № 1. С. 91–96.
4. Bartlett J.G. et al. Antibiotic–associated pseudomembranous colitis due to toxin producing clostridia // N. Engl. J. Med. 1978. Vol. 298. P. 531.
5. Borriello S.P. Virulence factors of Clostridium difficile. In “Recent advances in Clostridium difficile and its toxins” // Societe Fransaise de Microbiologie, Tours, May 4 1995.
6. MacFarland L.V. The epidemiology of Clostridium difficile infections // Gastroenterology Internat. 1991. № 4. P. 82– 85.
7. Marteau P.H., Lavergne A. Clostridium difficile In: Diarrheas infectieuses – Progreces en Gastroenterologie. J.C. Rambaud and P. Rampal (eds). Paris, Doin, 1993. 113 p.
8. Ерюхин И.А., Шляпников С.А., Лебедев В.Ф., Иванов Г.А. Псевдомембранозный колит и «кишечный сепсис» – следствие дисбактериоза, вызванного антибиотиками // Вестник хирургии им И.И. Грекова. 1997. Т. 156. № 2. С. 108–111.
9. Шевяков М.А. Антибиотик–ассоциированная диарея и кандидоз кишечника: возможности лечения и профилактики // Антибиотики и химиотерапия. 2004. Т. 49. № 10. С. 26–29.
10. Privitera G., Ortisi G.,Rizzardini G. et al. Third generation cephalosporins as a risk factor for Clostridium difficile – associated disease: a four year survey in a general hospital // J. Antimicrob. Chemoter. 1989.Vol. 23.P. 623.
11. Jaimes E.C. Lincocinamides and the incidence of antibiotic–associated colitis. // Clin.Ther. 1991. Vol. 13. P. 270.
12. Clausen M.R., Bonnen H., Tvede M., Mortensen P.B. Colonic fermentation to short–chain fatty acids is decreased in antibiotic–associated diarrhea // Gastroenterology. 1991 Dec. Vol. 101 (6). Р. 1497–1504.
13. Cook S.I., Sellin J.H. Review article: short chain fatty acids in health and disease. // Aliment PharmacolTher. 1998 Jun; Vol. 12 (6). Р. 499–507.
14. D’Argenio G., Mazzacca G. Short–chain fatty acid in the human colon. Relation to inflammatory bowel diseases and colon cancer // AdvExp Med Biol. 1999. Vol. 472. Р. 149–158.
15. MacFarland L.V. The epidemiology of Clostridium difficile infections. // Gastroenterology Internat. 1991. № 4. P. 82–85.
16. Hall I., O'Toole E. Intestinal flora in newborn infants with a description of a new pathogenic anaerobe, Bacillus difficilis // Am J Dis Child. 49, 390.
17. Lyerly D.M., Krivan H.C., Wilkins T.D. Clostridium difficile: its disease and toxins // Clin. Microbiol. Rev. 1988. Vol. 1. P. 1.
18. Marteau P.H., Lavergne A. Clostridium difficile In: Diarrheas infectieuses – Progreces en Gastroenterologie. J.C. Rambaud and P. Rampal (eds), Paris, Doin. 1993. 113 p.
19. Van Ness M.M., Cattau E.L. Fulminant colitis complicating antibiotic–associated pseudomembranous colitis: case report and review of the clinical manifestations and treatement // Am. J. Gastroenterol. 1987. Vol. 82. P. 374.
20. Triadafilopulos G., Hallstone A.E. Acute abdomen as the first presentation of pseudomembranous colitis //Gastroenterology. 1991. Vol. 101. P. 685.
21. Downey D.B., Wilson S.R. Pseudomembranous colitis: sonographic features // Radiology. 1991. Vol. 180. P. 61.
22. Жихарева Н.С., Хавкин А.И. Терапия антибиотик–ассоциированного дисбактериоза. // Русский медицинский журнал. 2006. Т. 14. № 19.
23. Bergogne–Berezin E. Treatment and prevention of antibiotic associated diarrhea // Int J Antimicrob Agents. 2000 Dec. Vol. 16 (4). Р. 521–526.
24. Teasley D.G. et al. Prospective randomized trial of metranidazole versus vancomycin for Clostridium difficile – associated diarrhea and colitis // Lancet. 1983. Vol. 2. P. 1043.
25. Корнеева О.Н., Ивашкин В.Т. Антибиотико–ассоциированный колит: патоморфология, клиника, лечение // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2007. № 3. С. 65–70.
26. D’Souza A.L., Rajkumar C., Cooke J., Bulpitt C.J. Probiotics in prevention of antibiotic associated diarrhoea: meta–analysis // BMJ. 2002, Jun 8. Vol. 324 (7350). Р. 1361.
27. Koning C.J., Jonkers D.M., Stobberingh E.E., Mulder L., Rombouts F.M., Stockbrugger R.W. The effect of a multispecies probiotic on the intestinal microbiota and bowel movements in healthy volunteers taking the antibiotic amoxycillin // Am J Gastroenterol. 2008 Jan. Vol. 103 (1). Р. 178–189.
28. De Vrese М., Marteau Р.R. Probiotics and Prebiotics: Effects on Diarrhea // J. Nutr. 2007. Vol.137. 803–811.
29. WcFarland L.V. Evidence–based review of probiotics for antibiotic–associated diarrhea and Clostridium difficile infections // Anaerobe. 2009, Dec. Vol. 15 (6). Р. 274–280. Epub 2009 Oct 13.
30. Gill H., Prasad J. Probiotics, immunomodulation and health benefits // AdvExp Med Biol. 2008. Vol. 606. Р. 423–454.
31. Осипенко М.Ф., Бикбулатова Е.А., Холин С.И. Пробиотики в лечении диарейного синдрома // Фарматека. 2008. № 13. С. 36–41.
32. Cremonini F. et al. Meta–analysis: the effect of probiotic administration on antibiotic–associated diarrhoea // Aliment PharmacolTher. 2002. Vol. 16 (8). Р. 1461–1467.
33. Ушкалова Е.А. Роль пробиотиков в гастроэнтерологии // Фарматека. 2007. № 6. С. 16–23.
34. Huang J.S., Bousvaros A., Lee J.W. et al. Efficacy of probiotic use in acute diarrhea in children: a metaanalysis // Dig Dis Sci. 2002. Vol. 11. Р. 2625–2634.












