Апротинин относится к разряду препаратов с антиферментной активностью. Этот природный ингибитор тканевых и сывороточных протеаз по химической структуре представляет собой полипептид; в фармацевтическом производстве его получают из легких крупного рогатого скота.
Традиционно, еще с 70-х годов, апротинин использовали в терапии острого и обострений хронического панкреатита. В то время лечебное воздействие препарата в основном связывали с подавлением активности продукта экзокринной панкреатической секреции – протеолитического фермента трипсина, который способствует внутрипротоковой активации ферментов и лизису железистых структур.
В дальнейших исследованиях, касающихся патофизиологических изменений, которые сопровождают острый воспалительный процесс в поджелудочной железе, было установлено, что ведущим механизмом развития локальных и генерализованных нарушений в этой ситуации является повышенное образование кининов (брадикинина в плазме крови и калликреина в тканях), высвобождение эластазы лейкоцитов, протеиназ нейтрофилов, провоспалительных цитокинов (в том числе, фактора некроза опухоли-a). Эти биологически активные вещества вызывают нарушения микроциркуляции, вазодилатацию, повышают проницаемость сосудов, способствуют развитию тяжелых геморрагически-некротических изменений в поджелудочной железе, а также вызывают болевые ощущения. Глубокие расстройства гемодинамики (сердечно-сосудистая недостаточность), дыхания (респираторный дистресс-синдром взрослых) и других жизненно важных функций (преренальная анурия, диссеминированное внутрисосудистое свертывание крови) при тяжелом течении острого панкреатита формируют картину “панкреатического шока” и могут приводить к смертельному исходу в первые несколько суток (рис. 1). Запуск калликреин-кининового каскада происходит под воздействием активированного фактора Хагемана (рис. 2).
Результаты масштабных многоцентровых исследований свидетельствуют о том, что ингибиторы протеаз не влияют на динамику развития повреждения поджелудочной железы, поскольку не обладают способностью тормозить процесс внутрипротоковой активации ферментов. На сегодняшний день считается нецелесообразным назначение препаратов этого ряда пациентам с обострением хронического панкреатита, которым показано лечение в условиях терапевтического стационара, и пациентам с острым отечным панкреатитом.
Вопрос о необходимости применения ингибиторов протеаз при остром деструктивном панкреатите остается спорным. Ряд авторов придерживается мнения, что их назначение при остром панкреатите не показано, поскольку риск смертельного исхода определяется в основном гнойными осложнениями. Однако многие исследователи склоняются к тому, что при тяжелых генерализованных расстройствах, сопровождающих геморрагические и деструктивные панкреатиты, в первые 3-е суток необходимо назначение препаратов этого ряда, в частности апротинина, подавляющего активность калликреина. Кроме того, апротинин (Контрикал) временно угнетает внутриклеточный синтез белка (экзокринную секрецию поджелудочной железы).
Для поддержания оптимальной концентрации в крови апротинин необходимо вводить внутривенно в дозах 20 000 ЕД и более в сутки. Применяют смесь следующего состава: апротинин 30 000–50 000 ЕД, гепарин натрий 5000 ЕД, прокаин 0,25%–200 мл, реополиглюкин – 100 мл, атропин сульфат 0,1% – 1 мл, дифенгидрамин 1% – 2 мл, промедол 2% – 2 мл. Введение декстрана способствует улучшению доставки ингибитора протеаз в зону некроза [K. Huch и соавт., 1995]. Эффективность препаратов данной группы увеличивается при их введении внутриартериально, в круглую связку печени, главный панкреатический проток, эндолимфатически, в брюшную полость и парапанкреатическую клетчатку.
В двойном слепом многоцентровом рандомизированном исследовании, проведенном в 1996 г. в Швеции на 48 пациентах с тяжелой формой острого панкреатита, было показано, что перитонеальный лаваж, дополненный внутрибрюшинным введением апротинина в большой дозе (15 000 000 ЕД на протяжении 30 ч), уменьшал тяжесть течения острого панкреатита [R. Berling и соавт., 1998]. Ни у одного пациента, получавшего апротинин, не возникло необходимости в проведении оперативного вмешательства (в отличие от контрольной группы, в которой прооперированы 24% пациентов). Назначение апротинина интраперитонеально сопровождалось снижением уровня активации комплемента и содержания провоспалительного цитокина интерлейкина-6, повышением активности каллистатина в сыворотке. Для борьбы с болью, помимо спазмолитических средств, ненаркотических и наркотических анальгетиков, прокаиновых блокад, некоторые авторы рекомендуют внутривенное введение смесей, содержащих в своем составе прокаин, спазмолитик, малые дозы преднизолона и 10 000 ЕД апротинина.
Апротинин при панкреатите можно применять местно (используя метод гальванизации). Установлено, что это в 3–6 раз снижает активность протеолиза [А. Iftodii, 1998].
Показано, что назначение апротинина снижает риск развития острого панкреатита как осложнения эзофагохолангиопанкреографии.
Применение при реологических расстройствах
С развитием биохимии и патофизиологии открывались новые лечебные возможности ингибиторов протеаз. Детальное изучение механизмов развития синдрома диссеминированного внутрисосудистого свертывания крови (ДВС) прочно закрепило за апротинином место в ряду средств первой необходимости при ведении пациентов с кровотечениями на почве ДВС в хирургической, акушерской, гинекологической, терапевтической практике.
Известно, что чрезмерная активация фибринолиза, его преобладание над скоростью свертывания крови (II вариант ДВС-синдрома) лежат в основе развития тяжелых геморрагических проявлений, являющихся универсальным осложнением различных заболеваний.
Ингибиторы протеаз способны подавлять активность практически всех плазменных прокоагулянтных и антикоагулянтных звеньев. При ДВС они находятся в состоянии “взрыва”. В средних терапевтических дозах (10 000–20 000 ЕД) антикоагулянтное действие апротинина выражено умеренно и проявляется лишь на начальных этапах активации свертывания крови и при трансформации Х фактора в активную форму. Таким образом, в этих дозах препарат не обладает значительными антикоагулянтными и антитромбиновыми свойствами. Клинический опыт показывает, что применение апротинина в больших дозах 100 000 ЕД и более в комплексе с мини-дозами гепарина натрия в ситуации гиперфибринолиза “на глазах” прекращает или существенно уменьшает спонтанные геморрагические проявления. При дефиците антитромбина III терапию большими дозами ингибиторов протеаз дополняют инфузией свежезамороженной плазмы.
Профилактика и купирование кровотечений, развивающихся на фоне гиперфибринолиза, является одной из важнейших областей применения апротинина, особенно в группах высокого риска. Данные ситуации наблюдаются прежде всего в акушерской и гинекологической практике, травматологии, онкологии и гематологии.
В связи с бурным развитием в последние годы сердечно-сосудистой хирургии с применением аппаратов искусственного кровообращения возрастает интерес к терапевтическим возможностям ингибиторов протеаз в предотвращении интра- и послеоперационных кровотечений, требующих переливания препаратов крови, повторных торакотомий и сопровождающихся высокой смертностью. Применение апротинина в дозах до 40 000 – 60 000 ЕД оказывает антифибринолитический эффект, подавляет контактную активацию, уменьшает дисфункцию тромбоцитов и воспаление в области сосудистых анастомозов. Препарат достоверно снижает риск развития осложнений за счет подавления образования калликреина и тромбина по внешнему каскаду свертывания крови, подавления фибринолиза; снижает потребность в переливании препаратов крови, уменьшает частоту ретрактотомий и смертность. Его эффективность в этом плане превышает эффективность e-аминокапроновой кислоты.
Применение апротинина в профилактических целях особенно показано у пациентов, которым нежелательно производить переливание крови.
Вместе с тем в опытах продемонстрировано, что антипротеазы обладают антиагрегационным и дезагрегантным действием. В средних и больших лечебных дозах они не только препятствуют агрегации тромбоцитов, но и вызывают дезагрегацию уже прореагировавших под действием аденозиндифосфата кровяных пластинок. В экспериментах in vitro, моделирующих условия искусственного кровообращения, показано, что апротинин также уменьшает экспрессию активных гликопротеиновых IIb-IIIa рецепторов, которые имеют большое значение в агрегации и адгезии тромбоцитов к поверхности биоматериалов.
Результаты плацебо-контролируемых исследований указывают на то, что апротинин уменьшает риск развития нарушений мозгового кровообращения при операциях с использованием экстракорпорального кровообращения, особенно у пожилых лиц.
Апротинин в терапевтической практике
Интересны результаты применения апротинина при трансмуральном инфаркте миокарда в группе пациентов, у которых отмечались признаки высокого риска разрыва сердца. К таким признакам можно отнести проявления “чрезмерной резорбции” в фазе максимально выраженной миомаляции (3–6-е сутки болезни): повышение активности лактатдегидрогеназы, концентрации лизосомальных ферментов и сердечного антигена в сыворотке крови. Частота случаев возникновения разрыва сердца в группе пациентов, которым проводилась терапия ингибиторами протеолиза, снизилась в 2 раза по сравнению с контрольной группой (где она составила 5,7%) [Г.А. Трофимов и соавт., 1994].
Одним из важных направлений применения ингибиторов протеиназ является лечение ожогов. Апротинин (в сочетании с антибиотиками) положительно воздействует на регенерацию тканей ожоговых ран. На фоне его применения в фазе регенерации скорость восстановления эпителия по краям раны удваивается, на 3–4 дня уменьшается срок подготовки раны к пересадке собственной кожи, повышается выживание кожных лоскутов. Внутривенное введение апротинина (от 10 000 до 60 000 ЕД в сутки, в зависимости от тяжести состояния) показано при развитии ожогового шока, острой ожоговой токсемии.
При хронических неспецифических заболеваниях, а также острых гнойно-деструктивных процессах в легких имеет место нарушение равновесия в системе протеиназ - естественных ингибиторов протеиназ: повышение активности лейкоцитарных, микробных протеиназ, провоспалительных биологически активных пептидов и снижение активности естественных ингибиторов протеолиза. Имеется клинический опыт успешного применения апротинина при этих состояниях (внутривенное введение в дозе 10 000– 20 000 ЕД, а также трансторакальное внутрилегочное введение с помощью безыгольного инъектора непосредственно в очаг воспаления), при этом отмечено снижение частоты хронизации абсцессов, показателей смертности.
Проводились плацебо-контролируемые клинические исследования по применению апротинина в форме аэрозоля при инфекциях вирусами гриппа и парагриппа. Основанием для выделения подобных показаний к назначению препарата послужил тот факт, что его применение оказывало протективное действие в условиях экспериментально вызванной бронхопневмонии на фоне гриппа и парагриппа. Применение апротинина в течение первых 3–4 дней инфекции приводит к уменьшению выраженности симптомов интоксикации и продолжительности острого периода заболевания. Ингаляция апротинина хорошо переносилась пациентами.
Применение в анестезиологии, неврологии и онкологии
Применение апротинина нашло свое место и в анестезиологии. В литературе последних лет уделяется все больше внимания использованию профилактической анальгезии. Она подразумевает мероприятия, направленные на уменьшение последствий операционной травмы и снижение интенсивности послеоперационного болевого синдрома (подавление синтеза биологических медиаторов боли – простагландинов и кининов). В комплекс профилактической анестезии входит, например, назначение нестероидных противовоспалительных средств (НПВС) кетопрофена или кеторолака за 1 ч до операции. В отличие от неполостных операций, при которых можно ограничиться применением анальгетика из ряда НПВС, обширные полостные, как считает ряд авторов, требуют использования также препаратов – ингибиторов образования кининов, дополняющих и усиливающих антиноцицептивную блокаду на периферическом (рецепторном) уровне. Антикининоген апротинин в целях профилактической анальгезии назначается внутривенно по следующей схеме: этап “индукции” – 20 000 ЕД, весь период анестезии – 50 000 ЕД.
В неврологической практике апротинин находит свое применение при инсультах, развивающихся на фоне декомпенсированной фибринолитической реакции. Препарат назначается под контролем коагулографических показателей до их нормализации. В подобных ситуациях включение апротинина в комплекс терапевтических мер улучшает исходы инсульта.
В экспериментах на животных показано уменьшение частоты образования экстраневральных рубцов после оперативных вмешательств на периферических нервах (нейролизис, анастомозирование и др.) при местном применении апротинина.
Использование апротинина в сочетании с a-интерфероном, лучевой терапией и микроволновой гипертермией для профилактики рецидивов карцином шейно-головной области после хирургического лечения позволяет повысить трехлетний срок выживания на 37 %, а число пациентов без рецидивов опухоли – на 39 %.
Наконец, перспективным представляется применение апротинина в качестве средства, повышающего биодоступность лекарственных препаратов белковой природы (в частности, ингибиторов тромбина) при их пероральном назначении. Включение апротинина (Контрикала) в лекарственную форму позволит уменьшить степень протеолиза лекарственного вещества в желудочно-кишечном тракте.
Заключение
Фармакологам и клиницистам предстоит еще открыть новые сферы применения антипротеаз. Универсальность патофизиологических механизмов, лежащих в основе генерализованных патологических изменений в огранизме, является залогом “бессмертия” препаратов этого класса для клинической практики.
Литература
1. Арнаудов Г.Д. Лекарственная терапия. Перевод под ред. проф. А.Н. Кудрина. София, Медицина и физкултура, 1975; 1167.
2. Гастроэнтерология (справочник). Под ред. В.Т. Ивашкина, С.И. Рапопорта М.: Русский врач, 1998; 96.
3. Голдин В.А. Деструктивный панкреатит, инвазивные методы введения лекарственных веществ // Вестник Российского университета дружбы народов. 1999: 136-138.
4. Кадышев Ю.Г., Левицкий А.П., Литвинов П.Г. и др. Применение ингибиторов протеиназ для лечения ожоговых ран. Клин. хир. 1992(3): 42–4.
5. Лычев В.Г. Диагностика и лечение диссеминированного внутрисосудистого свертывания крови. - 2-е изд., перераб. и доп. Н. Новгород: НГМА, 1998; 191.
6. Михалкин И.А., Яжвили Ц.Г., Быков В.Л. Терморадиотерапия в сочетании с ингибитором протеиназ для терапии карциномов в шейно-головной области. Онкология 1993;50(5): 344–7.
7. Смирнов O.П., Киршнер Л.С., Овчаренко А.В. и др. Клиническое действие аэрозоля Апротинина при гриппе и парагриппе. Вестн. Росс. Акад. мед. наук 1996(5): 26–31.
8. Трофимов Г. А., Ардашев В.Н., Серова Л.С. и др. Разрыв сердца в острой фазе инфаркта миокарда: прогноз и возможности предупреждения. Клин. мед. 1994; 72(6): 22–5.
9. Belorgey D, Dirrig S, Amouric M et al. Inhibition of human pancreatic proteinases by mucus proteinase inhibitor, eglin c and aprotinin. Biochem J 1996; 313 (Pt2):555–60.
10. Berling R, Borgstrom A, Ohlsson K. Peritoneal lavage with aprotinin in patients with severe acute pancreatitis. Effects on plasma and peritoneal levels of trypsin and leukocyte proteases and their major inhibitors. Int J Pancreatol 1998;24(1):9-17.
11. Bull DA, Connors RC, Albanil A et al.. Karwande SV Aprotinin preserves myocardial biochemical function during cold storage through suppression of tumor necrosis factor. J Thorac Cardiovasc Surg 2000;119(2): 242–50.
12. Chan H, Springman EB, Clark JM. Expression and characterization of human tissue kallikrein variants. Protein Expr Purif 1998 Apr;12(3):361–70.
13. Gorgulu A, Imer M, Simsek O et al. The effect of aprotinin on extraneural scarring in peripheral nerve surgery: an experimental study. Acta Neurochir (Wien) 1998;140(12):1303–7.
14. Huch K, Schmidt J, Schratt W, Sinn HP et al. Hyperoncotic dextran and systemic aprotinin in necrotizing rodent pancreatitis. Scand J Gastroenterol 1995;30(8): 812–6.
15. Iftodii A.. Effects of constant-current electric field on tissue and plasma proteolysis in acute pancreatitis // Klin Khir. 1998; 2: 34-6.
16. Khan MM, Gikakis N, Miyamoto S et al. Aprotinin inhibits thrombin formation and monocyte tissue factor in simulated cardiopulmonary bypass. Ann Thorac Surg 1999; 68(2): 473–8.
17. Kozek-Langenecker SA, Mohammad SF, Masaki T et al.. The effects of aprotonin on platelets in vitro using whole blood flow cytometry. Anesth Analg 2000; 90(1):12–6.
18. McCarthy RJ, Tuman KJ, OХConnor C et al. Aprotinin pretreatment diminishes postischemic myocardial contractile dysfunction in dogs. Anesth Analg 1999; 89(5):1096–100.
19. Murkin JM Etiology and incidence of brain dysfunction after cardiac surgery. J Cardiothorac Vasc Anesth 1999;13(4 Suppl 1):12–7; discussion 36–7.
20. Peters DC, Noble S. Aprotinin: an update of its pharmacology and therapeutic use in open heart surgery and coronary artery bypass surgery. Drugs 1999; 57(2): 233–60.
21. Schmid S, Uhl W, Buchler MW. Protease-antiprotease interactions and the rationale for therapeutic protease inhibitors. Scand J Gastroenterol 1996; 219 Suppl: 47–50.
22. Sjostrom M, Lindfors L, Ungell AL Inhibition of binding of an enzymatically stable thrombin inhibitor to lumenal proteases as an additional mechanism of intestinal absorption enhancement. Pharm Res 1999;16(1):74–9.
23. Ziebert JJ, Bjorkman DJ. Protease inhibitors for prevention of ERCP pancreatitis: can we afford the price of success? J Gastroenterol 1997; 92(6):1067–8.
Апротинин –
Контрикал (торговое название)
(ASTA Medica)
Приложения к статье
Считается нецелесообразным назначение ингибиторов протеаз пациентам с обострением хронического панкреатита
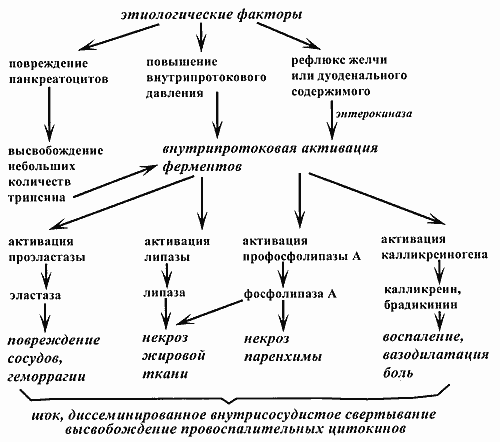
| Рис. 1. Патогенез острого панкреатита |
|
[Просмотреть Рис.2 Калликреин-кининовая система и ее связи с факторами свертывания крови] |












