–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –≥–ї–Њ–±–∞–ї—М–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —З–∞—Б—В–Њ—В—Л –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –њ—А–Є –њ–µ–њ—В–Є—З–µ—Б–Ї–Њ–є –ѓ–С, —Б—Г–Љ–Љ–∞—А–љ–∞—П —З–∞—Б—В–Њ—В–∞ –Ц–Ъ–Ъ –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е 20 –ї–µ—В –љ–µ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –Є –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В –Њ—Б—В–∞–≤–∞—В—М—Б—П –њ—А–Є—З–Є–љ–Њ–є, –њ–Њ —А–∞–Ј–љ—Л–Љ –і–∞–љ–љ—Л–Љ, 1,4–2% –ї–µ—В–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, —Г –ґ–Є—В–µ–ї–µ–є –Љ–µ–≥–∞–њ–Њ–ї–Є—Б–Њ–≤ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –Ц–Ъ–Ъ —Б—В–∞–ї–Є —А–∞–Ј–≤–Є–≤–∞—В—М—Б—П —З–∞—Й–µ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –Њ–±—Й–µ–≥–Њ —Б—В–∞—А–µ–љ–Є—П –љ–∞—Б–µ–ї–µ–љ–Є—П –≥–Њ—А–Њ–і–Њ–≤ –Є –њ–Њ—А–∞–ґ–µ–љ–Є–є –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є —Б–ї–Є–Ј–Є—Б—В–Њ–є –љ–∞ —Д–Њ–љ–µ —А–Њ—Б—В–∞ —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –Э–Я–Т–Я, –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–Њ–≤, –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ –Є –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –Њ–±—А–∞—В–љ–Њ–≥–Њ –Ј–∞—Е–≤–∞—В–∞ —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞ [3]. –£ –Љ—Г–ґ—З–Є–љ, –њ–Њ–ґ–Є–ї—Л—Е –±–Њ–ї—М–љ—Л—Е –Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—В—П–≥–Њ—Й–µ–љ–љ—Л–Љ –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л–Љ —Б—В–∞—В—Г—Б–Њ–Љ, –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤ —Б–≤—П–Ј–Є —Б –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤, –Ц–Ъ–Ъ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –≤–і–≤–Њ–µ —З–∞—Й–µ [2]. –Ю–±—Й–∞—П –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –њ—А–Є –Ц–Ъ–Ъ –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е 10 –ї–µ—В —В–∞–Ї–ґ–µ –Њ—Б—В–∞–µ—В—Б—П —Б—В–∞–±–Є–ї—М–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є –Є –≤ —А–∞–Ј–љ—Л—Е —Б—В—А–∞–љ–∞—Е –≤–∞—А—М–Є—А—Г–µ—В –≤ –њ—А–µ–і–µ–ї–∞—Е 4–10%, –і–Њ—Б—В–Є–≥–∞—П 14–17% —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є 26% – —Г –±–Њ–ї—М–љ—Л—Е, –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤ –Љ–љ–Њ–≥–Њ–њ—А–Њ—Д–Є–ї—М–љ—Л–є —Б—В–∞—Ж–Є–Њ–љ–∞—А [5–10]. –Я–Њ –і–∞–љ–љ—Л–Љ –Ь–Њ—Б–Ї–Њ–≤—Б–Ї–Њ–≥–Њ –≥–Њ—А–Њ–і—Б–Ї–Њ–≥–Њ —Ж–µ–љ—В—А–∞ –њ–∞—В–Њ–ї–Њ–≥–Њ––∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Ф–µ–њ–∞—А—В–∞–Љ–µ–љ—В–∞ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –≥–Њ—А–Њ–і–∞ –Ь–Њ—Б–Ї–≤—Л, –≤ 2004–2010 –≥–≥. –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є 5,1–8% –∞—Г—В–Њ–њ—Б–Є–є —Г–Љ–µ—А—И–Є—Е –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞—Е –Є –≤ 11–13% —Б–ї—Г—З–∞–µ–≤ –љ–µ –±—Л–ї–Є –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ—Л –њ—А–Є –ґ–Є–Ј–љ–Є. –°—А–µ–і–Є —Г–Љ–µ—А—И–Є—Е –љ–∞ –і–Њ–Љ—Г —З–∞—Б—В–Њ—В–∞ –љ–µ—А–∞—Б–њ–Њ–Ј–љ–∞–љ–љ—Л—Е –њ—А–Є –ґ–Є–Ј–љ–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –≤ —Н—В–Є –ґ–µ –≥–Њ–і—Л –і–Њ—Б—В–Є–≥–∞–ї–∞ 36–74% [9,10].
–Ю–Ї–Њ–ї–Њ –њ–Њ–ї–Њ–≤–Є–љ—Л –≤—Б–µ—Е –Є–ї–Є 50–70% «–љ–µ–≤–∞—А–Є–Ї–Њ–Ј–љ—Л—Е» –Ц–Ъ–Ъ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –њ—А–Є –њ–µ–њ—В–Є—З–µ—Б–Ї–Њ–є –ѓ–С, –Ї–Њ—В–Њ—А–Њ–є –≤ –†–Њ—Б—Б–Є–Є —Б—В—А–∞–і–∞–µ—В –Њ–Ї–Њ–ї–Њ 10% –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П [4,10,11]. –Ц–Ъ–Ъ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П —Г 10–15% –±–Њ–ї–µ—О—Й–Є—Е –њ–µ–њ—В–Є—З–µ—Б–Ї–Њ–є –ѓ–С, —З–∞—Й–µ – —Б –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є (–Ф–Я–Ъ), –Є –Є—Е —З–∞—Б—В–Њ—В–∞ –љ–µ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –≥–ї–Њ–±–∞–ї—М–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ —В–µ—З–µ–љ–Є—П –ѓ–С, –њ—А–Њ–Є–Ј–Њ—И–µ–і—И–µ–µ –њ–Њ—Б–ї–µ –њ–Њ–≤—Б–µ–Љ–µ—Б—В–љ–Њ–≥–Њ –≤–љ–µ–і—А–µ–љ–Є—П —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ–Њ—З—В–Є —Г 30% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ц–Ъ–Ъ –Є –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –∞–љ—В–Є—Е–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ –≤–љ–Њ–≤—М –≤–Њ–Ј–љ–Є–Ї–љ–µ—В –≤ —В–µ—З–µ–љ–Є–µ 2 –ї–µ—В, –∞ —Г 40–50% – –≤ —В–µ—З–µ–љ–Є–µ 10 –ї–µ—В [12]. –Ы–µ—В–∞–ї—М–љ–Њ—Б—В—М –њ—А–Є –Ц–Ъ–Ъ –љ–∞ —Д–Њ–љ–µ –њ–µ–њ—В–Є—З–µ—Б–Ї–Њ–є –ѓ–С –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –њ–Њ—Б–ї–µ–і–љ–Є—Е 50 –ї–µ—В –≤ —А–∞–Ј–љ—Л—Е —Б—В—А–∞–љ–∞—Е –Њ—Б—В–∞–µ—В—Б—П –і–Њ–≤–Њ–ї—М–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є – –Њ–Ї–Њ–ї–Њ 8–10% [13]. –Т –Ь–Њ—Б–Ї–≤–µ –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –њ—А–Є –ѓ–С —Б –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ–Љ –≤ 2009 –≥. —Б–љ–Є–Ј–Є–ї–∞—Б—М –і–Њ 4 —Б 5,3% –≤ 2008 –≥. [10].
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –њ–µ–њ—В–Є—З–µ—Б–Ї–∞—П –ѓ–С —З–∞—Й–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Г –Љ–Њ–ї–Њ–і—Л—Е –Љ—Г–ґ—З–Є–љ —Б –љ–µ–Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є –≥–Є–њ–µ—А–∞—Ж–Є–і–љ–Њ—Б—В—М—О –Є —Е–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А–љ—Л–Љ –≥–∞—Б—В—А–Є—В–Њ–Љ. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –Њ–Ї–Њ–ї–Њ 80% –ї–µ—В–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –Њ—В –Ц–Ъ–Ъ —А–µ–≥–Є—Б—В—А–Є—А—Г–µ—В—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б—В–∞—А—И–µ 65 –ї–µ—В, –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 62–65 –ї–µ—В, –±–µ–Ј –≥–Є–њ–µ—А–∞—Ж–Є–і–љ–Њ—Б—В–Є –Є –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞ –њ–µ–њ—В–Є—З–µ—Б–Ї–Њ–є –ѓ–С –Є —З–∞—Б—В–Њ – –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Ј–љ–∞—З–Є–Љ–Њ–є –Ї–Њ–љ—В–∞–Љ–Є–љ–∞—Ж–Є–Є —Е–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А–Њ–Љ [14,15]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ј–љ–∞—З–Є—В–µ–ї—М–љ–∞—П –і–Њ–ї—П –Ц–Ъ–Ъ, –≤–µ—А–Њ—П—В–љ–Њ, —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ –≤—В–Њ—А–Є—З–љ–Њ–є –≥–Є–њ–µ—А–∞—Ж–Є–і–љ–Њ—Б—В–Є, –Ї–Њ—В–Њ—А–∞—П —П–≤–ї—П–µ—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –љ–∞—А—Г—И–µ–љ–Є–є –Њ—Й–µ–ї–∞—З–Є–≤–∞–љ–Є—П, –∞ –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –µ—Й–µ –Є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є –≥–µ–Љ–Њ—Б—В–∞–Ј–∞.
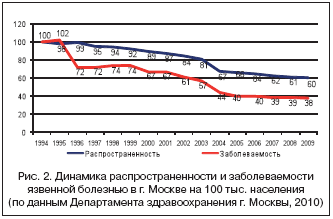
–Я—А–Є—З–Є–љ–Њ–є —А–∞–Ј–≤–Є—В–Є—П 15–27% –Ц–Ъ–Ъ –Є–Ј –≤–µ—А—Е–љ–µ–≥–Њ –Њ—В–і–µ–ї–∞ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ (–Ц–Ъ–Ґ) —Г –њ–Њ–ґ–Є–ї—Л—Е –±–Њ–ї—М–љ—Л—Е —П–≤–ї—П—О—В—Б—П —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ –Є—И–µ–Љ–Є–Є –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–•–°–Э), –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–µ —З—А–µ–≤–љ—Л—Е –∞—А—В–µ—А–Є–є, –∞–љ–µ–≤—А–Є–Ј–Љ–µ –∞–Њ—А—В—Л. –Э–µ—А–µ–і–Ї–Њ —Н—В–∞ –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–∞—П –Є—И–µ–Љ–Є—П —Г «—Б–Њ—Б—Г–і–Є—Б—В—Л—Е» –±–Њ–ї—М–љ—Л—Е –і–ї–Є—В–µ–ї—М–љ–Њ —Б—Г—Й–µ—Б—В–≤—Г–µ—В —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є —Б —Б–Є–Љ–њ—В–Њ–Љ–Њ–Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–Љ –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–є –і–Є—Б–њ–µ–њ—Б–Є–Є («–±—А—О—И–љ–∞—П –ґ–∞–±–∞») –Є –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–Є—А—Г–µ—В—Б—П –љ–∞ —Д–Њ–љ–µ –Њ–±–Њ—Б—В—А–µ–љ–Є—П –Ш–С–°. –Я–Њ —А–∞–Ј–љ—Л–Љ –і–∞–љ–љ—Л–Љ, –Ц–Ъ–Ъ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П —Г 8–25% –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б—В—А—Л–Љ –Ї–Њ—А–Њ–љ–∞—А–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ (–Ю–Ъ–°), –Є–љ—Д–∞—А–Ї—В–Њ–Љ –Љ–Є–Њ–Ї–∞—А–і–∞ (–Ш–Ь) –Є –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–µ–є –•–°–Э [16,17]. –Я–Њ –і–∞–љ–љ—Л–Љ –Ь–Њ—Б–Ї–Њ–≤—Б–Ї–Њ–≥–Њ –≥–Њ—А–Њ–і—Б–Ї–Њ–≥–Њ —Ж–µ–љ—В—А–∞ –њ–∞—В–Њ–ї–Њ–≥–Њ––∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Ф–µ–њ–∞—А—В–∞–Љ–µ–љ—В–∞ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –≥–Њ—А–Њ–і–∞ –Ь–Њ—Б–Ї–≤—Л, –Ц–Ъ–Ъ —П–≤–ї—П—О—В—Б—П –њ—А–Є—З–Є–љ–Њ–є —Б–Љ–µ—А—В–Є 10–15% –±–Њ–ї—М–љ—Л—Е, —Г–Љ–µ—А—И–Є—Е –Њ—В –Њ—Б—В—А–Њ–≥–Њ –Ш–Ь, –Є 2–5% –±–Њ–ї—М–љ—Л—Е —Б –•–°–Э [9,17]. –Т —Ж–µ–ї–Њ–Љ –≤ –Љ–љ–Њ–≥–Њ–њ—А–Њ—Д–Є–ї—М–љ–Њ–Љ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ —Б–Ї–Њ—А–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –Љ–µ–≥–∞–њ–Њ–ї–Є—Б–∞ —Б—А–µ–і–Є –ї–µ—В–∞–ї—М–љ—Л—Е –Ц–Ъ–Ъ —З–∞—Б—В–Њ—В–∞ –ѓ–С –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 5%, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —З–∞—Б—В–Њ—В–∞ –Ц–Ъ–Ъ –њ—А–Є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е (–°–°–Ч) –і–Њ—Б—В–Є–≥–∞–µ—В 67% (—А–Є—Б. 2).
–Я–Њ–Љ–Є–Љ–Њ —Д–Њ–љ–Њ–≤–Њ–є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є—И–µ–Љ–Є–Є –Ї —А–∞–Ј–≤–Є—В–Є—О –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –Є –Ц–Ъ–Ъ –њ—А–Є –Ш–Ь –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Њ—Б—В—А–Њ–µ «—Б—В—А–µ—Б—Б–Њ–≤–Њ–µ» —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ —П–≤–ї—П–µ—В—Б—П –њ—А–Є—З–Є–љ–Њ–є 8–15% –≤—Б–µ—Е –Ц–Ъ–Ъ [11]. –Э–∞–Є–±–Њ–ї–µ–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ –њ—А–Њ—В–µ–Ї–∞—О—В –Ц–Ъ–Ъ –Є–Ј «c—В—А–µ—Б—Б–Њ–≤—Л—Е» –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –њ—А–Є –Њ–ґ–Њ–≥–∞—Е (—П–Ј–≤—Л –Ъ—Г—А–ї–Є–љ–≥–∞) –Є –Њ–±–Љ–Њ—А–Њ–ґ–µ–љ–Є—П—Е, —И–Њ–Ї–µ —А–∞–Ј–ї–Є—З–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є, –љ–µ–є—А–Њ—В—А–∞–≤–Љ–µ (—П–Ј–≤—Л –Ъ—Г—И–Є–љ–≥–∞), –Њ—Б—В—А–Њ–Љ –њ—Б–Є—Е–Њ—Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–Љ —Б—В—А–µ—Б—Б–µ, —Б–µ–њ—Б–Є—Б–µ, —В–µ—А–Љ–Є–љ–∞–ї—М–љ–Њ–є —Б—В–∞–і–Є–Є —А–∞–Ї–∞, –≥–Є–њ–µ—А–њ–∞—А–∞—В–Є—А–µ–Њ–Ј–µ, –Њ—Б—В—А–Њ–Љ —В—А–∞–љ—Б–Љ—Г—А–∞–ї—М–љ–Њ–Љ –Ш–Ь [10]. –І–∞—Б—В–Њ—В–∞ –Ц–Ъ–Ъ –њ—А–Є —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —П–Ј–≤–∞—Е —Г –±–Њ–ї—М–љ—Л—Е, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –њ–Њ –і–∞–љ–љ—Л–Љ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞, —Б–Њ—Б—В–∞–≤–ї—П–µ—В 6% [21].
–Ы–µ—В–∞–ї—М–љ–Њ—Б—В—М –≤ —Н—В–Њ–є –≥—А—Г–њ–њ–µ –Њ—Б—В—А—Л—Е «–љ–µ–њ–µ–њ—В–Є—З–µ—Б–Ї–Є—Е» –Ц–Ъ–Ъ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤—Л—И–µ, —З–µ–Љ –њ—А–Є –ѓ–С, –Є –і–Њ—Б—В–Є–≥–∞–µ—В 50–80% [22]. –Э–∞–њ—А–Є–Љ–µ—А, –≤—Л—Б–Њ–Ї–∞—П –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М (10% –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б 2,8%, —А=0,0046) —Е–∞—А–∞–Ї—В–µ—А–љ–∞ –і–ї—П –Ц–Ъ–Ъ –њ–Њ—Б–ї–µ –∞–љ–≥–Є–Њ–њ–ї–∞—Б—В–Є–Ї–Є –њ–Њ –њ–Њ–≤–Њ–і—Г –Ю–Ъ–°. –£ –±–Њ–ї—М–љ—Л—Е, –љ–µ–і–∞–≤–љ–Њ –њ–µ—А–µ–љ–µ—Б—И–Є—Е –∞–љ–≥–Є–Њ–њ–ї–∞—Б—В–Є–Ї—Г, —В–∞–Ї–ґ–µ –њ–Њ–≤—Л—И–µ–љ –љ–µ —В–Њ–ї—М–Ї–Њ –Ї—А–∞—В–Ї–Њ—Б—А–Њ—З–љ—Л–є, –љ–Њ –Є –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ—Л–є —А–Є—Б–Ї —Б–Љ–µ—А—В–Є (6––Љ–µ—Б—П—З–љ–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–ї—П–µ—В 14% –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б 4,6%, —А=0,0016). –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —З–∞—Б—В–Њ—В–∞ –Ц–Ъ–Ъ –љ–µ –Ј–∞–≤–Є—Б–Є—В –Њ—В —Г—Б–њ–µ—И–љ–Њ—Б—В–Є —Б–∞–Љ–Њ–≥–Њ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞, –љ–∞–ї–Є—З–Є—П –Љ–љ–Њ–≥–Њ—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б—В–µ–љ—В–Њ–≤ –Є–ї–Є –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤—Л—Е IIb/IIIa —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, —Б–∞–Љ—Л–Љ –Ј–љ–∞—З–Є–Љ—Л–Љ –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ –Ц–Ъ–Ъ —П–≤–ї—П–µ—В—Б—П –≤–Њ–Ј—А–∞—Б—В —Б—В–∞—А—И–µ 70 –ї–µ—В [23]. –Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј –Ц–Ъ–Ъ —Г –±–Њ–ї—М–љ—Л—Е —Б–Њ —Б—В—А–µ—Б—Б–Њ–≤—Л–Љ–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П–Љ–Є –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ: 1) –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —А–∞–Ј–≤–Є–≤–∞—О—Й–µ–є—Б—П –Є–ї–Є —П—В—А–Њ–≥–µ–љ–љ–Њ–є –љ–µ–њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ—Б—В—М—О –≤—Б–µ—Е –Ј–≤–µ–љ—М–µ–≤ —Б–Є—Б—В–µ–Љ—Л –≥–µ–Љ–Њ—Б—В–∞–Ј–∞: —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –∞–≥—А–µ–≥–∞—Ж–Є–Њ–љ–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –Є –њ—А–Њ–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є –Є –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є —Д–Є–±—А–Є–љ–Њ–ї–Є–Ј–∞; 2) –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ —В–Є–њ–Є—З–љ–Њ–є –Є —П—А–Ї–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –≤ 30–90% –Ц–Ъ–Ъ [2,16].
–Т–∞–ґ–љ–µ–є—И–µ–є –њ—А–Є—З–Є–љ–Њ–є –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –Є –Ц–Ъ–Ъ —П–≤–ї—П–µ—В—Б—П –ї–µ—З–µ–љ–Є–µ –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ–Є –Э–Я–Т–Я. –Ґ–µ—А–∞–њ–Є—П –Э–Я–Т–Я –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –љ–∞—А—Г—И–µ–љ–Є—П–Љ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—В–і–µ–ї–∞—Е –Ц–Ъ–Ґ (—А–Є—Б. 3). –Ю–і–љ–∞–Ї–Њ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є —Б–ї–Є–Ј–Є—Б—В–Њ–є —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Є —Б–Њ–њ—А—П–ґ–µ–љ–Њ —Б –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–Љ —Б –Ц–Ъ–Ъ. –Т–њ–µ—А–≤—Л–µ Rots S.H. –Є —Б–Њ–∞–≤—В. (1986) —Г—Б—В–∞–љ–Њ–≤–Є–ї–Є, —З—В–Њ 68% –±–Њ–ї—М–љ—Л—Е, —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –Э–Я–Т–Я > 6 –љ–µ–і., –Є–Љ–µ—О—В –≥–µ–Љ–Њ—А—А–∞–≥–Є–Є –Є —Н—А–Њ–Ј–Є–Є, –∞ 15% – —П–Ј–≤—Л —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –ґ–µ–ї—Г–і–Ї–∞ –Є –Ф–Я–Ъ, –Є –њ—А–µ–і–ї–Њ–ґ–Є–ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —В–µ—А–Љ–Є–љ «–Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є—П». –Т –і–∞–ї—М–љ–µ–є—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —З–∞—Б—В–Њ—В–∞ –Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є–Є –≤–∞—А—М–Є—А–Њ–≤–∞–ї–∞ –Њ—В 40 [23] –і–Њ 81% [24]. –£ 20–25% –±–Њ–ї—М–љ—Л—Е —Б –Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є–µ–є —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –Њ—Б—В—А—Л–µ —П–Ј–≤—Л, –∞ –±–Њ–ї–µ–µ —З–µ–Љ —Г 50% – —Н—А–Њ–Ј–Є–≤–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є —Б–ї–Є–Ј–Є—Б—В–Њ–є [19–23]. –Ъ –љ–∞—З–∞–ї—Г XXI –≤. –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Э–Я–Т–Я —А–µ–≥—Г–ї—П—А–љ–Њ –њ—А–Є–љ–Є–Љ–∞–ї–Є –±–Њ–ї–µ–µ 50% –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ц–Ъ–Ъ [18], –Є —З—В–Њ –њ—А–Є –Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є–Є –Ц–Ъ–Ъ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –≤ 5 —А–∞–Ј —З–∞—Й–µ, —З–µ–Љ —Г –љ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Э–Я–Т–Я –±–Њ–ї—М–љ—Л—Е [2]. –І–∞—Б—В–Њ—В–∞ –Ц–Ъ–Ъ –њ—А–Є –Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є–Є —Б–µ–≥–Њ–і–љ—П –Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П –≤ 10–15% –Њ—В –≤—Б–µ—Е –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б–ї—Г—З–∞–µ–≤, –∞ —З–∞—Б—В–Њ—В–∞ –ї–µ—В–∞–ї—М–љ—Л—Е –Ц–Ъ–Ъ – –≤ 15,5 —Б–ї—Г—З–∞—П –љ–∞ 100 —В—Л—Б. –љ–∞—Б–µ–ї–µ–љ–Є—П [22]. –Ю–±—Й–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М –Њ—В –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –Э–Я–Т–Я –њ–Њ—А–∞–ґ–µ–љ–Є–є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 5,62% (95% CI: 4,8–6,8) (—А–Є—Б. 4) [22,24,27].
–Я–Њ –і–∞–љ–љ—Л–Љ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞ Lewis S.C. –Є —Б–Њ–∞–≤—В. (2002), –љ–∞–Є–Љ–µ–љ—М—И–Є–µ –≥–∞—Б—В—А–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –Є —А–Є—Б–Ї –Ц–Ъ–Ъ —Е–∞—А–∞–Ї—В–µ—А–љ—Л –і–ї—П –Є–±—Г–њ—А–Њ—Д–µ–љ–∞ (OR 1,7; 95% CI 1,1–2,5), –љ–∞–Є–±–Њ–ї—М—И–Є–µ – –і–ї—П –Ї–µ—В–Њ–њ—А–Њ—Д–µ–љ–∞ (34,9; 12,7–96,5). –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Њ–њ–∞—Б–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ—А–Є–љ–Є–Љ–∞–µ–Љ–Њ–≥–Њ –Э–Я–Т–Я –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –љ–∞ 1––є –љ–µ–і. –њ—А–Є–µ–Љ–∞, —Б–љ–Є–ґ–∞–µ—В—Б—П –њ—А–Є –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–Є –њ—А–Є–µ–Љ–∞ –Э–Я–Т–Я (5,6; 4,6–7,0) –Є –њ–∞–і–∞–µ—В —З–µ—А–µ–Ј –љ–µ–і–µ–ї—О –њ–Њ—Б–ї–µ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –њ—А–Є–µ–Љ–∞ –і–∞–љ–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ [25]. –†–Є—Б–Ї —В—П–ґ–µ–ї–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Є–ї–Є –Ц–Ъ–Ъ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –њ—А–Є –њ—А–Є–µ–Љ–µ –Э–Я–Т–Я <3 –Љ–µ—Б., —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –і–Њ–Ј—Л –Э–Я–Т–Я –Є/–Є–ї–Є –њ—А–Є–µ–Љ–µ 2 –Э–Я–Т–Я, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –њ—А–Є–µ–Љ–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤, –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–Њ–≤ –Є –Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤, –Ї—Г—А–µ–љ–Є–Є, –≤–Њ–Ј—А–∞—Б—В–µ —Б—В–∞—А—И–µ 60 –ї–µ—В –Є –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ–є –Њ—В—П–≥–Њ—Й–µ–љ–љ–Њ—Б—В–Є [28,42].
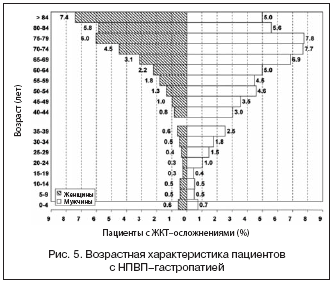
–Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є—П –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –Ц–Ъ–Ъ –≤ –ї—О–±–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ, –Њ–і–љ–∞–Ї–Њ –≤–Њ –Љ–љ–Њ–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ–Ї–∞–Ј–∞–љ–∞ –Њ—Б–Њ–±–∞—П —Г—П–Ј–≤–Є–Љ–Њ—Б—В—М –њ–Њ–ґ–Є–ї—Л—Е –±–Њ–ї—М–љ—Л—Е (—А–Є—Б. 5), –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–љ—Г—О —В–µ—А–∞–њ–Є—О –і–ї–Є—В–µ–ї—М–љ–Њ –љ–Є–Ј–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–Р–°–Ъ), –Є –Њ—Б–Њ–±–µ–љ–љ–Њ —В–µ—Е, –Ї—В–Њ –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б –Р–°–Ъ –њ—А–Є–љ–Є–Љ–∞–µ—В –і—А—Г–≥–Є–µ –Э–Я–Т–Я, –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і—Л –Є –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї [22]. –Т –±–Њ–ї—М—И–Њ–Љ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Lanas A. et al. (2005) –ї–µ—В–∞–ї—М–љ–Њ–µ –Ц–Ъ–Ъ —А–∞–Ј–≤–Є–≤–∞–ї–Њ—Б—М —З–∞—Й–µ —Г –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 76±13,5 –≥–Њ–і–∞, –≤ 21,6% —Б–ї—Г—З–∞–µ–≤ – —Б –ѓ–С –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, 15,3% –±–Њ–ї—М–љ—Л—Е —Г–ґ–µ –њ–µ—А–µ–љ–Њ—Б–Є–ї–Є –Ц–Ъ–Ъ –Є –≤ 13,5% —Б–ї—Г—З–∞–µ–≤ –Њ–±—А–∞—Й–∞–ї–Є—Б—М –Ї –≤—А–∞—З—Г —А–∞–љ–µ–µ –≤ —Б–≤—П–Ј–Є —Б –і–Є—Б–њ–µ–њ—Б–Є–µ–є. 65,1% —Г–Љ–µ—А—И–Є—Е –Њ—В –Ц–Ъ–Ъ –Є–Љ–µ–ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Г—О –Ш–С–° –Є 40% – –∞—А—В–µ—А–Є–∞–ї—М–љ—Г—О –≥–Є–њ–µ—А—В–Њ–љ–Є—О. –•–∞—А–∞–Ї—В–µ—А–љ–Њ, —З—В–Њ –љ–∞–Ї–∞–љ—Г–љ–µ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є —В–Њ–ї—М–Ї–Њ 27% —Г–Љ–µ—А—И–Є—Е –њ–Њ–ї—Г—З–∞–ї–Є –Є–љ–≥–Є–±–Є—В–Њ—А—Л –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л (–Ш–Я–Я) –Є 10% – –і—А—Г–≥–Є–µ –∞–љ—В–∞—Ж–Є–і—Л [22].
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Р.–Ы. –Т–µ—А—В–Ї–Є–љ–∞ –Є —Б–Њ–∞–≤—В. (2007) –≤—Л—Б–Њ–Ї–∞—П –Ї–Њ–Љ–Њ—А–±–Є–і–љ–∞—П –Њ—В—П–≥–Њ—Й–µ–љ–љ–Њ—Б—В—М, –њ–Њ–ґ–Є–ї–Њ–є –≤–Њ–Ј—А–∞—Б—В –Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ–ї–∞–љ–Њ–≤–Њ–є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —В–∞–Ї–ґ–µ –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –≤–∞–ґ–љ–µ–є—И–Є–Љ–Є –њ—А–µ–і–Є–Ї—В–Њ—А–∞–Љ–Є –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ –њ—А–Є –Ц–Ъ–Ъ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ –Ш–С–° [17].
–Ф–ї–Є—В–µ–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –Р–°–Ъ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –°–°–Ч —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –≥–∞—Б—В—А–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Э–Я–Т–Я. –Т –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –і–Њ–ї–≥–Њ–µ –≤—А–µ–Љ—П —Б—З–Є—В–∞–ї–Њ—Б—М, —З—В–Њ –љ–Є–Ј–Ї–Є–µ –і–Њ–Ј—Л –Р–°–Ъ –Є –њ—А–µ–њ–∞—А–∞—В—Л —Б –Љ–µ–і–ї–µ–љ–љ—Л–Љ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ–Љ –Р–°–Ъ, –Ї–Њ—В–Њ—А—Л–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–∞–Ј–љ–∞—З–∞—О—В –њ–Њ–ґ–Є–ї—Л–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ, –±–µ–Ј–Њ–њ–∞—Б–љ—Л –Є –љ–µ —В—А–µ–±—Г—О—В –љ–∞—Б—В–Њ—А–Њ–ґ–µ–љ–љ–Њ—Б—В–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —А–∞–Ј–≤–Є—В–Є—П –Ц–Ъ–Ъ, —В–µ–Љ –±–Њ–ї–µ–µ —З—В–Њ –Р–°–Ъ —П–≤–ї—П–µ—В—Б—П —Б–ї–∞–±—Л–Љ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Љ –њ—А–Њ—Б—В–∞—Ж–Є–Ї–ї–Є–љ–∞, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–µ–≥–Њ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≥–∞—Б—В—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –≤ –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є —Б–ї–Є–Ј–Є—Б—В–Њ–є. –°–µ–≥–Њ–і–љ—П, –њ–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є–Є —Ж–µ–ї–Њ–≥–Њ —А—П–і–∞ –±–Њ–ї—М—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Љ–Њ–ґ–љ–Њ —Г–≤–µ—А–µ–љ–љ–Њ –≥–Њ–≤–Њ—А–Є—В—М –Њ —В–Њ–Љ, —З—В–Њ –љ–Є–Ј–Ї–Є–µ –і–Њ–Ј—Л –Р–°–Ъ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ —П–≤–ї—П—О—В—Б—П –≥–∞—Б—В—А–Њ—В–Њ–Ї—Б–Є—З–љ—Л–Љ–Є, –Є –љ–µ—В –Њ—Б–љ–Њ–≤–∞–љ–Є–є –і—Г–Љ–∞—В—М, —З—В–Њ –і–∞–ї—М–љ–µ–є—И–µ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –і–Њ–Ј—Л –Љ–Њ–ґ–µ—В —Б–љ–Є–Ј–Є—В—М —А–Є—Б–Ї –Ц–Ъ–Ъ.
–Я–Њ –і–∞–љ–љ—Л–Љ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –Р–°–Ъ –≤ –і–Њ–Ј–µ –Њ–Ї–Њ–ї–Њ 150 –Љ–≥/—Б—Г—В. –Ц–Ъ–Ъ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Г 2,47% –±–Њ–ї—М–љ—Л—Е –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В 1,42% –љ–∞ —Д–Њ–љ–µ –њ–ї–∞—Ж–µ–±–Њ (OR 1,68; 95% CI 1,51–1,88) –Є–ї–Є –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ —Г 1 –±–Њ–ї—М–љ–Њ–≥–Њ –Є–Ј –Ї–∞–ґ–і—Л—Е 100 [26]. –Ф–ї–Є—В–µ–ї—М–љ–∞—П –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –љ–Є–Ј–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є –Р–°–Ъ –љ–∞ 3,8% —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —Б—Г–Љ–Љ–∞—А–љ—Л–є —А–Є—Б–Ї –њ–Њ—А–∞–ґ–µ–љ–Є—П –Ц–Ъ–Ґ [27]. –°–Њ—З–µ—В–∞–љ–љ—Л–є –њ—А–Є–µ–Љ –Р–°–Ъ –Є –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Э–Я–Т–Я —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —А–Є—Б–Ї –Ц–Ъ–Ъ –і–Њ 5,6%, –∞ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –Р–°–Ъ + –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї – –і–Њ 7,4% [27]. –Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —А–Є—Б–Ї –Ц–Ъ–Ъ —Г –±–Њ–ї—М–љ—Л—Е, –і–ї–Є—В–µ–ї—М–љ–Њ –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –Э–Я–Т–Я, –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ —Ж–µ–ї–Њ–≥–Њ —А—П–і–∞ —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ—Л—Е –љ–µ–≥–∞—В–Є–≤–љ—Л—Е –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–≤ –Ц–Ъ–Ъ, —В–∞–Ї–Є—Е –Ї–∞–Ї:
• –ѓ–С (–њ–µ–њ—В–Є—З–µ—Б–Ї–∞—П —П–Ј–≤–∞) –Є –µ–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ;
• —Б—В–∞—А—И–Є–є –≤–Њ–Ј—А–∞—Б—В;
• –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –Э–Я–Т–Я;
• –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є –њ—А–Є–µ–Љ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤;
• –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є –њ—А–Є–µ–Љ –Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤;
• –≤—Л–±—А–∞–љ–љ—Л–є –Э–Я–Т–Я;
• –°–°–Ч [18].
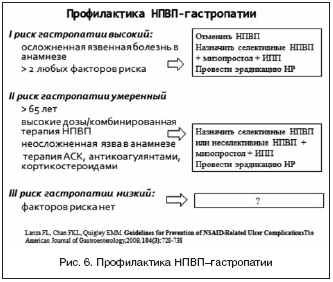
–Э–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Ї–ї–Є–љ–Є–Ї–Њ––∞–љ–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–≤ –Ц–Ъ–Ъ, –Є—Е –≤—Л—Б–Њ–Ї–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Є —З–∞—Б—В–Њ–µ –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–µ —В–µ—З–µ–љ–Є–µ –Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є–Є —Д–Њ–Ї—Г—Б–Є—А—Г—О—В —Г—Б–Є–ї–Є—П –њ–Њ —Г–њ—А–∞–≤–ї–µ–љ–Є—О –њ—А–Њ–≥–љ–Њ–Ј–Њ–Љ –Ц–Ъ–Ъ —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –≤—Л—П–≤–ї–µ–љ–Є–Є —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –њ–µ—А–≤–Є—З–љ–Њ–є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≥–∞—Б—В—А–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–∞–Љ–Є. –Ф–ї—П —А–µ—И–µ–љ–Є—П —Н—В–Є—Е –Ј–∞–і–∞—З –≤ 2008 –≥. –≤ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е ACCF/ACG/AHA –Є –≤ 2009 –≥. –≤ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е American College of Gastroenterology –љ–µ–≥–∞—В–Є–≤–љ–Њ–µ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –±—Л–ї–Њ —Г—В–Њ—З–љ–µ–љ–Њ –Є —Б—В—А–∞—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Њ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є –≥–∞—Б—В—А–Њ–њ—А–Њ—В–µ–Ї—Ж–Є–Є (—А–Є—Б. 6) [27,28].
–°–Њ–≥–ї–∞—Б–љ–Њ —Н—В–Є–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ, –њ–∞—Ж–Є–µ–љ—В–∞–Љ –Є–Ј –≥—А—Г–њ–њ—Л –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є–Ј–±–µ–≥–∞—В—М –њ—А–Є–µ–Љ–∞ –Э–Я–Т–Я. –Я—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Є–Љ —Б–ї–µ–і—Г–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –¶–Ю–У–2 —Б –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –Ї—Г—А—Б–Њ–Љ –Љ–Є–Ј–Њ–њ—А–Њ—Б—В–Њ–ї–∞ –Є–ї–Є –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л (–Ш–Я–Я). –Я–∞—Ж–Є–µ–љ—В–∞–Љ, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –±—Л—В—М –Њ—В–љ–µ—Б–µ–љ—Л –Ї –≥—А—Г–њ–њ–µ —Г–Љ–µ—А–µ–љ–љ–Њ–≥–Њ —А–Є—Б–Ї–∞, —Б–ї–µ–і—Г–µ—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –Є–ї–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –¶–Ю–У–2, –Є–ї–Є –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Э–Я–Т–Я –≤–Љ–µ—Б—В–µ —Б –Љ–Є–Ј–Њ–њ—А–Њ—Б—В–Њ–ї–Њ–Љ, –Є–ї–Є –Ш–Я–Я [28]. –Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –і–∞–љ–љ—Л—Е –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –і–µ—Б—П—В–Є–ї–µ—В–Є—П –Љ–∞—Б—И—В–∞–±–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (OMNIUM, –РSTRONAUT, VENUS, PLUTO –Є –і—А.) –Ш–Я–Я –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ –њ—А–Є–Ј–љ–∞–љ—Л –≤–µ–і—Г—Й–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —В—П–ґ–µ–ї—Л—Е –Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є–є, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –њ—А–Є–µ–Љ–Њ–Љ –Р–°–Ъ –Є –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–Њ–≤ [23,28–30,37,42]. –Т —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Љ–Є–Ј–Њ–њ—А–Њ—Б—В–Њ–ї–Њ–Љ –Є –Э2––±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –Ш–Я–Я –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –ї—Г—З—И–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ц–Ъ–Ъ [28,36]. –Ю—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Э–Я–Т–Я, —Б–Њ—Б—В–∞–≤–Є–ї 0,13 (95% –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї 0,09–0,19), –≤ –≥—А—Г–њ–њ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –љ–Є–Ј–Ї–Є–µ –і–Њ–Ј—Л –Р–°–Ъ – 0,32 (0,22–0,51), –≤ –≥—А—Г–њ–њ–µ –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї–∞ – 0,19 (0,07–0,49) [28].
–Ш–Я–Я (–≤ –љ–∞—З–∞–ї–µ –Є–Ј—Г—З–µ–љ–Є—П –њ—А–Њ–±–ї–µ–Љ—Л —Н—В–Њ –±—Л–ї –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї) –≤ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –і–Њ–Ј–µ –љ–µ —В–Њ–ї—М–Ї–Њ –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л, –љ–Њ –Є –љ–µ –Є–Љ–µ–ї–Є —З–∞—Б—В–Њ –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, –Ї–∞–Ї –њ—А–Є —В–µ—А–∞–њ–Є–Є –Љ–Є–Ј–Њ–њ—А–Њ—Б—В–Њ–ї–Њ–Љ. –Т –і–∞–ї—М–љ–µ–є—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Ш–Я–Я —Б–ї–µ–і—Г—О—Й–Є—Е –њ–Њ–Ї–Њ–ї–µ–љ–Є–є – –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї (–Ъ–Њ–љ—В—А–Њ–ї–Њ–Ї®), —Н–Ј–Њ–Љ–µ–њ—А–∞–Ј–Њ–ї, –ї–∞–љ—Б–Њ–њ—А–∞–Ј–Њ–ї –Є —А–∞–±–µ–њ—А–∞–Ј–Њ–ї –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є–Є –Њ–Ї–∞–Ј–∞–ї–Є—Б—М —Б—А–∞–≤–љ–Є–Љ—Л –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–Њ–Љ –Є –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ —Г—Б–њ–µ—И–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 16 —З —Г–і–µ—А–ґ–Є–≤–∞–ї–Є —А–Э>4, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–є –і–ї—П –Ј–∞—Й–Є—В—Л –Њ—В –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –≤ –≥—А—Г–њ–њ–µ —А–Є—Б–Ї–∞ –Ц–Ъ–Ъ.
–Я–Њ –і–∞–љ–љ—Л–Љ Regula J., Butruk E., Dekkers C., et al. (2006), –ї–µ—З–µ–љ–Є–µ –Ш–Я–Я –њ—А–Є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–Љ –њ—А–Є–µ–Љ–µ –Э–Я–Т–Я —З–µ—А–µ–Ј 6 –Љ–µ—Б. –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –њ—А–Є –њ—А–Є–µ–Љ–µ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ (–Ъ–Њ–љ—В—А–Њ–ї–Њ–Ї®) 20 –Љ–≥/—Б—Г—В. –Є 40 –Љ–≥/—Б—Г—В. —Г 91 –Є 95% –±–Њ–ї—М–љ—Л—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –Є —Г 93% – –њ—А–Є –њ—А–Є–µ–Љ–µ –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ 20 –Љ–≥/—Б—Г—В. [31].
–Ю–і–љ–∞–Ї–Њ —В–µ—А–∞–њ–Є—П —А–∞–Ј–љ—Л–Љ–Є –Ш–Я–Я —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —А–∞–Ј–ї–Є—З–∞–ї–∞—Б—М –њ–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–ї–Є—Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–µ–є –Є –Њ—В—П–≥–Њ—Й–µ–љ–љ—Л–Љ –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л–Љ —Б—В–∞—В—Г—Б–Њ–Љ, —Г –Ї–Њ—В–Њ—А—Л—Е –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї –Ц–Ъ–Ъ —В—А–µ–±—Г–µ—В –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ, –∞ –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ – –Є –њ–Њ–ґ–Є–Ј–љ–µ–љ–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л. –Ю–Ї–∞–Ј–∞–ї–∞—Б—М, —З—В–Њ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї (–Ъ–Њ–љ—В—А–Њ–ї–Њ–Ї®) –Њ–±–ї–∞–і–∞–µ—В —Ж–µ–ї—Л–Љ —А—П–і–Њ–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є—Е –љ–µ —В–Њ–ї—М–Ї–Њ –Њ–±–µ—Б–њ–µ—З–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —В–µ—А–∞–њ–Є–Є, –љ–Њ –Є —Г–≤–µ–ї–Є—З–Є—В—М –Њ–±—Й—Г—О –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –≤ —Н—В–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е: –њ–Њ—Б–ї–µ –µ–і–Є–љ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ 40 –Љ–≥/—Б—Г—В. –≤—Л–Ј—Л–≤–∞–µ—В —Б–∞–Љ—Л–є –і–ї–Є—В–µ–ї—М–љ—Л–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В (–і–Њ 24 —З) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ –≤—Б–µ–Љ–Є –і—А—Г–≥–Є–Љ–Є –Ш–Я–Я. –Я—А–Є –њ—А–Є–µ–Љ–µ –≤ –і–Њ–Ј–µ 40 –Љ–≥ –Ј–љ–∞—З–µ–љ–Є—П —А–Э>3 —Б–Њ—Е—А–∞–љ—П—О—В—Б—П –±–Њ–ї–µ–µ 19 —З. –≠—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ–Љ –µ–≥–Њ —Ж–Є—Б—В–µ–Є–љ–Њ–Љ 822 –≤ —В—А–∞–љ—Б–њ–Њ—А—В–љ–Њ–Љ –і–Њ–Љ–µ–љ–µ –ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ –Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –њ—А–Њ–і—Г–Ї—Ж–Є–Є —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ—А–Є —В–µ—А–∞–њ–Є–Є –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–Њ–Љ –Ј–∞–≤–Є—Б–Є—В –Њ—В —Б–∞–Љ–Њ–Њ–±–љ–Њ–≤–ї–µ–љ–Є—П –±–µ–ї–Ї–Њ–≤ –њ—А–Њ—В–Њ–љ–љ–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞, –∞ –љ–µ –Ґ1/2 –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞, –Є –±–ї–Њ–Ї–∞–і–∞ –Њ–Ї–Њ–ї–Њ 70% –Э+/–Ъ+––Р–Ґ–§–∞–Ј—Л —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –≤ —Б–ї—Г—З–∞–µ –њ—А–Є–µ–Љ–∞ 40 –Љ–≥ –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 2–5 —Б—Г—В., –∞ –њ—А–Є –њ—А–Є–µ–Љ–µ –≤–љ—Г—В—А—М 2 —А–∞–Ј–∞/—Б—Г—В. – –≤ —В–µ—З–µ–љ–Є–µ 2–3 —Б—Г—В. [32,33]. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ –Є —Н–Ј–Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї –љ–µ –∞–Ї–Ї—Г–Љ—Г–ї–Є—А—Г–µ—В—Б—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Є, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–µ —В—А–µ–±—Г–µ—В –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –≤–≤–Њ–і–Є–Љ–Њ–є –і–Њ–Ј—Л –њ—А–Є –љ–∞—А—Г—И–µ–љ–Є–Є —Д—Г–љ–Ї—Ж–Є–Є –њ–µ—З–µ–љ–Є –Є –њ–Њ—З–µ–Ї [11,15,34].
–Я–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї –љ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–Љ—Г –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—О, –Ј–љ–∞—З–Є–Љ–Њ–Љ—Г –і–ї—П –њ–Њ–ґ–Є–ї—Л—Е «—Б–Њ—Б—Г–і–Є—Б—В—Л—Е» –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –љ–µ–њ—А—П–Љ—Л–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ –Є –Њ—Б—В–∞–ї—М–љ—Л—Е –Ш–Я–Я, –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—О—Й–Є—Е —Б —Д–µ—А–Љ–µ–љ—В–∞–Љ–Є –°Y–†450, –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –≤–ї–Є—П–µ—В –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М CYP2C19, –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г—О—Й–µ–≥–Њ —Д–µ–љ–Є—В–Њ–Є–љ, –≤–∞—А—Д–∞—А–Є–љ, CYP1C19 –Є CYP3–Р4, –Њ–Ї–Є—Б–ї—П—О—Й–Є—Е –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї –Є –љ–µ –њ—А–Є–≤–Њ–і–Є—В –љ–Є –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–∞, –љ–Є –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Т –±–Њ–ї—М—И–Њ–Љ —З–Є—Б–ї–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ –љ–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г–µ—В —Б —В–µ–Њ—Д–Є–ї–ї–Є–љ–Њ–Љ –Є –Ї–Њ—Д–µ–Є–љ–Њ–Љ, –і–Є–∞–Ј–µ–њ–∞–Љ–Њ–Љ, –≤–∞—А—Д–∞—А–Є–љ–Њ–Љ, –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–Њ–Љ, —Д–µ–љ–Є—В–Њ–Є–љ–Њ–Љ, –Ї–∞—А–±–∞–Љ–∞–Ј–µ–њ–Є–љ–Њ–Љ, –љ–Є—Д–µ–і–Є–њ–Є–љ–Њ–Љ, –Љ–µ—В–Њ–њ—А–Њ–ї–Њ–ї–Њ–Љ –Є –≥–ї–Є–±–µ–љ–Ї–ї–∞–Љ–Є–і–Њ–Љ [34]. –Э–µ –±—Л–ї–Њ —В–∞–Ї–ґ–µ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ —Б —Б—Г–±—Б—В—А–∞—В–∞–Љ–Є CYP3 A3, 4, 5, —В–∞–Ї–Є–Љ–Є –Ї–∞–Ї –њ–µ—А–Њ—А–∞–ї—М–љ—Л–µ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤—Л, –Є –µ–≥–Њ –≤–ї–Є—П–љ–Є—П –≤ –і–Њ–Ј–µ 40 –Љ–≥/—Б—Г—В. —Г –Ј–і–Њ—А–Њ–≤—Л—Е –і–Њ–±—А–Њ–≤–Њ–ї—М—Ж–µ–≤ –љ–∞ –∞–±—Б–Њ—А–±—Ж–Є—О –Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ —Н—В–∞–љ–Њ–ї–∞, —П–≤–ї—П—О—Й–µ–≥–Њ—Б—П —Б—Г–±—Б—В—А–∞—В–Њ–Љ CYP2E1 [15,32–34].
–Т –Њ—В–ї–Є—З–Є–µ –Њ—В –њ—А–Є–µ–Љ–∞ –і—А—Г–≥–Є—Е –Ш–Я–Я –і–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Є–µ–Љ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ –±–Њ–ї—М–љ—Л–Љ–Є, –њ–Њ–ї—Г—З–∞—О—Й–Є–Љ–Є –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї –њ–Њ—Б–ї–µ –Ш–Ь, –љ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є—О —А–Є—Б–Ї–∞ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Ш–Ь [35].
–° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–µ–Љ–µ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ –≤—Л–Ј—Л–≤–∞—В—М –≥–Є–њ–µ—А–≥–∞—Б—В—А–Є–љ–µ–Љ–Є—О –Є —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —Н–љ—В–µ—А–Њ—Е—А–Њ–Љ–∞—Д—Д–Є–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ –ґ–µ–ї—Г–і–Ї–∞ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –љ–µ –Љ–µ–љ—М—И–µ–є, —З–µ–Љ —Г –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ –Є –ї–∞–љ—Б–Њ–њ—А–∞–Ј–Њ–ї–∞. –Я—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–µ–Љ–µ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ —З–∞—Б—В–Њ—В–∞ —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –і–ї—П –Ш–Я–Я –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ (–і–Є–∞—А–µ—П, –Љ–µ—В–µ–Њ—А–Є–Ј–Љ, –±–Њ–ї–Є –≤ –ґ–Є–≤–Њ—В–µ, –Ј–∞–њ–Њ—А, –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М –Є –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ) –љ–µ –њ—А–µ–≤—Л—И–∞–ї–∞ —Б—А–µ–і–љ–Є—Е –і–ї—П –Ш–Я–Я 1,5–2,5% [15,34].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї (–Ъ–Њ–љ—В—А–Њ–ї–Њ–Ї®), —П–≤–ї—П—П—Б—М –Њ–і–љ–Є–Љ –Є–Ј —Б–∞–Љ—Л—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є, —В–∞–Ї–ґ–µ –Њ–±–ї–∞–і–∞–µ—В –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –µ–≥–Њ –і–ї—П –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Є —Б –Њ—В—П–≥–Њ—Й–µ–љ–љ—Л–Љ –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л–Љ —Б—В–∞—В—Г—Б–Њ–Љ –љ–µ–Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ –і–Њ–ї–≥–Њ. –Ф–ї—П –ї–µ—З–µ–љ–Є—П —Н—А–Њ–Ј–Є–≤–љ–Њ-—П–Ј–≤–µ–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –Є–ї–Є –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б –њ—А–Є–µ–Љ–Њ–Љ –Э–Я–Т–Я –љ–µ—П–Ј–≤–µ–љ–љ–Њ–є –і–Є—Б–њ–µ–њ—Б–Є–Є –Ъ–Њ–љ—В—А–Њ–ї–Њ–Ї® –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Є–љ–Є–Љ–∞—В—М –≤–љ—Г—В—А—М –њ–Њ 40 –Љ–≥ 2 —А–∞–Ј–∞/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 5–7 –і–љ–µ–є –ї–µ—З–µ–љ–Є—П. –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —З–µ—А–µ–Ј 5 –і–љ–µ–є –њ—А–Є–µ–Љ–∞, –њ–Њ—Б–ї–µ —Г—Б—В–Њ–є—З–Є–≤–Њ–є –ї–Є–Ї–≤–Є–і–∞—Ж–Є–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤–Њ–Ј–Љ–Њ–ґ–µ–љ –њ–µ—А–µ—Е–Њ–і –љ–∞ –њ—А–Є–µ–Љ 40 –Љ–≥ –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–Њ–љ—В—А–Њ–ї–Њ–Ї® 1 —А–∞–Ј/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 2 –љ–µ–і. –Ф–ї—П –њ–µ—А–≤–Є—З–љ–Њ–є –Є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є–Є 20 –Љ–≥ –Ъ–Њ–љ—В—А–Њ–ї–Њ–Ї–∞® –њ—А–Є–љ–Є–Љ–∞—О—В 1 —А–∞–Ј/—Б—Г—В. –±–µ–Ј –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–є –Њ–±—Й–µ–є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–Є–µ–Љ–∞. –С–Њ–ї—М–љ—Л–Љ —Б –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є –њ–Њ—З–µ–Ї –Є –њ–µ—З–µ–љ–Є –љ–µ —Б–ї–µ–і—Г–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М –±–Њ–ї–µ–µ 20 –Љ–≥ –Ъ–Њ–љ—В—А–Њ–ї–Њ–Ї–∞® –≤ —Б—Г—В–Ї–Є –±–µ–Ј –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ—А–Њ–±.
–Э–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј (—А–µ—Ж–Є–і–Є–≤ –Є–ї–Є –ї–µ—В–∞–ї—М–љ—Л–є –Є—Б—Е–Њ–і) —В–µ–Ї—Г—Й–µ–≥–Њ –Є–ї–Є —Б–Њ—Б—В–Њ—П–≤—И–µ–≥–Њ—Б—П –Ц–Ъ–Ъ —В–µ—Б–љ–Њ —Б–≤—П–Ј–∞–љ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Г—Б—В–Њ–є—З–Є–≤–Њ–є –≥–Є–њ–Њ—В–Њ–љ–Є–Є –Є –≥–Є–њ–Њ–≤–Њ–ї–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —И–Њ–Ї–∞, –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А–Њ–≥–Њ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б –Њ–±—К–µ–Љ–Њ–Љ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Ї –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–Є –Є–ї–Є –Ї —А–µ—Ж–Є–і–Є–≤—Г –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 72 —З. –†–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —Н—В–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є–Љ–µ–µ—В—Б—П —Г 20% –±–Њ–ї—М–љ—Л—Е, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –±–Њ–ї–µ–µ —З–µ–Љ –≤ 80% —Б–ї—Г—З–∞–µ–≤ –Ц–Ъ–Ъ –≤ —В–µ—З–µ–љ–Є–µ 2–12 —З –њ—А–µ–Ї—А–∞—Й–∞–µ—В—Б—П —Б–њ–Њ–љ—В–∞–љ–љ–Њ. –Ґ–∞–Ї, –љ–µ —Б—В—А–∞—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–∞—П –њ–Њ –≤–Њ–Ј—А–∞—Б—В—Г –Њ–±—Й–∞—П –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–∞—П –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –њ—А–Є —А–µ—Ж–Є–і–Є–≤–µ –Њ—Б—В—А–Њ–≥–Њ –Ц–Ъ–Ъ –і–Њ—Б—В–Є–≥–∞–µ—В 15–40%, –∞ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–∞—П – 40–60% [8,27].
–Я—А–µ–і–Є–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞/—А–µ—Ж–Є–і–Є–≤–∞ –Ц–Ъ–Ъ —Б—З–Є—В–∞—О—В—Б—П:
• –≤–Њ–Ј—А–∞—Б—В –±–Њ–ї–µ–µ 60 –ї–µ—В;
• —И–Њ–Ї (—Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –Р–Ф <100 –Љ–Љ —А—В. —Б—В. —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ <60 –ї–µ—В, <120 –Љ–Љ —А—В. —Б—В. —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ >60 –ї–µ—В);
• –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –±—А–∞–і–Є–Ї–∞—А–і–Є—П –Є–ї–Є –І–°–° >120 –≤ –Љ–Є–љ.;
• –њ–Њ—Б—В—Г—А–∞–ї—М–љ–∞—П (–Њ—А—В–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–∞—П) —В–∞—Е–Є–Ї–∞—А–і–Є—П –Є –≥–Є–њ–Њ—В–Њ–љ–Є—П;
• —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–µ—З–µ–љ–Є;
• —В—П–ґ–µ–ї—Л–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–µ—А–і—Ж–∞, –Њ—А–≥–∞–љ–Њ–≤ –і—Л—Е–∞–љ–Є—П, –њ–Њ—З–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, –±–ї–∞—Б—В–Њ–Љ–∞—В–Њ–Ј–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П;
• –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є –і–Є–∞—В–µ–Ј, –і–ї–Є—В–µ–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞–Љ–Є –Є –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–∞–Љ–Є;
• –љ–∞—А—Г—И–µ–љ–Є—П —Б–Њ–Ј–љ–∞–љ–Є—П.
–Ъ–∞–Ї –Є –љ–∞ —Н—В–∞–њ–µ –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є, –≤–∞–ґ–љ–µ–є—И–Є–Љ–Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–Љ–Є, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є–Љ–Є —Г–ї—Г—З—И–Є—В—М –Є—Б—Е–Њ–і—Л –Ц–Ъ–Ъ, —П–≤–ї—П—О—В—Б—П –∞–і–µ–Ї–≤–∞—В–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –њ—А–Њ–≥–љ–Њ–Ј–∞ –Є —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–∞—П –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є—П —Г —Н—В–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є –Є, —З–∞—Б—В–Њ, – –і–Њ–≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–є –Є–љ—Д—Г–Ј–Є–Њ–љ–љ–Њ–є –Є –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Ґ–∞–Ї, —Г –±–Њ–ї—М–љ—Л—Е —Б –Ю–Ъ–° –Ї –њ—А–µ–і–Є–Ї—В–Њ—А–∞–Љ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї «—Б—В—А–µ—Б—Б–Њ–≤–Њ–≥–Њ» –Ц–Ъ–Ъ –Њ—В–љ–Њ—Б—П—В—Б—П (CRUSADE, 2001):
• –≤–Њ–Ј—А–∞—Б—В —Б—В–∞—А—И–µ 65 –ї–µ—В;
• –ѓ–С –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ;
• —В–µ—А–∞–њ–Є—П –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞–Љ–Є;
• –ґ–µ–љ—Б–Ї–Є–є –њ–Њ–ї;
• –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —В—А–Њ–њ–Њ–љ–Є–љ–Њ–≤—Л–є —В–µ—Б—В;
• –љ–µ–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–∞—П –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–Њ–љ–Є—П;
• –љ–Є–Ї–Њ—В–Є–љ–Њ–≤–∞—П –∞–±—Б—В–Є–љ–µ–љ—Ж–Є—П;
• —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М;
• –і—Л—Е–∞—В–µ–ї—М–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М.
–°–Њ–≥–ї–∞—Б–љ–Њ –Ї–Њ–љ—Б–µ–љ—Б—Г—Б—Г –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –і–Њ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Є —А–∞–љ–љ—П—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Ц–Ъ–Ъ —В–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–∞–њ—А–∞–≤–ї–µ–љ–∞ –љ–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –≤–µ—А–Њ—П—В–љ–Њ–≥–Њ «—Н—В–∞–ґ–∞» –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П/ –Љ–∞—Б—И—В–∞–±–∞ –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–Є, –≤—Л—П–≤–ї–µ–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–µ–≥–Њ—Б—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, –∞ —Б—В—А–∞—В–µ–≥–Є—З–µ—Б–Ї–Є – –љ–∞ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї—Г—О —Б–Њ—А—В–Є—А–Њ–≤–Ї—Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—Л—Б–Њ–Ї–Њ–≥–Њ –Є–ї–Є –љ–Є–Ј–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ —Б–Љ–µ—А—В–Є/—А–µ—Ж–Є–і–Є–≤–∞ –Ц–Ъ–Ъ, –Ї–Њ—В–Њ—А—Л–є –Є –і–Њ–ї–ґ–µ–љ –Њ–њ—А–µ–і–µ–ї—П—В—М –Њ–±—К–µ–Љ —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є (—Г—А–Њ–≤–µ–љ—М –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є A) [4].
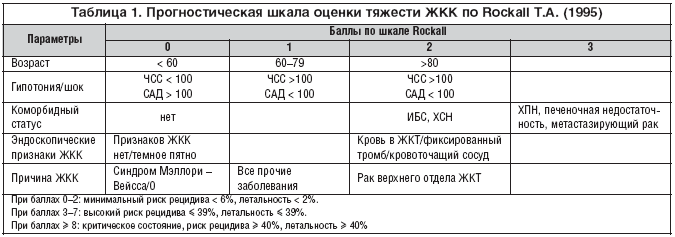
–Э–∞ –њ—А–∞–Ї—В–Є–Ї–µ –Њ–±—К–µ–Ї—В–Є–≤–Є–Ј–Є—А–Њ–≤–∞—В—М —В—П–ґ–µ—Б—В—М —Б–Њ—Б—В–Њ—П–љ–Є—П –Є –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–є —Б –љ–µ–є —А–Є—Б–Ї –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ –Љ–Њ–ґ–љ–Њ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –ї—О–±–Њ–є –≤–∞–ї–Є–і–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є —И–Ї–∞–ї—Л, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–µ–є –Є–љ—В–µ–≥—А–∞–ї—М–љ–Њ –Њ—Ж–µ–љ–Є—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –±–Њ–ї—М–љ–Њ–≥–Њ –Є –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л–є —Б—В–∞—В—Г—Б, –љ–∞–њ—А–Є–Љ–µ—А —И–Ї–∞–ї –РPACHE –Є–ї–Є Rockall (1995) (—Г—А–Њ–≤–µ–љ—М –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є –Т) [4]. –Т –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є –њ—А–Є –Њ–Ї–∞–Ј–∞–љ–Є–Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ–Њ–Љ—Г —Б –Ц–Ъ–Ъ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О —И–Ї–∞–ї—Г (—В–∞–±–ї. 1), –Ї–Њ—В–Њ—А–∞—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –≤–∞–ґ–љ–µ–є—И–Є—Е –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–≤ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –њ—А–Њ–≥–љ–Њ–Ј–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–∞–Ј–і–µ–ї–Є—В—М –±–Њ–ї—М–љ—Л—Е –љ–∞ —В—А–Є –Ї–∞—В–µ–≥–Њ—А–Є–Є: —Б –љ–Є–Ј–Ї–Є–Љ, –≤—Л—Б–Њ–Ї–Є–Љ –Є –Ї—А–Є—В–Є—З–µ—Б–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —А–Є—Б–Ї–∞ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –њ—А–Њ–≥–љ–Њ–Ј–∞ [30].
–°–Њ–≥–ї–∞—Б–љ–Њ –Ї–Њ–љ—Б–µ–љ—Б—Г—Б—Г, –±–Њ–ї—М–љ—Л–Љ –≤ –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є –Є–ї–Є –Є–Љ–µ—О—Й–Є–Љ –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї —А–µ—Ж–Є–і–Є–≤–∞ –Ц–Ъ–Ъ (3 –Є –±–Њ–ї–µ–µ –±–∞–ї–ї–Њ–≤ –њ–Њ —И–Ї–∞–ї–µ Rockall) —Г–ґ–µ –љ–∞ –і–Њ–≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–Љ —Н—В–∞–њ–µ —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В –і–≤–∞ –Ї—Г–±–Є—В–∞–ї—М–љ—Л—Е –Ї–∞—В–µ—В–µ—А–∞ –Є –љ–∞—З–Є–љ–∞—О—В –∞–Ї—В–Є–≤–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –Є–Ј–Њ—В–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–Є—Б—В–∞–ї–ї–Њ–Є–і–љ—Л—Е –Є –њ–ї–∞–Ј–Љ–Њ–Ј–∞–Љ–µ—Й–∞—О—Й–Є—Е —А–∞—Б—В–≤–Њ—А–Њ–≤ –і–ї—П –≤–Њ–Ј–Љ–µ—Й–µ–љ–Є—П –њ–Њ—В–µ—А–Є –Ю–¶–Ъ [30]. –С–Њ–ї—М–љ—Л–µ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–µ—Ж–Є–і–Є–≤–∞ –і–Њ–ї–ґ–љ—Л –±—Л—В—М —Н–Ї—Б—В—А–µ–љ–љ–Њ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л –≤ –Њ—В–і–µ–ї–µ–љ–Є–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞ —Б –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –∞–њ–њ–∞—А–∞—В–љ–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є—П –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є –Є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–Љ–Њ—Б—В–∞–Ј–∞. –Ю–і–љ–∞–Ї–Њ –≤–∞–ґ–љ–µ–є—И–Є–Љ –Љ–µ—В–Њ–і–Њ–Љ —Г–ї—Г—З—И–µ–љ–Є—П –њ—А–Њ–≥–љ–Њ–Ј–∞ —В–µ–Ї—Г—Й–µ–≥–Њ –Ц–Ъ–Ъ —В–∞–Ї–ґ–µ —Б–ї—Г–ґ–Є—В —А–∞–љ–љ—П—П –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–∞—П —В–µ—А–∞–њ–Є—П, –љ–∞—Ж–µ–ї–µ–љ–љ–∞—П –љ–∞ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ –≤ –ґ–µ–ї—Г–і–Ї–µ —Г—А–Њ–≤–љ—П —А–Э >6. –Я–Њ –і–∞–љ–љ—Л–Љ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ш–Я–Я –±–Њ–ї—М–љ—Л–Љ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ –Є —Г—Б—В–Њ–є—З–Є–≤—Л–є –Ї–Њ–љ—В—А–Њ–ї—М —А–Э >6 –≤ —В–µ—З–µ–љ–Є–µ —Б—Г—В–Њ–Ї –њ–Њ–Ј–≤–Њ–ї—П–µ—В –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М –Ї–Є—Б–ї–Њ—В–љ—Л–є –њ—А–Њ—В–µ–Њ–ї–Є–Ј —В—А–Њ–Љ–±–∞ –Є —В–µ–Љ —Б–∞–Љ—Л–Љ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—В—М —А–µ—Ж–Є–і–Є–≤, —Г–Љ–µ–љ—М—И–∞–µ—В –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –і–Њ 2–3% –Є —А–µ–Ј–Ї–Њ —Б–љ–Є–ґ–∞–µ—В –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –≥–µ–Љ–Њ—В—А–∞–љ—Б—Д—Г–Ј–Є–Є –Є –Њ–±—Й—Г—О —Б—В–Њ–Є–Љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П [38,39].
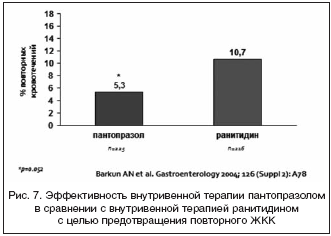
–Ю—З–µ–≤–Є–і–љ–Њ, —З—В–Њ —В–∞–Ї–∞—П –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–∞—П —В–µ—А–∞–њ–Є—П —В—А–µ–±—Г–µ—В –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ–≥–Њ –∞–љ—В–Є–∞—Ж–Є–і–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—А–µ–і—Б—В–≤–∞ —Б –Ї–∞–Ї –Љ–Њ–ґ–љ–Њ –±–Њ–ї–µ–µ –±—Л—Б—В—А—Л–Љ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ–Љ —Б–µ–Ї—А–µ—Ж–Є–Є —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Т —В–µ—З–µ–љ–Є–µ –Љ–љ–Њ–≥–Є—Е –ї–µ—В, –і–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П –≤ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ —А–∞—Б—В–≤–Њ—А–∞ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ –і–ї—П –Є–љ—Д—Г–Ј–Є–є —Н—В–Є–Љ —В—А–µ–±–Њ–≤–∞–љ–Є—П–Љ –њ–Њ—З—В–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–Є —В–Њ–ї—М–Ї–Њ –Э2––±–ї–Њ–Ї–∞—В–Њ—А—Л —А–∞–љ–Є—В–Є–і–Є–љ –Є —Д–∞–Љ–Њ—В–Є–і–Є–љ, –Ї–Њ—В–Њ—А—Л–µ –Є –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М —И–Є—А–Њ–Ї–Њ –і–ї—П –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–µ—Ж–Є–і–Є–≤–∞ –Ц–Ъ–Ъ [37]. –Я–Њ –і–∞–љ–љ—Л–Љ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞, —В–µ—А–∞–њ–Є—П –Э2––±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –њ—А–Є–≤–Њ–і–Є–ї–∞ –Ї 40–50––њ—А–Њ—Ж–µ–љ—В–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О —А–Є—Б–Ї–∞ –њ–Њ–≤—В–Њ—А–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є —Г –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –±–Њ–ї—М–љ—Л—Е, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –Р–°–Ъ [40]. –Ю–і–љ–∞–Ї–Њ —В–µ—А–∞–њ–Є—П —А–∞–љ–Є—В–Є–і–Є–љ–Њ–Љ [36] –Є —Д–∞–Љ–Њ—В–Є–і–Є–љ–Њ–Љ [43] –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є, —З–µ–Љ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ (—А–Є—Б. 7) [40,41].
–Я–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї –Њ–Ї–∞–Ј–∞–ї—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–µ–µ, —З–µ–Љ –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Г–Љ–µ–љ—М—И–µ–љ–Є—П —З–∞—Б—В–Њ—В—Л —А–µ—Ж–Є–і–Є–≤–Њ–≤ –Ц–Ъ–Ъ, –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –≤ —Б–≤—П–Ј–Є —Б —А–µ—Ж–Є–і–Є–≤–Њ–Љ –Ц–Ъ–Ъ –Є –Њ–±—Й–µ–є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є (—А–Є—Б. 8) [44].
–Ф–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —А–µ—Ж–Є–і–Є–≤–Є—А–Њ–≤–∞–љ–Є—П –Ц–Ъ–Ъ –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —П–Ј–≤/—Н—А–Њ–Ј–Є–є –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї –љ–∞–Ј–љ–∞—З–∞—О—В –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –њ–Њ 40 –Љ–≥ –Ї–∞–ґ–і—Л–µ 12 —З –і–Њ —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ –Є –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Г—Б—В–Њ–є—З–Є–≤–Њ–≥–Њ –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ –њ–Њ –і–∞–љ–љ—Л–Љ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є–Є. –Я—А–Є–Љ–µ—А–љ–∞—П —Б—Е–µ–Љ–∞ –≤–µ–і–µ–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ —Б–Њ —Б—В—А–µ—Б—Б–Њ–≤—Л–Љ–Є —П–Ј–≤–∞–Љ–Є –Є/–Є–ї–Є –Ц–Ъ–Ъ: –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї (–Ъ–Њ–љ—В—А–Њ–ї–Њ–Ї®) 40 –Љ–≥ –Ї–∞–ґ–і—Л–µ 12 —З –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 3–7 –і–љ–µ–є, –Ј–∞—В–µ–Љ per os –≤ —В–µ—З–µ–љ–Є–µ 7 –і–љ–µ–є –њ–Њ 40 –Љ–≥ 2 —А–∞–Ј–∞/—Б—Г—В., –Ј–∞—В–µ–Љ –њ–Њ 40 –Љ–≥ 1 —А–∞–Ј/—Б—Г—В., –њ—А–Є–љ–Є–Љ–∞—В—М –≤ 17.00–18.00 —З –і–Њ 4 –љ–µ–і. [11]. –Ф–∞–љ–љ–∞—П —Б—Е–µ–Љ–∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В –Ї–Є—Б–ї–Њ—В–љ—Г—О –∞–≥—А–µ—Б—Б–Є—О –≤ –ґ–µ–ї—Г–і–Ї–µ —Г –±–Њ–ї—М–љ–Њ–≥–Њ, –љ–∞—Е–Њ–і—П—Й–µ–≥–Њ—Б—П –≤ –љ–∞–Є–±–Њ–ї–µ–µ –Њ–њ–∞—Б–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ, –±–ї–Њ–Ї–Є—А—Г–µ—В –љ–Њ—З–љ—Г—О —Б–µ–Ї—А–µ—Ж–Є—О —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –љ–Њ–Ј–Њ–Ї–Њ–Љ–Є–∞–ї—М–љ—Л—Е –њ–љ–µ–≤–Љ–Њ–љ–Є–є.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Љ–Њ–ґ–љ–Њ —Г—В–≤–µ—А–ґ–і–∞—В—М, —З—В–Њ –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї (–Ъ–Њ–љ—В—А–Њ–ї–Њ–Ї®) –≤ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ 40 –Љ–≥ —П–≤–ї—П–µ—В—Б—П –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –Є –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤—Л–±–Њ—А–∞ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ—Л—Е —Н—А–Њ–Ј–Є–≤–љ–Њ–—П–Ј–≤–µ–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –Є –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –љ–Є–Љ–Є –Ц–Ъ–Ъ, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—В—П–≥–Њ—Й–µ–љ–љ—Л–Љ –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л–Љ —Д–Њ–љ–Њ–Љ, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –і–ї–Є—В–µ–ї—М–љ—Л–Љ –њ—А–Є–µ–Љ–Њ–Љ –Р–°–Ъ, –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–Њ–≤ –Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤.


![–†–Є—Б. 4. –Ю–±—Й–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М –Њ—В –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –Э–Я–Т–Я –њ–Њ—А–∞–ґ–µ–љ–Є–є –Ц–Ъ–Ґ [22]](/data/articles/Image/t20/n15/771-4.gif)
![–†–Є—Б. 8. –°—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ –Є –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ (–Ъ–Њ–љ—В—А–Њ–ї–Њ–Ї¬Ѓ) –њ—А–Є –Ц–Ъ–Ъ [44]](/data/articles/Image/t20/n15/771-8.gif)
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –®–µ–њ—В—Г–ї–Є–љ –Р.–Р. –Ъ—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –Є–Ј –љ–Є–ґ–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ // –†–Ь–Ц. –С–Ю–Я. 2000. –Ґ. 2. вДЦ 2. –°. 36–40.
2. –®–∞–њ–Њ—И–љ–Є–Ї–Њ–≤ –Р.–Т. –ѓ–Ј–≤–µ–љ–љ–∞—П –±–Њ–ї–µ–Ј–љ—М. –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–µ –љ–∞–±–ї—О–і–µ–љ–Є—П. –†–Њ—Б—Б–Є–є—Б–Ї–Є–є –ґ—Г—А–љ–∞–ї –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є–Є, –≥–µ–њ–∞—В–Њ–ї–Њ–≥–Є–Є, –Ї–Њ–ї–Њ–њ—А–Њ–Ї—В–Њ–ї–Њ–≥–Є–Є (–Ь–∞—В–µ—А–Є–∞–ї—Л –Ґ—А–Є–љ–∞–і—Ж–∞—В–Њ–є –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –љ–µ–і–µ–ї–Є 22–24 –Њ–Ї—В—П–±—А—П 2007 –≥., –≥. –Ь–Њ—Б–Ї–≤–∞). 2007. вДЦ 5.. –°. 39.
3. Brzozowski T., Konturek P.C., Sliwowski Z. et al. Interaction of nonsteroidal anti–inflammatory drugs (NSAID) with Helicobacter pylori in the stomach of humans and experimental animals // J PhysiolPharmacol. 2006 Sep. Vol. 57 Suppl 3. –†. 67–79.
4. Barkun A., Bardou M., Marshall J.K. Consensus Recommendations for Managing Patients with Nonvariceal Upper Gastrointestinal Bleeding // Ann Intern Med. 2003.Vol. 139 (10). –†. 843–857.
5. Scottish Intercollegiate Guidelines Network (SIGN). Management of acute upper and lower gastrointestinal bleeding. A national clinical guideline. Edinburgh (Scotland): Scottish Intercollegiate Guidelines Network (SIGN); 2008 Sep. 57 p. (SIGN publication; no. 105).
6. Celinski K. et al. Journal of Physiology and Pharmacology. 2008. Vol. 59 (Suppl 2). –†. 215– 229.
7. –Ъ—Г—А—Л–≥–Є–љ –Р.–Р., –°—В–Њ–є–Ї–Њ –Ѓ.–Ь., –С–∞–≥–љ–µ–љ–Ї–Њ –°.–§. –Э–µ–Њ—В–ї–Њ–ґ–љ–∞—П —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–∞—П –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—П. –°–њ–±.: –Я–Є—В–µ—А, 2001. 568 —Б.
8. –°–Њ—В–љ–Є–Ї–Њ–≤ –Т. –Э., –Ф—Г–±–Є–љ—Б–Ї–∞—П –Ґ. –Ъ., –†–∞–Ј–ґ–Є–≤–Є–љ–∞ –Р. –Р. –≠–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л –ї–µ—З–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є–Ј –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞: –£—З–µ–±–љ–Њ–µ –њ–Њ—Б–Њ–±–Є–µ. –Ь.: –†–Ь–Р–Я–Ю, 2000. 48 —Б.
9. –Т–µ—А—В–Ї–Є–љ –Р.–Ы., –Ч–∞–є—А–∞—В—М—П–љ—Ж –Ю.–Т., –Т–Њ–≤–Ї –Х.–Ш. –Ю–Ї–Њ–љ—З–∞—В–µ–ї—М–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј. –Ь.: –У–≠–Ю–Ґ–Р–†––Ь–µ–і, 2008.
10. –Ю—В—З–µ—В –Ь–Њ—Б–Ї–Њ–≤—Б–Ї–Њ–≥–Њ –≥–Њ—А–Њ–і—Б–Ї–Њ–≥–Њ —Ж–µ–љ—В—А–∞ –њ–∞—В–Њ–ї–Њ–≥–Њ––∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Ф–µ–њ–∞—А—В–∞–Љ–µ–љ—В–∞ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –≥–Њ—А–Њ–і–∞ –Ь–Њ—Б–Ї–≤—Л, 2010.
11. –ѓ–Ї–Њ–≤–µ–љ–Ї–Њ –≠.–Я., –ѓ–Ї–Њ–≤–µ–љ–Ї–Њ –Р.–Т., –Ш–ї–ї–∞—А–Є–Њ–љ–Њ–≤–∞ –Р.–Э. –Є –і—А. –Ы–µ—З–∞—Й–Є–є –Т—А–∞—З. 2010. вДЦ 2. C. 21.
12. Leontiadis G.I., Sreedharan A., Dorward S. // Health Technology Assessment. 2007. 11(51): 25.
13. Van Leerdam M.E., Vreeburg E.M., Rauws E.A.J. et al. Acute upper GI bleeding: Did anything change? // Am J Gastroenterol. 2003. Vol. 98. –†. 1494–1499.
14. Geyer M et al. Application of bleeding prophylactic criteria (NICE) in patients with acute gastrointestinal bleeding. SWISS MED WKLY 2007; Vol. 137:146–150.
15. –Ш—Б–∞–Ї–Њ–≤ –Т.–Р. –С–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ—А–Њ—В–Њ–љ–љ–Њ–≥–Њ –љ–∞—Б–Њ—Б–∞ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є // –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—П –Є —В–µ—А–∞–њ–Є—П. – 2004. – вДЦ13(1).
16. –Ы–Њ–≥–Є–љ–Њ–≤ –Р.–°., –Ч–≤–µ–љ–Є–≥–Њ—А–Њ–і—Б–Ї–∞—П –Ы.–Р., –Я–Њ—В–∞–њ–Њ–≤–∞ –Т.–С. –Є —Б–Њ–∞–≤—В. –Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –њ–µ–њ—В–Є—З–µ—Б–Ї–Њ–є —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О —Б–µ—А–і—Ж–∞. –Ґ–µ—А –Р—А—Е., 1998;70(2):9–13.
17. –Т–µ—А—В–Ї–Є–љ –Р.–Ы., –§—А–Њ–ї–Њ–≤–∞ –Ѓ.–Т., –Р–і–Њ–љ–Є–љ–∞ –Х.–Т, –Я–µ—В—А–Є–Ї –Х.–Р., –Т–Њ–≤–Ї –Х.–Ш. –Ю—Ж–µ–љ–Ї–∞ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ—Л–Љ —Б –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О —Б–µ—А–і—Ж–∞. вДЦ16 (170) 2008; –°. 33–38.
18. Hawkey C.J., Lanas A.I. Doubt and certainty about nonsteroidal anti–inflammatory drugs in the year 2000: a multidisciplinary expert statement. // Am. J. Med. – 2001. – Vol.. 110. – P. 79S–100S.
19. Brooks P. Use and benefits of NSAID. Amer.J.Med. 1998; 104 (3A): 9–13.
20. Silverstein F.E. Improving the gastrointestinal safety of NSAID’s. The development of misoprostol – from hypothesis to clinical practice. Dig.Dis.Sci. 1998; Vol. 43: 447–458.
21. American Gastroenterological Association Clinical Practice and Practice Economics Committee. AGA Medi Position Statement: Evaluation of Dyspepsia. Gastroenterology, 1998; Vol. 114: 579–581
22. Lanas A., Perez–Aisa M.A., Feu F. et al. A Nationwide Study of Mortality Associated with Hospital Admission Due to Severe Gastrointestinal Events and Those Associated with NonsteroidalAntiinflammatory Drug Use. The American Journal of Gastroenterology (2005) Vol. 100, 1685–1693.
23. –Ъ–∞—А–∞—В–µ–µ–≤–Р.–Х. –Ы–µ—З–µ–љ–Є–µ–Є–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–∞—П–њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞–љ–њ–≤–њ––≥–∞—Б—В—А–Њ–њ–∞—В–Є–Є: –Њ—Б–љ–Њ–≤–љ—Л–µ–њ–Њ–ї–Њ–ґ–µ–љ–Є—П. –§–∞—А–Љ–∞—В–µ–Ї–∞. 2006. –†–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П, –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—П, –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—П. вДЦ6 (121). –°.37–45.
24. Significant mortality is associated with NSAID gastropathy. G. Singh and G. Triadafilopoulos, Epidemiology of NSAID induced gastrointestinal complications, Journal of Rheumatology, 1999, Vol. 26, 56, 18–24, by permission of Oxford University Press.
25. Lewis S.C., Langman M., Laporte J.–R. et al. Dose–response relationships between individual nonaspirinnonsteroidal anti–inflammatory drugs and serious upper gastrointestinal bleeding: a meta–analysis based on individual patient data. // Br J ClinPharmacol. 2002; Vol. 54(3): 320–326
26. Derry S., Loke Y.K. Risk of gastrointestinal haemorrhage with long term use of aspirin: meta–analysis. BMJ. 2000 November 11; Vol. 321(7270): 1183–1187
27. ACCF/ACG/AHA 2008 Expert Consensus Document on Reducing the Gastrointestinal Risks of Antiplatelet Therapy and NSAID Use. A Report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents. Circulation 2008; Vol. 118:1894–1909.
28. Lanza F.L., Chan F., Quigley E. et al. Guidelines for Prevention of NSAID–Related Ulcer Complications Am J Gastroenterol 2009; Vol. 104:728 – 738.
29. Chan F, Sung J, Suen B. Prospective randomized trial of H. pylori eradication versus maintenance omeprazole to prevent recurrent upper gastrointestinal hemorrhage in high–risk aspirin and nonaspirin NSAID users. Gastroenterology 2000; Vol. 118:194.
30. Stupnicki T, Dietrich K, Gonzalez–Carro P. Efficacy and tolerability of pantoprazole compared with misoprostol for the prevention of NSAID–related gastrointestinal lesions and symptoms in rheumatic patients. Digestion 2003; Vol. 68: 198–208.
31. RegulaJa., ButrukEu., Dekkers C. et al. Prevention of NSAID–Associated Gastrointestinal Lesions: A Comparison Study Pantoprazole versus Omeprazole. // Amer. J. Gastroenterol. 2006; Vol. 101: P. 1747 – 1755.
32. –Э–Є–Ї–Њ–љ–Њ–≤ –Х. –Ы. –Ъ–ї–Є–љ–Є–Ї–Њ––њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–Є–і–Њ–≤ –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е –Ї–Є—Б–ї–Њ—В–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є. –Р–≤—В–Њ—А–µ—Д. –і–Є—Б. –і–Њ–Ї—В. –Љ–µ–і.–љ–∞—Г–Ї. –Ь., 2004. 22 —Б.
33. Huber R., Hartmann M., Bliesath H. etal. Pharmacokinetics of pantoprazole in man //Int J. Clin. Pharmacol. Ther. 1996; Vol. 34 (5): 185–194.
34. Yang Y.–X., Metz D.C. –С–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л // –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –У–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—П –Є –У–µ–њ–∞—В–Њ–ї–Њ–≥–Є—П. –†—Г—Б—Б–Ї–Њ–µ –Є–Ј–і–∞–љ–Є–µ. – 2010. – –Ґ. 3. – вДЦ 6. – –°. 342–353.
35. Juurlink D.N., Gomes T., etal., CMAJ 2009; Vol. 180(7).
36. BarkunAN et al. Gastroenterology 2004; Vol. 126 (Suppl 2): A78.
37. Vonkeman H, Meek I, –Ьan de Laar M. Risk management of risk management: Combining proton pump inhibitors with low–dose aspirin. Drug Healthc Patient Saf. 2010; Vol. 2: 191–204.
38. Palmer K, Nairn M. Management of acute gastrointestinal blood loss: summary of SIGN. BMJ 2008; Vol. 337:a1832
39. British Society of Gastroenterology Endoscopy Committee. Non–variceal upper gastrointestinal haemorrhage: guidelines. Gut 2002; Vol. 51 (Suppl 4): IV1–IV6).
40. Bardou M, Toubouti YM, Benhaberou–Brun D et al. High dose intravenous proton pump inhibitors decrease both re–bleeding and mortality in high–risk patients with acute peptic ulcer bleeding: a series of meta–analyses. Gastroenterology 2003; Vol. 124 (Suppl 1): A625.
41. Leontiadis GI, Sharma VK, Howden CW. Proton pump inhibitor treatment for acute peptic ulcer bleeding. Cochrane Data base Syst Rev 2006; Vol. 1: CD002094.
42. Yeomans N., Lanas A., Labenz J. et al. Efficacy of Esomeprazole (20 mg Once Daily) for Reducing the Risk of Gastroduodenal Ulcers Associated With Continuous Use of Low–Dose AspirinEfficacy of Esomeprazole for Reducing the Risk of Gastroduodenal Ulcers // The American Journal of Gastroenterology. 2008. Vol. 103. –†. 2465–2473.
43. Ng F.H., Wong S.Y., Lam K.F. wet al. Famotidine is inferior to pantoprazole in preventing recurrence of aspirin–related peptic ulcers or erosions // Gastroenterology. 2010 Jan. Vol. 138 (1). –†. 82–88.
44. Chahin N.J. et al. // Can J Gastroenterol. 2006. Vol. 20. Suppl A. –†112.












