
–§–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–∞—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ вАУ –њ—А–µ–њ–∞—А–∞—В STW 5 (–Ш–±–µ—А–Њ–≥–∞—Б—В¬Ѓ) —Б–Њ–і–µ—А–ґ–Є—В 15 –Љ–ї —Н–Ї—Б—В—А–∞–Ї—В–∞ –Є–±–µ—А–Є–є–Ї–Є –≥–Њ—А—М–Ї–Њ–є (1:2, —Н–Ї—Б—В—А–∞–≥–µ–љ—В —Н—В–∞–љ–Њ–ї 50%) –Є —Н–Ї—Б—В—А–∞–Ї—В—Л (1:3, —Н–Ї—Б—В—А–∞–≥–µ–љ—В —Н—В–∞–љ–Њ–ї 30%) –Ї–Њ—А–љ—П –і—П–≥–Є–ї—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ (10 –Љ–ї), —А–∞—Б—В–Њ—А–Њ–њ—И–Є –њ—П—В–љ–Є—Б—В–Њ–є (10 –Љ–ї), –њ–ї–Њ–і–Њ–≤ —В–Љ–Є–љ–∞ –Њ–±—Л–Ї–љ–Њ–≤–µ–љ–љ–Њ–≥–Њ (10 –Љ–ї), —З–Є—Б—В–Њ—В–µ–ї–∞ –Љ–∞–є—Б–Ї–Њ–≥–Њ (10 –Љ–ї), —А–Њ–Љ–∞—И–Ї–Є –∞–њ—В–µ—З–љ–Њ–є (20 –Љ–ї), —Б–Њ–ї–Њ–і–Ї–Є –≥–Њ–ї–Њ–є (10 –Љ–ї), –Љ–µ–ї–Є—Б—Б—Л –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є (10 –Љ–ї) –Є –Љ—П—В—Л –њ–µ—А–µ—З–љ–Њ–є (5 –Љ–ї) –љ–∞ 100 –Љ–ї —А–∞—Б—В–≤–Њ—А–∞. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Н—В–Њ—В –њ—А–µ–њ–∞—А–∞—В —В–∞–Ї –ґ–µ —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –≤ –ї–µ—З–µ–љ–Є–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –і–Є—Б–њ–µ–њ—Б–Є–Є –Є —Б–Є–љ–і—А–Њ–Љ–∞ —А–∞–Ј–і—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞ [Saller R. –Є —Б–Њ–∞–≤—В., 2002; Roesch W. –Є —Б–Њ–∞–≤—В., 2006], –Ї–∞–Ї –Є —Ж–Є–Ј–∞–њ—А–Є–і [Roesch W. –Є —Б–Њ–∞–≤—В., 2002] –Є –Љ–µ—В–Њ–Ї–ї–Њ–њ—А–∞–Љ–Є–і [Nikolay K., 1984], –љ–Њ –Њ–±–ї–∞–і–∞–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–Є–Љ —З–Є—Б–ї–Њ–Љ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤.
–Т —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –љ–∞ –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –њ–Њ–і–≤–Ј–і–Њ—И–љ–Њ–є –Ї–Є—И–Ї–µ –Љ–Њ—А—Б–Ї–Њ–є —Б–≤–Є–љ–Ї–Є –њ—А–Є —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ–Њ–Љ –Є–ї–Є –≥–Є—Б—В–∞–Љ–Є–љ–Њ–Љ –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ —Б–њ–∞–Ј–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Ш–±–µ—А–Њ–≥–∞—Б—В–∞ [Ammon H. –Є —Б–Њ–∞–≤—В., 2006]. –Я—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –Ш–±–µ—А–Њ–≥–∞—Б—В –Є –µ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В вАУ –Є–±–µ—А–Є–є–Ї–∞ –≥–Њ—А—М–Ї–∞—П –њ–Њ–≤—Л—И–∞–ї–Є –±–∞–Ј–∞–ї—М–љ—Л–є —В–Њ–љ—Г—Б –≥–ї–∞–і–Ї–Є—Е –Љ—Л—И—Ж [Okpanyi S. –Є —Б–Њ–∞–≤—В., 1993; Ammon H. –Є —Б–Њ–∞–≤—В., 2006; Michael S. –Є —Б–Њ–∞–≤—В., 2006]. In vitro –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ —Б–Њ–Ї—А–∞—В–Є—В–µ–ї—М–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Ї–∞ [Schemann M. –Є —Б–Њ–∞–≤—В., 2006], —З—В–Њ —В–∞–Ї–ґ–µ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є [Pilichiewicz –Є —Б–Њ–∞–≤—В., 2006]. –Я–Њ–Љ–Є–Љ–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Б–Њ–Ї—А–∞—В–Є—В–µ–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О in vivo –±—Л–ї–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ –≤–ї–Є—П–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ц–Ъ–Ґ [Muller M. –Є —Б–Њ–∞–≤—В., 2006], –∞ —В–∞–Ї–ґ–µ –µ–≥–Њ –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ–µ –њ—А–Њ—В–Є–≤–Њ—П–Ј–≤–µ–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Є —Ж–Є—В–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ [Khayyal M. –Є —Б–Њ–∞–≤—В., 2006].
–§—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –ґ–µ–ї—Г–і–Њ—З–љ–ЊвАУ–Ї–Є—И–µ—З–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —В–∞–Ї–Є–µ –Ї–∞–Ї —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П –і–Є—Б–њ–µ–њ—Б–Є—П (–§–Ф) –Є —Б–Є–љ–і—А–Њ–Љ —А–∞–Ј–і—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞ (–°–†–Ъ) вАУ –Њ–і–љ–Є –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤ —А–∞–Ј–≤–Є—В—Л—Е —Б—В—А–∞–љ–∞—Е [Allescher H., 2006]. –Ы–Є—И—М –љ–µ–і–∞–≤–љ–Њ –±—Л–ї–Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –∞–ї–Њ—Б–µ—В—А–Њ–љ (–∞–љ—В–∞–≥–Њ–љ–Є—Б—В 5вАУ–Э–Ґ3вАУ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤), —Ж–Є–Ј–∞–њ—А–Є–і –Є —В–µ–≥–∞—Б–µ—А–Њ–і (–Њ–±–∞ –∞–≥–Њ–љ–Є—Б—В—Л 5вАУ–Э–Ґ4вАУ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤). –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –љ–µ —Г–≤–µ–љ—З–∞–ї–Њ—Б—М —Г—Б–њ–µ—Е–Њ–Љ: –∞–ї–Њ—Б–µ—В—А–Њ–љ –Є —Ж–Є–Ј–∞–њ—А–Є–і –±—Л–ї–Є –Њ—В–Њ–Ј–≤–∞–љ—Л —Б —А—Л–љ–Ї–∞ –Є–ЈвАУ–Ј–∞ —Б–µ—А—М–µ–Ј–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —П–≤–ї–µ–љ–Є–є, —В–∞–Ї–Є—Е –Ї–∞–Ї –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–є –Ї–Њ–ї–Є—В –Є –љ–∞—А—Г—И–µ–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —А–Є—В–Љ–∞ [Callahan M., 2002; Kamm M., 2002]. –Ю–і–љ–∞–Ї–Њ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б—В—А–∞–љ–∞—Е —Ж–Є–Ј–∞–њ—А–Є–і –±—Л–ї —А–∞–Ј—А–µ—И–µ–љ –Ї –≤—Л–њ–Є—Б–Ї–µ –њ–Њ —Б—В—А–Њ–≥–Є–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –љ–µ–њ–Њ–ї–љ–Њ–≥–Њ –∞–≥–Њ–љ–Є—Б—В–∞ —В–µ–≥–∞—Б–µ—А–Њ–і–∞ –≤—Б–µ –µ—Й–µ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –њ–Њ–ї—Г—З–µ–љ—Л —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞, —З—В–Њ —А–µ—Ж–µ–њ—В–Њ—А—Л 5вАУ–Э–Ґ3 –Є 5вАУ–Э–Ґ4 —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –љ–µ–є—А–Њ–љ–Њ–≤ –њ–Њ–і—Б–ї–Є–Ј–Є—Б—В–Њ–≥–Њ —Б–ї–Њ—П, —В–∞–Ї –ґ–µ –Ї–∞–Ї –Є –Љ—Г—Б–Ї–∞—А–Є–љ–Њ–≤—Л–µ –Ь3вАУ—А–µ—Ж–µ–њ—В–Њ—А—Л –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є –Љ–љ–Њ–≥–Њ–Њ–±–µ—Й–∞—О—Й–Є–µ –Љ–Є—И–µ–љ–Є –і–ї—П –ї–µ—З–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Ц–Ъ–Ґ [Houghton L. –Є —Б–Њ–∞–≤—В., 1997; Prins N. –Є —Б–Њ–∞–≤—В., 1999; Berman S. –Є —Б–Њ–∞–≤—В., 2002]. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –±–ї–Њ–Ї–∞—В–Њ—А—Л –Њ–њ–Є–Њ–Є–і–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Б–µ–є—З–∞—Б –Њ–±—Б—Г–ґ–і–∞—О—В—Б—П –Ї–∞–Ї –љ–Њ–≤—Л–є –Ї–ї–∞—Б—Б –≤ –ї–µ—З–µ–љ–Є–Є –§–Ф [Stanghellini V. –Є —Б–Њ–∞–≤—В., 2003; Camilleri M., 2004].
–Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –і–µ–є—Б—В–≤–Є–µ –Ш–±–µ—А–Њ–≥–∞—Б—В–∞ –љ–∞ —Н—В–Є –Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ –Є–Ј—Г—З–∞–ї–Њ—Б—М, –±—Л–ї–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –љ–∞—Б—В–Њ—П—Й–∞—П —А–∞–±–Њ—В–∞ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –Ї–Њ–љ–Ї—Г—А–µ–љ—В–љ–Њ–≥–Њ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Ш–±–µ—А–Њ–≥–∞—Б—В –Є –µ–≥–Њ —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е.
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л
–°–њ–Є—А—В–Њ–≤—Л–µ —Н–Ї—Б—В—А–∞–Ї—В—Л (—Н–Ї—Б—В—А–∞–≥–µ–љ—В —Н—В–∞–љ–Њ–ї 30%) –Ш–±–µ—А–Њ–≥–∞—Б—В–∞ –±—Л–ї–Є —А–∞–Ј–±–∞–≤–ї–µ–љ—Л –≤–Њ–і–Њ–є –і–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П —Б–ї–µ–і—Г—О—Й–Є—Е —А–∞–Ј–≤–µ–і–µ–љ–Є–є, –Є–Ј—Г—З–∞–µ–Љ—Л—Е –≤ –Њ–њ—Л—В–µ —Б –Ї–Њ–љ–Ї—Г—А–µ–љ—В–љ—Л–Љ —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ–Љ: 1:200, 1:500, 1:1000 –Є 1:10000. –Ъ–Є—И–µ—З–љ–Є–Ї –Ї—А—Л—Б (Wistar, RCC Ltd, –®–≤–µ–є—Ж–∞—А–Є—П) –±—Л–ї –≥–Њ–Љ–Њ–≥–µ–љ–Є–Ј–Є—А–Њ–≤–∞–љ, —Ж–µ–љ—В—А–Є—Д—Г–≥–Є—А–Њ–≤–∞–љ –Є —Е—А–∞–љ–Є–ї—Б—П –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ вАУ80o–°.
–Ґ–µ—Б—В—Л –љ–∞ —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ —Б 5вАУ–Э–Ґ3, 5вАУ–Э–Ґ4, –Љ—Г—Б–Ї–∞—А–Є–љ–Њ–≤—Л–Љ–Є –Ь3, 5вАУ–Э–Ґ1A –Є –Њ–њ–Є–Њ–Є–і–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞ –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М —Б —А–∞–і–Є–Њ–∞–Ї—В–Є–≤–љ–Њ –Љ–µ—З–µ–љ–љ—Л–Љ–Є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є 5вАУ–Э–Ґ3, 5вАУ–Э–Ґ4, –Ь3вАУ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –∞–≥–Њ–љ–Є—Б—В–Њ–Љ 5вАУ–Э–Ґ1AвАУ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є 3–ЭвАУ–љ–∞–ї–Њ–Ї—Б–Њ–љ–Њ–Љ (–љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В), –∞ –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–µ —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ –Њ–њ—А–µ–і–µ–ї—П–ї–Є –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є –Љ–µ—В–Њ–Ї–ї–Њ–њ—А–∞–Љ–Є–і–∞, 5вАУ–Э–Ґ, –∞—В—А–Њ–њ–Є–љ–∞, 8вАУ–Ю–ЭвАУDPAT –Є –љ–∞–ї–Њ–Ї—Б–Њ–љ–∞.
–Ч–љ–∞—З–µ–љ–Є—П IC50 (¬Ђ–Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П 50¬ї вАУ –≤–µ–ї–Є—З–Є–љ–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є, –Є–Ј–Љ–µ–љ—П—О—Й–µ–є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–µ —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ —А–∞–і–Є–Њ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –ї–Є–≥–∞–љ–і–∞ —Б —А–µ—Ж–µ–њ—В–Њ—А–Њ–Љ –љ–∞ 50%), –≤—Л—А–∞–ґ–µ–љ–љ—Л–µ –Ї–∞–Ї —А–∞–Ј–≤–µ–і–µ–љ–Є–µ —Н–Ї—Б—В—А–∞–Ї—В–∞, –Њ–њ—А–µ–і–µ–ї—П–ї–Є –Ї–∞–Ї —А–∞–Ј–љ–Є—Ж—Г –Љ–µ–ґ–і—Г —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ –Є –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ–Љ –њ—А–Є –Ј–∞–і–∞–љ–љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е —Н–Ї—Б—В—А–∞–Ї—В–∞.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
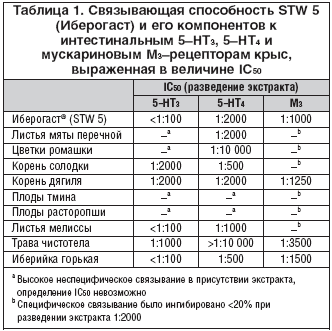
–Ш–±–µ—А–Њ–≥–∞—Б—В –Є 9 –≤—Е–Њ–і—П—Й–Є—Е –≤ –љ–µ–≥–Њ —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є —А–∞–Ј–љ—Г—О —Б–Є–ї—Г —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б 5вАУ–Э–Ґ3, 5вАУ–Э–Ґ4 –Є –Љ—Г—Б–Ї–∞—А–Є–љ–Њ–≤—Л–Љ–Є –Ь3вАУ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є (—В–∞–±–ї. 1). –Т—Л—П–≤–ї–µ–љ–Њ –≤ 10 —А–∞–Ј –±–Њ–ї—М—И–µ–µ —Б—А–Њ–і—Б—В–≤–Њ –Ш–±–µ—А–Њ–≥–∞—Б—В–∞ –Ї 5вАУ–Э–Ґ4 –Є –Ь3вАУ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, —З–µ–Љ –Ї 5вАУ–Э–Ґ3.
–Х—Б–ї–Є –±—А–∞—В—М —Д–∞–Ї—В–Њ—А —А–∞–Ј–≤–µ–і–µ–љ–Є—П —А–∞–≤–љ—Л–Љ –њ—А–Є–Љ–µ—А–љ–Њ 1:1000 –і–ї—П —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤ –Ш–±–µ—А–Њ–≥–∞—Б—В–∞, –њ–Њ–њ–∞–і–∞—О—Й–Є—Е –≤ –ґ–µ–ї—Г–і–Њ–Ї (1 –Љ–ї –њ—А–µ–њ–∞—А–∞—В–∞ –≤ 1 –ї –ґ–µ–ї—Г–і–Њ—З–љ–ЊвАУ–Ї–Є—И–µ—З–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞), —В–Њ –Љ–Њ–ґ–љ–Њ –Њ–±—К—П—Б–љ–Є—В—М —Н—Д—Д–µ–Ї—В—Л, –њ—А–Њ—П–≤–ї—П–µ–Љ—Л–µ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ in vivo, –і–µ–є—Б—В–≤–Є–µ–Љ —Б–µ–Љ–Є –Є–Ј –і–µ–≤—П—В–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤, —З—В–Њ –Њ—В—А–∞–ґ–∞–µ—В –Є—Е IC50 < 1:1000.
–Ґ–∞–Ї, —Н–Ї—Б—В—А–∞–Ї—В –Є–±–µ—А–Є–є–Ї–Є –≥–Њ—А—М–Ї–Њ–є –Є–Ј–±–Є—А–∞—В–µ–ї—М–љ–Њ –Є–љ–≥–Є–±–Є—А—Г–µ—В —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ —Б –Ь3вАУ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є, —В–Њ–≥–і–∞ –Ї–∞–Ї —Б–њ–Є—А—В–Њ–≤—Л–µ —Н–Ї—Б—В—А–∞–Ї—В—Л —З–Є—Б—В–Њ—В–µ–ї–∞ –Є —А–Њ–Љ–∞—И–Ї–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ —Б–≤—П–Ј—Л–≤–∞–ї–Є—Б—М —Б 5вАУ–Э–Ґ4вАУ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є, –∞ —Н–Ї—Б—В—А–∞–Ї—В –Ї–Њ—А–љ—П —Б–Њ–ї–Њ–і–Ї–Є вАУ —Б 5вАУ–Э–Ґ3вАУ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є. –І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤ —В–Љ–Є–љ–∞ –Є –њ–ї–Њ–і–Њ–≤ —А–∞—Б—В–Њ—А–Њ–њ—И–Є, —В–Њ –і–ї—П –љ–Є—Е –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ —Б—А–Њ–і—Б—В–≤–∞ –Ї –Ї–∞–Ї–Є–ЉвАУ–ї–Є–±–Њ –Є–Ј—Г—З–∞–µ–Љ—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ.
–Ш–±–µ—А–Њ–≥–∞—Б—В –Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –≤—Е–Њ–і—П—Й–Є—Е –≤ –љ–µ–≥–Њ —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ —Б—Е–Њ–ґ—Г—О —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б —А–µ–Ї–Њ–Љ–±–Є–љ–∞–љ—В–љ—Л–Љ–Є —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Є–Љ–Є 5вАУ–Э–Ґ3, 5вАУ–Э–Ґ4, –Љ—Г—Б–Ї–∞—А–Є–љ–Њ–≤—Л–Љ–Є –Ь3вАУ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є, –њ–Њ –∞–љ–∞–ї–Њ–≥–Є–Є —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞. –Ю–і–љ–∞–Ї–Њ —Б–≤—П–Ј—Л–≤–∞—О—Й–∞—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ш–±–µ—А–Њ–≥–∞—Б—В–∞, —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤ –Ї–Њ—А–љ—П —Б–Њ–ї–Њ–і–Ї–Є, —З–Є—Б—В–Њ—В–µ–ї–∞ –Є –Є–±–µ—А–Є–є–Ї–Є –≥–Њ—А—М–Ї–Њ–є –Ї —А–µ–Ї–Њ–Љ–±–Є–љ–∞–љ—В–љ—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ –±—Л–ї–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–∞ –љ–∞ —Г—А–Њ–≤–љ–µ –њ—А–Є–Љ–µ—А–љ–Њ –≤ 10 —А–∞–Ј –љ–Є–ґ–µ, —З–µ–Љ –Ї –Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Н—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –Љ–µ–љ—М—И–µ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –њ—А–Њ—П–≤–ї—П–µ–Љ–Њ–є —А–∞–і–Є–Њ–∞–Ї—В–Є–≤–љ–Њ –Љ–µ—З–µ–љ–љ—Л–Љ–Є –ї–Є–≥–∞–љ–і–∞–Љ–Є –њ—А–Є —Б–≤—П–Ј—Л–≤–∞–љ–Є–Є —Б —А–µ–Ї–Њ–Љ–±–Є–љ–∞–љ—В–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є.
–°–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–µ —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ –Ш–±–µ—А–Њ–≥–∞—Б—В–∞ –Є –µ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ вАУ —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤ —А–Њ–Љ–∞—И–Ї–Є –Є —З–Є—Б—В–Њ—В–µ–ї–∞, —Б 5вАУ–Э–Ґ4вАУ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1. –С—Л–ї–Є –њ—А–Њ—В–µ—Б—В–Є—А–Њ–≤–∞–љ—Л —З–µ—В—Л—А–µ —А–∞–Ј–≤–µ–і–µ–љ–Є—П —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤ (1:200, 1:500, 1:2000 –Є 1:10000). –Ю—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –Њ–±–∞ —Н–Ї—Б—В—А–∞–Ї—В–∞ –Є–љ–≥–Є–±–Є—А—Г—О—В —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞ –і–∞–љ–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –±–Њ–ї–µ–µ —Б–Є–ї—М–љ–Њ, —З–µ–Љ –і—А—Г–≥–Є–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –њ—А–µ–њ–∞—А–∞—В–∞, —З—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –Є—Е –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –≤ –і–∞–љ–љ–Њ–є —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є.
–Ш–±–µ—А–Њ–≥–∞—Б—В —В–∞–Ї–ґ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Є–љ–≥–Є–±–Є—А—Г–µ—В –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–µ —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ 3HвАУ–љ–∞–ї–Њ–Ї—Б–Њ–љ–∞ —Б –Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л–Љ–Є –Њ–њ–Є–Њ–Є–і–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є (—В–∞–±–ї. 2).
–Э–µ –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –љ–Є–Ї–∞–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ 5вАУ–Э–Ґ1–Р.
–§–µ–љ–Њ–Љ–µ–љ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ –і–µ–є—Б—В–≤–Є–µ –Њ—В–і–µ–ї—М–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –љ–µ –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ–Є—В—М —Н—Д—Д–µ–Ї—В –≤—Б–µ–≥–Њ —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞, —З—В–Њ —З–∞—Б—В–Њ —Б–ї—Г—З–∞–µ—В—Б—П –њ—А–Є —В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є–Є in vitro. –Ю–±—К—П—Б–љ–µ–љ–Є–µ–Љ —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–Љ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–Є —Н—Д—Д–µ–Ї—В–Њ–≤ —А–∞–Ј–љ—Л—Е —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е (–љ–∞–њ—А–Є–Љ–µ—А, –∞–і–і–Є—В–Є–≤–љ–Њ—Б—В—М, –Ї–Њ–љ–Ї—Г—А–µ–љ—В–љ–Њ—Б—В—М, —Б–Є–љ–µ—А–≥–Є–Ј–Љ –Є —В.–і.), —З—В–Њ —В—А–µ–±—Г–µ—В –Є–Ј—Г—З–µ–љ–Є—П –≤ –±—Г–і—Г—Й–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ш–±–µ—А–Њ–≥–∞—Б—В¬Ѓ (STW 5) –њ–Њ–Ї–∞–Ј–∞–ї —Б—А–Њ–і—Б—В–≤–Њ –Ї –Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л–Љ 5вАУ–Э–Ґ3, 5вАУ–Э–Ґ4, –Љ—Г—Б–Ї–∞—А–Є–љ–Њ–≤—Л–Љ –Ь3, –Њ–њ–Є–Њ–Є–і–љ—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, –Ї–Њ—В–Њ—А–Њ–µ –±–Њ–ї–µ–µ —З–µ–Љ –≤ 10 —А–∞–Ј –≤—Л—И–µ –Є–Љ–µ–љ–љ–Њ –Ї —В—А–µ–Љ –њ–Њ—Б–ї–µ–і–љ–Є–Љ —В–Є–њ–∞–Љ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –°—А–∞–≤–љ–µ–љ–Є–µ –і–µ–≤—П—В–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–∞ –Ш–±–µ—А–Њ–≥–∞—Б—В –њ–Њ —Б–≤—П–Ј—Л–≤–∞—О—Й–µ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Ї —Н—В–Є–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ –≤—Л—П–≤–Є–ї–Њ —А–∞–Ј–љ—Г—О —Б—В–µ–њ–µ–љ—М —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Т —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Н–Ї—Б—В—А–∞–Ї—В –Є–±–µ—А–Є–є–Ї–Є –≥–Њ—А—М–Ї–Њ–є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ –Є–љ–≥–Є–±–Є—А—Г–µ—В —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ —Б –Ь3вАУ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є, —Б–њ–Є—А—В–Њ–≤—Л–µ —Н–Ї—Б—В—А–∞–Ї—В—Л —З–Є—Б—В–Њ—В–µ–ї–∞ –Є —А–Њ–Љ–∞—И–Ї–Є –±—Л–ї–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л –Ї 5вАУ–Э–Ґ4вАУ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, –∞ —Н–Ї—Б—В—А–∞–Ї—В –Ї–Њ—А–љ—П —Б–Њ–ї–Њ–і–Ї–Є вАУ –Ї 5вАУ–Э–Ґ3вАУ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ. –≠—В–Є –і–∞–љ–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є –≤–Њ–≤–ї–µ—З–µ–љ–љ–Њ—Б—В—М –≤ —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є —Б–µ–Љ–Є –Є–Ј –і–µ–≤—П—В–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Ш–±–µ—А–Њ–≥–∞—Б—В–∞, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ–Њ–≥–Њ –і–ї—П –ї–µ—З–µ–љ–Є—П —В–∞–Ї–Є—Е —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –ґ–µ–ї—Г–і–Њ—З–љ–ЊвАУ–Ї–Є—И–µ—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Ї–∞–Ї —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П –і–Є—Б–њ–µ–њ—Б–Є—П –Є —Б–Є–љ–і—А–Њ–Љ —А–∞–Ј–і—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞. –Т –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –Љ–Њ–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –і–∞–љ–љ—Л–µ in vitro –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–∞ –Ш–±–µ—А–Њ–≥–∞—Б—В –і–ї—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –ґ–µ–ї—Г–і–Њ—З–љ–ЊвАУ–Ї–Є—И–µ—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —В.–Ї. –Њ–љ–Є –і–µ–є—Б—В–≤—Г—О—В –љ–∞ –Ї–ї—О—З–µ–≤—Л–µ –Љ–Є—И–µ–љ–Є, –≤–Ї–ї—О—З–∞—П 5вАУ–Э–Ґ3, 5вАУ–Э–Ґ4, –Љ—Г—Б–Ї–∞—А–Є–љ–Њ–≤—Л–µ –Ь3 –Є –Њ–њ–Є–Њ–Є–і–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л.


–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Allescher H., 2006. Functional dyspepsia вАУ a multiвАУcausal disease and its therapy. Phytomedicine, this issue.
2. Ammon H.P.T., Kelber O., Okpanyi S.N., 2006. Spasmolytic and tonic effect of Iberogasts (STW 5) in intestinal smooth muscle. Phytomedicine, this issue.
3. Berman S.M., Chang L., Suyenobu B., Derbyshire S.W., Stains J., Fitzgerald L., Mandelkern M., Hamm L., Vogt B., Naliboff B.D., Mayer E.A., 2002. Conditionspecific deactivation of brain regions by 5вАУHT3 receptor antagonist Alosetron. Gastroenterology 123, 969вАУ977.
4. Callahan M.J., 2002. Irritable bowel syndrome neuropharmacology. A review of approved and investigational compounds. J. Clin. Gastroenterol. 35 (Suppl.), 58вАУ67.
5. Chamilleri M., 2004. Treating irritable bowel syndrome: overview, perspective and future therapies. Br. J. Pharmacol. 141, 1237вАУ1248.
6. Houghton L.A., Rogers J., Whorwell P.J., Campbell F.C., Williams N.S., Goka J., 1997. Zamifenacin (UKвАУ76, 654) a potent gut M3 selective muscarinic antagonist, reduces colonic motor activity in patients with irritable bowel syndrome. Aliment Pharmacol. Ther. 11, 561вАУ568.
7. Kamm M.A., 2002. The complexity of drug development for irritable bowel syndrome. Aliment Pharmacol. Ther. 16, 343вАУ351.
8. Kelber O., Wittwer A., Lapke C., Weiser D, Okpanyi S.N., Heilmann J., 2006. Absorption of STW 5 (Iberogast) and its components ex vivo/in vitro. Phytomedicine, this issue.
9. Khayyal M.T., SeifвАУElвАУNasr M., ElвАУGhazaly M.A., Okpanyi S.N., Kelber O., Weiser D., 2006. Mechanisms involved in the gastroвАУprotective effect of STW 5 (Iberogast¬Ѓ) and its components against ulcers and rebound acidity. Phytomedicine, this issue.
10. Michael S., Kelber O., Vinson B., Nieber K., 2006. Herbal preparations STW 5 and STW 6 inhibit inflammationmediated motility disorders in the ileum. Gut, in press.
11. Muller M.H., Liu C.вАУY., Glatzle J., Weiser D., Kelber O., Enck P., Grundy D., Kreis M.E., 2006. STW 5 (Iberogast) reduces afferent sensitivity in the rat small intestine. Phytomedicine, this issue.
12. Nikolay K., 1984. Funktionelle Gastroenteropathien im therapeutischen Blindvergleich von Metoclopramid mit dem Phytopharmakon Iberogast. GastroвАУEnteroвАУHepatologie 2, 24вАУ28.
13. Okpanyi S.N., Mark, Wahl M.A., 1993. Gastrointestinal motility modulation with Iberogast. Acta Hortic. 332, 227вАУ235.
14. Prins N.H., Van Haselen J.F., Lefebvre R.A., Briejer M.R., Akkermans L.M., Schuurkes J.A., 1999. Pharmacological characterization of 5вАУHT4 receptors mediating relaxation of canine isolated rectum circular smooth muscle. Br. J. Pharmacol. 127, 1431вАУ1437.
15. Pilichiewicz A.N., Horowitz M., Russo A., Maddox A.F., Jones K.L., Schemann M., Holtmann G., FeinleвАУBisset C., 2006. Effects of Iberogast¬Ѓ on proximal gastric volume, antropyloroduodenal (APD) motility and gastric emptying in healthy men. Neurogastroenterol. Motility, in press.
16. Roesch W., Vinson B., Sassin I., 2002. A randomised clinical trial comparing the efficacy of a herbal preparation STW 5 with the prokinetic drug cisapride in patients with dysmotility type of functional dyspepsia. Z. Gastroenterol. 40, 401вАУ408.
17. Roesch W., Vinson B., Gundermann K.H., Holtman G., 2006. Clinical efficacy and safety of STW 5 вАУ a review. Phytomedicine, this issue.
18. Saller R., PfisterвАУHotz G., Iten F., Melzer J., Reichling J., 2002. Iberogast: Eine moderne phytotherapeutische Arzneimittelkombination zur behandlung funktioneller Erkrankungen des MagenвАУDarmвАУTrakts (Dyspepsie, Colon irritabile) вАУ von der Pflanzenheilkunde zur ¬ЂEvidence Based Phytotherapy¬ї. Eine systematische Ubersicht. Forsch Komlementarmed Klass Naturheilk 9 (Suppl. 1), 1вАУ20.
19. Schemann M., Hohenester B., Ruhl A., 2006. Regionspecific effects of STW 5 and its components in gastric fundus/corpus and antrum. Phytomedicine, this issue.
20. Stanghellini V., De Ponti F., De Giorgio R., Barbara G., Tosetti C., Corinaldesi R., 2003. New developments in the treatment of functional dyspepsia. Drugs 63, 869вАУ892.
–†–µ—Д–µ—А–∞—В –њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ –Р.–Ѓ. –У—А–µ–±–µ–љ–Ї–Њ, –Ї.–Љ.–љ. –Ы.–У. –Ю–≥–∞–љ–µ–Ј–Њ–≤–Њ–є –њ–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞–Љ —Б—В–∞—В—М–Є U. Simmen, O. Kelber, S.N. Okpanyi, et al. Binding of STW 5 (Iberogast¬Ѓ) and its components to intestinal 5-HT, muscarinic M3, and opioid receptors // Phytomedicine. 2006. 13. P. 51вАУ55












