Функциональная диспепсия (ФД) является клиническим синдромом, характеризующимся хроническими или рецидивирующими симптомами со стороны верхних отделов желудочно-кишечного тракта (ЖКТ) [1]. Для дифференциальной диагностики между органической диспепсией и более распространенной ФД (также называемой неязвенной диспепсией (НЯД) или «раздраженным желудком») происхождение и тяжесть клинической симптоматики имеют ограниченное значение [2]. Как показало исследование, длившееся 3 мес., от симптомов диспепсии страдает приблизительно 1/4 взрослого населения, и эти симптомы являются причинами около 5% всех обращений за медицинской помощью [3, 4] и другими медицинскими услугами [5]. Диагноз ФД ставится путем исключения других возможных причин симптомов. Этиология данного заболевания, по всей видимости, имеет полиморфный характер, описаны различные потенциальные патогенетические механизмы, лежащие в основе заболевания, например: замедленное опорожнение желудка, желудочная гиперсекреция, гиперчувствительность к растяжению или нарушение распределения пищи внутри желудка. Кроме того, по результатам эпидемиологических исследований, была выявлена связь между возникновением диспепсии и недавними событиями в жизни пациента – психосоциальный фактор [6].
Для лечения ФД были предложены различные диагностические и терапевтические методики, каждая из которых имеет свои преимущества и недостатки [7, 8]. Лечение этого заболевания остается зачастую спорным вопросом, и, вероятно, «подходящая всем» терапия отсутствует. По результатам Кохрановского анализа [9], было сделано заключение, что применение прокинетиков, антагонистов Н2-рецепторов и ингибиторов протонной помпы (ИПП) приводит к значимому снижению относительного риска по сравнению с таковым при применении плацебо: на 48, 22 и 14% соответственно.
Однако прокинетики, несмотря на наличие некоторых положительных эффектов, обладают и рядом недостатков: воздействие на центральную нервную систему (метоклопрамид) или ряд побочных эффектов со стороны сердечно-сосудистой системы (цизаприд) [10]. Препараты солей висмута, антациды и сукральфат продемонстрировали ограниченный эффект или полное его отсутствие, Helicobacter pylori-эрадикационная терапия обладает небольшим, но статистически значимым эффектом в отношении H. pylori-положительной НЯД [11]. Применение растительных препаратов при лечении диспепсических жалоб имеет долгую историю. Они используются либо самостоятельно, либо в сочетании с другими растительными препаратами, т. к. содержат эфирные масла, которые известны своими спазмолитическими эффектами, ветрогонным и местным анестезирующим действием. Механизмы действия данных препаратов до конца не изучены. Однако результаты исследований позволяют предположить, что они регулируют активность гладкой мускулатуры пищеварительного тракта [12]. Оценке эффективности растительных лекарственных препаратов при лечении больных с диспепсическими симптомами раньше уделялось недостаточно внимания [13]. Растительный лекарственный препарат STW 5 (Иберогаст® «Штайгервальд», Дармштадт, Германия) представляет собой фиксированную комбинацию 9 растительных экстрактов (табл. 1), каждый из которых (за исключением иберийки горькой [14]) содержится в очень низкой концентрации по сравнению с дозировками, используемыми в монопрепаратах из травы чистотела, корня солодки, цветков ромашки, цветков мелиссы, листьев перечной мяты [15] или плодов расторопши пятнистой [16] и корня дягиля лекарственного [17]. Клиническая эффективность этого препарата считается высокой [18]. В представленной работе проанализированы клинические данные, касающиеся лечения ФД.

Материал и методы
Стратегия поиска
Для проведения настоящего метаанализа были использованы следующие базы данных: TOXLINE, MEDLINE, HealthSTAR, AIDSLINE и CANCERLIT, Embase, AMED и Cochrane Collaboration, которые анализировались со дня их формирования до декабря 2003 г. Условия поиска были следующими: STW 5, Иберогаст, растительные препараты, диспепсия, диспепсические и желудочно-кишечные расстройства, фитотерапия. Кроме того, были тщательно изучены ссылки на источники литературы из соответствующих статей, обзоров и книг, были установлены контакты со специалистами в данной области и производителем растительного препарата. В случае наличия дублирующихся публикаций в анализ включалась более поздняя или та, что была опубликована в рецензируемом журнале. Поскольку опубликованные данные были немногочисленны, в анализ также были включены неопубликованные данные и результаты отчетов, представленных для регистрации препарата в органы здравоохранения Германии (в Федеральный институт лекарственных средств и изделий медицинского назначения (BfArM)). Использование разносторонних данных способствовало снижению количества ошибок и отклонений анализа [19]. Для более точной уверенности в достоверности и сравнимости первичных данных была проведена перепроверка всех необработанных данных РКИ.
Критерий отбора
Для формирования обзора изначально были взяты все статьи с упоминанием о STW 5. Затем статьи были разделены в соответствии с тематикой или особенностями отбора пациентов и качеством методологии публикации (использованные методы, участники исследования, получаемая терапия и оценка результатов). Статьи о комбинированных лекарственных препаратах, опубликованные до 1992 г., не были включены в анализ, поскольку они не соответствуют современным стандартам надлежащей клинической практики (GCP), а также современным диагностическим критериям (Римские критерии). Для включения в данный анализ исследования должны были быть двойными слепыми рандомизированными плацебо-контролируемыми, с включением пациентов с ФД, кроме того, исследования должны были соответствовать стандартам GCP и использовать адекватные статистические методы. Исследования, которые не отвечали данным критериям, были исключены из нашего метаанализа. В своем анализе мы также следовали принципам, предусмотренным Кохрановским сообществом [20].
Статистические методы
После отбора исследований соответствующие исходные данные были перепроверены с использованием метода на основе пациентов, начавших получать лечение (ITT), и переноса вперед данных последнего наблюдения (метод замены пропущенных данных последним значением) (LOCF). Анализ отобранных исследований с учетом диагностических критериев и характеристик пациентов проводили в соответствии с Римскими критериями II [21]. Эти критерии классифицируют функциональные желудочно-кишечные расстройства как ФД, аэрофагию и функциональную рвоту. ФД подразделяется на 3 группы симптомов: «язвенного типа», «нарушения моторики» и «неспецифические» симптомы. Кроме того, был проведен анализ в соответствии с наиболее часто встречающимися симптомами, т. е. симптомами, получившими наиболее высокий балл у пациента. Анализ отобранных исследований продемонстрировал, что у 1/3 пациентов с ФД дополнительно присутствуют симптомы гастроэзофагеального рефлюкса (ГЭР) или синдрома раздраженного кишечника [22]. Таким образом, были отобраны все исследования, где изучали ФД, т. е. жалобы, которые не сопровождались нарушениями по данным эзофагогастродуоденоскопии, УЗИ или стандартных лабораторных показателей.
Полученные данные были сведены в таблицу для работы в соответствующей компьютерной программе [23]. Изучаемые исследования были преобразованы в «стандартное исследование» для возможности адекватного сопоставления первичных данных: вводный период – 7 дней, рандомизация при поступлении (включении), лечение после консультаций 3 и 5 нед. Полученные результаты были обобщены в таблицах и статистически проанализированы: в случае наличия дихотомических данных были определены отношение шансов и различия рисков по критериям Пето, Мантеля – Гензеля. У непрерывных данных было приведено среднее взвешенное по разности обратной дисперсией. При наличии значимости полученных результатов проводился анализ чувствительности. Уровень значимости был рассчитан с использованием двусторонних тестов, порог значимости был определен как p≤0,05, а незначимый результат соответствовал p>0,1; значения между р >0,05 и р<0,1 были определены как тенденции. Для оценки степени выраженности симптомов была использована шкала 10 наиболее часто встречающихся гастроинтестинальных симптомов (ГИС): от резко выраженных до мягких (с использованием 5-балльной шкалы Лайкерта: симптом резко выраженный, выраженный, умеренно выраженный, незначительно выраженный, симптом отсутствует).
Результаты
В электронных базах данных STW 5 и Иберогаст® были идентифицированы в 5 статьях. Также в анализ были включены 2 дополнительных клинических исследования. Так как основной целью настоящего метаанализа явилась оценка эффективности STW 5 с клинической точки зрения, особое внимание было обращено на клинически значимые конечные точки. Из 7 отобранных исследований 4 не соответствовали критериям включения (различная структура исследования и повторная публикация [24, 25], наблюдательное исследование [26], использован простой слепой метод [27]), в связи с чем в метаанализ были включены 3 исследования [28–30]. Четвертое исследование [31] было взято для анализа безопасности. Клинико-диагностические характеристики пациентов, включенных в исследования, достоверно не различались (табл. 2).

Плацебо-контролируемые исследования STW 5 (Иберогаст®): отдельные исследования
Все 3 рандомизированных исследования STW 5 были многоцентровыми, двойными слепыми плацебо-контролируемыми. В каждом исследовании пациенты получали STW 5 по 20 капель (20 капель = 1 мл) 3 р./сут в течение 4-х нед., за этот период было 4 визита (табл. 3). Анамнез пациентов был сопоставим, но длительность симптомов была весьма разнородна, что, вероятно, могло быть связано с различными способами запроса для определения продолжительности симптомов. В каждом исследовании было проанализировано улучшение симптомов у пациентов, начавших получать лечение. Помимо STW 5 в каждом из исследований изучался и другой дополнительный препарат, схожий с STW 5, но не содержащий всех 9 его растительных компонентов. Последние были отмечены в таблице 2 как STW 5-S, STW 6, STW 5-II.

1. В небольшом РКИ, опубликованном Madisch et al. [30], было рандомизировано 60 пациентов, получавших STW 5 (n=20), STW 5-S (n=20) или плацебо (n=20). На последнем визите 15 из 20 пациентов, получавших STW 5, сообщили о том, что наиболее часто встречающиеся симптомы идентифицировались как «незначительно выраженный» или «симптом отсутствует», по сравнению с отсутствием таковых у пациентов из группы, получавшей плацебо. Исследователями также был сделан вывод о более высокой эффективности STW 5 по сравнению с плацебо (р<0,05).
2. Второе РКИ, проведенное Schnitker и Schulte-Körne [29], не было опубликовано. Оно основано на данных о 118 пациентах, получавших STW 5 (n=35), STW 6 (n=38), плацебо (n=35); 10 пациентов были исключены из анализа, т. к. не была известна информация о получаемой ими терапии. В общей сложности 91 пациент побывал на всех 4-х контрольных визитах. На последнем визите 16 из 35 пациентов, получавших STW 5, сообщили о том, что наиболее часто встречающиеся симптомы идентифицировались как «незначительно выраженный» или «симптом отсутствует», в то время как 7 из 35 идентифицировали симптомы как «выраженный» или «резко выраженный». Мнение о симптоматике и пациентов, и исследователей было отрицательным – не удалось показать существенную разницу между STW 5 и плацебо (визит 4, χ2 тенденция: статистически недостоверно).
3. Третье РКИ – это абстракт, опубликованный Buchert [28]. Было набрано 247 пациентов, 243 из них были включены в исследование. О 4-х исключенных пациентах нет данных. Пациенты были разделены на 3 группы, получавшие STW 5 (n=83), STW 5-II (n=80), плацебо (n=80). На последнем визите 52 из 83 пациентов, получавших STW 5, сообщили о том, что наиболее часто встречающиеся симптомы идентифицировались как «незначительно выраженный» или «симптом отсутствует», по сравнению с 14 из 80, получавших плацебо (χ2 тенденция: p<0,01). Анализ отдельных симптомов на последнем визите продемонстрировал значимые различия между STW 5 и плацебо в пользу препарата исследования для всех симптомов, за исключением спастических болей в животе.
Плацебо-контролируемые исследования препарата STW 5 (Иберогаст®): объединенные исследования
В настоящем метаанализе были использованы данные пациентов, участвующих в 3-х РКИ (первичные данные были сопоставимы по общим клинико-диагностическим, анамнестическим характеристикам и проводимой терапии): STW 5 (138 пациентов) и плацебо (135 пациентов). У большинства пациентов среди симптомов преобладала отрыжка кислым (n=124), остальных в основном беспокоила боль в эпигастральной области (n=101), преобладали симптомы расстройства моторики (n=30) или функциональной рвоты (n=18). На заключительном визите 83 из 138 пациентов, получавших препарат исследования, сообщили о том, что наиболее часто встречающиеся симптомы идентифицировались как «незначительно выраженный» или «симптом отсутствует» по сравнению с 33 из 135 пациентов в группе плацебо (V2 тенденция: p<0,01 (рис. 1).
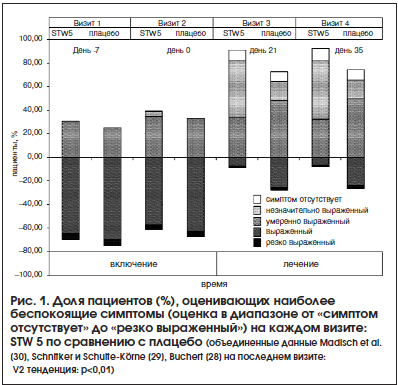
Был выполнен пошаговый регрессионный анализ, в качестве независимых переменных использовались данные, полученные при включении (лечение, возраст, пол, рост, курение, ИМТ, наиболее часто встречающиеся симптомы: максимальное количество баллов при поступлении) и исходы (наиболее часто встречающиеся симптомы: максимальное количество баллов на последнем визите). В качестве зависимой переменной были использованы только лечение (p<0,001) и оценка наиболее часто встречающихся симптомов при включении (p=0,013), которые коррелировали с исходами. В конце периода лечения наиболее часто встречавшиеся симптомы идентифицировались как «выраженный» и «резко выраженный» у 26% пациентов в группе плацебо и только у 7% в группе STW 5. Различие между плацебо и STW 5 составляет 19% (р<0,001; отношение шансов 0,22; 95% ДИ: 0,11–0,47) (рис. 2).

На финальных визитах результаты индивидуальной оценки симптомов были получены в пользу препарата исследования (STW 5) – это касалось боли в эпигастральной области, отрыжки кислым и дискомфорта за грудиной (не было оценено у Schnitker и Schulte-Körne [29]). Пошаговый регрессионный анализ данных при включении в исследование и финальном визите продемонстрировал, что лечение было в значительной степени связано с исходом (p<0,001) для 6 из 10 симптомов (спастические боли в животе, боли в эпигастральной области, тошнота, отрыжка кислым, дискомфорт за грудиной, рвота), не было выявлено значимой корреляции для оставшихся 4-х симптомов: отсутствие аппетита, ощущение «переполнения», рвотные позывы и раннее насыщение.
Контролируемое исследование STW 5 с использованием эталонного препарата
Представлено многоцентровое контролируемое исследование по сравнению STW 5 с эталонным препаратом – прокинетиком цизапридом [31]. В общей сложности в это исследование было включено 193 пациента с ФД с нарушением моторики, 186 были рандомизированы, а 183 были проанализированы как начавшие получать лечение. 137 пациентов участвовали в протоколе исследования. В настоящем метаанализе были перепроверены первичные данные всех рандомизированных пациентов, получавших STW 5 (n=61), STW 5-II (n=62), цизаприд (n=463) (всего: n=186). При включении пациенты были сопоставимы по общим клинико-диагностическим характеристикам, продолжительности симптомов, результатам эндоскопических исследований и частоте встречаемости симптомов – от незначительных до резко выраженных (кроме рвотных позывов, для которых была отмечена тенденция к преобладанию в группе цизаприда (от незначительных до выраженных, p<0,1)).
Как показано на рисунке 3, баллы наиболее часто встречающегося симптома значительно сдвинуты в сторону STW 5 и цизаприда по сравнению с плацебо: от «преимущественно выраженный»/«резко выраженный» до «симптом отсутствует»/«незначительно выраженный».

Тем не менее сравнительный анализ 2-х групп, получавших препарат исследования, в отношении индивидуальных оценок симптомов в конце лечения продемонстрировал значительно меньшее количество таких симптомов, как отсутствие аппетита (p<0,01) и тенденцию к меньшему количеству симптомов раннего насыщения в группе STW 5 (р<0,1). Кроме того, общая оценка эффективности и переносимости исследуемых препаратов не продемонстрировала каких-либо существенных различий, хотя по данным опроса пациентов была тенденция к лучшей переносимости STW 5 по сравнению с цизапридом (р<0,1).
Безопасность
STW 5, как правило, хорошо переносится, при этом частота встречаемости НЯ значительно варьирует среди проведенных исследований, что может быть связано с более активным или пассивным сбором информации о НЯ. В анализируемых исследованиях регистрировались следующие процентные отношения частоты НЯ на фоне приема STW 5 или плацебо, соответственно: Buchert [28] 3,6% против 1,3%, Schnitker и Schulte-Körne [29] 22,9% против 25,7%, Madisch et al. [30] 5% против 10 % и Rösch et al. [31] 24,6% против 34,9% у цизаприда. Классификация НЯ, зарегистрированных в исследованиях в соответствии с системой (табл. 4), показала аналогичное число НЯ на фоне приема STW 5, плацебо или цизаприда. В действительности для любого препарата серьезных побочных эффектов в этих исследованиях зарегистрировано не было, а также не было обнаружено отклонений от соответствующих стандартных биохимических показателей. В одном наблюдательном исследовании (постмаркетинговые наблюдения), проведенном производителем STW 5 и включавшем 2267 пациентов, было выявлено единственное серьезное НЯ, которое не могло быть связано с лечением, – хирургическое вмешательство по поводу рака толстой кишки через 4 дня после завершения исследования [18, 26]. В течение 14 лет среди сообщений о НЯ было зарегистрировано 7 случаев экзантематозной кожной реакции (1 – с отеком Квинке и 1 – с рассеянным нейродермитом), 6 случаев непереносимости и 1 случай аллергической астмы. На фоне приема STW 5 побочные эффекты со стороны центральной нервной или сердечно-сосудистой системы зарегистрированы не были.

Обсуждение
273 пациента с ФД, получавших STW 5 (Иберогаст®) и плацебо в нескольких РКИ, – это довольно ограниченное, но все же достаточно большое количество наблюдений, необходимых для четкого представления о кратковременной клинической эффективности лекарственного препарата. Представленный анализ позволяет избежать проблем, часто встречающихся в метаанализах и анализах объединенных данных [32, 33]: (I) в анализ были включены все исследования, которые удовлетворяли текущим нормативам и стандартам, (II) дизайн исследования и схемы оценки симптомов были идентичны во всех исследованиях, и (III) все исследования проводились в одной социально-культурной среде. В отличие от ранее проведенного анализа тех же данных [29] мы избежали использования суммы баллов и провели повторный анализ всех первичных данных пациентов, начавших получать лечение, и метода переноса вперед данных последнего наблюдения (метод замены пропущенных данных последним значением).
Этот подход характеризуется некоторой потерей чувствительности, однако полученные результаты фактически подтвердили результаты, опубликованные или представленные в отдельных исследованиях с использованием оценки различных ГИС в качестве критерия эффективности. Хотя используемые в исследовании STW 5 профили ГИС не сильно различаются, всех их объединяет проблема многих других методов оценки клинических симптомов – они недостаточно апробированы для оценки ФД. Метод определения баллов наиболее часто встречающихся симптомов ранее уже использовался с целью разработки классификации [4] и определения эффективности другой группы лекарственных препаратов, используемых для лечения ФД (например, ИПП омепразола) [34]. Для обеспечения сопоставимости демографических и клинико-диагностических характеристик пациентов был предпринят повторный анализ первичных данных опубликованных и неопубликованных исследований, что помогло свести к минимуму различные отклонения. Применение метода для пациентов, начавших получать лечение, ко всем данным, увеличило надежность использованных в этом анализе данных. Хотя включение неопубликованных данных в метаанализ по-прежнему является предметом дискуссий, существуют указания, свидетельствующие о том, что это возможно, например, в случае скудности опубликованных данных. При этом неопубликованные данные могут быть подвергнуты такому же пристальному анализу, как и опубликованные [19].
Результаты объединенных исследований продемонстрировали, что STW 5 с точки зрения симптоматической помощи пациентам с ФД является более эффективным, чем плацебо. При сочетании с ГЭР или при преобладании боли в эпигастральной области такое различие имеет еще более высокую степень значимости. Однако данные результаты должны быть подтверждены в более крупных исследованиях.
С учетом данных, полученных в ходе клинических и наблюдательных исследований, а также того факта, что препарат применяется на немецком фармацевтическом рынке около 40 лет, профиль безопасности STW 5 является благоприятным. Хорошая переносимость препарата может быть связана с низкими концентрациями его отдельных компонентов. Вероятно, существует синергизм терапевтических эффектов, например, спазмолитического, ветрогонного, противовоспалительного и местного обезболивающего, и при этом без присоединения токсических эффектов. По данным ряда работ, только на фоне приема чистотела в составе других препаратов и в более высокой концентрации регистрировались редкие случаи холестатического гепатита [35, 36]. Данный факт объясняет отсутствие таких явлений на фоне приема STW 5 [18]. Исследования, проведенные в течение 4-х нед. в отношении других фиксированных комбинаций, таких как перечная мята и масло тмина [37, 38] или масло перечной мяты и экстракт имбиря [39], продемонстрировали улучшение течения ФД или НЯД по сравнению с результатами при применении плацебо или цизаприда, что сопоставимо с результатами на фоне приема STW 5. Результаты, касающиеся безопасности и эффективности лечения, обнадеживающие, однако необходимы дальнейшие исследования безопасности препарата при длительном применении, а также возможных взаимодействий растительных препаратов [13].
Таким образом, с точки зрения эффективности и профиля безопасности препарат STW 5 (Иберогаст®) может быть рекомендован в качестве перспективного препарата первой линии терапии ФД для пациентов, нуждающихся в комплексном медицинском подходе. Для подтверждения полученных данных необходимо дальнейшее проведение крупномасштабных исследований.
Перевод с английского выполнен к.м.н. Ю.Е. Ефремовой












