Актуальность проблемы лечения нарушений липидного метаболизма в настоящее время признается в различных областях медицины, включая хирургию. Это обусловлено широким диапазоном и чрезвычайной распространенностью заболеваний, патогенез которых связан с дислипопротеидемией [14,16,17,30,35,36,38,39,42].
В 1998 году, по предложению академика В.С. Савельева, все заболевания, входящие в рамки хирургической специальности и патогенетически связанные с нарушениями липидного гомеостаза (облитерирующий атеросклероз, хроническая ишемическая болезнь органов пищеварения, холестероз желчного пузыря, желчекаменная болезнь, липогенный панкреатит, жировой гепатоз и др.) были объединены в липидный дистресс–синдром (ЛДС), названный позже его именем [11,12,13]. Концепция ЛДС Савельева заключается в том, что нозологические формы, входящие в его состав, являются, по сути, разными в клиническом плане проявлениями единого патологического процесса, фундаментом которого служат различные нарушения липидного обмена.
Важность, необходимость и целесообразность такой интеграции объясняется постоянным ростом и без того высокой частоты заболеваний, входящих в ЛДС как в виде отдельных самостоятельных заболеваний, так и в сочетании друг с другом, с одной стороны, а с другой – отсутствием этиопатогенетически обоснованного подхода к их лечению.
Многолетними исследованиями доказано, что ЛДС Савельева всегда формируется на фоне функциональных расстройств печени – нарушений синтеза желчи гепатоцитами и ее выведения из печени, а также снижения активности купферовских клеток ретикулоэндотелия печени [13].
Роль и значение этих нарушений в развитии и прогрессировании нарушений липидного обмена и липидного дистресс–синдрома трудно переоценить, так как главным физиологическим механизмом холестеринового гомеостаза является экскреция желчных кислот с желчью в процессе их энтерогепатической циркуляции по принципу «обратной связи», регламентирующему внутрипеченочный синтез стероида и его метаболизм в желчные кислоты. Эти сложные биохимические процессы строго сбалансированы и происходят при непосредственном участии многочисленных ферментов, главными из которых являются ГМГ–КоА–редуктаза и 7–альфа–гидроксилаза [2,29].
В настоящее время благодаря фундаментальным исследованиям в области теоретической медицины накопилось достаточно фактов, свидетельствующих о том, что морфогенез различных заболеваний, связанных с патологией липидного обмена, во многом «обязан» нарушениям взаимодействий гепатоцитов с обеспечивающей его функции системой синусоидальных клеток и нарушениям кооперативных связей в самой этой системе [9]. Изучение нарушений функций ретикулоэндотелиальной системы (РЭС) печени при ЛДС столь же необходимо, как и оценка ее метаболических функций, а с учетом кооперации разделить их практически невозможно.
Значению микробной экологии пищеварительного тракта в реализации физиологических функций и патологических нарушений печени при ЛДС до настоящего времени уделяется необоснованно мало внимания. При этом упускается из вида участие в процессах энтерогепатической циркуляции желчных кислот наряду с печенью и микрофлоры пищеварительного тракта [17]. При снижении детоксикационной функции микрофлоры кишечника, связанной с микроэкологическими нарушениями различного генеза, первый «удар» на себя принимает печень [17]. Это с одной стороны. С другой – подавляющее большинство микроорганизмов характеризуются резко выраженной способностью деконьюгировать желчные кислоты, в связи с чем усиленное размножение в подвздошной кишке таких бактерий (прежде всего анаэробных, обладающих повышенной деконьюгирующей активностью в отношении связанных желчных кислот) и образования токсических эндогенных солей желчных кислот [28] являются важными предпосылками для возникновения нарушений всех функций печени, включая деятельность купферовских ее клеток и всей системы мононуклеарных макрофагов [9].
В этой связи формирование и прогрессирование ЛДС, независимо от органа–мишени, необходимо рассматривать в тесной взаимосвязи с микробиотой пищеварительного тракта. Схематически это можно представить следующим образом: нарушение микроэкологии кишечника – накопление эндотоксинов в кишечнике – поступление эндотоксинов по портальной вене в печень – повреждение клеток РЭС печени – усиление патологического влияния токсикантов другого (не микробного) происхождения – нарушение функции гепатоцитов – дислипопротеидемия – ЛДС [29,34].
Лечение дислипопротеидемии при ЛДС основано либо на применении лекарственных препаратов, подавляющих синтез холестерина в печени, либо использовании различных методов, основанных на хирургической или консервативной блокаде энтерогепатической циркуляции желчных кислот [19,21,23,31,33,37]. При этом совершенно забывает о другой уникальной возможности лечения – восстановлении роли микрофлоры организма в регулировании функций печени и метаболизма липидов.
Целью настоящего исследования явилось изучение нарушений функций печени и микробиоценоза толстой кишки при липидном дистресс–синдроме Савельева и оценка результатов их коррекции пребиотиком Хилак–форте.
Материал и методы исследования
Было обследовано 66 пациентов с ЛДС Савельева: 20 больных с желчнокаменной болезнью, 19 пациентов с облитерирующим атеросклерозом артерий нижних конечностей, 8 пациентов с бескаменным холестерозом желчного пузыря, 9 больных с липогенным панкреатитом и 10 пациентов с хронической ишемической болезнью органов пищеварения, Из них 39 (59%) женщин и 27 (41%) мужчин; возраст от 29 до 55 лет.
Желчесинтетическая и желчеэкскреторная функции печени изучены с помощью гепатобилисцинтиграфии (ГБСГ), которая основана на регистрации пассажа короткоживущих радионуклидов по билиарному тракту после введения 3 мКм Тс–99м–бромезида внутривенно на гамма камере «Diakam» фирмы «Siеmens» (Германия) с обработкой данных на компьютере «Icon». Нормальными показателями ГБСГ считалось время полувыведения Т1/2 радиофармпрепарата (РФП) из печени менее 35 минут, Т1/2 из холедоха менее 50 минут, время поступления РФП в 12–ти перстную кишку менее 40 минут.
Для комплексной оценки функции РЭС печени и печеночного кровотока была использована динамическая сцинтиграфия печени с коллоидными частицами, маркированными радионуклидом (250 Мбк Тс–99м–технефита). Метод основан на высокой специфичности купферовских клеток печени к захвату РФП, что отражает их фагоцитарную активность. Функциональное состояние купферовских клеток оценивали по показателю Тмах печени, т.е. по времени максимального захвата радиофармпрепарата клетками РЭС печени (норма – 9,07±0,89 мин).
Структурный и метаболический дисбаланс микробиоценоза толстой кишки у пациентов был исследован в Московском НИИ микробиологии и эпидемиологии им. Г.Н. Габричевского. Методом газожидкостной хроматографии (ГЖХ) определялись уровни и спектры летучих жирных кислот в фекалиях (биохимическое исследование), проводился также копрологический анализ и устанавливалась концентрация в материале секреторного иммуноглобулина А (s–IgA).
Биохимические исследования плазмы крови выполнялись на автоматическом биохимическом анализаторе «Express–Plus» при помощи стандартных наборов и на автоматическом биохимическом анализаторе «Cholestech LDX» (США).
Лечение нарушений функций печени проведено пребиотиком Хилак-форте (фирма Ратиофарм, Германия) в течение 2 месяцев по 40–60 капель 3 раза в день. Выбор данного метода лечения обоснован уникальной способностью препарата восстанавливать нарушения микробиоценоза желудочно–кишечного тракта.
Все полученные данные подвергнуты статистической оценке с математической обработкой на ЭВМ (IBM PC Pentium 110) при помощи стандартных прикладных программ.
Результаты и их обсуждение
Результаты биохимических исследований липидного спектра плазмы крови представлены в таблице 1. Как следует из приведенных в ней данных, средние показатели липидного обмена у пациентов до лечения достоверно отличались от нормальных значений и соответствовали дислипопротеидемии 2Б типа категории «Д» тяжести [13].
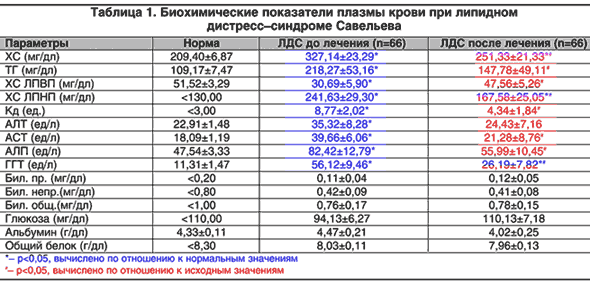
Степень поражения гепатоцитов можно косвенно оценить по уровню в плазме крови билирубина, альбумина и активности в сыворотке крови печеночных трансаминаз [25]. При анализе выявлено достоверное повышение в плазме крови АСТ и АЛТ (табл. 1). При этом концентрация АСТ была повышена в 2,2 раза (p<0,05), АЛТ в 1,5 раза (р<0,05).
Еще одним специфичным печеночным ферментом является ГГТ. В исходе концентрация его в плазме крови была повышена в 5 раз (р<0,05). Важно отметить, что повышение уровня ГГТ является достаточно специфичным маркером жирового гепатоза [26].
Обнаруженная у пациентов с ЛДС повышенная концентрация в плазме крови фермента АЛП (в среднем, на 73%, р<0,05), косвенно свидетельствует об имеющемся у данной категории больных холестазе, возникающем, по–видимому, на уровне желчных капилляров. Подтверждением этого служат данные о наличии явлений катарального холангита на уровне мелких внутрипеченочных желчных протоков при наличии жировой инфильтрации печени. На ультраструктурном уровне это доказывается локальным расширением отдельных желчных капилляров, сочетающимся с частичной редукцией микроворсинок [3]. Нормальная концентрация в плазме крови билирубина (как общего, так и его фракций) доказывает отсутствие грубых нарушений оттока желчи из печени. После курса лечения Хилак–форте установлено достоверное улучшение всех исследованных показателей липидного обмена и концентрации гепатоцитарных ферментов (табл. 1).
Результаты гепатобилисцинтиграфии (ГБСГ) до лечения приведены в таблице 2. При их анализе видно, что при ЛДС Савельева имеются нарушения билисинтетической функции гепатоцитов. Так, время максимального накопления РФП в печени (Тмакс.печ.) составило 19,49±1,79 мин., что на 57% превышало нормальные значения (p<0,05). Желчеэкскреторная функция печени при ГБСГ характеризуется периодом полувыведения РФП из печени (Т1/2 печ.), показавшим достоверное замедление экскреции желчи из гепатоцитов у пациентов с ЛДС (на 42%, p<0,05). Нормальное время поступления РФП в холедох и 12–ти перстную кишку доказывает внутрипеченочный характер холестаза. Важно отметить, что время полувыведения РФП из печени выявило высокую положительную корреляционную связь (r=+0,84) с концентрацией в плазме крови фермента АЛП, отражающую общую тенденцию к внутрипеченочному холестазу у больных с липидным дистресс–синдромом.
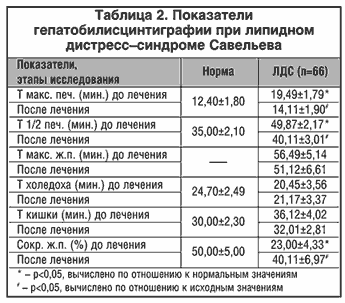
Таким образом, при липидном дистресс–синдроме имеются значительные нарушения в желчепродуцирующей и желчеэкскреторной функциях печени, являющихся, на наш взгляд, основной причиной дислипопротеидемии вследствие недостаточного пула желчных кислот.
Терапия Хилак–форте положительно повлияла на выявленные нарушения (табл. 2). Произошло достоверное улучшение синтеза желчи и ее транспорт из гепатоцитов на фоне восстановления моторно–эвакуаторной функции желчного пузыря.
Результаты исследования ретикулоэндотелиальной системы (РЭС) печени показали достоверное снижение фагоцитарной активности Купферовских клеток (табл. 3). Время максимального накопления РФП в печени было увеличено на 77% (р<0,05). При оценке многофакторных корреляционных взаимосвязей установлена обратная связь между уровнями плазменного ХС ЛПНП и фагоцитарной активностью РЭС (r=–0,82).

Как показали наши исследования, у пациентов отмечалось увеличение доли артериальной и снижение венозной фракции портального кровотока (табл. 3). При этом каких–либо достоверных клинических или ультразвуковых признаков фиброзного процесса в печени выявлено не было.
Проведенное исследование показало четкую взаимосвязь нарушений липидного обмена с функцией РЭС печени. Длительно формирующаяся ишемия печени вследствие поражения капилляров печеночной паренхимы способствует развитию и прогрессированию склероза, а в ряде случаев и цирроза печени [16].
Применение пребиотика Хилак–форте нормализует активность РЭС печени, однако фракции печеночного кровотока не изменились, что объясняется коротким курсом лечения.
Таким образом, основным органом–мишенью при ЛДС Савельева является печень. Ее поражение проявляется в виде дистрофии и стеатоза (жирового гепатоза), основную роль в этом играет ее ретикулоэндотелиальная система, действующая в тесной кооперации с гепатоцитами [5,7,9]. Регуляция РЭС печени очень сложна, ее клетки легко переходят из одного функционального состояния в другое. Основной регуляторный механизм осуществляется путем премирования (кондиционирования) клеток Купфера [13]. В реальной жизни в качестве премирующего стимула выступают липополисахариды эндотоксинов грамнегативной микрофлоры толстой кишки [9]. Стимулированные эндотоксином клетки РЭС печени вырабатывают большое количество различных цитокинов [9]. При этом происходит торможение активности монооксигеназ в гепатоцитах [32], нарушается сложная кооперация клеток РЭС с гепатоцитами, что приводит в итоге к снижению скорости гидролиза эфиров холестерина в печени и выведения их вместе с холестерином в желчь [9]. Повышенное поступление липополисахаридов эндотоксинов, кроме непосредственного влияния на обмен холестерина, опосредованно, через ту же ретикулоэндотелиальную систему печени, нарушает суммарный синтез белка гепатоцитами, при этом в них обнаруживаются поврежденные мембраны и дегенерация органелл [9].
Синусоидальные клетки в своем взаимодействии связаны как структурно, так и функционально. Их функции, осуществляемые по принципу «дублирования и взаимной поддержки», контролируют метаболизм липидов, белков, липопротеидов, биогенных аминов, цитокинов и т.д. При этом кооперативные связи синусоидальных клеток, определяющих внутрипеченочный гомеостаз, подчинены «обслуживанию» гепатоцита, осуществляющего основные специализированные функции печени [9].
Результаты исследования микробиоценоза толстой кишки при ЛДС Савельева во многом объяснили вышеназванные нарушения функций печени. При биохимическом анализе микрофлоры у пациентов (табл. 4) было выявлено снижение общего количества летучих жирных кислот (ЛЖК) в 2 раза (р<0,05). При детальном анализе по отдельным кислотам установлено следующее. Уровень уксусной кислоты (С2) был снижен относительно нормальных значений на 64,9%, пропионовой (С3) – на 36%, масляной (С4) – на 21,6%, т.е., дефицит ЛЖК был обусловлен преимущественным недостатком уксусной кислоты. Профиль ЛЖК, являющийся характерным для любой конкретной патологии набором удельных концентраций (т.е., их долей в общем пуле ЛЖК), достоверно отличался от нормы, но общая закономерность (С2>С3>С4) тем не менее сохранялась.
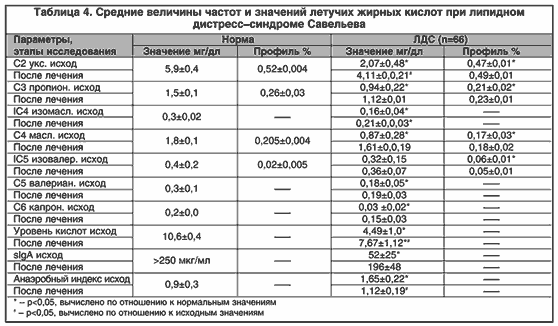
Полученные при анализе ЛЖК данные подтвердило определение величины анаэробного индекса (АИ), количественно оценивающего смещение окислительно–восстановительного потенциала (баланса) продуктов брожения и представляющего собой сумму окислительно–восстановительных потенциалов [24]. Он составил 1,65±0,22 ед (норма 0,9±0,3 ед) р<0,05. Повышение АИ свидетельствовало о серьезных сдвигах соотношения анаэробы/аэробы в пользу последних, что, собственно говоря, еще раз доказывает и объясняет причину столь выраженного снижения уровней ЛЖК за счет уменьшения количества основных продуцентов уксусной кислоты (бифидо– и лактобактерий) [17,24].
Известно, что ЛЖК образуются не только при различных видах брожения глюкозы, но и при распаде гликопротеидов, белков, липидов и т.д. Утилизируясь в колоноцитах в рамках цикла Кребса, ЛЖК в значительной (если не основной) мере восполняют энергетические потребности колоноцитов и, кроме того, осуществляют значительный вклад в липо– и гликонеогенез [20,27,40].
Следует указать на истинные, с нашей точки зрения, причины возможного развития нарушений функций печени у больных с ЛДС и роль в них кишечной микрофлоры.
Микрофлора, участвуя во всех процессах детоксикации, происходящих в печени, сама по себе способна осуществлять микробную трансформацию метаболитов, после чего они «легче» и быстрее разрушаются в печени. Кроме этого, сами метаболиты микрофлоры изменяют полярность различных соединений, уменьшая тем самым и скорость экскреции метаболитов, и их транслокацию из кишечника в кровеносное русло [1,4,8].
Если рассматривать дисбиоз толстой кишки в виде основного этиологического фактора развития ЛДС, то в защиту этой концепции необходимо дать некоторые пояснения. В процессах деконъюгации комплексов желчных кислот с таурином и глицином активное участие принимают ферменты различных бактерий. В норме дезоксихолевая и хенодезоксихолевая кислоты при участии секреторного IgA, влияющего на антимикробную активность этих кислот, подавляют рост патогенных и условно–патогенных микроорганизмов даже в естественных для организма концентрациях [41]. Установленные нами в исходе достоверно низкие уровни секреторного sIgA (табл. 4) свидетельствуют о снижении колонизационной резистентности толстой кишки, с одной стороны, а с другой – осоздании всех условий при непременном участии IgA для развития хронического воспаления толстой кишки.
Дополнительно это подтвердили данные изучения корреляционных взаимосвязей ЛЖК с показателями различных функций печени. Так, концентрация С2 положительно коррелировала с функцией купферовских клеток (r=+0,75), С3 – с билисекреторной функцией гепатоцитов (r=+0,79) и экскрецией желчи из них (r=+0,61), уровень масляной кислоты со значением сократимости желчного пузыря (r=–0,49), концентрацией плазменных ферментов печени (r от +0,76 до +0,85) и уровнем атерогенных липопротеидов низкой плотности (r=+0,50). АИ в большей степени был взаимосвязан со значениями изо–С4 (r=+0,61), С5 (r=+0,75) и функцией купферовских клеток (r=–0,64) и гепатоцитов (r=–0,71).
Анализ этих данных позволяет сделать вывод: нарушения функций печени при липидном дистресс–синдроме главным образом обусловлены выраженным дисбиозом толстой кишки, выражающемся в понижении общего уровня летучих жирных кислот и повышении анаэробного индекса, характерных для угнетения активности резидентной микрофлоры кишечника.
Кроме того, полученные данные позволяют заключить, что нарушения функции печени при ЛДС являются прямым следствием нарушенного симбиоза в системе «микробиота–хозяин» в результате различных агрессивных воздействий (стресс, пищевая агрессия и т.д.). Эти нарушения порождают взаимную агрессию микробиоты и «хозяина». Побеждает в этом «метаболическом поединке» микробиота при помощи активации «ударного» ферментативного аппарата бактерий и высвобождения эндотоксинов. Последние, повреждая эпителий илеоцекального отдела кишечника, в значительной мере нарушают метаболизм желчных кислот в цикле их энтерогепатической циркуляции, приводя в итоге к дислипопротеидемии и липидному дистресс–синдрому [17,28].
Применение пребиотика Хилак–форте, «локально» воздействующего на микробиоценоз толстой кишки, подтвердило это. Курс пребиотикотерапии вдвое увеличил общее количество ЛЖК, в 1,47 раза уменьшил величину анаэробного индекса, способствуя тем самым повышению уровня sIgA в 4 раза.
Таким образом, кишечная микрофлора представляет собой сложный метаболический орган, подобный печени, дефекты функционирования которого приводят к серьезным нарушениям здоровья. При липидном дистресс–синдроме происходят выраженные дисбиотические изменения кишечника, как толстого, так и тонкого, следствием этих нарушений является эндотоксемия, бактериальная транслокация, нарушение функций печени. В этой связи вполне логичен рациональный подход к лечению патологических изменений микрофлоры, состоящий в поддержке роста существующей кишечной флоры, физиологически адекватной организму человека, который способен нормализовать эти нарушения и стабилизировать течение ЛДС, т.е. уменьшить прогрессирование патологических изменений в органах–мишенях.
Выводы
• При липидном дистресс–синдроме Савельева происходят значительные нарушения в желчепродуцирующей и желчеэкскреторной функциях печени и снижение фагоцитарной активности ее купферовских клеток на фоне выраженных дисбиотических изменений толстой кишки.
• Пребиотикотерапия Хилак-форте устраняет дисбиоз, способствуя при этом восстановлению функций печени при ЛДС и нормализации липидного метаболизма.
• Хилак-форте может использоваться при липидном дистресс–синдроме Савельева как виде монотерапии, так и в составе комплексного липидокоррегирующего лечения.
1. Бабин В.Н., Домарадский И.В., Дубинин А.В., Кондракова О.А. Биохимические и молекулярные аспекты симбиоза человека и его микрофлоры.// Российский химический журнал. Т XXXVIII. №6, 1994, с. 66–68.
2. Болдырев А.А. // Биохимия мембран: (Введение в биохимию мембран).// М. – Высшая школа. – 1986. – 112 с.
3. Васильев Р.Х. // Диагностическая и лечебная лапароскопия.// М – Медицина. – 1986.
4. Готтшалк Г. «Метаболизм бактерий.»// Перевод с английского, Москва, «МИР», 1982.
5. Дибиров А.Д., Петухов В.А. и др. Морфофункциональные изменения органов гепатопанкреатобилиарной системы при экспериментальной дислипопротеидемии. //Бюлл. экперим.биол.и медицины, 2000, №7, с.45–51.
6. Доклад экспертной группы: выявление, количественная оценка и терапия высокого уровня холестерина у взрослых.»//Швейцария, 1990, с.34–56.
7. Кузнецов М.Р. Диагностика и лечение липидного дистресс–синдрома при облитерирующем атеросклерозе. //Диссертация на соискание ученой степени доктора медицинских наук. М. 2000.
8. Мак–Мюррей У. Обмен веществ у человека.// Пер. с англ., Москва, «Мир», 1980, с. 280.
9. Маянский Д.Н., Виссе Э., Декер К. //Новые рубежи гепатологии.// РАМН, Сибирское отделение, Новосибирск, 1992, 264с.
10. Пермяков Н.К., Подольский А.Е.// Холестероз желчного пузыря.// М.– Медицина.– 1969.– 102 с.
11. Савельев В.С. // Липидный дистресс–синдром в хирургии.// Материалы научно–практической конференции, посвященной 200–летию ВМА. – С.–П. – 1998.
12. Савельев В.С. // Липидный дистресс–синдром в хирургии.// Материалы 8–ой открытой сессии РАМН. – М. – 1999. – с.56–57.
13. Савельев В.С., Яблоков Е.Г., Петухов В.А. // Липидный дистресс–синдром в хирургии.// Бюллетень экспериментальной биологии и медицины. – 1999. – т.127.– №6. – с.604–611.
14. Савельев В.С., Яблоков Е.Г., Петухов В.А. и др.// Дислипопротеидемия при панкреонекрозе: причинно–следственные взаимосвязи.// Хирургия.– 1995.– №3.– С.23–26.
15. Синьков А.Н. //Коррекция дислипопротеидемии у больных холестерозом желчного пузыря.// Диссертация на соискание ученой степени кандидата медицинских наук. – М. – 1998.
16. Тугдумов Б.В. // Результаты хирургической коррекции дислипопротеидемии при липидном дистресс–синдроме.// Диссертация на соискание ученой степени кандидата медицинских наук. – М. – 1999.
17. Шендеров Б.А. Медицинская микробная экология и функциональное питание.М.,1998, 1 и 2 том.
18. Яблоков Е.Г., Петухов В.А., Кузнецов М.Р. //Дислипопротеидемия и облитерирующий атеросклероз (под ред. академика В.С.Савельева.).// М.– 1996. – 147 с.
19. Яблоков Е.Г., Петухов В.А., Кузнецов М.Р. Дислипопротеидемия и облитерирующий атеросклероз. Методические рекомендации для врачей., М.,1996, 38 с.
20. Anderson J.V. The impact of SCFAs on sistemic metabolism./SCFAs and metabolism.// Short Chain Fatty Acides. Congress Short Report Falk Symposium, comp. by Scheppach W., Strasbourg, 1993, pp.27.
21. Bairaktari ET; Tzallas CS; Tsimihodimos VK; Liberopoulos EN; Miltiadous GA; Elisaf MS Comparison of the efficacy of atorvastatin and micronized fenofibrate in the treatment of mixed hyperlipidemia. // J Cardiovasc Risk, 1999 Apr, 6:2, 113–6.
22. Boyd W. // Studies In gallbladder pathology // Brit. J.Surg. – 1923. – Vol.10. – p.337–356.
23. Brown M., Goldstein J. Lipoprotein metabolism in the macrophage: implication for cholesterol deposition in atherosclerosis. // Ann. Rev Biochem., 1983, vol. 52, p. 223–261.
24. Cato E.P., Cummins C.S., Holdeman L.V. et. al. Virginia Polytechnic Institute: Anaerobic. Laboratory, 2–d Rev., Blacksburg, 1970, p. 82–87.
25. Choa A., Courtman D.W., Langille B.L. //Apoptosis (Programmed Cells Death) in arteries of neonatal umb.// Circulat. Res. 1995, 16(2):168–175.
26. Cianflone D, Lanza G A., Maseri A //Microvascular angina in patients with normal coronary arteries and with other ischaemic syndromes.// Istituto di Cardiologia, Universita Cattolica del Sacro Cuore, Roma, Italy. Microcirculation 1995 Aug;2(2):165–172.
27. Demigne C. SCFAs and hepatic metabolism./ SCFAs and metabolism.// Short Chain Fatty Acides. Congress Short Report Falk Symposium, comp. by Scheppach W., Strasbourg, 1993, pp.28–29.
28. Fukushima K., Shindp K., Yamazaki R. Et al. Jejunal bacterial flora and deconugation of bile acids. // J. Germfree, v. 5, №1.
29. Fuller R, Gibson GR. Modifications of the intestinal microflora using probiotics and prebiotics. Scand. J. Gastroenterol 1997; 32: (suppl. 222): 28–32.
30. Getz G.S., Vesselinovitch D., Wissler R.W. // A dynamic pathology of atherosclerosis.// Am. J. Med. – 1969. –Vol.46. – p.657–673.
31. Iliadis EA; Rosenson RS Long–term safety of pravastatin–gemfibrozil therapy in mixed hyperlipidemia. // Clin Cardiol, 1999 Jan, 22:1, 25–8.
32. Jacyna M. R., Bouchier I. A. DM Cholesterosis: a physical cause of function disorder.// Brit. J. Surg.–1987.– Vol. 295.– P. 619–620.
33. Juhn S.K. Barrier system in inner ear //Acta Otolaryngol. (Stockh)/–1988.–Suppl.458.–p.79–83.
34. Kim M., Onda M., Yoshimura S. et al. The experimental study of hepatocytotoxicity in endotoxemia. // J. Germfree life gnotobiol., 1991, v. 21, №2.
35. Nevelsteen A., Suy R., Daenen W. Et al. // Report of the surgical correction of high blood cholesterol.// Surgery. – 1980. – Vol.88. – N5. – p.642–653.
36. Patsch J.P. // Lipid lowering drugs in preventing of atherosclerosis.// Internist. – Berlin. – 189. – May. – Vol.30(5). – p.309–314.
37. Peterson T. C., Renton K. W. Kupffer cell factor mediated depression of hepatic parenchymal cell cytochrome P–450. // Biochem. Pharmacol., 1986, vol. 35, p. 1491–1497.
38. Ross R. // The pathogenesis of atherosclerosis – an update.// N. Engl. J. Med. – 1986. – Vol.314. – p.489–500.
39. Ross R., Harker L. // Hyperlipidemia and atherosclerosis.// Science. – 1976. – Vol.193. – p.1094–1100.
40. Stephen A.M. Propionate and its role in lipid metabolism./ SCFAs and metabolism.// Short Chain Fatty Acides. Congress Short Report Falk Symposium, comp. by Scheppach W., Strasbourg, 1993, pp.27–28.
41. Tazume S., Yamaoka T., Hashimoto K., Sasaki S. Intestinal flora and bile acide metabo. Quantitative analysis of bile acide mttabolites in each step of rejection of shigella organisms.// J. Germfree., 1978, Vol. 8, №2.
42. Thompson G.R.// A handbook of hyperlipidemia.// London. – 1991. –255p.












