–Ę–Ķ—Ä–ľ–ł–Ĺ –Ě–ź–°–ď –≤–Ņ–Ķ—Ä–≤—č–Ķ —Ā—Ą–ĺ—Ä–ľ—É–Ľ–ł—Ä–ĺ–≤–į–Ľ–ł Ludwig –ł —Ā–ĺ–į–≤—ā. –≤ 1980 –≥., –ł–∑—É—á–į—Ź —Ö–į—Ä–į–ļ—ā–Ķ—Ä –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –≤ –Ņ–Ķ—á–Ķ–Ĺ–ł —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –ĺ–∂–ł—Ä–Ķ–Ĺ–ł–Ķ–ľ –ł —Ā–į—Ö–į—Ä–Ĺ—č–ľ –ī–ł–į–Ī–Ķ—ā–ĺ–ľ 2 —ā–ł–Ņ–į, —É –ļ–ĺ—ā–ĺ—Ä—č—Ö –≤ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–Ķ –Ĺ–Ķ –Ī—č–Ľ–ĺ —É–ļ–į–∑–į–Ĺ–ł–Ļ –Ĺ–į –Ņ—Ä–ł–Ķ–ľ –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ź –≤ –≥–Ķ–Ņ–į—ā–ĺ—ā–ĺ–ļ—Ā–ł—á–Ķ—Ā–ļ–ł—Ö –ī–ĺ–∑–į—Ö, –ĺ–ī–Ĺ–į–ļ–ĺ –Ņ—Ä–ł –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł —ā–ļ–į–Ĺ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł –Ī—č–Ľ–ł –≤—č—Ź–≤–Ľ–Ķ–Ĺ—č –Ņ—Ä–ł–∑–Ĺ–į–ļ–ł, —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ—č–Ķ –ī–Ľ—Ź –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ–ĺ–Ļ –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł. –°–ĺ—á–Ķ—ā–į–Ĺ–ł–Ķ –ī–≤—É—Ö –ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č—Ö –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ļ—Ä–ł—ā–Ķ—Ä–ł–Ķ–≤: –Ņ—Ä–ł–∑–Ĺ–į–ļ–ł –∂–ł—Ä–ĺ–≤–ĺ–Ļ –ī–ł—Ā—ā—Ä–ĺ—Ą–ł–ł —Ā –Ľ–ĺ–Ī—É–Ľ—Ź—Ä–Ĺ—č–ľ –≥–Ķ–Ņ–į—ā–ł—ā–ĺ–ľ –ł –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–į –ī–į–Ľ–ĺ –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–Ķ –Ņ—Ä–Ķ–ī–Ľ–ĺ–∂–ł—ā—Ć –ī–Ľ—Ź —ā–į–ļ–ł—Ö —Ā–Ľ—É—á–į–Ķ–≤ —ā–Ķ—Ä–ľ–ł–Ĺ «–Ĺ–Ķ–į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ—č–Ļ —Ā—ā–Ķ–į—ā–ĺ–≥–Ķ–Ņ–į—ā–ł—ā». –Ē–ĺ —ā–Ķ—Ö –Ņ–ĺ—Ä –ī–Ľ—Ź –ĺ–Ī–ĺ–∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź –Ņ–ĺ–ī–ĺ–Ī–Ĺ—č—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –≤ –Ņ–Ķ—á–Ķ–Ĺ–ł –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –≤—Ä–Ķ–ľ—Ź –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ľ–ł—Ā—Ć —ā–Ķ—Ä–ľ–ł–Ĺ—č «–Ņ—Ā–Ķ–≤–ī–ĺ–į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ—č–Ļ –≥–Ķ–Ņ–į—ā–ł—ā», «–ī–ł–į–Ī–Ķ—ā–ł—á–Ķ—Ā–ļ–ł–Ļ –≥–Ķ–Ņ–į—ā–ł—ā», «—Ā—ā–Ķ–į—ā–ĺ–Ĺ–Ķ–ļ—Ä–ĺ–∑», «–≥–Ķ–Ņ–į—ā–ł—ā —Ā –∂–ł—Ä–ĺ–≤–ĺ–Ļ –ī–ł—Ā—ā—Ä–ĺ—Ą–ł–Ķ–Ļ –Ņ–Ķ—á–Ķ–Ĺ–ł».
–í –°–Ķ–≤–Ķ—Ä–Ĺ–ĺ–Ļ –ź–ľ–Ķ—Ä–ł–ļ–Ķ, –ē–≤—Ä–ĺ–Ņ–Ķ, –Į–Ņ–ĺ–Ĺ–ł–ł —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ě–ź–Ė–Ď–ü –≤ –Ņ–ĺ–Ņ—É–Ľ—Ź—Ü–ł–ł –ī–ĺ—Ā—ā–ł–≥–į–Ķ—ā 10–40%, –Ņ—Ä–ł —ć—ā–ĺ–ľ –Ě–ź–°–ď –≤–Ķ—Ä–ł—Ą–ł—Ü–ł—Ä—É—é—ā –≤ 1,2–4,8% —Ā–Ľ—É—á–į–Ķ–≤. –í –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–Ķ –≤—Ä–Ķ–ľ—Ź –ĺ—ā–ľ–Ķ—á–į–Ķ—ā—Ā—Ź –Ĺ–Ķ—É–ļ–Ľ–ĺ–Ĺ–Ĺ—č–Ļ —Ä–ĺ—Ā—ā –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ķ–ľ–ĺ—Ā—ā–ł –Ě–ź–Ė–Ď–ü, –Ĺ–į –ī–ĺ–Ľ—é –ļ–ĺ—ā–ĺ—Ä–ĺ–Ļ –≤ –°–®–ź –Ņ—Ä–ł—Ö–ĺ–ī–ł—ā—Ā—Ź 69% –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –Ņ–Ķ—á–Ķ–Ĺ–ł. –ß–į—Ā—ā–ĺ—ā–į –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź –Ě–ź–°–ď —Ā—Ä–Ķ–ī–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, —É –ļ–ĺ—ā–ĺ—Ä—č—Ö –Ĺ–į –Ņ—Ä–ĺ—ā—Ź–∂–Ķ–Ĺ–ł–ł –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –≤—Ä–Ķ–ľ–Ķ–Ĺ–ł –≤—č—Ź–≤–Ľ—Ź—é—ā –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–Ĺ—č–Ļ —É—Ä–ĺ–≤–Ķ–Ĺ—Ć —Ā—č–≤–ĺ—Ä–ĺ—ā–ĺ—á–Ĺ—č—Ö –į–ľ–ł–Ĺ–ĺ—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑ –Ĺ–Ķ—É—ā–ĺ—á–Ĺ–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –≥–Ķ–Ĺ–Ķ–∑–į, —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ—ā 20–32%. –Ě–Ķ—Ā–ľ–ĺ—ā—Ä—Ź –Ĺ–į –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –ĺ—ā–Ķ—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –ī–į–Ĺ–Ĺ—č—Ö, –ľ–ĺ–∂–Ĺ–ĺ –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–ĺ–∂–ł—ā—Ć, —á—ā–ĺ –≤ –†–ĺ—Ā—Ā–ł–ł –ł–∑ –Ī–ĺ–Ľ–Ķ–Ķ 2 –ľ–Ľ–Ĺ. –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā–į—Ö–į—Ä–Ĺ—č–ľ –ī–ł–į–Ī–Ķ—ā–ĺ–ľ 2 —ā–ł–Ņ–į —É 2/3 –ł–ľ–Ķ–Ķ—ā—Ā—Ź –Ě–ź–Ė–Ď–ü. –ü–ĺ –ī–į–Ĺ–Ĺ—č–ľ –ö–Ľ–ł–Ĺ–ł–ļ–ł –Ņ—Ä–ĺ–Ņ–Ķ–ī–Ķ–≤—ā–ł–ļ–ł –≤–Ĺ—É—ā—Ä–Ķ–Ĺ–Ĺ–ł—Ö –Ī–ĺ–Ľ–Ķ–∑–Ĺ–Ķ–Ļ, –≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–ł–ł –ł –≥–Ķ–Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł –ł–ľ. –í.–•. –í–į—Ā–ł–Ľ–Ķ–Ĺ–ļ–ĺ –ú–ú–ź –ł–ľ–Ķ–Ĺ–ł –ė.–ú. –°–Ķ—á–Ķ–Ĺ–ĺ–≤–į, –ī–ĺ–Ľ—Ź –Ě–ź–°–ď –≤ —Ā—ā—Ä—É–ļ—ā—É—Ä–Ķ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –Ņ–Ķ—á–Ķ–Ĺ–ł, –Ņ—Ä–ł –ļ–ĺ—ā–ĺ—Ä—č—Ö –Ņ–ĺ—ā—Ä–Ķ–Ī–ĺ–≤–į–Ľ–ĺ—Ā—Ć –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ł–Ķ –Ņ—É–Ĺ–ļ—Ü–ł–ĺ–Ĺ–Ĺ–ĺ–Ļ –Ī–ł–ĺ–Ņ—Ā–ł–ł, —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–į 5,2%, —É–ī–Ķ–Ľ—Ć–Ĺ—č–Ļ –≤–Ķ—Ā –Ě–ź–°–ď –ł —Ü–ł—Ä—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł –≤ –ł—Ā—Ö–ĺ–ī–Ķ –Ě–ź–°–ď —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ–ľ –Ņ–Ķ—á–Ķ–Ĺ–ł –Ĺ–Ķ—É—ā–ĺ—á–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ļ —ć—ā–ł–ĺ–Ľ–ĺ–≥–ł–ł – 6,8% [3,4].
–°—ā–Ķ–į—ā–ĺ–∑ –ł –Ě–ź–°–ď
–ü–ĺ—Ā–Ľ–Ķ–ī–Ĺ–ł–Ķ –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–ł—Ź –ĺ –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ–∑–Ķ –Ě–ź–°–ď –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź—é—ā –≤—č–ī–Ķ–Ľ–ł—ā—Ć, –ļ–į–ļ –ľ–ł–Ĺ–ł–ľ—É–ľ, –ī–≤–į —ć—ā–į–Ņ–į –Ķ–≥–ĺ —Ä–į–∑–≤–ł—ā–ł—Ź:
• I —ć—ā–į–Ņ – –Ņ–ĺ—Ā—ā—É–Ņ–Ľ–Ķ–Ĺ–ł–Ķ –Ľ–ł–Ņ–ł–ī–ĺ–≤ –≤ –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā—č – —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ —Ā—ā–Ķ–į—ā–ĺ–∑–į (—ā–Ķ–ĺ—Ä–ł—Ź «–Ņ–Ķ—Ä–≤–ĺ–≥–ĺ —ā–ĺ–Ľ—á–ļ–į»);
• II —ć—ā–į–Ņ – —Ä–į–∑–≤–ł—ā–ł–Ķ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź – —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ —Ā—ā–Ķ–į—ā–ĺ–≥–Ķ–Ņ–į—ā–ł—ā–į (—ā–Ķ–ĺ—Ä–ł—Ź «–≤—ā–ĺ—Ä–ĺ–≥–ĺ —ā–ĺ–Ľ—á–ļ–į»).
–°—ā–Ķ–į—ā–ĺ–∑ –Ņ–Ķ—á–Ķ–Ĺ–ł –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ—Ź–Ķ—ā —Ā–ĺ–Ī–ĺ–Ļ –ł–∑–Ī—č—ā–ĺ—á–Ĺ–ĺ–Ķ –Ĺ–į–ļ–ĺ–Ņ–Ľ–Ķ–Ĺ–ł–Ķ –Ľ–ł–Ņ–ł–ī–ĺ–≤ –≤ –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–į—Ö. –ě–Ī –ĺ–∂–ł—Ä–Ķ–Ĺ–ł–ł –Ņ–Ķ—á–Ķ–Ĺ–ł –≥–ĺ–≤–ĺ—Ä—Ź—ā, –ļ–ĺ–≥–ī–į –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–ĺ –Ľ–ł–Ņ–ł–ī–ĺ–≤ –Ņ—Ä–Ķ–≤—č—ą–į–Ķ—ā 5% –ĺ—ā –Ķ–Ķ –ľ–į—Ā—Ā—č. –í –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ņ—Ä–į–ļ—ā–ł–ļ–Ķ —Ā—ā–Ķ–į—ā–ĺ–∑ –ĺ–Ī—č—á–Ĺ–ĺ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ķ—ā—Ā—Ź –Ņ—Ä–ł –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł —ā–ļ–į–Ĺ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł –≤ –≤–ł–ī–Ķ –ļ–į–Ņ–Ķ–Ľ—Ć –∂–ł—Ä–į, —Ä–į—Ā–Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–Ĺ—č—Ö –≤ –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–į—Ö [1,2]. –Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –Ņ—Ä–ł –Ņ–ĺ—Ā—ā–į–Ĺ–ĺ–≤–ļ–Ķ –ī–ł–į–≥–Ĺ–ĺ–∑–į —Ā—ā–Ķ–į—ā–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł –≤ –Ņ–Ķ—Ä–≤—É—é –ĺ—á–Ķ—Ä–Ķ–ī—Ć –ł–ľ–Ķ—é—ā –≤ –≤–ł–ī—É –Ĺ–į–Ľ–ł—á–ł–Ķ –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ł–∑–Ĺ–į–ļ–ĺ–≤ –ĺ–∂–ł—Ä–Ķ–Ĺ–ł—Ź –Ņ–Ķ—á–Ķ–Ĺ–ł –ł –≤ –ľ–Ķ–Ĺ—Ć—ą–Ķ–Ļ —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł – –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź. –°—ā–Ķ–į—ā–ĺ–∑ –Ņ–Ķ—á–Ķ–Ĺ–ł –ĺ–Ī—č—á–Ĺ–ĺ —É–ļ–į–∑—č–≤–į–Ķ—ā –Ĺ–į –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ —Ä–Ķ–≥—É–Ľ—Ź—Ü–ł–ł —Ā–ł–Ĺ—ā–Ķ–∑–į –ł —Ā–Ķ–ļ—Ä–Ķ—Ü–ł–ł —ā—Ä–ł–≥–Ľ–ł—Ü–Ķ—Ä–ł–ī–ĺ–≤, –ļ–ĺ–Ĺ–ļ—Ä–Ķ—ā–Ĺ—č–Ķ –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ—č –ļ–ĺ—ā–ĺ—Ä–ĺ–≥–ĺ –Ĺ–į —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź—ą–Ĺ–ł–Ļ –ī–Ķ–Ĺ—Ć –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ –ł–∑—É—á–Ķ–Ĺ—č. –Ě–Ķ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ—č –ł —Ą–į–ļ—ā–ĺ—Ä—č, –≤—č—Ā—ā—É–Ņ–į—é—Č–ł–Ķ –≤ —Ä–ĺ–Ľ–ł —ā—Ä–ł–≥–≥–Ķ—Ä–Ĺ—č—Ö –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ–ĺ–≤ –∑–į–Ņ—É—Ā–ļ–į –ī–į–Ĺ–Ĺ—č—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ. –ö–į–ļ –≤–ĺ–∑–ľ–ĺ–∂–Ĺ—č–Ķ –Ņ–į—ā–ĺ—Ą–ł–∑–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ—č –ĺ–Ī—Ā—É–∂–ī–į—é—ā—Ā—Ź: –ł–∑–Ī—č—ā–ĺ—á–Ĺ–ĺ–Ķ –Ņ–ĺ—Ā—ā—É–Ņ–Ľ–Ķ–Ĺ–ł–Ķ –∂–ł—Ä–Ĺ—č—Ö –ļ–ł—Ā–Ľ–ĺ—ā –ł–∑ –∂–ł—Ä–ĺ–≤–ĺ–Ļ —ā–ļ–į–Ĺ–ł –ł–Ľ–ł –Ņ–ł—Č–Ķ–≤–ĺ–≥–ĺ –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–∂–ī–Ķ–Ĺ–ł—Ź –≤ –Ņ–Ķ—á–Ķ–Ĺ—Ć; —É—Ā–ł–Ľ–Ķ–Ĺ–ł–Ķ —ć–Ĺ–ī–ĺ–≥–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ —Ā–ł–Ĺ—ā–Ķ–∑–į –∂–ł—Ä–Ĺ—č—Ö –ļ–ł—Ā–Ľ–ĺ—ā; —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł–Ķ –ľ–ł—ā–ĺ—Ö–ĺ–Ĺ–ī—Ä–ł–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ β––ĺ–ļ–ł—Ā–Ľ–Ķ–Ĺ–ł—Ź –∂–ł—Ä–į; –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ –≤–ļ–Ľ—é—á–Ķ–Ĺ–ł–Ļ –ł —ć–ļ—Ā–ļ—Ä–Ķ—Ü–ł–ł —ā—Ä–ł–≥–Ľ–ł—Ü–Ķ—Ä–ł–ī–ĺ–≤ –≤ —Ā–ĺ—Ā—ā–į–≤–Ķ –Ľ–ł–Ņ–ĺ–Ņ—Ä–ĺ—ā–Ķ–ł–ī–ĺ–≤ –ĺ—á–Ķ–Ĺ—Ć –Ĺ–ł–∑–ļ–ĺ–Ļ –Ņ–Ľ–ĺ—ā–Ĺ–ĺ—Ā—ā–ł [9]. –®–ł—Ä–ĺ–ļ–ĺ –ł–∑–≤–Ķ—Ā—ā–Ĺ—č –ī–≤–į —ā–ł–Ņ–į –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ–į—Ä—ā–ł–Ĺ—č —Ā—ā–Ķ–į—ā–ĺ–∑–į. –ß–į—Č–Ķ –≤—Ā—ā—Ä–Ķ—á–į–Ķ—ā—Ā—Ź —ā–į–ļ –Ĺ–į–∑—č–≤–į–Ķ–ľ–ĺ–Ķ –ļ—Ä—É–Ņ–Ĺ–ĺ–ļ–į–Ņ–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ (–ľ–į–ļ—Ä–ĺ–≤–Ķ–∑–ł–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ–Ķ) –ĺ–∂–ł—Ä–Ķ–Ĺ–ł–Ķ, –ī–Ľ—Ź –ļ–ĺ—ā–ĺ—Ä–ĺ–≥–ĺ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ–ĺ –Ĺ–į–Ľ–ł—á–ł–Ķ –ĺ–ī–Ĺ–ĺ–Ļ –Ī–ĺ–Ľ—Ć—ą–ĺ–Ļ –≤–į–ļ—É–ĺ–Ľ–ł –∂–ł—Ä–į –≤ –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–Ķ, –ĺ—ā—ā–Ķ—Ā–Ĺ—Ź—é—Č–Ķ–Ļ –Ķ–≥–ĺ —Ź–ī—Ä–ĺ –ļ –Ņ–Ķ—Ä–ł—Ą–Ķ—Ä–ł–ł –ļ–Ľ–Ķ—ā–ļ–ł. –†–Ķ–∂–Ķ –Ĺ–į–Ī–Ľ—é–ī–į–Ķ—ā—Ā—Ź –ľ–Ķ–Ľ–ļ–ĺ–ļ–į–Ņ–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ (–ľ–ł–ļ—Ä–ĺ–≤–Ķ–∑–ł–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ–Ķ) –ĺ–∂–ł—Ä–Ķ–Ĺ–ł–Ķ, –ī–Ľ—Ź –ļ–ĺ—ā–ĺ—Ä–ĺ–≥–ĺ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ–ĺ –Ĺ–į–Ľ–ł—á–ł–Ķ –ľ–Ĺ–ĺ–∂–Ķ—Ā—ā–≤–į –ľ–Ķ–Ľ–ļ–ł—Ö –≤–į–ļ—É–ĺ–Ľ–Ķ–Ļ –∂–ł—Ä–į –≤–ĺ–ļ—Ä—É–≥ —Ź–ī—Ä–į –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–į, –ļ–ĺ—ā–ĺ—Ä—č–Ļ —Ā–ĺ—Ö—Ä–į–Ĺ—Ź–Ķ—ā —Ü–Ķ–Ĺ—ā—Ä–į–Ľ—Ć–Ĺ–ĺ–Ķ –Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–ł–Ķ –≤ –ļ–Ľ–Ķ—ā–ļ–Ķ. –Ě–į –Ņ—Ä–į–ļ—ā–ł–ļ–Ķ –≤ —Ä—Ź–ī–Ķ —Ā–Ľ—É—á–į–Ķ–≤ –Ņ–į—Ä–į–Ľ–Ľ–Ķ–Ľ—Ć–Ĺ–ĺ –ĺ—ā–ľ–Ķ—á–į—é—ā—Ā—Ź –Ņ—Ä–ł–∑–Ĺ–į–ļ–ł –ĺ–Ī–ĺ–ł—Ö —ā–ł–Ņ–ĺ–≤ –ĺ–∂–ł—Ä–Ķ–Ĺ–ł—Ź. –ö–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ –ĺ–Ņ—č—ā, –Ĺ–į–ļ–ĺ–Ņ–Ľ–Ķ–Ĺ–Ĺ—č–Ļ –Ĺ–į —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź—ą–Ĺ–ł–Ļ –ī–Ķ–Ĺ—Ć, –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –≥–ĺ–≤–ĺ—Ä–ł—ā—Ć –ĺ –≤–Ľ–ł—Ź–Ĺ–ł–ł –ī–≤—É—Ö —ā–ł–Ņ–ĺ–≤ –ĺ–∂–ł—Ä–Ķ–Ĺ–ł—Ź –Ĺ–į —ā–Ķ—á–Ķ–Ĺ–ł–Ķ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł [5,6,8]. –ö—Ä—É–Ņ–Ĺ–ĺ–ļ–į–Ņ–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –ĺ–∂–ł—Ä–Ķ–Ĺ–ł–Ķ –≤—Ā—ā—Ä–Ķ—á–į–Ķ—ā—Ā—Ź –Ņ—Ä–ł —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź—Ö –Ņ–Ķ—á–Ķ–Ĺ–ł –ł —É–ļ–į–∑—č–≤–į–Ķ—ā –Ĺ–į –ī–ĺ–Ī—Ä–ĺ–ļ–į—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ —Ā –Ĺ–Ķ–Ī–ĺ–Ľ—Ć—ą–ĺ–Ļ —Ā–ļ–Ľ–ĺ–Ĺ–Ĺ–ĺ—Ā—ā—Ć—é –ļ –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł—Ź–ľ. –Ě–į–Ņ—Ä–ĺ—ā–ł–≤, –ľ–Ķ–Ľ–ļ–ĺ–ļ–į–Ņ–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –ĺ–∂–ł—Ä–Ķ–Ĺ–ł–Ķ, –≤ —á–į—Ā—ā–Ĺ–ĺ—Ā—ā–ł, –Ķ–≥–ĺ —Ā–į–ľ–ĺ—Ā—ā–ĺ—Ź—ā–Ķ–Ľ—Ć–Ĺ–į—Ź —Ą–ĺ—Ä–ľ–į, –≤—Ā—ā—Ä–Ķ—á–į–Ķ—ā—Ā—Ź –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —Ä–Ķ–∂–Ķ –ł –ĺ—ā—Ä–į–∂–į–Ķ—ā –Ĺ–į–Ľ–ł—á–ł–Ķ —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –≥–Ľ—É–Ī–ĺ–ļ–ĺ–≥–ĺ –Ņ–ĺ—Ä–į–∂–Ķ–Ĺ–ł—Ź –ľ–ł—ā–ĺ—Ö–ĺ–Ĺ–ī—Ä–ł–Ļ –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–ĺ–≤, —á—ā–ĺ —á–į—Č–Ķ –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ —Ä–į–∑–≤–ł—ā–ł—é –Ņ–Ķ—á–Ķ–Ĺ–ĺ—á–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł, —ć–Ĺ—Ü–Ķ—Ą–į–Ľ–ĺ–Ņ–į—ā–ł–ł, –ļ–ĺ–ľ—č –ł —Ā–ľ–Ķ—Ä—ā–ł –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö [10].
–Ě–ź–°–ď – –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ —Ā—ā–Ķ–į—ā–ĺ–∑–į –ł –Ĺ–Ķ–ļ—Ä–ĺ––≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ —Ä–Ķ–į–ļ—Ü–ł–ł —ā–ļ–į–Ĺ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł, –ļ–ĺ—ā–ĺ—Ä—č–Ļ —É—Ā—ā–į–Ĺ–į–≤–Ľ–ł–≤–į–Ķ—ā—Ā—Ź –Ņ–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–į–ľ –Ī–ł–ĺ–Ņ—Ā–ł–ł –Ņ–Ķ—á–Ķ–Ĺ–ł, –Ņ–ĺ—Ā–Ľ–Ķ –ł—Ā–ļ–Ľ—é—á–Ķ–Ĺ–ł—Ź –ī—Ä—É–≥–ł—Ö –Ņ—Ä–ł—á–ł–Ĺ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ņ–Ķ—á–Ķ–Ĺ–ł. –Ě–ź–°–ď, –ļ–į–ļ –Ņ—Ä–į–≤–ł–Ľ–ĺ, –Ĺ–ĺ—Ā–ł—ā —Ö–į—Ä–į–ļ—ā–Ķ—Ä –ī–ł—Ą—Ą—É–∑–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į. –Ē–Ľ—Ź –Ķ–≥–ĺ —Ä–į–∑–≤–ł—ā–ł—Ź –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –Ĺ–į–Ľ–ł—á–ł–Ķ –ī–≤—É—Ö —É—Ā–Ľ–ĺ–≤–ł–Ļ – –ł–∑–Ī—č—ā–ĺ—á–Ĺ–ĺ–Ļ –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į –ł —Ā–į—Ö–į—Ä–Ĺ–ĺ–≥–ĺ –ī–ł–į–Ī–Ķ—ā–į. –°—ā–Ķ–į—ā–ĺ–∑ –Ĺ–į—Ö–ĺ–ī—Ź—ā —É 70% –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, —á–Ķ–Ļ –≤–Ķ—Ā –Ņ—Ä–Ķ–≤—č—ą–į–Ķ—ā –ĺ—ā 110 –ī–ĺ 200% –ł–ī–Ķ–į–Ľ—Ć–Ĺ–ĺ–Ļ –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į. –Ę–ĺ–Ľ—Ć–ļ–ĺ —É 1–4% —ā—É—á–Ĺ—č—Ö –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–į—Ź –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ě–ź–°–ď –ĺ—ā—Ä–į–∂–į–Ķ—ā –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –ł–∑–Ī—č—ā–ļ–į –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į. –£ 20–70% –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ě–ź–°–ď –≤—č—Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —Ā–į—Ö–į—Ä–Ĺ—č–Ļ –ī–ł–į–Ī–Ķ—ā, —É –ĺ—Ā—ā–į–Ľ—Ć–Ĺ—č—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ĺ–į —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö —Ā—Ä–ĺ–ļ–į—Ö —Ä–į–∑–≤–ł—ā–ł—Ź –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—Ä—É–Ķ—ā—Ā—Ź –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ —ā–ĺ–Ľ–Ķ—Ä–į–Ĺ—ā–Ĺ–ĺ—Ā—ā–ł –ļ –≥–Ľ—é–ļ–ĺ–∑–Ķ. –Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č —Ā –Ĺ–į–Ľ–ł—á–ł–Ķ–ľ —ć—ā–ł—Ö –ī–≤—É—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ –≤—Ö–ĺ–ī—Ź—ā –≤ –≥—Ä—É–Ņ–Ņ—É –≤—č—Ā–ĺ–ļ–ĺ–≥–ĺ —Ä–ł—Ā–ļ–į –Ě–ź–°–ď [10,11]. –°—Ä–Ķ–ī–ł –ī—Ä—É–≥–ł—Ö —É—Ā–Ľ–ĺ–≤–ł–Ļ, —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É—é—Č–ł—Ö —Ä–į–∑–≤–ł—ā–ł—é –Ě–ź–°–ď, –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –Ĺ–Ķ –∑–į–Ī—č–≤–į—ā—Ć –ł –ĺ —Ö–ł—Ä—É—Ä–≥–ł—á–Ķ—Ā–ļ–ł—Ö –≤–ľ–Ķ—ą–į—ā–Ķ–Ľ—Ć—Ā—ā–≤–į—Ö, –Ņ—Ä–ĺ–≤–ĺ–ī–ł–ľ—č—Ö –Ņ–ĺ –Ņ–ĺ–≤–ĺ–ī—É –ĺ–∂–ł—Ä–Ķ–Ĺ–ł—Ź, —ā–į–ļ–ł—Ö –ļ–į–ļ –Ĺ–į–Ľ–ĺ–∂–Ķ–Ĺ–ł–Ķ –Ķ—é–Ĺ–ĺ––ł–Ľ–Ķ–ĺ–į–Ĺ–į—Ā—ā–ĺ–ľ–ĺ–∑–į. –ü–ĺ–ī–ĺ–Ī–Ĺ—č–Ķ –ĺ–Ņ–Ķ—Ä–į—Ü–ł–ł –ľ–ĺ–≥—É—ā –Ņ—Ä–ł–≤–ĺ–ī–ł—ā—Ć –ļ –Ņ–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—é –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł —Ä–į–Ĺ–Ķ–Ķ –ł–ľ–Ķ—é—Č–Ķ–≥–ĺ—Ā—Ź –ł–Ľ–ł –ļ —Ä–į–∑–≤–ł—ā–ł—é –Ě–ź–°–ď —Ā –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č–ľ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ–ľ, –Ņ—Ä–ł–≤–ĺ–ī—Ź—Č–Ķ–≥–ĺ –ļ —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł—é —Ą–ł–Ī—Ä–ĺ–∑–į, —Ü–ł—Ä—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł –ł –Ķ–≥–ĺ –ĺ—Ā–Ľ–ĺ–∂–Ĺ–Ķ–Ĺ–ł–Ļ [8,10].
–ď—Ä–į–ľ–ĺ—ā–Ĺ–į—Ź –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–į—Ź –ĺ—Ü–Ķ–Ĺ–ļ–į –Ě–ź–Ė–Ď–ü –ł–ľ–Ķ–Ķ—ā –Ņ—Ä–ł–Ĺ—Ü–ł–Ņ–ł–į–Ľ—Ć–Ĺ–ĺ–Ķ –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –Ĺ–Ķ —ā–ĺ–Ľ—Ć–ļ–ĺ –≤ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–Ķ, –Ĺ–ĺ –ł –≤ –ĺ—Ü–Ķ–Ĺ–ļ–Ķ —Ą–ĺ—Ä–ľ—č —ā–Ķ—á–Ķ–Ĺ–ł—Ź, –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–į –ł —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–ĺ–≤–ĺ–ī–ł–ľ–ĺ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź. –ü–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł —Ā—č–≤–ĺ—Ä–ĺ—ā–ĺ—á–Ĺ—č—Ö –į–ľ–ł–Ĺ–ĺ—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑ –Ĺ–Ķ –ł–ľ–Ķ—é—ā –ļ–ĺ—Ä—Ä–Ķ–Ľ—Ź—Ü–ł–ł —Ā –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć—é –≥–ł—Ā—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –≤ –Ņ–Ķ—á–Ķ–Ĺ–ł.
–ú–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–į—Ź –ļ–į—Ä—ā–ł–Ĺ–į –Ě–ź–°–ď —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł–∑—É–Ķ—ā—Ā—Ź –Ĺ–į–Ľ–ł—á–ł–Ķ–ľ –ļ—Ä—É–Ņ–Ĺ–ĺ–ļ–į–Ņ–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –∂–ł—Ä–ĺ–≤–ĺ–Ļ –ī–ł—Ā—ā—Ä–ĺ—Ą–ł–ł –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–ĺ–≤ –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –≤ 3––Ļ –∑–ĺ–Ĺ–Ķ –į—Ü–ł–Ĺ—É—Ā–į, –ł–ľ–Ķ—é—Č–Ķ–Ļ –≤–ł–ī –ļ—Ä—É–Ņ–Ĺ—č—Ö –ĺ–ī–ł–Ĺ–ĺ—á–Ĺ—č—Ö –Ľ–ł–Ņ–ł–ī–Ĺ—č—Ö –ļ–į–Ņ–Ķ–Ľ—Ć –≤ —Ü–ł—ā–ĺ–Ņ–Ľ–į–∑–ľ–Ķ —Ā–ĺ —Ā–ľ–Ķ—Č–Ķ–Ĺ–ł–Ķ–ľ —Ź–ī—Ä–į –ļ –Ņ–Ķ—Ä–ł—Ą–Ķ—Ä–ł–ł –ļ–Ľ–Ķ—ā–ļ–ł. –ě—ā–ľ–Ķ—á–į–Ķ—ā—Ā—Ź —ā–į–ļ–∂–Ķ –Ī–į–Ľ–Ľ–ĺ–Ĺ–Ĺ–į—Ź –ī–ł—Ā—ā—Ä–ĺ—Ą–ł—Ź –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–ĺ–≤. –í–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–į—Ź —Ä–Ķ–į–ļ—Ü–ł—Ź, –ļ–į–ļ –Ņ—Ä–į–≤–ł–Ľ–ĺ, –ľ—Ź–≥–ļ–į—Ź, –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–į –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –≤–Ĺ—É—ā—Ä–ł–ī–ĺ–Ľ—Ć–ļ–ĺ–≤—č–ľ–ł –ł–Ĺ—Ą–ł–Ľ—Ć—ā—Ä–į—ā–į–ľ–ł (–Ī–ĺ–Ľ–Ķ–Ķ –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ—č–ľ–ł, —á–Ķ–ľ –ł–Ĺ—Ą–ł–Ľ—Ć—ā—Ä–į—Ü–ł—Ź –Ņ–ĺ—Ä—ā–į–Ľ—Ć–Ĺ—č—Ö —ā—Ä–į–ļ—ā–ĺ–≤), —Ā–ĺ—Ā—ā–ĺ—Ź—Č–ł–ľ–ł –ł–∑ –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–Ĺ–ĺ—Ź–ī–Ķ—Ä–Ĺ—č—Ö –Ľ–Ķ–Ļ–ļ–ĺ—Ü–ł—ā–ĺ–≤, –Ľ–ł–ľ—Ą–ĺ—Ü–ł—ā–ĺ–≤ –ł –ľ–ĺ–Ĺ–ĺ–Ĺ—É–ļ–Ľ–Ķ–į—Ä–Ĺ—č—Ö —Ą–į–≥–ĺ—Ü–ł—ā–ĺ–≤. –Ę–Ķ–Ľ—Ć—Ü–į –ú—ć–Ľ–Ľ–ĺ—Ä–ł –ĺ–Ī–Ĺ–į—Ä—É–∂–ł–≤–į—é—ā—Ā—Ź –Ĺ–Ķ –≤–ĺ –≤—Ā–Ķ—Ö —Ā–Ľ—É—á–į—Ź—Ö –ł –≤ –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–Ķ –ľ–Ķ–Ĺ—Ć—ą–Ķ–ľ, —á–Ķ–ľ –Ņ—Ä–ł –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ–ĺ–ľ –≥–Ķ–Ņ–į—ā–ł—ā–Ķ. –§–ł–Ī—Ä–ĺ–∑ (–Ņ–Ķ—Ä–ł—Ā–ł–Ĺ—É—Ā–ĺ–ł–ī–į–Ľ—Ć–Ĺ—č–Ļ –ł –Ņ–Ķ—Ä–ł—Ü–Ķ–Ľ–Ľ—é–Ľ—Ź—Ä–Ĺ—č–Ļ) –≤ —Ä–į–Ĺ–Ĺ–Ķ–Ļ —Ā—ā–į–ī–ł–ł –≤—č—Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –≤ 3 –∑–ĺ–Ĺ–Ķ –į—Ü–ł–Ĺ—É—Ā–į –ł –ľ–ĺ–∂–Ķ—ā –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į—ā—Ć —Ā –ĺ–Ī—Ä–į–∑–ĺ–≤–į–Ĺ–ł–Ķ–ľ —Ā–Ķ–Ņ—ā –ł —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ–ľ —Ü–ł—Ä—Ä–ĺ–∑–į. –ú–Ķ–Ĺ–Ķ–Ķ –∑–Ĺ–į—á–ł–ľ—č–Ķ –ī–Ľ—Ź –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ě–ź–°–ď –≤–ļ–Ľ—é—á–į—é—ā: –∂–ł—Ä–ĺ–≤—č–Ķ –ļ–ł—Ā—ā—č, «–ĺ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł –Ņ—É—Ā—ā—č–Ķ» —Ź–ī—Ä–į –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–ĺ–≤, –Ľ–ł–Ņ–ĺ–≥—Ä–į–Ĺ—É–Ľ–Ķ–ľ—č, –ľ–Ķ–≥–į–ľ–ł—ā–ĺ—Ö–ĺ–Ĺ–ī—Ä–ł–ł –≤ –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–į—Ö, –Ĺ–Ķ–Ī–ĺ–Ľ—Ć—ą–ĺ–Ķ –ĺ—ā–Ľ–ĺ–∂–Ķ–Ĺ–ł–Ķ –∂–Ķ–Ľ–Ķ–∑–į –≤ 1––Ļ –∑–ĺ–Ĺ–Ķ –į—Ü–ł–Ĺ—É—Ā–į. –Ě–Ķ —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–ĺ –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ–Ļ —Ā–≤—Ź–∑–ł –ľ–Ķ–∂–ī—É —Ā–ĺ–ī–Ķ—Ä–∂–į–Ĺ–ł–Ķ–ľ –∂–Ķ–Ľ–Ķ–∑–į –≤ –Ņ–Ķ—á–Ķ–Ĺ–ł –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ě–ź–°–ď –ł —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć—é –≥–ł—Ā—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –ł —Ą–ł–Ī—Ä–ĺ–∑–į. –ü—Ä–ł –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ł–ł –ľ–Ķ–Ľ–ļ–ĺ–ļ–į–Ņ–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –∂–ł—Ä–ĺ–≤–ĺ–Ļ –ī–ł—Ā—ā—Ä–ĺ—Ą–ł–ł –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–ĺ–≤, –Ņ—Ä–Ķ–ĺ–Ī–Ľ–į–ī–į–Ĺ–ł–ł –Ņ–ĺ—Ä—ā–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź –ł/–ł–Ľ–ł —Ą–ł–Ī—Ä–ĺ–∑–į –Ĺ–į–ī –Ľ–ĺ–Ī—É–Ľ—Ź—Ä–Ĺ—č–ľ, –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–ł –Ņ–Ķ—Ä–ł—Ā–ł–Ĺ—É—Ā–ĺ–ł–ī–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ —Ą–ł–Ī—Ä–ĺ–∑–į –≤ 3 –∑–ĺ–Ĺ–Ķ –į—Ü–ł–Ĺ—É—Ā–į, —Ö–ĺ–Ľ–į–Ĺ–≥–ł—ā–į –ł–Ľ–ł –Ņ—Ä–ĺ–Ľ–ł—Ą–Ķ—Ä–į—Ü–ł–ł –∂–Ķ–Ľ—á–Ĺ—č—Ö –Ņ—Ä–ĺ—ā–ĺ–ļ–ĺ–≤, –Ņ—Ä–ł–∑–Ĺ–į–ļ–ĺ–≤ –≤–Ķ–Ĺ–ĺ––ĺ–ļ–ļ–Ľ—é–∑–ł–ĺ–Ĺ–Ĺ–ĺ–Ļ –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł –ī–ł–į–≥–Ĺ–ĺ–∑ –Ě–ź–°–ď —Ā–ĺ–ľ–Ĺ–ł—ā–Ķ–Ľ–Ķ–Ĺ.
–í–į–∂–Ĺ–ĺ, —á—ā–ĺ 4 —Ā—ā–į–ī–ł—Ź —Ą–ł–Ī—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł – —Ü–ł—Ä—Ä–ĺ–∑ —Ā–ĺ–Ņ—Ä–ĺ–≤–ĺ–∂–ī–į–Ķ—ā—Ā—Ź –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ—č–ľ —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł–Ķ–ľ —Ā–ĺ–ī–Ķ—Ä–∂–į–Ĺ–ł—Ź –∂–ł—Ä–į –≤ –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–į—Ö –Ņ—Ä–ł —Ā–ĺ—Ö—Ä–į–Ĺ–Ķ–Ĺ–ł–ł –Ī–į–Ľ–Ľ–ĺ–Ĺ–Ĺ–ĺ–Ļ –ī–ł—Ā—ā—Ä–ĺ—Ą–ł–ł. –ö—Ä–ĺ–ľ–Ķ —ā–ĺ–≥–ĺ, –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ķ —Ā–ĺ–ĺ—ā–Ĺ–ĺ—ą–Ķ–Ĺ–ł—Ź «–Ľ–ĺ–Ī—É–Ľ—Ź—Ä–Ĺ–ĺ–Ķ/–Ņ–ĺ—Ä—ā–į–Ľ—Ć–Ĺ–ĺ–Ķ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł–Ķ», —á—ā–ĺ –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –∑–į—ā—Ä—É–ī–Ĺ—Ź–Ķ—ā –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ—É –Ě–ź–°–ď —Ā –ł—Ā—Ö–ĺ–ī–ĺ–ľ –≤ —Ü–ł—Ä—Ä–ĺ–∑ –Ņ–Ķ—á–Ķ–Ĺ–ł. –í –ļ–ĺ–Ĺ–Ķ—á–Ĺ–ĺ–Ļ —Ā—ā–į–ī–ł–ł –ľ–į—Ä–ļ–Ķ—Ä—č, –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź—é—Č–ł–Ķ –≤–Ķ—Ä–ł—Ą–ł—Ü–ł—Ä–ĺ–≤–į—ā—Ć –Ě–ź–°–ď —Ā –ł—Ā—Ö–ĺ–ī–ĺ–ľ –≤ —Ü–ł—Ä—Ä–ĺ–∑ –Ņ–Ķ—á–Ķ–Ĺ–ł, –ī–ĺ–≤–ĺ–Ľ—Ć–Ĺ–ĺ —Ā–ĺ–ľ–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ—č –ł —ā—Ä—É–ī–Ĺ–ĺ –ī–ĺ–ļ–į–∑—É–Ķ–ľ—č.
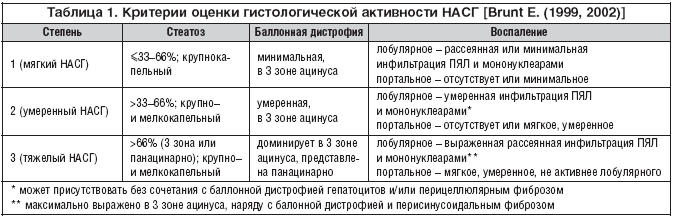
–Ē–Ľ—Ź –ĺ—Ü–Ķ–Ĺ–ļ–ł —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ě–ź–°–ď –ł —Ā—ā–į–ī–ł–ł —Ą–ł–Ī—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź–Ķ—ā—Ā—Ź –ļ–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł—Ź Brunt –ē., –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ–į—Ź –≤ —ā–į–Ī–Ľ–ł—Ü–į—Ö 1 –ł 2.
–ē—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ě–ź–Ė–Ď–ü
–í —Ü–Ķ–Ľ–ĺ–ľ, –Ě–ź–Ė–Ď–ü —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł–∑—É–Ķ—ā—Ā—Ź –ĺ—ā–Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –ī–ĺ–Ī—Ä–ĺ–ļ–į—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–ľ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ–ľ. –Ē–Ľ—Ź –∂–ł—Ä–ĺ–≤–ĺ–Ļ –ī–ł—Ā—ā—Ä–ĺ—Ą–ł–ł (—Ā–į–ľ–ĺ–Ļ –Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ–ĺ–Ļ —Ą–ĺ—Ä–ľ—č –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł) —Ā–≤–ĺ–Ļ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ, –ļ–į–ļ –Ņ—Ä–į–≤–ł–Ľ–ĺ, —Ā—ā–į–Ī–ł–Ľ—Ć–Ĺ–ĺ–Ķ, –Ĺ–Ķ–Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É—é—Č–Ķ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ.
–Ě–ź–°–ď —É 20–37% –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É–Ķ—ā —Ā —Ä–į–∑–≤–ł—ā–ł–Ķ–ľ –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ —Ą–ł–Ī—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł; —É 20% –ł–∑ —ć—ā–ł—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 20 –Ľ–Ķ—ā —Ą–ĺ—Ä–ľ–ł—Ä—É–Ķ—ā—Ā—Ź —Ü–ł—Ä—Ä–ĺ–∑ —Ā —Ä–į–∑–≤–ł—ā–ł–Ķ–ľ –Ņ–Ķ—á–Ķ–Ĺ–ĺ—á–Ĺ–ĺ––ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł. –í —Ä—Ź–ī–Ķ —Ā–Ľ—É—á–į–Ķ–≤ –Ĺ–į–Ī–Ľ—é–ī–į–Ķ—ā—Ā—Ź —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ —Ü–ł—Ä—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł –≤ –Ī–ĺ–Ľ–Ķ–Ķ —Ä–į–Ĺ–Ĺ–ł–Ķ —Ā—Ä–ĺ–ļ–ł (–≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 10 –Ľ–Ķ—ā). –ü—Ä–ł –Ņ–Ķ—Ä–≤–ł—á–Ĺ–ĺ–ľ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł —É–∂–Ķ —É 30–40% –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ě–ź–°–ď –≤—č—Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —Ą–ł–Ī—Ä–ĺ–∑ –Ņ–Ķ—á–Ķ–Ĺ–ł, —É 10–15% –ĺ–Ī–Ĺ–į—Ä—É–∂–ł–≤–į–Ķ—ā—Ā—Ź —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –Ľ–ĺ–∂–Ĺ—č—Ö –ī–ĺ–Ľ–Ķ–ļ. –Ě–į —ć—ā–į–Ņ–Ķ —Ü–ł—Ä—Ä–ĺ—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ —ā—Ä–į–Ĺ—Ā—Ą–ĺ—Ä–ľ–į—Ü–ł–ł –ĺ–Ņ–ł—Ā–į–Ĺ—č —Ā–Ľ—É—á–į–ł —Ä–į–∑–≤–ł—ā–ł—Ź –≥–Ķ–Ņ–į—ā–ĺ—Ü–Ķ–Ľ–Ľ—é–Ľ—Ź—Ä–Ĺ–ĺ–Ļ –ļ–į—Ä—Ü–ł–Ĺ–ĺ–ľ—č. –ü–ĺ–Ņ—É–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ—č–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź—é—ā –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–ĺ–∂–ł—ā—Ć, —á—ā–ĺ 60–80% –ļ—Ä–ł–Ņ—ā–ĺ–≥–Ķ–Ĺ–Ĺ—č—Ö —Ü–ł—Ä—Ä–ĺ–∑–ĺ–≤ –Ņ–Ķ—á–Ķ–Ĺ–ł – —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā –Ě–ź–°–ď. –£ –Ņ–ĺ–Ľ–ĺ–≤–ł–Ĺ—č –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ě–ź–°–ď –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –ī–ĺ —Ā—ā–į–ī–ł–ł —Ü–ł—Ä—Ä–ĺ–∑–į –Ĺ–Ķ –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–ī–ł—ā. –ü—Ä–ł —Ä–Ķ—ā—Ä–ĺ—Ā–Ņ–Ķ–ļ—ā–ł–≤–Ĺ–ĺ–ľ –į–Ĺ–į–Ľ–ł–∑–Ķ —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–ĺ, —á—ā–ĺ —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź —Ü–ł—Ä—Ä–ĺ–∑–į –≤—č—ą–Ķ –Ņ—Ä–ł –Ĺ–į–Ľ–ł—á–ł–ł –Ī–į–Ľ–Ľ–ĺ–Ĺ–Ĺ–ĺ–Ļ –ī–ł—Ā—ā—Ä–ĺ—Ą–ł–ł –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–ĺ–≤. –§–į–ļ—ā–ĺ—Ä–į–ľ–ł —Ä–ł—Ā–ļ–į –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É—é—Č–Ķ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –Ě–ź–°–ď —ā–į–ļ–∂–Ķ —Ā–Ľ—É–∂–į—ā: –≤–ĺ–∑—Ä–į—Ā—ā —Ā—ā–į—Ä—ą–Ķ 45 –Ľ–Ķ—ā, –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ķ –ĺ–∂–ł—Ä–Ķ–Ĺ–ł–Ķ, —Ā–į—Ö–į—Ä–Ĺ—č–Ļ –ī–ł–į–Ī–Ķ—ā 2 —ā–ł–Ņ–į, –∂–Ķ–Ĺ—Ā–ļ–ł–Ļ –Ņ–ĺ–Ľ.
–Ě–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –ĺ—ā–ľ–Ķ—ā–ł—ā—Ć –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā—Ć –ĺ–Ī—Ä–į—ā–Ĺ–ĺ–≥–ĺ —Ä–į–∑–≤–ł—ā–ł—Ź –∂–ł—Ä–ĺ–≤–ĺ–Ļ –ī–ł—Ā—ā—Ä–ĺ—Ą–ł–ł, –Ě–ź–°–ď –ł –ī–į–∂–Ķ –Ě–ź–°–ď —Ā —ā—Ä–į–Ĺ—Ā—Ą–ĺ—Ä–ľ–į—Ü–ł–Ķ–Ļ –≤ —Ü–ł—Ä—Ä–ĺ–∑ –Ĺ–į —Ą–ĺ–Ĺ–Ķ –Ņ–Ľ–į–≤–Ĺ–ĺ–≥–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į (1,6–2,0 –ļ–≥/–ľ–Ķ—Ā.) –ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł. –Ď—č—Ā—ā—Ä–į—Ź –Ņ–ĺ—ā–Ķ—Ä—Ź –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į, –Ĺ–į–Ņ—Ä–ĺ—ā–ł–≤, —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É–Ķ—ā —É—Ö—É–ī—ą–Ķ–Ĺ–ł—é —ā–Ķ—á–Ķ–Ĺ–ł—Ź –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł. –Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, —Ą–ł–Ī—Ä–ĺ–∑ –Ņ–Ķ—á–Ķ–Ĺ–ł –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ķ—ā –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑ –∂–ł–∑–Ĺ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –Ě–ź–°–ď.
–Ď–ł–ĺ–Ņ—Ā–ł—Ź –Ņ–Ķ—á–Ķ–Ĺ–ł –ł–Ľ–ł –Ĺ–Ķ–ł–Ĺ–≤–į–∑–ł–≤–Ĺ–į—Ź –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–į –Ě–ź–°–ď?
–°–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č–Ļ —ć—ā–į–Ņ —Ä–į–∑–≤–ł—ā–ł—Ź –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ľ–Ķ–ī–ł—Ü–ł–Ĺ—č –ł –≥–Ķ–Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł, –≤ —á–į—Ā—ā–Ĺ–ĺ—Ā—ā–ł, —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł–∑—É–Ķ—ā—Ā—Ź –Ņ–ĺ—Ā—ā–Ķ–Ņ–Ķ–Ĺ–Ĺ—č–ľ –ĺ—ā—Ö–ĺ–ī–ĺ–ľ –ĺ—ā —ā—Ä–į–ī–ł—Ü–ł–ĺ–Ĺ–Ĺ–ĺ –Ņ—Ä–ł–Ĺ—Ź—ā–ĺ–≥–ĺ –ł —Ā–Ľ—É–∂–ł–≤—ą–Ķ–≥–ĺ –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –≤–Ķ–ļ–ĺ–≤ –ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č–ľ –Ņ—É—ā–Ķ–ľ –Ĺ–į–ļ–ĺ–Ņ–Ľ–Ķ–Ĺ–ł—Ź –≤—Ä–į—á–Ķ–Ī–Ĺ—č—Ö –∑–Ĺ–į–Ĺ–ł–Ļ –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ľ–Ķ—ā–ĺ–ī–į –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź —ā–ļ–į–Ĺ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł. –Ē–į–Ĺ–Ĺ–į—Ź –ľ–Ķ—ā–ĺ–ī–ł–ļ–į —ą–ł—Ä–ĺ–ļ–ĺ –ī–ĺ—Ā—ā—É–Ņ–Ĺ–į –ł –Ī–Ķ–∑–ĺ–Ņ–į—Ā–Ĺ–į, –Ņ—Ä–ĺ–≤–ĺ–ī–ł—ā—Ā—Ź –≤ –ī–ł–Ĺ–į–ľ–ł–ļ–Ķ —Ā —Ü–Ķ–Ľ—Ć—é –ĺ—Ü–Ķ–Ĺ–ļ–ł –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –Ņ–ĺ—Ä–į–∂–Ķ–Ĺ–ł—Ź –ł —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź, –į –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–į—Ź –ĺ—Ü–Ķ–Ĺ–ļ–į, –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–Ĺ–į—Ź –Ĺ–į –Ķ–Ķ –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–ł, –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –ĺ—Ü–Ķ–Ĺ–ł—ā—Ć –Ľ–ĺ–ļ–į–Ľ–ł–∑–į—Ü–ł—é –ł —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć —Ą–ł–Ī—Ä–ĺ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į.
–Ď–ĺ–Ľ–Ķ–Ķ —ą–ł—Ä–ĺ–ļ–ĺ–Ķ –≤–Ĺ–Ķ–ī—Ä–Ķ–Ĺ–ł–Ķ –Ī–ł–ĺ–Ņ—Ā–ł–ł –Ņ–Ķ—á–Ķ–Ĺ–ł –≤ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ—É—é –Ņ—Ä–į–ļ—ā–ł–ļ—É —Ā–Ņ–Ķ—Ü–ł–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č—Ö –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ļ –ĺ–≥—Ä–į–Ĺ–ł—á–ł–≤–į–Ķ—ā—Ā—Ź –Ĺ–į–Ľ–ł—á–ł–Ķ–ľ –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ł—Ö –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ: –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ–ľ –Ĺ–ĺ—Ä–ľ–į—ā–ł–≤–Ĺ—č—Ö –ī–ĺ–ļ—É–ľ–Ķ–Ĺ—ā–ĺ–≤, —Ä–Ķ–≥–Ľ–į–ľ–Ķ–Ĺ—ā–ł—Ä—É—é—Č–ł—Ö –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ –ľ–į–Ĺ–ł–Ņ—É–Ľ—Ź—Ü–ł–ł; –Ĺ–Ķ—Ö–≤–į—ā–ļ–ĺ–Ļ –ļ–≤–į–Ľ–ł—Ą–ł—Ü–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č—Ö –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ĺ–≤, —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ—č—Ö –ĺ–Ī—ä–Ķ–ļ—ā–ł–≤–Ĺ–ĺ –ĺ–Ņ–ł—Ā–į—ā—Ć –ł –ī–į—ā—Ć –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—É—é –ĺ—Ü–Ķ–Ĺ–ļ—É –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–ľ –Ņ—Ä–ł–∑–Ĺ–į–ļ–į–ľ; –ł–Ĺ–≤–į–∑–ł–≤–Ĺ—č–ľ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ĺ–ľ –Ņ—Ä–ĺ—Ü–Ķ–ī—É—Ä—č –ł –Ņ–ĺ—ā–Ķ–Ĺ—Ü–ł–į–Ľ—Ć–Ĺ—č–ľ —Ä–ł—Ā–ļ–ĺ–ľ —Ä–į–∑–≤–ł—ā–ł—Ź –ĺ—Ā–Ľ–ĺ–∂–Ĺ–Ķ–Ĺ–ł–Ļ, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –Ĺ–į–Ņ—Ä—Ź–ľ—É—é —Ā–≤—Ź–∑–į–Ĺ—č —Ā –ļ–≤–į–Ľ–ł—Ą–ł–ļ–į—Ü–ł–Ķ–Ļ –ł –ĺ–Ņ—č—ā–ĺ–ľ –≤—Ä–į—á–į, –≤—č–Ņ–ĺ–Ľ–Ĺ—Ź—é—Č–Ķ–≥–ĺ –Ī–ł–ĺ–Ņ—Ā–ł—é –Ņ–Ķ—á–Ķ–Ĺ–ł.
–ü—Ä–į–≤–ł–Ľ—Ć–Ĺ–į—Ź –ĺ—Ü–Ķ–Ĺ–ļ–į –≥–ł—Ā—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ–į—Ä—ā–ł–Ĺ—č –Ņ—Ä–ł –Ě–ź–Ė–Ď–ü –ł–ľ–Ķ–Ķ—ā –Ņ—Ä–ł–Ĺ—Ü–ł–Ņ–ł–į–Ľ—Ć–Ĺ–ĺ–Ķ –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –Ĺ–Ķ —ā–ĺ–Ľ—Ć–ļ–ĺ –≤ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź, –Ĺ–ĺ –ł –≤ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł–ł —Ą–ĺ—Ä–ľ—č —ā–Ķ—á–Ķ–Ĺ–ł—Ź, –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–Ķ –ł —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–ĺ–≤–ĺ–ī–ł–ľ–ĺ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź. –ü–ĺ–≤–ĺ–ī–ĺ–ľ –ī–Ľ—Ź –ĺ—ā–ļ–į–∑–į –ĺ—ā –Ī–ł–ĺ–Ņ—Ā–ł–ł –Ņ–Ķ—á–Ķ–Ĺ–ł —Ā–Ľ—É–∂–ł—ā —Ā—ā—Ä–į—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ–Ķ—Ä–Ķ–ī –Ņ—Ä–ĺ—Ü–Ķ–ī—É—Ä–ĺ–Ļ. –í–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā—Ć –Ī–ĺ–Ľ–Ķ–≤—č—Ö –ĺ—Č—É—Č–Ķ–Ĺ–ł–Ļ –≤ –ľ–Ķ—Ā—ā–Ķ –Ņ—Ä–ĺ–ļ–ĺ–Ľ–į –ł –Ņ–ĺ–Ī–ĺ—á–Ĺ—č–Ķ —ć—Ą—Ą–Ķ–ļ—ā—č –Ĺ–į –į–Ĺ–Ķ—Ā—ā–Ķ–∑–ł—é –∑–į—Ā—ā–į–≤–Ľ—Ź—é—ā –ī–ĺ 1/3 –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ī–ł—Ą—Ą—É–∑–Ĺ—č–ľ–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź–ľ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł –ĺ—ā–ļ–į–∑–į—ā—Ć—Ā—Ź –ĺ—ā –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ł—Ź –Ī–ł–ĺ–Ņ—Ā–ł–ł –Ņ–Ķ—á–Ķ–Ĺ–ł, —á—ā–ĺ –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ –Ņ—Ä–ĺ–ī–Ľ–Ķ–Ĺ–ł—é —Ā—Ä–ĺ–ļ–ĺ–≤ –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł–ł –ł –∑–į–ī–Ķ—Ä–∂–ļ–Ķ —Ā –Ņ—Ä–ł–Ĺ—Ź—ā–ł–Ķ–ľ —Ä–Ķ—ą–Ķ–Ĺ–ł—Ź –ĺ –Ĺ–į—á–į–Ľ–Ķ —ā–Ķ—Ä–į–Ņ–ł–ł. –Ě–Ķ–ľ–į–Ľ–ĺ–≤–į–∂–Ĺ–į –ł –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ–į –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ł–Ĺ—ā–Ķ—Ä–Ņ—Ä–Ķ—ā–į—Ü–ł–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –≤ —ā–ļ–į–Ĺ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł. –í—č—ą–Ķ–Ņ–Ķ—Ä–Ķ—á–ł—Ā–Ľ–Ķ–Ĺ–Ĺ—č–Ķ –ĺ–Ī—Ā—ā–ĺ—Ź—ā–Ķ–Ľ—Ć—Ā—ā–≤–į –Ņ–ĺ—Ā–Ľ—É–∂–ł–Ľ–ł –≤–Ķ—Ā–ĺ–ľ—č–ľ –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–Ķ–ľ –ī–Ľ—Ź –≤–Ĺ–Ķ–ī—Ä–Ķ–Ĺ–ł—Ź –≤ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ—É—é –Ņ—Ä–į–ļ—ā–ł–ļ—É –Ĺ–Ķ–ł–Ĺ–≤–į–∑–ł–≤–Ĺ—č—Ö –ľ–Ķ—ā–ĺ–ī–ĺ–≤ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł –ī–ł—Ą—Ą—É–∑–Ĺ—č—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –Ņ–Ķ—á–Ķ–Ĺ–ł.
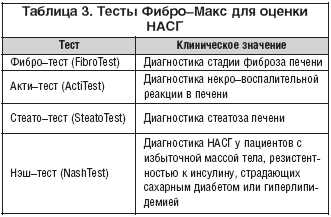
–° —Ü–Ķ–Ľ—Ć—é –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł –Ě–ź–°–ď –Ņ—Ä–Ķ–ī–Ľ–ĺ–∂–Ķ–Ĺ —Ä—Ź–ī –ľ–Ķ—ā–ĺ–ī–ĺ–≤ –Ĺ–Ķ–ł–Ĺ–≤–į–∑–ł–≤–Ĺ–ĺ–Ļ –ĺ—Ü–Ķ–Ĺ–ļ–ł –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ĺ–Ķ–ļ—Ä–ĺ––≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł, —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł —Ā—ā–Ķ–į—ā–ĺ–∑–į –ł —Ą–ł–Ī—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł:
• —ć–Ľ–į—Ā—ā–ĺ–ľ–Ķ—ā—Ä–ł—Ź –Ņ–Ķ—á–Ķ–Ĺ–ł —Ā –Ņ–ĺ–ľ–ĺ—Č—Ć—é –į–Ņ–Ņ–į—Ä–į—ā–į «–§–ł–Ī—Ä–ĺ—Ā–ļ–į–Ĺ», –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–į –Ĺ–į –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–ł —ć–Ľ–į—Ā—ā–ł—á–Ķ—Ā–ļ–ł—Ö —Ā–≤–ĺ–Ļ—Ā—ā–≤ –Ņ–Ķ—á–Ķ–Ĺ–ł –ł –Ĺ–į –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł–ł —Ā—ā–į–ī–ł–ł —Ą–ł–Ī—Ä–ĺ–∑–į;
• —ā–Ķ—Ā—ā «–§–ł–Ī—Ä–ĺ––ú–į–ļ—Ā» (–≤ —á–į—Ā—ā–Ĺ–ĺ—Ā—ā–ł, –į–ļ—ā–ł–—ā–Ķ—Ā—ā, —Ą–ł–Ī—Ä–ĺ–—ā–Ķ—Ā—ā, —Ā—ā–Ķ–į—ā–ĺ–—ā–Ķ—Ā—ā –ł –Ĺ—ć—ą–—ā–Ķ—Ā—ā) (—ā–į–Ī–Ľ. 3).
–§–ł–Ī—Ä–ĺ–—ā–Ķ—Ā—ā –Ņ—Ä–Ķ–ī–Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ –ī–Ľ—Ź –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł —Ā—ā–į–ī–ł–ł —Ą–ł–Ī—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł, –≤–ļ–Ľ—é—á–į–Ķ—ā 5 –Ī–ł–ĺ—Ö–ł–ľ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ: a2––ľ–į–ļ—Ä–ĺ–≥–Ľ–ĺ–Ī—É–Ľ–ł–Ĺ (–ź–ú–ď), –≥–į–Ņ—ā–ĺ–≥–Ľ–ĺ–Ī–Ľ–ł–Ĺ (–Ě—Ä), –į–Ņ–ĺ–Ľ–ł–Ņ–ĺ–Ņ—Ä–ĺ—ā–Ķ–ł–Ĺ –ź1 (–ź–Ņ–ĺ –ź1), g––≥–Ľ—É—ā–į–ľ–ł–Ľ—ā—Ä–į–Ĺ—Ā–Ņ–Ķ–Ņ—ā–ł–ī–į–∑—É (–ď–ď–Ę), –ĺ–Ī—Č–ł–Ļ –Ī–ł–Ľ–ł—Ä—É–Ī–ł–Ĺ, –ļ–ĺ—ā–ĺ—Ä—č–Ķ —Ā–≤—Ź–∑–į–Ĺ—č –≤ –ī–ł—Ā–ļ—Ä–ł–ľ–ł–Ĺ–į–Ĺ—ā–Ĺ—É—é —Ą—É–Ĺ–ļ—Ü–ł—é.
–ź–ļ—ā–ł–—ā–Ķ—Ā—ā –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ķ—ā —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć –Ĺ–Ķ–ļ—Ä–ĺ––≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ —Ä–Ķ–į–ļ—Ü–ł–ł –≤ —ā–ļ–į–Ĺ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł, –≤–ļ–Ľ—é—á–į–Ķ—ā –Ņ–Ķ—Ä–Ķ—á–ł—Ā–Ľ–Ķ–Ĺ–Ĺ—č–Ķ –≤—č—ą–Ķ 5 –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā–ĺ–≤ –ł –ī–ĺ–Ņ–ĺ–Ľ–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –į–Ľ–į–Ĺ–ł–Ĺ–ĺ–≤—É—é –į–ľ–ł–Ĺ–ĺ—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑—É, —Ā–≤—Ź–∑–į–Ĺ–Ĺ—č–Ķ –≤ –ī–ł—Ā–ļ—Ä–ł–ľ–ł–Ĺ–į–Ĺ—ā–Ĺ—É—é —Ą—É–Ĺ–ļ—Ü–ł—é.
–°—ā–Ķ–į—ā–ĺ–—ā–Ķ—Ā—ā –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ķ—ā —Ā—ā–Ķ–į—ā–ĺ–∑ –Ņ–Ķ—á–Ķ–Ĺ–ł, –≤–ļ–Ľ—é—á–į–Ķ—ā a2––ľ–į–ļ—Ä–ĺ–≥–Ľ–ĺ–Ī—É–Ľ–ł–Ĺ (–ź–ú–ď), –≥–į–Ņ—ā–ĺ–≥–Ľ–ĺ–Ī–Ľ–ł–Ĺ (–Ě—Ä), –į–Ņ–ĺ–Ľ–ł–Ņ–ĺ–Ņ—Ä–ĺ—ā–Ķ–ł–Ĺ –ź1 (–ź–Ņ–ĺ –ź1), g––≥–Ľ—É—ā–į–ľ–ł–Ľ—ā—Ä–į–Ĺ—Ā–Ņ–Ķ–Ņ—ā–ł–ī–į–∑—É (–ď–ď–Ę), –ĺ–Ī—Č–ł–Ļ –Ī–ł–Ľ–ł—Ä—É–Ī–ł–Ĺ, –į–Ľ–į–Ĺ–ł–Ĺ–ĺ–≤—É—é –į–ľ–ł–Ĺ–ĺ—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑—É (–ź–õ–Ę), –≥–Ľ—é–ļ–ĺ–∑—É, —ā—Ä–ł–≥–Ľ–ł—Ü–Ķ—Ä–ł–ī—č, —Ö–ĺ–Ľ–Ķ—Ā—ā–Ķ—Ä–ł–Ĺ, –≤–ĺ–∑—Ä–į—Ā—ā, —Ä–ĺ—Ā—ā, –ľ–į—Ā—Ā—É —ā–Ķ–Ľ–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į, —Ā–≤—Ź–∑–į–Ĺ–Ĺ—č–Ķ –≤ –ī–ł—Ā–ļ—Ä–ł–ľ–ł–Ĺ–į–Ĺ—ā–Ĺ—É—é —Ą—É–Ĺ–ļ—Ü–ł—é.
–Ě—ć—ą–—ā–Ķ—Ā—ā —Ä–į–∑—Ä–į–Ī–ĺ—ā–į–Ĺ —Ā —Ü–Ķ–Ľ—Ć—é –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł –Ě–ź–°–ď —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –ł–∑–Ī—č—ā–ĺ—á–Ĺ–ĺ–Ļ –ľ–į—Ā—Ā–ĺ–Ļ —ā–Ķ–Ľ–į, —Ä–Ķ–∑–ł—Ā—ā–Ķ–Ĺ—ā–Ĺ–ĺ—Ā—ā—Ć—é –ļ –ł–Ĺ—Ā—É–Ľ–ł–Ĺ—É, —Ā—ā—Ä–į–ī–į—é—Č–ł—Ö —Ā–į—Ö–į—Ä–Ĺ—č–ľ –ī–ł–į–Ī–Ķ—ā–ĺ–ľ –ł–Ľ–ł –≥–ł–Ņ–Ķ—Ä–Ľ–ł–Ņ–ł–ī–Ķ–ľ–ł–Ķ–Ļ. –ö–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā—č —ā–Ķ—Ā—ā–į: a2––ľ–į–ļ—Ä–ĺ–≥–Ľ–ĺ–Ī—É–Ľ–ł–Ĺ (–ź–ú–ď), –≥–į–Ņ—ā–ĺ–≥–Ľ–ĺ–Ī–Ľ–ł–Ĺ (–Ě—Ä), –į–Ņ–ĺ–Ľ–ł–Ņ–ĺ–Ņ—Ä–ĺ—ā–Ķ–ł–Ĺ –ź1 (–ź–Ņ–ĺ –ź1), g––≥–Ľ—É—ā–į–ľ–ł–Ľ—ā—Ä–į–Ĺ—Ā–Ņ–Ķ–Ņ—ā–ł–ī–į–∑–į (–ď–ď–Ę), –ĺ–Ī—Č–ł–Ļ –Ī–ł–Ľ–ł—Ä—É–Ī–ł–Ĺ, –į–Ľ–į–Ĺ–ł–Ĺ–ĺ–≤–į—Ź –į–ľ–ł–Ĺ–ĺ—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑–į (–ź–õ–Ę), –į—Ā–Ņ–į—Ä–į–≥–ł–Ĺ–ĺ–≤–į—Ź –į–ľ–ł–Ĺ–ĺ—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑–į (–ź–°–Ę), –≥–Ľ—é–ļ–ĺ–∑–į, —ā—Ä–ł–≥–Ľ–ł—Ü–Ķ—Ä–ł–ī—č, —Ö–ĺ–Ľ–Ķ—Ā—ā–Ķ—Ä–ł–Ĺ, –≤–ĺ–∑—Ä–į—Ā—ā, —Ä–ĺ—Ā—ā, –ľ–į—Ā—Ā–į —ā–Ķ–Ľ–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į, —Ā–≤—Ź–∑–į–Ĺ–Ĺ—č–Ķ –≤ –ī–ł—Ā–ļ—Ä–ł–ľ–ł–Ĺ–į–Ĺ—ā–Ĺ—É—é —Ą—É–Ĺ–ļ—Ü–ł—é [7].
–ö–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ķ –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł–Ķ
–ü–į—Ü–ł–Ķ–Ĺ—ā–ļ–į –ö., 56 –Ľ–Ķ—ā, –Ņ–ĺ—Ā—ā—É–Ņ–ł–Ľ–į –≤ –ļ–Ľ–ł–Ĺ–ł–ļ—É –Ņ—Ä–ĺ–Ņ–Ķ–ī–Ķ–≤—ā–ł–ļ–ł –≤–Ĺ—É—ā—Ä–Ķ–Ĺ–Ĺ–ł—Ö –Ī–ĺ–Ľ–Ķ–∑–Ĺ–Ķ–Ļ –ł–ľ. –í.–•. –í–į—Ā–ł–Ľ–Ķ–Ĺ–ļ–ĺ –≤ —Ą–Ķ–≤—Ä–į–Ľ–Ķ 2008 –≥. –Ě–į –Ņ—Ä–ĺ—ā—Ź–∂–Ķ–Ĺ–ł–ł –Ņ–ĺ—Ā–Ľ–Ķ–ī–Ĺ–ł—Ö 2 –Ľ–Ķ—ā –ĺ—ā–ľ–Ķ—á–į–Ķ—ā –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į –Ĺ–į 9 –ļ–≥. –ü–ĺ–≤–ĺ–ī–ĺ–ľ –ī–Ľ—Ź –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł–ł –Ņ–ĺ—Ā–Ľ—É–∂–ł–Ľ–ł –Ī–ĺ–Ľ—Ć –≤ –ĺ–Ī–Ľ–į—Ā—ā–ł –Ņ—Ä–į–≤–ĺ–≥–ĺ –Ņ–ĺ–ī—Ä–Ķ–Ī–Ķ—Ä—Ć—Ź –Ī–Ķ–∑ —á–Ķ—ā–ļ–ĺ–Ļ —Ā–≤—Ź–∑–ł —Ā –Ķ–ī–ĺ–Ļ, —Ā—É—Ö–ĺ—Ā—ā—Ć –≤–ĺ —Ä—ā—É, –∂–į–∂–ī–į, –į —ā–į–ļ–∂–Ķ –≤—č—Ź–≤–Ľ–Ķ–Ĺ–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –≤ –Ī–ł–ĺ—Ö–ł–ľ–ł—á–Ķ—Ā–ļ–ĺ–ľ –į–Ĺ–į–Ľ–ł–∑–Ķ –ļ—Ä–ĺ–≤–ł –≤ –≤–ł–ī–Ķ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł—Ź —É—Ä–ĺ–≤–Ĺ—Ź —Ā—č–≤–ĺ—Ä–ĺ—ā–ĺ—á–Ĺ—č—Ö –į–ľ–ł–Ĺ–ĺ—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑ –≤ 2–3 —Ä–į–∑–į –ĺ—ā –≤–Ķ—Ä—Ö–Ĺ–Ķ–Ļ –≥—Ä–į–Ĺ–ł—Ü—č –Ĺ–ĺ—Ä–ľ—č –ł –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ —É—Ä–ĺ–≤–Ĺ—Ź –≥–Ľ—é–ļ–ĺ–∑—č.
–ě–Ī—ä–Ķ–ļ—ā–ł–≤–Ĺ–ĺ: –°–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł–Ķ –ĺ—ā–Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —É–ī–ĺ–≤–Ľ–Ķ—ā–≤–ĺ—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ. –ö–ĺ–∂–į —á–ł—Ā—ā–į—Ź, —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ–ĺ–Ļ –≤–Ľ–į–∂–Ĺ–ĺ—Ā—ā–ł. –í–Ĺ–Ķ–Ņ–Ķ—á–Ķ–Ĺ–ĺ—á–Ĺ—č—Ö –∑–Ĺ–į–ļ–ĺ–≤ –Ĺ–Ķ—ā. –ü–Ķ—Ä–ł—Ą–Ķ—Ä–ł—á–Ķ—Ā–ļ–ł—Ö –ĺ—ā–Ķ–ļ–ĺ–≤ –Ĺ–Ķ—ā. –ė–ú–Ę=28 –ļ–≥/–ľ2, –ĺ–Ī—Ö–≤–į—ā —ā–į–Ľ–ł–ł – 112 —Ā–ľ. –Ě–į–ī –Ľ–Ķ–≥–ļ–ł–ľ–ł –ī—č—Ö–į–Ĺ–ł–Ķ –≤–Ķ–∑–ł–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ–Ķ, —Ö—Ä–ł–Ņ—č –Ĺ–Ķ –≤—č—Ā–Ľ—É—ą–ł–≤–į—é—ā—Ā—Ź. –Ę–ĺ–Ĺ—č —Ā–Ķ—Ä–ī—Ü–į —Ä–ł—ā–ľ–ł—á–Ĺ—č–Ķ, –į–ļ—Ü–Ķ–Ĺ—ā II —ā–ĺ–Ĺ–į –Ĺ–į–ī –į–ĺ—Ä—ā–ĺ–Ļ. –ź–Ē 160 –ł 90 –ľ–ľ —Ä—ā.—Ā—ā. –Ė–ł–≤–ĺ—ā –ľ—Ź–≥–ļ–ł–Ļ, —á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ –≤ –ĺ–Ī–Ľ–į—Ā—ā–ł –Ņ—Ä–į–≤–ĺ–≥–ĺ –Ņ–ĺ–ī—Ä–Ķ–Ī–Ķ—Ä—Ć—Ź –Ņ—Ä–ł –Ņ–į–Ľ—Ć–Ņ–į—Ü–ł–ł. –ü–Ķ—á–Ķ–Ĺ—Ć –Ĺ–į 2 —Ā–ľ –≤—č—Ā—ā—É–Ņ–į–Ķ—ā –ĺ—ā –ļ—Ä–į—Ź —Ä–Ķ–Ī–Ķ—Ä–Ĺ–ĺ–Ļ –ī—É–≥–ł –Ņ–ĺ –Ņ—Ä–į–≤–ĺ–Ļ —Ā—Ä–Ķ–ī–ł–Ĺ–Ĺ–ĺ––ļ–Ľ—é—á–ł—á–Ĺ–ĺ–Ļ –Ľ–ł–Ĺ–ł–ł, –ļ—Ä–į–Ļ –∑–į–ļ—Ä—É–≥–Ľ–Ķ–Ĺ, –Ņ–ĺ–≤–Ķ—Ä—Ö–Ĺ–ĺ—Ā—ā—Ć –≥–Ľ–į–ī–ļ–į—Ź, —ć–Ľ–į—Ā—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ–ĺ–Ĺ—Ā–ł—Ā—ā–Ķ–Ĺ—Ü–ł–ł. –°–Ķ–Ľ–Ķ–∑–Ķ–Ĺ–ļ–į –Ĺ–Ķ –Ņ–į–Ľ—Ć–Ņ–ł—Ä—É–Ķ—ā—Ā—Ź. –°–ł–ľ–Ņ—ā–ĺ–ľ «–Ņ–ĺ–ļ–ĺ–Ľ–į—á–ł–≤–į–Ĺ–ł—Ź» –Ņ–ĺ –Ņ–ĺ—Ź—Ā–Ĺ–ł—á–Ĺ–ĺ–Ļ –ĺ–Ī–Ľ–į—Ā—ā–ł –ĺ—ā—Ä–ł—Ü–į—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ —Ā –ĺ–Ī–Ķ–ł—Ö —Ā—ā–ĺ—Ä–ĺ–Ĺ.
–í –į–Ĺ–į–Ľ–ł–∑–į—Ö –ļ—Ä–ĺ–≤–ł: –į—ā–Ķ—Ä–ĺ–≥–Ķ–Ĺ–Ĺ–į—Ź –ī–ł—Ā–Ľ–ł–Ņ–ł–ī–Ķ–ľ–ł—Ź: –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ —É—Ä–ĺ–≤–Ĺ—Ź –ĺ–Ī—Č–Ķ–≥–ĺ —Ö–ĺ–Ľ–Ķ—Ā—ā–Ķ—Ä–ł–Ĺ–į –ī–ĺ 267 –ľ–≥/–ī–Ľ, –≥–ł–Ņ–Ķ—Ä—ā—Ä–ł–≥–Ľ–ł—Ü–Ķ—Ä–ł–ī–Ķ–ľ–ł—Ź – 240 –ľ–≥/–ī–Ľ, –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ —É—Ä–ĺ–≤–Ĺ—Ź –õ–ü–Ě–ü –ł –õ–ü–ě–Ě–ü, —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –õ–ü–í–ü –ī–ĺ 38 –ľ–≥/–ī–Ľ.; –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ —É—Ä–ĺ–≤–Ĺ—Ź —Ā—č–≤–ĺ—Ä–ĺ—ā–ĺ—á–Ĺ—č—Ö —ā—Ä–į–Ĺ—Ā–į–ľ–ł–Ĺ–į–∑: –ź–õ–Ę – 134 –Ķ–ī/–Ľ., –ź–°–Ę – 217 –Ķ–ī/–Ľ. –ü–į—Ü–ł–Ķ–Ĺ—ā–ļ–Ķ –ł—Ā–ļ–Ľ—é—á–Ķ–Ĺ–ĺ –≤–ł—Ä—É—Ā–Ĺ–ĺ–Ķ, –į—É—ā–ĺ–ł–ľ–ľ—É–Ĺ–Ĺ–ĺ–Ķ, —Ö–ĺ–Ľ–Ķ—Ā—ā–į—ā–ł—á–Ķ—Ā–ļ–ĺ–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ –Ņ–Ķ—á–Ķ–Ĺ–ł, –∑–Ľ–ĺ—É–Ņ–ĺ—ā—Ä–Ķ–Ī–Ľ–Ķ–Ĺ–ł–Ķ –į–Ľ–ļ–ĺ–≥–ĺ–Ľ–Ķ–ľ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–į –ĺ—ā—Ä–ł—Ü–į–Ľ–į. –ě–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ľ–į—Ā—Ć –≥–ł–Ņ–Ķ—Ä–≥–Ľ–ł–ļ–Ķ–ľ–ł—Ź –Ĺ–į—ā–ĺ—Č–į–ļ: –≥–Ľ—é–ļ–ĺ–∑–į – 121 –ľ–≥/–ī–Ľ. –†–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –≥–Ľ—é–ļ–ĺ–∑–ĺ—ā–ĺ–Ľ–Ķ—Ä–į–Ĺ—ā–Ĺ–ĺ–≥–ĺ —ā–Ķ—Ā—ā–į (–≥–Ľ—é–ļ–ĺ–∑–į –Ĺ–į—ā–ĺ—Č–į–ļ – 110 –ľ–≥/–ī–Ľ, —á–Ķ—Ä–Ķ–∑ 2 —á–į—Ā–į –Ņ–ĺ—Ā–Ľ–Ķ –Ķ–ī—č – 130 –ľ–≥/–ī–Ľ) —É–ļ–į–∑—č–≤–į–Ľ–ł –Ĺ–į —ā—Ä–į–Ĺ–∑–ł—ā–ĺ—Ä–Ĺ—É—é –≥–ł–Ņ–Ķ—Ä–≥–Ľ–ł–ļ–Ķ–ľ–ł—é –Ĺ–į—ā–ĺ—Č–į–ļ. –ü–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł –ł–Ĺ—Ā—É–Ľ–ł–Ĺ–ĺ–≤–ĺ–≥–ĺ –ĺ–Ī–ľ–Ķ–Ĺ–į –Ņ–ĺ–≤—č—ą–Ķ–Ĺ—č: –ł–Ĺ—Ā—É–Ľ–ł–Ĺ 27,9 –ú–ļ–ľ–Ķ/–ľ–Ľ, –°––Ņ–Ķ–Ņ—ā–ł–ī 1854 –Ņ–ľ–ĺ–Ľ—Ć/–Ľ. –Ě–ě–ú–ź–IR = 7,8 –ú–Ķ, —á—ā–ĺ –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–į–Ľ–ĺ –Ĺ–į–Ľ–ł—á–ł–Ķ –ł–Ĺ—Ā—É–Ľ–ł–Ĺ–ĺ—Ä–Ķ–∑–ł—Ā—ā–Ķ–Ĺ—ā–Ĺ–ĺ—Ā—ā–ł.
–ü—Ä–ł –ł–Ĺ—Ā—ā—Ä—É–ľ–Ķ–Ĺ—ā–į–Ľ—Ć–Ĺ–ĺ–ľ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł: –≠–ö–ď – —Ā–ł–Ĺ—É—Ā–ĺ–≤—č–Ļ —Ä–ł—ā–ľ, –ß–°–° – 72 –≤ –ľ–ł–Ĺ. –≠—Ö–ĺ–ö–ď – –Ņ—Ä–ł–∑–Ĺ–į–ļ–ł –į—ā–Ķ—Ä–ĺ—Ā–ļ–Ľ–Ķ—Ä–ĺ–∑–į –į–ĺ—Ä—ā—č, —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ–ĺ–Ļ –≥–ł–Ņ–Ķ—Ä—ā—Ä–ĺ—Ą–ł–ł –õ–Ė –ł —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź —Ą—É–Ĺ–ļ—Ü–ł–ł –ī–ł–į—Ā—ā–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ä–į—Ā—Ā–Ľ–į–Ī–Ľ–Ķ–Ĺ–ł—Ź (–ī–ł–į—Ā—ā–ĺ–Ľ–ł—á–Ķ—Ā–ļ–į—Ź –ī–ł—Ā—Ą—É–Ĺ–ļ—Ü–ł—Ź –ľ–ł–ĺ–ļ–į—Ä–ī–į 1 —ā–ł–Ņ–į). –ü—Ä–ł —Ā—É—ā–ĺ—á–Ĺ–ĺ–ľ –ľ–ĺ–Ĺ–ł—ā–ĺ—Ä–ł—Ä–ĺ–≤–į–Ĺ–ł–ł –ź–Ē –≤—č—Ź–≤–Ľ–Ķ–Ĺ–į —Ā–ł—Ā—ā–ĺ–Ľ–ĺ––ī–ł–į—Ā—ā–ĺ–Ľ–ł—á–Ķ—Ā–ļ–į—Ź –į—Ä—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ–į—Ź –≥–ł–Ņ–Ķ—Ä—ā–Ķ–Ĺ–∑–ł—Ź –ī–Ĺ–Ķ–ľ –ł –ī–ł–į—Ā—ā–ĺ–Ľ–ł—á–Ķ—Ā–ļ–į—Ź –į—Ä—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ–į—Ź –≥–ł–Ņ–Ķ—Ä—ā–Ķ–Ĺ–∑–ł—Ź –Ĺ–ĺ—á—Ć—é —Ā –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ–ľ –ł–Ĺ–ī–Ķ–ļ—Ā–ĺ–≤ –≥–ł–Ņ–Ķ—Ä—ā–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ĺ–į–≥—Ä—É–∑–ļ–ł –ł –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ–ľ —Ā—É—ā–ĺ—á–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ą–ł–Ľ—Ź (non–dipper). –ü–ĺ –ī–į–Ĺ–Ĺ—č–ľ –£–ó–ė –Ī—Ä—é—ą–Ĺ–ĺ–Ļ –Ņ–ĺ–Ľ–ĺ—Ā—ā–ł: –≥–Ķ–Ņ–į—ā–ĺ–ľ–Ķ–≥–į–Ľ–ł—Ź, —Ā—ā–Ķ–į—ā–ĺ–∑ –Ņ–Ķ—á–Ķ–Ĺ–ł. –ü–ĺ –ī–į–Ĺ–Ĺ—č–ľ –≠–ď–Ē–° –Ņ—Ä–ł–∑–Ĺ–į–ļ–ĺ–≤ –Ņ–ĺ—Ä—ā–į–Ľ—Ć–Ĺ–ĺ–Ļ –≥–ł–Ņ–Ķ—Ä—ā–Ķ–Ĺ–∑–ł–ł –Ĺ–Ķ –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ĺ. –° —Ü–Ķ–Ľ—Ć—é –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –ł–Ĺ–ī–Ķ–ļ—Ā–į –≥–ł—Ā—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –ł —Ā—ā–į–ī–ł–ł —Ą–ł–Ī—Ä–ĺ–∑–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–Ķ –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–į –Ņ—É–Ĺ–ļ—Ü–ł–ĺ–Ĺ–Ĺ–į—Ź –Ī–ł–ĺ–Ņ—Ā–ł—Ź –Ņ–Ķ—á–Ķ–Ĺ–ł, –Ņ—Ä–ł –ļ–ĺ—ā–ĺ—Ä–ĺ–Ļ –≤ –ī–ĺ–Ľ—Ć–ļ–į—Ö –ľ–Ĺ–ĺ–≥–ĺ —Ā—Ä–į–≤–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –Ĺ–Ķ–ļ—Ä—É–Ņ–Ĺ—č—Ö —É—á–į—Ā—ā–ļ–ĺ–≤ –∂–ł—Ä–ĺ–≤–ĺ–Ļ –ī–ł—Ā—ā—Ä–ĺ—Ą–ł–ł –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–ĺ–≤ (–ļ—Ä—É–Ņ–Ĺ–ĺ–ļ–į–Ņ–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ —Ā –∂–ł—Ä–ĺ–≤—č–ľ–ł –ļ–ł—Ā—ā–į–ľ–ł), –Ĺ–Ķ–Ī–ĺ–Ľ—Ć—ą–ł–Ķ —Ā–ļ–ĺ–Ņ–Ľ–Ķ–Ĺ–ł—Ź –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–Ĺ–ĺ—Ź–ī–Ķ—Ä–Ĺ—č—Ö –Ľ–Ķ–Ļ–ļ–ĺ—Ü–ł—ā–ĺ–≤ –ł –Ľ–ł–ľ—Ą–ĺ—Ü–ł—ā–ĺ–≤, –≤ —ā–ĺ–ľ —á–ł—Ā–Ľ–Ķ –≤–ĺ–ļ—Ä—É–≥ —Ü–Ķ–Ĺ—ā—Ä–į–Ľ—Ć–Ĺ—č—Ö –≤–Ķ–Ĺ, —Ā –Ĺ–Ķ—ą–ł—Ä–ĺ–ļ–ł–ľ–ł —Ą–ł–Ī—Ä–ĺ–∑–Ĺ—č–ľ–ł –Ņ—Ä–ĺ—Ā–Ľ–ĺ–Ļ–ļ–į–ľ–ł –≤ –∑–ĺ–Ĺ–Ķ –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –ł–Ĺ—Ą–ł–Ľ—Ć—ā—Ä–į—Ü–ł–ł. –ü–ĺ—Ä—ā–į–Ľ—Ć–Ĺ—č–Ķ —ā—Ä–į–ļ—ā—č —Ā —Ą–ł–Ī—Ä–ĺ–∑–Ĺ—č–ľ–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź–ľ–ł, —á–į—Ā—ā—Ć –ł—Ö –ī–Ķ—Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–į, —Ā–ĺ —Ā–Ľ–į–Ī–ĺ–Ļ –ł–Ľ–ł —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ–ĺ–Ļ –ļ–Ľ–Ķ—ā–ĺ—á–Ĺ–ĺ–Ļ –ł–Ĺ—Ą–ł–Ľ—Ć—ā—Ä–į—Ü–ł–Ķ–Ļ, –Ņ—Ä–ĺ–Ĺ–ł–ļ–į—é—Č–Ķ–Ļ –≤ –Ņ–Ķ—Ä–ł–Ņ–ĺ—Ä—ā–į–Ľ—Ć–Ĺ—É—é –∑–ĺ–Ĺ—É. –ó–į–ļ–Ľ—é—á–Ķ–Ĺ–ł–Ķ: –Ĺ–Ķ–į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ—č–Ļ —Ā—ā–Ķ–į—ā–ĺ–≥–Ķ–Ņ–į—ā–ł—ā (—É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ—č–Ļ, 2 —Ā—ā–į–ī–ł—Ź —Ą–ł–Ī—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł –Ņ–ĺ E.Brunt).
–ö–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ –ī–ł–į–≥–Ĺ–ĺ–∑ –Ī—č–Ľ —Ā—Ą–ĺ—Ä–ľ—É–Ľ–ł—Ä–ĺ–≤–į–Ĺ —Ā–Ľ–Ķ–ī—É—é—Č–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ: –Ě–Ķ–į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ—č–Ļ —Ā—ā–Ķ–į—ā–ĺ–≥–Ķ–Ņ–į—ā–ł—ā –Ĺ–į —Ą–ĺ–Ĺ–Ķ –ł–∑–Ī—č—ā–ĺ—á–Ĺ–ĺ–Ļ –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į –ł –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź –Ľ–ł–Ņ–ł–ī–Ĺ–ĺ–≥–ĺ –ĺ–Ī–ľ–Ķ–Ĺ–į, —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ–ĺ–Ļ –≥–ł—Ā—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł —Ā —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ–ľ —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ —Ą–ł–Ī—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł. –ď–ł–Ņ–Ķ—Ä—ā–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź –Ī–ĺ–Ľ–Ķ–∑–Ĺ—Ć II —Ā—ā., –≤—č—Ā–ĺ–ļ–ĺ–≥–ĺ —Ä–ł—Ā–ļ–į. –ź—ā–Ķ—Ä–ĺ—Ā–ļ–Ľ–Ķ—Ä–ĺ–∑ –į–ĺ—Ä—ā—č, –ļ–ĺ—Ä–ĺ–Ĺ–į—Ä–Ĺ—č—Ö –ł –ľ–ĺ–∑–≥–ĺ–≤—č—Ö –į—Ä—ā–Ķ—Ä–ł–Ļ. –ź—ā–Ķ—Ä–ĺ—Ā–ļ–Ľ–Ķ—Ä–ĺ—ā–ł—á–Ķ—Ā–ļ–ł–Ļ –ļ–į—Ä–ī–ł–ĺ—Ā–ļ–Ľ–Ķ—Ä–ĺ–∑. –°–į—Ö–į—Ä–Ĺ—č–Ļ –ī–ł–į–Ī–Ķ—ā 2 —ā–ł–Ņ–į, –≤–Ņ–Ķ—Ä–≤—č–Ķ –≤—č—Ź–≤–Ľ–Ķ–Ĺ–Ĺ—č–Ļ. –≠–ļ–∑–ĺ–≥–Ķ–Ĺ–Ĺ–ĺ––ļ–ĺ–Ĺ—Ā—ā–ł—ā—É—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ķ –ĺ–∂–ł—Ä–Ķ–Ĺ–ł–Ķ. –Ē–ł—Ā–Ľ–ł–Ņ–ł–ī–Ķ–ľ–ł—Ź. –ü–į—Ü–ł–Ķ–Ĺ—ā–ļ–Ķ –Ī—č–Ľ–ł —Ä–į–∑—ä—Ź—Ā–Ĺ–Ķ–Ĺ—č –Ņ—Ä–ł–Ĺ—Ü–ł–Ņ—č –≥–ł–Ņ–ĺ—Ö–ĺ–Ľ–Ķ—Ā—ā–Ķ—Ä–ł–Ĺ–ĺ–≤–ĺ–Ļ, –≥–ł–Ņ–ĺ–ļ–į–Ľ–ĺ—Ä–ł–Ļ–Ĺ–ĺ–Ļ –ī–ł–Ķ—ā—č, —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–ĺ–≤–į–Ĺ–ĺ —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ —Ą–ł–∑–ł—á–Ķ—Ā–ļ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł. –í –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā–Ĺ—É—é —ā–Ķ—Ä–į–Ņ–ł—é –Ī–ĺ–Ľ—Ć–Ĺ–ĺ–Ļ –Ī—č–Ľ–ł –≤–ļ–Ľ—é—á–Ķ–Ĺ—č: –ł–Ĺ—Ā—É–Ľ–ł–Ĺ–ĺ—Ā–Ķ–Ĺ—Ā–ł—ā–į–Ļ–∑–Ķ—Ä—č – –ľ–Ķ—ā—Ą–ĺ—Ä–ľ–ł–Ĺ 500 –ľ–≥ 2 —Ä–į–∑–į –≤ —Ā—É—ā–ļ–ł –ł —ć—Ā—Ā–Ķ–Ĺ—Ü–ł–į–Ľ—Ć–Ĺ—č–Ķ —Ą–ĺ—Ā—Ą–ĺ–Ľ–ł–Ņ–ł–ī—č – –≠—Ā—Ā–Ķ–Ĺ—Ü–ł–į–Ľ–Ķ® –Ě 10,0 – –≤–Ĺ—É—ā—Ä–ł–≤–Ķ–Ĺ–Ĺ–ĺ, —Ā—ā—Ä—É–Ļ–Ĺ–ĺ – –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 10 –ī–Ĺ–Ķ–Ļ, —Ā –Ņ–ĺ—Ā–Ľ–Ķ–ī—É—é—Č–ł–ľ –Ņ–Ķ—Ä–Ķ—Ö–ĺ–ī–ĺ–ľ –Ĺ–į –Ņ–Ķ—Ä–ĺ—Ä–į–Ľ—Ć–Ĺ—č–Ļ –Ņ—Ä–ł–Ķ–ľ –≠—Ā—Ā–Ķ–Ĺ—Ü–ł–į–Ľ–Ķ® –§–ĺ—Ä—ā–Ķ –Ě 2 –ļ–į–Ņ—Ā—É–Ľ—č 3 —Ä–į–∑–į –≤ —Ā—É—ā–ļ–ł –Ĺ–į –Ņ—Ä–ĺ—ā—Ź–∂–Ķ–Ĺ–ł–ł 6 –ľ–Ķ—Ā—Ź—Ü–Ķ–≤. –Ě–į —Ą–ĺ–Ĺ–Ķ —ā–Ķ—Ä–į–Ņ–ł–ł —á–Ķ—Ä–Ķ–∑ 3 –Ĺ–Ķ–ī–Ķ–Ľ–ł –Ņ—Ä–Ķ–Ī—č–≤–į–Ĺ–ł—Ź –≤ –ļ–Ľ–ł–Ĺ–ł–ļ–Ķ –Ī–ĺ–Ľ—Ć–Ĺ–į—Ź —Ā–Ĺ–ł–∑–ł–Ľ–į –ľ–į—Ā—Ā—É —ā–Ķ–Ľ–į –Ĺ–į 3 –ļ–≥, –ź–Ē —Ā—ā–į–Ī–ł–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ľ–ĺ—Ā—Ć –Ĺ–į —É—Ä–ĺ–≤–Ĺ–Ķ 120 –ł 80 –ľ–ľ —Ä—ā.—Ā—ā., –ĺ–Ī—Ö–≤–į—ā —ā–į–Ľ–ł–ł —É–ľ–Ķ–Ĺ—Ć—ą–ł–Ľ—Ā—Ź –Ĺ–į 3 —Ā–ľ, —É—Ä–ĺ–≤–Ķ–Ĺ—Ć –ź–°–Ę —Ā–Ĺ–ł–∑–ł–Ľ—Ā—Ź —Ā 217 –ī–ĺ 92 –Ķ–ī/–Ľ, –ź–õ–Ę —Ā 134 –ī–ĺ 65 –Ķ–ī/–Ľ. –Ď–ĺ–Ľ—Ć–Ĺ–į—Ź –Ī—č–Ľ–į –≤—č–Ņ–ł—Ā–į–Ĺ–į —Ā –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ —É–Ľ—É—á—ą–Ķ–Ĺ–ł–Ķ–ľ –ł —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł—Ź–ľ–ł –Ņ—Ä–ĺ–ī–ĺ–Ľ–∂–ł—ā—Ć –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–Ĺ—É—é —ā–Ķ—Ä–į–Ņ–ł—é. –ß–Ķ—Ä–Ķ–∑ 6 –ľ–Ķ—Ā—Ź—Ü–Ķ–≤ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ľ–į—Ā—Ć –≤ –ļ–Ľ–ł–Ĺ–ł–ļ–Ķ –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ–ĺ: —á—É–≤—Ā—ā–≤—É–Ķ—ā —Ā–Ķ–Ī—Ź —É–ī–ĺ–≤–Ľ–Ķ—ā–≤–ĺ—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ, —Ā–Ĺ–ł–∑–ł–Ľ–į –≤–Ķ—Ā –Ĺ–į 7 –ļ–≥, –ź–Ē 130 –ł 80 –ľ–ľ —Ä—ā.—Ā—ā., –ě–Ę – 102 —Ā–ľ, –ź–°–Ę – 43 –Ķ–ī/–Ľ, –ź–õ–Ę – 30 –Ķ–ī/–Ľ, –Ľ–ł–Ņ–ł–ī–Ĺ—č–Ļ —Ā–Ņ–Ķ–ļ—ā—Ä: –ĺ–Ī—Č–ł–Ļ —Ö–ĺ–Ľ–Ķ—Ā—ā–Ķ—Ä–ł–Ĺ – 133 –ľ–≥/–ī–Ľ, —ā—Ä–ł–≥–Ľ–ł—Ü–Ķ—Ä–ł–ī—č – 139 –ľ–≥/–ī–Ľ, –õ–ü–í–ü – 37 –ľ–≥/–ī–Ľ, –õ–ü–ě–Ě–ü – 27,8 –ľ–≥/–ī–Ľ, –õ–ü–Ě–ü – 68 –ľ–≥/–ī–Ľ, –≥–Ľ—é–ļ–ĺ–∑–į – 100 –ľ–≥/–ī–Ľ, —É—Ä–ĺ–≤–Ķ–Ĺ—Ć –ł–Ĺ—Ā—É–Ľ–ł–Ĺ–į —Ā–Ĺ–ł–∑–ł–Ľ—Ā—Ź —Ā 27,9 –ī–ĺ 16 –Ķ–ī/–Ľ. –ß–Ķ—Ä–Ķ–∑ 1 –≥–ĺ–ī –Ņ—Ä–ł –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –≤ –Ī–ł–ĺ—Ö–ł–ľ–ł—á–Ķ—Ā–ļ–ĺ–ľ –į–Ĺ–į–Ľ–ł–∑–Ķ –ļ—Ä–ĺ–≤–ł: —É—Ä–ĺ–≤–Ķ–Ĺ—Ć –ź–õ–Ę –ł –ź–°–Ę –≤ –Ņ—Ä–Ķ–ī–Ķ–Ľ–į—Ö –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ—č—Ö –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ļ. –Ē–Ľ—Ź –ĺ—Ü–Ķ–Ĺ–ļ–ł –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ĺ–Ķ–ļ—Ä–ĺ––≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł, —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł —Ā—ā–Ķ–į—ā–ĺ–∑–į –ł —Ą–ł–Ī—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–Ķ –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ —ā–Ķ—Ā—ā «–§–ł–Ī—Ä–ĺ–ú–į–ļ—Ā» –ł –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–į —ć–Ľ–į—Ā—ā–ĺ–≥—Ä–į—Ą–ł—Ź –Ņ–Ķ—á–Ķ–Ĺ–ł. –ü–ĺ –ī–į–Ĺ–Ĺ—č–ľ –į–ļ—ā–ł–—ā–Ķ—Ā—ā–į –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć —Ā–ĺ—Ā—ā–į–≤–ł–Ľ 0,16, —á—ā–ĺ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–ĺ–≤–į–Ľ–ĺ –ź0 – –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł—é –≥–ł—Ā—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł; –Ņ–ĺ –ī–į–Ĺ–Ĺ—č–ľ —Ā—ā–Ķ–į—ā–ĺ–—ā–Ķ—Ā—ā–į –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć —Ā–ĺ—Ā—ā–į–≤–ł–Ľ 0,42, —á—ā–ĺ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–ĺ–≤–į–Ľ–ĺ S1 – –ľ–ł–Ĺ–ł–ľ–į–Ľ—Ć–Ĺ–ĺ–ľ—É —Ā—ā–Ķ–į—ā–ĺ–∑—É (–ľ–Ķ–Ĺ–Ķ–Ķ 5% –≥–Ķ–Ņ–į—ā–ĺ—Ü–ł—ā–ĺ–≤ —Ā–ĺ —Ā—ā–Ķ–į—ā–ĺ–∑–ĺ–ľ); –Ņ–ĺ –ī–į–Ĺ–Ĺ—č–ľ –Ĺ—ć—ą–—ā–Ķ—Ā—ā–į –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć —Ā–ĺ—Ā—ā–į–≤–ł–Ľ – 0,25, —á—ā–ĺ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–ĺ–≤–į–Ľ–ĺ N 0 – –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł—é –Ě–ź–°–ď; –Ņ–ĺ –ī–į–Ĺ–Ĺ—č–ľ —Ą–ł–Ī—Ä–ĺ–—ā–Ķ—Ā—ā–į –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć —Ā–ĺ—Ā—ā–į–≤–ł–Ľ 0,29. –ü–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć —ć–Ľ–į—Ā—ā–ł—á–Ĺ–ĺ—Ā—ā–ł –Ņ–Ķ—á–Ķ–Ĺ–ĺ—á–Ĺ–ĺ–Ļ —ā–ļ–į–Ĺ–ł —Ä–į–≤–Ķ–Ĺ 6,7 –ļ–ü–į, —á—ā–ĺ —É–ļ–į–∑—č–≤–į–Ľ–ĺ –Ĺ–į –Ĺ–į–Ľ–ł—á–ł–Ķ —Ā–Ľ–į–Ī–ĺ–≥–ĺ —Ą–ł–Ī—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł. –Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–Ķ —Ā –Ě–ź–°–ď –ī–ł–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ä–Ķ–∂–ł–ľ–į, –ł–Ĺ—Ā—É–Ľ–ł–Ĺ–ĺ—Ā–Ķ–Ĺ—Ā–ł—ā–į–Ļ–∑–Ķ—Ä–ĺ–≤ –ł —ć—Ā—Ā–Ķ–Ĺ—Ü–ł–į–Ľ—Ć–Ĺ—č—Ö —Ą–ĺ—Ā—Ą–ĺ—Ā—Ą–ĺ–Ľ–ł–Ņ–ł–ī–ĺ–≤ –Ņ—Ä–ł–≤–Ķ–Ľ–ĺ –ļ —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł—é —Ą–ł–Ī—Ä–ĺ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –ł —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł —Ā—ā–Ķ–į—ā–ĺ–∑–į, –į —ā–į–ļ–∂–Ķ –ļ —Ä–Ķ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł—é –Ĺ–Ķ–ļ—Ä–ĺ––≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ —Ä–Ķ–į–ļ—Ü–ł–ł –≤ —ā–ļ–į–Ĺ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł, —á—ā–ĺ –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —É–Ľ—É—á—ą–ł–Ľ–ĺ –∂–ł–∑–Ĺ–Ķ–Ĺ–Ĺ—č–Ļ –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑ –ł –ļ–į—á–Ķ—Ā—ā–≤–ĺ –∂–ł–∑–Ĺ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–ł.

–õ–ł—ā–Ķ—Ä–į—ā—É—Ä–į
1. –Ď–į–ļ—É–Ľ–ł–Ĺ –ė.–ď., –Ě–ĺ–≤–ĺ–∂–Ķ–Ĺ–ĺ–≤ –í.–ď., –Ē–Ķ–≥–ĺ–Ķ–≤–į –Ď.–ź. –ü–Ķ—Ä—Ā–Ņ–Ķ–ļ—ā–ł–≤—č –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł—Ź –ľ–į–ļ—Ä–ĺ– –ł –ľ–ł–ļ—Ä–ĺ—ć–Ľ–Ķ–ľ–Ķ–Ĺ—ā–ĺ–≤ –ī–Ľ—Ź —É–Ľ—É—á—ą–Ķ–Ĺ–ł—Ź –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –ľ–ł–ļ—Ä–ĺ–Ĺ—É—ā—Ä–ł–Ķ–Ĺ—ā–į–ľ–ł –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź–ľ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł // –ö–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź –ī–ł–Ķ—ā–ĺ–Ľ–ĺ–≥–ł—Ź. – –Ę.1, ‚ĄĖ4. – 2004. – –°. 35–39.
2. –Ď–ĺ–≥–ĺ–ľ–ĺ–Ľ–ĺ–≤ –ü.–ě., –®—É–Ľ—Ć–Ņ–Ķ–ļ–ĺ–≤–į –ģ.–ě. –°—ā–Ķ–į—ā–ĺ–∑ –Ņ–Ķ—á–Ķ–Ĺ–ł –ł –Ĺ–Ķ–į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ—č–Ļ —Ā—ā–Ķ–į—ā–ĺ–≥–Ķ–Ņ–į—ā–ł—ā. –Ď–ĺ–Ľ–Ķ–∑–Ĺ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł –ł –∂–Ķ–Ľ—á–Ķ–≤—č–≤–ĺ–ī—Ź—Č–ł—Ö –Ņ—É—ā–Ķ–Ļ / –ü–ĺ–ī —Ä–Ķ–ī. –į–ļ–į–ī. –†–ź–ú–Ě –Ņ—Ä–ĺ—Ą. –ė–≤–į—ą–ļ–ł–Ĺ–į –í.–Ę. / –ė–∑–ī––Ķ 2––Ķ, –ł—Ā–Ņ—Ä–į–≤–Ľ. –ł –ī–ĺ–Ņ–ĺ–Ľ–Ĺ. – M.: –ė–∑–ī. –ī–ĺ–ľ –ú––í–Ķ—Ā—ā–ł. – 2005. – C. 205–216.
3. –ü–į–≤–Ľ–ĺ–≤ –ß.–°., –ó–ĺ–Ľ–ĺ—ā–į—Ä–Ķ–≤—Ā–ļ–ł–Ļ –í.–Ď., –ė–≤–į—ą–ļ–ł–Ĺ –í.–Ę. –ł —Ā–ĺ–į–≤—ā. –°—ā—Ä—É–ļ—ā—É—Ä–į —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –Ņ–Ķ—á–Ķ–Ĺ–ł –Ņ–ĺ –ī–į–Ĺ–Ĺ—č–ľ –Ī–ł–ĺ–Ņ—Ā–ł–ł –ł –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ķ–Ķ —ā–ļ–į–Ĺ–ł // –†–ĺ—Ā. –∂—É—Ä–Ĺ. –≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ., –≥–Ķ–Ņ–į—ā–ĺ–Ľ., –ļ–ĺ–Ľ–ĺ–Ņ—Ä–ĺ–ļ—ā–ĺ–Ľ. – 2007. – –Ę. 17, ‚ĄĖ 1. – –°. 90.
4. –ü–į–≤–Ľ–ĺ–≤ –ß. –°., –ó–ĺ–Ľ–ĺ—ā–į—Ä–Ķ–≤—Ā–ļ–ł–Ļ –í. –Ď., –ė–≤–į—ą–ļ–ł–Ĺ –í. –Ę. –ł —Ā–ĺ–į–≤—ā. –Ď–ł–ĺ–Ņ—Ā–ł—Ź –ł –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –≤ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–Ķ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –Ņ–Ķ—á–Ķ–Ĺ–ł –Ĺ–Ķ—É—ā–ĺ—á–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ļ —ć—ā–ł–ĺ–Ľ–ĺ–≥–ł–ł // –†–ĺ—Ā. –∂—É—Ä–Ĺ. –≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ., –≥–Ķ–Ņ–į—ā–ĺ–Ľ., –ļ–ĺ–Ľ–ĺ–Ņ—Ä–ĺ–ļ—ā–ĺ–Ľ. – 2007. – –Ę. 17, ‚ĄĖ 1. – –°. 90.
5. –ü–į–≤–Ľ–ĺ–≤ –ß.–°., –ė–≤–į—ą–ļ–ł–Ĺ –í.–Ę. –Ď–ł–ĺ–Ņ—Ā–ł—Ź –Ņ–Ķ—á–Ķ–Ĺ–ł: –ľ–Ķ—ā–ĺ–ī–ĺ–Ľ–ĺ–≥–ł—Ź –ł –Ņ—Ä–į–ļ—ā–ł–ļ–į —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź // –†–ĺ—Ā. –∂—É—Ä–Ĺ. –≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ., –≥–Ķ–Ņ–į—ā–ĺ–Ľ., –ļ–ĺ–Ľ–ĺ–Ņ—Ä–ĺ–ļ—ā–ĺ–Ľ. – 2006. – –Ę. 16, ‚ĄĖ 4. – –°. 65–78.
6. –ü–į–≤–Ľ–ĺ–≤ –ß.–°., –ó–ĺ–Ľ–ĺ—ā–į—Ä–Ķ–≤—Ā–ļ–ł–Ļ –í.–Ď., –ė–≤–į—ą–ļ–ł–Ĺ –í.–Ę. –ł —Ā–ĺ–į–≤—ā. –í–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā—Ć –ĺ–Ī—Ä–į—ā–ł–ľ–ĺ—Ā—ā–ł —Ü–ł—Ä—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł (–ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ķ –ł –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–Ķ–ī–Ņ–ĺ—Ā—č–Ľ–ļ–ł) // –†–ĺ—Ā. –∂—É—Ä–Ĺ. –≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ., –≥–Ķ–Ņ–į—ā–ĺ–Ľ., –ļ–ĺ–Ľ–ĺ–Ņ—Ä–ĺ–ļ—ā–ĺ–Ľ. – 2006. – –Ę. 16, – ‚ĄĖ 1. – –°. 20–29.
7. –ü–į–≤–Ľ–ĺ–≤ –ß.–°., –ď–Ľ—É—ą–Ķ–Ĺ–ļ–ĺ–≤ –Ē.–í., –ě–Ĺ–ī–ĺ—Ā –®.–ź., –ė–≤–į—ą–ļ–ł–Ĺ –í.–Ę. «–§–ł–Ī—Ä–ĺ––ú–į–ļ—Ā» – –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā –Ĺ–Ķ–ł–Ĺ–≤–į–∑–ł–≤–Ĺ—č—Ö —ā–Ķ—Ā—ā–ĺ–≤ –ī–Ľ—Ź –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –ī–ł—Ą—Ą—É–∑–Ĺ—č—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –Ņ–Ķ—á–Ķ–Ĺ–ł // –ď–Ķ–Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ļ —Ą–ĺ—Ä—É–ľ – 2008 – ‚ĄĖ 3 – –°. 22–27
8. Brunt E.M. Nonalcoholic steatohepatiatis // Semin Liver Dis. – 2004. – 24, 3–20.
9. Donnelly K.L., Smith C.I. et al. Sources of fatty acids storet in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease // J Clin. Invest. – 2005. – 115, 1343–51.
10. Nahum Mendez–Sanchez, Marco Arrese et al. Current concepts in pathogenesis of nonalcoholic fatty liver disease // Liver intern. – 2007. – Vol. 27. – N 4. – 423–433.
11. Roberts E.A. Pediatric nonalcoholic fatty liver disease(NAFLD): A “growing” problem? // J Hepatol. – 2007. – Vol. 46. – N6. – 1133–1142.












