–Т –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Є–Ј—Г—З–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –љ–Њ–≤–Њ–≥–Њ –∞–љ—В–Є—А–µ—Д–ї—О–Ї—Б–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –У–µ–≤–Є—Б–Ї–Њ–љ –§–Њ—А—В–µ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Є–Ј–ґ–Њ–≥–Є –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —П–≤–ї—П–ї–Њ—Б—М –Њ—В–Ї—А—Л—В—Л–Љ, –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л–Љ, IV —Д–∞–Ј—Л –Є –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ –±–Њ–ї—М–љ–Є—Ж–∞—Е –Є —А–Њ–і–Є–ї—М–љ—Л—Е –і–Њ–Љ–∞—Е –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є –Є –Ѓ–ґ–љ–Њ––Р—Д—А–Є–Ї–∞–љ—Б–Ї–Њ–є –†–µ—Б–њ—Г–±–ї–Є–Ї–Є. –С–µ—А–µ–Љ–µ–љ–љ—Л–µ –ґ–µ–љ—Й–Є–љ—Л (<38 –љ–µ–і–µ–ї—М –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, n=83) –≤ –≤–Њ–Ј—А–∞—Б—В–µ 18–40 –ї–µ—В, —Б—В—А–∞–і–∞—О—Й–Є–µ –Њ—В –Є–Ј–ґ–Њ–≥–Є, –і–Њ–ї–ґ–љ—Л –±—Л–ї–Є –њ—А–Є–љ–Є–Љ–∞—В—М –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є 5–10 –Љ–ї –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ –і–ї—П –Њ–±–ї–µ–≥—З–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є —Б–њ–Њ—Б–Њ–±–∞–Љ–Є –Њ—Ж–µ–љ–Ї–Є —П–≤–ї—П–ї–Є—Б—М –Њ—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–Љ –Є –ґ–µ–љ—Й–Є–љ–∞–Љ–Є –њ–Њ—Б–ї–µ —З–µ—В—Л—А–µ—Е –љ–µ–і–µ–ї—М –љ–∞ –Њ—Б–љ–Њ–≤–µ –њ—П—В–Є–±–∞–ї–ї—М–љ–Њ–є —И–Ї–∞–ї—Л. –Я–Њ—Б–ї–µ —З–µ—В—Л—А–µ—Е –љ–µ–і–µ–ї—М –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є, –і–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–Љ –Є –ґ–µ–љ—Й–Є–љ–∞–Љ–Є, –±—Л–ї–Є «–Њ—З–µ–љ—М —Е–Њ—А–Њ—И–∞—П» –Є «—Е–Њ—А–Њ—И–∞—П» —Г 88 –Є 90% –ґ–µ–љ—Й–Є–љ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –ґ–µ–љ—Й–Є–љ (57%, n=83) —Б–Њ–Њ–±—Й–∞–ї–Є –Њ–± –Њ–±–ї–µ–≥—З–µ–љ–Є–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ 10 –Љ–Є–љ—Г—В. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –У–µ–≤–Є—Б–Ї–Њ–љ –§–Њ—А—В–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –Є –±—Л—Б—В—А–Њ —Б–љ–Є–ґ–∞–µ—В –Є–Ј–ґ–Њ–≥—Г –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Х–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ—А–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –љ–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Є–Ј–≤–µ—Б—В–љ—Л—Е —А–Є—Б–Ї–Њ–≤ –і–ї—П –Љ–∞—В–µ—А–Є –Є–ї–Є —А–µ–±–µ–љ–Ї–∞ [–Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–є –Ц—Г—А–љ–∞–ї –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Я—А–∞–Ї—В–Є–Ї–Є, 2003; 57(3): 175–179].
45–85% –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ –ґ–∞–ї—Г—О—В—Б—П –љ–∞ –Є–Ј–ґ–Њ–≥—Г, –Є —Г –љ–Є—Е –≤—Л—П–≤–ї—П—В—Б—П –≥–∞—Б—В—А–Њ—Н–Ј–Њ—Д–∞–≥–µ–∞–ї—М–љ—Л–є —А–µ—Д–ї—О–Ї—Б (–У–≠–†). –Я—А–Є—З–µ–Љ —З–∞—Б—В–Њ—В–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –њ—А–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Я–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –≥–Њ—А–Љ–Њ–љ–Њ–≤ –њ–ї–∞—Ж–µ–љ—В—Л –Є –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –≤–љ—Г—В—А–Є–±—А—О—И–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –Њ—В —А–∞—Б—В—Г—Й–µ–≥–Њ –њ–ї–Њ–і–∞ —Г—Е—Г–і—И–∞–µ—В—Б—П —А–∞–±–Њ—В–∞ –љ–Є–ґ–љ–µ–≥–Њ –њ–Є—Й–µ–≤–Њ–і–љ–Њ–≥–Њ —Б—Д–Є–љ–Ї—В–µ—А–∞ (–Э–Я–°), –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≤ —В—А–µ—В—М–µ–Љ —В—А–Є–Љ–µ—Б—В—А–µ. –†–∞—Б—Б–ї–∞–±–ї–µ–љ–Є–µ –Э–Я–° –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї —В–Њ–Љ—Г, —З—В–Њ –ґ–µ–ї—Г–і–Њ—З–љ—Л–є —Б–Њ–Ї –±–Њ–ї–µ–µ —Б–≤–Њ–±–Њ–і–љ–Њ –њ–Њ—Б—В—Г–њ–∞–µ—В –≤ –њ–Є—Й–µ–≤–Њ–і. –•–Њ—В—П —Б–Є–Љ–њ—В–Њ–Љ—Л –Њ–±—Л—З–љ–Њ —П–≤–ї—П—О—В—Б—П –Љ—П–≥–Ї–Є–Љ–Є –Є–ї–Є —Б—А–µ–і–љ–Є–Љ–Є –њ–Њ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –Є —Б–∞–Љ–Є –њ—А–Њ—Е–Њ–і—П—В –њ–Њ—Б–ї–µ —А–Њ–і–Њ–≤, –Њ–љ–Є –Љ–Њ–≥—Г—В –≤—Л–Ј–≤–∞—В—М –±–Њ–ї—М—И–µ–µ –љ–µ–і–Њ–Љ–Њ–≥–∞–љ–Є–µ, —З–µ–Љ –і—А—Г–≥–Є–µ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –±–Њ–ї–µ–µ —Б–µ—А—М–µ–Ј–љ—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –њ—А–Є–≤–µ—Б—В–Є –Ї –љ–∞—А—Г—И–µ–љ–Є—О —Б–љ–∞ –Є –њ–Є—Й–µ–≤–∞—А–µ–љ–Є—П, —В–µ–Љ —Б–∞–Љ—Л–Љ –Ї–Њ—Б–≤–µ–љ–љ–Њ –Њ–Ї–∞–Ј—Л–≤–∞—П –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –Љ–∞—В—М –Є –њ–ї–Њ–і.
–Т—А–µ–Љ–µ–љ–љ–∞—П –њ—А–Є—А–Њ–і–∞ —Н—В–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є –Њ–њ–∞—Б–µ–љ–Є–µ, —З—В–Њ –њ—А–Є–љ–Є–Љ–∞–µ–Љ—Л–µ –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –ї–µ–Ї–∞—А—Б—В–≤–∞ –Љ–Њ–≥—Г—В –њ—А–Є–љ–µ—Б—В–Є –≤—А–µ–і —А–∞–Ј–≤–Є–≤–∞—О—Й–µ–Љ—Г—Б—П –њ–ї–Њ–і—Г, –Њ–Ј–љ–∞—З–∞—О—В, —З—В–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Ї —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –њ–Њ –Њ–±—А–∞–Ј—Г –ґ–Є–Ј–љ–Є –ї–µ—З–µ–љ–Є–µ –Њ–±—Л—З–љ–Њ –љ–∞—З–Є–љ–∞–µ—В—Б—П —Б –±–Њ–ї–µ–µ –Љ—П–≥–Ї–Є—Е —Б–њ–Њ—Б–Њ–±–Њ–≤ – –њ—А–Њ—Б—В—Л–Љ–Є –∞–љ—В–∞—Ж–Є–і–∞–Љ–Є –Є–ї–Є –∞–љ—В–Є—А–µ—Д–ї—О–Ї—Б–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –љ–∞ –Њ—Б–љ–Њ–≤–µ –∞–ї—М–≥–Є–љ–∞—В–∞. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б–њ—Л—В–∞–љ–Є—П –њ–Њ –њ—А–Њ–≤–µ—А–Ї–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —А–µ–і–Ї–Њ –њ—А–Њ–≤–Њ–і—П—В—Б—П –≤ —Н—В–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, —Б—Г—Й–µ—Б—В–≤—Г–µ—В –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –і–∞–љ–љ—Л—Е –≤ –њ–Њ–і–і–µ—А–ґ–Ї—Г –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –і–∞–љ–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –≥–ї–∞–≤–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л –Њ—А–≥–∞–љ–Њ–≤ —Г –њ–ї–Њ–і–∞ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –Ї 12––є –љ–µ–і–µ–ї–µ –Є –њ–µ—А–Є–Њ–і —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї –њ–Њ—А–Њ–Ї–∞–Љ —А–∞–Ј–≤–Є—В–Є—П —Б—Г—Й–µ—Б—В–≤—Г–µ—В –і–Њ 16––є –љ–µ–і–µ–ї–Є, –ї–µ–Ї–∞—А—Б—В–≤–∞, –њ—А–Є–љ–Є–Љ–∞–µ–Љ—Л–µ –љ–∞ –±–Њ–ї–µ–µ –њ–Њ–Ј–і–љ–Є—Е —Б—А–Њ–Ї–∞—Е –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В –њ—А–Є–љ–µ—Б—В–Є –≤—А–µ–і —А–∞–Ј–≤–Є–≤–∞—О—Й–µ–Љ—Г—Б—П –њ–ї–Њ–і—Г.
–У–µ–≤–Є—Б–Ї–Њ–љ –§–Њ—А—В–µ® —П–≤–ї—П–µ—В—Б—П —Г–љ–Є–Ї–∞–ї—М–љ—Л–Љ –∞–љ—В–Є—А–µ—Д–ї—О–Ї—Б–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –љ–∞ –Њ—Б–љ–Њ–≤–µ –∞–ї—М–≥–Є–љ–∞—В–∞, —Б–Њ–і–µ—А–ґ–Є—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–µ –љ–∞—В—А–Є—П –љ–∞ –і–Њ–Ј—Г –њ—А–µ–њ–∞—А–∞—В–∞, —З–µ–Љ –Њ–±—Л—З–љ—Л–µ —Д–Њ—А–Љ—Г–ї—Л –∞–ї—М–≥–Є–љ–∞—В–∞. –Ю–љ –Њ–±—А–∞–Ј—Г–µ—В —Г—Б—В–Њ–є—З–Є–≤—Л–є –љ–µ–≤—Б–∞—Б—Л–≤–∞—О—Й–Є–є—Б—П –±–∞—А—М–µ—А –≤ –ґ–µ–ї—Г–і–Ї–µ, –њ—А–µ–њ—П—В—Б—В–≤—Г—О—Й–Є–є –њ–Њ–њ–∞–і–∞–љ–Є—О –≤ –њ–Є—Й–µ–≤–Њ–і –Ї–Є—Б–ї–Њ—В—Л –Є –њ–Є—Й–Є, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –њ–Њ–≤—А–µ–і–Є—В—М —Б–ї–Є–Ј–Є—Б—В—Г—О –њ–Є—Й–µ–≤–Њ–і–∞ –Є –≤—Л–Ј–≤–∞—В—М –Є–Ј–ґ–Њ–≥—Г. –Ф–∞–љ–љ—Л–є –љ–µ—Б–Є—Б—В–µ–Љ–љ—Л–є —Б–њ–Њ—Б–Њ–± –і–µ–є—Б—В–≤–Є—П –Њ–Ј–љ–∞—З–∞–µ—В, —З—В–Њ –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –і—А—Г–≥–Є—Е –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е —Б–њ–Њ—Б–Њ–±–Њ–≤ –ї–µ—З–µ–љ–Є—П –Є–Ј–ґ–Њ–≥–Є –Є –У–≠–† –µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є –љ–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Њ–њ–∞—Б–љ–Њ—Б—В–Є –і–ї—П –Љ–∞—В–µ—А–Є –Є–ї–Є —А–µ–±–µ–љ–Ї–∞. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –љ–∞ –љ–µ—Б–Є—Б—В–µ–Љ–љ—Л–є —Б–њ–Њ—Б–Њ–± –і–µ–є—Б—В–≤–Є—П –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ –љ–µ –Љ–Њ–≥—Г—В –њ–Њ–≤–ї–Є—П—В—М –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М—О.
–Ф–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤ —Ж–µ–ї—П—Е –і–Њ–Ї—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ–≥–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ –њ—А–Є –ї–µ—З–µ–љ–Є–Є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –У–≠–† –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Ґ–∞–Ї–ґ–µ –і–Њ–Ї—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–∞—Б—М –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П –Њ –µ–≥–Њ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є –љ–∞ –Љ–∞—В—М, –њ–ї–Њ–і –Є –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ.
–Ь–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Ф–∞–љ–љ–Њ–µ –Њ—В–Ї—А—Л—В–Њ–µ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ IV —Д–∞–Ј—Л –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ 7 –±–Њ–ї—М–љ–Є—Ж–∞—Е –Є —А–Њ–і–Є–ї—М–љ—Л—Е –і–Њ–Љ–∞—Е: 3 –≤ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є –Є 4 –≤ –Ѓ–ґ–љ–Њ––Р—Д—А–Є–Ї–∞–љ—Б–Ї–Њ–є –†–µ—Б–њ—Г–±–ї–Є–Ї–µ (–Ѓ–Р–†). –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –±–µ—А–µ–Љ–µ–љ–љ—Л–µ –ґ–µ–љ—Й–Є–љ—Л (<38 –љ–µ–і–µ–ї—М –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є) –≤ –≤–Њ–Ј—А–∞—Б—В–µ 18–40 –ї–µ—В, —Б—В—А–∞–і–∞—О—Й–Є–µ –Њ—В –Є–Ј–ґ–Њ–≥–Є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —В–µ–Ї—Г—Й–µ–є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є –Є—Б–њ—Л—В–∞–≤—И–Є–µ –Є–Ј–ґ–Њ–≥—Г –≤ —В–µ—З–µ–љ–Є–µ –њ—А–µ–і—Л–і—Г—Й–Є—Е 72 —З–∞—Б–Њ–≤. –Ш—Б–Ї–ї—О—З–∞–ї–Є—Б—М –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Б —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ—Л–Љ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ–Љ, –Ј–∞—В—А—Г–і–љ–µ–љ–љ—Л–Љ –≥–ї–Њ—В–∞–љ–Є–µ–Љ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М—О –і–Є–µ—В—Л —Б –њ–Њ–љ–Є–ґ–µ–љ–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –љ–∞—В—А–Є—П, –∞ —В–∞–Ї–ґ–µ —Г—З–∞—Б—В–≤—Г—О—Й–Є–µ –≤ –і—А—Г–≥–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б–њ—Л—В–∞–љ–Є–Є. –Ю—В –Ї–∞–ґ–і–Њ–є –њ–∞—Ж–Є–µ–љ—В–Ї–Є –њ–µ—А–µ–і –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ –µ–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–ї—Г—З–∞–ї–Є –њ–Є—Б—М–Љ–µ–љ–љ–Њ–µ –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ. –Ц–µ–љ—Й–Є–љ—Л –≤—Л–≤–Њ–і–Є–ї–Є—Б—М –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —В–Њ–ї—М–Ї–Њ —В–Њ–≥–і–∞, –Ї–Њ–≥–і–∞ –Њ–љ–Є –±–Њ–ї—М—И–µ –љ–µ –ґ–µ–ї–∞–ї–Є –њ—А–Њ–і–Њ–ї–ґ–∞—В—М —Б–≤–Њ–µ —Г—З–∞—Б—В–Є–µ.
–Т–≤–Є–і—Г —В–Њ–≥–Њ, —З—В–Њ –≤ —Б—В—А–∞–љ–∞—Е, –≥–і–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –љ–µ—В –і—А—Г–≥–Є—Е —А–∞–Ј—А–µ—И–µ–љ–љ—Л—Е –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ —Б—А–Њ–Ї–∞ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –ї–µ–Ї–∞—А—Б—В–≤ –Њ—В –Є–Ј–ґ–Њ–≥–Є –Є –±—Л–ї–Њ –љ–µ—Н—В–Є—З–љ—Л–Љ –њ—А–µ–Ї—А–∞—Й–∞—В—М –ї–µ—З–µ–љ–Є–µ –Є–ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ–ї–∞—Ж–µ–±–Њ, –≤ –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–µ –±—Л–ї–Њ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л.
–Ъ—А–Њ–Љ–µ –і–≤—Г—Е –њ–Њ—Б–µ—Й–µ–љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ (–Њ–і–Є–љ –і–ї—П –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –Њ–і–Є–љ –і–ї—П –Њ—Ж–µ–љ–Ї–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ—Б–ї–µ —З–µ—В—Л—А–µ—Е –љ–µ–і–µ–ї—М –ї–µ—З–µ–љ–Є—П), –њ–∞—Ж–Є–µ–љ—В–Ї–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–ї–Є—Б—М –≤–Њ –≤—А–µ–Љ—П –Ї–∞–ґ–і–Њ–≥–Њ –Њ–±—Л—З–љ–Њ–≥–Њ –њ–Њ—Б–µ—Й–µ–љ–Є—П –Ї–ї–Є–љ–Є–Ї–Є –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є –њ–Њ—Б–ї–µ —А–Њ–і–Њ–≤. –Т —В–µ—З–µ–љ–Є–µ 4––љ–µ–і–µ–ї—М–љ–Њ–≥–Њ —Б—А–Њ–Ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –ґ–µ–љ—Й–Є–љ—Л –і–Њ–ї–ґ–љ—Л –±—Л–ї–Є –њ—А–Є–љ–Є–Љ–∞—В—М 5–10 –Љ–ї –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ –У–µ–≤–Є—Б–Ї–Њ–љ –§–Њ—А—В–µ –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є —Б–љ—П—В–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ (–љ–µ –±–Њ–ї–µ–µ 40 –Љ–ї –≤ —Б—Г—В–Ї–Є). –Я–∞—Ж–Є–µ–љ—В–Ї–∞–Љ —А–∞–Ј—А–µ—И–∞–ї–Њ—Б—М –њ—А–Њ–і–Њ–ї–ґ–∞—В—М –ї–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ —З–µ—В—Л—А–µ—Е–љ–µ–і–µ–ї—М–љ–Њ–≥–Њ –Њ—Ж–µ–љ–Њ—З–љ–Њ–≥–Њ —Б—А–Њ–Ї–∞, –µ—Б–ї–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М –Є –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –±—Л–ї–Є —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–µ–љ—Л –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М—О –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –ї–µ—З–µ–љ–Є—П.
–Т–Њ –≤—А–µ–Љ—П –њ–Њ—Б–µ—Й–µ–љ–Є–є –і–ї—П –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –і–ї—П –Њ—Ж–µ–љ–Ї–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М —Б–Є–Љ–њ—В–Њ–Љ—Л –Є–Ј–ґ–Њ–≥–Є –Є —А–µ–≥—Г—А–≥–Є—В–∞—Ж–Є–Є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М –Є –њ–∞—Ж–Є–µ–љ—В–Ї–Є —В–∞–Ї–ґ–µ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –Њ–±—Й—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞ –њ–Њ –њ—П—В–Є–±–∞–ї–ї—М–љ–Њ–є —И–Ї–∞–ї–µ (–Њ—З–µ–љ—М —Е–Њ—А–Њ—И–∞—П, —Е–Њ—А–Њ—И–∞—П, –њ—А–Є–µ–Љ–ї–µ–Љ–∞—П, –њ–ї–Њ—Е–∞—П, –Њ—З–µ–љ—М –њ–ї–Њ—Е–∞—П). –Ц–µ–љ—Й–Є–љ—Л —В–∞–Ї–ґ–µ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Б—А–µ–і–љ–µ–µ –≤—А–µ–Љ—П –љ–∞—З–∞–ї–∞ —Б–љ–Є–ґ–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –ї–µ–Ї–∞—А—Б—В–≤–∞.
–Т–Њ –≤—А–µ–Љ—П –≤—Б–µ—Е –њ–Њ—Б–µ—Й–µ–љ–Є–є –≤ —В–µ—З–µ–љ–Є–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Ј–∞–њ–Є—Б—Л–≤–∞–ї–Є—Б—М —Б–ї—Г—З–∞–Є –љ–∞–ї–Є—З–Є—П/–Њ—В—Б—Г—В—Б—В–≤–Є—П –Є–Ј–ґ–Њ–≥–Є –Є —А–µ–≥—Г—А–≥–Є—В–∞—Ж–Є–Є –Њ—В –≤—А–µ–Љ–µ–љ–Є –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –њ–Њ—Б–µ—Й–µ–љ–Є—П.
–Я—А–Є –Ї–∞–ґ–і–Њ–Љ –њ–Њ—Б–µ—Й–µ–љ–Є–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —П–≤–ї–µ–љ–Є–Є –Є –Є–Ј–Љ–µ—А—П–ї–Њ—Б—М –Ї—А–Њ–≤—П–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ; —В–∞–Ї–ґ–µ –Ј–∞–њ–Є—Б—Л–≤–∞–ї–Є—Б—М –њ–Њ–і—А–Њ–±–љ–Њ—Б—В–Є –ї—О–±—Л—Е –і—А—Г–≥–Є—Е –Њ–±—Л—З–љ—Л—Е –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Њ—Ж–µ–љ–Њ–Ї —Б–Њ—Б—В–Њ—П–љ–Є—П –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Т–Њ –≤—А–µ–Љ—П –њ–Њ—Б–µ—Й–µ–љ–Є–є –і–ї—П –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –і–ї—П –Њ—Ж–µ–љ–Ї–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є–Ј–Љ–µ—А—П–ї–Є—Б—М —Н–ї–µ–Ї—В—А–Њ–ї–Є—В—Л –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ. –Ч–∞–њ–Є—Б—Л–≤–∞–ї–Є—Б—М –њ–Њ–і—А–Њ–±–љ–Њ—Б—В–Є —А–Њ–і–Њ–≤, –∞ —В–∞–Ї–ґ–µ —А–∞–Ј–≤–Є—В–Є–µ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ —А–µ–±–µ–љ–Ї–∞ –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –±–∞–ї–ї–Њ–≤ –њ–Њ —И–Ї–∞–ї–µ –Р–њ–≥–∞—А. –Т–Њ –≤—А–µ–Љ—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є—Б–Ї–ї—О—З–∞–ї–Є—Б—М –ї—О–±—Л–µ –ї–µ–Ї–∞—А—Б—В–≤–∞ –њ—А–Њ—В–Є–≤ –Є–Ј–ґ–Њ–≥–Є, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞. –Ю—В–Љ–µ—З–∞–ї–Є—Б—М –њ–Њ–і—А–Њ–±–љ–Њ—Б—В–Є –њ—А–Є–µ–Љ–∞ –≤—Б–µ—Е –ї–µ–Ї–∞—А—Б—В–≤ –≤–Њ –≤—А–µ–Љ—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤–Ї–ї—О—З–∞—П –Є—Е –µ–ґ–µ–і–љ–µ–≤–љ—Г—О –і–Њ–Ј—Г –Є —Б–Њ—Б—В–Њ—П–љ–Є—П, –њ–Њ –њ–Њ–≤–Њ–і—Г –Ї–Њ—В–Њ—А—Л—Е –њ—А–Є–љ–Є–Љ–∞–ї–Є—Б—М –і–∞–љ–љ—Л–µ –ї–µ–Ї–∞—А—Б—В–≤–∞.
–Ъ—А–Є—В–Є—З–µ—Б–Ї–Њ–є —В–Њ—З–Ї–Њ–є –њ–µ—А–≤–Є—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —П–≤–ї—П–ї–Њ—Б—М –Њ–±—Й–µ–µ –≤–њ–µ—З–∞—В–ї–µ–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П –Њ—В –ї–µ—З–µ–љ–Є—П –њ–Њ—Б–ї–µ —З–µ—В—Л—А–µ—Е –љ–µ–і–µ–ї—М, —З—В–Њ –Њ–±–Њ–±—Й–∞–ї–Њ—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–є —З–∞—Б—В–Њ—В—Л –і–ї—П –∞–љ–∞–ї–Є–Ј–Є—А—Г–µ–Љ—Л—Е –≥—А—Г–њ–њ (in¬tention–to–treat – ITT) –Є –≥—А—Г–њ–њ, –≥–і–µ –Љ–Њ–ґ–љ–Њ –±—Л–ї–Њ –Њ—Ж–µ–љ–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –•–µ–ї—М—Б–Є–љ–Ї—Б–Ї–Њ–є –Ф–µ–Ї–ї–∞—А–∞—Ж–Є–µ–є –Є –њ—А–∞–≤–Є–ї–∞–Љ–Є –љ–∞–і–ї–µ–ґ–∞—Й–µ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є. –Ь–µ—Б—В–љ—Л–µ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–µ —Н—В–Є—З–µ—Б–Ї–Є–µ –Ї–Њ–Љ–Є—В–µ—В—Л –Њ–і–Њ–±—А–Є–ї–Є –њ—А–Њ—В–Њ–Ї–Њ–ї –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–†–µ–Ј—Г–ї—М—В–∞—В—Л
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Є–љ–Є–Љ–∞–ї–Є —Г—З–∞—Б—В–Є–µ 150 –ґ–µ–љ—Й–Є–љ (–Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є—П, n=54; –Ѓ–Р–†, n=96). –Ч–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ —Н—В–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –≤ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є (–Т–Ъ) –Є –Ѓ–Р–† –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л (—В–∞–±–ї. 1), —Е–Њ—В—П –њ–∞—Ж–Є–µ–љ—В–Ї–Є –≤ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–∞ –±–Њ–ї–µ–µ —А–∞–љ–љ–Є—Е —Б—А–Њ–Ї–∞—Е –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Ф–≤–µ –њ–∞—Ж–Є–µ–љ—В–Ї–Є –≤—Л–±—Л–ї–Є –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–µ—А–µ–і –њ—А–Є–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≥—А—Г–њ–њ–∞ –њ–Њ –Њ—Ж–µ–љ–Ї–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 148 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї (–Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є—П, n=52; –Ѓ–Р–†, n=96). –Э–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Њ –Є—Б–Ї–ї—О—З–µ–љ–Њ –≤–Њ—Б–µ–Љ—М –ґ–µ–љ—Й–Є–љ (–Њ—В—Б—Г—В—Б—В–≤–Є–µ —Н—Д—Д–µ–Ї—В–∞ – 1, –љ–∞—А—Г—И–µ–љ–Є–µ –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є – 6 –Є –≤—Л—Е–Њ–і –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П – 1). –Я–Њ—Н—В–Њ–Љ—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–µ—В –і–∞–љ–љ—Л–µ –њ–Њ 142 –ґ–µ–љ—Й–Є–љ–∞–Љ (–Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є—П, n=49; –Ѓ–Р–†, n=93) (—В–∞–±–ї. 2). –Я–Њ 146 –њ–∞—Ж–Є–µ–љ—В–Ї–∞–Љ –µ—Б—В—М –і–∞–љ–љ—Л–µ –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ – –Њ–љ–Є –Є —Б–Њ—Б—В–∞–≤–Є–ї–Є –≥—А—Г–њ–њ—Г –Њ–±—А–∞–±–Њ—В–Ї–Є.
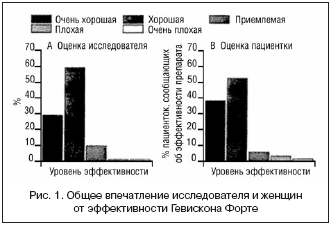
–Я–Њ—Б–ї–µ 4 –љ–µ–і–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М –Њ—Ж–µ–љ–Є–≤–∞–ї —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ –Ї–∞–Ї «–Њ—З–µ–љ—М —Е–Њ—А–Њ—И—Г—О» –Є–ї–Є «—Е–Њ—А–Њ—И—Г—О» (—В.–µ. —Б—З–Є—В–∞–ї –ї–µ—З–µ–љ–Є–µ —Г—Б–њ–µ—И–љ—Л–Љ) —Г 88% (95% CI, 82,0–93,1%) –њ–∞—Ж–Є–µ–љ—В–Њ–Ї (—А–Є—Б. 1–Р). –Т —Е–Њ–і–µ –≤—Б–µ—Е –њ–Њ—Б–µ—Й–µ–љ–Є–є –≤–Њ –≤—А–µ–Љ—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –ґ–µ–љ—Й–Є–љ—Л —Б–Њ–Њ–±—Й–∞–ї–Є –Њ–± –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞, –≤–Ї–ї—О—З–∞—П –Њ–±—Л—З–љ—Л–µ –њ–Њ—Б–µ—Й–µ–љ–Є—П –≤ —Е–Њ–і–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М —Б—З–Є—В–∞–ї –ї–µ—З–µ–љ–Є–µ —Г—Б–њ–µ—И–љ—Л–Љ –≤ 80% –њ–Њ—Б–µ—Й–µ–љ–Є–є.
–Ю—Ж–µ–љ–Ї–∞ –ґ–µ–љ—Й–Є–љ–∞–Љ–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –≤ —Е–Њ–і–µ –њ–Њ—Б–µ—Й–µ–љ–Є—П –њ–Њ—Б–ї–µ 4 –љ–µ–і–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–∞ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–∞ —Б –Њ—Ж–µ–љ–Ї–Њ–є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П, –њ—А–Є —Н—В–Њ–Љ 90% (95% CI, 83,6–94,1%) –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ –Ї–∞–Ї «–Њ—З–µ–љ—М —Е–Њ—А–Њ—И—Г—О» –Є–ї–Є «—Е–Њ—А–Њ—И—Г—О» (—А–Є—Б. 1–Т). –Т —Е–Њ–і–µ –≤—Б–µ—Е –њ–Њ—Б–µ—Й–µ–љ–Є–є –≤–Њ –≤—А–µ–Љ—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Њ—Б—М –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–µ –ї–µ–Ї–∞—А—Б—В–≤–Њ, –њ–∞—Ж–Є–µ–љ—В–Ї–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –ї–µ—З–µ–љ–Є–µ –Ї–∞–Ї —Г—Б–њ–µ—И–љ–Њ–µ –≤ 81% –њ–Њ—Б–µ—Й–µ–љ–Є–є.
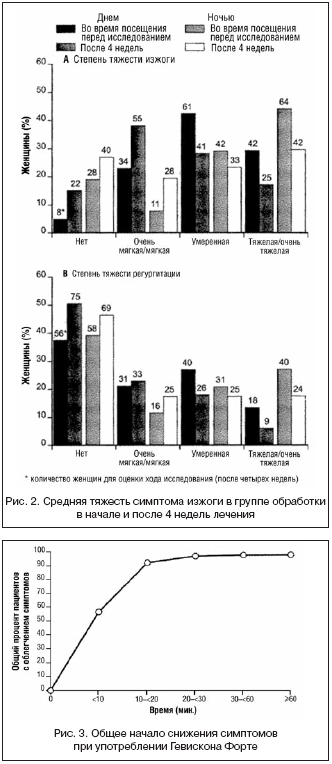
–І–∞—Б—В–Њ—В–∞ –Є —В—П–ґ–µ—Б—В—М –Є–Ј–ґ–Њ–≥–Є —Б–љ–Є–ґ–∞–ї–Є—Б—М –і–љ–µ–Љ –Є –љ–Њ—З—М—О (—А–Є—Б. 2). –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –ґ–µ–љ—Й–Є–љ —Б–Њ–Њ–±—Й–∞–ї–Є –Њ–± –Њ–±–ї–µ–≥—З–µ–љ–Є–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ 10 –Љ–Є–љ—Г—В (57%, n=83), –Є –њ–Њ—З—В–Є –≤—Б–µ —Б–Њ–Њ–±—Й–∞–ї–Є –Њ–± –Њ–±–ї–µ–≥—З–µ–љ–Є–Є –≤ —В–µ—З–µ–љ–Є–µ 20 –Љ–Є–љ—Г—В (93%, n=136) (—А–Є—Б. 3).
–Т –≥—А—Г–њ–њ–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є (n=148) —Б—А–µ–і–љ—П—П –µ–ґ–µ–і–љ–µ–≤–љ–∞—П –і–Њ–Ј–∞ –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 12,8 –Љ–ї —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –≤ –Т–Ъ –Є 19,7 –Љ–ї —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –≤ –Ѓ–Р–†. –Я–Њ—Б–ї–µ –њ–µ—А–≤–Њ–≥–Њ —З–µ—В—Л—А–µ—Е–љ–µ–і–µ–ї—М–љ–Њ–≥–Њ —Б—А–Њ–Ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М —Б—З–Є—В–∞–ї –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –і–ї—П 82% –ґ–µ–љ—Й–Є–љ (n=122) –њ—А–Њ–і–Њ–ї–ґ–Є—В—М –њ—А–Є–µ–Љ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞. –Ш–Ј –љ–Є—Е 120 (81% –≤—Б–µ—Е –ґ–µ–љ—Й–Є–љ) –≤—Л—А–∞–Ј–Є–ї–Є –ґ–µ–ї–∞–љ–Є–µ —Н—В–Њ —Б–і–µ–ї–∞—В—М. –Ґ–µ, –Ї—В–Њ –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ –ї–µ—З–µ–љ–Є—П —Б–Њ—З–ї–Є –і–ї—П —Б–µ–±—П –љ–µ–њ–Њ–і—Е–Њ–і—П—Й–Є–Љ, –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ —Б–Њ–Њ–±—Й–∞–ї–Є, —З—В–Њ –Є–Љ «–љ–µ –љ—А–∞–≤–Є–ї—Б—П –≤–Ї—Г—Б» –Є–ї–Є –њ–Њ—В–Њ–Љ—Г, —З—В–Њ –Њ–љ–Є —Г–ґ–µ —А–Њ–і–Є–ї–Є. –Э–Њ –љ–Є –і–ї—П –Њ–і–љ–Њ–є –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Н—В–Њ –љ–µ –±—Л–ї–Њ –≤—Л–Ј—Л–≤–∞–љ–Њ —Б–Њ–Њ–±—А–∞–ґ–µ–љ–Є—П–Љ–Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є.
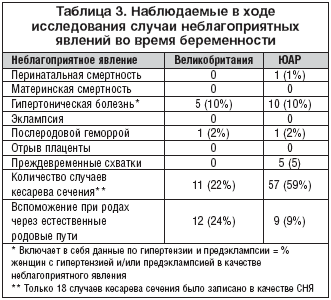
–Ш–Ј 148 –ґ–µ–љ—Й–Є–љ, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–µ –ї–µ–Ї–∞—А—Б—В–≤–Њ, 90 (61%; –Т–Ъ – n=43; –Ѓ–Р–† – n=47) —Б–Њ–Њ–±—Й–∞–ї–Є –Њ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П—Е (–Њ–±—Й–Є–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ 240) –≤ —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —В–Њ–ї—М–Ї–Њ –і–µ–≤—П—В—М –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —Б—З–Є—В–∞–ї–Є—Б—М «–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ» –Є–ї–Є «–≤–µ—А–Њ—П—В–љ–Њ» —Б–≤—П–Ј–∞–љ–љ—Л–Љ–Є —Б –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–Њ–Љ. –£ 25 –ґ–µ–љ—Й–Є–љ (17%) –±—Л–ї–Њ 46 –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є (–Э–Я), –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А—Г–µ–Љ—Л—Е –Ї–∞–Ї —Б–µ—А—М–µ–Ј–љ—Л–µ; –Є–Ј –љ–Є—Е —З–∞—Й–µ –≤—Б–µ–≥–Њ —Б–Њ–Њ–±—Й–∞–ї–Њ—Б—М –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Ї–µ—Б–∞—А–µ–≤–∞ —Б–µ—З–µ–љ–Є—П (18 –ґ–µ–љ—Й–Є–љ).
–£ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –ґ–µ–љ—Й–Є–љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –±—Л–ї–Є –≤ –њ—А–µ–і–µ–ї–∞—Е –љ–Њ—А–Љ—Л –Є–ї–Є –Є–Љ–µ–ї–Є –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П. –£ –Њ–і–љ–Њ–є –њ–∞—Ж–Є–µ–љ—В–Ї–Є –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –Ї–∞–ї–Є—П.
–Ъ—А–Њ–Љ–µ –Э–Я, –Њ –Ї–Њ—В–Њ—А—Л—Е —Б–Њ–Њ–±—Й–∞–ї–Є –њ–∞—Ж–Є–µ–љ—В–Ї–Є, 10 –Э–Я –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ —Г 10 –њ–ї–Њ–і–Њ–≤ –Є 33 –Э–Я —Г 23 –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е. –°–∞–Љ—Л–Љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –Э–Я –і–ї—П –њ–ї–Њ–і–∞ –±—Л–ї–Њ —Г–≥–љ–µ—В–µ–љ–Є–µ –њ–ї–Њ–і–∞ (—В—А–Є —Б–ї—Г—З–∞—П —Г —В—А–µ—Е –њ–ї–Њ–і–Њ–≤), –Є –і–ї—П –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е – –њ–Њ—Б—В–љ–∞—В–∞–ї—М–љ–∞—П –Є–ї–Є –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П (14 —Б–ї—Г—З–∞–µ–≤ —Г 12 –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е). –Э–Є –Њ–і–Є–љ –Є–Ј —Б–ї—Г—З–∞–µ–≤ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –њ–ї–Њ–і –Є–ї–Є –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ –љ–µ —Б—З–Є—В–∞–ї–Є—Б—М «–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ» –Є–ї–Є «–≤–µ—А–Њ—П—В–љ–Њ» —Б–≤—П–Ј–∞–љ–љ—Л–Љ–Є —Б –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–Њ–Љ.
–Т—Б–µ —Б–ї—Г—З–∞–Є —Б–µ—А—М–µ–Ј–љ—Л—Е –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —П–≤–ї–µ–љ–Є–є (–°–Э–ѓ) –і–ї—П –њ–ї–Њ–і–∞ –љ–∞—Б—В—Г–њ–∞–ї–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б —В–∞–Ї–Њ–≤—Л–Љ–Є —Г –Љ–∞—В–µ—А–Є, –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –њ—А–Є –Ї–µ—Б–∞—А–µ–≤–Њ–Љ —Б–µ—З–µ–љ–Є–Є. –®–µ—Б—В—М —Б–ї—Г—З–∞–µ–≤ –°–Э–ѓ –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л —Г 6 –њ–ї–Њ–і–Њ–≤ (–≤–Ї–ї—О—З–∞—П —Г–≥–љ–µ—В–µ–љ–Є–µ –њ–ї–Њ–і–∞ –Є —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–Њ –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П) –Є 10 –°–Э–ѓ –±—Л–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —Г 8 –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е (–≤–Ї–ї—О—З–∞—П –±–Њ–ї—М –≤ –ґ–Є–≤–Њ—В–µ –Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –ї–µ–≥–Ї–Є—Е). –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є—Е —Н—В–Є—Е –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —П–≤–ї–µ–љ–Є–є –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А–Њ–≤–∞–ї–Є—Б—М –Ї–∞–Ї —Б–µ—А—М–µ–Ј–љ—Л–µ, –њ–Њ—В–Њ–Љ—Г —З—В–Њ –Њ–љ–Є —В—А–µ–±–Њ–≤–∞–ї–Є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–ї–Є —Г–≥—А–Њ–ґ–∞–ї–Є –ґ–Є–Ј–љ–Є. –Ю–і–Є–љ –њ–ї–Њ–і —Г–Љ–µ—А (–Њ–і–Є–љ –Є–Ј –±–ї–Є–Ј–љ–µ—Ж–Њ–≤) –њ–Њ—Б–ї–µ –Ї–µ—Б–∞—А–µ–≤–∞ —Б–µ—З–µ–љ–Є—П. –Э–Є –Њ–і–Є–љ –Є–Ј —Б–ї—Г—З–∞–µ–≤ –°–Э–ѓ —Г –ґ–µ–љ—Й–Є–љ, –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –Є–ї–Є –њ–ї–Њ–і–Њ–≤ –љ–µ —Б—З–Є—В–∞–ї—Б—П —Б–≤—П–Ј–∞–љ–љ—Л–Љ —Б –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–Њ–Љ.
–£ 142 –Љ–∞—В–µ—А–µ–є —А–Њ–і–Є–ї–Њ—Б—М 145 –і–µ—В–µ–є (—Г —В—А–µ—Е –Љ–∞—В–µ—А–µ–є —А–Њ–і–Є–ї–Є—Б—М –і–≤–Њ–є–љ–Є). –Ч–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –Њ–і–љ–Њ–≥–Њ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ (–Њ–і–љ–Њ–≥–Њ –Є–Ј –±–ї–Є–Ј–љ–µ—Ж–Њ–≤), –њ–Њ –Ї–Њ—В–Њ—А—Л–Љ –Є–Љ–µ–ї–Є—Б—М –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤—Л–µ –і–∞–љ–љ—Л–µ, –Њ—Б—В–∞–ї—М–љ—Л–µ –±—Л–ї–Є –ґ–Є–≤—Л–Љ–Є –њ—А–Є —А–Њ–і–∞—Е. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –і–µ—В–µ–є (93%, n=135) —А–Њ–і–Є–ї–Є—Б—М –њ–Њ—Б–ї–µ 36–44 –љ–µ–і–µ–ї—М –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є; –Њ—Б—В–∞–ї—М–љ—Л–µ 7% (n=10) –±—Л–ї–Є –љ–µ–і–Њ–љ–Њ—И–µ–љ–љ—Л–Љ–Є (<36 –љ–µ–і–µ–ї—М –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є). –°—А–µ–і–љ–Є–є —Б—А–Њ–Ї –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є —Б–Њ—Б—В–∞–≤–ї—П–ї 38,9 –љ–µ–і–µ–ї—М (SD 1,8, –і–Є–∞–њ–∞–Ј–Њ–љ 32–42 –љ–µ–і–µ–ї—М).
–С–∞–ї–ї—Л –Р–њ–≥–∞—А —Б–Њ—Б—В–∞–≤–ї—П–ї–Є –Є–ї–Є –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–ї–Є—Б—М –±–Њ–ї–µ–µ 7 –і–ї—П 93% –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –≤–Њ –≤—А–µ–Љ—П –њ–µ—А–≤–Є—З–љ–Њ–є –Ј–∞–њ–Є—Б–Є –Є –і–ї—П 99% –њ—А–Є –њ–Њ–≤—В–Њ—А–љ–Њ–є –Ј–∞–њ–Є—Б–Є. –Э–∞–±–ї—О–і–∞–µ–Љ—Л–µ –≤ –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —П–≤–ї–µ–љ–Є—П —Г–Ї–∞–Ј–∞–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 3.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Я—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, —Б–Ї–Њ—А–µ–µ, —П–≤–ї—П—О—В—Б—П –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ, –∞ –љ–µ –њ—А–∞–≤–Є–ї–Њ–Љ. –≠—В–Њ –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –±–µ—Б–њ–Њ–Ї–Њ–є—Б—В–≤–Њ–Љ –≤—А–∞—З–µ–є –Є –Љ–∞—В–µ—А–µ–є –Ј–∞ –±–ї–∞–≥–Њ–њ–Њ–ї—Г—З–Є–µ –њ–ї–Њ–і–∞. –•–Њ—В—П –Є–Ј–ґ–Њ–≥–∞ —З–∞—Б—В–Њ —Б—З–Є—В–∞–µ—В—Б—П –љ–µ–±–Њ–ї—М—И–Є–Љ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–Њ–Љ –њ—А–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –Є–Љ–µ—П –Њ–±—Л—З–љ–Њ –Љ—П–≥–Ї—Г—О –Є–ї–Є —Б—А–µ–і–љ—О—О –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М, –Є –њ—А–Њ—Е–Њ–і–Є—В –њ–Њ—Б–ї–µ —А–Њ–і–Њ–≤, –Њ–љ–∞ –Љ–Њ–ґ–µ—В –≤—Л–Ј–≤–∞—В—М –±–Њ–ї—М—И–µ–µ –љ–µ–і–Њ–Љ–Њ–≥–∞–љ–Є–µ, —З–µ–Љ –і—А—Г–≥–Є–µ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –±–Њ–ї–µ–µ —Б–µ—А—М–µ–Ј–љ—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П. –Я—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –ї–µ—З–µ–љ–Є—П –Є–Ј–ґ–Њ–≥–∞ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –љ–∞—А—Г—И–µ–љ–Є—О —Б–љ–∞ –Є –њ–Є—Й–µ–≤–∞—А–µ–љ–Є—П, –Є —В–µ–Љ —Б–∞–Љ—Л–Љ –Њ–Ї–∞–Ј–∞—В—М –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –њ–Є—Й–µ–≤–∞—А–µ–љ–Є–µ –Є —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Љ–∞—В–µ—А–Є. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ, –љ–Њ –Љ–∞–ї–Њ –Њ–±—Б—Г–ґ–і–∞–µ–Љ—Л–Љ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–µ–Љ –±–Њ–ї–µ–Ј–љ–Є —А–µ–≥—Г—А–≥–Є—В–∞—Ж–Є–Є —П–≤–ї—П–µ—В—Б—П –±—А–Њ–љ—Е–Њ—Б–њ–∞–Ј–Љ, —З–µ–Љ—Г —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —В–Њ, —З—В–Њ –Њ—В—А—Л–≥–Є–≤–∞–µ–Љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї –і–Њ—Б—В–Є–≥–∞–µ—В –љ–Є–ґ–љ–Є—Е –≤–Њ–Ј–і—Г—Е–Њ–љ–Њ—Б–љ—Л—Е –њ—Г—В–µ–є.
–У–≠–† –Є –Є–Ј–ґ–Њ–≥–∞ —В—А–µ–±—Г—О—В –±—Л—Б—В—А–Њ–≥–Њ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –Т —Б–ї—Г—З–∞–µ —Б –±–µ—А–µ–Љ–µ–љ–љ—Л–Љ–Є –ґ–µ–љ—Й–Є–љ–∞–Љ–Є —Б—Г—Й–µ—Б—В–≤—Г—О—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Њ–њ–∞—Б–µ–љ–Є—П –Ј–∞ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ–ї–Њ–і–∞. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –≥–ї–∞–≤–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л –Њ—А–≥–∞–љ–Њ–≤ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –Ј–∞ 12 –љ–µ–і–µ–ї—М, –Є –њ–µ—А–Є–Њ–і —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї –њ–Њ—А–Њ–Ї–∞–Љ —А–∞–Ј–≤–Є—В–Є—П —Б—Г—Й–µ—Б—В–≤—Г–µ—В –≤ —В–µ—З–µ–љ–Є–µ 16 –љ–µ–і–µ–ї—М –њ–Њ—Б–ї–µ –Ј–∞—З–∞—В–Є—П, –ї–µ–Ї–∞—А—Б—В–≤–∞, –њ—А–Є–љ–Є–Љ–∞–µ–Љ—Л–µ –љ–∞ –±–Њ–ї–µ–µ –њ–Њ–Ј–і–љ–Є—Е —Б—А–Њ–Ї–∞—Е –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В –љ–∞—А—Г—И–Є—В—М —А–∞–Ј–≤–Є—В–Є–µ –њ–ї–Њ–і–∞. –Я–Њ—Н—В–Њ–Љ—Г –ї—О–±–Њ–µ –ї–µ—З–µ–љ–Є–µ, –љ–µ —Б–≤—П–Ј–∞–љ–љ–Њ–µ —Б —Б–Є—Б—В–µ–Љ–љ—Л–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ, —П–≤–ї—П–µ—В—Б—П –±–Њ–ї–µ–µ –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ –і–ї—П –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ.
–У–µ–≤–Є—Б–Ї–Њ–љ –§–Њ—А—В–µ –Є–Љ–µ–µ—В –љ–µ—Б–Є—Б—В–µ–Љ–љ—Л–є —Б–њ–Њ—Б–Њ–± –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П, –Њ–±—А–∞–Ј—Г—П –≤—П–Ј–Ї–Є–є, –њ–Њ—З—В–Є –љ–µ–є—В—А–∞–ї—М–љ—Л–є «–њ–ї–Њ—В» —Б –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В—М—О, –Ї–Њ—В–Њ—А—Л–є –њ–ї–∞–≤–∞–µ—В –љ–∞–і —Б–Њ–і–µ—А–ґ–Є–Љ—Л–Љ –ґ–µ–ї—Г–і–Ї–∞, —Д–Є–Ј–Є—З–µ—Б–Ї–Є –њ—А–µ–≥—А–∞–ґ–і–∞—П –µ–≥–Њ –њ–Њ–њ–∞–і–∞–љ–Є–µ –≤ –њ–Є—Й–µ–≤–Њ–і. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, —Б–њ–Њ—Б–Њ–± –µ–≥–Њ –і–µ–є—Б—В–≤–Є—П –љ–µ –і–Њ–ї–ґ–µ–љ –Њ–Ї–∞–Ј—Л–≤–∞—В—М –≤–ї–Є—П–љ–Є—П –љ–∞ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М—О, –Є –µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –љ–µ –і–Њ–ї–ґ–љ–Њ –њ—А–µ–і—Б—В–∞–≤–ї—П—В—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Њ–њ–∞—Б–љ–Њ—Б—В–Є –і–ї—П –Љ–∞—В–µ—А–Є –Є–ї–Є —А–µ–±–µ–љ–Ї–∞.
–Т –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е —А–∞–љ–µ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ –ї–µ—З–µ–љ–Є—О –Є–Ј–ґ–Њ–≥–Є –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є —Б–Њ–±–ї—О–і–∞–ї—Б—П —Г—Б—В–Њ–є—З–Є–≤—Л–є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Ї–Њ—А–Њ—В–Ї–Є–є —Б—А–Њ–Ї –ї–µ—З–µ–љ–Є—П.
–Т –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ—Б—В—М —Н—В–Њ–Љ—Г, –≤ —В–µ–Ї—Г—Й–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б–Њ—Б—В–Њ—П–љ–Є–µ –ґ–µ–љ—Й–Є–љ –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –њ—А–Є –Ї–∞–ґ–і–Њ–Љ –Њ–±—Л—З–љ–Њ–Љ –њ–Њ—Б–µ—Й–µ–љ–Є–Є –Ї–ї–Є–љ–Є–Ї–Є –≤ —Е–Њ–і–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є –њ–Њ—Б–ї–µ —А–Њ–і–Њ–≤, –∞ —В–∞–Ї–ґ–µ –≤ —Е–Њ–і–µ –њ–Њ—Б–µ—Й–µ–љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ, –њ–Њ—Б–ї–µ —З–µ—В—Л—А–µ—Е –љ–µ–і–µ–ї—М –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –ґ–µ–љ—Й–Є–љ–∞–Љ —А–∞–Ј—А–µ—И–∞–ї–Њ—Б—М –љ–∞—З–Є–љ–∞—В—М –Є –њ—А–µ–Ї—А–∞—Й–∞—В—М –њ—А–Є–µ–Љ –ї–µ–Ї–∞—А—Б—В–≤–∞ –њ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є. –Я–Њ—Н—В–Њ–Љ—Г —Г—Б–ї–Њ–≤–Є—П –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є –±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Є–Љ–Є, —З—В–Њ –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. –Ю—Б–љ–Њ–≤–∞–љ–Є—П –і–ї—П –±–µ—Б–њ–Њ–Ї–Њ–є—Б—В–≤–∞ –њ–Њ –њ—А–Є—З–Є–љ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –ї–µ–Ї–∞—А—Б—В–≤–∞ –±—Л–ї–Є —Б–≤–µ–і–µ–љ—Л –Ї –Љ–Є–љ–Є–Љ—Г–Љ—Г. –Т –њ–Њ–і–і–µ—А–ґ–Ї—Г —Н—В–Њ–≥–Њ –≥–Њ–≤–Њ—А–Є—В —Е–Њ—А–Њ—И–Є–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є—П –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–∞—Ж–Є–µ–љ—В–Ї–∞–Љ–Є, –Є —В–Њ, —З—В–Њ –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤—Л–µ –і–∞–љ–љ—Л–µ –Є–Љ–µ–ї–Є—Б—М –њ–Њ 95% —Г—З–∞—Б—В–≤–Њ–≤–∞–≤—И–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–Ї. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –ґ–µ–љ—Й–Є–љ –≤—Л—А–∞–Ј–Є–ї–Є —Б–Њ–≥–ї–∞—Б–Є–µ –њ—А–Њ–і–Њ–ї–ґ–∞—В—М –њ—А–Є–µ–Љ –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ –њ–Њ—Б–ї–µ 4 –љ–µ–і–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Т –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В–µ —Б–Њ–≤–њ–∞–і–∞–ї–Є –Њ—Ж–µ–љ–Ї–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П –Є –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ —Б—А–Њ–Ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Є —Н—В–Њ–Љ –Њ–±–µ —Б—В–Њ—А–Њ–љ—Л –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –ї–µ—З–µ–љ–Є–µ —Б –њ–Њ–Љ–Њ—Й—М—О –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ –Ї–∞–Ї —Г—Б–њ–µ—И–љ–Њ–µ –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ –≤ 90% —Б–ї—Г—З–∞–µ–≤. –≠—В–Њ –Є–љ—В–µ—А–µ—Б–љ–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г (–Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤) —З–∞—Б—В–Њ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —А–∞—Б—Е–Њ–ґ–і–µ–љ–Є–µ –Љ–µ–ґ–і—Г –Љ–љ–µ–љ–Є—П–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П –Є –њ–∞—Ж–Є–µ–љ—В–∞ –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П. –Ф–∞–љ–љ–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –Љ–Њ–ґ–µ—В —Г–Ї–∞–Ј—Л–≤–∞—В—М, —З—В–Њ –Є—Б—Б–ї–µ–і—Г–µ–Љ–∞—П –≥—А—Г–њ–њ–∞ (–±–µ—А–µ–Љ–µ–љ–љ—Л–µ –ґ–µ–љ—Й–Є–љ—Л) –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ –Є–Љ–µ–µ—В –ґ–∞–ї–Њ–±—Л –љ–∞ —А–µ–≥—Г—А–≥–Є—В–∞—Ж–Є—О –Є –ї—Г—З—И–µ –Њ—В–≤–µ—З–∞–µ—В –љ–∞ –ї–µ—З–µ–љ–Є–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞, –Ї–Њ—В–Њ—А—Л–є —А–∞–Ј—А–∞–±–Њ—В–∞–љ –і–ї—П –ї–µ—З–µ–љ–Є—П —А–µ–≥—Г—А–≥–Є—В–∞—Ж–Є–Є —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ –ґ–µ–ї—Г–і–Ї–∞.
–Ґ–∞–Ї –Ї–∞–Ї –і–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–µ–і–љ–∞–Ј–љ–∞—З–∞–ї–Њ—Б—М –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –і–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є, –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є –њ—А–∞–≤–Є–ї—М–љ–Њ—Б—В–Є –і–Њ–Ј–Є—А–Њ–≤–Ї–Є –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ –њ—А–Є –µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –і–ї—П –ї–µ—З–µ–љ–Є—П –Є–Ј–ґ–Њ–≥–Є –њ—А–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –±—Л–ї–Њ —А–µ—И–µ–љ–Њ, —З—В–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ–ї–∞—Ж–µ–±–Њ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л—Е —Ж–µ–ї—П—Е –љ–µ –±—Г–і–µ—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞—В—М –Є–љ—В–µ—А–µ—Б–∞–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Т –њ—А–µ–і—Л–і—Г—Й–µ–Љ –Њ—В–Ї—А—Л—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б —Г—З–∞—Б—В–Є–µ–Љ 50 –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б—Г—Б–њ–µ–љ–Ј–Є–Є –∞–ї—М–≥–Є–љ–∞—В–∞ (–У–µ–≤–Є—Б–Ї–Њ–љ–∞®) –њ–Њ–ї—Г—З–Є–ї–∞ –Њ—Ж–µ–љ–Ї–Є «–Њ—З–µ–љ—М —Е–Њ—А–Њ—И–∞—П» –Є «—Е–Њ—А–Њ—И–∞—П» –≤ 72% —Б–ї—Г—З–∞–µ–≤. –Ы—Г—З—И–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –У–µ–≤–Є—Б–Ї–Њ–љ –§–Њ—А—В–µ –≤ –љ–∞—Б—В–Њ—П—Й–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Љ–Њ–ґ–µ—В –Њ–±—К—П—Б–љ—П—В—М—Б—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є, –≤–Ї–ї—О—З–∞—П –±–Њ–ї—М—И–Є–є —А–∞–Ј–Љ–µ—А –≥—А—Г–њ–њ—Л, —А–µ–ґ–Є–Љ –і–Њ–Ј–Є—А–Њ–≤–Ї–Є –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П. –Ґ–∞–Ї–ґ–µ —Н—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–Њ (–њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ, —З–∞—Б—В–Є—З–љ–Њ) —Б —Г–љ–Є–Ї–∞–ї—М–љ—Л–Љ —Б–Њ—Б—В–∞–≤–Њ–Љ —Д–Њ—А–Љ—Г–ї—Л –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –∞–ї—М–≥–Є–љ–∞—В–∞ —Б–≤—П–Ј–∞–љ–∞ —Б–Њ —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –Њ–±—А–∞–Ј—Г–µ–Љ—Л—Е –Є–Љ–Є –њ–ї–Њ—В–Њ–≤, —В.–µ. —Б–Є–ї–Њ–є –Є —А–∞—Б—В—П–ґ–Є–Љ–Њ—Б—В—М—О –њ–ї–Њ—В–∞, –Љ–µ—Б—В–Њ–Љ –µ–≥–Њ –љ–∞—Е–Њ–ґ–і–µ–љ–Є—П –Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –≤ –ґ–µ–ї—Г–і–Ї–µ. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П in vitro —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є –ї—Г—З—И–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ –ї–µ–Ї–∞—А—Б—В–≤–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –∞–ї—М–≥–Є–љ–∞—В–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —В–∞–Ї–ґ–µ –њ—А–µ–≤–Њ—Б—Е–Њ–і—П—В —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–≤–Њ–і–Є–≤—И–Є—Е—Б—П —Б—А–µ–і–Є –љ–µ –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т –Њ–і–љ–Њ–Љ –Є–Ј –њ—А–Њ—И–ї—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –У–µ–≤–Є—Б–Ї–Њ–љ –§–Њ—А—В–µ –≤ –і–Њ–Ј–µ 10 –Љ–ї —Б—А–∞–≤–љ–Є–≤–∞–ї—Б—П —Б –њ–ї–∞—Ж–µ–±–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –Є–Ј–ґ–Њ–≥–Є –Є —А–µ–≥—Г—А–≥–Є—В–∞—Ж–Є–Є. –Т —В–Њ–Љ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ 84% –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Њ—Ж–µ–љ–Є–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ –Ї–∞–Ї «–Њ—З–µ–љ—М —Е–Њ—А–Њ—И—Г—О» –Є–ї–Є «—Е–Њ—А–Њ—И—Г—О» –њ–Њ—Б–ї–µ 4 –љ–µ–і–µ–ї—М –ї–µ—З–µ–љ–Є—П, –≤ –љ–∞—Б—В–Њ—П—Й–µ–Љ –ґ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є – 90%.
–Т –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –ґ–µ–љ—Й–Є–љ (57%) —Б–Њ–Њ–±—Й–∞–ї–Є –Њ –±—Л—Б—В—А–Њ–Љ –љ–∞—З–∞–ї–µ –і–µ–є—Б—В–≤–Є—П –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ –≤ —В–µ—З–µ–љ–Є–µ 10 –Љ–Є–љ—Г—В, –Є –њ–Њ—З—В–Є –≤—Б–µ (93%) —Б–Њ–Њ–±—Й–∞–ї–Є –Њ –љ–∞—З–∞–ї–µ –і–µ–є—Б—В–≤–Є—П –≤ —В–µ—З–µ–љ–Є–µ 20 –Љ–Є–љ—Г—В. –≠—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –і–∞–љ–љ—Л–Љ –њ—А–µ–і—Л–і—Г—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А–Њ–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ –њ–Њ—З—В–Є –Љ–≥–љ–Њ–≤–µ–љ–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–Э –≤ –њ–Є—Й–µ–≤–Њ–і–µ –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –ґ–Є–і–Ї–Њ–≥–Њ –∞–ї—М–≥–Є–љ–∞—В–∞. –Т –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б–љ–Є–ґ–µ–љ–Є–µ —В—П–ґ–µ—Б—В–Є –Є —З–∞—Б—В–Њ—В—Л –і–љ–µ–≤–љ—Л—Е –Є –љ–Њ—З–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –њ–Њ—Б–ї–µ —З–µ—В—Л—А–µ—Е –љ–µ–і–µ–ї—М. –Э–Њ—З–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –Љ–Њ–≥—Г—В –±—Л—В—М –Њ—Б–Њ–±–µ–љ–љ–Њ –±–µ—Б–њ–Њ–Ї–Њ—П—Й–Є–Љ–Є –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –љ–∞—А—Г—И–∞—О—Й–Є–Љ–Є —Б–Њ–љ, –≤ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –≤–Њ –≤—А–µ–Љ—П —В—А–µ—В—М–µ–≥–Њ —В—А–Є–Љ–µ—Б—В—А–∞ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Э–∞—А—Г—И–µ–љ–Є—П —Б–љ–∞ —З–∞—Б—В–Њ –љ–∞–±–ї—О–і–∞—О—В—Б—П –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є –Љ–Њ–≥—Г—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г—Е—Г–і—И–∞—В—М —Б–Њ—Б—В–Њ—П–љ–Є–µ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞.
–Т –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б–∞–Љ—Л–Љ–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ–Є –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П–Љ–Є, –Њ –Ї–Њ—В–Њ—А—Л—Е —Б–Њ–Њ–±—Й–∞–ї–Є –ґ–µ–љ—Й–Є–љ—Л, –±—Л–ї–Є —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞, –≤—Л–Ј–≤–∞–љ–љ—Л–µ —Б–∞–Љ–Њ–є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М—О –Є–ї–Є —Г—Е—Г–і—И–∞—О—Й–Є–µ—Б—П –њ—А–Є –µ–µ —В–µ—З–µ–љ–Є–Є, –Є –Ї–Њ—В–Њ—А—Л–µ —Б—З–Є—В–∞–ї–Є—Б—М –љ–µ —Б–≤—П–Ј–∞–љ–љ—Л–Љ–Є —Б –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–Њ–Љ. –°–ї—Г—З–∞–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–є –љ–∞ –њ–ї–Њ–і –Є–ї–Є –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ —А–µ–±–µ–љ–Ї–∞ –±—Л–ї–Є –Њ—З–µ–љ—М —А–µ–і–Ї–Є–Љ–Є –Є —Б–Њ–≤–њ–∞–і–∞–ї–Є —Б –Њ–ґ–Є–і–∞–µ–Љ—Л–Љ–Є, –љ–Њ –љ–Є –Њ–і–Є–љ –Є–Ј –љ–Є—Е –љ–µ —Б—З–Є—В–∞–ї—Б—П –≤—Л–Ј–≤–∞–љ–љ—Л–Љ –њ—А–Є–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –љ–µ–±–Њ–ї—М—И–Њ–µ —А–∞–Ј–ї–Є—З–Є–µ –≤ —Б—А–µ–і–љ–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –љ–∞—В—А–Є—П –Є–ї–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ї–∞–ї–Є—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ —Г –Љ–∞—В–µ—А–µ–є –њ–Њ—Б–ї–µ 4 –љ–µ–і–µ–ї—М –ї–µ—З–µ–љ–Є—П.
–Т —Ж–µ–ї–Њ–Љ –Ї–∞–Ї –њ–∞—Ж–Є–µ–љ—В—Л, —В–∞–Ї –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є —Г–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –У–µ–≤–Є—Б–Ї–Њ–љ –§–Њ—А—В–µ –±—Л—Б—В—А–Њ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Б–љ–Є–ґ–∞–ї —Б–Є–Љ–њ—В–Њ–Љ—Л –ґ–µ–ї—Г–і–Њ—З–љ–Њ––њ–Є—Й–µ–≤–Њ–і–љ–Њ–≥–Њ —А–µ—Д–ї—О–Ї—Б–∞. –Ю—В—Б—Г—В—Б—В–≤–Є–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –њ—А–Є–µ–Љ–Њ–Љ –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ, —П–≤–ї—П–µ—В—Б—П –Њ–±–љ–∞–і–µ–ґ–Є–≤–∞—О—Й–Є–Љ –Є –њ—А–µ–і—Б–Ї–∞–Ј—Г–µ–Љ—Л–Љ, —В–∞–Ї –Ї–∞–Ї –і–∞–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –Є–Љ–µ–µ—В –Љ–µ—Б—В–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ф–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –У–µ–≤–Є—Б–Ї–Њ–љ –§–Њ—А—В–µ –≤ –і–Њ–Ј–µ 5–10 –Љ–ї (–≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є) —П–≤–ї—П–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –і–ї—П –Њ–±–ї–µ–≥—З–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є–Ј–ґ–Њ–≥–Є –Є —А–µ–≥—Г—А–≥–Є—В–∞—Ж–Є–Є –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є –Њ—В–ї–Є—З–∞–µ—В—Б—П –±—Л—Б—В—А–Њ—В–Њ–є –і–µ–є—Б—В–≤–Є—П. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –У–µ–≤–Є—Б–Ї–Њ–љ–∞ –§–Њ—А—В–µ –і–ї—П –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ.
–С–ї–∞–≥–Њ–і–∞—А–љ–Њ—Б—В—М
–Р–≤—В–Њ—А—Л –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤—Л—А–∞–ґ–∞—О—В –±–ї–∞–≥–Њ–і–∞—А–љ–Њ—Б—В—М –і–—А—Г –£–Њ–ї–ї—Г (–Т–Њ–Ї–Є–љ–≥, –°–∞—А—А–µ–є, –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є—П), –і–—А—Г –†–Є—Б (–І–µ–ї–Љ—Б—Д–Њ—А–і, –≠—Б—Б–µ–Ї—Б, –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є—П), –і–—А—Г –Ь–∞—А–∞–Ј–Ј–Є (–Ы–µ–Ј–µ—А—Е–µ–і, –°–∞—А—А–µ–є, –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є—П), –і–—А—Г –Ь–∞–Ї –Ш–љ—В–∞–Є—А—Г (–Щ–Њ—Е–∞–љ–љ–µ—Б–±—Г—А–≥, –Ѓ–Р–†), –і–—А—Г –Р–ї—М–њ–µ—А—И—В–∞–є–љ—Г (–Ъ–µ–є—В–њ–∞—Г–љ, –Ѓ–Р–†), –і–—А—Г –Я–∞–њ–∞–≤–∞—А–љ–∞–≤–∞—Б—Г (–Ь–Њ—А–љ–Є–љ–≥—Б–∞–є–і, –Ѓ–Р–†) –Є –і–—А—Г –•–Њ—Д–Љ–µ–є—А—Г (–Щ–Њ—Е–∞–љ–љ–µ—Б–±—Г—А–≥, –Ѓ–Р–†).
–Ы–µ–Ї–∞—А—Б—В–≤–Њ –і–ї—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –њ–Њ–і–і–µ—А–ґ–Ї–∞ –≤ –≤–Є–і–µ —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–≥–Њ –≥—А–∞–љ—В–∞ –±—Л–ї–Є –ї—О–±–µ–Ј–љ–Њ –њ—А–µ–і–Њ—Б—В–∞–≤–ї–µ–љ—Л –Ї–Њ–Љ–њ–∞–љ–Є–µ–є –†–µ–Ї–Є—В –С–µ–љ–Ї–Є—Б–µ—А –•–µ–ї—Б–Ї–µ—А (–Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є—П) –Ы–і—В.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Ъ–∞—Ж –Я–Ю. –Ц–µ–ї—Г–і–Њ—З–љ–Њ––њ–Є—Й–µ–≤–Њ–і–љ–∞—П —А–µ–≥—Г—А–≥–Є—В–∞—Ж–Є—П –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. Clin Perspec Gastroenterol; –Ь–∞–є/–Є—О–љ—М: 164–167.
2. –†—Г–±–Є–љ –Я. –Ы–µ—З–µ–љ–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–∞–Љ–Є –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. BMJ 1998; 317:1503–1506.
3. –Ф–Њ–ї–Ї X., –Э–Є–Ї–Њ–ї—М—Б –†. –Ю—Ж–µ–љ–Ї–∞ –≤–ї–Є—П–љ–Є—П –І–µ—А–љ–Њ–±—Л–ї—П –љ–∞ –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ –њ–Њ—А–Њ–Ї–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –≤ 16 —А–µ–≥–Є–Њ–љ–∞—Е –Х–≤—А–Њ–њ—Л. Int J Epidemiol 1999; 28: 941–948.
4. –Ы–∞–љ–≥ –У.–Ф., –Ф—Г–≥–∞–ї –Р. –°—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–µ–є—Б—В–≤–Є—П –°—Г—Б–њ–µ–љ–Ј–Є–Є –Р–ї—М–≥–Є–Ї–Њ–љ–∞ (Algicon Suspension) –Є —В—А–Є—Б–Є–ї–Є–Ї–∞—В–љ–Њ–є —Б–Љ–µ—Б–Є –Љ–∞–≥–љ–Є—П (magnesium trisilicate mixture) –≤ –ї–µ—З–µ–љ–Є–Є –і–Є—Б–њ–µ–њ—Б–Є–Є —А–µ–≥—Г—А–≥–Є—В–∞—Ж–Є–Є –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. Br J Clin Pract 1990; Suppl 66: 48–51.
5. –І–µ—А—А–Є –°.–•., –Ь–µ—А–Ї–∞—В—Ж –Ш. –Ь–µ–і–Є—Ж–Є–љ—Б–Ї–Є–µ, —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–µ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. 4––µ –Є–Ј–і. Baltimore: Williams&Wilkins 1991; 925–926.
6. –£–Ј–∞–љ –Ь., –£–Ј–∞–љ –°, –°—Г—А–µ –Ъ., –†–Є—З–∞—А–і––С–µ—А—В –Ъ. –Ш–Ј–ґ–Њ–≥–∞ –Є —А–µ–≥—Г—А–≥–Є—В–∞—Ж–Є—П –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є: —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П —Б—Г—Б–њ–µ–љ–Ј–Є–µ–є –У–µ–≤–Є—Б–Ї–Њ–љ®. Rev Fr Gynecol Obstet 1988; 83: 569–572.
7. –І—Н—В—Д–Є–ї–і –°. –°—А–∞–≤–љ–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –∞–ї—М–≥–Є–љ–∞—В–∞ –У–µ–≤–Є—Б–Ї–Њ–љ –§–Њ—А—В–µ —Б –њ–ї–∞—Ж–µ–±–Њ –њ—А–Є
–ї–µ—З–µ–љ–Є–Є –±–Њ–ї–µ–Ј–љ–Є –ґ–µ–ї—Г–і–Њ—З–љ–Њ––њ–Є—Й–µ–≤–Њ–і–љ–Њ–є —А–µ–≥—Г—А–≥–Є—В–∞—Ж–Є–Є. Curr Med Res Opin 1999; 15:152–159.
8. –С—Г—А–Ї–Є—В –Т., –Ф–ґ–Њ–ї–Є—Д—Д –Ш.–У., –°–∞–є–Ї–µ –Ф–ґ., –Ф–µ—В—В–Љ–∞—А –Я.–Т. –С—А–Є—В–∞–љ—Б–Ї–Є–µ —Б—Г—Б–њ–µ–љ–Ј–Є–Є –∞–ї—М–≥–Є–љ–∞—В–∞: –Љ–µ—В–Њ–і–Њ–ї–Њ–≥–Є—П –і–ї—П –Є–Ј—Г—З–µ–љ–Є—П –±–∞—А—М–µ—А–љ—Л—Е —Б–≤–Њ–є—Б—В–≤. –®–µ—Б—В–Њ–є –Т—Б–µ–Љ–Є—А–љ—Л–є –Ъ–Њ–љ–≥—А–µ—Б—Б OESO, –Я–∞—А–Є–ґ 2000, –°—В–∞—В—М—П 26, 75.
9. –Т–∞—И–Є–љ–≥—В–Њ–љ –Э., –°–∞–є–Ї–µ –Ф–ґ., –Я–∞—А–Ї–µ—А –Ь.–Р. –Є –і—А. –°—А–Њ–Ї –љ–∞—З–∞–ї–∞ –і–µ–є—Б—В–≤–Є—П –∞–ї—М–≥–Є–љ–∞—В–∞ –љ–∞—В—А–Є—П, —А–∞–љ–Є—В–Є–і–Є–љ–∞, –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ –Є –≤–Њ–і—Л –љ–∞ –Њ—Б–љ–Њ–≤–µ –њ–Є—Й–µ–≤–Њ–і–љ–Њ–≥–Њ —А–Э. –У–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—П 1999; 116: G1529.
10. –Ь–Є–љ–і–µ–ї–ї –Ф–ґ.–Р., –ѓ–Ї–Њ–±—Б–Њ–љ –С.–Ф–ґ. –Э–∞—А—Г—И–µ–љ–Є—П —Б–љ–∞ –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. J Obstet Gynecol Neonatal Nurs 2000; 29: 590–597.IJCP, –∞–њ—А–µ–ї—М 2003, —В–Њ–Љ 57, вДЦ 3 –Р–≤—В–Њ—А—Б–Ї–∞—П —Б—В–∞—В—М—П-
IJCP, –∞–њ—А–µ–ї—М 2003, —В–Њ–Љ 57, вДЦ 3












