–£ –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Β –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Ϋ―΄―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η–Μ–Α―¹―¨ –Ψ―Ü–Β–Ϋ–Κ–Α ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –¥–Μ–Η―²–Β–Μ―¨–Ϋ–Ψ–Ι –¥–Β–Κ–Ψ–Ϋ―²–Α–Φ–Η–Ϋ–Α―Ü–Η–Η –Κ–Η―à–Β―΅–Ϋ–Η–Κ–Α ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –Ω–Β―Ä–Ψ―Ä–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Ω―Ä–Η–Β–Φ–Α –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α (–Η–Μ–Η –¥―Ä―É–≥–Η―Ö –Α–Ϋ―²–Η–±–Η–Ψ―²–Η–Κ–Ψ–≤) ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Ω–Ψ―¹–Μ–Β ―ç–Ω–Η–Ζ–Ψ–¥–Α –Γ–ë–ü (–≤―²–Ψ―Ä–Η―΅–Ϋ–Α―è –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Α) [7–11]. –ü–Ψ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Α–Φ –≤―¹–Β―Ö ―Ä–Α–±–Ψ―², –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²―¨ ―Ä–Β―Ü–Η–¥–Η–≤–Α –Γ–ë–ü –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ ―¹–Ϋ–Η–Ε–Α–Μ–Α―¹―¨. –û–¥–Ϋ–Α–Κ–Ψ –Ϋ–Β –Ϋ–Α–±–Μ―é–¥–Α–Μ–Ψ―¹―¨ –Ζ–Ϋ–Α―΅–Η–Φ–Ψ–≥–Ψ ―É–Μ―É―΅―à–Β–Ϋ–Η―è –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Ι –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²–Η. –†–Ψ–Μ―¨ –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –≤ –Ω–Β―Ä–≤–Η―΅–Ϋ–Ψ–Ι –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Β –Γ–ë–ü –Ϋ–Β ―É―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Α. –Δ–Ψ–Μ―¨–Κ–Ψ –Ω–Ψ –¥–Α–Ϋ–Ϋ―΄–Φ –Ψ–¥–Ϋ–Ψ–≥–Ψ ―Ä–Α–Ϋ–¥–Ψ–Φ–Η–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–≥–Ψ –Ω–Μ–Α―Ü–Β–±–Ψ––Κ–Ψ–Ϋ―²―Ä–Ψ–Μ–Η―Ä―É–Β–Φ–Ψ–≥–Ψ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –Ϋ–Β –±―΄–Μ–Ψ –≤―΄―è–≤–Μ–Β–Ϋ–Ψ –Ζ–Ϋ–Α―΅–Η–Φ–Ψ–≥–Ψ –≤–Μ–Η―è–Ϋ–Η―è –Ϋ–Α –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²―¨ ―Ä–Α–Ζ–≤–Η―²–Η―è –Γ–ë–ü –Η–Μ–Η –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²―¨ [12]. –û–¥–Ϋ–Α–Κ–Ψ –¥–Η–Ζ–Α–Ι–Ϋ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –Η –Ψ―²–±–Ψ―Ä –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Ϋ–Β –±―΄–Μ–Η –Α–¥–Β–Κ–≤–Α―²–Ϋ―΄–Φ–Η –¥–Μ―è –≤―΄―è–≤–Μ–Β–Ϋ–Η―è ―Ä–Α–Ζ–Μ–Η―΅–Η–Ι –≤ –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²–Η.
–‰–¥–Β–Α–Μ―¨–Ϋ–Α―è –≥―Ä―É–Ω–Ω–Α –¥–Μ―è –Ψ―Ü–Β–Ϋ–Κ–Η ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Η –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Ψ–Φ –Ω―Ä–Η ―Ü–Η―Ä―Ä–Ψ–Ζ–Β –Ω–Β―΅–Β–Ϋ–Η – ―ç―²–Ψ –Ω–Α―Ü–Η–Β–Ϋ―²―΄ ―¹ –≤―΄―¹–Ψ–Κ–Η–Φ ―Ä–Η―¹–Κ–Ψ–Φ ―Ä–Α–Ζ–≤–Η―²–Η―è –Γ–ë–ü –Η–Μ–Η –™–†–Γ. –£―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Α―è –Ω–Β―΅–Β–Ϋ–Ψ―΅–Ϋ–Α―è –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨ –Η –Ϋ–Η–Ζ–Κ–Ψ–Β ―¹–Ψ–¥–Β―Ä–Ε–Α–Ϋ–Η–Β –±–Β–Μ–Κ–Α –≤ –Α―¹―Ü–Η―²–Η―΅–Β―¹–Κ–Ψ–Ι –Ε–Η–¥–Κ–Ψ―¹―²–Η – –≤–Α–Ε–Ϋ―΄–Β –Ω―Ä–Β–¥–Η–Κ―²–Ψ―Ä―΄ –Γ–ë–ü [13–16]. –ù–Α―Ä―É―à–Β–Ϋ–Η–Β ―Ü–Η―Ä–Κ―É–Μ―è―²–Ψ―Ä–Ϋ–Ψ–Ι –Η –Ω–Ψ―΅–Β―΅–Ϋ–Ψ–Ι ―³―É–Ϋ–Κ―Ü–Η–Η – –≥–Μ–Α–≤–Ϋ―΄–Ι –Ω―Ä–Β–¥–Η–Κ―²–Ψ―Ä –™–†–Γ [3–6,17,18]. –£ –¥–Α–Ϋ–Ϋ–Ψ–Ι ―¹―²–Α―²―¨–Β –Ω―Ä–Η–≤–Β–¥–Β–Ϋ―΄ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―΄ –¥–≤–Ψ–Ι–Ϋ–Ψ–≥–Ψ ―¹–Μ–Β–Ω–Ψ–≥–Ψ ―Ä–Α–Ϋ–¥–Ψ–Φ–Η–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–≥–Ψ –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ–Η―Ä―É–Β–Φ–Ψ–≥–Ψ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è, –Ω–Ψ–Κ–Α–Ζ―΄–≤–Α―é―â–Η–Β, ―΅―²–Ψ –Ω–Β―Ä–≤–Η―΅–Ϋ–Α―è –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Α –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Ψ–Φ ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –≤―΄―¹–Ψ–Κ–Η–Φ ―Ä–Η―¹–Κ–Ψ–Φ ―Ä–Α–Ζ–≤–Η―²–Η―è –Γ–ë–ü –Η –™–†–Γ –Α―¹―¹–Ψ―Ü–Η–Η―Ä–Ψ–≤–Α–Ϋ–Α ―¹–Ψ –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ―΄–Φ ―É–Μ―É―΅―à–Β–Ϋ–Η–Β–Φ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ ―²–Β―΅–Β–Ϋ–Η―è –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è –Η –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Ι –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²–Η.
–€–Α―²–Β―Ä–Η–Α–Μ―΄ –Η –Φ–Β―²–Ψ–¥―΄
–ü–Α―Ü–Η–Β–Ϋ―²―΄
–€―΄ –Ψ–±―¹–Μ–Β–¥–Ψ–≤–Α–Μ–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ ―Ü–Η―Ä―Ä–Ψ–Ζ–Ψ–Φ –Η –Α―¹―Ü–Η―²–Ψ–Φ, –≤―΄―è–≤–Μ–Β–Ϋ–Ϋ―΄–Φ–Η –≤ –Ω–Β―Ä–Η–Ψ–¥ ―¹–Β–Ϋ―²―è–±―Ä―¨ 2000 –≥. – –Η―é–Ϋ―¨ 2004 –≥. –î–Η–Α–≥–Ϋ–Ψ–Ζ –Ψ―¹–Ϋ–Ψ–≤―΄–≤–Α–Μ―¹―è –Ϋ–Α –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö, –Η–Ϋ―¹―²―Ä―É–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ―΄―Ö –¥–Α–Ϋ–Ϋ―΄―Ö –Η ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Α―Ö ―É–Μ―¨―²―Ä–Α―¹–Ψ–Ϋ–Ψ–≥―Ä–Α―³–Η–Η –Η–Μ–Η –≥–Η―¹―²–Ψ–Μ–Ψ–≥–Η–Η.
–ö―Ä–Η―²–Β―Ä–Η–Η –≤–Κ–Μ―é―΅–Β–Ϋ–Η―è: (1) –≤–Ψ–Ζ―Ä–Α―¹―² 18–80 –Μ–Β―², (2) ―¹–Ψ–¥–Β―Ä–Ε–Α–Ϋ–Η–Β –±–Β–Μ–Κ–Α –≤ –Α―¹―Ü–Η―²–Η―΅–Β―¹–Κ–Ψ–Ι –Ε–Η–¥–Κ–Ψ―¹―²–Η –Φ–Β–Ϋ–Β–Β 25 –≥/–Μ, (3) –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Β –Ω–Ψ―΅–Β―΅–Ϋ–Ψ–Ι ―³―É–Ϋ–Κ―Ü–Η–Η (–Κ―Ä–Β–Α―²–Η–Ϋ–Η–Ϋ –Ω–Μ–Α–Ζ–Φ―΄ –Κ―Ä–Ψ–≤–Η ?1,2 –Φ–≥/–¥–Μ, –Α–Ζ–Ψ―² –Φ–Ψ―΅–Β–≤–Η–Ϋ―΄ –Κ―Ä–Ψ–≤–Η ?25 –Φ–≥/–¥–Μ –Η–Μ–Η –Ϋ–Α―²―Ä–Η–Ι –Ω–Μ–Α–Ζ–Φ―΄ –Κ―Ä–Ψ–≤–Η ?130 –Φ–≠–Κ/–Μ) –Η–Μ–Η ―²―è–Ε–Β–Μ–Α―è –Ω–Β―΅–Β–Ϋ–Ψ―΅–Ϋ–Α―è –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨ (–Ω–Ψ ―à–Κ–Α–Μ–Β Child–Pugh ?9 –±–Α–Μ–Μ–Ψ–≤ ―¹ ―É―Ä–Ψ–≤–Ϋ–Β–Φ –±–Η–Μ–Η―Ä―É–±–Η–Ϋ–Α –Ω–Μ–Α–Ζ–Φ―΄ –Κ―Ä–Ψ–≤–Η ?3 –Φ–≥/–¥–Μ). –Δ–Α–Κ–Ψ–Ι –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―¨, –Κ–Α–Κ ―¹–Ψ–¥–Β―Ä–Ε–Α–Ϋ–Η–Β –±–Β–Μ–Κ–Α –≤ –Α―¹―Ü–Η―²–Η―΅–Β―¹–Κ–Ψ–Ι –Ε–Η–¥–Κ–Ψ―¹―²–Η, –±―΄–Μ –≤―΄–±―Ä–Α–Ϋ, –Ω–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É –Ψ–Ϋ ―è–≤–Μ―è–Β―²―¹―è –≤–Α–Ε–Ϋ―΄–Φ –Ω―Ä–Β–¥–Η–Κ―²–Ψ―Ä–Ψ–Φ –Γ–ë–ü [13–16]. –ë–Η–Μ–Η―Ä―É–±–Η–Ϋ [14–16], –Α–Μ―¨–±―É–Φ–Η–Ϋ –Ω–Μ–Α–Ζ–Φ―΄ –Κ―Ä–Ψ–≤–Η [15] –Η –Ω―Ä–Ψ―²―Ä–Ψ–Φ–±–Η–Ϋ–Ψ–≤–Ψ–Β –≤―Ä–Β–Φ―è [15] ―²–Α–Κ–Ε–Β –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Μ–Η―¹―¨ –≤ –Κ–Α―΅–Β―¹―²–≤–Β –Ϋ–Β–Ζ–Α–≤–Η―¹–Η–Φ―΄―Ö –Ω―Ä–Β–¥–Η–Κ―²–Ψ―Ä–Ψ–≤ –Γ–ë–ü, –Η –Ω–Ψ ―ç―²–Ψ–Ι –Ε–Β –Ω―Ä–Η―΅–Η–Ϋ–Β –±―΄–Μ–Α –≤―΄–±―Ä–Α–Ϋ–Α ―à–Κ–Α–Μ–Α Child–Pugh. –û–¥–Ϋ–Α–Κ–Ψ –Ω–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É ―¹―΄–≤–Ψ―Ä–Ψ―²–Ψ―΅–Ϋ―΄–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ –±–Η–Μ–Η―Ä―É–±–Η–Ϋ–Α ―Ä–Α―¹―¹–Φ–Α―²―Ä–Η–≤–Α–Μ―¹―è –Ω–Ψ –¥–Α–Ϋ–Ϋ―΄–Φ –Ϋ–Β―¹–Κ–Ψ–Μ―¨–Κ–Η―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι [15,16], –Κ–Α–Κ –Ψ―΅–Β–Ϋ―¨ ―¹–Η–Μ―¨–Ϋ―΄–Ι –Ω―Ä–Β–¥–Η–Κ―²–Ψ―Ä –Γ–ë–ü, ―à–Κ–Α–Μ–Α Child–Pugh ―¹–Ψ―΅–Β―²–Α–Μ–Α―¹―¨ ―¹ ―É―Ä–Ψ–≤–Ϋ–Β–Φ ―¹―΄–≤–Ψ―Ä–Ψ―²–Ψ―΅–Ϋ–Ψ–≥–Ψ –±–Η–Μ–Η―Ä―É–±–Η–Ϋ–Α. –½–Ϋ–Α―΅–Β–Ϋ–Η–Β 3 –Φ–≥/–¥–Μ (―É―Ä–Ψ–≤–Ϋ―è ―¹―΄–≤–Ψ―Ä–Ψ―²–Ψ―΅–Ϋ–Ψ–≥–Ψ –±–Η–Μ–Η―Ä―É–±–Η–Ϋ–Α) –±―΄–Μ–Ψ –≤―΄–±―Ä–Α–Ϋ–Ψ –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤–Α–Ϋ–Η–Η –¥–≤―É―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι, –Κ–Ψ―²–Ψ―Ä―΄–Β –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Η, ―΅―²–Ψ ―É―Ä–Ψ–≤–Β–Ϋ―¨ –±–Ψ–Μ–Β–Β 2,5 –Η–Μ–Η 3,2 –Φ–≥/–¥–Μ –Α―¹―¹–Ψ―Ü–Η–Η―Ä–Ψ–≤–Α–Ϋ ―¹ –≤―΄―¹–Ψ–Κ–Ψ–Ι ―΅–Α―¹―²–Ψ―²–Ψ–Ι –Γ–ë–ü [15,16].
–™–Η–Ω–Ψ–Ϋ–Α―²―Ä–Η–Β–Φ–Η―è, –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ―΄–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Κ―Ä–Β–Α―²–Η–Ϋ–Η–Ϋ–Α –Η–Μ–Η –Φ–Ψ―΅–Β–≤–Η–Ϋ―΄ –Ω–Μ–Α–Ζ–Φ―΄ –Κ―Ä–Ψ–≤–Η –≤―΄–±―Ä–Α–Ϋ―΄, –Ω–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É –Ψ–Ϋ–Η ―è–≤–Μ―è―é―²―¹―è ―¹–Η–Μ―¨–Ϋ―΄–Φ–Η –Ω―Ä–Β–¥–Η–Κ―²–Ψ―Ä–Α–Φ–Η –™–†–Γ ―²–Η–Ω–Α–1 [3,4,18–20].
–ö―Ä–Η―²–Β―Ä–Η–Η –Η―¹–Κ–Μ―é―΅–Β–Ϋ–Η―è: (1) ―ç–Ω–Η–Ζ–Ψ–¥ –Γ–ë–ü –Η–Μ–Η –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Α –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Ψ–Φ –≤ –Α–Ϋ–Α–Φ–Ϋ–Β–Ζ–Β, (2) –Α–Μ–Μ–Β―Ä–≥–Η―è –Ϋ–Α ―Ö–Η–Ϋ–Ψ–Μ–Ψ–Ϋ―΄, (3) –≥–Β–Ω–Α―²–Ψ―Ü–Β–Μ–Μ―é–Μ―è―Ä–Ϋ–Α―è –Κ–Α―Ä―Ü–Η–Ϋ–Ψ–Φ–Α, (4) –¥–Α–Ϋ–Ϋ―΄–Β –Ψ–± –Ψ―Ä–≥–Α–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι –Ω–Ψ―΅–Β―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η (―É–Μ―¨―²―Ä–Α―¹–Ψ–Ϋ–Ψ–≥―Ä–Α―³–Η―΅–Β―¹–Κ–Ψ–Β –Ω–Ψ–¥―²–≤–Β―Ä–Ε–¥–Β–Ϋ–Η–Β –Ψ–±―¹―²―Ä―É–Κ―²–Η–≤–Ϋ–Ψ–Ι ―É―Ä–Ψ–Ω–Α―²–Η–Η –Η–Μ–Η –Ω–Α―Ä–Β–Ϋ―Ö–Η–Φ–Α―²–Ψ–Ζ–Ϋ–Ψ–≥–Ψ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è –Ω–Ψ―΅–Β–Κ –Η–Μ–Η –≥–Β–Φ–Α―²―É―Ä–Η―è –Η/–Η–Μ–Η –Ω―Ä–Ψ―²–Β–Η–Ϋ―É―Ä–Η―è) –Η (5) –Η–Ϋ―³–Η―Ü–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β –≤–Η―Ä―É―¹–Ψ–Φ –Η–Φ–Φ―É–Ϋ–Ψ–¥–Β―³–Η―Ü–Η―²–Α ―΅–Β–Μ–Ψ–≤–Β–Κ–Α. –ü―Ä–Ψ―²–Ψ–Κ–Ψ–Μ –±―΄–Μ –Ψ–¥–Ψ–±―Ä–Β–Ϋ ―ç―²–Η―΅–Β―¹–Κ–Η–Φ –Κ–Ψ–Φ–Η―²–Β―²–Ψ–Φ –Κ–Α–Ε–¥–Ψ–Ι –±–Ψ–Μ―¨–Ϋ–Η―Ü―΄. –ü–Α―Ü–Η–Β–Ϋ―² –Ω–Ψ–¥–Ω–Η―¹―΄–≤–Α–Μ –Η–Ϋ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–Β ―¹–Ψ–≥–Μ–Α―¹–Η–Β.
–ü―Ä–Ψ―²–Ψ–Κ–Ψ–Μ
–£ –Ϋ–Α―΅–Α–Μ–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Η―¹―¨ –Η–Ζ―É―΅–Β–Ϋ–Η–Β –Η―¹―²–Ψ―Ä–Η–Η –±–Ψ–Μ–Β–Ζ–Ϋ–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Α –Η ―³–Η–Ζ–Η–Κ–Α–Μ―¨–Ϋ–Ψ–Β –Ψ–±―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β, –Ψ–±―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –Ω–Β―΅–Β–Ϋ–Η –Η –Ω–Ψ―΅–Β–Κ, –Α–Ϋ–Α–Μ–Η–Ζ―΄ –Α―¹―Ü–Η―²–Η―΅–Β―¹–Κ–Ψ–Ι –Ε–Η–¥–Κ–Ψ―¹―²–Η –Η –Κ―É–Μ―¨―²―É―Ä–Α–Μ―¨–Ϋ―΄–Ι –Α–Ϋ–Α–Μ–Η–Ζ, –Ψ―¹–Α–¥–Ψ―΅–Ϋ–Α―è –Ω―Ä–Ψ–±–Α ―¹–≤–Β–Ε–Β–Ι –Φ–Ψ―΅–Η –Η –Α–±–¥–Ψ–Φ–Η–Ϋ–Α–Μ―¨–Ϋ–Α―è ―É–Μ―¨―²―Ä–Α―¹–Ψ–Ϋ–Ψ–≥―Ä–Α―³–Η―è. –ü–Α―Ü–Η–Β–Ϋ―²―΄, ―É–¥–Ψ–≤–Μ–Β―²–≤–Ψ―Ä―è–≤―à–Η–Β –Κ―Ä–Η―²–Β―Ä–Η―è–Φ –≤–Κ–Μ―é―΅–Β–Ϋ–Η―è, –±―΄–Μ–Η ―Ä–Α–Ζ–¥–Β–Μ–Β–Ϋ―΄ –Ϋ–Α 2 –≥―Ä―É–Ω–Ω―΄: –Ω–Α―Ü–Η–Β–Ϋ―²―΄ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ –Ω–Ψ–Μ―É―΅–Α–Μ–Η –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ 400 –Φ–≥ –≤ ―¹―É―²–Κ–Η (1?―²–Α–±–Μ–Β―²–Κ–Α), –Ω–Α―Ü–Η–Β–Ϋ―²―΄ –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―¨–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ –Ω–Ψ–Μ―É―΅–Α–Μ–Η –Ω–Μ–Α―Ü–Β–±–Ψ (1 ―²–Α–±–Μ–Β―²–Κ–Α –≤ ―¹―É―²–Κ–Η). –‰–¥–Β–Ϋ―²–Η―΅–Ϋ―΄–Β ―²–Α–±–Μ–Β―²–Κ–Η –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –Η –Ω–Μ–Α―Ü–Β–±–Ψ –±―΄–Μ–Η –Η–Ζ–≥–Ψ―²–Ψ–≤–Μ–Β–Ϋ―΄ –Γ.–ê. –€–Α–¥–Α―É―¹–Ψ–Φ (–ë–Α―Ä―¹–Β–Μ–Ψ–Ϋ–Α, –‰―¹–Ω–Α–Ϋ–Η―è). –†–Α–Ϋ–¥–Ψ–Φ–Η–Ζ–Α―Ü–Η―è –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Α―¹―¨ ―¹ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β–Φ –Ω–Ψ―¹–Μ–Β–¥–Ψ–≤–Α―²–Β–Μ―¨–Ϋ–Ψ–Ι –Ϋ―É–Φ–Β―Ä–Α―Ü–Η–Η –Κ–Ψ–Φ–Ω―¨―é―²–Β―Ä–Ψ–Φ –Κ–Ψ–Ϋ–≤–Β―Ä―²–Ψ–≤, ―¹–Ψ–¥–Β―Ä–Ε–Α―â–Η―Ö ―¹―Ö–Β–Φ―É ―²–Β―Ä–Α–Ω–Η–Η. –¦–Β―΅–Β–Ϋ–Η–Β –Ϋ–Α―΅–Η–Ϋ–Α–Μ–Ψ―¹―¨ –Ϋ–Β–Ζ–Α–Φ–Β–¥–Μ–Η―²–Β–Μ―¨–Ϋ–Ψ –Ω–Ψ―¹–Μ–Β ―Ä–Α–Ϋ–¥–Ψ–Φ–Η–Ζ–Α―Ü–Η–Η. –£–Η–Ζ–Η―²―΄ –Ω―Ä–Ψ―Ö–Ψ–¥–Η–Μ–Η –Κ–Α–Ε–¥―΄–Β 2 –Φ–Β―¹―è―Ü–Α. –ö–Ψ–Φ–Ω–Μ–Α–Ι–Ϋ―¹ –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Ψ―Ü–Β–Ϋ–Η–≤–Α–Μ―¹―è –Ω―É―²–Β–Φ –Η―Ö –Ψ–Ω―Ä–Ψ―¹–Α –Η –Ω–Ψ–¥―¹―΅–Β―²–Ψ–Φ ―²–Α–±–Μ–Β―²–Ψ–Κ –Ϋ–Α –Κ–Α–Ε–¥–Ψ–Φ –≤–Η–Ζ–Η―²–Β. –½–Α―²–Β–Φ –≤―΄–¥–Α–≤–Α–Μ–Α―¹―¨ –Ϋ–Ψ–≤–Α―è –Κ–Ψ―Ä–Ψ–±–Κ–Α ―¹ –Η―¹―¹–Μ–Β–¥―É–Β–Φ―΄–Φ –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–Φ. –ü–Α―Ü–Η–Β–Ϋ―² ―¹―΅–Η―²–Α–Μ―¹―è –Ϋ–Β–Κ–Ψ–Φ–Ω–Μ–Α–Β–Ϋ―²–Ϋ―΄–Φ, –Β―¹–Μ–Η –Η―¹―¹–Μ–Β–¥―É–Β–Φ―΄–Ι –Ω―Ä–Β–Ω–Α―Ä–Α―² –Ϋ–Β –Ω―Ä–Η–Ϋ–Η–Φ–Α–Μ―¹―è –≤ ―²–Β―΅–Β–Ϋ–Η–Β 7 –¥–Ϋ–Β–Ι (–Η–Μ–Η –±–Ψ–Μ–Β–Β) –Κ–Α–Ε–¥―΄–Β 2 –Φ–Β―¹―è―Ü–Α. –ü―Ä–Η–Β–Φ –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –Η–Μ–Η –Ω–Μ–Α―Ü–Β–±–Ψ –Ω―Ä–Β–Κ―Ä–Α―â–Α–Μ―¹―è –≤ ―¹–Μ―É―΅–Α–Β, –Β―¹–Μ–Η ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Α ―Ä–Α–Ζ–≤–Η–≤–Α–Μ―¹―è –Γ–ë–ü, –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η–Μ–Α―¹―¨ ―²―Ä–Α–Ϋ―¹–Ω–Μ–Α–Ϋ―²–Α―Ü–Η―è –Ω–Β―΅–Β–Ϋ–Η –Η–Μ–Η –Ζ–Α–≤–Β―Ä―à–Α–Μ―¹―è –Ω–Β―Ä–Η–Ψ–¥ –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è –Ω―Ä–Ψ–¥–Ψ–Μ–Ε–Η―²–Β–Μ―¨–Ϋ–Ψ―¹―²―¨―é 1 –≥–Ψ–¥. –£―΄–±–Ψ―Ä –Ω―Ä–Ψ–¥–Ψ–Μ–Ε–Η―²–Β–Μ―¨–Ϋ–Ψ―¹―²–Η –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è –≤ 1 –≥–Ψ–¥ –Ψ―¹–Ϋ–Ψ–≤–Α–Ϋ –Ϋ–Α 3 –Ω―É–Ϋ–Κ―²–Α―Ö. –£–Ψ––Ω–Β―Ä–≤―΄―Ö, –Ω–Ψ –¥–Α–Ϋ–Ϋ―΄–Φ –Ω―Ä–Β–¥―΄–¥―É―â–Β–≥–Ψ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è, –Ϋ–Α–Η–±–Ψ–Μ―¨―à–Β–Β ―Ä–Α–Ζ–Μ–Η―΅–Η–Β –≤ ―΅–Α―¹―²–Ψ―²–Β ―Ä–Β―Ü–Η–¥–Η–≤–Ψ–≤ –Γ–ë–ü (–Φ–Β–Ε–¥―É –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ–Η, –Ω–Ψ–Μ―É―΅–Α–≤―à–Η–Φ–Η –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ –Η–Μ–Η –Ω–Μ–Α―Ü–Β–±–Ψ) –Ϋ–Α–±–Μ―é–¥–Α–Μ–Ψ―¹―¨ –Ϋ–Α 11––Φ –Φ–Β―¹―è―Ü–Β –Ψ―²―¹―Ä–Ψ―΅–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Ω–Β―Ä–Η–Ψ–¥–Α [7]. –Ξ–Ψ―²―è ―É –≤–Κ–Μ―é―΅–Β–Ϋ–Ϋ―΄―Ö –≤ –¥–Α–Ϋ–Ϋ–Ψ–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Ϋ–Β –±―΄–Μ–Ψ –≤ –Α–Ϋ–Α–Φ–Ϋ–Β–Ζ–Β ―ç–Ω–Η–Ζ–Ψ–¥–Α –Γ–ë–ü, –Ϋ–Α–Φ–Η –Ψ–Ε–Η–¥–Α–Μ–Η―¹―¨ ―¹―Ö–Ψ–¥–Ϋ―΄–Β ―Ä–Α–Ζ–Μ–Η―΅–Η―è –≤ –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²–Η ―Ä–Α–Ζ–≤–Η―²–Η―è –Γ–ë–ü –Φ–Β–Ε–¥―É –≥―Ä―É–Ω–Ω–Α–Φ–Η –Η–Ζ––Ζ–Α –Κ―Ä–Α–Ι–Ϋ–Β –≤―΄―¹–Ψ–Κ–Ψ–≥–Ψ ―Ä–Η―¹–Κ–Α –Η–Ϋ―³–Η―Ü–Η―Ä–Ψ–≤–Α–Ϋ–Η―è ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ. –£–Ψ––≤―²–Ψ―Ä―΄―Ö, –Φ―΄ –Ω―Ä–Β–¥–Ω–Ψ–Μ–Ψ–Ε–Η–Μ–Η, ―΅―²–Ψ ―¹–Φ–Β―Ä―²–Ϋ–Ψ―¹―²―¨ –≤–Ψ –≤―Ä–Β–Φ―è –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –±―É–¥–Β―² ―²–Β―¹–Ϋ–Ψ –Κ–Ψ―Ä―Ä–Β–Μ–Η―Ä–Ψ–≤–Α―²―¨ ―¹ –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η―è–Φ–Η –Γ–ë–ü. –ü–Ψ―ç―²–Ψ–Φ―É –Φ―΄ ―Ä–Β―à–Η–Μ–Η –Ψ―Ü–Β–Ϋ–Η–≤–Α―²―¨ –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²―¨ –≤ –Ω–Β―Ä–Η–Ψ–¥ –Ϋ–Α–Η–±–Ψ–Μ―¨―à–Η―Ö ―Ä–Α–Ζ–Μ–Η―΅–Η–Ι –≤ –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²–Η ―Ä–Α–Ζ–≤–Η―²–Η―è –Γ–ë–ü. –‰, –Ϋ–Α–Κ–Ψ–Ϋ–Β―Ü, –≤ ―¹–≤―è–Ζ–Η ―¹ ―²–Β–Φ, ―΅―²–Ψ ―É –Ϋ–Α―à–Η―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Ϋ–Α–±–Μ―é–¥–Α–Μ–Ψ―¹―¨ ―¹–Β―Ä―¨–Β–Ζ–Ϋ–Ψ–Β –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Β ―³―É–Ϋ–Κ―Ü–Η–Η –Ω–Β―΅–Β–Ϋ–Η –Η/–Η–Μ–Η –Ω–Ψ―΅–Β–Κ, –≤―΄―¹–Ψ–Κ–Η–Β –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Η ―¹–Φ–Β―Ä―²–Ϋ–Ψ―¹―²–Η –Ψ–Ε–Η–¥–Α–Μ–Η―¹―¨ –≤ ―²–Β―΅–Β–Ϋ–Η–Β –Ω–Β―Ä–≤–Ψ–≥–Ψ –≥–Ψ–¥–Α –Ω–Ψ―¹–Μ–Β –≤–Κ–Μ―é―΅–Β–Ϋ–Η―è –≤ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β.
–î–Η–Α–≥–Ϋ–Ψ―¹―²–Η―΅–Β―¹–Κ–Η–Ι –Μ–Α–Ω–Α―Ä–Ψ―Ü–Β–Ϋ―²–Β–Ζ –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η–Μ―¹―è ―²–Ψ–Μ―¨–Κ–Ψ –Ω―Ä–Η –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö –Ω–Ψ–Κ–Α–Ζ–Α–Ϋ–Η―è―Ö. –î–Η–Α–≥–Ϋ–Ψ–Ζ―΄ ―¹–Ω–Ψ–Ϋ―²–Α–Ϋ–Ϋ–Ψ–Ι –±–Α–Κ―²–Β―Ä–Η–Β–Φ–Η–Η, –Γ–ë–ü, –Φ–Ψ―΅–Β–≤–Ψ–Ι –Η –¥―Ä―É–≥–Η―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι ―É―¹―²–Α–Ϋ–Α–≤–Μ–Η–≤–Α–Μ–Η―¹―¨, –Κ–Α–Κ –Ψ–Ω–Η―¹–Α–Ϋ–Ψ ―Ä–Α–Ϋ–Β–Β [21]. –Δ–Η–Ω–1 –Η ―²–Η–Ω–2 –™–†–ù –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η―Ä–Ψ–≤–Α–Μ–Η―¹―¨ –≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Η–Η ―¹ –Κ―Ä–Η―²–Β―Ä–Η―è–Φ–Η –€–Β–Ε–¥―É–Ϋ–Α―Ä–Ψ–¥–Ϋ–Ψ–≥–Ψ ―¹–Ψ–Ψ–±―â–Β―¹―²–≤–Α –Ω–Ψ –Α―¹―Ü–Η―²―É [22]. –Δ―Ä–Α–Ϋ–Ζ–Η―²–Ψ―Ä–Ϋ–Α―è –Ω–Ψ―΅–Β―΅–Ϋ–Α―è –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨ –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Μ–Α―¹―¨ –Κ–Α–Κ –Ϋ–Β―É―¹―²–Ψ–Ι―΅–Η–≤–Ψ–Β –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Β –Κ―Ä–Β–Α―²–Η–Ϋ–Η–Ϋ–Α –Ω–Μ–Α–Ζ–Φ―΄ –Κ―Ä–Ψ–≤–Η (–Ϋ–Α >50%) –≤―΄―à–Β 1,5 –Φ–≥/–¥–Μ. –¦–Β―΅–Β–Ϋ–Η–Β ―¹–Ω–Ψ–Ϋ―²–Α–Ϋ–Ϋ–Ψ–Ι –±–Α–Κ―²–Β―Ä–Η–Β–Φ–Η–Η –Η –Γ–ë–ü –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η–Μ–Ψ―¹―¨ ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é ―Ü–Β―³―²―Ä–Η–Α–Κ―¹–Ψ–Ϋ–Α. –Δ–Β―Ä–Α–Ω–Η―è –Η–Ζ–Φ–Β–Ϋ―è–Μ–Α―¹―¨ –Ω―Ä–Η –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²–Η –≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Η–Η ―¹ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Φ ―²–Β―΅–Β–Ϋ–Η–Β–Φ –Η –Φ–Η–Κ―Ä–Ψ–±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Φ–Η ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Α–Φ–Η. –ü–Α―Ü–Η–Β–Ϋ―²–Α–Φ ―¹ –Γ–ë–ü –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η–Μ–Ψ―¹―¨ –≤–Ϋ―É―²―Ä–Η–≤–Β–Ϋ–Ϋ–Ψ–Β –≤–≤–Β–¥–Β–Ϋ–Η–Β –Α–Μ―¨–±―É–Φ–Η–Ϋ–Α –¥–Μ―è –Ω―Ä–Β–¥–Ψ―²–≤―Ä–Α―â–Β–Ϋ–Η―è –™–†–Γ (1,5 –≥/–Κ–≥ –Φ–Α―¹―¹―΄ ―²–Β–Μ–Α –Ω―Ä–Η –≤―΄―è–≤–Μ–Β–Ϋ–Η–Η –Η–Ϋ―³–Β–Κ―Ü–Η–Η –Η 1 –≥/–Κ–≥ –Φ–Α―¹―¹―΄ ―²–Β–Μ–Α –Ϋ–Α ―²―Ä–Β―²–Η–Ι –¥–Β–Ϋ―¨) [6]. –ù–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ (400 –Φ–≥ –Κ–Α–Ε–¥―΄–Β 12 ―΅ –≤ ―²–Β―΅–Β–Ϋ–Η–Β 7 –¥–Ϋ–Β–Ι) –Ϋ–Α–Ζ–Ϋ–Α―΅–Α–Μ―¹―è –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ –Ψ–±–Β–Η―Ö –≥―Ä―É–Ω–Ω, ―É –Κ–Ψ―²–Ψ―Ä―΄―Ö ―Ä–Α–Ζ–≤–Η–Μ–Ψ―¹―¨ –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η–Β –Η–Ζ –≤–Β―Ä―Ö–Ϋ–Η―Ö –Ψ―²–¥–Β–Μ–Ψ–≤ –Ε–Β–Μ―É–¥–Ψ―΅–Ϋ–Ψ––Κ–Η―à–Β―΅–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α –¥–Μ―è –Ω―Ä–Β–¥–Ψ―²–≤―Ä–Α―â–Β–Ϋ–Η―è –±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–Ι –Η–Ϋ―³–Β–Κ―Ü–Η–Η [23]. –¦–Β―΅–Β–Ϋ–Η–Β –™–†–Γ ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –≤–Α–Ζ–Ψ–Κ–Ψ–Ϋ―¹―²―Ä–Η–Κ―²–Ψ―Ä–Ψ–≤ –Ϋ–Β –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η–Μ–Ψ―¹―¨, –Ω–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É –≤–Ψ –≤―Ä–Β–Φ―è –Ψ–¥–Ψ–±―Ä–Β–Ϋ–Η―è –Ω―Ä–Ψ―²–Ψ–Κ–Ψ–Μ–Α (1999 –≥.) –Η–Φ–Β–Μ–Ψ―¹―¨ –Ψ―΅–Β–Ϋ―¨ –Φ–Α–Μ–Ψ –¥–Α–Ϋ–Ϋ―΄―Ö –Ψ–± ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –¥–Α–Ϋ–Ϋ–Ψ–≥–Ψ –≤–Η–¥–Α –Μ–Β―΅–Β–Ϋ–Η―è.
–Γ―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Η–Ι –Α–Ϋ–Α–Μ–Η–Ζ
–™–Μ–Α–≤–Ϋ–Ψ–Ι –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ–Ι ―²–Ψ―΅–Κ–Ψ–Ι –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –±―΄–Μ–Α 3––Φ–Β―¹―è―΅–Ϋ–Α―è –Η –≥–Ψ–¥–Ψ–≤–Α―è –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²―¨. –ü–Ψ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Α–Φ –Ω―Ä–Β–¥―΄–¥―É―â–Η―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι –Ω–Ψ –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Β –Γ–ë–ü, –Ϋ–Β –±―΄–Μ–Ψ –≤―΄―è–≤–Μ–Β–Ϋ–Ψ –Ζ–Ϋ–Α―΅–Η–Φ―΄―Ö ―Ä–Α–Ζ–Μ–Η―΅–Η–Ι –≤ –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –Ω–Ψ–Μ―É―΅–Α–≤―à–Η―Ö –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ –Η –Ω–Μ–Α―Ü–Β–±–Ψ [7,12]. –û–¥–Ϋ–Α–Κ–Ψ –Ϋ–Α―¹―²–Ψ―è―â–Β–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β (–≤ –Ψ―²–Μ–Η―΅–Η–Β –Ψ―² –Ω―Ä–Β–¥―΄–¥―É―â–Η―Ö) –≤–Κ–Μ―é―΅–Α–Μ–Ψ –≤ –Ψ―¹–Ϋ–Ψ–≤–Ϋ–Ψ–Φ –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –≤―΄―¹–Ψ–Κ–Η–Φ ―Ä–Η―¹–Κ–Ψ–Φ ―Ä–Α–Ζ–≤–Η―²–Η―è –™–†–ù ―²–Η–Ω–Α–1, –Α―¹―¹–Ψ―Ü–Η–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―É―é ―¹ –Γ–ë–ü –Η –Ω–Ψ―ç―²–Ψ–Φ―É, ―¹ –≤―΄―¹–Ψ–Κ–Η–Φ ―Ä–Η―¹–Κ–Ψ–Φ ―¹–Φ–Β―Ä―²–Η –≤ ―²–Β―΅–Β–Ϋ–Η–Β –Κ–Ψ―Ä–Ψ―²–Κ–Ψ–≥–Ψ –Ω–Β―Ä–Η–Ψ–¥–Α –≤―Ä–Β–Φ–Β–Ϋ–Η. –½–Ϋ–Α―΅–Β–Ϋ–Η–Β –≥–Ψ–¥–Ψ–≤–Ψ–Ι –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²–Η –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ (25%) –±―΄–Μ–Ψ ―É―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Ψ –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤–Β –Ω―Ä–Β–¥―à–Β―¹―²–≤―É―é―â–Η―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι, –Ω–Ψ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Α–Φ –Κ–Ψ―²–Ψ―Ä―΄―Ö –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Η –≥–Ψ–¥–Ψ–≤–Ψ–Ι –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²–Η ―¹–Ψ―¹―²–Α–≤–Η–Μ–Η 20, 26 –Η 38% –¥–Μ―è –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –™–†–ù ―²–Η–Ω–Α–2 [24]; –¥–Η–Μ―é―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–Ι –≥–Η–Ω–Ψ–Ϋ–Α―²―Ä–Η–Β–Φ–Η–Β–Ι (–ü. –™–Η–Ϋ–Β―¹, –Ϋ–Β–Ψ–Ω―É–±–Μ–Η–Κ–Ψ–≤–Α–Ϋ–Ϋ―΄–Ι –Ψ–±–Ζ–Ψ―Ä [25,26]); –Η –Ϋ–Η–Ζ–Κ–Η–Φ ―¹–Ψ–¥–Β―Ä–Ε–Α–Ϋ–Η–Β–Φ –±–Β–Μ–Κ–Α –≤ –Α―¹―Ü–Η―²–Η―΅–Β―¹–Κ–Ψ–Ι –Ε–Η–¥–Κ–Ψ―¹―²–Η, –≤―΄―¹–Ψ–Κ–Η–Φ ―É―Ä–Ψ–≤–Ϋ–Β–Φ –±–Η–Μ–Η―Ä―É–±–Η–Ϋ–Α –Η/–Η–Μ–Η –Ϋ–Η–Ζ–Κ–Η–Φ ―΅–Η―¹–Μ–Ψ–Φ ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–≤ [16] ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ. –½–Ϋ–Α―΅–Β–Ϋ–Η–Β –≥–Ψ–¥–Ψ–≤–Ψ–Ι –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α (55%) –±―΄–Μ–Ψ ―É―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Ψ ―¹ ―É―΅–Β―²–Ψ–Φ ―²–Ψ–≥–Ψ, ―΅―²–Ψ ―¹–Β–Μ–Β–Κ―²–Η–≤–Ϋ–Α―è –¥–Β–Κ–Ψ–Ϋ―²–Α–Φ–Η–Ϋ–Α―Ü–Η―è –Κ–Η―à–Β―΅–Ϋ–Η–Κ–Α –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ ―¹–Ϋ–Η–Ζ–Η―² ―΅–Α―¹―²–Ψ―²―É –Γ–ë–ü, ―è–≤–Μ―è―é―â–Β–≥–Ψ―¹―è –Ϋ–Α–Η–±–Ψ–Μ–Β–Β ―΅–Α―¹―²―΄–Φ –Η―¹―Ö–Ψ–¥–Ψ–Φ –™–†–ù ―²–Η–Ω–Α–1 [19] –Η ―¹–Α–Φ–Ψ–Ι ―΅–Α―¹―²–Ψ–Ι –Ω―Ä–Η―΅–Η–Ϋ–Ψ–Ι ―¹–Φ–Β―Ä―²–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Ϋ–Α –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η―Ö ―¹―²–Α–¥–Η―è―Ö ―Ü–Η―Ä―Ä–Ψ–Ζ–Α. –ë–Ψ–Μ–Β–Β ―²–Ψ–≥–Ψ, –Ϋ–Β–¥–Α–≤–Ϋ–Η–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Η, ―΅―²–Ψ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ ―Ü–Η―Ä―Ä–Ψ–Ζ–Ψ–Φ –Η –Α―¹―Ü–Η―²–Ψ–Φ –Α―¹―¹–Ψ―Ü–Η–Η―Ä–Ψ–≤–Α–Ϋ–Ψ ―¹–Ψ –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ―΄–Φ ―É–Μ―É―΅―à–Β–Ϋ–Η–Β–Φ ―¹–Η―¹―²–Β–Φ–Ϋ–Ψ–Ι –≥–Β–Φ–Ψ–¥–Η–Ϋ–Α–Φ–Η–Κ–Η, ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β–Φ –Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è ―¹―Ä–Β–¥–Ϋ–Β–≥–Ψ –Α―Ä―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –¥–Α–≤–Μ–Β–Ϋ–Η―è –Η –Ω–Ψ–¥–Α–≤–Μ–Β–Ϋ–Η–Β–Φ –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η ―Ä–Β–Ϋ–Η–Ϋ–Α –Ω–Μ–Α–Ζ–Φ―΄ –Κ―Ä–Ψ–≤–Η [27,28]. –≠―²–Η 2 –Ω–Α―Ä–Α–Φ–Β―²―Ä–Α – –Ϋ–Α–Η–±–Ψ–Μ–Β–Β ―΅―É–≤―¹―²–≤–Η―²–Β–Μ―¨–Ϋ―΄–Β –Ω―Ä–Β–¥–Η–Κ―²–Ψ―Ä―΄ –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ ―Ü–Η―Ä―Ä–Ψ–Ζ–Ψ–Φ –Η –Α―¹―Ü–Η―²–Ψ–Φ [19,29]. –ü–Ψ ―Ä–Α―¹―΅–Β―²–Α–Φ –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ –±―΄–Μ–Ψ –≤–Κ–Μ―é―΅–Η―²―¨ –≤ –Κ–Α–Ε–¥―É―é –≥―Ä―É–Ω–Ω―É 34 –Ω–Α―Ü–Η–Β–Ϋ―²–Α –¥–Μ―è –¥–Ψ―¹―²–Η–Ε–Β–Ϋ–Η―è –Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è p –Φ–Β–Ϋ–Β–Β ―΅–Β–Φ 0,05 ―¹ –Ψ―à–Η–±–Κ–Ψ–Ι a 5% –Η –Ψ―à–Η–±–Κ–Ψ–Ι b 20%. –£―²–Ψ―Ä–Η―΅–Ϋ―΄–Β –Κ–Ψ–Ϋ–Β―΅–Ϋ―΄–Β ―²–Ψ―΅–Κ–Η – ―ç―²–Ψ ―΅–Α―¹―²–Ψ―²–Α ―Ä–Α–Ζ–≤–Η―²–Η―è –Γ–ë–ü –Η –™–†–Γ –≤ ―²–Β―΅–Β–Ϋ–Η–Β 1 –≥–Ψ–¥–Α.
–½–Ϋ–Α―΅–Β–Ϋ–Η―è ―¹―Ä–Α–≤–Ϋ–Η–≤–Α–Μ–Η―¹―¨ ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é t–―²–Β―¹―²–Α –Γ―²―¨―é–¥–Β–Ϋ―²–Α –Η–Μ–Η ―²–Β―¹―²–Α c2 ―¹ –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η–Β–Ι –Ω–Ψ Yates –Ω―Ä–Η –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²–Η. –ö―Ä–Η–≤―΄–Β –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²–Η –±―΄–Μ–Η –Ω–Ψ―¹―²―Ä–Ψ–Β–Ϋ―΄ ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –Φ–Β―²–Ψ–¥–Α –ö–Α–Ω–Μ–Α–Ϋ–Α––€–Α–Ι–Β―Ä–Α. –†–Β–Ζ―É–Μ―¨―²–Α―²―΄ –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ―΄ –Κ–Α–Κ: –Ψ―²–Ϋ–Ψ―¹–Η―²–Β–Μ―¨–Ϋ―΄–Ι ―Ä–Η―¹–Κ + 95%––Ι –¥–Ψ–≤–Β―Ä–Η―²–Β–Μ―¨–Ϋ―΄–Ι –Η–Ϋ―²–Β―Ä–≤–Α–Μ –Η–Μ–Η ―¹―Ä–Β–¥–Ϋ–Β–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β±–Κ–≤–Α–¥―Ä–Α―²–Η―΅–Ϋ–Ψ–Β –Ψ―²–Κ–Μ–Ψ–Ϋ–Β–Ϋ–Η–Β. –£―΄―΅–Η―¹–Μ–Β–Ϋ–Η―è –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η–Μ–Η―¹―¨ ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –Ω–Α–Κ–Β―²–Α ―¹―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Η―Ö –Ω―Ä–Ψ–≥―Ä–Α–Φ–Φ SPSS (–≤–Β―Ä―¹–Η―è 11.0, 2000; –ß–Η–Κ–Α–≥–Ψ). –†–Α–Ζ–Μ–Η―΅–Η―è ―¹―΅–Η―²–Α–Μ–Η―¹―¨ –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ―΄–Φ–Η –Ω―Ä–Η –Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Η p 0,05.
–†–Β–Ζ―É–Μ―¨―²–Α―²―΄
–‰―¹―¹–Μ–Β–¥―É–Β–Φ–Α―è –≤―΄–±–Ψ―Ä–Κ–Α
–£―¹–Β–≥–Ψ –±―΄–Μ–Ψ ―¹–Κ―Ä–Η–Ϋ–Η―Ä–Ψ–≤–Α–Ϋ–Ψ 157 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Α―¹―Ü–Η―²–Ψ–Φ (―¹ –Ϋ–Η–Ζ–Κ–Η–Φ ―¹–Ψ–¥–Β―Ä–Ε–Α–Ϋ–Η–Β–Φ –±–Β–Μ–Κ–Α) –Η –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Ψ–Ι –Ω–Β―΅–Β–Ϋ–Ψ―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨―é –Η–Μ–Η –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Β–Φ ―³―É–Ϋ–Κ―Ü–Η–Η –Ω–Ψ―΅–Β–Κ. –‰–Ζ –Ϋ–Η―Ö 83 –Ϋ–Β –Ω―Ä–Η–Ϋ―è–Μ–Η ―É―΅–Α―¹―²–Η–Β –≤ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η –≤ ―¹–≤―è–Ζ–Η ―¹ –Ϋ–Α–Μ–Η―΅–Η–Β–Φ –Κ―Ä–Η―²–Β―Ä–Η–Β–≤ –Η―¹–Κ–Μ―é―΅–Β–Ϋ–Η―è (61 –Ω–Α―Ü–Η–Β–Ϋ―²), ―¹–Φ–Β―Ä―²―¨―é –¥–Ψ ―Ä–Α–Ϋ–¥–Ψ–Φ–Η–Ζ–Α―Ü–Η–Η (8 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤). –‰–Ζ 74 ―Ä–Α–Ϋ–¥–Ψ–Φ–Η–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ 6 –±―΄–Μ–Η –Η―¹–Κ–Μ―é―΅–Β–Ϋ―΄ –Η–Ζ –Α–Ϋ–Α–Μ–Η–Ζ–Α ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Ψ–≤: ―¹ –Ω―è―²―¨―é (3 –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –Η 2 –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ) –±―΄–Μ –Ω–Ψ―²–Β―Ä―è–Ϋ –Κ–Ψ–Ϋ―²–Α–Κ―² ―¹―Ä–Α–Ζ―É –Ε–Β –Ω–Ψ―¹–Μ–Β ―Ä–Α–Ϋ–¥–Ψ–Φ–Η–Ζ–Α―Ü–Η–Η, –Α ―à–Β―¹―²–Ψ–Ι –Ω–Α―Ü–Η–Β–Ϋ―² (–Η–Ζ –≥―Ä―É–Ω–Ω―΄ –Ω–Μ–Α―Ü–Β–±–Ψ) –±―΄–Μ –Η―¹–Κ–Μ―é―΅–Β–Ϋ –Η–Ζ––Ζ–Α –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è ―É―¹–Μ–Ψ–≤–Η–Ι –Ω―Ä–Ψ―²–Ψ–Κ–Ψ–Μ–Α (–Ϋ–Β–Η–Ζ–≤–Β―¹―²–Ϋ–Α―è ―Ä–Α–Ϋ–Β–Β –Ω–Β―Ä–≤–Η―΅–Ϋ–Α―è –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Α –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Ψ–Φ). –Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, –≤ –Κ–Ψ–Ϋ–Β―΅–Ϋ―΄–Ι –Α–Ϋ–Α–Μ–Η–Ζ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –±―΄–Μ–Ψ –≤–Κ–Μ―é―΅–Β–Ϋ–Ψ 68 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤: 35 –Η–Ζ –≥―Ä―É–Ω–Ω―΄ –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –Η 33 – –Η–Ζ –≥―Ä―É–Ω–Ω―΄ –Ω–Μ–Α―Ü–Β–±–Ψ. –ü―Ä–Η―΅–Η–Ϋ–Α–Φ–Η –≤–Κ–Μ―é―΅–Β–Ϋ–Η―è –≤ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β ―è–≤–Μ―è–Μ–Η―¹―¨: –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Β –Ω–Ψ―΅–Β―΅–Ϋ–Ψ–Ι ―³―É–Ϋ–Κ―Ü–Η–Η ―É 20 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ (29%), ―²―è–Ε–Β–Μ–Α―è –Ω–Β―΅–Β–Ϋ–Ψ―΅–Ϋ–Α―è –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨ ―É 14 (21%) –Η –Ψ–±–Α –Κ―Ä–Η―²–Β―Ä–Η―è ―É 34 (50%). –†–Α–Ζ–Μ–Η―΅–Η–Ι –Φ–Β–Ε–¥―É –≥―Ä―É–Ω–Ω–Α–Φ–Η –Ω–Ψ –Κ―Ä–Η―²–Β―Ä–Η―è–Φ –≤–Κ–Μ―é―΅–Β–Ϋ–Η―è –≤―΄―è–≤–Μ–Β–Ϋ–Ψ –Ϋ–Β –±―΄–Μ–Ψ. 65% –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –±―΄–Μ–Η –≤–Κ–Μ―é―΅–Β–Ϋ―΄ –≤ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –≤–Ψ –≤―Ä–Β–Φ―è –≥–Ψ―¹–Ω–Η―²–Α–Μ–Η–Ζ–Α―Ü–Η–Η, 23 –Η–Ζ 35 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ – –≤ –≥―Ä―É–Ω–Ω―É –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α (66%) –Η 21 –Η–Ζ 33 – –≤ –≥―Ä―É–Ω–Ω―É –Ω–Μ–Α―Ü–Β–±–Ψ (64%). –™–Μ–Α–≤–Ϋ―΄–Φ–Η –Ω―Ä–Η―΅–Η–Ϋ–Α–Φ–Η –Ω–Ψ―¹―²―É–Ω–Μ–Β–Ϋ–Η―è –≤ ―¹―²–Α―Ü–Η–Ψ–Ϋ–Α―Ä –±―΄–Μ–Η –Α―¹―Ü–Η―², ―ç–Ϋ―Ü–Β―³–Α–Μ–Ψ–Ω–Α―²–Η―è –Η –Η–Ϋ―³–Β–Κ―Ü–Η–Η, –Ψ―²–Μ–Η―΅–Ϋ―΄–Β –Ψ―² –Γ–ë–ü. –£ –Ϋ–Α―΅–Α–Μ–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –Ϋ–Β –Ϋ–Α–±–Μ―é–¥–Α–Μ–Ψ―¹―¨ –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ―΄―Ö ―Ä–Α–Ζ–Μ–Η―΅–Η–Ι –Φ–Β–Ε–¥―É –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ–Η, –Ω–Ψ–Μ―É―΅–Α―é―â–Η–Φ–Η –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ –Η–Μ–Η –Ω–Μ–Α―Ü–Β–±–Ψ (―²–Α–±–Μ. 1). –Γ―Ö–Ψ–¥–Ϋ―΄–Φ–Η –±―΄–Μ–Η –Η –Ϋ–Α―΅–Α–Μ―¨–Ϋ―΄–Β ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η―¹―²–Η–Κ–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –≤–Κ–Μ―é―΅–Β–Ϋ–Ϋ―΄―Ö –≤ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –≤–Ψ –≤―Ä–Β–Φ―è –≥–Ψ―¹–Ω–Η―²–Α–Μ–Η–Ζ–Α―Ü–Η–Η –Η–Μ–Η –Ϋ–Α–±―Ä–Α–Ϋ–Ϋ―΄―Ö –Α–Φ–±―É–Μ–Α―²–Ψ―Ä–Ϋ–Ψ, –Κ―Ä–Ψ–Φ–Β ―΅–Α―¹―²–Ψ―²―΄ ―Ä–Β―³―Ä–Α–Κ―²–Β―Ä–Ϋ–Ψ–≥–Ψ –Α―¹―Ü–Η―²–Α, –Κ–Ψ―²–Ψ―Ä―΄–Ι ―΅–Α―â–Β –≤―¹―²―Ä–Β―΅–Α–Μ―¹―è ―É ―¹―²–Α―Ü–Η–Ψ–Ϋ–Α―Ä–Ϋ―΄―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö (43% –Ω―Ä–Ψ―²–Η–≤ 12%, p=0,02).
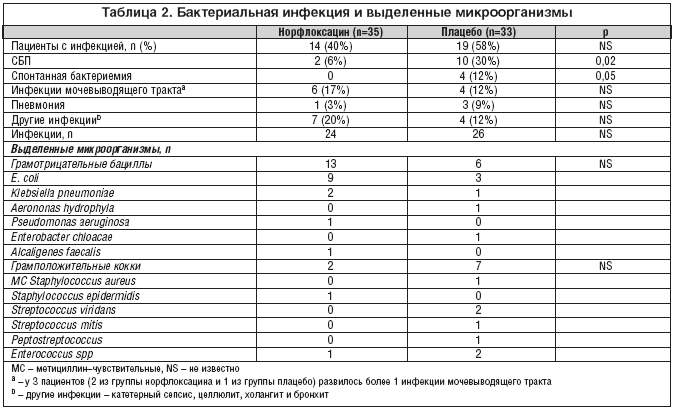
–ß–Α―¹―²–Ψ―²–Α –Γ–ë–ü –Η –¥―Ä―É–≥–Η―Ö –±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι
–Θ –¥–≤―É―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Η–Ζ –≥―Ä―É–Ω–Ω―΄ –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –Η ―É 10 –Η–Ζ –≥―Ä―É–Ω–Ω―΄ –Ω–Μ–Α―Ü–Β–±–Ψ ―Ä–Α–Ζ–≤–Η–Μ―¹―è –Γ–ë–ü (p=0,02), ―¹–Ω–Ψ–Ϋ―²–Α–Ϋ–Ϋ–Α―è –±–Α–Κ―²–Β―Ä–Η–Β–Φ–Η―è – ―É 0 –Η 4 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ (p=0,05). –ß–Α―¹―²–Ψ―²–Α –¥―Ä―É–≥–Η―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι –±―΄–Μ–Α ―¹―Ö–Ψ–¥–Ϋ–Α –≤ –¥–≤―É―Ö –≥―Ä―É–Ω–Ω–Α―Ö (―²–Α–±–Μ.?2). –£–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²―¨ ―Ä–Α–Ζ–≤–Η―²–Η―è –Γ–ë–ü –≤ ―²–Β―΅–Β–Ϋ–Η–Β1 –≥–Ψ–¥–Α –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –±―΄–Μ–Α –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –Ϋ–Η–Ε–Β (―Ä–Η―¹.?1). –Θ 7 –Η–Ζ 44 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ (16%), –≤–Κ–Μ―é―΅–Β–Ϋ–Ϋ―΄―Ö –≤ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –≤–Ψ –≤―Ä–Β–Φ―è –≥–Ψ―¹–Ω–Η―²–Α–Μ–Η–Ζ–Α―Ü–Η–Η, –≤–Ψ –≤―Ä–Β–Φ―è –Ω–Β―Ä–Η–Ψ–¥–Α –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è ―Ä–Α–Ζ–≤–Η–Μ―¹―è –Γ–ë–ü. –≠―²–Ψ―² –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―¨ ―¹―Ö–Ψ–¥–Β–Ϋ ―¹ ―²–Α–Κ–Ψ–≤―΄–Φ ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –≤–Κ–Μ―é―΅–Β–Ϋ–Ϋ―΄―Ö –Α–Φ–±―É–Μ–Α―²–Ψ―Ä–Ϋ–Ψ (5 –Η–Ζ 24; 21%).
–ë–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Ψ –±–Α–Κ―²–Β―Ä–Η–Ι, –≤―΄–¥–Β–Μ–Β–Ϋ–Ϋ―΄―Ö –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α, –±―΄–Μ–Η –≥―Ä–Α–Φ–Ψ―²―Ä–Η―Ü–Α―²–Β–Μ―¨–Ϋ―΄–Φ–Η –±–Α―Ü–Η–Μ–Μ–Α–Φ–Η (―²–Α–±–Μ. 2). –™―Ä–Α–Φ–Ω–Ψ–Μ–Ψ–Ε–Η―²–Β–Μ―¨–Ϋ―΄–Β –Κ–Ψ–Κ–Κ–Η –Η –≥―Ä–Α–Φ–Ψ―²―Ä–Η―Ü–Α―²–Β–Μ―¨–Ϋ―΄–Β –±–Α―Ü–Η–Μ–Μ―΄ –≤―΄–¥–Β–Μ―è–Μ–Η―¹―¨ –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ ―¹ –Ψ–¥–Η–Ϋ–Α–Κ–Ψ–≤–Ψ–Ι ―΅–Α―¹―²–Ψ―²–Ψ–Ι. 11 –Η–Ζ 13 –≥―Ä–Α–Φ–Ψ―²―Ä–Η―Ü–Α―²–Β–Μ―¨–Ϋ―΄―Ö –±–Α―Ü–Η–Μ–Μ, –≤―΄–¥–Β–Μ–Β–Ϋ–Ϋ―΄―Ö –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α, –±―΄–Μ–Η ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ―΄ –Κ ―Ö–Η–Ϋ–Ψ–Μ–Ψ–Ϋ–Α–Φ –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ –Μ–Η―à―¨ 1 –Η–Ζ 6, –≤―΄–¥–Β–Μ–Β–Ϋ–Ϋ―΄―Ö –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ (p=0,01). –£ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η –Ϋ–Β –Ϋ–Α–±–Μ―é–¥–Α–Μ–Ψ―¹―¨ –Ϋ–Η –Ψ–¥–Ϋ–Ψ–≥–Ψ ―¹–Μ―É―΅–Α―è –Γ–ë–ü, –≤―΄–Ζ–≤–Α–Ϋ–Ϋ–Ψ–≥–Ψ ―Ö–Η–Ϋ–Ψ–Μ–Ψ–Ϋ–―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ―΄–Φ–Η –±–Α–Κ―²–Β―Ä–Η―è–Φ–Η. –ü–Ψ―¹–Μ–Β–¥–Ϋ–Η–Β –≤―΄–¥–Β–Μ―è–Μ–Η―¹―¨ –≤ –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Β ―¹–Μ―É―΅–Α–Β–≤ –Ω―Ä–Η –Φ–Ψ―΅–Β–≤―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η―è―Ö.
11 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –Η 18 –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ –≤―΄–±―΄–Μ–Η –Η–Ζ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –¥–Ψ –Ζ–Α–≤–Β―Ä―à–Β–Ϋ–Η―è 1 –≥–Ψ–¥–Α –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è –≤ ―¹–≤―è–Ζ–Η ―¹ ―Ä–Α–Ζ–≤–Η―²–Η–Β–Φ –Γ–ë–ü (2 –Η 10 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ), ―²―Ä–Α–Ϋ―¹–Ω–Μ–Α–Ϋ―²–Α―Ü–Η–Β–Ι –Ω–Β―΅–Β–Ϋ–Η (6 –Η 6 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ) –Η –Ω–Ψ―²–Β―Ä–Β–Ι –Κ–Ψ–Ϋ―²–Α–Κ―²–Α (3 –Η 2 –Ω–Α―Ü–Η–Β–Ϋ―²–Α ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ). –ü–Ψ 3 –Ω–Α―Ü–Η–Β–Ϋ―²–Α –Η–Ζ –Κ–Α–Ε–¥–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ –±―΄–Μ–Η –Ϋ–Β–Κ–Ψ–Φ–Ω–Μ–Α–Β–Ϋ―²–Ϋ―΄. –ü―Ä–Η―΅–Η–Ϋ–Α–Φ–Η –Ϋ–Β–Κ–Ψ–Φ–Ω–Μ–Α–Β–Ϋ―²–Ϋ–Ψ―¹―²–Η –±―΄–Μ–Η: –Ψ―²–Κ–Α–Ζ –Ψ―² –Μ–Β―΅–Β–Ϋ–Η―è (3 –Η 1 –Ω–Α―Ü–Η–Β–Ϋ―² ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ) –Η ―¹–Μ–Α–±–Α―è –Ω―Ä–Η–≤–Β―Ä–Ε–Β–Ϋ–Ϋ–Ψ―¹―²―¨ –Κ –Μ–Β―΅–Β–Ϋ–Η―é (0 –Η 2 –Ω–Α―Ü–Η–Β–Ϋ―²–Α ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ). –≠―²–Η 6 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –±―΄–Μ–Η –≤–Κ–Μ―é―΅–Β–Ϋ―΄ –≤ –Η―²–Ψ–≥–Ψ–≤―΄–Ι –Α–Ϋ–Α–Μ–Η–Ζ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Ψ–≤. –ü–Ψ–±–Ψ―΅–Ϋ―΄―Ö ―ç―³―³–Β–Κ―²–Ψ–≤, ―¹–≤―è–Ζ–Α–Ϋ–Ϋ―΄―Ö ―¹ –Ω―Ä–Η–Β–Φ–Ψ–Φ –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –Η–Μ–Η –Ω–Μ–Α―Ü–Β–±–Ψ, –Ϋ–Β –Ϋ–Α–±–Μ―é–¥–Α–Μ–Ψ―¹―¨.
–ß–Α―¹―²–Ψ―²–Α –™–†–Γ
–ü–Ψ―΅–Β―΅–Ϋ–Α―è –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨ ―Ä–Α–Ζ–≤–Η–≤–Α–Μ–Α―¹―¨ –Ζ–Ϋ–Α―΅–Η–Φ–Ψ ―Ä–Β–Ε–Β ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –Ω–Ψ–Μ―É―΅–Α–≤―à–Η―Ö –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ (7 –Ω―Ä–Ψ―²–Η–≤ 16 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, p=0,03). –ü―Ä–Η―΅–Η–Ϋ–Α–Φ–Η –Ω–Ψ―΅–Β―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η –±―΄–Μ–Η ―¹–Μ–Β–¥―É―é―â–Η–Β: –™–†–Γ ―²–Η–Ω–Α–1 (6 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤) –Η ―²―Ä–Α–Ϋ–Ζ–Η―²–Ψ―Ä–Ϋ–Α―è –Ω–Ψ―΅–Β―΅–Ϋ–Α―è –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨ (1 –Ω–Α―Ü–Η–Β–Ϋ―²) –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α, –Η –™–†–Γ ―²–Η–Ω–Α–1 (1 –Ω–Α―Ü–Η–Β–Ϋ―²), –Ψ―¹―²―Ä―΄–Ι –≥–Μ–Ψ–Φ–Β―Ä―É–Μ–Ψ–Ϋ–Β―³―Ä–Η―² (1 –Ω–Α―Ü–Η–Β–Ϋ―²) –Η ―²―Ä–Α–Ϋ–Ζ–Η―²–Ψ―Ä–Ϋ–Α―è –Ω–Ψ―΅–Β―΅–Ϋ–Α―è –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨ (5 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤) –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ. –™–†–Γ –±―΄–Μ –Α―¹―¹–Ψ―Ü–Η–Η―Ä–Ψ–≤–Α–Ϋ ―¹ –±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–Ι –Η–Ϋ―³–Β–Κ―Ü–Η–Β–Ι ―É 4 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α (3 –Φ–Ψ―΅–Β–≤―΄–Β –Η–Ϋ―³–Β–Κ―Ü–Η–Η –Η 1 ―Ö–Ψ–Μ–Α–Ϋ–≥–Η―²) –Η ―É 6 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ (3 –Φ–Ψ―΅–Β–≤―΄–Β –Η–Ϋ―³–Β–Κ―Ü–Η–Η, 1 –Γ–ë–ü, 1 ―¹–Ω–Ψ–Ϋ―²–Α–Ϋ–Ϋ–Α―è –±–Α–Κ―²–Β―Ä–Η–Β–Φ–Η―è –Η 1 –Ω–Ϋ–Β–≤–Φ–Ψ–Ϋ–Η―è). –™–†–Γ ―Ä–Α–Ζ–≤–Η–Μ―¹―è –≤ ―²–Β―΅–Β–Ϋ–Η–Β –Ω–Β―Ä–≤―΄―Ö 3?–Φ–Β―¹―è―Ü–Β–≤ –Ω–Β―Ä–Η–Ψ–¥–Α –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è ―É 9 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ –Η –Μ–Η―à―¨ ―É 1 –Ω–Α―Ü–Η–Β–Ϋ―²–Α –Η–Ζ –≥―Ä―É–Ω–Ω―΄ –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α (p=0,006). –£–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²―¨ ―Ä–Α–Ζ–≤–Η―²–Η―è –™–†–Γ –≤ ―²–Β―΅–Β–Ϋ–Η–Β 1 –≥–Ψ–¥–Α –±―΄–Μ–Α –Ζ–Ϋ–Α―΅–Η–Φ–Ψ –Ϋ–Η–Ε–Β –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α (―Ä–Η―¹. 2).
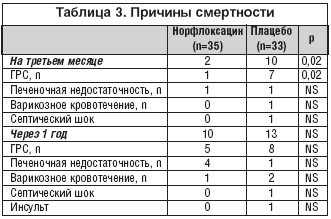
–Γ–Φ–Β―Ä―²–Ϋ–Ψ―¹―²―¨
–£―¹–Β–≥–Ψ ―É–Φ–Β―Ä–Μ–Ψ 10 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –Η 13 – –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ. –ü―Ä–Η―΅–Η–Ϋ―΄ ―¹–Φ–Β―Ä―²–Η –Ω–Ψ–Κ–Α–Ζ–Α–Ϋ―΄ –≤ ―²–Α–±–Μ–Η―Ü–Β 3. –™–Μ–Α–≤–Ϋ–Ψ–Ι –Ω―Ä–Η―΅–Η–Ϋ–Ψ–Ι ―¹–Φ–Β―Ä―²–Ϋ–Ψ―¹―²–Η –≤ –Ψ–±–Β–Η―Ö –≥―Ä―É–Ω–Ω–Α―Ö ―è–≤–Η–Μ–Α―¹―¨ –™–†–ù (5 –Η 8 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ). –Γ–Φ–Β―Ä―²–Ϋ–Ψ―¹―²―¨ –≤ ―²–Β―΅–Β–Ϋ–Η–Β –Ω–Β―Ä–≤―΄―Ö 3 –Φ–Β―¹―è―Ü–Β–≤ –Ω–Β―Ä–Η–Ψ–¥–Α –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è –±―΄–Μ–Α –Ζ–Ϋ–Α―΅–Η–Φ–Ψ –≤―΄―à–Β –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ (10?–Ω―Ä–Ψ―²–Η–≤ 2 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, p=0,02). –Δ―Ä–Β―Ö–Φ–Β―¹―è―΅–Ϋ–Α―è (94% ―¹―Ä–Β–¥–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –Ω–Ψ–Μ―É―΅–Α―é―â–Η―Ö –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ, –Ω―Ä–Ψ―²–Η–≤ 62% –Ω–Ψ–Μ―É―΅–Α―é―â–Η―Ö –Ω–Μ–Α―Ü–Β–±–Ψ) –Η –≥–Ψ–¥–Ψ–≤–Α―è –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²―¨ (60% –Ω―Ä–Ψ―²–Η–≤ 48% ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ, p=0,05, ―Ä–Η―¹. 3) –±―΄–Μ–Α –Ζ–Ϋ–Α―΅–Η–Φ–Ψ –≤―΄―à–Β –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α.
–û–±―¹―É–Ε–¥–Β–Ϋ–Η–Β
–£ –¥–Α–Ϋ–Ϋ–Ψ–Φ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η –≥―Ä―É–Ω–Ω–Α –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, ―¹―²―Ä–Α–¥–Α―é―â–Η―Ö ―Ü–Η―Ä―Ä–Ψ–Ζ–Ψ–Φ –Ω–Β―΅–Β–Ϋ–Η, ―¹ –≤―΄―¹–Ψ–Κ–Η–Φ ―Ä–Η―¹–Κ–Ψ–Φ ―Ä–Α–Ζ–≤–Η―²–Η―è –™–†–Γ –Η –Γ–ë–ü, –≤―΄―è–≤–Μ–Β–Ϋ–Α ―¹ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β–Φ –Ω―Ä–Ψ―¹―²―΄―Ö –Ω–Α―Ä–Α–Φ–Β―²―Ä–Ψ–≤, –Κ–Ψ―²–Ψ―Ä―΄–Β –Ψ―Ü–Β–Ϋ–Η–≤–Α―é―² –Α–Ϋ―²–Η–±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―É―é –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Α―¹―Ü–Η―²–Η―΅–Β―¹–Κ–Ψ–Ι –Ε–Η–¥–Κ–Ψ―¹―²–Η, ―¹―²–Β–Ω–Β–Ϋ―¨ –Ω–Β―΅–Β–Ϋ–Ψ―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η –Η ―²―è–Ε–Β―¹―²―¨ –Ω–Ψ―΅–Β―΅–Ϋ–Ψ–Ι –¥–Η―¹―³―É–Ϋ–Κ―Ü–Η–Η. –£–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²―¨ ―Ä–Α–Ζ–≤–Η―²–Η―è –Γ–ë–ü –Η –™–†–Γ –≤ ―²–Β―΅–Β–Ϋ–Η–Β 1 –≥–Ψ–¥–Α –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ ―¹–Ψ―¹―²–Α–≤–Η–Μ–Α 61 –Η 41% ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ. –£–Α–Ε–Ϋ–Ψ –Ψ―²–Φ–Β―²–Η―²―¨ –Ψ―΅–Β–Ϋ―¨ –≤―΄―¹–Ψ–Κ―É―é ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –≤–Ϋ―É―²―Ä–Η–≤–Β–Ϋ–Ϋ–Ψ–≥–Ψ –≤–≤–Β–¥–Β–Ϋ–Η―è –Α–Μ―¨–±―É–Φ–Η–Ϋ–Α –¥–Μ―è –Ω―Ä–Β–¥–Ψ―²–≤―Ä–Α―â–Β–Ϋ–Η―è ―Ä–Α–Ζ–≤–Η―²–Η―è –™–†–Γ. –Δ–Ψ–Μ―¨–Κ–Ψ ―É 1 –Η–Ζ 12 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Γ–ë–ü (8%) ―Ä–Α–Ζ–≤–Η―²–Η–Β –™–†–Γ –±―΄–Μ–Ψ –Α―¹―¹–Ψ―Ü–Η–Η―Ä–Ψ–≤–Α–Ϋ–Ψ ―¹ –Η–Ϋ―³–Β–Κ―Ü–Η–Β–Ι. –≠―²–Ψ―² –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―¨ –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –Ϋ–Η–Ε–Β ―²–Α–Κ–Ψ–≤–Ψ–≥–Ψ –Ω―Ä–Η –Ψ―²―¹―É―²―¹―²–≤–Η–Η –≤–≤–Β–¥–Β–Ϋ–Η―è –Α–Μ―¨–±―É–Φ–Η–Ϋ–Α (30–40%) [6].
–‰―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β, ―Ü–Β–Μ―¨―é –Κ–Ψ―²–Ψ―Ä–Ψ–≥–Ψ ―è–≤–Η–Μ–Α―¹―¨ –Ψ―Ü–Β–Ϋ–Κ–Α ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –¥–Μ–Η―²–Β–Μ―¨–Ϋ–Ψ–≥–Ψ –≤–≤–Β–¥–Β–Ϋ–Η―è –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α, –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Ψ –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ–Β –≤–Μ–Η―è–Ϋ–Η–Β –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Β–≥–Ψ –Ϋ–Α ―²–Β―΅–Β–Ϋ–Η–Β –±–Ψ–Μ–Β–Ζ–Ϋ–Η ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Ϋ–Α –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η―Ö ―¹―²–Α–¥–Η―è―Ö ―Ü–Η―Ä―Ä–Ψ–Ζ–Α. –ü–Ψ ―ç―²–Ψ–Ι –Ω―Ä–Η―΅–Η–Ϋ–Β –Κ–Ψ–Ϋ–Β―΅–Ϋ―΄–Φ–Η ―²–Ψ―΅–Κ–Α–Φ–Η –±―΄–Μ–Η –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²―¨ ―Ä–Α–Ζ–≤–Η―²–Η―è –Γ–ë–ü –Η –™–†–Γ –≤ ―²–Β―΅–Β–Ϋ–Η–Β 1 –≥–Ψ–¥–Α –Η –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²―¨. –Ξ–Ψ―²―è –≤ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η –Ω―Ä–Η–Ϋ―è–Μ–Α ―É―΅–Α―¹―²–Η–Β –Μ–Η―à―¨ –Ψ–≥―Ä–Α–Ϋ–Η―΅–Β–Ϋ–Ϋ–Α―è –≥―Ä―É–Ω–Ω–Α –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –¥–Β–Κ–Ψ–Φ–Ω–Β–Ϋ―¹–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄–Φ ―Ü–Η―Ä―Ä–Ψ–Ζ–Ψ–Φ –Ω–Β―΅–Β–Ϋ–Η, –Ψ–Ϋ–Α –Ω―Ä–Β–¥―¹―²–Α–≤–Μ―è–Β―² –±–Ψ–Μ―¨―à–Ψ–Β ―΅–Η―¹–Μ–Ψ –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –Ϋ–Α–Ω―Ä–Α–≤–Μ–Β–Ϋ–Ϋ―΄―Ö –Ϋ–Α ―²―Ä–Α–Ϋ―¹–Ω–Μ–Α–Ϋ―²–Α―Ü–Η―é –Ω–Β―΅–Β–Ϋ–Η (32% –Η–Ζ 459?–Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤ –Ϋ–Α―à–Β–Φ ―Ü–Β–Ϋ―²―Ä–Β –Ζ–Α –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η–Β 5 –Μ–Β―²). –‰–Φ–Β–Ϋ–Ϋ–Ψ ―¹ ―ç―²–Η–Φ ―¹–≤―è–Ζ–Α–Ϋ–Ψ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β 3––Φ–Β―¹―è―΅–Ϋ–Ψ–Ι –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²–Η –≤ –Κ–Α―΅–Β―¹―²–≤–Β –Ω–Β―Ä–≤–Η―΅–Ϋ–Ψ–Ι –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ–Ι ―²–Ψ―΅–Κ–Η. –€―΄ ―Ö–Ψ―²–Β–Μ–Η ―É–Ζ–Ϋ–Α―²―¨, –Φ–Ψ–Ε–Β―² –Μ–Η ―É–Μ―É―΅―à–Η―²―¨―¹―è –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –Ψ–Ε–Η–¥–Α―é―â–Η―Ö ―²―Ä–Α–Ϋ―¹–Ω–Μ–Α–Ϋ―²–Α―Ü–Η―é –Ω–Β―΅–Β–Ϋ–Η, –Ω―Ä–Η –Ω–Β―Ä–≤–Η―΅–Ϋ–Ψ–Ι –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Β ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α.
–£–Μ–Η―è–Ϋ–Η–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –Ϋ–Α –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Β ―²–Β―΅–Β–Ϋ–Η–Β –±–Ψ–Μ–Β–Ζ–Ϋ–Η ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Ϋ–Α –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η―Ö ―¹―²–Α–¥–Η―è―Ö ―Ü–Η―Ä―Ä–Ψ–Ζ–Α ―¹–≤―è–Ζ–Α–Ϋ–Ψ ―¹–Ψ –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ―΄–Φ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β–Φ –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²–Η ―Ä–Α–Ζ–≤–Η―²–Η―è –Γ–ë–ü –Η –™–†–Γ –≤ ―²–Β―΅–Β–Ϋ–Η–Β 1 –≥–Ψ–¥–Α. –ë–Ψ–Μ–Β–Β ―²–Ψ–≥–Ψ, –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ ―É–≤–Β–Μ–Η―΅–Η–Μ–Α―¹―¨ 3––Φ–Β―¹―è―΅–Ϋ–Α―è –Η –≥–Ψ–¥–Ψ–≤–Α―è –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²―¨. –£–Α–Ε–Ϋ–Ψ –Ψ―²–Φ–Β―²–Η―²―¨, ―΅―²–Ψ ―Ä–Α–Ζ–Μ–Η―΅–Η–Β –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Ι –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²–Η –Φ–Β–Ε–¥―É –≥―Ä―É–Ω–Ω–Α–Φ–Η –±―΄–Μ–Ψ –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –≤―΄―Ä–Α–Ε–Β–Ϋ–Ψ –Ϋ–Α ―²―Ä–Β―²―¨–Β–Φ –Φ–Β―¹―è―Ü–Β –Η ―¹–Ϋ–Η–Ε–Α–Μ–Ψ―¹―¨ –Κ 1 –≥–Ψ–¥―É –Ω–Β―Ä–Η–Ψ–¥–Α –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è. –ü–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É –Φ―΄ –Ϋ–Β–¥–Ψ–Ψ―Ü–Β–Ϋ–Η–Μ–Η –≥–Ψ–¥–Ψ–≤―É―é –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²―¨ –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ –Ω―Ä–Η ―Ä–Α―¹―΅–Β―²–Β ―Ä–Α–Ζ–Φ–Β―Ä–Α –≤―΄–±–Ψ―Ä–Κ–Η, –Φ―΄ –Ϋ–Β –Φ–Ψ–Ε–Β–Φ ―¹–¥–Β–Μ–Α―²―¨ –≤―΄–≤–Ψ–¥―΄ –Ω–Ψ –Ω–Ψ–≤–Ψ–¥―É –¥–Α–Ϋ–Ϋ–Ψ–Ι ―¹–Ω–Β―Ü–Η―³–Η―΅–Ϋ–Ψ–Ι –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ–Ι ―²–Ψ―΅–Κ–Η.
–ü–Ψ –¥–Α–Ϋ–Ϋ―΄–Φ –Ϋ–Β–¥–Α–≤–Ϋ–Η―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι, –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Α –Γ–ë–ü –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Ψ–Φ ―¹–Β–Ι―΅–Α―¹ –Φ–Ψ–Ε–Β―² –±―΄―²―¨ –Ϋ–Β ―¹―²–Ψ–Μ―¨ ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Α, –Κ–Α–Κ –≤ –Ω―Ä–Ψ―à–Μ–Ψ–Φ, –Η–Ζ––Ζ–Α –≤–Ψ–Ζ―Ä–Ψ―¹―à–Β–Ι ―΅–Α―¹―²–Ψ―²―΄ –≤―¹―²―Ä–Β―΅–Α–Β–Φ–Ψ―¹―²–Η ―Ö–Η–Ϋ–Ψ–Μ–Ψ–Ϋ–―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ―΄―Ö –±–Α–Κ―²–Β―Ä–Η–Ι –≤ ―³–Β–Κ–Α–Μ―¨–Ϋ–Ψ–Ι ―³–Μ–Ψ―Ä–Β –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ ―Ü–Η―Ä―Ä–Ψ–Ζ–Ψ–Φ (–≤―²–Ψ―Ä–Η―΅–Ϋ–Ψ, –Η–Ζ––Ζ–Α ―à–Η―Ä–Ψ–Κ–Ψ–≥–Ψ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―è ―ç―²–Η―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤) [21,30–33]. –ù–Α―à–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –Ϋ–Β –≤―΄―¹―²―É–Ω–Α–Β―² –≤ –Ω–Ψ–¥–¥–Β―Ä–Ε–Κ―É ―ç―²–Ψ–Ι –Κ–Ψ–Ϋ―Ü–Β–Ω―Ü–Η–Η. –Δ–Ψ–Μ―¨–Κ–Ψ ―É 2 –Η–Ζ 35 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –≤–Ψ –≤―Ä–Β–Φ―è –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è ―Ä–Α–Ζ–≤–Η–Μ―¹―è –Γ–ë–ü, –Η –Ϋ–Η –≤ –Ψ–¥–Ϋ–Ψ–Φ ―¹–Μ―É―΅–Α–Β –Η–Ϋ―³–Β–Κ―Ü–Η―è –Ϋ–Β –±―΄–Μ–Α –≤―΄–Ζ–≤–Α–Ϋ–Α ―Ö–Η–Ϋ–Ψ–Μ–Ψ–Ϋ–―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ―΄–Φ–Η –±–Α–Κ―²–Β―Ä–Η―è–Φ–Η. –≠―²–Η –±–Α–Κ―²–Β―Ä–Η–Η –≤―΄–¥–Β–Μ―è–Μ–Η―¹―¨ –≤ –Ψ―¹–Ϋ–Ψ–≤–Ϋ–Ψ–Φ –Ω―Ä–Η –Φ–Ψ―΅–Β–≤―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η―è―Ö. –Γ –¥―Ä―É–≥–Ψ–Ι ―¹―²–Ψ―Ä–Ψ–Ϋ―΄, –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²―¨ ―Ä–Α–Ζ–≤–Η―²–Η―è –Γ–ë–ü –≤ ―²–Β―΅–Β–Ϋ–Η–Β 1 –≥–Ψ–¥–Α –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –Η –Ω–Μ–Α―Ü–Β–±–Ψ –≤ –¥–Α–Ϋ–Ϋ–Ψ–Φ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η –±―΄–Μ–Α ―¹―Ä–Α–≤–Ϋ–Η–Φ–Α ―¹ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Α–Φ–Η –™–Η–Ϋ–Β―¹–Α –Η –¥―Ä. [7], –Ω–Ψ–Μ―É―΅–Β–Ϋ–Ϋ―΄–Φ–Η –≤ 1990 –≥. –≤ –Η―Ö –Ω–Η–Μ–Ψ―²–Ϋ–Ψ–Φ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η –Ω–Ψ –Ψ―Ü–Β–Ϋ–Κ–Β ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –≤ –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Β ―Ä–Β―Ü–Η–¥–Η–≤–Ψ–≤ –Γ–ë–ü.
–€–Β―Ö–Α–Ϋ–Η–Ζ–Φ, –Ω–Ψ –Κ–Ψ―²–Ψ―Ä–Ψ–Φ―É –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ ―¹–Ψ–Κ―Ä–Α―â–Α–Μ –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²―¨ ―Ä–Α–Ζ–≤–Η―²–Η―è –™–†–Γ, –Ϋ–Β –Ζ–Α–≤–Η―¹–Β–Μ –Ψ―² –Β–≥–Ψ ―Ä–Ψ–Μ–Η –≤ –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Β –Γ–ë–ü, –Ω–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ ―²–Ψ–Μ―¨–Κ–Ψ ―É 1 –Ω–Α―Ü–Η–Β–Ϋ―²–Α –Η–Ζ––Ζ–Α –Η–Ϋ―³–Β–Κ―Ü–Η–Η ―Ä–Α–Ζ–≤–Η–Μ―¹―è –™–†–Γ. –Δ–Α–Κ–Ε–Β –¥–Α–Ϋ–Ϋ―΄–Ι ―ç―³―³–Β–Κ―² –Ϋ–Β –±―΄–Μ ―¹–≤―è–Ζ–Α–Ϋ ―¹ –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Ψ–Ι –¥―Ä―É–≥–Η―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι, –Ω–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É –Ψ–Ϋ–Η –Ψ–¥–Η–Ϋ–Α–Κ–Ψ–≤–Ψ ―΅–Α―¹―²–Ψ –≤―¹―²―Ä–Β―΅–Α–Μ–Η―¹―¨ –≤ –Ψ–±–Β–Η―Ö –≥―Ä―É–Ω–Ω–Α―Ö. –ü–Ψ―¹–Μ–Β–¥–Ϋ–Η–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Η, ―΅―²–Ψ ―¹–Β–Μ–Β–Κ―²–Η–≤–Ϋ–Α―è –¥–Β–Κ–Ψ–Ϋ―²–Α–Φ–Η–Ϋ–Α―Ü–Η―è –Κ–Η―à–Β―΅–Ϋ–Η–Κ–Α –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Ψ–Φ ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ ―Ü–Η―Ä―Ä–Ψ–Ζ–Ψ–Φ –±–Β–Ζ –±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–Ι –Η–Ϋ―³–Β–Κ―Ü–Η–Η –≤―΄–Ζ―΄–≤–Α–Β―² –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ–Β ―É–Μ―É―΅―à–Β–Ϋ–Η–Β ―Ü–Η―Ä–Κ―É–Μ―è―²–Ψ―Ä–Ϋ–Ψ–Ι ―³―É–Ϋ–Κ―Ü–Η–Η –≤―¹–Μ–Β–¥―¹―²–≤–Η–Β –Ω–Ψ–≤―΄―à–Β–Ϋ–Η―è –Α―Ä―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –¥–Α–≤–Μ–Β–Ϋ–Η―è –Η ―¹–Η―¹―²–Β–Φ–Ϋ–Ψ–Ι ―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–Ι ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²–Η, –Α ―²–Α–Κ–Ε–Β –Ω–Ψ–¥–Α–≤–Μ–Β–Ϋ–Η―è –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η ―Ä–Β–Ϋ–Η–Ϋ–Α –Ω–Μ–Α–Ζ–Φ―΄ –Κ―Ä–Ψ–≤–Η [27,28].
–≠―²–Ψ ―¹–≤―è–Ζ–Α–Ϋ–Ψ ―¹–Ψ –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ―΄–Φ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β–Φ ―Ü–Η―Ä–Κ―É–Μ―è―Ü–Η–Η –Μ–Η–Ω–Ψ–Ω–Ψ–Μ–Η―¹–Α―Ö–Α―Ä–Η–¥–―¹–≤―è–Ζ―΄–≤–Α―é―â–Β–≥–Ψ –Ω―Ä–Ψ―²–Β–Η–Ϋ–Α (–Φ–Α―Ä–Κ–Β―Ä ―ç–Ϋ–¥–Ψ―²–Ψ–Κ―¹–Β–Φ–Η–Η), ―Ü–Η―²–Ψ–Κ–Η–Ϋ–Ψ–≤, –Φ–Β―²–Α–±–Ψ–Μ–Η―²–Ψ–≤ –Ψ–Κ―¹–Η–¥–Α –Α–Ζ–Ψ―²–Α –Η ―É–Φ–Β–Ϋ―¨―à–Β–Ϋ–Η–Β–Φ ―²―Ä–Α–Ϋ―¹–Μ–Ψ–Κ–Α―Ü–Η–Η –±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ―΄―Ö –Ω―Ä–Ψ–¥―É–Κ―²–Ψ–≤ –Η–Ζ –Κ–Η―à–Β―΅–Ϋ–Η–Κ–Α –≤ ―¹–Η―¹―²–Β–Φ–Ϋ―΄–Ι –Κ―Ä–Ψ–≤–Ψ―²–Ψ–Κ [27]. –Θ–Μ―É―΅―à–Β–Ϋ–Η–Β ―¹–Η―¹―²–Β–Φ–Ϋ–Ψ–≥–Ψ –Κ―Ä–Ψ–≤–Ψ―²–Ψ–Κ–Α, –≤―΄–Ζ–≤–Α–Ϋ–Ϋ–Ψ–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Ψ–Φ – –Ω―Ä–Η–≤–Μ–Β–Κ–Α―²–Β–Μ―¨–Ϋ–Α―è –≥–Η–Ω–Ψ―²–Β–Ζ–Α –¥–Μ―è –Ψ–±―ä―è―¹–Ϋ–Β–Ϋ–Η―è –Ϋ–Α―à–Η―Ö ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Ψ–≤, –Ω–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É ―¹―²–Β–Ω–Β–Ϋ―¨ –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è ―Ü–Η―Ä–Κ―É–Μ―è―²–Ψ―Ä–Ϋ–Ψ–Ι –Η –Ω–Ψ―΅–Β―΅–Ϋ–Ψ–Ι ―³―É–Ϋ–Κ―Ü–Η–Ι ―è–≤–Μ―è–Β―²―¹―è –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤–Α–Ε–Ϋ―΄–Φ –Ω―Ä–Β–¥–Η–Κ―²–Ψ―Ä–Ψ–Φ ―Ä–Α–Ζ–≤–Η―²–Η―è –™–†–Γ ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ ―Ü–Η―Ä―Ä–Ψ–Ζ–Ψ–Φ –Η –Α―¹―Ü–Η―²–Ψ–Φ [17,18]. –ü―è―²–Ϋ–Α–¥―Ü–Α―²―¨ –Η–Ζ 16 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ ―Ä–Α–Ζ–≤–Η–≤―à–Η–Φ―¹―è –™–†–Γ ―É–Φ–Β―Ä–Μ–Η. –‰ –Η–Φ–Β–Ϋ–Ϋ–Ψ –™–†–Γ –±―΄–Μ ―¹–Α–Φ–Ψ–Ι ―΅–Α―¹―²–Ψ–Ι –Ω―Ä–Η―΅–Η–Ϋ–Ψ–Ι ―¹–Φ–Β―Ä―²–Η –≤ –Ϋ–Α―à–Β–Φ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η. –Ξ–Ψ―²―è –Ϋ–Β –≤―΄―è–≤–Μ–Β–Ϋ–Ψ –Ζ–Ϋ–Α―΅–Η–Φ–Ψ–Ι ―Ä–Α–Ζ–Ϋ–Η―Ü―΄ –Ω–Ψ ―΅–Α―¹―²–Ψ―²–Β ―Ä–Α–Ζ–≤–Η―²–Η―è –™–†–Γ –Φ–Β–Ε–¥―É –≥―Ä―É–Ω–Ω–Α–Φ–Η, ―ç―²–Ψ –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Β –≤–Ψ–Ζ–Ϋ–Η–Κ–Α–Μ–Ψ –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –Ω–Ψ–Ζ–Ε–Β ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤ –≥―Ä―É–Ω–Ω–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α. –†–Α–Ζ–Μ–Η―΅–Η―è –≤ ―É―Ä–Ψ–≤–Ϋ–Β –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²–Η –Ω–Ψ –≥―Ä―É–Ω–Ω–Α–Φ, ―¹–Μ–Β–¥–Ψ–≤–Α―²–Β–Μ―¨–Ϋ–Ψ, ―²–Α–Κ–Ε–Β –±―΄–Μ–Ψ ―¹–≤―è–Ζ–Α–Ϋ–Ψ ―¹–Ψ –≤―Ä–Β–Φ–Β–Ϋ–Β–Φ –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è –™–†–Γ.
–£–Α–Ε–Ϋ―΄–Φ –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η–Β–Φ ―è–≤–Μ―è–Β―²―¹―è ―²–Ψ, ―΅―²–Ψ –Ω–Ψ–Μ–Ψ–Ε–Η―²–Β–Μ―¨–Ϋ–Ψ–Β –≤–Μ–Η―è–Ϋ–Η–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –Ϋ–Α ―Ä–Α–Ζ–≤–Η―²–Η–Β –™–†–Γ –Η ―¹–Φ–Β―Ä―²–Ϋ–Ψ―¹―²―¨ –Ψ–≥―Ä–Α–Ϋ–Η―΅–Η–≤–Α–Μ–Ψ―¹―¨ –≤ –Ψ―¹–Ϋ–Ψ–≤–Ϋ–Ψ–Φ ―²―Ä–Β–Φ―è –Φ–Β―¹―è―Ü–Α–Φ–Η –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è. –Θ –Ϋ–Α―¹ –Ϋ–Β―² ―΅–Β―²–Κ–Η―Ö –Ψ–±―ä―è―¹–Ϋ–Β–Ϋ–Η–Ι ―ç―²–Ψ–≥–Ψ ―³–Β–Ϋ–Ψ–Φ–Β–Ϋ–Α, –Ω–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É –≤–Μ–Η―è–Ϋ–Η–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α –Ϋ–Α ―Ä–Α–Ζ–≤–Η―²–Η–Β –Γ–ë–ü –Ω―Ä–Ψ–¥–Ψ–Μ–Ε–Α–Μ–Ψ―¹―¨ –≤ ―²–Β―΅–Β–Ϋ–Η–Β –≤―¹–Β–≥–Ψ –Ω–Β―Ä–Η–Ψ–¥–Α –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è. –Δ–Α–Κ–Ε–Β ―É –Ϋ–Α―¹ –Ϋ–Β―² –Ψ–±―ä―è―¹–Ϋ–Β–Ϋ–Η–Ι –±–Ψ–Μ–Β–Β –≤―΄―¹–Ψ–Κ–Ψ–≥–Ψ ―É―Ä–Ψ–≤–Ϋ―è –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ –¥–Α–Ϋ–Ϋ―΄–Φ–Η –Ω―Ä–Β–¥―΄–¥―É―â–Η―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι ―¹―Ä–Β–¥–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ ―²―è–Ε–Β–Μ–Ψ–Ι –Ω–Β―΅–Β–Ϋ–Ψ―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨―é –Η–Μ–Η –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Β–Φ –Ω–Ψ―΅–Β―΅–Ϋ–Ψ–Ι ―³―É–Ϋ–Κ―Ü–Η–Η.
–£ –Ζ–Α–Κ–Μ―é―΅–Β–Ϋ–Η–Β –Φ–Ψ–Ε–Ϋ–Ψ ―¹–Κ–Α–Ζ–Α―²―¨, ―΅―²–Ψ –Ω–Β―Ä–≤–Η―΅–Ϋ–Α―è –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Α –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Ψ–Φ ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Ϋ–Α –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η―Ö ―¹―²–Α–¥–Η―è―Ö ―Ü–Η―Ä―Ä–Ψ–Ζ–Α –Ω–Β―΅–Β–Ϋ–Η –Η –Α―¹―Ü–Η―²–Ψ–Φ ―¹ –Ϋ–Η–Ζ–Κ–Η–Φ ―¹–Ψ–¥–Β―Ä–Ε–Α–Ϋ–Η–Β–Φ –±–Β–Μ–Κ–Α ―¹–≤―è–Ζ–Α–Ϋ–Α ―¹–Ψ –Ζ–Ϋ–Α―΅–Η–Φ―΄–Φ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β–Φ ―Ä–Α–Ζ–≤–Η―²–Η―è –Γ–ë–ü –Η –™–†–Γ –≤ ―²–Β―΅–Β–Ϋ–Η–Β 1 –≥–Ψ–¥–Α –Η ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β–Φ 3––Φ–Β―¹―è―΅–Ϋ–Ψ–Ι –Η –≥–Ψ–¥–Ψ–≤–Ψ–Ι –≤―΄–Ε–Η–≤–Α–Β–Φ–Ψ―¹―²–Η. –û―΅–Β–≤–Η–¥–Ϋ–Ψ, ―΅―²–Ψ ―²–Α–Κ–Η–Φ –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ –Ω–Ψ–Κ–Α–Ζ–Α–Ϋ–Ψ –¥–Μ–Η―²–Β–Μ―¨–Ϋ–Ψ–Β –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β –Ϋ–Ψ―Ä―³–Μ–Ψ–Κ―¹–Α―Ü–Η–Ϋ–Α, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –≤ –Ω–Β―Ä–Η–Ψ–¥ –Ψ–Ε–Η–¥–Α–Ϋ–Η―è –Ψ–Ω–Β―Ä–Α―Ü–Η–Η ―²―Ä–Α–Ϋ―¹–Ω–Μ–Α–Ϋ―²–Α―Ü–Η–Η –Ω–Β―΅–Β–Ϋ–Η.
–†–Β―³–Β―Ä–Α―² –Ω–Ψ–¥–≥–Ψ―²–Ψ–≤–Μ–Β–Ϋ –ï.–ê. –ö–Μ–Η–Φ–Ψ–≤–Ψ–Ι –Ω–Ψ –Φ–Α―²–Β―Ä–Η–Α–Μ–Α–Φ ―¹―²–Α―²―¨–Η Javier Fernandez, Miquel Navasa, Ramon Planas et al. «Primary Prophylaxis of Spontaneous Bacterial Peritonitis Delays Hepatorenal Syndrome and Improves Survival in Cirrhosis». –•―É―Ä–Ϋ–Α–Μ –≥–Α―¹―²―Ä–Ψ―ç–Ϋ―²–Β―Ä–Ψ–Μ–Ψ–≥–Η–Η 2007;
133: ―¹―²―Ä. 818–824.



–¦–Η―²–Β―Ä–Α―²―É―Ä–Α
1. Navasa M, Rimola A, Rodes J. Bacterial infections in liver disease. Semin Liver Dis 1997;17:323–333.
2. Wong F, Bernardi M, Balk R, Christman B, Moreau R, Garcia–Tsao G, Patch D, Soriano G, Hoefs J, Navasa M, on behalf of the International Ascites Club. Sepsis in cirrhosis: report on the 7th meeting of the International Ascites Club. Gut 2005;54:718–725.
3. Follo A, Llovet JM, Navasa M, Planas R, Forns X, Francitorra A, Rimola A, Gassull MA, Arroyo V, Rodes J. Renal impairment after spontaneous bacterial peritonitis in cirrhosis: incidence, clinical course, predictive factors and prognosis. Hepatology 1994;20:1495–1401.
4. Navasa M, Follo A, Filella X, Jimenez W, Francitorra A, Planas R, Rimola A, Arroyo V, Rodes J. Tumor necrosis factor and interleukin–6 in spontaneous bacterial peritonitis in cirrhosis: relationship with the development of renal impairment and mortality. Hepatology 1998;27:1227–1232.
5. Ruiz–del–Arbol L, Urman J, Fernandez J, Gonzalez M, Navasa M, Monescillo A, Albillos A, Jimenez W, Arroyo V. Systemic, renal and hepatic hemodynamic derangement in cirrhotic patients with spontaneous bacterial peritonitis. Hepatology 2003;38:1210–1218.
6. Sort P, Navasa M, Arroyo V, Aldeguer X, Planas R, Ruiz–del–Arbol L, Castells L, Vargas V, Soriano G, Guevara M, Gines P, Rodes J. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med 1999;341:403–409.
7. Gines P, Rimola A, Planas R, Vargas V, Marco F, Almela M, Forne M, Miranda ML, Llach J, Salmeron JM, Esteve M, Marques JM, Jimenez de Anta MT, Arroyo V, Rodes J. Norfloxacin prevents spontaneous bacterial peritonitis recurrence in cirrhosis: results of a double–blind, placebo–controlled trial. Hepatology 1990;12:716–724.
8. Rolanchon A, Cordier L, Bacq Y, Nousbaum JB, Franza A, Paris JC, Fratte S, Bohn B, Kitmacher P, Stahl JP, Zarski JP. Ciprofloxacin and long–term prevention of spontaneous bacterial peritonitis: results of a prospective controlled trial. Hepatology 1995;22:1171–1174.
9. Singh N, Gayowski T, Yu VL, Wagener MM. Trimethoprim–sulfamethoxazole for the prevention of spontaneous bacterial peritonitis in cirrhosis: a randomized trial. Ann Intern Med 1995;122:595–598.
10. Bauer TM, Follo A, Navasa M, Vila J, Planas R, Clemente G, Vargas V, Bory F, Vaquer P, Rodes J. Daily norfloxacin is more effective than weekly rufloxacin in prevention of spontaneous bacterial peritonitis recurrence. Dig Dis Sci 2002;47:1356–1361.
11. Sandhu BS, Gupta R, Sharma J, Singh J, Murthy NS, Sarin SK. Norfloxacin and cisapride combination decreases the incidence of spontaneous bacterial peritonitis in cirrhotic ascites. J Gastroenterol Hepatol 2005;20:599–605.
12. Grange JD, Roulot D, Pelletier G, Pariente EA, Denis J, Ink O, Blanc P, Richardet JP, Vinel JP, Delisle F, Fischer D, Flahault A, Amiot X. Norfloxacin primary prophylaxis of bacterial infections in cirrhotic patients with ascites: a double–blind randomized trial. J Hepatol 1998;29:430–436.
13. Runyon BA. Low–protein–concentration ascitic fluid is predisposed to spontaneous bacterial peritonitis. Gastroenterology 1986;91:1343–1346.
14. Llach J, Rimola A, Navasa M, Gines P, Salmeron JM, Gines A, Arroyo V, Rodes J. Incidence and predictive factors of first episode of spontaneous bacterial peritonitis in cirrhosis with ascites: relevance of ascitic fluid protein concentration. Hepatology 1992;16:724–727.
15. Andreu M, Sola R, Sitges–Serra A, Alia C, Gallen M, Vila MC, Coll S, Oliver MI. Risk factors for spontaneous bacterial peritonitis. Gastroenterology 1993;104:1133–1138.
16. Guarner C, Sola R, Soriano G, Andreu M, Novella MT, Vila C, Sabat M, Coll S, Ortiz J, Gomez C, Balanzo J. Risk of a first community–acquired spontaneous bacterial peritonitis in cirrhotics with low ascitic fluid protein levels. Gastroenterology 1999; 117:414–419.
17. Ruiz–del–Arbol L, Monescillo A, Arocena C, Valer P, Gines P, Moreira V, Milicua JM, Jimenez W, Arroyo V. Circulatory function and hepatorenal syndrome in cirrhosis. Hepatology 2005;42:439–447.
18. Gines A, Escorsell A, Gines P, Salo J, Jimenez W, Inglada L, Navasa M, Claria J, Rimola A, Arroyo V, Rodes J. Incidence, predictive factors, and prognosis of the hepatorenal syndrome in cirrhosis with ascites. Gastroenterology 1993;105:229–236.
19. Bataller R, Gines P, Guevara M, Arroyo V. Hepatorenal syndrome. Semin Liver Dis 1997;17:233–247.
20. Angeli P, Wong F, Watson H, Gines P, and the CAPPS investigators. Hyponatremia in cirrhosis: results of a patient population survey. Hepatology 2006;44:1535–1542.
21. Fernandez J, Navasa M, Gomez J, Colmenero J, Vila J, Arroyo V, Rodes J. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis. Hepatology 2002;35:140–148.
22. Arroyo V, Gines P, Gerbes AL, Dudley FJ, Gentilini P, Laffi G, Reynolds TB, RingLarsen H, Scholmerich J. Definition and diagnostic criteria of refractory ascites and hepatorenal syndrome in cirrhosis. International Ascites Club. Hepatology 1996;23:164–176.
23. Rimola A, Garcia–Tsao G, Navasa M, Piddock LJ, Planas R, Bernard B, Inadomi JM. Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document. International Ascites Club. J Hepatol 2000;32:142–153.
24. Arroyo V, Terra C, Gines P. New treatments of hepatorenal syndrome. Semin Liver Dis 2006;26:254–264.
25. Arroyo V, Rodes J, Gutierrez–Lizarraga MA, Revert L. Prognostic value of spontaneous hyponatremia in cirrhosis with ascites. Am J Dig Dis 1976;21:249–256.
26. Planas R, Montoliu S, Balleste B, Rivera M, Miquel M, Masnou H, Galeras JA, Gimenez MD, Santos J, Cirera I, Morillas RM, Coll S, Sola R. Natural history of patients hospitalized for management of cirrhotic ascites. Clin Gastroenterol Hepatol 2006;4:1385–1394.
27. Albillos A, de la Hera A, Gonzalez M, Moya JL, Calleja JL, Monserrat J, Ruiz–del Arbol L, Alvarez–Mon M. Increased lipopolysaccharide binding protein in cirrhotic patients with marked immune and hemodynamic derangement. Hepatology 2003;37:208–217.
28. Rasaratnam B, Kaye D, Jennings G, Dudley F, Chin–Dusting J. The effect of selective intestinal decontamination on the hyperdynamic circulatory state in cirrhosis. A randomized trial. Ann Intern Med 2003;139:186–193.
29. Llach J, Gines P, Arroyo V, Rimola A, Tito L, Badalamenti S, Jimenez W, Gaya J, Rivera F, Rodes J. Prognostic value of arterial pressure, endogenous vasoactive systems, and renal function in cirrhotic patients admitted to the hospital for the treatment of ascites. Gastroenterology 1988;94:482–487.
30. Dupeyron C, Mangeney N, Sedrati L, Campillo B, Fouet P, Leluan G. Rapid emergence of quinolone resistance in cirrhotic patients treated with norfloxacin to prevent spontaneous bacterial peritonitis. Antimicrob Agents Chemother 1994;38:340–344.
31. Aparicio JR, Such J, Pascual S, Arroyo A, Plazas J, Girona E, Gutierrez A, de Vera F, Palazon JM, Carnicer F, Perez–Mateo M. Development of quinolone–resistant strains of Escherichia coli in stools of patients with cirrhosis undergoing norfloxacin prophylaxis: clinical consequences. J Hepatol 1999;31:277–283.
32. Novella M, Sola R, Soriano G, Andreu M, Gana J, Ortiz J, Coll S, Sabat M, Vila MC, Guarner C, Vilardell F. Continuous versus inpatient prophylaxis of the first episode of spontaneous bacterial peritonitis with norfloxacin. Hepatology 1997;25:532–536.
33. Ortiz J, Vila MC, Soriano G, Minana J, Gana J, Mirelis B, Novella MT, Coll S, Sabat M, Andreu M, Prats G, Sola R, Guarner C. Infections caused by Escherichia coli resistant to norfloxacin in hospitalized cirrhotic patients. Hepatology 1999;29:1064–1069.












