Наиболее демонстративно роль HCl в развитии заболевания и клинической симптоматики проявляется при ЯБ. Отмечено, что ЯБ диагностируют в настоящее время реже. Это в первую очередь связано с тем, что определение в качестве ведущего этиологического агента микроба Helicobacter pylori (H. pylori) при ЯБ ДПК и ЯБ желудка потребовало включения в обязательную схему лечения эрадикации H. pylori, что значительно сократило количество рецидивов ЯБ и первичную заболеваемость.
Колонизация H. pylori слизистой оболочки желудка сопровождается и поражением системы защиты слизистой, и нарушением характера кислотопродукции. Микробная инвазия происходит с уменьшением вязкости, гидрофобности слизи, повреждением эпителиоцитов и эндотелия сосудов. Жизнедеятельность микроба приводит к развитию хронического воспаления, что сопровождается повышенной продукцией провоспалительных цитокинов (ИЛ-1, ФНО-α). Воздействие таких интерлейкинов на G-клетки обусловливает увеличение образования гастрина и, следовательно, интенсификацию продукции HCl. Гипергастринемия также обусловлена свойством H. pylori вырабатывать уреазу. Уреаза превращает мочевину, поступившую в слизистую оболочку из крови, в углекислый газ и аммиак. Аммиак, окружающий микроорганизм, нейтрализует HCl, ликвидируя бактерицидный эффект кислоты на H. pylori и одновременно повышая местно рН, стимулирует G-клетки. Гастрин потенцирует гиперплазию ECL-клеток, приводит к повышению содержания гистамина, что также увеличивает секрецию HCl.
Следствием развития гиперсекреторного H. pylori-ассоциированного антрального гастрита является и нарушение моторно-эвакуаторной функции желудка, что способствует раннему поступлению HCl в ДПК и значительной ацидитации кишки. Постоянное воздействие кислоты на клетки приводит к метаплазии кишечного эпителия, образованию эпителия желудочного типа с последующей адгезией бактерии пилорического геликобактера, что является фактором развития пептической язвы ДПК. Наиболее высок уровень ацидитации в луковице ДПК, что и объясняет частое развитие в этом месте язвенных дефектов.
Боль при ЯБ – главная жалоба, определяющая стадию болезни и по ряду параметров – локализацию язвы. В генезе язвенной боли значительную роль играют воздействие HCl на зону пептического дефекта и связанная с этим спастическая реакция мышечного слоя. Участие HCl в появлении боли определяет такие особенности, как зависимость появления боли и ее максимума от времени, прошедшего после приема пищи, зависимость интенсивности боли от кислотостимулирующих свойств пищи, а также стихание боли после приема антацидов, рвоты, нейтрализующей кислоту пищи. И врачи, и пациенты знают о зависимости болевого синдрома от факторов, влияющих на интенсивность секреции кислоты, таких как усиление боли при употреблении кислых продуктов, специй, мясных бульонов и ее стихание после пищи, связывающей HCl и уменьшающей кислотопродукцию (вареное мясо, яичный белок, молоко). Быстро облегчающий боль эффект приема раствора или порошка пищевой соды (гидрокарбоната натрия) при ЯБ образно сравнивают с действием нитроглицерина при стенокардии, он обусловлен нейтрализацией HCl.
Показано, что ранние боли при ЯБ желудка, возникающие через 30–60 мин после еды, совпадают с максимальной концентрацией HCl в желудке, а поздние при ЯБ ДПК – с пиком ацидитации в ДПК. С интенсивной секрецией кислоты натощак ассоциированы голодные боли, а гиперацидитации ночью сопровождаются ночными болями. Исчезновение патогномичного ритма «прием пищи – боль», когда боли становятся постоянными или эпизодическими, – тревожный симптом и требует исключения таких осложнений ЯБ, как пенетрация и малигнизация.
В клиническую картину ЯБ входит синдром кислой желудочной диспепсии – это изжога, кислая отрыжка, срыгивание кислым, рвота кислым. Помимо рефлюкса в пищевод в генезе этого варианта диспепсии важным является гиперсекреторный статус желудочной секреции.
В ситуации, когда количество гастроэзофагеальных рефлюксов (ГЭР) за сутки превышает 50, а рН в пищеводе снижается до уровня ниже 4,0 (длительностью 1 ч и более), возникают клинические и, возможно, в дальнейшем эндоскопические проявления ГЭРБ. Рефлюкс желудочного и дуоденального содержимого приводит к разнообразным пищеводным и внепищеводным симптомам. В пищеводе, по данным эзофагогастродуоденоскопии (ЭГДС), в 5–7% случаев выявляют эрозивный, эрозивно-язвенный или катаральный эзофагит. Другая форма ГЭРБ является эндоскопически негативной, т.к. эндоскопическое исследование не выявляет патологической картины.
Симптомы ГЭРБ: изжогу, отрыжку, срыгивание испытывают до 30% населения. Изжога – мучительное, различной интенсивности и длительности чувство жжения за грудиной, в области эпигастрия, иногда глотки. Ведущий фактор в генезе ГЭРБ – повреждающее длительное воздействие кислоты на слизистую пищевода. Подтверждением являются результаты исследования, свидетельствующие, что если рН в пищеводе остается выше 4,0 в течение 22 ч/сут, то эффект терапии ГЭРБ достигается в 80–90% случаев. Естественно, что в патогенезе ГЭРБ помимо агрессивного воздействия кислоты выделяют и снижение тонуса нижнего пищеводного сфинктера, и повышение внутрижелудочного давления, и снижение клиренса пищевода, и действие других повреждающих слизистую факторов. Таким образом, учитывая, что в генезе самых распространенных заболеваний – H. pylori-ассоциированного гастрита, ЯБ желудка и ДПК, ГЭРБ – HCl является главным патогенным фактором, логично сделать вывод: снижение секреции HCl является основной задачей терапии. При выборе лечебных подходов целесообразно принимать во внимание основные механизмы регуляции продукции HCl.
Секреция HCl происходит при воздействии на париетальную клетку главным образом ацетилхолина, гистамина и гастрина. Продуцентами этих стимулирующих агентов являются, соответственно, постганглионарные волокна n. vagus, ECL-клетки и G-клетки. Следовательно, к снижению продукции HCl могут приводить подавление регулирующих механизмов и блокирующее вмешательство во внутриклеточный аппарат синтеза HCl. Понятно, почему в арсенал кислотоснижающей терапии входят холиноблокаторы, блокаторы Н2-гистаминовых рецепторов, ингибиторы протонной помпы (ИПП), ваготомия и также гастроинтестинальные гормоны, такие как соматостатин, секретин, глюкагон.
Перед врачом встает задача выбора снижающего кислотопродукцию средства с учетом его механизма действия, эффективности, спектра побочного действия и соотношения цена – качество.
Неселективные блокаторы М1- и М2-холинергических рецепторов (атропин, платифиллин, метоциния йодид) применять для снижения продукции HCl не рекомендуют из-за непродолжительного периода действия (8–10 ч), невысокой способности снижать секрецию кислоты и большого количества побочных системных эффектов, в т.ч. и весьма опасных (нарушения сердечного ритма, затруднение мочеиспускания, нарушение аккомодации зрения).
Селективный М1-холинолитический препарат пирензепин, снижая вагусное воздействие, уменьшает на 30% стимулированную секрецию и снижает объем желудочного содержимого [1]. Длительность эффекта не превышает 12 ч, что требует 2–3-кратного приема. При длительном приеме возникает риск системных побочных проявлений. Все это не позволяет рекомендовать вышеуказанный препарат для применения в терапевтической, гастроэнтерологической практике.
В настоящее время наиболее употребляемыми являются блокаторы Н2-рецепторов гистамина (Н2-блокаторы) и ИПП.
Циметидин – первый препарат группы Н2-блокаторов продемонстрировал заметный эффект в лечении главным образом ЯБ, позитивно влияя на болевой синдром и рубцевание, но значительные побочные проявления (гепатотоксичность, повышение уровня пролактина, ведущее к галакторее, аменорее, импотенции) потребовали совершенствования препаратов этой группы. Препараты II и III поколений Н2-блокаторов ранитидин и фамотидин снижают кислотопродукцию, блокируя стимуляцию париетальной клетки гистамином. Сам механизм действия и является «ахиллесовой пятой» этих препаратов. Даже при значительном уменьшении действия гистамина на париетальную клетку продолжают воздействовать другие стимуляторы, главным образом ацетилхолин и гастрин. Следует учитывать, что действие Н2-блокаторов продолжается только при их присутствии в кровотоке. Отмечено, что длительный прием приводит к «усталости» рецепторов и снижению эффективности. Гипергастринемия, возникающая при длительном подавлении кислотопродукции, в случае быстрой отмены лекарства является причиной феномена рикошета, т.е. значительного увеличения секреции обкладочных клеток.
Поиск путей снижения функции париетальных клеток привел к появлению лекарств, блокирующих внутриклеточный процесс синтеза и выведения HCl. Такими лекарствами являются ИПП. Протонная помпа – белок, встроенный в апикальную мембрану обкладочной клетки. Помпа осуществляет обмен внутриклеточных Н+ на внеклеточные К+. Это требует энергии, в связи с чем происходит гидролизация аденозинтрифосфата (АТФ) в аденозиндифосфат (АДФ), протонная помпа – белок, являющийся АТФ-азой. Фермент Н+/К+-АТФ-аза расположен в микроворсинках секреторных канальцев париетальных клеток и является ведущим элементом системы транспорта HCl через апикальную мембрану клетки в просвет желудка. ИПП блокируют фермент. Продукция кислоты остается подавленной до момента появления вновь синтезированного фермента. В механизме блокирования участвует не принятый препарат, а его метаболит, взаимодействующий с сульфгидрильными группами фермента. Ингибирующий эффект продолжается и после элиминации лекарства из кровотока.
ИПП угнетают все фазы желудочной секреции, что имеет большое терапевтическое значение при ЯБ и ГЭРБ, т.к. показано повышение при ЯБ базальной секреции в 2–3 раза, ночной – в 3,5–4 раза, стимулированная превышает показатели у здоровых в 2,5–3 раза. Прием стандартных доз ИПП позволяет сохранить рН>3 в желудке 15–18 ч, а выше 4 – около 11 ч. Такие благотворные временные параметры в 3–4 раза превышают параметры ситуации в желудке при отсутствии медикаментозного воздействия.
Убедительные исследования показали, что применение ИПП имеет преимущество в сравнении с применением блокаторов Н2-рецепторов. Использование блокаторов Н2-рецепторов приводит к излечению пептической язвы в 80% случаев, применение ИПП эффективно в 95% [2]. В рекомендуемые схемы эрадикации однозначно включены ИПП. Первый препарат группы ИПП – омепразол вошел в широкую практику в 1989 г. и с тех пор остается высокоэффективным и популярным препаратом. При применении омепразола следует учитывать, что он, как и все лекарства группы ИПП, неустойчив в кислой среде, поэтому помещен в защищающую желатиновую капсулу. Препарат всасывается в ДПК. Максимальная концентрация в крови отмечается через 1–2 ч. Эффект однократно принятого препарата сохраняется более 24 ч. Курсовое лечение ИПП приводит к накоплению блокирующего секрецию HCl эффекта без накопления препарата в организме. Отмена препарата приводит к восстановлению секреции кислоты в течение 3–5 дней, по мере синтеза новых протонных помп. Полупериод восстановления секреции HCl при применении большинства ИПП составляет порядка 20 ч [3]. У человека после приема лансопразола полупериод восстановления выработки кислоты – 12,9 ч, омепразола – 27,52 [4]. Мишенями ИПП являются остатки цистеина АТФ-азы. Омепразол и другие препараты взаимодействуют с остатками цистеина в положении 813 [5]. На реальную эффективность влияют многие факторы, на первое место следует поставить индивидуальные особенности секреторного аппарата, в т.ч. аномальное строение протонного насоса [2].
Длительное применение ИПП с хорошим кислотоподавляющим эффектом, в т.ч. и омепразола, приводит по закону обратной связи к гипергастринемии и увеличению объема париетальных клеток, поэтому во избежание рикошета – значительного подъема секреции HCl – отмену лекарства следует проводить постепенно.
Прием ИПП требует внимательно отнестись к другим возможным эффектам побочного воздействия длительного снижения кислотопродукции. В первую очередь следует иметь в виду снижение бактерицидной функции желудка. Следствием этого может быть возникновение синдрома контаминации тонкой кишки и вероятного бактериального поражения желчевыводящих путей. Из-за низкого содержания HCl в желудке может нарушиться переваривание белка (снижение образования пепсина) и уменьшиться внешняя секреция поджелудочной железы (снижение продукции секретина при дефиците HCl). Следует отметить, что применение омепразола короткими, до 3 мес., курсами не сопровождается, как правило, побочными эффектами. У 2,4% больных отмечается головная боль, у 2,1% – диарея [6]. Диагностика инфекции H. pylori у трудоспособного населения г. Москвы показала, что распространенность заражения достигает 88%, при этом преобладают вирулентные штаммы бактерии [7]. Является бесспорным тот факт, что эрадикация H. pylori приводит к прекращению воспаления слизистой желудка, ликвидации H. pylori-ассоциированного гастрита и, следовательно, к нормализации кислотопродукции. При этом понятно, что прием антибиотиков несет риск гепатотоксического действия, нарушения микробиосферы организма.
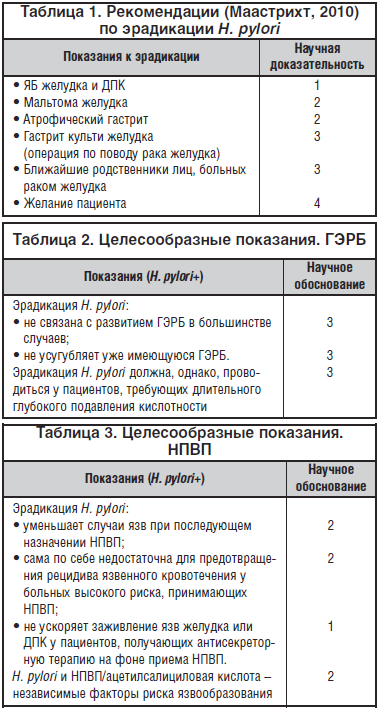
В рекомендациях (Маастрихт, 2010) показания к эрадикации H. pylori нашли отражение в следующих положениях (табл. 1).
Признавая примат хеликобактерной концепции этиологии ЯБ, следует также иметь в виду и другие факторы, приводящие к язвенному дефекту слизистой желудка и ДПК: повышение кислотопродукции, повреждение слизистой и снижение резистентности.
Известно, что базальная и стимулированная кислотопродукция у пациентов с ЯБ, не имеющих колонизации H. pylori, выше в 1,5–3 раза, чем в популяции [5], считается, что имеется наследственная предрасположенность к этому. К причинам повышения продукции HCl при наследственно отягощенной ЯБ относят генетически обусловленное увеличение количества париетальных и главных клеток. Возможно, что увеличенное количество париетальных клеток у мужчин по сравнению с женщинами является одной из причин преобладания заболеваемости ЯБ ДПК у мужчин. Максимальная секреция HCl обусловлена количеством обкладочных клеток, составляющим у мужчин 1,8×109, у женщин – 0,84×109. При ЯБ париетальные клетки расположены не только в фундальном, но и в пилорическом отделе, что определяет еще один фактор гиперсекреторного статуса [1].
Предрасположенность определяется и увеличением G-клеток и развитием гипергастринемии после приема пищи. Предрасположенность проявляется и высоким уровнем гуморальных стимуляторов париетальных клеток – ацетилхолина и гистамина. Клинически прослеживается гипертонус блуждающего нерва.
Свой вклад в гиперсекреторный статус пациентов с ЯБ ДПК молодого возраста вносит гормональный дисбаланс: повышение уровня адренокортикотропного гормона, кортизола, соматотропного гормона, нарушение ритма секреции мелатонина. Следовательно, и при H. pylori-позитивных, и при H. pylori-негативных язвах снижение кислотопродукции является необходимым. При этом применение монотерапии – вопрос весьма дискуссионный [6, 8, 9]. Есть мнение, что показания к длительной поддерживающей терапии ИПП значительно сузились, т.к. главным в предупреждении рецидивов является эрадикация H. pylori [6]. Предлагают для достижения оптимальной эффективности антихеликобактерной терапии за 3–5 дней до приема антибиотиков проводить монотерапию ИПП [10].
В ситуации, когда возникает вопрос о проведении кислотоподавляющей терапии, следует убедиться в отсутствии или наличии H. pylori. Это важно, т.к. до 40% лиц, имеющих пептическую язву, относятся к H. pylori-негативным пациентам, а по данным на 2006 г. распространенность ЯБ в популяции России составляла 1 711 509 (1198,9 на 100 тыс. населения) [11].
Предпочтительно использовать неинвазивные методики (Маастрихт–IV, апрель 2012).
Рекомендуемые неинвазивные методы диагностики H. pylori:
• уреазный дыхательный тест:
– чувствительность – 88–95%;
– специфичность – 95%;
• исследование моноклональных антител H. pylori в кале:
– чувствительность – 94%;
– специфичность – 92%.
Длительное подавление продукции HCl при колонизированной H. pylori слизистой без эрадикации чревато развитием бациллярно-кокковой трансформации H. pylori, прогрессированием H. pylori + гастрита [8].
При ГЭРБ терапию, направленную на снижение кислотности рефлюктанта, рекомендовано проводить ИПП. Применение эрадикации регламентируется положениями, изложенными в таблице 2.
Поскольку при НПВП-гастропатиях H. pylori и НПВП являются независимыми факторами развития эрозивно-язвенных поражений желудка и ДПК и требуют длительного приема ИПП, применение эрадикации обсуждается в таблице 3.
Во все схемы эрадикации включены ИПП, в основном омепразол. В России оригинальный омепразол известен с начала 1990 г., была подтверждена его высокая противоязвенная эффективность. Однако продвижение этого препарата в РФ было затруднено в связи с его высокой стоимостью для российских пациентов [12].
Хорошо зарекомендовал себя омепразол компании «Шрея Лайф Саенсиз Пвт. Лтд.» (Shreya Life Sciences, Pvt. Ltd.) Омитокс. Препарат показал эффективность 100% в терапии эрозивно-язвенной патологии желудка и ДПК при полном отсутствии нежелательных побочных клинических и лабораторных эффектов [13]. Омитокс хорошо показал себя в лечении ЯБ ДПК и ЯБ желудка при состоявшемся кровотечении и его угрозе [14]. На фоне приема Омитокса не отмечено токсических реакций. Переносимость Омитокса не отличалась от переносимости других препаратов ИПП [14].
Клиническая апробация Омитокса у 35 пациентов с обострением ЯБ ДПК и ЯБ желудка показала устойчивый эффект при суточной дозе 40 мг [15]. Включение Омитокса в дозе 20 мг × 2 приема в укороченную схему приема антибиотиков продемонстрировало высокую клиническую эффективность, полную эрадикацию в 86,7% случаев, 93,3% рубцевания на 14-й день и 100% при 28-дневном приеме Омитокса [16]. Монокурс Омитокса в течение 14 дней при стрессовых эрозивных поражениях ДПК приводит к заживлению дефектов у 96,7% больных, а при язвах гастродуоденальной зоны – у 94,4%. Полное заживление отмечено к 28-му дню. Проведение 24-часовой внутрижелудочной рН-метрии показало, что доза Омитокса 20 мг приводила к повышению рН до 4 ед. в течение 6–8 ч [15].
Продемонстрирована эффективность Омитокса в терапии панкреатита, сочетанного с ЯБ. Препарат позитивно влиял на панкреатогенные боли и процесс рубцевания ЯБ [17]. Позитивный опыт применения Омитокса при эрозивной и эндоскопически негативной формах ГЭРБ также нашел отражение в литературе [18]. Доступная стоимость Омитокса особенно важна, как отмечают авторы [19], при длительных курсах, для всех категорий населения на территориях с неравномерным экономическим развитием.
Литература
1. Пиманов С.И. Эзофагит, гастрит и язвенная болезнь. Руководство для врачей. М.: Медицинская книга, 2000. С. 276.
2. Бельмер С.В. Пять поколений ингибиторов протонного насоса: проблема выбора // Лечащий врач. 2009. № 7. С. 14–17.
3. Gedda K., Scott D., Besancon M., Lorentzon R., Sachs G. Turnover of the gastric H+,K+–adenosine triphosphatase alpha subunit and its effect on inhibition of rat gastric acid secretion // Gastroenterology. 1995. Vol. 109. Р. 1134–1141.
4. Katashima M., Yamamoto K., Tokuma Y., Hata T., Sawada Y., Iga T. Comparative pharmacokinetic/pharmacodynamic analysis of proton pump inhibitors omeprazole, lansoprazole and pantoprazole, in humans // Eur J Drug Metab Pharmacokinet. 1998. Vol. 23. Р. 19–26.
5. Сакс Г., Шин Дж.М., Прата В., Хоган Д. Синтез или разрушение: длительность эффекта ингибиторов протонной помпы // РМЖ. 2010. Т. 18. №13. С. 862–863.
6. Шептулин А.А. Применение ингибиторов протонного насоса при лечении язвенной болезни: перспективы монотерапии // II Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 1997. № 5. С. 104–106.
7. Герман С.В., Зыкова И.Е., Модестова А.В., Ермаков Н.В. Распространенность инфекции H. pylori среди населения Москвы // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.. 2010. № 2. С. 45.
8. Хомерики Н.М., Хомерики С.Г. Длительная терапия антисекреторными препаратами – устойчивое равновесие // Consilium medicum. 2008. № 2. С. 8–10.
9. Лапина Т.Л. Тактика долгосрочного лечения больных гастроэзофагеальной рефлюксной болезнью // Ревматология, иммунология, гастроэнтерология. № 6 (121). С. 38–42.
10. Тумарева С.Н. Сравнительная оценка эффекта различных ингибиторов протонной помпы (париет, нексиум, омез, ланзап, контролок) в лечении больных язвенной болезнью двенадцатиперстной кишки [Электронный ресурс] Режим доступа: www.medgazeta.ru/files_for_downloads/upload/pariet_tumareva.doc 05.06.2009.
11. Маев И.В., Оганесян Т.С., Кучерявый Ю.А. Язвенная болезнь двенадцатиперстной кишки: диагностика и лечение // Consilium medicum. 2010. № 8. С. 24–26.
12. Булгаков С.А. Классический ингибитор протонной помпы препарат Омез (омепразол) в лечении язвенной болезни // II Фарматека. 2010. № 13. С. 28–32.
13. Денисов И.Н., Топчий Н.В., Чертов Д.Н. Клиническое исследование препарата Омитокс // Мед. кафедра. 2003. № 4. С. 111–115.
14. Минушкин О.Н., Зверьков И.В., Иванова О.И. Клиническая апробация ингибитора «протонной помпы» Омитокса (Омепразола) в лечении язвенной болезни, осложненной кровотечением // Лечащий врач. 2004. № 4. С. 74–75.
15. Калинин А.В., Логинов А., Цырик В. Клиническая апробация препарата Омитокс // Клинические перспективы гастроэнтерологии, гепатологии. 2003. № 5. С. 27–29.
16. Латышев О.А., Зайцев С.В., Орехова А.И. Эффективность и переносимость комбинации препаратов Омитокс, Авитрал, Амоксициллин при лечении язвенной болезни желудка и двенадцатиперстной кишки, ассоциированной с Helicobacter pylori // Материалы ХХ Российского национального конгресса «Человек и лекарство – 2013». Результаты клинических исследований в гастроэнтерологии. М., 2013. С. 84–94.
17. Васильев Ю.В., Березина О.И. Открытое простое исследование по оценке эффективности и переносимости Омитокса в комплексной терапии хронического панкреатита, сочетающегося с язвенной болезнью // Материалы ХХ Российского национального конгресса «Человек и лекарство – 2013». Результаты клинических исследований в гастроэнтерологии. М., 2013. С. 81–83.
18. Ивашкин В.Т., Лапина Т.П. Исследование эффективности препарата Омитокс в лечении эрозивного эзофагита и эндоскопически негативной рефлюксной болезни. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2004. № 6. С. 82–85.
19. Денисов И.Н., Топчий Н.В., Латышев О.А., Куликов О.А., Зайцев С.В. Эффективность Омитокса при стрессовых язвах // Российские аптеки. 2003. № 11.












