–Ь–µ—Е–∞–љ–Є–Ј–Љ –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–µ–≥–Њ –і–µ–є—Б—В–≤–Є—П CCl4 –Њ—Б–љ–Њ–≤–∞–љ –љ–∞ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –≤ —Н–љ–і–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ —А–µ—В–Є–Ї—Г–ї—Г–Љ–µ –∞–Ї—В–Є–≤–љ—Л—Е —А–∞–і–Є–Ї–∞–ї–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —Д–Њ—А–Љ–Є—А—Г—О—В—Б—П –њ—А–Є –µ–≥–Њ —А–∞—Б—Й–µ–њ–ї–µ–љ–Є–Є —Ж–Є—В–Њ—Е—А–Њ–Љ–Њ–Љ –†450 [3]. CCl4 –≤—Л–Ј—Л–≤–∞–µ—В —Ж–µ–љ—В—А–Њ–ї–Њ–±—Г–ї—П—А–љ—Л–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П, –њ–µ—А–µ—Е–Њ–і—П—Й–Є–µ –≤ —Д–Є–±—А–Њ–Ј –Є —Ж–µ–љ—В—А–Њ–ї–Њ–±—Г–ї—П—А–љ—Л–є —Ж–Є—А—А–Њ–Ј. –§–Є–±—А–Њ–Ј —П–≤–ї—П–µ—В—Б—П –Ї–Њ–љ–µ—З–љ—Л–Љ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –≤—Л–Ј–≤–∞–љ–љ—Л—Е —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є —Б—В–Є–Љ—Г–ї–∞–Љ–Є [4] –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ј–≤–µ–Ј–і—З–∞—В—Л—Е –Ї–ї–µ—В–Њ–Ї, –Ї–Њ—В–Њ—А–∞—П —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В—Б—П –њ—А–Є –≥–Є–±–µ–ї–Є –њ–∞—А–µ–љ—Е–Є–Љ–∞—В–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї [5].
–Я—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—В—М –Є –Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞—В—М —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –Є —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –њ–µ—З–µ–љ–Є –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤, —П–≤–ї—П—О—В—Б—П –њ—А–µ–њ–∞—А–∞—В—Л –њ–Њ–і –Њ–±—Й–Є–Љ –љ–∞–Ј–≤–∞–љ–Є–µ–Љ ¬Ђ–≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А—Л¬ї [6, 7]. –Ю–і–љ–Є–Љ –Є–Ј —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —П–≤–ї—П–µ—В—Б—П —Б–Є–ї–Є–Љ–∞—А–Є–љ, –Ї–Њ—В–Њ—А—Л–є –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В –≥–µ–њ–∞—В–Њ–Ј–∞—Й–Є—В–љ—Л–µ –Є –∞–љ—В–Є—Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞, —З—В–Њ –±—Л–ї–Њ –љ–∞–є–і–µ–љ–Њ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —В–∞–Ї–Є—Е –Љ–Њ–і–µ–ї–µ–є, –Ї–∞–Ї –њ–µ—А–µ–≤—П–Ј–Ї–∞ –ґ–µ–ї—З–љ–Њ–≥–Њ –њ—А–Њ—В–Њ–Ї–∞ [8], –≤–≤–µ–і–µ–љ–Є–µ —Н—В–∞–љ–Њ–ї–∞ [9], CCl4 [10]. –Т–∞–ґ–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –Є–Ј—Г—З–µ–љ–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –њ–µ—З–µ–љ–Є, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Д–Є–±—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–є –Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–Ї–Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–∞ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞. –¶–µ–ї—М —А–∞–±–Њ—В—Л вАУ –Є–Ј—Г—З–µ–љ–Є–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Д–Є–±—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ CCl4 —Б –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –њ–µ—З–µ–љ–Є –Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤ —Д–Є–±—А–Њ–≥–µ–љ–µ–Ј–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –љ–∞ –±–µ–ї—Л—Е –Ї—А—Л—Б–∞—Е-—Б–∞–Љ—Ж–∞—Е –њ–Њ—А–Њ–і—Л Wistar –Љ–∞—Б—Б–Њ–є 250вАУ350 –≥. –Ъ—А—Л—Б—Л —Б–Њ–і–µ—А–ґ–∞–ї–Є—Б—М –љ–∞ —Б—В–∞–љ–і–∞—А—В–љ–Њ–Љ —А–∞—Ж–Є–Њ–љ–µ –Є –њ–Њ–ї—Г—З–∞–ї–Є –Ї–Њ—А–Љ –Є –≤–Њ–і—Г ad libitum. –Ю—Ж–µ–љ–Ї–∞ —Б–Њ—Б—В–Њ—П–љ–Є—П –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –њ—Г—В–µ–Љ –µ–ґ–µ–і–љ–µ–≤–љ–Њ–≥–Њ –Њ—Б–Љ–Њ—В—А–∞ –Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Њ—Б–љ–Њ–≤–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–ї–Є—Б—М –њ—А–Є–Ј–љ–∞–Ї–Є –Њ–±—Й–µ–≥–Њ —Г–≥–љ–µ—В–µ–љ–Є—П, –њ–Њ–і–≤–Є–ґ–љ–Њ—Б—В—М, —Б–Њ—Б—В–Њ—П–љ–Є–µ —И–µ—А—Б—В–Є, –≤–Є–і–Є–Љ—Л—Е —Б–ї–Є–Ј–Є—Б—В—Л—Е –Њ–±–Њ–ї–Њ—З–µ–Ї, –њ–Њ–≤–µ–і–µ–љ–Є–µ, –і–≤–Є–≥–∞—В–µ–ї—М–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М. –Ю–і–Є–љ —А–∞–Ј –≤ –љ–µ–і–µ–ї—О –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤–Ј–≤–µ—И–Є–≤–∞–љ–Є–µ –ґ–Є–≤–Њ—В–љ—Л—Е, –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –њ–Є—Й–Є –Є –≤–Њ–і—Л.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–µ–і–µ–љ—Л –љ–∞ 4-—Е –≥—А—Г–њ–њ–∞—Е –ґ–Є–≤–Њ—В–љ—Л—Е –њ–Њ 5 –≤ –≥—А—Г–њ–њ–µ. –Ґ–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –њ–µ—З–µ–љ–Є –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–ї–Є –њ—Г—В–µ–Љ –њ–Њ–і–Ї–Њ–ґ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П CCl4 (50% —А–∞—Б—В–≤–Њ—А –≤ –Њ–ї–Є–≤–Ї–Њ–≤–Њ–Љ –Љ–∞—Б–ї–µ –≤ –і–Њ–Ј–µ 0,2 –Љ–ї / 100 –≥ –Љ–∞—Б—Б—Л —В–µ–ї–∞) 2 —А./–љ–µ–і. –Ч–∞–±–Њ–є –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї—Б—П –љ–∞ —Б—А–Њ–Ї–∞—Е 14, 30 –Є 90 —Б—Г—В –Њ—В –љ–∞—З–∞–ї–∞ –≤–≤–µ–і–µ–љ–Є—П CCl4. –Я—А–Є –Ј–∞–±–Њ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤–Ј—П—В–Є–µ –Ї—А–Њ–≤–Є. —Б–Є–ї–Є–Љ–∞—А–Є–љ –≤–≤–Њ–і–Є–ї—Б—П –≤–љ—Г—В—А–Є–ґ–µ–ї—Г–і–Њ—З–љ–Њ –≤ –і–Њ–Ј–µ 15 –Љ–≥/–Ї–≥ 5 —А./–љ–µ–і.
–У–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ. –Ґ–Ї–∞–љ—М –њ–µ—З–µ–љ–Є —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–∞—Б—М –≤ 10% —А–∞—Б—В–≤–Њ—А–µ —Д–Њ—А–Љ–∞–ї–Є–љ–∞, –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –Њ–±–µ–Ј–≤–Њ–ґ–Є–≤–∞–љ–Є–µ –Є –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –Њ–±—А–∞–Ј—Ж–Њ–≤ –≤ –њ–∞—А–∞—Д–Є–љ. –У–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б—А–µ–Ј—Л –Њ–Ї—А–∞—И–Є–≤–∞–ї–Є—Б—М –≥–µ–Љ–∞—В–Њ–Ї—Б–Є–ї–Є–љ–Њ–Љ –Є —Н–Њ–Ј–Є–љ–Њ–Љ, –∞ —В–∞–Ї–ґ–µ –њ–Є–Ї—А–Њ—Д—Г–Ї—Б–Є–љ–Њ–Љ (–њ–Њ –Т–∞–љ –У–Є–Ј–Њ–љ—Г). –Ю—Ж–µ–љ–Ї–∞ —Б—В–µ–њ–µ–љ–Є —Д–Є–±—А–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П —В–Ї–∞–љ–Є –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –њ–Њ —Б–Є—Б—В–µ–Љ–µ METAVIR.
–Т —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є–Ј–Љ–µ—А—П–ї–Є —Г—А–Њ–≤–љ–Є —Д–∞–Ї—В–Њ—А–∞ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є-ќ± (TNF-ќ±), —В—А–∞–љ—Б—Д–Њ—А–Љ–Є—А—Г—О—Й–µ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ —А–Њ—Б—В–∞-ќ≤ (TGF-ќ≤), –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞-10 (IL-10), –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ IV, –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є–Љ–Љ—Г–љ–Њ—Д–µ—А–Љ–µ–љ—В–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї—Г—О –Њ–±—А–∞–±–Њ—В–Ї—Г –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ–≥—А–∞–Љ–Љ—Л Statistica 8. –Ф–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–Є–є –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї—А–Є—В–µ—А–Є—П –Ь–∞–љ–љ–∞ вАУ –£–Є—В–љ–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
–Э–∞ —Б—А–Њ–Ї–∞—Е 14 –Є 30 —Б—Г—В –Њ—В –љ–∞—З–∞–ї–∞ –≤–≤–µ–і–µ–љ–Є—П CCl4 —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є—П –ґ–Є–≤–Њ—В–љ—Л—Е –≤ –Њ–њ—Л—В–љ–Њ–є –≥—А—Г–њ–њ–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –љ–µ –њ—А–Њ–Є–Ј–Њ—И–ї–Њ. –Я—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –≤–≤–µ–і–µ–љ–Є—П CCl4 –љ–∞ 90-–µ —Б—Г—В —Г –ґ–Є–≤–Њ—В–љ—Л—Е –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –њ—А–Є–Ј–љ–∞–Ї–Є –Њ–±—Й–µ–≥–Њ —Г–≥–љ–µ—В–µ–љ–Є—П, –ї–µ–≥–Ї–∞—П –ґ–µ–ї—В—Г—И–љ–Њ—Б—В—М –≤–Є–і–Є–Љ—Л—Е —Б–ї–Є–Ј–Є—Б—В—Л—Е –Њ–±–Њ–ї–Њ—З–µ–Ї. –Ю—В–Љ–µ—З–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –∞–њ–њ–µ—В–Є—В–∞, –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –≤–Њ–і—Л, –Ї–Њ—В–Њ—А–Њ–µ –≤–Њ–Ј—А–Њ—Б–ї–Њ –≤ 1,5 —А–∞–Ј–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–∞–Ї–Њ–≤—Л–Љ —Г –ґ–Є–≤–Њ—В–љ—Л—Е –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ. –Я–Њ—Б–ї–µ –Ј–∞–±–Њ—П –ґ–Є–≤–Њ—В–љ—Л—Е –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є –Љ–∞—Б—Б—Л –њ–µ—З–µ–љ–Є –љ–∞ 30% –≤ –≥—А—Г–њ–њ–∞—Е 30 –Є 90 –і–љ–µ–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є –Љ–∞—Б—Б–Њ–є —Г –ґ–Є–≤–Њ—В–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л.
–Я—А–Є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–∞–є–і–µ–љ–Њ, —З—В–Њ –љ–∞ 14-–µ —Б—Г—В –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –ґ–Є—А–Њ–≤–∞—П –і–Є—Б—В—А–Њ—Д–Є—П –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤, –Њ—З–∞–≥–Њ–≤—Л–є –љ–µ–Ї—А–Њ–Ј –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤, –љ–∞—З–∞–ї—М–љ—Л–є —Д–Є–±—А–Њ–Ј —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –≤–µ–љ, –њ–Њ—А—В–∞–ї—М–љ—Л—Е —В—А–∞–Ї—В–Њ–≤, —А–∞—Б—И–Є—А–µ–љ–Є–µ –њ–Њ—А—В–∞–ї—М–љ—Л—Е –≤–µ–љ, —Б–Є–љ—Г—Б–Њ–Є–і–Њ–≤, –Њ—В–µ–Ї –њ–Њ—А—В–∞–ї—М–љ—Л—Е —В—А–∞–Ї—В–Њ–≤, –≤ –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞—Е вАУ –±–µ–ї–Ї–Њ–≤–∞—П –і–Є—Б—В—А–Њ—Д–Є—П. –Т –≥—А—Г–њ–њ–µ —Б –≤–≤–µ–і–µ–љ–Є–µ–Љ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –љ–∞ —Д–Њ–љ–µ –ґ–Є—А–Њ–≤–Њ–є –і–Є—Б—В—А–Њ—Д–Є–Є –њ–µ—З–µ–љ–Є –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –њ–Њ–ї–љ–Њ–µ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —П–≤–ї–µ–љ–Є—П –љ–∞—З–∞–ї—М–љ–Њ–≥–Њ —Д–Є–±—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є —Г 4 –ґ–Є–≤–Њ—В–љ—Л—Е –Є–Ј 5, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –≥—А—Г–њ–њ–µ —Б –≤–≤–µ–і–µ–љ–Є–µ–Љ CCl4 —П–≤–ї–µ–љ–Є—П –љ–∞—З–∞–ї—М–љ–Њ–≥–Њ —Д–Є–±—А–Њ–Ј–∞ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —Г –≤—Б–µ—Е 5 –ґ–Є–≤–Њ—В–љ—Л—Е. –Э–∞ 30-–µ —Б—Г—В –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –љ–µ–Ї—А–Њ–Ј—Л –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤, –љ–∞–ї–Є—З–Є–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є–љ—Д–Є–ї—М—В—А–∞—В–∞ –≤–Њ–Ї—А—Г–≥ –њ–Њ—А—В–∞–ї—М–љ—Л—Е —В—А–∞–Ї—В–Њ–≤, –Њ—В–µ—З–љ–Њ—Б—В—М –њ–Њ—А—В–∞–ї—М–љ—Л—Е —В—А–∞–Ї—В–Њ–≤, —Д–Є–±—А–Њ–Ј –њ–Њ—А—В–∞–ї—М–љ—Л—Е —В—А–∞–Ї—В–Њ–≤ —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Ї–Њ—А–Њ—В–Ї–Є—Е –њ–Њ—А—В–Њ–њ–Њ—А—В–∞–ї—М–љ—Л—Е —Б–µ–њ—В, –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –Ї—А—Г–њ–љ–Њ–Ї–∞–њ–µ–ї—М–љ–∞—П –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є—П –њ–µ—А–Є–њ–Њ—А—В–∞–ї—М–љ—Л—Е –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤. –Э–∞–±–ї—О–і–∞–ї–Є—Б—М –њ—А–Њ—П–≤–ї–µ–љ–Є—П –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤: –∞–љ–Є–Ј–Њ–Ї–∞—А–Є–Њ–Ј, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —З–Є—Б–ї–∞ –Љ–Є—В–Њ–Ј–Њ–≤, –љ–∞–ї–Є—З–Є–µ –і–≤—Г—П–і–µ—А–љ—Л—Е –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤. –Ю—В–Љ–µ—З–µ–љ—Л —Г—З–∞—Б—В–Ї–Є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —Е–Њ–ї–µ—Б—В–∞–Ј–∞ –≤ –њ–µ—А–Є–њ–Њ—А—В–∞–ї—М–љ—Л—Е –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞—Е, –≥–Є–њ–µ—А–њ–ї–∞–Ј–Є—П –Ї–ї–µ—В–Њ–Ї —А–µ—В–Є–Ї—Г–ї—Г–Љ–∞ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Т–≤–µ–і–µ–љ–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –љ–∞ 30-–µ —Б—Г—В –љ–µ –њ–Њ–≤–ї–Є—П–ї–Њ –љ–∞ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –ґ–Є—А–Њ–≤–Њ–є –Є —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—В—А–Њ—Д–Є–Є, –∞ —В–∞–Ї–ґ–µ –љ–µ –њ—А–Є–≤–µ–ї–Њ –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О —П–≤–ї–µ–љ–Є–є –Њ—З–∞–≥–Њ–≤–Њ–≥–Њ –љ–µ–Ї—А–Њ–Ј–∞. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —П–≤–ї–µ–љ–Є—П —Д–Є–±—А–Њ–Ј–∞ —В–∞–Ї –ґ–µ, –Ї–∞–Ї –љ–∞ —Б—А–Њ–Ї–µ 14 —Б—Г—В, —Г–Љ–µ–љ—М—И–Є–ї–Є—Б—М, —З—В–Њ –≤—Л—А–∞–ґ–∞–ї–Њ—Б—М –≤ —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –њ–Њ—А—В–Њ–њ–Њ—А—В–∞–ї—М–љ—Л—Е —Б–µ–њ—В –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ґ–Є–≤–Њ—В–љ—Л—Е —Б —П–≤–ї–µ–љ–Є—П–Љ–Є —Д–Є–±—А–Њ–Ј–∞ –≤ –≥—А—Г–њ–њ–µ CCl4 —Б 80 –і–Њ 40% –≤ –≥—А—Г–њ–њ–µ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞. –Э–∞ 90-–µ —Б—Г—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ —В–Ї–∞–љ–Є –њ–µ—З–µ–љ–Є –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –Ї—А—Г–њ–љ–Њ–Ї–∞–њ–µ–ї—М–љ–∞—П –ґ–Є—А–Њ–≤–∞—П –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є—П –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤, —А–∞—Б—И–Є—А–µ–љ–Є–µ —Б–Є–љ—Г—Б–Њ–Є–і–Њ–≤, –љ–∞–ї–Є—З–Є–µ —Г—З–∞—Б—В–Ї–Њ–≤ –∞—Ж–Є–і–Њ—Д–Є–ї—М–љ–Њ–є –і–Є—Б—В—А–Њ—Д–Є–Є, –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ –Ї—А—Г–њ–љ–Њ—П–і–µ—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї (–∞–Ї—В–Є–≤–∞—Ж–Є—П —А–µ–≥–µ–љ–µ—А–∞—В–Њ—А–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –њ–Њ –Ј–∞–Љ–µ—Й–µ–љ–Є—О –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –њ–µ—З–µ–љ–Є), —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є —А–µ–≥–µ–љ–µ—А–∞—В–Њ—А–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –њ—А–Є –≤–≤–µ–і–µ–љ–Є–Є CCl4. –Э–∞ —Б—А–Њ–Ї–µ 90 —Б—Г—В —Г–≤–µ–ї–Є—З–Є–ї–Њ—Б—М –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є –≤–Њ–Ї—А—Г–≥ –њ–Њ—А—В–∞–ї—М–љ—Л—Е —В—А–∞–Ї—В–Њ–≤, –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –љ–∞–ї–Є—З–Є–µ –њ–Њ—А—В–Њ–њ–Њ—А—В–∞–ї—М–љ—Л—Е –Є –њ–Њ—А—В–Њ—Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е —Б–µ–њ—В, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –ї–Њ–ґ–љ—Л—Е –і–Њ–ї–µ–Ї (—Г –≤—Б–µ—Е –ґ–Є–≤–Њ—В–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–Љ –≤–≤–Њ–і–Є–ї–Є CCl4), —З—В–Њ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –і–ї—П —А–∞–љ–љ–Є—Е —Б—В–∞–і–Є–є —Ж–Є—А—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є. –Т–≤–µ–і–µ–љ–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–µ –≤–ї–Є—П–ї–Њ –љ–∞ –ґ–Є—А–Њ–≤—Г—О –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є—О –њ–µ—З–µ–љ–Є. –Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є –≤ –≥—А—Г–њ–њ–µ —Б –≤–≤–µ–і–µ–љ–Є–µ–Љ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –љ–∞–є–і–µ–љ–Њ, —З—В–Њ —Г 2 –ґ–Є–≤–Њ—В–љ—Л—Е –≤ –≥—А—Г–њ–њ–µ —Д–Є–±—А–Њ–Ј –±—Л–ї –≤—Л—А–∞–ґ–µ–љ —Б–ї–∞–±–Њ (–≤ –≤–Є–і–µ –њ–µ—А–Є–њ–Њ—А—В–∞–ї—М–љ–Њ–≥–Њ —Д–Є–±—А–Њ–Ј–∞) –±–µ–Ј —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Б–µ–њ—В –Є –ї–Њ–ґ–љ—Л—Е –і–Њ–ї–µ–Ї, –∞ –≤ 3 —Б–ї—Г—З–∞—П—Е –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –ї–Њ–ґ–љ—Л—Е –і–Њ–ї–µ–Ї. –Э–∞—З–∞–ї—М–љ—Л–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П —Д–Є–±—А–Њ–Ј–∞ —Г–Љ–µ–љ—М—И–Є–ї–Є—Б—М (–і–Њ 60% —Б–ї—Г—З–∞–µ–≤), —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —В–µ–љ–і–µ–љ—Ж–Є–Є –Ї —Б–љ–Є–ґ–µ–љ–Є—О —В—П–ґ–µ—Б—В–Є —Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞.
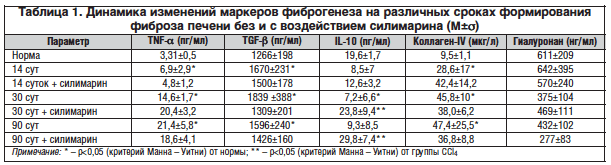
–Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г—А–Њ–≤–љ—П TNF-ќ± –≤ —А–∞–Ј–ї–Є—З–љ—Л–µ —Б—А–Њ–Ї–Є –Њ—В –љ–∞—З–∞–ї–∞ –≤–≤–µ–і–µ–љ–Є—П CCl4 –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–µ —Г—А–Њ–≤–љ—П —Ж–Є—В–Њ–Ї–Є–љ–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (—В–∞–±–ї. 1). –Я–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П TNF-ќ± –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —А–∞–љ–љ–µ–є –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є —Н—В–Њ–≥–Њ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Ж–Є—В–Њ–Ї–Є–љ–∞ –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Г—В—П–ґ–µ–ї–µ–љ–Є—О –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –°–Є–љ—В–µ–Ј –Є —Б–µ–Ї—А–µ—Ж–Є—П –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—О –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О —Д–Є–±—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є [11]. TNF-ќ± –њ—А–Њ–і—Г—Ж–Є—А—Г–µ—В—Б—П –Љ–∞–Ї—А–Њ—Д–∞–≥–∞–Љ–Є, –Љ–Њ–љ–Њ—Ж–Є—В–∞–Љ–Є, –Ґ-–Ї–ї–µ—В–Ї–∞–Љ–Є –≤ –Њ—В–≤–µ—В –љ–∞ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –њ–µ—З–µ–љ–Є —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –∞–≥–µ–љ—В–∞–Љ–Є –њ—А–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е —Н—В–Њ–≥–Њ –Њ—А–≥–∞–љ–∞ –Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є —В–∞–Ї–Є—Е —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –≤–µ—Й–µ—Б—В–≤, –Ї–∞–Ї CCl4. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, TNF-ќ± –≤—Л—А–∞–±–∞—В—Л–≤–∞–µ—В—Б—П –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞–Љ–Є –Є –Ј–≤–µ–Ј–і—З–∞—В—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є [12]. –Я—А–Є –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–Є —Г—А–Њ–≤–љ—П TNF-ќ± —А–µ–Ј–Ї–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –∞–њ–Њ–њ—В–Њ–Ј –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤ [13]. –Т–≤–µ–і–µ–љ–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –љ–∞ 14-–µ —Б—Г—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П TNF-ќ± –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, –љ–∞ 30-–µ —Б—Г—В –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –≤—Л—Е–Њ–і–∞ TNF-ќ± –≤ —Б—Л–≤–Њ—А–Њ—В–Ї—Г –Ї—А–Њ–≤–Є. –≠—В–∞ —В–µ–љ–і–µ–љ—Ж–Є—П –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –Є –љ–∞ 90-–µ —Б—Г—В –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –≤–≤–µ–і–µ–љ–Є—П CCl4.
–Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г—А–Њ–≤–љ—П TGF-ќ≤ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ—Л –µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–µ –љ–∞ 14-–µ —Б—Г—В –њ–Њ—Б–ї–µ –≤–≤–µ–і–µ–љ–Є—П CCl4 –Є —Г–Љ–µ—А–µ–љ–љ—Л–є —А–Њ—Б—В –љ–∞ 90-–µ —Б—Г—В (—В–∞–±–ї. 1). TGF-ќ≤ —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–Є–Љ –Ј–≤–µ–Ј–і—З–∞—В—Л–µ –Ї–ї–µ—В–Ї–Є. –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Г—А–Њ–≤–µ–љ—М TGF-ќ≤ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б —В—П–ґ–µ—Б—В—М—О —Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [14]. –£–Љ–µ—А–µ–љ–љ–Њ–µ –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–µ —Г—А–Њ–≤–љ—П TGF-ќ≤ –Љ–Њ–ґ–µ—В —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞—В—М –Њ–± —Г–Љ–µ—А–µ–љ–љ–Њ–є —В—П–ґ–µ—Б—В–Є —Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –і–∞–љ–љ—Л–Љ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Я—А–Є –≤–≤–µ–і–µ–љ–Є–Є —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —Г—А–Њ–≤–µ–љ—М TGF-ќ≤ –њ–Њ–≤—Л—И–∞–ї—Б—П –љ–∞ 30-–µ —Б—Г—В –Њ—В –љ–∞—З–∞–ї–∞ –≤–≤–µ–і–µ–љ–Є—П CCl4 –Є —Б–љ–Є–ґ–∞–ї—Б—П –љ–∞ 90-–µ —Б—Г—В.
–Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г—А–Њ–≤–љ—П IL-10 –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –µ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –њ–Њ–і–Њ–њ—Л—В–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –љ–∞–±–ї—О–і–µ–љ–Є—П. –Ю—В—З–µ—В–ї–Є–≤–Њ –≤—Л—А–∞–ґ–µ–љ–љ–∞—П —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П IL-10 –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –і–Њ 90-—Е —Б—Г—В (—В–∞–±–ї. 1). –°–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П IL-10 —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —Г—Е—Г–і—И–µ–љ–Є–Є –Є–Љ–Љ—Г–љ–Њ—А–µ–≥—Г–ї–Є—А—Г—О—Й–µ–є —Д—Г–љ–Ї—Ж–Є–Є —Ж–Є—В–Њ–Ї–Є–љ–∞ –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –±–Њ–ї–µ–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–Љ—Г –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—О –њ–µ—З–µ–љ–Є –Є —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є —Д–Є–±—А–Њ–≥–µ–љ–µ–Ј–∞ –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ CCl4 [5]. –°–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П IL-10 –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О —Д–Є–±—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є, —В. –Ї. –Њ–љ –Њ–±–ї–∞–і–∞–µ—В –∞–љ—В–Є—Д–Є–±—А–Њ–≥–µ–љ–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є [15]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, IL-10 —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –∞–њ–Њ–њ—В–Њ–Ј –Ј–≤–µ–Ј–і—З–∞—В—Л—Е –Ї–ї–µ—В–Њ–Ї [16, 17], —З—В–Њ –њ–Њ–і–∞–≤–ї—П–µ—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –Є–Љ–Є TGF-ќ≤. –Т–≤–µ–і–µ–љ–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–Є–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ —Г—А–Њ–≤–µ–љ—М IL-10 –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є: —В–∞–Ї, –≤ –≥—А—Г–њ–њ–µ —Б –≤–≤–µ–і–µ–љ–Є–µ–Љ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —Г—А–Њ–≤–µ–љ—М IL-10 –љ–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–ї—Б—П –љ–∞ 30-–µ –Є 90-–µ —Б—Г—В –љ–∞–±–ї—О–і–µ–љ–Є—П, –њ—А–Є —Н—В–Њ–Љ —А–Њ—Б—В –љ–∞ 30-–µ —Б—Г—В —Б–Њ—Б—В–∞–≤–Є–ї 305% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є —Б –≤–≤–µ–і–µ–љ–Є–µ–Љ CCl4, –∞ –љ–∞ 90-–µ —Б—Г—В –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–µ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 320% (—В–∞–±–ї. 1). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, IL-10 –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Љ–љ–Њ–≥–Њ—Б—В–Њ—А–Њ–љ–љ–µ–µ —Б–і–µ—А–ґ–Є–≤–∞—О—Й–µ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Д–Є–±—А–Њ–≥–µ–љ–µ–Ј, –Є —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –µ–≥–Њ –і–ї–Є—В–µ–ї—М–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –љ–∞—А—П–і—Г —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П TNF-ќ± –Є —Г–Љ–µ—А–µ–љ–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П TGF-ќ≤ —Б–≤–Є–і–µ–ї—М—Б—В–≤—Г–µ—В –Њ –њ—А–Њ—Д–Є–±—А–Њ–≥–µ–љ–љ–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є –Є —А–∞–Ј–≤–Є—В–Є–Є —Д–Є–±—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є CCl4.
–Ъ–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ TNF-ќ± –Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ IL-10 –Є TGF-ќ≤ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —А–∞–Ј–љ–Њ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є–Є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П —Н—В–Є—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –љ–∞ —А–∞–љ–љ–Є—Е —Н—В–∞–њ–∞—Е —А–∞–Ј–≤–Є—В–Є—П —Д–Є–±—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є. –Я—А–Є —Н—В–Њ–Љ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є –∞–љ—В–Є—Д–Є–±—А–Њ–≥–µ–љ–љ–Њ–≥–Њ IL-10 –љ–∞ —Д–Њ–љ–µ —Г–Љ–µ—А–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є—П TGF-ќ≤ –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–≥–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є—П TNF-ќ±, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ–Љ —Д–Є–±—А–Њ–Ј–∞ –≤ —В–Ї–∞–љ–Є –њ–µ—З–µ–љ–Є. –Т–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П IL-10 –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —Г –ґ–Є–≤–Њ—В–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–Љ –≤–≤–Њ–і–Є–ї–Є CCl4, –і–∞–ґ–µ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ —Г—А–Њ–≤–µ–љ—М TGF-ќ≤ –Є TNF-ќ± —Б–љ–Є–ґ–∞–µ—В —В—П–ґ–µ—Б—В—М —Д–Є–±—А–Њ–Ј–∞ –љ–∞ —А–∞–љ–љ–Є—Е —Б—В–∞–і–Є—П—Е —Д–Є–±—А–Њ–≥–µ–љ–µ–Ј–∞ –њ–µ—З–µ–љ–Є.
–Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А—П–Љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤ —Д–Є–±—А–Њ–≥–µ–љ–µ–Ј–∞ вАУ –Ї–Њ–ї–ї–∞–≥–µ–љ–∞-IV –Є –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –љ–∞–є–і–µ–љ–Њ, —З—В–Њ —Г—А–Њ–≤–µ–љ—М –Ї–Њ–ї–ї–∞–≥–µ–љ–∞-IV –≤–Њ–Ј—А–Њ—Б –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –њ–Њ–і–Њ–њ—Л—В–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –і–Њ 301% (p<0,05), 482% (p<0,05) –Є 502% –љ–∞ 14-–µ, 30-–µ –Є 90-–µ —Б—Г—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (—В–∞–±–ї. 1). –Т–Њ–Ј—А–∞—Б—В–∞–љ–Є–µ —Г—А–Њ–≤–љ—П –Ї–Њ–ї–ї–∞–≥–µ–љ–∞-IV —П–≤–ї—П–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –њ–µ—З–µ–љ–Є —Б —Г—З–µ—В–Њ–Љ —В–Њ–≥–Њ, —З—В–Њ –Ї–Њ–ї–ї–∞–≥–µ–љ-IV вАУ –≤–∞–ґ–љ—Л–є —Б—В—А—Г–Ї—В—Г—А–љ—Л–є —Н–ї–µ–Љ–µ–љ—В –±–∞–Ј–∞–ї—М–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ –µ–≥–Њ —Г—А–Њ–≤–љ—П –≤ –Ї—А–Њ–≤–Є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –µ–≥–Њ –Ј–∞–Љ–µ–љ–µ –≤ –±–∞–Ј–∞–ї—М–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ–µ –љ–∞ —Д–Є–±—А–Є–ї–ї—П—А–љ—Л–µ –Ї–Њ–ї–ї–∞–≥–µ–љ—Л [18]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ–Њ–Ї–∞–Ј–∞–ї–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ 61% (p>0,05) –Є 71% (p>0,05) –љ–∞ 30-–µ –Є 90-–µ —Б—Г—В–Ї–Є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, —Б–Є–љ—В–µ–Ј–Є—А—Г–µ–Љ–Њ–є –Ј–≤–µ–Ј–і—З–∞—В—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є, —Б—З–Є—В–∞–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [19], –Њ–і–љ–∞–Ї–Њ –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –≥–Є–∞–ї—Г—А–Њ–љ–∞–љ–∞ –≤ –Ї—А–Њ–≤–Є –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ—В—А–∞–ґ–µ–љ–Є–µ–Љ –µ–≥–Њ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ —Б–Є–љ—В–µ–Ј–∞ –≤ –і—А—Г–≥–Є—Е —В–Ї–∞–љ—П—Е –Є –љ–µ —Б–≤—П–Ј–∞–љ —Б –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є –њ–µ—З–µ–љ–Є [20].
–°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ –ї–∞–±–Є–ї—М–љ—Л–Љ —Н–ї–µ–Љ–µ–љ—В–Њ–Љ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ –Є –Љ–Њ–ґ–µ—В –њ–Њ–і–≤–µ—А–≥–∞—В—М—Б—П –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–Љ—Г —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–Љ—Г (–≥–Є–∞–ї—Г—А–Њ–љ–Є–і–∞–Ј—Л) –Є –љ–µ—Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–Љ—Г —А–∞–Ј—А—Г—И–µ–љ–Є—О. –Ю–±–Љ–µ–љ –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±—Л—Б—В—А–µ–µ, —З–µ–Љ –Њ–±–Љ–µ–љ –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤ [21]. –Ь–Њ–ї–µ–Ї—Г–ї—Л –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —А–∞–Ј—А—Г—И–∞—О—В—Б—П –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ. –Э–µ—Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–µ —А–∞–Ј—А—Г—И–µ–љ–Є–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –∞–Ї—В–Є–≤–љ—Л—Е —А–∞–і–Є–Ї–∞–ї–Њ–≤ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ [22]. –†–∞–Ј—А—Г—И–µ–љ–Є–µ —В–∞–Ї–Њ–≥–Њ —А–Њ–і–∞, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В –≤ –Љ–µ—Б—В–∞—Е –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —В–Ї–∞–љ–µ–є. –Ґ–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –≤–µ—А–Њ—П—В–љ–Њ, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ–± –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ї–∞–Ї –µ–µ —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–≥–Њ —А–∞–Ј—А—Г—И–µ–љ–Є—П –≥–Є–∞–ї—Г—А–Њ–љ–Є–і–∞–Ј–∞–Љ–Є, —В–∞–Ї –Є –љ–µ—Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–≥–Њ —А–∞–Ј—А—Г—И–µ–љ–Є—П –∞–Ї—В–Є–≤–љ—Л–Љ–Є —А–∞–і–Є–Ї–∞–ї–∞–Љ–Є –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –Є —Е–ї–Њ—А–∞ –љ–∞ –љ–∞—З–∞–ї—М–љ—Л—Е —Б—В–∞–і–Є—П—Е —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Д–Є–±—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ CCl4.
–Т–≤–µ–і–µ–љ–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –љ–µ –Њ–Ї–∞–Ј–∞–ї–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ —Г—А–Њ–≤–љ–Є –Ї–Њ–ї–ї–∞–≥–µ–љ–∞-IV –Є –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є —Г –њ–Њ–і–Њ–њ—Л—В–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е.
–Т—Л–≤–Њ–і—Л
1. –Э–∞—З–∞–ї—М–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є —Д–Є–±—А–Њ–Ј–∞ –≤ –њ–µ—З–µ–љ–Є –≤–Њ–Ј–љ–Є–Ї–∞—О—В —З–µ—А–µ–Ј 14 –і–љ–µ–є –Њ—В –љ–∞—З–∞–ї–∞ –≤–≤–µ–і–µ–љ–Є—П CCl4 –Є –≤—Л—А–∞–ґ–∞—О—В—Б—П –≤ —Д–Є–±—А–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–Є —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –≤–µ–љ –Є –њ–Њ—А—В–∞–ї—М–љ—Л—Е —В—А–∞–Ї—В–Њ–≤ (F1). –Э–∞—З–∞–ї–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Б–µ–њ—В –љ–∞–±–ї—О–і–∞–µ—В—Б—П –љ–∞ 30-–µ —Б—Г—В –Њ—В –≤–≤–µ–і–µ–љ–Є—П CCl4 (F2). –Э–∞ 90-–µ —Б—Г—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—В–Љ–µ—З–∞—О—В—Б—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ—А—В–Њ–њ–Њ—А—В–∞–ї—М–љ—Л—Е —Б–µ–њ—В, –њ–Њ—А—В–Њ—Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е —Б–µ–њ—В, –љ–∞—З–∞–ї–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –ї–Њ–ґ–љ—Л—Е –і–Њ–ї–µ–Ї вАУ –љ–∞—З–∞–ї—М–љ—Л—Е —Б—В–∞–і–Є–є —Д–Є–±—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є (F3).
2. –°–Є–ї–Є–Љ–∞—А–Є–љ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї —Б–љ–Є–ґ–µ–љ–Є—О —В—П–ґ–µ—Б—В–Є —Д–Є–±—А–Њ–Ј–∞ –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –≥—А—Г–њ–њ–∞—Е –Є —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ґ–Є–≤–Њ—В–љ—Л—Е —Б –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є —Д–Є–±—А–Њ–Ј–∞.
3. –Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г—А–Њ–≤–љ—П —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П TNF-ќ±, —Г–Љ–µ—А–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П TGF-ќ≤, —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П IL-10 –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
4. –°–Є–ї–Є–Љ–∞—А–Є–љ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є —Г—А–Њ–≤–љ—П IL-10 –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–ї —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Г—А–Њ–≤–љ–Є TGF-ќ≤ –Є TNF-ќ± —Г –њ–Њ–і–Њ–њ—Л—В–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е.
5. –Т –Ї—А–Њ–≤–Є –њ–Њ–≤—Л—И–µ–љ —Г—А–Њ–≤–µ–љ—М –Ї–Њ–ї–ї–∞–≥–µ–љ–∞-IV –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Є –Є–Љ–µ–µ—В—Б—П —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –љ–∞ 30-–µ, 90-–µ —Б—Г—В –Њ—В –љ–∞—З–∞–ї–∞ –≤–≤–µ–і–µ–љ–Є—П CCl4.
6. –°–Є–ї–Є–Љ–∞—А–Є–љ –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–ї —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Г—А–Њ–≤–µ–љ—М –Ї–Њ–ї–ї–∞–≥–µ–љ–∞-IV –Є –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.