Частота ЖДА у беременных в мире, в том числе в развивающихся странах, достигает 75%. В России, по данным Минздравсоцразвития, составляет 41,7% (МЗ и СР РФ, 2005)
К основным группам риска развития ЖДА относятся: беременные и кормящие женщины, дети, рожденные от матерей с наличием ЖДА в период беременности, женщины, страдающие меноррагиями различного генеза, больные с хроническими кровопотерями различной локализации (в том числе доноры). Как видим, основные группы риска представлены пациентами, находящимися под наблюдением акушера–гинеколога. Именно в акушерско–гинекологической практике представляется возможным проследить «железодефицитный континуум» в виде порочного круга формирования железодефицитного состояния у различных групп риска (рис. 1).
При неадекватной коррекции ЖДА у беременной рождается ребенок с недостаточными запасами железа, что является одним из факторов риска развития ЖДА, особенно при наличии у ребенка дополнительных факторов (алиментарный и др.). К тому же лактация матерью с некорригированной ЖДА не может компенсировать дефицит железа у ребенка. Однако дефицит железа у ребенка может не проявляться в течение некоторого времени, а манифестируется анемическим синдромом в подростковом возрасте, в период интенсивного роста или при наступлении менструаций у девочек.
В клинической практике встречаются случаи ЖДА у девушек (реже у подростков), у которых отсутствуют хронические кровопотери, признаки нарушения кишечного всасывания и инфекционно–воспалительного процесса. В то же время, у этих пациентов наблюдаются астенические проявления, некоторое отставание в развитии, частые заболевания в детском возрасте. В прошлом подобные анемии обозначались, как ранний хлороз. Проведенные исследования позволили установить, что матери этих пациентов во время беременности страдали ЖДА, лечение которой либо было неадекватным, либо вообще не проводилось. В связи с этим плод получает недостаточное количество железа и родившиеся дети имеют скрытый его дефицит, который не проявляется до тех пор, пока организм не испытывает повышенной потребности в железе (интенсивный рост органов и тканей, появление менструальных кровопотерь у девочек и др.). Дополнительными факторами риска при этом могут быть наличие других источников кровопотерь (десневые, носовые), а также алиментарный дефицит железа. Таким образом, развитие ЖДА в подростковом возрасте является чаще всего следствием недостаточных запасов железа в результате дефицита железа у матери во время беременности. Девушки с «врожденным» дефицитом железа, у которых устанавливаются обильные менструации, имеют больший риск развития ЖДА. Женщины с меноррагиями различного генеза составляют основную группу риска ЖДА. В случаях наступления беременности у женщин данной категории становится еще более высоким риск возникновения ЖДА и дефицита железа у плода.
Диагностический поиск
при подозрении
на железодефицитную анемию
Ключевыми лабораторными признаками ЖДА являются следующие:
– низкий цветовой показатель,
– гипохромия эритроцитов, микроцитоз,
– снижение уровня сывороточного железа,
– повышение общей железосвязывающей способности,
– снижение уровня ферритина.
При трактовке результатов анализа крови следует обязательно обращать внимание не только на цветовой показатель, который может быть рассчитан неправильно (например, в случае ошибочного подсчета количества эритроцитов), но и на морфологическую характеристику эритроцитов (гипохромия эритроцитов и ее выраженность, микроцитоз), которая дается врачом–лаборантом при просмотре мазка крови. При использовании в лабораторной практике современных анализаторов имеется возможность непосредственного определения среднего содержания гемоглобина в одном эритроците, обозначающегося аббревиатурой MSN (в норме 27–35 pg).
Гипохромный характер анемии делает весьма вероятным наличие ЖДА, поскольку последние всегда гипохромные. Однако не все гипохромные анемии являются железодефицитными, в связи с чем необходима дифференциальная диагностика ЖДА с другими, реже встречающимися гипохромными анемиями (сидероахрестические анемии, талассемия). Определение уровня сывороточного железа позволяет разграничить эти состояния на данном этапе диагностического поиска. На показатели сывороточного железа может влиять целый ряд факторов, маскирующих тем самым истинное содержание железа в сыворотке, что следует учитывать при трактовке полученных результатов. К таким факторам относятся:
– лабораторно–методические погрешности,
– прием лекарственных препаратов железа,
– прием витаминных препаратов, содержащих небольшое количество железа,
– прием некоторых лекарственных препаратов (оральные контрацептивы, аллопуринол),
– трансфузии эритроцитов,
– время исследования сывороточного железа (фаза цикла, время суток).
Наряду с определением концентрации железа в сыворотке диагностическое значение имеет оценка общей железосвязывающей способности сыворотки (ОЖСС), отражающей степень «голодания» сыворотки и насыщения трансферрина железом. У больных ЖДА отмечаются повышение ОЖСС, значительное повышение латентной железосвязывающей способности и уменьшение процента насыщения трансферрина. Поскольку запасы железа при развитии ЖДА истощены, отмечается снижение содержания в сыворотке ферритина – железосодержащего белка, уровень которого отражает, наряду с концентрацией гемосидерина, величину запасов железа в депо. Снижение уровня ферритина в сыворотке является наиболее чувствительным и специфичным признаком дефицита железа.
После верификации железодефицитного характера анемии, т.е. синдрома ЖДА, необходимо выявление причины, лежащей в основе данного варианта анемического синдрома (нозологическая диагностика). Для клинициста этот этап является не менее важным и, вместе с тем, наиболее трудным и ответственным, поскольку в основе имеющейся ЖДА могут лежать потенциально курабельные заболевания. Наличие в МКБ–10 рубрики «Железодефицитная анемия неуточненная» оставляет для врача «лазейку» в случаях отсутствия явной причины анемии, «освобождая» его от тщательности и углубления диагностического поиска на этапе нозологической диагностики. Следует подчеркнуть важность конструктивного взаимодействия акушера–гинеколога и интерниста на этапах синдромной и нозологической диагностики, поскольку подавляющее большинство больных ЖДА независимо от вызванной причины обращаются прежде всего, как и многие другие пациенты, к терапевту, а не к акушеру–гинекологу.
ЖДА составляют около 90% всех анемий беременных и обычно диагностируются во 2–3 триместре беременности.
Основной причиной ЖДА у беременных является повышенная потребность и дополнительный расход железа на нужды плода, рост плаценты. Развитие ЖДА во время беременности зависит от исходных запасов железа у женщины, величины плода, многоплодия, количеств беременностей и сроков между ними, а также от других факторов (алиментарная недостаточность, хронические кровопотери и др.). Даже прекращение менструальных кровопотерь, в том числе и обильных, не в состоянии компенсировать повышенную потребность в железе при беременности из–за вышеуказанных причин.
В гинекологической практике основной причиной ЖДА являются хронические маточные кровопотери при меноррагиях различного генеза (тромбоцитопатии, внутриматочный контрацептив и др.), дисфункциональных маточных кровотечениях, миоме матки, эндометриозе и других состояниях. Особого внимания заслуживает большая группа женщин, страдающих меноррагиями, у которых врач–гинеколог, не обнаруживая при обследовании какой–либо очевидной причины, даже при выявлении миомы отвергает в качестве причины ЖДА меноррагию и рекомендует искать другие причины анемии. В представлении многих врачей такие менструальные кровопотери не могут приводить к развитию анемии, нередко выраженной. В связи с этим следует подчеркнуть, что механизм анемии у данной категории пациенток обусловлен не объемом кровопотери (в отличие от острых массивных однократных кровопотерь), а ежемесячными потерями железа, превышающими количество поступающего с пищей железа.
Напомним, что средняя менструальная кровопотеря составляет около 50 мл (25 мг железа), что и определяет дополнительные (около 1 мг в сутки) по сравнению с мужчинами потери железа. У женщин, страдающих меноррагиями различного генеза, количество теряемой за одну менструацию крови достигает 200 мл (100 мг железа) и более, а следовательно, суточные потери железа составляют около 4 мг. В подобных ситуациях потеря железа за 1 сутки уже превышает его поступление на 1 мг, за 1 мес. на 30 мг, а за 1 год дефицит железа достигает 360 мг. Нетрудно понять, что в условиях продолжающихся меноррагий при отсутствии компенсации потерь железа и по мере истощения его запасов у женщин развивается дефицит железа с последующим формированием клинико–гематологического синдрома ЖДА. Сроки развития ЖДА при этом зависят от выраженности меноррагий, величины исходных запасов железа, наличия других факторов риска развития ЖДА. С учетом этого при выявлении причин анемии у женщин детородного возраста врач должен получить информацию о длительности менструальных кровопотерь (число дней), ее интенсивности (наличие сгустков, количество применяемых гигиенических средств и т.д.), продолжительности цикла (число дней), длительности наличия меноррагий.
Лечение больных
железодефицитными анемиями
В случаях выявления причины ЖДА (например, миомы матки) лечение должно быть направлено на устранение этой причины (в случае возможности и при соответствующих показаниях)
Всем больным ЖДА показана патогенетическая терапия препаратами железа. Следует подчеркнуть ошибочность мнения о возможности коррекции дефицита железа с помощью пищевых продуктов с высоким содержанием железа, что является одним из мифов в представлениях о ведении больных ЖДА. Об этом должны быть осведомлены больные, что следует считать важным образовательным компонентом ведения данной категории пациентов. Разумеется, пища должна быть богата продуктами, содержащими железо. Однако следует иметь в виду неодинаковую степень всасываемости железа из различных продуктов. Так, например, железо, содержащееся в мясе в виде гема, всасывается на 40–50%, в то время как из растительных продуктов, овощей, фруктов всасывается всего 3–5% содержащегося в них железа. Поэтому средством выбора для коррекции дефицита железа и уровня гемоглобина у больных ЖДА являются лекарственные препараты железа (ПЖ).
В настоящее время в распоряжении врача имеется большой арсенал лекарственных ПЖ, характеризующихся различным количеством содержащегося в них железа, наличием дополнительных компонентов, влияющих на фармакокинетику разных лекарственных форм (рис. 2).
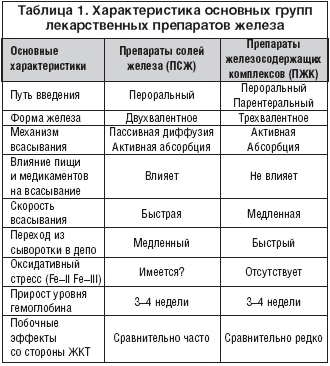
Из препаратов солей железа (ПСЖ) железо всасывается в двухвалентной форме, а в последующем превращается в трехвалетное, которое связывается с трансферрином и используется для построения молекулы гемоглобина. В препаратах железосодержащих комплексов (ПЖК) железо находится в трехвалентной форме и всасывается как бы в готовом виде. В ПЖК, в частности, в гидрооксиполимальтозном комплексе железо связано, как в физиологическом состоянии, в молекуле ферритина.
Существуют различия в механизмах всасывания железа из ПСЖ и ПЖК. Всасывание железа из ПСЖ происходит главным образом в виде пассивной диффузии согласно градиенту концентрации и в меньшей степени активно, в то время как абсорбция железа из ПЖК является активным процессом в виде конкурентного обмена лигандами. Это ведет к различному уровню железа в сыворотке, объему распределения, константам элиминации после абсорбции. Железо из ПЖК медленно всасывается, концентрация его в сыворотке нарастает медленно, и оно быстро поступает в запасы.
Считается, что при лечении ПСЖ могут возникать нарушения окислительных процессов (оксидативные повреждения) вследствие превращения ионов двухвалентного железа в трехвалентное, которое соединяется с трансферрином и включается в молекулу гемоглобина. При окислении образуются свободные радикалы, которые вызывают клеточные повреждения, такие как перекисное окисление липидов, нарушение структуры мембранных и клеточных белков, повреждение клеточной ДНК и РНК. ПСЖ в отличие от ПЖК не вызывают «оксидативного стресса», поскольку ионы железа не меняют свою валентность в процессе всасывания.
Для более лучшей абсорбции ПСЖ рекомендуется принимать за час до еды, т.е. на пустой желудок, чтобы избежать нарушений со стороны желудка, кишечника и других побочных эффектов. Современные технологии производства препаратов железа позволяют производить ПСЖ с замедленным высвобождением железа в тонком кишечнике, что уменьшает токсическое воздействие ионов железа на слизистую желудка. Частота побочных эффектов при лечении ПЖК меньше по сравнении с ПСЖ, что обеспечивает лучшую комплаентность больных ЖДА (табл. 1).
Кроме того, ПСЖ взаимодействует с некоторыми пищевыми продуктами (танин, фитаты, соли кальция) и медикаментами (пленкообразующие препараты, тетрациклины, препараты кальция), влияющими на биодоступность железа. В связи с этим ПСЖ не следует принимать одновременно с указанными пищевыми продуктами и лекарственными препаратами. В то же время пища и медикаменты не оказывают влияния на всасывание железа из ПЖК.
Темпы прироста показателей гемоглобина при применении ПСЖ и ПЖК примерно одинаковые.
При принятии решения о назначении ПЖ врач должен учитывать следующие моменты, имеющие принципиальное значение в тактике ведения конкретного больного:
• путь введения ПЖ
• выбор лекарственного ПЖ
• длительность насыщающей терапии
• необходимость поддерживающей терапии
• оценка эффективности
• оценка переносимости
• установление причины отсутствия или недостаточного эффекта.
Путь введения препаратов железа
В большинстве случаев для коррекции дефицита железа при отсутствии специальных показаний ПЖ следует назначать внутрь. Путь введения ПЖ у больных ЖДА определяется конкретной клинической ситуацией, в частности, состоянием кишечного всасывания и переносимостью пероральных ПЖ. Основным показанием для парентерального введения ПЖ следует считать наличие патологии кишечника с нарушением всасывания (различные энтериты, синдром недостаточности всасывания, резекция тонкой кишки, резекция желудка по Бильрот II с формированием «слепой петли»). ПЖ для парентерального введения могут быть средством выбора при плохой переносимости пероральных ПЖ, однако большинство современных ПСЖ и ПЖК переносятся сравнительно удовлетворительно. В связи с этим принятие решения о назначении парентерального ПЖ должно осуществляться только после ряда «врачебных маневров» (снижение дозы ПЖ, прием вместе с пищей, смена препарата и т.д.). Темпы прироста уровня гемоглобина при назначении ПЖ внутрь и парентерально оказались приблизительно одинаковыми, в связи с чем предпочтение ПЖ в инъекционных формах в случаях необходимости более быстрого прироста уровня гемглобина (например, при подготовке больной миомой к оперативному вмешательству) следует считать неоправданным. Многие врачи обосновывают назначение парентеральных ПЖ выраженностью анемического синдрома в расчете на якобы больший их эффект, что также не имеет достаточных оснований и не подтверждается клинической практикой.
Выбор лекарственного
препарата железа
Не менее важным шагом является выбор конкретного лекарственного ПЖ для приема внутрь, тем более, что в настоящее время на российском фармацевтическом рынке имеется большой арсенал ПЖ в виде различных солей железа и в меньшем количестве – в виде железосодержащих комплексов.
Выбор ПЖ и оптимального режима его дозирования должен определяться количеством и биодоступностью содержащегося в нем железа, переносимостью, стоимостью. При этом необходимо иметь в виду, что адекватный прирост показателей гемоглобина у больных ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг элементарного железа. Учитывая, что при развитии ЖДА всасывание железа увеличивается по сравнению с нормой и составляет 25–30% (при нормальных запасах железа – всего 3–7%), необходимо назначать от 100 до 300 мг элементарного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. С учетом этого при выборе ПЖ следует ориентироваться не на содержание в нем общего количества соединений железа, а на количество элементарного железа. Например, при назначении препаратов сульфата железа с низким содержанием элементарного железа (менее 100 мг) количество принимаемых таблеток должно быть от 3 и выше (в зависимости от содержания железа в каждой таблетке), в то время как препараты сульфата, фумарата или гидроксиполимальтозного комплекса железа с содержанием 100 мг элементарного железа можно принимать в количестве 1–2 таблетки в сутки.
Основные ПСЖ представлены сульфатом железа, глюконатом, хлоридом, фумаратом, глицин сульфатом. Наибольшей степенью абсорбции обладают препараты сульфата железа, наименьшей – глицинсульфата. Многие из ПСЖ содержат вещества, например, аскорбиновую кислоту, усиливающие всасывание железа и улучшающие биодоступность препарата, а также витамины (фолиевую кислоту, цианокобаламин). Среди ПЖК на отечественном рынке имеются гидроксиполимальтозный комплекс, железо–сорбитоловый комплекс, протеин сукцинилат железа, железо–сахарозный комплекс.
Необходимо учитывать, что всасывание железа из ПСЖ может уменьшаться под влиянием содержащихся в некоторых пищевых продуктах веществ – фитинов (рис, соя), фосфатов (рыба, морепродукты), танина (чай, кофе). Многие больные склонны запивать лекарства чаем, что в случаях приема ПСЖ недопустимо, поскольку образуются плохо растворимые комплексы с низкой их абсорбцией в кишечнике. Кроме того, всасывание железа из ПЖ в виде солей ухудшается при одновременном приеме ряда медикаментов (тетрациклины, антациды, соли кальция и магния). С учетом этого следует рекомендовать прием ПСЖ в различное время с другими вышеуказанными медикаментами. В то же время препараты ЖСК, в частности, гидроксиполимальтозный комплекс, лишены подобных недостатков, поскольку пищевые продукты и медикаменты не оказывают влияния на всасываемость железа (в виде трехвалентной формы) из железосодержащих комплексов.
Как уже упоминалось, ПСЖ содержат двухвалентное железо, которое после поступления в кровь превращается в трехвалентное железо для последующего его включения в молекулу гемоглобина. Процесс превращения двухвалентного в трехвалентное железо благодаря потере одного электрона может сопровождаться образованием свободных радикалов, что обозначается как оксидативный стресс, способный оказывать негативное влияние на физиологические процессы в различных органах и тканях. В то же время препараты ЖСК, в состав которых входит трехвалентное железо, непосредственно использующееся для построения молекулы гемоглобина, лишены возможного прооксидантного действия. Это различие между двумя группами железосодержащих препаратов постулируется, как недостаток ПСЖ и преимущество ЖСК. Между тем способность ПСЖ вызывать оксидативный стресс, в отличие от ЖСК, показана в эксперименте на крысах и в условиях in vitro. Реальность феномена оксидативного стресса при лечении препаратами солей железа в клинических условиях оставалась недоказанной [2–4]. В проведенных нами исследованиях различных показателей активности свободнорадикального перекисного окисления липидов (базальная и стимулированная хемолюминисценция, малоновый диальдегид) и антиперекисной активности плазмы не выявлено активизации процессов свободноперекисного окисления у больных ЖДА на фоне лечения ПСЖ (в частности, препаратом Ферро–Фольгамма) [5].
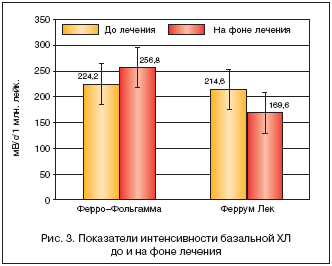
Так, после проведенного курса лечения ПЖ (Ферро–Фольгамма и Феррум Лек в виде жевательных таблеток) и достижения целевого уровня гемоглобина базальный показатель интенсивности хемолюминисценции (ХЛ) лейкоцитов составил 256,8±45,2 мВ/с/106 лейкоцитов в группе, леченной Ферро–Фольгаммой, и 169,6±31,9 мВ/с/106 лейкоцитов у больных, получавших Феррум Лек. Различия между группами как до лечения, так на фоне приема препаратов железа статистически недостоверны (р>0,05). Статистически недостоверна и разница показателей до и на фоне лечения у пациентов внутри каждой группы (рис. 3).
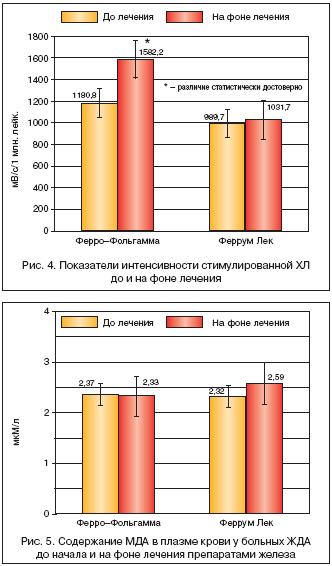
Иная динамика на фоне лечения ПЖ наблюдалась при исследовании стимулированного показателя интенсивности ХЛ лейкоцитов (рис. 4). До назначения препаратов железа исследуемый показатель составил в I и II группах 1180,5±204,5 мВ/с/106 и 989,7±245,8 мВ/с/106 лейкоцитов соответственно. После лечения этот показатель составил 1582,2±178,4 мВ/с/106 лейкоцитов в группе, получавшей Ферро–Фольгамму, и 1031,7±231,9 мВ/с/106 лейкоцитов в группе Феррум Лека. Различия до лечения в группах статистически недостоверны (р>0,05). Различие до и на фоне лечения статистически достоверно только в первой группе (р<0,05).
Таким образом, Ферро–Фольгамма приводит к статистически достоверному повышению показателя стимулированной ХЛ, в то время как Феррум Лек не влиял на этот показатель. Однако поскольку на фоне лечения Ферро–Фольгаммой не происходило повышения интенсивности базальной ХЛ, то можно говорить лишь о модифицирующем действии данного препарата железа на стимулированную генерацию активных форм кислорода лейкоцитами.
Различие в содержании малонового диальдегида до и после лечения Ферро–Фольгаммой и Феррум Лек (рис. 5) статистически недостоверно (р>0,05).
Полученные нами данные об отсутствии активации свободноперекисного окисления и оксидативного стресса на фоне применения ПСЖ (в частности, Ферро–Фольгаммы) представляются принципиально новыми и могут иметь важное клиническое значение.
Продолжительность лечения
У женщин, страдающих ЖДА на фоне меноррагий при отсутствии явной гинекологической патологии, как причины меноррагий и невозможности их корригировать, необходима длительная терапия ПЖ внутрь. Целесообразно назначать препараты с высоким содержанием железа, позволяющим осуществлять одно– или двухразовый прием в сутки, что способствует достижению комплайнса пациенток.
Длительность насыщающей терапии ПЖ определяется, с одной стороны, выраженностью дефицита железа и анемического синдрома, а с другой – темпами прироста и сроками нормализации гемоглобина на фоне лечения. В большинстве случаев восстановление показателей гемоглобина до нормальных происходит через 3–4 недели. Следует подчеркнуть, что у многих женщин улучшение самочувствия на фоне лечения ПЖ наблюдается раньше, чем происходит восстановление показателей гемоглобина до нормальных. В связи с этим прием ПЖ становится нерегулярным и иногда прекращается вообще. При этом не происходит полной коррекции уровня гемоглобина и ЖДА остается фактически недолеченной. С учетом данного обстоятельства при оценке эффективности терапии необходимо ориентироваться на лабораторные показатели, т.е. на уровень гемоглобина, а не на субъективные показатели, о чем пациентки должны быть обязательно информированы.
ЖДА беременных требует обязательной коррекции лекарственными ПЖ для приема внутрь. Лечение ПЖ при диагностированной ЖДА должно проводиться до конца беременности. Это имеет принципиальное значение не только для коррекции анемии у беременных и профилактики осложнений в родах, послеродовых инфекций, но главным образом для предупреждения дефицита железа у плода. Фактически назначение препаратов железа беременным является антенатальной профилактикой ЖДА. Назначение препаратов фолиевой кислоты беременным должно быть строго обоснованным с учетом макроцитарного характера анемии, факторов риска дефицита фолиевой кислоты (алкоголизм, прием противосудорожных препаратов, алиментарная недостаточность) или его верификации.
При выборе препарата, содержащего железо, необходимо учитывать несколько факторов. Поскольку из желудочно–кишечного тракта ионизированное железо всасывается только в двухвалентной форме и большое значение в этом процессе играет аскорбиновая кислота, то очень важно ее наличие в препарате. Существенная роль в гемопоэзе принадлежит фолиевой кислоте, усиливающей нуклеиновый обмен. Для нормального обмена фолиевой кислоты необходим цианокобаламин, который является основным фактором при образовании из нее активной формы. Дефицит этих веществ, часто возникающий при анемиях, связанных с кровопотерями, приводит к нарушению синтеза ДНК в кроветворных клетках, тогда как включение этих компонентов в препарат увеличивает активную абсорбцию железа в кишечнике, его дальнейшую утилизацию, а также освобождает дополнительное количество трансферрина и ферритина. Все это значительно увеличивает скорость синтеза гемоглобина и повышает эффективность терапии железодефицитных состояний и железодефицитной анемии. Всем этим требованиям удовлетворяет комплексный антианемический препарат Ферро–Фольгамма, содержащий 100 мг сульфата железа, 5 мг фолиевой кислоты, 10 мкг цианокобаламина и 100 мг аскорбиновой кислоты. Активные компоненты препарата Ферро–Фольгамма находятся в специальной нейтральной оболочке, которая обеспечивает их всасывание главным образом в верхнем отделе тонкой кишки. Отсутствие местного раздражающего действия на слизистую желудка способствует хорошей переносимости препарата со стороны желудочно–кишечного тракта. Ферро–Фольгамма назначается по 1–2 капсулы в сутки. Наилучший эффект дает применение препарата до еды. При анемии легкой формы рекомендован прием 1 капсулы 3 раза в сутки в течение 3–4 недель; при среднетяжелой форме по 1 капсуле 3 раза в сутки в течение 8–12 недель; при тяжелой форме по 1 капсуле 3 раза в сутки в течение 16 недель и более.
Хороший клинический эффект препарата подтвержден данными клинических исследований. Так, для лечения анемии беременных использование Ферро–Фольгаммы по 1 капсуле 2 раза в сутки в течение 6 недель привело к нормализации клинических и лабораторных показателей у всех пациенток [6]. Применение Ферро–Фольгаммы у беременных с анемией и при сочетании с гестозом приводит к улучшению клинического состояния, достоверному повышению гематологических (гемоглобина на 15%, эритроцитов на 10%, гематокрита на 9%) и феррокинетических показателей (сывороточного железа на 32%, ферритина на 53%), уровня фолиевой кислоты на 24% и витамина В12 на 21,7% [7,8].
Нами проводилась оценка эффективности различных ПЖ у больных ЖДА вследствие различных причин (преимущественно на фоне меноррагий). На рисунках 6 и 7 представлены темпы прироста уровня гемоглобина при лечении ПЖ для приема внутрь Ферро–Фольгаммы и Феррум Лек (жевательные таблетки).
Различие между группами статистически достоверно. Различие между группами в темпах прироста гемоглобина отмечалось на 3–й неделе лечения (р<0,05) и было выше у больных на фоне лечения Ферро–Фольгаммой. В среднем темпы прироста гемоглобина составили в группе больных, леченных Ферро–Фольгаммой, 1,4±0,6 и 0,9±0,7 г/л в сутки среди больных, получавших Феррум Лек.
При лечении ЖДА у беременных и больных с сохраняющимися меноррагиями важное значение имеет поддерживающая терапия ПЖ. В большинстве случаев беременные должны получать ПЖ до конца беременности. Что касается больных меноррагиями, которые не могут быть устранены, то после нормализации показателей гемоглобина рекомендуется поддерживающая терапия.
Переносимость препаратов железа
Среди побочных эффектов на фоне применения ПЖ внутрь наиболее часто возникают тошнота, анорексия, металлический вкус во рту, запоры, реже – поносы. Развитие запоров обусловлено, по всей вероятности, связыванием в кишечнике сероводорода, являющегося одним из стимулов кишечной перистальтики. В большинстве случаев современные ПЖ вызывают незначительные побочные явления, не требующие их отмены и перехода на парентеральный путь введения. Чаще побочные эффекты регистрируются при приеме ПСЖ, в то время как препараты ПЖК (гидроксиполимальтозный комплекс) переносятся лучше и имеют в связи с этим определенные преимущества.
У беременных прием ПЖ внутрь может вызывать различные диспептические расстройства, к которым и без того склонны беременные. При этом рекомендуется снижение дозы препарата или прием ПЖ во время еды. Следует, однако, иметь в виду, что всасывание железа лучше при приеме лекарственных препаратов перед едой. Только в случаях сохраняющихся нежелательных эффектов показано назначение ПЖ для парентерального введения.
На фоне лечения парентеральными ПЖ, особенно для внутривенного введения, могут возникать аллергические реакции в виде крапивницы, лихорадка, флебиты, анафилактический шок. Кроме того, при внутримышечном введении ПЖ возможно потемнение кожи в местах инъекций, инфильтраты, абсцессы. Если ПЖ для парентерального введения назначают больным гипохромной анемией, не связанной с дефицитом железа, имеется повышенный риск возникновения тяжелых нарушений из–за «перегрузки» железом различных органов и тканей (печень, поджелудочная железа и др.) с развитием гемосидероза.
Оценка эффективности
и причины неэффективности
лечения препаратами железа
В случаях назначения ПЖ в достаточной дозе на 7–10–й день от начала лечения наблюдается повышение количества ретикулоцитов. Достоверное повышение уровня гемоглобина отмечается через 3–4 нед. от начала лечения. Нормализация показателей гемоглобина обычно происходит в сроки 4–9 нед. Иногда наблюдается резкое скачкообразное повышение гемоглобина. Эти индивидуальные колебания могут быть обусловлены, с одной стороны, выраженностью ЖДА, степенью истощения запасов железа, а с другой – эффективностью назначенного ПЖ (количество содержащегося железа, биодоступность и др.). Имеет также значение некомплаентность больных (нерегулярность приема ПЖ, побочные эффекты).
При отсутствии или недостаточности эффекта от лечения ПЖ следует выяснить причину с целью возможности ее коррекции. Необходима убежденность в правильной трактовке всех клинико–лабораторных признаков и в достоверности синдрома ЖДА. Причиной отсутствия или недостаточной эффективности ПЖ может быть недостаточная суточная доза железа, что обычно возникает при назначении ПЖ с низким содержанием в нем железа и малым количеством принимаемых таблеток. Так, например, при лечении препаратом ферроплекс, в котором содержится всего лишь 10 мг двухвалентного железа, число принимаемых таблеток должно быть не менее 10 в сутки. Такой режим дозирования неудобен для больных, что может объяснять невыполнение ими врачебного назначения. С учетом вышесказанного для обеспечения комплаентности следует назначать ПЖ с высоким содержанием железа (не менее 100 мг). Препараты с низким содержанием железа целесообразно использовать в педиатрической практике.
Одной из причин неэффективности ПЖ при назначении внутрь может быть нарушение всасывания железа, в частности, у больных с невыявленной или недооцененной кишечной патологией. В этих случаях показано назначение парентеральных ПЖ.
В ряде случаев вследствие улучшения самочувствия больные начинают нерегулярно принимать ПЖ или вообще прекращают лечение. В результате этого показатели гемоглобина не достигают нормальных показателей и ЖДА при этом остается фактически недолеченной. С учетом этого длительность насыщающей терапии ПЖ должна определяться сроками достижения нормального уровня гемоглобина, что требует постоянного лабораторного мониторинга.
Отсутствие эффекта от ПЖ может быть связано с неустраненными причинами ЖДА, из которых наиболее клинически значимыми являются скрытые кровопотери из желудочно–кишечного тракта, чаще из кишечника (невыявленная опухоль!). С учетом этого в подобных ситуациях при исключении других возможных причин неэффективности ПЖ необходимо тщательное исследование кишечника (в ряде случаев повторное).
Таким образом, столь распространенные в акушерско–гинекологической практике железодефицитные состояния характеризуются неспецифическими клиническими проявлениями и лабораторными признаками. Необходима ориентировка врача в отношении лабораторных признаков ЖДА, а также основных причин развития данного синдрома. Наряду с устранением причины обязательна патогенетическая терапия ПЖ (ПСЖ и ПЖК), которые должны назначаться преимущественно внутрь. Тактика лечения ПЖ предусматривает выбор пути введения ПЖ с учетом клинической ситуации, оптимального ПЖ с достаточным содержанием в нем железа, оценку эффективности и переносимости препарата, длительность насыщающей и обоснованность поддерживающей терапии. Существенным компонентом ведения беременных и гинекологических больных ЖДА является повышение их образовательного уровня в отношении данной патологии, вовлечение пациентов в контроль за своим состоянием и лабораторными показателями. Своевременная верификация синдрома ЖДА и адекватная патогенетическая терапия ПЖ позволяет корригировать анемический синдром, осуществлять антенатальную профилактику ЖДА и обеспечивать достаточный уровень качества жизни данной категории пациентов.



Литература
1. Ершов В. И. Клиника железодефицитной анемии и ишемической болезни сердца и свободнорадикальные процессы при них // Автореферат дисс. докт., Москва, 1996.,
2. Isler M., Delibas N., Guclu M., Guldekin F., Sutcu R., Bahceci M., Kosar A. Superoxide dismutase and glutathione peroxidase in erytrocytes of patient with iron deficieny anemia: effects of different treatment modalities // Croatian medical journal, 2002, 43(1), p. 16–19.
4. Kurtoglu E., Ugor A., Baltaci A. K. and Undar L. Effect of iron supplementation on oxidative stress and antioxidant status in iron deficiency anemia // Biol Trace Elem Res, 2003, 96 (1–3), p. 117–124.
5. Дворецкий Л. И., Заспа Е. А., Литвицкий П. Ф., Болевич С. Б., Меньшова Н. И. Свободнорадикальные процессы у больных железодефицитной анемией на фоне лечения препаратами железа // Терапевтический архив 2006 г., 78(1): с. 52–57.
6. Петрухин В.А., Гришин В.Л. Лечение анемии беременных с использованием препарата феррофольгамма. // Проблемы репродукции. 2002,6.
7. Коноводова Е.Н., Бурлев В.А., Кравченко Н.Ф., Карибджанов О.К., Мурашко Л.Е., Сопоева Ж.А.Коэффициент насыщения трансферрина железом у беременных Проблемы репродукции.2002;№6,45–47.
8. Мурашко Л.Е. Коноводова Е.Н, Бурлев В.А., Сопоева Ж.А. Объемный транспорт кислорода у беременных с анемией и гестозом при лечении Ферро–Фольгаммой. // РМЖ, , 2002, Том 10 № 7,364–367.












