–Ю—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –Ц–Ф–Р –љ–∞ —В–µ—З–µ–љ–Є–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Њ–±—К—П—Б–љ—П—О—В —В–µ–Љ, —З—В–Њ —А–∞–Ј–≤–Є–≤–∞—О—Й–∞—П—Б—П –≥–Є–њ–Њ–Ї—Б–Є—П –Љ–Њ–ґ–µ—В –≤—Л–Ј–≤–∞—В—М —Б—В—А–µ—Б—Б –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Љ–∞—В–µ—А–Є –Є –њ–ї–Њ–і–∞, —Б—В–Є–Љ—Г–ї–Є—А—Г—П —Б–Є–љ—В–µ–Ј –Ї–Њ—А—В–Є–Ї–Њ—В—А–Њ–њ–Є–љ–—А–Є–ї–Є–Ј–Є–љ–≥––≥–Њ—А–Љ–Њ–љ–∞ (–Ъ–†–У). –Я–Њ–≤—Л—И–µ–љ–љ—Л–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ъ–†–У – –≥–ї–∞–≤–љ—Л–є —Д–∞–Ї—В–Њ—А —А–Є—Б–Ї–∞ –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ—Л—Е —А–Њ–і–Њ–≤, –≥–µ—Б—В–Њ–Ј–∞ –Є –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –Є–Ј–ї–Є—В–Є—П –Њ–Ї–Њ–ї–Њ–њ–ї–Њ–і–љ—Л—Е –≤–Њ–і. –Ъ–†–У —Г—Б–Є–ї–Є–≤–∞–µ—В –≤—Л–±—А–Њ—Б –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –њ–ї–Њ–і–Њ–Љ, —З—В–Њ –Љ–Њ–ґ–µ—В –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М —А–Њ—Б—В –њ–ї–Њ–і–∞. –†–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ —Н—В–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ц–Ф–Р –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ—Л–є —Б—В—А–µ—Б—Б —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –Є —Д–µ—В–Њ–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ [7,11,17].
–Я—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є –∞–љ–µ–Љ–Є–Є –љ–∞—А—Г—И–∞–µ—В—Б—П —Д—Г–љ–Ї—Ж–Є—П –њ–ї–∞—Ж–µ–љ—В—Л, –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –µ–µ —В—А–Њ—Д–Є—З–µ—Б–Ї–Њ–є, –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–є, –≥–Њ—А–Љ–Њ–љ–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–µ–є –Є –≥–∞–Ј–Њ–Њ–±–Љ–µ–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–є, —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –њ–ї–∞—Ж–µ–љ—В–∞—А–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М. –І–∞—Б—В–Њ (—Г 40–50%) –њ—А–Є—Б–Њ–µ–і–Є–љ—П–µ—В—Б—П –≥–µ—Б—В–Њ–Ј; –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ—Л–µ —А–Њ–і—Л –љ–∞—Б—В—Г–њ–∞—О—В —Г 11–42%; —Б–ї–∞–±–Њ—Б—В—М —А–Њ–і–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Г 10–15% —А–Њ–ґ–µ–љ–Є—Ж; –≥–Є–њ–Њ—В–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –≤ —А–Њ–і–∞—Е – —Г 10%; –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤–Њ–є –њ–µ—А–Є–Њ–і –Њ—Б–ї–Њ–ґ–љ—П–µ—В—Б—П –≥–љ–Њ–є–љ–Њ–—Б–µ–њ—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є —Г 12% –Є –≥–Є–њ–Њ–≥–∞–ї–∞–Ї—В–Є–µ–є —Г 38% —А–Њ–і–Є–ї—М–љ–Є—Ж [7,9,10,13].
–§–µ—В–Њ–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М (–§–Я–Э) –њ—А–Є –Ц–Ф–Р –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ —А–µ–Ј–Ї–Є–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –ґ–µ–ї–µ–Ј–∞ –≤ –њ–ї–∞—Ж–µ–љ—В–µ, –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ –Є –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј [12].
–Р.–Я. –Ь–Є–ї–Њ–≤–∞–љ–Њ–≤ —Б—З–Є—В–∞–µ—В, —З—В–Њ –Њ–і–љ–Є–Љ –Є–Ј —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –≤ —А–∞–Ј–≤–Є—В–Є–Є –≥–Є–њ–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є, —Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–є, —В–Ї–∞–љ–µ–≤–Њ–є –Є –≥–µ–Љ–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–Њ–Ї—Б–Є–Є –≤ –њ–ї–∞—Ж–µ–љ—В–µ —П–≤–ї—П–µ—В—Б—П –њ–∞—В–Њ–ї–Њ–≥–Є—П —Б–њ–Є—А–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є–є –Љ–∞—В–Ї–Є [6]. –Я–Њ –Љ–љ–µ–љ–Є—О –У.–Ь. –°–∞–≤–µ–ї—М–µ–≤–Њ–є –Є —Б–Њ–∞–≤—В. (1986 –≥.), –≤ –Њ—Б–љ–Њ–≤–µ –§–Я–Э –ї—О–±–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –ї–µ–ґ–∞—В –љ–∞—А—Г—И–µ–љ–Є—П –њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, –≤–Ї–ї—О—З–∞—П –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—О, –Є –Њ–±–Љ–µ–љ–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —В–µ—Б–љ–Њ —Б–≤—П–Ј–∞–љ—Л –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є –Є –љ–µ—А–µ–і–Ї–Њ –≤–Ј–∞–Є–Љ–Њ–Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л. –Ю–љ–Є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В—Б—П –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –њ–ї–∞—Ж–µ–љ—В–µ, –љ–Њ —В–∞–Ї–ґ–µ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Љ–∞—В–µ—А–Є –Є –њ–ї–Њ–і–∞. –Т –њ–Њ–ї–љ–Њ–є –Љ–µ—А–µ —Н—В–Њ –Њ—В–љ–Њ—Б–Є—В—Б—П –Є –Ї –§–Я–Э, —А–∞–Ј–≤–Є–≤–∞—О—Й–µ–є—Б—П –њ—А–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –Њ—В—П–≥–Њ—Й–µ–љ–љ–Њ–є –Ц–Ф–Р [19].
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Ї—А–Є—В–µ—А–Є—П–Љ–Є –Ц–Ф–Р —П–≤–ї—П—О—В—Б—П –љ–Є–Ј–Ї–Є–є —Ж–≤–µ—В–Њ–≤–Њ–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М, –≥–Є–њ–Њ—Е—А–Њ–Љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞, –њ–Њ–≤—Л—И–µ–љ–Є–µ –Њ–±—Й–µ–є –ґ–µ–ї–µ–Ј–Њ—Б–≤—П–Ј—Л–≤–∞—О—Й–µ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –≥–Є–њ–Њ—Б–Є–і–µ—А–Њ–Ј–∞. –Т–∞–ґ–љ–µ–є—И–Є–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ –∞–љ–µ–Љ–Є–є —П–≤–ї—П–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ —Б–ї–µ–і—Г–µ—В –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞—В—М –∞–љ–µ–Љ–Є—О. –≠—В–∞ –≤–µ–ї–Є—З–Є–љ–∞ –љ–µ–Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ –Љ–µ–љ—П–ї–∞—Б—М –≤ —Б—В–Њ—А–Њ–љ—Г –њ–Њ–≤—Л—И–µ–љ–Є—П –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П: 100, 110 –≥/–ї (–Т–Ю–Ч, 1971). –Ы–µ–≥–Ї–∞—П (I) —Б—В–µ–њ–µ–љ—М –∞–љ–µ–Љ–Є–Є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –і–Њ 110–90 –≥/–ї; —Б—А–µ–і–љ—П—П (II) —Б—В–µ–њ–µ–љ—М – –Њ—В 89 –і–Њ 70 –≥/–ї; —В—П–ґ–µ–ї–∞—П (III) – 70 –Є –Љ–µ–љ–µ–µ –≥/–ї [2, 4].
–Ы–µ—З–µ–љ–Є–µ –Ц–Ф–Р –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В, –њ–Њ–Љ–Є–Љ–Њ —Г—Б—В—А–∞–љ–µ–љ–Є—П –Њ—Б–љ–Њ–≤–љ–Њ–є –њ—А–Є—З–Є–љ—Л —Н—В–Њ–≥–Њ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ґ–µ–ї–µ–Ј–∞. –Ш–і–µ–∞–ї—М–љ—Л–є –њ—А–Њ—В–Є–≤–Њ–∞–љ–µ–Љ–Є—З–µ—Б–Ї–Є–є –њ—А–µ–њ–∞—А–∞—В –і–Њ–ї–ґ–µ–љ —Б–Њ–і–µ—А–ґ–∞—В—М –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –ґ–µ–ї–µ–Ј–∞, –Њ–Ї–∞–Ј—Л–≤–∞—В—М –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л, –Є–Љ–µ—В—М –њ—А–Њ—Б—В—Г—О —Б—Е–µ–Љ—Г –њ—А–Є–Љ–µ–љ–µ–љ–Є—П, –љ–∞–Є–ї—Г—З—И–µ–µ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М/—Ж–µ–љ–∞. –Ю–і–љ–∞–Ї–Њ –Љ–љ–Њ–≥–Є–µ –ґ–µ–ї–µ–Ј–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л –Њ–±–ї–∞–і–∞—О—В —А—П–і–Њ–Љ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–≤, —Б–Њ–Ј–і–∞—О—Й–Є—Е –њ—А–Њ–±–ї–µ–Љ—Л –њ—А–Є –Є—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є: –љ–µ–њ—А–Є—П—В–љ—Л–µ –Њ—А–≥–∞–љ–Њ–ї–µ–њ—В–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞, –љ–Є–Ј–Ї–∞—П –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М, —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —А–∞–Ј–і—А–∞–ґ–∞—В—М —Б–ї–Є–Ј–Є—Б—В—Г—О –Њ–±–Њ–ї–Њ—З–Ї—Г –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, —З—В–Њ —З–∞—Б—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –і–Є—Б–њ–µ–њ—В–Є—З–µ—Б–Ї–Є–µ —П–≤–ї–µ–љ–Є—П. –° —Н—В–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Њ–±–Њ—Б–љ–Њ–≤–∞–љ –Є–љ—В–µ—А–µ—Б –Ї –њ—А–Њ–±–ї–µ–Љ–µ –њ–Њ–Є—Б–Ї–∞ –љ–Њ–≤—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П –Ц–Ф–Р, —Б–њ–Њ—Б–Њ–±–љ—Л—Е –≤–ї–Є—П—В—М –љ–µ —В–Њ–ї—М–Ї–Њ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ–є, –љ–Њ –Є –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—В—М –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П —Г –њ–ї–Њ–і–∞, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –§–Я–Ъ [1,7,13,14].
–Ы–µ—З–µ–љ–Є–µ –Ц–Ф–Р —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–Љ. –Т –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г–і–µ–ї–Є—В—М –≤–љ–Є–Љ–∞–љ–Є–µ –і–Є–µ—В–µ. –Ю–і–љ–∞–Ї–Њ –Њ—Б–љ–Њ–≤–љ–Њ–є –≤–Є–і —В–µ—А–∞–њ–Є–Є –Ц–Ф–Р —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е – —Н—В–Њ –њ—А–µ–њ–∞—А–∞—В—Л –ґ–µ–ї–µ–Ј–∞ [1,9,18]. –С–Њ–ї—М—И–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Є–љ—В–µ—А–µ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –°–Њ—А–±–Є—Д–µ—А –Ф—Г—А—Г–ї–µ—Б —Б –≤—Л—Б–Њ–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ Fe2+ (100 –Љ–≥) –Є –∞—Б–Ї–Њ—А–±–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (60 –Љ–≥), –Ї–Њ—В–Њ—А–∞—П —Б–Њ–Ј–і–∞–µ—В –±–Њ–ї–µ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —Г—Б–ї–Њ–≤–Є—П –і–ї—П –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ –Є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –µ–≥–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї—Г—О –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М.
–¶–µ–ї—М—О –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —П–≤–Є–ї–∞—Б—М –Њ—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –ґ–µ–ї–µ–Ј–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –§–Я–Э –Є –њ–µ—А–Є–љ–∞—В–∞–ї—М–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –∞–љ–µ–Љ–Є–µ–є.
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Я–Њ–і –љ–∞—И–Є–Љ –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ –љ–∞—Е–Њ–і–Є–ї–Є—Б—М 115 –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ —Б –Ц–Ф–Р –≤–Њ II –Є III —В—А–Є–Љ–µ—Б—В—А–∞—Е –≥–µ—Б—В–∞—Ж–Є–Є. –С–µ—А–µ–Љ–µ–љ–љ—Л–µ –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ –і–≤–µ –≥—А—Г–њ–њ—Л. –Т 1–—О –≥—А—Г–њ–њ—Г –≤–Њ—И–ї–Є 75 –±–µ—А–µ–Љ–µ–љ–љ—Л—Е, —Г –Ї–Њ—В–Њ—А—Л—Е –∞–љ–µ–Љ–Є—П –±—Л–ї–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–∞ –≤–Њ II —В—А–Є–Љ–µ—Б—В—А–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є; 2–—О –≥—А—Г–њ–њ—Г (–≥—А—Г–њ–њ–∞ —Б—А–∞–≤–љ–µ–љ–Є—П) —Б–Њ—Б—В–∞–≤–Є–ї–Є 40 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ—Б—В—Г–њ–Є–ї–Є –≤ –Є–љ—Б—В–Є—В—Г—В –њ–µ—А–µ–і —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ–Є–µ–Љ –≤ 35–40 –љ–µ–і –≥–µ—Б—В–∞—Ж–Є–Є.
–Т—Б–µ–Љ –±–µ—А–µ–Љ–µ–љ–љ—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —В–µ—А–∞–њ–Є—П –Ц–Ф–Р –ґ–µ–ї–µ–Ј–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –°–Њ—А–±–Є—Д–µ—А–Њ–Љ –Ф—Г—А—Г–ї–µ—Б–Њ–Љ –≤ –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–Љ —А–µ–ґ–Є–Љ–µ —Б–Њ II —В—А–Є–Љ–µ—Б—В—А–∞ (1 —В–∞–±–ї–µ—В–Ї–∞ –≤ —Б—Г—В–Ї–Є), –∞ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е 2––є –≥—А—Г–њ–њ—Л —Н—В–Њ—В –њ—А–µ–њ–∞—А–∞—В –±—Л–ї –њ—А–Є–Љ–µ–љ–µ–љ –≤ 36–38 –љ–µ–і (–њ–Њ 1 —В–∞–±–ї–µ—В–Ї–µ 2 —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є).
–Т–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –љ–∞—Е–Њ–і–Є–ї—Б—П –≤ –њ—А–µ–і–µ–ї–∞—Е –Њ—В 22 –і–Њ 37 –ї–µ—В. –£ 37 (49,6%) –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 1––є –≥—А—Г–њ–њ—Л –Є —Г 21 (52,5%) 2––є –≥—А—Г–њ–њ—Л –њ—А–µ–і—Б—В–Њ—П–ї–Є –њ–µ—А–≤—Л–µ —А–Њ–і—Л, —Г 38 (50,4%) –Є 19 (47,5%) – –њ–Њ–≤—В–Њ—А–љ—Л–µ. –Ш–Ј –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –∞–Ї—Г—И–µ—А-—Б–Ї–Њ––≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –Њ–±–µ–Є—Е –≥—А—Г–њ–њ —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞ —Г 17 (22%) –Є 16 (40%) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, —Б–∞–Љ–Њ–њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ—Л–µ –≤—Л–Ї–Є–і—Л—И–Є – —Г 18 (24%) –Є 10 (25%). –Я–µ—А–Є–љ–∞—В–∞–ї—М–љ—Л–µ –њ–Њ—В–µ—А–Є –Є–Љ–µ–ї–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ 5 (7%) –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 1––є –≥—А—Г–њ–њ—Л –Є 6 (15%) –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 2––є –≥—А—Г–њ–њ—Л.
–£ 88,6% –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –Њ–±–µ–Є—Е –≥—А—Г–њ–њ –Є–Љ–µ–ї–Є—Б—М —А–∞–Ј–ї–Є—З–љ—Л–µ —Н–Ї—Б—В—А–∞–≥–µ–љ–Є—В–∞–ї—М–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П: –њ–∞—В–Њ–ї–Њ–≥–Є—П —Б–µ—А–і–µ—З-–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л —Г 12 (16%) –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –≤ 1––є –≥—А—Г–њ–њ–µ, —Г 6 (15%) – –≤–Њ 2––є; —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є —В–Њ–љ–Ј–Є–ї–ї–Є—В – —Г 12 (16%) –Є —Г 7 (17,5%) –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ; —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –±—А–Њ–љ—Е–Њ–ї–µ–≥–Њ—З–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П – —Г 5 (6,6%) –Є 3 (7,5%); —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В 1 —В–Є–њ–∞ – —Г 8 (11%) –Є 9 (22,5%); –њ–∞—В–Њ–ї–Њ–≥–Є—П —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л – —Г 5 (6,6%) –Є 4 (10,0%) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ.
–Я–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –∞–Ї—Г—И–µ—А—Б–Ї–Њ––≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞ —Б–Њ–Ј–і–∞–≤–∞–ї–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є —Д–Њ–љ –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –≤—Л–Ј—Л–≤–∞—П –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П –≤ —В–µ—З–µ–љ–Є–Є –≥–µ—Б—В–∞—Ж–Є–Є.
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –∞–љ–µ–Љ–Є–Є –Њ—Б–љ–Њ–≤—Л–≤–∞–ї–∞—Б—М –љ–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –Є —Ж–≤–µ—В–Њ–≤–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Ї—А–Њ–≤–Є.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–∞—В–Њ—З–љ–Њ––њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ––њ–ї–Њ–і–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –љ–∞ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–Љ –њ—А–Є–±–Њ—А–µ Voluson–730, –Њ—Б–љ–∞—Й–µ–љ–љ–Њ–Љ —Б–њ–µ—Ж–Є–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ –і–∞—В—З–Є–Ї–Њ–Љ (RAB 4–8p), –њ—Г—В–µ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Ж–≤–µ—В–Њ–≤–Њ–≥–Њ –і–Њ–њ–њ–ї–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ –Ї–∞—А—В–Є—А–Њ–≤–∞–љ–Є—П –Є –Є–Љ–њ—Г–ї—М—Б–љ–Њ–є –і–Њ–њ–њ–ї–µ—А–Њ–Љ–µ—В—А–Є–Є –∞—А—В–µ—А–Є–Є –њ—Г–њ–Њ–≤–Є–љ—Л, –≥—А—Г–і–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –∞–Њ—А—В—Л –њ–ї–Њ–і–∞, —Б—А–µ–і–љ–µ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є –њ–ї–Њ–і–∞ –Є —Б–Њ—Б—Г–і–Њ–≤ –њ–ї–∞—Ж–µ–љ—В—Л. –Ъ–∞—З–µ—Б—В–≤–µ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –Ї—А–Є–≤—Л—Е —Б–Ї–Њ—А–Њ—Б—В–µ–є –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤–Ї–ї—О—З–∞–ї –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Б–Є—Б—В–Њ–ї–Њ––і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–љ–Њ—И–µ–љ–Є—П (–°/–Ф) –≤ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е —Б–Њ—Б—Г–і–∞—Е (–љ–Њ—А–Љ–∞—В–Є–≤–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –°/–Ф –≤ –∞–Њ—А—В–µ –і–Њ 5,6, –≤ –∞—А—В–µ—А–Є–Є –њ—Г–њ–Њ–≤–Є–љ—Л –і–Њ 2,8, –≤ —Б–њ–Є—А–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є—П—Е 1,60 – 1,80, —Б—А–µ–і–љ–µ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є 3,5–5,0) [10,11,15]. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ —Б–ї—Г–ґ–Є—В –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ–Њ–є —Ж–µ–љ—В—А–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–ї–Њ–і–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П –њ—А–Є –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–є –≥–Є–њ–Њ–Ї—Б–Є–Є –≤ —Г—Б–ї–Њ–≤–Є—П—Е —Б–љ–Є–ґ–µ–љ–љ–Њ–є –њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–є –њ–µ—А—Д—Г–Ј–Є–Є. –Я–Њ –і–∞–љ–љ—Л–Љ D. Arduini –Є —Б–Њ–∞–≤—В. [16], –і–Њ–њ–њ–ї–µ—А–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ —Г –њ–ї–Њ–і–Њ–≤ —Б –Ј–∞–і–µ—А–ґ–Ї–Њ–є –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–≥–Њ —А–Њ—Б—В–∞ (–Ч–Т–£–†) –Є –∞–љ–µ–Љ–Є–µ–є –Є–Љ–µ–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –њ—Г–ї—М—Б–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Є–љ–і–µ–Ї—Б–∞ –≤ —Б—А–µ–і–љ–µ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –љ–∞—Е–Њ–і—П—В, —З—В–Њ –њ—Г–ї—М—Б–∞—Ж–Є–Њ–љ–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Б—А–µ–і–љ–µ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є —П–≤–ї—П—О—В—Б—П –љ–∞–Є–ї—Г—З—И–Є–Љ —В–µ—Б—В–Њ–Љ –њ—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є —Н—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –Я—А–Є –≥–Є–њ–Њ–Ї—Б–Є–Є –њ–ї–Њ–і–∞ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї—Г –≤ –Њ–±—Й–µ–є —Б–Њ–љ–љ–Њ–є –∞—А—В–µ—А–Є–Є –Є —Б—А–µ–і–љ–µ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П, –∞ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ –≤ –∞–Њ—А—В–µ –Є –њ—Г–њ–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П (—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Љ–µ—В–Њ–і–∞ 89%, —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М 94%).
–Я—А–Є –≤–Є–Ј—Г–∞–ї—М–љ–Њ–є –Њ—Ж–µ–љ–Ї–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ 3D––Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤—Л–±—А–∞–љ–љ–Њ–є –Ј–Њ–љ—Л –њ–ї–∞—Ж–µ–љ—В—Л –Њ–±—А–∞—Й–∞–ї–Є –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ —Е–∞—А–∞–Ї—В–µ—А —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞, –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є—О —Б–Њ—Б—Г–і–Њ–≤ –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –Њ–±–ї–∞—Б—В–Є. –Я—А–Є –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–µ –њ–ї–∞—Ж–µ–љ—В–Њ–≥—А–∞–Љ–Љ —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є —Б–ї–µ–і—Г—О—Й–Є–µ –њ–∞—А–∞–Љ–µ—В—А—Л: VI – –Є–љ–і–µ–Ї—Б –≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є, FI – –Є–љ–і–µ–Ї—Б –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞. –Э–Њ—А–Љ–∞—В–Є–≤–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Љ–∞—В–Њ—З–љ–Њ––њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞, —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л–µ –≤ –Њ—В–і–µ–ї–µ–љ–Є–Є –њ–µ—А–Є–љ–∞—В–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ь–Ю–Э–Ш–Ш–Р–У: —Ж–µ–љ—В—А–∞–ї—М–љ–∞—П –Ј–Њ–љ–∞ – VI 4,0–8,1; FI 42,0–45,0; –њ–∞—А–∞—Ж–µ–љ—В—А–∞–ї—М–љ–∞—П – VI 3,8–7,6; FI 40,5–43,7; –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–∞—П – VI 2,8–5,9; FI 37,5–42,1 [12].
–Ф–ї—П –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –§–Я–Э –њ—А–Њ–≤–µ–і–µ–љ–Њ –Є–Ј—Г—З–µ–љ–Є–µ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–ї–∞—Ж–µ–љ—В –њ–Њ—Б–ї–µ —А–Њ–і–Њ–≤.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
–†–∞–Ј–ї–Є—З–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –∞–љ–µ–Љ–Є–Є (–±–ї–µ–і–љ–Њ—Б—В—М –Ї–Њ–ґ–љ—Л—Е –њ–Њ–Ї—А–Њ–≤–Њ–≤ –Є –≤–Є–і–Є–Љ—Л—Е —Б–ї–Є–Ј–Є—Б—В—Л—Е –Њ–±–Њ–ї–Њ—З–µ–Ї, —В–∞—Е–Є–Ї–∞—А–і–Є—П, —Б–ї–∞–±–Њ—Б—В—М, —Б–љ–Є–ґ–µ–љ–Є–µ —А–∞–±–Њ—В–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є, –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ, –њ–∞—А–µ—Б—В–µ–Ј–Є–Є –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є) –Є–Љ–µ–ї–Є—Б—М —Г 12 (16,0 %) –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 1––є –≥—А—Г–њ–њ—Л –Є —Г 20 (50%) – 2––є –≥—А—Г–њ–њ—Л.
–Ґ–µ—З–µ–љ–Є–µ –і–∞–љ–љ–Њ–є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –±—Л–ї–Њ –Њ—В—П–≥–Њ—Й–µ–љ–Њ —А–∞–љ–љ–Є–Љ —В–Њ–Ї—Б–Є–Ї–Њ–Ј–Њ–Љ —Г 36 (48%) –Є 27 (67,5%) –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 1––є –Є 2––є –≥—А—Г–њ–њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, —Г–≥—А–Њ–Ј–Њ–є –њ—А–µ—А—Л–≤–∞–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –≤ I —В—А–Є–Љ–µ—Б—В—А–µ – —Г 18 (24,0%) –Є 26 (65,0%). II —В—А–Є–Љ–µ—Б—В—А –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –±—Л–ї –Њ—Б–ї–Њ–ґ–љ–µ–љ —Г–≥—А–Њ–Ј–Њ–є –њ—А–µ—А—Л–≤–∞–љ–Є—П —Г 8 (10,6%) –ґ–µ–љ—Й–Є–љ 1––є –≥—А—Г–њ–њ—Л –Є —Г 18 (45,0%) – 2––є –≥—А—Г–њ–њ—Л, –≤–Њ–і—П–љ–Ї–Њ–є –±–µ—А–µ–Љ–µ–љ–љ—Л—Е – —Г 5 (6,6%) –Є 11 (27,5%) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Т III —В—А–Є–Љ–µ—Б—В—А–µ –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є –≥–µ—Б—В–∞—Ж–Є–Є –±—Л–ї–Є –≥–µ—Б—В–Њ–Ј –ї–µ–≥–Ї–Њ–є –Є —Б—А–µ–і–љ–µ–є —Б—В–µ–њ–µ–љ–µ–є —В—П–ґ–µ—Б—В–Є – —Г 6 (8,0%) –Є 9 (22,5%) –±–µ—А–µ–Љ–µ–љ–љ—Л—Е 1––є –Є 2––є –≥—А—Г–њ–њ –љ–∞–±–ї—О–і–µ–љ–Є—П, —Г–≥—А–Њ–Ј–∞ –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ—Л—Е —А–Њ–і–Њ–≤ – —Г 5 (6,6%) –Є 8 (20%), –њ—А–Є—З–µ–Љ —Г 3 –±–µ—А–µ–Љ–µ–љ–љ—Л—Е 1––є –≥—А—Г–њ–њ—Л –Є —Г 7 – 2––є, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ—А–Њ–≤–Њ–і–Є–Љ—Г—О —В–µ—А–∞–њ–Є—О, –њ—А–Њ–Є–Ј–Њ—И–ї–Є –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ—Л–µ —А–Њ–і—Л –≤ 35–36 –љ–µ–і –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Ф–Є—Д—Д—Г–Ј–љ–Њ–µ —Г—В–Њ–ї—Й–µ–љ–Є–µ –њ–ї–∞—Ж–µ–љ—В—Л –±—Л–ї–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–Њ —Г 4 (5,3%) –±–µ—А–µ–Љ–µ–љ–љ—Л—Е 1––є –≥—А—Г–њ–њ—Л –Є 5 (12,5%) – 2––є, –§–Я–Э – —Г 16 (21,3%) –Є 23 (57,5%), –Ч–Т–£–† – —Г 15 (20,6 %) –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 1––є –≥—А—Г–њ–њ—Л –Є —Г 26 (65,0%) –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П, –Љ–∞–ї–Њ–≤–Њ–і–Є–µ – —Г 12 (16,0%) –Є 7 (17,5%), –Љ–љ–Њ–≥–Њ–≤–Њ–і–Є–µ – —Г 4 (5,3%) –Є 5 (12,5%) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Ю–±—А–∞—Й–∞–µ—В –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ, —З—В–Њ –љ–∞–Є–±–Њ–ї–µ–µ —В—П–ґ–µ–ї—Л–µ –≥–µ—Б—В–∞—Ж–Є–Њ–љ–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П – –§–Я–Э –Є –Ч–Т–£–† –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –∞–љ–µ–Љ–Є–µ–є II –Є III —Б—В–µ–њ–µ–љ–Є (—В–∞–±–ї. 1). –£ —Н—В–Є—Е –ґ–µ –ґ–µ–љ—Й–Є–љ –Њ—В–Љ–µ—З–µ–љ—Л –Є –љ–∞–Є–±–Њ–ї–µ–µ —Б–µ—А—М–µ–Ј–љ—Л–µ —Н–Ї—Б—В—А–∞–≥–µ–љ–Є—В–∞–ї—М–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (—Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В, –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П, –±—А–Њ–љ—Е–Њ–ї–µ–≥–Њ—З–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П).
–†–Њ–і—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –≥—А—Г–њ–њ—Л —Б—А–∞–≤–љ–µ–љ–Є—П –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —З–∞—Й–µ –Њ—Б–ї–Њ–ґ–љ—П–ї–Є—Б—М –љ–µ—Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –Є–Ј–ї–Є—В–Є–µ–Љ –≤–Њ–і, –∞–љ–Њ–Љ–∞–ї–Є—П–Љ–Є —А–Њ–і–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є; –њ–Њ—Б–ї–µ–і–Њ–≤—Л–є –Є —А–∞–љ–љ–Є–є –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤–Њ–є –њ–µ—А–Є–Њ–і—Л – –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П–Љ–Є. –Ґ–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ –±—Л–ї–Њ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ.
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ —З–∞—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П—Е —В–µ—З–µ–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, —А–Њ–і–Њ–≤ –Є –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 2––є –≥—А—Г–њ–њ—Л (p<0,05). –Ч–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–µ–ґ–µ –≥–µ—Б—В–∞—Ж–Є–Њ–љ–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –∞–љ–µ–Љ–Є–µ–є –ї–µ–≥–Ї–Њ–є —Б—В–µ–њ–µ–љ–Є. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, —Г –љ–Є—Е –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–≥–Њ —Б—В—А–∞–і–∞–љ–Є—П –њ–ї–Њ–і–∞. –≠—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —В–Њ–Љ, —З—В–Њ —З–∞—Б—В–Њ—В–∞ –Є —В—П–ґ–µ—Б—В—М –≥–µ—Б—В–∞—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ї–Њ—А—А–µ–ї–Є—А—Г—О—В —Б–Њ —Б—В–µ–њ–µ–љ—М—О —В—П–ґ–µ—Б—В–Є –∞–љ–µ–Љ–Є–Є. –Т—Б–µ–Љ –±–µ—А–µ–Љ–µ–љ–љ—Л–Љ –њ—А–Њ–≤–µ–і–µ–љ–∞ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–∞—П —В–µ—А–∞–њ–Є—П –≥–µ—Б—В–∞—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Є–ї–Є –ї–µ—З–µ–љ–Є–µ –§–Я–Э (–∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–љ–∞—П, –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ–∞—П —В–µ—А–∞–њ–Є—П, –≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А—Л).
–Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ї—А–∞—Б–љ–Њ–є –Ї—А–Њ–≤–Є —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –Ц–Ф–Р –і–Њ –Є –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1. –Я—А–Є—А–Њ—Б—В —Б—А–µ–і–љ–µ–≥–Њ —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –≤ 1––є –≥—А—Г–њ–њ–µ –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –Є—Б—Е–Њ–і–љ–Њ–Љ—Г —Б–Њ—Б—В–∞–≤–Є–ї 23,2 –≥/–ї, —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ – 11,6 –Љ–Ї–Љ–Њ–ї—М/–ї, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤–Њ 2––є –≥—А—Г–њ–њ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Є –≤ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П—Е –Ї—А–∞—Б–љ–Њ–є –Ї—А–Њ–≤–Є –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ –Є –њ—А–Є—А–Њ—Б—В —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ —Б–Њ—Б—В–∞–≤–Є–ї 5 –≥/–ї, –∞ —Г—А–Њ–≤–µ–љ—М —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –Њ—Б—В–∞–≤–∞–ї—Б—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–∞ –Є—Б—Е–Њ–і–љ–Њ–Љ —Г—А–Њ–≤–љ–µ.
–Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Њ–±—К–µ–Љ–љ–Њ–≥–Њ –Љ–∞—В–Њ—З–љ–Њ––њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –Њ–±–µ–Є—Е –≥—А—Г–њ–њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 2. –Э–∞—И–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–Є –Њ —Б–љ–Є–ґ–µ–љ–Є–Є –≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –њ–ї–∞—Ж–µ–љ—В—Л (–≥–Є–њ–Њ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є—П) —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 2––є –≥—А—Г–њ–њ—Л, –љ–Њ –≤ 1––є –≥—А—Г–њ–њ–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Б–љ–Є–ґ–µ–љ–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–Є—Б—М –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –Ј–Њ–љ–∞—Е, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤–Њ 2––є –≥—А—Г–њ–њ–µ –Њ–љ–Є –±—Л–ї–Є –љ–Є–Ј–Ї–Є–Љ–Є –≤–Њ –≤—Б–µ—Е –Ј–Њ–љ–∞—Е, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–ї–Њ—Б—М —Б–Њ—Б—Г–і–Є—Б—В—Л–Љ —Б–њ–∞–Ј–Љ–Њ–Љ –Є –љ–∞—З–Є–љ–∞—О—Й–Є–Љ–Є—Б—П —А–µ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є –≤ –Љ–µ–ґ–≤–Њ—А—Б–Є–љ—З–∞—В–Њ–Љ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Ї–∞–Ї 1––є, —В–∞–Ї –Є 2––є –≥—А—Г–њ–њ—Л –љ–∞—А—Г—И–µ–љ–Є—П –њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї–Є —Б –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –Љ–∞—В–µ—А–Є–љ—Б–Ї–Њ–є –Є –њ–ї–Њ–і–Њ–≤–Њ–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, —З—В–Њ –≤—Л—А–∞–ґ–∞–ї–Њ—Б—М –≤ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–Љ –њ–Њ–≤—Л—И–µ–љ–Є–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –≤ —Б–њ–Є—А–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є—П—Е, –≤ —Б–Њ—Б—Г–і–∞—Е –њ—Г–њ–Њ–≤–Є–љ—Л –Є –∞–Њ—А—В–µ, –∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –°/–Ф –≤ —Б–њ–Є—А–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є—П—Е –њ—А–Є–±–ї–Є–ґ–∞–ї–Є—Б—М –Ї –ї–Є–љ–µ–є–љ–Њ–Љ—Г –≤–Є–і—Г (—В–∞–±–ї. 3). –Т–Њ 2––є –≥—А—Г–њ–њ–µ –Њ—В–Љ–µ—З–µ–љ–∞ —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –±–Њ–ї—М—И–µ–Љ—Г –њ–Њ–≤—Л—И–µ–љ–Є—О –°/–Ф. –Я—А–Є —Н—В–Њ–Љ –°/–Ф –≤ —Б—А–µ–і–љ–µ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є –њ–ї–Њ–і–∞ –±—Л–ї–Њ –њ–Њ–≤—Л—И–µ–љ–Њ —В–Њ–ї—М–Ї–Њ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е 2––є –≥—А—Г–њ–њ—Л. –Ы–Є—И—М —Г –Њ–і–љ–Њ–є –њ–∞—Ж–Є–µ–љ—В–Ї–Є 2––є –≥—А—Г–њ–њ—Л —Б –∞–љ–µ–Љ–Є–µ–є —В—П–ґ–µ–ї–Њ–є —Б—В–µ–њ–µ–љ–Є (Hb 68 –≥/–ї) –њ—А–Є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї—А–Њ–≤–Њ—В–Њ–Ї—Г –≤ –∞—А—В–µ—А–Є–Є –њ—Г–њ–Њ–≤–Є–љ—Л –Є –∞–Њ—А—В–µ –њ–ї–Њ–і–∞ –≤ —Б—А–µ–і–љ–µ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є –Њ—В–Љ–µ—З–µ–љ–Њ –µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ. –†–µ–±–µ–љ–Њ–Ї —А–Њ–і–Є–ї—Б—П —Б –∞–љ–µ–Љ–Є–µ–є —В—П–ґ–µ–ї–Њ–є —Б—В–µ–њ–µ–љ–Є (Hb 112 –≥/–ї). –Я—А–Є –≤–Ї–ї—О—З–µ–љ–Є–Є –≤ —В–µ—А–∞–њ–Є—О –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л—Е –љ–∞ —Г–ї—Г—З—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –§–Я–Ъ, –∞ —В–∞–Ї–ґ–µ –ґ–µ–ї–µ–Ј–Њ—Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞, –Њ—В–Љ–µ—З–µ–љ–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –≤ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П—Е –Њ–±—К–µ–Љ–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Њ–±–µ–Є—Е –≥—А—Г–њ–њ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ–Є –і–∞–љ–љ—Л–Љ–Є, –Њ–і–љ–∞–Ї–Њ —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е 2––є –≥—А—Г–њ–њ—Л –Њ–љ–Є –Њ—Б—В–∞–≤–∞–ї–Є—Б—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–Є–ґ–µ, —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 1––є –≥—А—Г–њ–њ—Л –Є –љ–Њ—А–Љ–∞—В–Є–≤–љ—Л—Е (—В–∞–±–ї. 4).
–Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –°/–Ф –њ—А–Є –і–Њ–њ–њ–ї–µ—А–Њ–Љ–µ—В—А–Є–Є —Б–Њ—Б—Г–і–Њ–≤ –Љ–∞—В–µ—А–Є –Є –њ–ї–Њ–і–∞ –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –≤ 1––є –≥—А—Г–њ–њ–µ –њ—А–Є–±–ї–Є–ґ–∞–ї–Є—Б—М –Ї –љ–Њ—А–Љ–∞—В–Є–≤–љ—Л–Љ. –Т–Њ 2––є –≥—А—Г–њ–њ–µ –°/–Ф –≤ –∞—А—В–µ—А–Є–Є –њ—Г–њ–Њ–≤–Є–љ—Л –Є –∞–Њ—А—В–µ –њ–ї–Њ–і–∞ –Є–Љ–µ–ї–Њ —В–µ–љ–і–µ–љ—Ж–Є—О –Ї –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ —Б–њ–Є—А–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є—П—Е –Є —Б—А–µ–і–љ–µ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є –њ–ї–Њ–і–∞ —Б–Њ—Е—А–∞–љ—П–ї–∞—Б—М –њ–Њ–≤—Л—И–µ–љ–љ–∞—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М, —З—В–Њ, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, —Б–≤—П–Ј–∞–љ–Њ —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ –≤ —Н—В—Г –≥—А—Г–њ–њ—Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –∞–љ–µ–Љ–Є–µ–є —Б—А–µ–і–љ–µ–є –Є —В—П–ґ–µ–ї–Њ–є —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
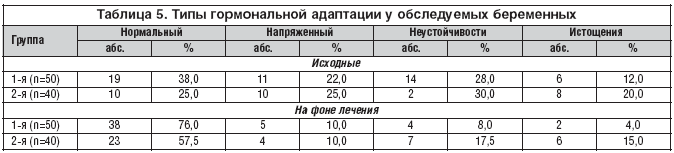
–Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –њ–ї–∞—Ж–µ–љ—В—Л —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –∞–љ–µ–Љ–Є–µ–є –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ —В–Њ–ї—М–Ї–Њ —Г 38% –ґ–µ–љ—Й–Є–љ 1––є –≥—А—Г–њ–њ—Л –Є 25% 2––є –Њ–љ–∞ –±—Л–ї–∞ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є. –£ 22,0% –Є 25,0% –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –Њ–љ–∞ –±—Л–ї–∞ –љ–∞–њ—А—П–ґ–µ–љ–љ–Њ–є, –∞ —Г 12% –Є 20% –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 1––є –Є 2––є –≥—А—Г–њ–њ –Њ—В–Љ–µ—З–µ–љ–Њ –Є—Б—В–Њ—Й–µ–љ–Є–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –њ–ї–∞—Ж–µ–љ—В—Л (—В–∞–±–ї. 5).
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Њ—З–µ–љ—М —Б–ї–Њ–ґ–љ–Њ –і–Њ—Б—В–Є—З—М –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –§–Я–Э –њ—А–Є –Є—Б—В–Њ—Й–µ–љ–Є–Є —Д—Г–љ–Ї—Ж–Є–Є –§–Я–Ъ. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї–Є –љ–∞—И–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –Њ—В –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –Є—Б—В–Њ—Й–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Є –§–Я–Ъ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ —Б —А–∞–љ–љ–Є–Љ –љ–∞—З–∞–ї–Њ–Љ –ї–µ—З–µ–љ–Є—П –∞–љ–µ–Љ–Є–Є –Є –§–Я–Э —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 1––є –≥—А—Г–њ–њ—Л.
–Т 1––є –≥—А—Г–њ–њ–µ —З–µ—А–µ–Ј –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–µ —А–Њ–і–Њ–≤—Л–µ –њ—Г—В–Є –±—Л–ї–Є —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ—Л 63 (84%) –±–µ—А–µ–Љ–µ–љ–љ—Л–µ, –њ–ї–∞–љ–Њ–≤–Њ–µ –Ї–µ—Б–∞—А–µ–≤–Њ —Б–µ—З–µ–љ–Є–µ –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–Њ 10 (13,3%) –њ–∞—Ж–Є–µ–љ—В–Ї–∞–Љ. –Я–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –Ї –њ–ї–∞–љ–Њ–≤–Њ–Љ—Г –Ї–µ—Б–∞—А–µ–≤—Г —Б–µ—З–µ–љ–Є—О —П–≤–Є–ї–Є—Б—М –њ—А–µ–і–ї–µ–ґ–∞–љ–Є–µ –њ–ї–∞—Ж–µ–љ—В—Л – –≤ –Њ–і–љ–Њ–Љ —Б–ї—Г—З–∞–µ, —В—П–ґ–µ–ї–Њ–µ —В–µ—З–µ–љ–Є–µ —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞ – –≤ 3 –љ–∞–±–ї—О–і–µ–љ–Є—П—Е, –∞–±—Б–Њ–ї—О—В–љ–∞—П –љ–µ–≥–Њ—В–Њ–≤–љ–Њ—Б—В—М –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Ї —А–Њ–і–∞–Љ –Є –њ–Њ–ґ–Є–ї–Њ–є –≤–Њ–Ј—А–∞—Б—В – —Г 4 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї; –њ–Њ –Њ–і–љ–Њ–Љ—Г —Б–ї—Г—З–∞—О —Б–Њ—Б—В–∞–≤–Є–ї —А—Г–±–µ—Ж –љ–∞ –Љ–∞—В–Ї–µ –њ–Њ—Б–ї–µ –Ї–µ—Б–∞—А–µ–≤–∞ —Б–µ—З–µ–љ–Є—П –Є –њ–Њ—Б–ї–µ –Љ–Є–Њ–Љ—Н–Ї—В–Њ–Љ–Є–Є. –≠–Ї—Б—В—А–µ–љ-–љ–Њ–µ –Ї–µ—Б–∞—А–µ–≤–Њ —Б–µ—З–µ–љ–Є–µ –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–Њ 2 (3,0%) –±–µ—А–µ–Љ–µ–љ–љ—Л–Љ –њ–Њ –њ–Њ–≤–Њ–і—Г –≥–µ—Б—В–Њ–Ј–∞ —В—П–ґ–µ–ї–Њ–є —Б—В–µ–њ–µ–љ–Є –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є –§–Я–Э –≤ —Б—А–Њ–Ї–µ 31–32 –љ–µ–і. –°–Ч–†–Я I —Б—В–µ–њ–µ–љ–Є –љ–∞–±–ї—О–і–∞–ї—Б—П —Г 13,3% –Є II —Б—В–µ–њ–µ–љ–Є – —Г 6,7% –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е. –Т –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ–µ –±—Л–ї–Њ 2 –і–µ—В–µ–є, —А–Њ–і–Є–≤—И–Є—Е—Б—П –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є –∞—Б—Д–Є–Ї—Б–Є–Є. –£ 12 (16%) –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –Њ—Ж–µ–љ–Ї–∞ —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–Њ —И–Ї–∞–ї–µ –Р–њ–≥–∞—А –љ–∞ 1––є –Љ–Є–љ—Г—В–µ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 7 –±–∞–ї–ї–Њ–≤, –љ–∞ 5––є –Љ–Є–љ—Г—В–µ —Г –≤—Б–µ—Е –і–µ—В–µ–є – 8 –Є 9 –±–∞–ї–ї–Њ–≤. –°—А–µ–і–љ—П—П –Љ–∞—Б—Б–∞ —В–µ–ї–∞ —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–µ–є 1––є –≥—А—Г–њ–њ—Л –і–Њ—Б—В–Є–≥–∞–ї–∞ 3215,0 –≥ (2650,0–3390,0 –≥). –Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ –њ—А–µ–і–µ–ї–∞—Е –љ–Њ—А–Љ–∞—В–Є–≤–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є (–°/–Ф=3,3–3,4; –Ш–†=0,70–0,71). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–Њ–ґ–і–µ–љ–Є–µ –±–Њ–ї–µ–µ 75% –Ј–і–Њ—А–Њ–≤—Л—Е –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –Ц–Ф–Р, –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ II —В—А–Є–Љ–µ—Б—В—А–µ –≥–µ—Б—В–∞—Ж–Є–Є, —П–≤–ї—П–µ—В—Б—П, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —Б–ї–µ–і—Б—В–≤–Є–µ–Љ –∞–і–µ–Ї–≤–∞—В–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–є –Є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Т—Б–µ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л–µ 1––є –≥—А—Г–њ–њ—Л –≤ —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є –≤—Л–њ–Є—Б–∞–љ—Л –і–Њ–Љ–Њ–є, –љ–Њ 18 (24,0%) –Є–Ј –љ–Є—Е –љ–µ –љ–∞ 4–5––µ, –∞ –љ–∞ 6–8––µ —Б—Г—В–Ї–Є –њ–Њ—Б–ї–µ —А–Њ–ґ–і–µ–љ–Є—П.
–І–µ—А–µ–Ј –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–µ —А–Њ–і–Њ–≤—Л–µ –њ—Г—В–Є –±—Л–ї–Є —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ—Л 15 (37%) –±–µ—А–µ–Љ–µ–љ–љ—Л—Е 2––є –≥—А—Г–њ–њ—Л, –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л–Љ –њ—Г—В–µ–Љ –≤ –њ–ї–∞–љ–Њ–≤–Њ–Љ –њ–Њ—А—П–і–Ї–µ – 18 (45%). –Т –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ–µ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –Ї –њ–ї–∞–љ–Њ–≤–Њ–Љ—Г –Ї–µ—Б–∞—А–µ–≤—Г —Б–µ—З–µ–љ–Є—О —П–≤–Є–ї–Є—Б—М –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є—П –§–Я–Э —Г 8 –±–µ—А–µ–Љ–µ–љ–љ—Л—Е, —А—Г–±–µ—Ж –љ–∞ –Љ–∞—В–Ї–µ –њ–Њ—Б–ї–µ –Ї–µ—Б–∞—А–µ–≤–∞ —Б–µ—З–µ–љ–Є—П –≤ –Њ–і–љ–Њ–Љ –љ–∞–±–ї—О–і–µ–љ–Є–Є, –Њ—Б—В—А–∞—П –≥–Є–њ–Њ–Ї—Б–Є—П –њ–ї–Њ–і–∞ – —Г 4, –≤ –Њ–і–љ–Њ–Љ —Б–ї—Г—З–∞–µ – —В—П–ґ–µ–ї—Л–є –≥–µ—Б—В–Њ–Ј, –≤ 4 —Б–ї—Г—З–∞—П—Е – –њ–Њ–ґ–Є–ї–Њ–є –≤–Њ–Ј—А–∞—Б—В –њ–µ—А–≤–Њ—А–Њ–і—П—Й–µ–є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є –§–Я–Э. –Т —Н–Ї—Б—В—А–µ–љ–љ–Њ–Љ –њ–Њ—А—П–і–Ї–µ –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ—Л 7 (17,5%) –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –њ–Њ –њ–Њ–≤–Њ–і—Г –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є –§–Я–Э. –°–Ч–†–Я I —Б—В–µ–њ–µ–љ–Є –љ–∞–±–ї—О–і–∞–ї—Б—П —Г 10 (25%) –Є II —Б—В–µ–њ–µ–љ–Є – —Г 9 (22,5%) –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е. –Т —Б–Њ—Б—В–Њ—П–љ–Є–Є –∞—Б—Д–Є–Ї—Б–Є–Є (—Б –Њ—Ж–µ–љ–Ї–Њ–є –њ–Њ —И–Ї–∞–ї–µ –Р–њ–≥–∞—А 5–6 –±–∞–ї–ї–Њ–≤ –љ–∞ 1––є –Љ–Є–љ—Г—В–µ) —А–Њ–і–Є–ї–Є—Б—М 7 (17,5%) –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е. –£ 15 (37,5%) –і–µ—В–µ–є –љ–∞ 1––є –Љ–Є–љ—Г—В–µ –Њ—Ж–µ–љ–Ї–∞ –њ–Њ —И–Ї–∞–ї–µ –Р–њ–≥–∞—А —Б–Њ—Б—В–∞–≤–Є–ї–∞ 7 –±–∞–ї–ї–Њ–≤, –љ–∞ 5––є –Љ–Є–љ—Г—В–µ —Г —Н—В–Є—Е –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –Њ—Ж–µ–љ–Ї–∞ –њ–Њ —И–Ї–∞–ї–µ –Р–њ–≥–∞—А –±—Л–ї–∞ 8 –±–∞–ї–ї–Њ–≤. –°—А–µ–і–љ—П—П –Љ–∞—Б—Б–∞ —В–µ–ї–∞ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е —Г –Љ–∞—В–µ—А–µ–є 1––є –≥—А—Г–њ–њ—Л –і–Њ—Б—В–Є–≥–∞–ї–∞ 2800,0 –≥ (2600,0– 3060,0 –≥). –Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ —В–∞–Ї–ґ–µ –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ –њ—А–µ–і–µ–ї–∞—Е –љ–Њ—А–Љ–∞—В–Є–≤–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є (–°/–Ф=3,3–3,4; –Ш–† = 0,70–0,71; –Я–Ш=1,3–1,4). –Ы–Є—И—М —Г –Њ–і–љ–Њ–≥–Њ —А–µ–±–µ–љ–Ї–∞, —А–Њ–і–Є–≤—И–µ–≥–Њ—Б—П —Б –∞–љ–µ–Љ–Є–µ–є —В—П–ґ–µ–ї–Њ–є —Б—В–µ–њ–µ–љ–Є, –Љ–Њ–Ј–≥–Њ–≤–Њ–є –Ї—А–Њ–≤–Њ—В–Њ–Ї –±—Л–ї —Б–љ–Є–ґ–µ–љ.
–£ 27 (67,5%) –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –њ–µ—А–Є–Њ–і —А–∞–љ–љ–µ–є –љ–µ–Њ–љ–∞—В–∞–ї—М–љ–Њ–є –∞–і–∞–њ—В–∞—Ж–Є–Є –њ—А–Њ—В–µ–Ї–∞–ї —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–Њ, —Н—В–Є –і–µ—В–Є –±—Л–ї–Є —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ –≤—Л–њ–Є—Б–∞–љ—Л –і–Њ–Љ–Њ–є. –Т—Б–µ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л–µ, —А–Њ–і–Є–≤—И–Є–µ—Б—П —Г –Љ–∞—В–µ—А–µ–є —Б –Ц–Ф–Р —Б—А–µ–і–љ–µ–є –Є —В—П–ґ–µ–ї–Њ–є —Б—В–µ–њ–µ–љ–Є, –Є–Љ–µ–ї–Є –≥–Є–њ–Њ—В—А–Њ—Д–Є—О, –Є—Е –Љ–∞—Б—Б–∞ –Є –і–ї–Є–љ–∞ —В–µ–ї–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–∞ 3–10––Љ—Г –њ–µ—А—Ж–µ–љ—В–Є–ї—М–љ–Њ–Љ—Г —Г—А–Њ–≤–љ—О; 6 (15%) –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –њ–µ—А–µ–≤–µ–і–µ–љ—Л –љ–∞ –≤—В–Њ—А–Њ–є —Н—В–∞–њ –ї–µ—З–µ–љ–Є—П –Є 7 (17,5%) –њ–µ—А–µ–≤–µ–і–µ–љ—Л –≤ –Њ—В–і–µ–ї–µ–љ–Є–µ —А–µ–∞–љ–Є–Љ–∞—Ж–Є–Є. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –њ—А–Є—З–Є–љ, –Њ—Б–ї–Њ–ґ–љ–Є–≤—И–Є—Е –њ–µ—А–Є–Њ–і —А–∞–љ–љ–µ–є –∞–і–∞–њ—В–∞—Ж–Є–Є –і–µ—В–µ–є, –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –≤—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Ж–µ–љ—В –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –љ–∞–±–ї—О–і–∞–ї—Б—П –≤–Њ 2––є –≥—А—Г–њ–њ–µ (33%). –Т 1––є –≥—А—Г–њ–њ–µ —З–Є—Б–ї–Њ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е —Б –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є –±—Л–ї–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–µ–љ—М—И–µ, —Е–Њ—В—П –і–∞–љ–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —В–∞–Ї–ґ–µ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—Б–Њ–Ї (24%). –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –Њ—В–Љ–µ—З–∞–ї–Є—Б—М —Б–Є–љ–і—А–Њ–Љ –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П, —Б—Г–і–Њ—А–Њ–ґ–љ—Л–є —Б–Є–љ–і—А–Њ–Љ. –•–∞—А–∞–Ї—В–µ—А–љ–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –≥—А—Г–њ–њ—Л –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–µ–є —Б –Ц–Ф–Р –±—Л–ї–∞ –Ј–∞–і–µ—А–ґ–Ї–∞ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П –њ—Г–њ–Њ—З–љ–Њ–є —А–∞–љ—Л, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —Б–љ–Є–ґ–µ–љ–Є–Є —А–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е –љ–∞–ї–Є—З–Є–µ–Љ —Г –Љ–∞—В–µ—А–µ–є –Ц–Ф–Р —Б—А–µ–і–љ–µ–є —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є.
–Ш–Љ–µ—О—В—Б—П –µ–і–Є–љ–Є—З–љ—Л–µ —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ –≤–ї–Є—П–љ–Є–Є –Ц–Ф–Р –љ–∞ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Б—В—А–Њ–µ–љ–Є—П –њ–ї–∞—Ж–µ–љ—В—Л [5]. –Я–Њ –і–∞–љ–љ—Л–Љ –∞–≤—В–Њ—А–∞, –Є–Љ–µ—О—В—Б—П —Е–∞—А–∞–Ї—В–µ—А–љ—Л–µ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –њ–ї–∞—Ж–µ–љ—В–µ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—А–µ–Љ–µ–љ–Є –≤—Л—П–≤–ї–µ–љ–Є—П, —Б—В–µ–њ–µ–љ–Є –∞–љ–µ–Љ–Є–Є –Є –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Я–Њ –љ–∞—И–Є–Љ –љ–∞–±–ї—О–і–µ–љ–Є—П–Љ, –њ—А–Є –Є–Ј—Г—З–µ–љ–Є–Є –њ–ї–∞—Ж–µ–љ—В –ґ–µ–љ—Й–Є–љ —Б –Ц–Ф–Р —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–є –Љ–Њ—А—Д–Њ—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О —П–≤–ї—П—О—В—Б—П –і–Є—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–є —В–Є–њ —Б–Њ–Ј—А–µ–≤–∞–љ–Є—П –Ї–Њ—В–Є–ї–µ–і–Њ–љ–Њ–≤, –љ–∞–ї–Є—З–Є–µ –њ—Б–µ–≤–і–Њ–Є–љ—Д–∞—А–Ї—В–Њ–≤, –∞—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Ј–Њ–љ, —Д–Њ–Ї–∞–ї—М–љ—Л—Е –љ–µ–Ї—А–Њ–Ј–Њ–≤ –≤–Њ—А—Б–Є–љ, —Б–Ї–ї–µ—А–Њ–Ј–∞ —Б—В—А–Њ–Љ—Л –≤–Њ—А—Б–Є–љ –Є –Є—Е —В—А–Њ–Љ–±–Њ–Ј. –£–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–Ї–ї–µ—А–Њ–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤–Њ—А—Б–Є–љ –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –њ—А—П–Љ–Њ–є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –∞–љ–µ–Љ–Є–Є. –Я—А–Є –∞–љ–µ–Љ–Є–Є –ї–µ–≥–Ї–Њ–є –Є —Б—А–µ–і–љ–µ–є —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є —Б–Њ—Е—А–∞–љ–љ–Њ—Б—В—М —Б–Є–љ—В–Є—Ж–Є–Њ—В—А–Њ—Д–Њ–±–ї–∞—Б—В–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 80–70%, —В–Њ–≥–і–∞ –Ї–∞–Ї –њ—А–Є –∞–љ–µ–Љ–Є–Є —В—П–ґ–µ–ї–Њ–є —Б—В–µ–њ–µ–љ–Є —Б–Њ—Е—А–∞–љ–љ–Њ—Б—В—М –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 60%. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 1––є –Є 2––є –≥—А—Г–њ–њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —А–∞–Ј–љ—П—В—Б—П –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –њ–ї–∞—Ж–µ–љ—В: —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є –∞–љ—В–Є–∞–љ–µ–Љ–Є—З–µ—Б–Ї—Г—О —В–µ—А–∞–њ–Є—О —Б–Њ II —В—А–Є–Љ–µ—Б—В—А–∞ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –±–Њ–ї—М—И–∞—П –Љ–∞—Б—Б–∞ –Є —А–∞–Ј–Љ–µ—А—Л –њ–ї–∞—Ж–µ–љ—В—Л, –њ–Њ–ї–љ–Њ–Ї—А–Њ–≤–Є–µ –≤–Њ—А—Б–Є–љ, —Б–Њ—Е—А–∞–љ–љ–Њ—Б—В—М —Б–Є–љ—Ж–Є—В–Є–Њ—В—А–Њ—Д–Њ–±–ї–∞—Б—В–∞, –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–є, —З—В–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –љ–∞ —Г–ї—Г—З—И–µ–љ–Є–µ –Њ–±–Љ–µ–љ–∞ –≤ –њ–ї–∞—Ж–µ–љ—В–µ –Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ –µ–µ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Ї —Б–Є–љ—В–µ–Ј—Г. –Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–ї–∞—Ж–µ–љ—В —Г –ґ–µ–љ—Й–Є–љ 2––є –≥—А—Г–њ–њ—Л –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –і–ї—П –љ–Є—Е —Е–∞—А–∞–Ї—В–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–Ї–ї–µ—А–Њ–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є —Д–Є–±—А–Є–љ–Њ–Є–і–љ–Њ––Є–Ј–Љ–µ–љ–µ–љ–љ—Л—Е –≤–Њ—А—Б–Є–љ –Є –Є—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ —Б–±–ї–Є–ґ–µ–љ–Є–µ, –Њ–±–ї–Є—В–µ—А–∞—Ж–Є—П —Б–Њ—Б—Г–і–Њ–≤, —Б–Ї–Њ–њ–ї–µ–љ–Є–µ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –≤ –Љ–µ–ґ–≤–Њ—А—Б–Є–љ—З–∞—В–Њ–Љ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ, –Љ–Є–Ї—А–Њ–Є–љ—Д–∞—А–Ї—В—Л.
–Т—Л–≤–Њ–і—Л
1. –†–∞–Ј–≤–Є—В–Є–µ –∞–љ–µ–Љ–Є–Є –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ –≤–ї–Є—П–µ—В –љ–∞ —В–µ—З–µ–љ–Є–µ –≥–µ—Б—В–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –Є —П–≤–ї—П–µ—В—Б—П —Б–µ—А—М–µ–Ј–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —В–Њ—А–Љ–Њ–ґ–µ–љ–Є—П –њ–Њ—Б—В–љ–∞—В–∞–ї—М–љ–Њ–є –∞–і–∞–њ—В–∞—Ж–Є–Є.
2. –°–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–µ –Є –∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–љ—В–Є–∞–љ–µ–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б —А–∞–љ–љ–Є—Е —Б—А–Њ–Ї–Њ–≤ –≥–µ—Б—В–∞—Ж–Є–Є – –Ј–∞–ї–Њ–≥ –±–ї–∞–≥–Њ–њ–Њ–ї—Г—З–љ–Њ–≥–Њ –Ј–∞–≤–µ—А—И–µ–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Ї–∞–Ї –і–ї—П –Љ–∞—В–µ—А–Є, —В–∞–Ї –Є –і–ї—П –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ.





–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –С–µ–ї–Њ—И–µ–≤—Б–Ї–Є–є –Х.–Р. –Ц–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В —Г –≤–Ј—А–Њ—Б–ї—Л—Е, –і–µ—В–µ–є –Є –±–µ—А–µ–Љ–µ–љ–љ—Л—Е. –Т–Њ—А–Њ–љ–µ–ґ 2000; 121.
2. –Т–Њ—А–Њ–±—М–µ–≤ –Я.–Р. –Р–љ–µ–Љ–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. –Ь 2001; 168.
3. –У—А–Є—Й–µ–љ–Ї–Њ –Ю.–Т., –Ы–∞—Е–љ–Њ –Ш.–Т., –Я–∞–Ї –°.–Р. –Є –і—А. –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї –ї–µ—З–µ–љ–Є—О —Д–µ—В–Њ–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є. –†–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–µ –Ј–і–Њ—А–Њ–≤—М–µ –ґ–µ–љ—Й–Є–љ—Л 2003; 1: 13: 18–22.
4. –Ф–≤–Њ—А–µ—Ж–Ї–Є–є –Ы.–Ш. –Р–ї–≥–Њ—А–Є—В–Љ—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–Њ–є –∞–љ–µ–Љ–Є–Є. –†–Ь–Ц 2002; 2: 6: 22–27.
5. –Ц–Є–ї—П–µ–≤–∞ –Ю.–Ф. –Ъ–ї–Є–љ–Є–Ї–Њ––∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Б–Є—Б—В–µ–Љ—Л –Љ–∞—В—М––њ–ї–∞—Ж–µ–љ—В–∞––њ–ї–Њ–і –њ—А–Є —В–µ—З–µ–љ–Є–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –љ–∞ —Д–Њ–љ–µ –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–Њ–є –∞–љ–µ–Љ–Є–Є: –Р–≤—В–Њ—А–µ—Д. –і–Є—Б…. –Ї–∞–љ–і. –Љ–µ–і. –љ–∞—Г–Ї. –Ь 2005; 24.
6. –Ь–Є–ї–Њ–≤–∞–љ–Њ–≤ –Р.–Я. –Я–∞—В–Њ–ї–Њ–≥–Є—П —Б–Є—Б—В–µ–Љ—Л –Љ–∞—В—М––њ–ї–∞—Ж–µ–љ—В–∞–
–њ–ї–Њ–і. –†—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ –і–ї—П –≤—А–∞—З–µ–є. –Ь: –Ь–µ–і–Є—Ж–Є–љ–∞ 1999: 351–368.
7. –Ь—Г—А–∞—И–Ї–Њ –Ы.–Х. –Я–ї–∞—Ж–µ–љ—В–∞—А–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М: –Р–Ї—В—Г–∞–ї—М–љ—Л–µ –≤–Њ–њ—А–Њ—Б—Л –њ–∞—В–Њ–ї–Њ–≥–Є–Є —А–Њ–і–Њ–≤, –њ–ї–Њ–і–∞ –Є –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ: –Я–Њ—Б–Њ–±–Є–µ –і–ї—П –≤—А–∞—З–µ–є. –Ь 2003; 38–45.
9. –°–µ—А–Њ–≤ –Т.–Э., –Я—А–Є–ї–µ–њ—Б–Ї–∞—П –Т.–Э., –Ц–∞—А–Њ–≤ –Х.–Т. –Є –і—А. –Ц–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –≤ —А–∞–Ј–ї–Є—З–љ—Л–µ –њ–µ—А–Є–Њ–і—Л –ґ–Є–Ј–љ–Є –ґ–µ–љ—Й–Є–љ—Л: –Ш–љ—Д–Њ—А–Љ–∞—Ж–Є–Њ–љ–љ–Њ–µ –њ–Њ—Б–Њ–±–Є–µ –і–ї—П –∞–Ї—Г—И–µ—А–Њ–≤ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Њ–≤. –Ь 2002; 15.
10. –°—В—А–Є–ґ–∞–Ї–Њ–≤ –Р.–Э., –С–∞–µ–≤ –Ю.–†., –Ґ–Є–Љ–Њ—Е–Є–љ–∞ –Ґ.–§. –§–µ—В–Њ–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М: –њ–∞—В–Њ–≥–µ–љ–µ–Ј, –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞, –ї–µ—З–µ–љ–Є–µ. –Т–Њ–њ—А –≥–Є–љ –∞–Ї—Г—И –Є –њ–µ—А–Є–љ–∞—В–Њ–ї 2003; 2: 2: 53–63.
11. –Ґ–Є—В—З–µ–љ–Ї–Њ –Ы.–Ш., –Ъ—А–∞—Б–љ–Њ–њ–Њ–ї—М—Б–Ї–Є–є –Т.–Ш., –Ґ—Г–Љ–∞–љ–Њ–≤–∞ –Т.–Р. –Є –і—А. –†–Њ–ї—М 3–D –і–Њ–њ–њ–ї–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–ї–∞—Ж–µ–љ—В—Л –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є –Њ—Ж–µ–љ–Ї–µ —Д–µ—В–Њ–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –њ–µ—А–Є–љ–∞—В–∞–ї—М–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –Р–Ї—Г—И –Є –≥–Є–љ 2003; 5: 16–20.
12. –®–µ—Е—В–Љ–∞–љ –Ь.–Ь. –†—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ –њ–Њ —Н–Ї—Б—В—А–∞–≥–µ–љ–Є—В–∞–ї—М–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е. –Ь 1999; 815.
13. –®–∞–Ї—Г—В–Є–љ–∞ –Ь.–Ъ. –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –≤–Ј–≥–ї—П–і—Л –љ–∞ –њ–∞—В–Њ–≥–µ–љ–µ–Ј –∞–љ–µ–Љ–Є–Є –њ—А–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є: –Р–≤—В–Њ—А–µ—Д. –і–Є—Б…. –Ї–∞–љ–і. –Љ–µ–і. –љ–∞—Г–Ї. –Э –Э–Њ–≤–≥–Њ—А–Њ–і 1995; 21.
14. Alen L.H. Biological mechanisms that might underlie iron’s effects on fetal growth and preterm birth. J Nutr 2001; 131: 28–2:581–589.
15. Aranyosi J., Zatick J., Jakab A.Jr. et al. Practical aspects of Doppler sonography in obstetrics. Orv Hetil 2003; 144: 34: 1683–1686.
16. Arduini D., Capponi M., Rizzo G. Sonographic automated volume count (SonoAVC) in volume measurement of fetal fluid–filled structures: comparison with virtual organ computeraided anaLysis (VOCAL). Ultrasound Obstet Gynec 2008; 32: 1: 111–112.
17. Casparis D., Del Carlo P., Branconi F. et al. Effectivness and tolerability of oral liquid ferrous gluconate in iron–deficient anemia in pregnancy and in the immediate post–partum period: comparison with other liquid or solid formulations containing bivalent or tnvalent iron. Minerva Ginecol 1996; 48:11: 511–518.
18. Hercberg S., Preziosi P., Galan P. Iron deficiency in Europe. Public Health Nutr 2001; 4: 2: (B): 537–545.
19. Ponka P. Cellular iron metabolism. Kidney Int 1999; 55: Suppl. 69: 2–11.












