–Т –Ї–∞—З–µ—Б—В–≤–µ —Н—Б—В—А–Њ–≥–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –≤ —Б–Њ—Б—В–∞–≤–µ –Є–Ј–≤–µ—Б—В–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —З–∞—Й–µ –≤—Б–µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П —Н—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї, –Ї–Њ—В–Њ—А—Л–є, —П–≤–ї—П—П—Б—М –∞–Ї—В–Є–≤–љ—Л–Љ —Н—Б—В—А–Њ–≥–µ–љ–Њ–Љ, —А–µ–∞–ї–Є–Ј—Г–µ—В —Б–≤–Њ–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л —З–µ—А–µ–Ј –њ–µ—З–µ–љ—М –њ—Г—В–µ–Љ —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є —Б–Є–љ—В–µ–Ј–∞ –±–µ–ї–Ї–Њ–≤. –Ч–∞ —Б—З–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Б–Є–љ—В–µ–Ј–∞ –∞–њ–Њ–ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤ —Г–ї—Г—З—И–∞–µ—В—Б—П –ї–Є–њ–Є–і–љ—Л–є —Б–њ–µ–Ї—В—А –Ї—А–Њ–≤–Є, —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —В—А–∞–љ—Б–њ–Њ—А—В–љ—Л—Е –±–µ–ї–Ї–Њ–≤ –Є –њ–Њ–ї–Њ–≤—Л—Е —Б—В–µ—А–Њ–Є–і–Њ–≤ —Б–≤—П–Ј—Л–≤–∞—О—Й–µ–≥–Њ –≥–ї–Њ–±—Г–ї–Є–љ–∞ (–Я–°–°–У), —З—В–Њ, –љ–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, —П–≤–ї—П–µ—В—Б—П –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –Љ–Њ–Љ–µ–љ—В–Њ–Љ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –Њ—А–∞–ї—М–љ—Л—Е –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–Њ–≤ (–Ъ–Ю–Ъ) [13]. –Э–Њ –≤–Љ–µ—Б—В–µ —Б —В–µ–Љ, –≤–ї–Є—П—П –љ–∞ —Б–Є–љ—В–µ–Ј —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ (–Ґ–У), –Ъ–Ю–Ъ —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В —Б–µ–Ї—А–µ—Ж–Є—О –ґ–µ–ї—З–Є, —В–µ–Љ —Б–∞–Љ—Л–Љ –љ–∞—А—Г—И–∞—П –Ї–Є–љ–µ—В–Є–Ї—Г –ґ–µ–ї—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є. –Р–Ї—В–Є–≤–∞—Ж–Є–µ–є —Б–Є–љ—В–µ–Ј–∞ –≤ –њ–µ—З–µ–љ–Є –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≥–µ–љ–∞ —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В—Б—П —А–µ–љ–Є–љ––∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ––∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤–∞—П —Б–Є—Б—В–µ–Љ–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Ј–∞–і–µ—А–ґ–Ї–µ –ґ–Є–і–Ї–Њ—Б—В–Є, –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—О –Њ—В–µ–Ї–Њ–≤, –њ–Њ–≤—Л—И–µ–љ–Є—О –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–Р–Ф) –Є –і—А—Г–≥–Є–Љ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–Љ —Н—Д—Д–µ–Ї—В–∞–Љ, —Б–≤—П–Ј–∞–љ–љ—Л–Љ —Б –Є–Ј–±—Л—В–Ї–Њ–Љ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞. –≠—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї —Б–њ–Њ—Б–Њ–±–µ–љ –њ–Њ–≤—Л—И–∞—В—М —Б–µ–Ї—А–µ—Ж–Є—О –Є–љ—Б—Г–ї–Є–љ–∞ –Ї–ї–µ—В–Ї–∞–Љ–Є –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, —З—В–Њ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї —Г—Б—Г–≥—Г–±–ї–µ–љ–Є—О –љ–∞—А—Г—И–µ–љ–Є—П —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї –≥–ї—О–Ї–Њ–Ј–µ –Є —В—А–∞–љ–Ј–Є—В–Њ—А–љ–Њ–є –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є [14].
–У–µ—Б—В–∞–≥–µ–љ–љ—Л–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –Ъ–Ю–Ъ –Њ—З–µ–љ—М —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л –Є –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А—Г—О—В—Б—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —В–Є–њ–∞ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є. –°–Њ–≥–ї–∞—Б–љ–Њ –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ –≤—Л–і–µ–ї—П—О—В: –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–µ –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–∞ (–њ—А–µ–≥–љ–∞–љ—Л, –љ–Њ—А––њ—А–µ–≥–љ–∞–љ—Л), –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–µ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ (—Н—Б—В—А–∞–љ—Л, –≥–Њ–љ–∞–љ—Л), –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–µ —Б–њ–Є—А–Њ–љ–Њ–ї–∞–Ї—В–Њ–љ–∞ (–і—А–Њ—Б–њ–Є—А–µ–љ–Њ–љ). –Т—Б–µ –Њ–љ–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –њ–Њ —Б–њ–µ–Ї—В—А—Г —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ —Н—В–Њ–≥–Њ, –≤–ї–Є—П–љ–Є—О –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М [4,7,8,11].
–Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є –њ—А–Њ–≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ —П–≤–ї—П—О—В—Б—П –∞–љ—В–Є–∞–љ–і—А–Њ–≥–µ–љ–љ—Л–є –Є –∞–љ—В–Є–Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–є, –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–Љ – –∞–љ–і—А–Њ–≥–µ–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ (—Б–љ–Є–ґ–µ–љ–Є–µ —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї —Г–≥–ї–µ–≤–Њ–і–∞–Љ, —Б–Є–љ—В–µ–Ј–∞ –∞–њ–Њ–±–µ–ї–Ї–Њ–≤ –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤ –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ —Н—В–Њ–≥–Њ, –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Б–њ–µ–Ї—В—А–∞ –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–Њ–≤ –љ–Є–Ј–Ї–Њ–є –Є –Њ—З–µ–љ—М –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є), –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –≤ –Ї—А–Њ–≤–Є [2]. –У–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–є —Н—Д—Д–µ–Ї—В —Г –њ—А–Њ–≥–µ—Б—В–∞–≥–µ–љ–Њ–≤ –≤—Л—А–∞–ґ–µ–љ —Б–ї–∞–±–Њ –Є —Б–≤—П–Ј–∞–љ —Б –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –љ–∞ —Г–≥–ї–µ–≤–Њ–і–љ—Л–є –Є –≤–Њ–і–љ–Њ–—Б–Њ–ї–µ–≤–Њ–є –Њ–±–Љ–µ–љ. –Р–љ—В–Є–Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–є (–∞–љ—В–Є–∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤—Л–є) —Н—Д—Д–µ–Ї—В –Є–Љ–µ–µ—В —В–Њ–ї—М–Ї–Њ –і—А–Њ—Б–њ–Є—А–µ–љ–Њ–љ, —З—В–Њ —П–≤–ї—П–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –Љ–Њ–Љ–µ–љ—В–Њ–Љ, —В.–Ї. –њ—А–Њ—В–Є–≤–Њ–і–µ–є—Б—В–≤—Г–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Б–Є—Б—В–µ–Љ—Л —А–µ–љ–Є–љ––∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ––∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ, –Ї–Њ—В–Њ—А–∞—П –Њ—В–Љ–µ—З–µ–љ–∞ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ —Н—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї–∞. –≠–Ї–Ј–Њ–≥–µ–љ–љ—Л–µ —Н—Б—В—А–Њ–≥–µ–љ—Л —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В –≤—Л—А–∞–±–Њ—В–Ї—Г –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≥–µ–љ–∞, —Г–≤–µ–ї–Є—З–Є–≤–∞—П —В–µ–Љ —Б–∞–Љ—Л–Љ —Г—А–Њ–≤–љ–Є —А–µ–љ–Є–љ–∞ –Є –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II, –Ї–Њ—В–Њ—А—Л–µ –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В –≤—Л—А–∞–±–Њ—В–Ї—Г –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –≤ –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–∞—Е [5]. –°–ї–µ–і—Б—В–≤–Є–µ–Љ —В–∞–Ї–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П —П–≤–ї—П—О—В—Б—П –Ј–∞–і–µ—А–ґ–Ї–∞ –љ–∞—В—А–Є—П, –≤–Њ–і—Л –Є –њ–Њ—В–µ—А—П –Ї–∞–ї–Є—П. –≠–љ–і–Њ–≥–µ–љ–љ—Л–є –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ –і–µ–є—Б—В–≤—Г–µ—В –Ї–∞–Ї –∞–љ—В–∞–≥–Њ–љ–Є—Б—В —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –Є —В–µ–Љ —Б–∞–Љ—Л–Љ —Б—В–∞–±–Є–ї–Є–Ј–Є—А—Г–µ—В —Б–Њ—Б—В–Њ—П–љ–Є–µ —А–µ–љ–Є–љ––∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л [9]. –Ф–∞–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –±–ї–∞–≥–Њ–њ—А–Є—П—В–µ–љ —Б –њ–Њ–Ј–Є—Ж–Є–є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Є –Љ–Њ–ґ–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М—Б—П –Ї–∞–Ї –њ–Њ–Ј–Є—В–Є–≤–љ—Л–є –њ—А–Є –љ–∞–ї–Є—З–Є–Є —А–Є—Б–Ї–∞ –Є–Ј–±—Л—В–Њ—З–љ—Л—Е –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤—Л—Е –≤–ї–Є—П–љ–Є–є [1,12].
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П – –Є–Ј—Г—З–Є—В—М –≤–ї–Є—П–љ–Є–µ –і—А–Њ—Б–њ–Є—А–µ–љ–Њ–љ—Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–∞ (–Ь–Є–і–Є–∞–љ–∞, «–У–µ–і–µ–Њ–љ –†–Є—Е—В–µ—А», –Т–µ–љ–≥—А–Є—П) –љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Є—Й–µ–≤–Њ–≥–Њ –њ–Њ–≤–µ–і–µ–љ–Є—П, –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Г—О —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї—Г, –∞–љ—В—А–Њ–њ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, –ї–Є–њ–Є–і—Л —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є –Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Є —Г–Љ–µ—А–µ–љ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ (–Є–љ–і–µ–Ї—Б –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ш–Ь–Ґ) < 30 –Ї–≥/–Љ2).
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–†–∞–±–Њ—В–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –љ–∞ –±–∞–Ј–µ –Ї–∞—Д–µ–і—А—Л –∞–Ї—Г—И–µ—А—Б—В–≤–∞ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є–Є –У–С–Ю–£ –Ф–Я–Ю –†–Ь–Р–Я–Ю. –Т –Њ—Б–љ–Њ–≤—Г –њ–Њ–ї–Њ–ґ–µ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–ї–Є–љ–Є–Ї–Њ––ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П 103 –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 18 –і–Њ 35 –ї–µ—В, –Њ–±—А–∞—В–Є–≤—И–Є—Е—Б—П –љ–∞ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л–є –њ—А–Є–µ–Љ –і–ї—П –≤—Л–±–Њ—А–∞ –Љ–µ—В–Њ–і–∞ –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ–Њ–є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Я–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ –Ї—А–Є—В–µ—А–Є—П–Љ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є—П –±—Л–ї–∞ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ 65 (63,1%) –њ–∞—Ж–Є–µ–љ—В–Ї–∞–Љ.
–Ъ—А–Є—В–µ—А–Є–Є –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –≥—А—Г–њ–њ—Г –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л–µ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤—Л: –ґ–µ–ї–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Ї–Є –≤–Њ—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –Љ–µ—В–Њ–і–Њ–Љ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і–∞–љ–љ—Л—Е –Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–Њ–ї–Њ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ–ї—Г–≥–Њ–і–∞ –і–Њ –љ–∞—З–∞–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Є–Ј–±—Л—В–Њ—З–љ–∞—П –Љ–∞—Б—Б–∞ —В–µ–ї–∞ –Є–ї–Є –Њ–ґ–Є—А–µ–љ–Є–µ 1–2 —Б—В. –Ъ—А–Є—В–µ—А–Є–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П: –љ–∞–ї–Є—З–Є–µ —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –њ—А–Є–µ–Љ—Г –Ъ–Ю–Ъ, –≥–Є–њ–Њ—В–Є—А–µ–Њ–Ј, –≥–Є–њ–µ—А–њ—А–Њ–ї–∞–Ї—В–Є–љ–µ–Љ–Є—П, –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ, –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤–∞—П –≥–Є–њ–µ—А–∞–љ–і—А–Њ–≥–µ–љ–Є—П.
–Т—Б–µ –њ–∞—Ж–Є–µ–љ—В–Ї–Є, –њ—А–Є–љ–Є–Љ–∞—О—Й–Є–µ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤ —В–µ—З–µ–љ–Є–µ 2 –Љ–µ—Б. –Ф–∞–љ–љ–Њ–µ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–Њ –Є–Љ–µ–µ—В –Њ—Б–Њ–±–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Б–µ–Ј–Њ–љ–љ–Њ—Б—В—М –Љ–Њ–ґ–µ—В –љ–∞–ї–Њ–ґ–Є—В—М –Њ—В–њ–µ—З–∞—В–Њ–Ї –љ–∞ —Д–Є–Ј–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –њ–Є—Й–µ–≤–Њ–µ –њ–Њ–≤–µ–і–µ–љ–Є–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е, –∞, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, – –љ–∞ –і–Є–љ–∞–Љ–Є–Ї—Г –Љ–∞—Б—Б—Л —В–µ–ї–∞. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤–ї–Є—П–љ–Є–µ —Н—В–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ –±—Л–ї–Њ –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞–љ–Њ. –У—А—Г–њ–њ—Г —Б—А–∞–≤–љ–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–Є 17 —З–µ–ї–Њ–≤–µ–Ї —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –Є —Г–Љ–µ—А–µ–љ–љ—Л–Љ –Њ–ґ–Є—А–µ–љ–Є–µ–Љ (10 –ґ–µ–љ—Й–Є–љ —Б –≥–Є–љ–Њ–Є–і–љ—Л–Љ —В–Є–њ–Њ–Љ –Є 7 – —Б –∞–љ–і—А–Њ–Є–і–љ—Л–Љ —В–Є–њ–Њ–Љ –Њ–ґ–Є—А–µ–љ–Є—П), –љ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–≤—И–Є–µ –Ъ–Ю–Ъ. –¶–µ–ї—М –љ–∞–±–ї—О–і–µ–љ–Є—П –≤ —Н—В–Њ–є –≥—А—Г–њ–њ–µ – –Њ—Ж–µ–љ–Ї–∞ –і–Є–љ–∞–Љ–Є–Ї–Є –Ш–Ь–Ґ –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –љ–∞–±–ї—О–і–µ–љ–Є—П –±–µ–Ј –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ–±—А–∞–Ј–∞ –ґ–Є–Ј–љ–Є –ґ–µ–љ—Й–Є–љ—Л.
–Ф–ї—П —Г—З–∞—Б—В–Є—П –≤ –љ–∞—Б—В–Њ—П—Й–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤—Б–µ –ґ–µ–љ—Й–Є–љ—Л –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ –і–≤–µ –≥—А—Г–њ–њ—Л: —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Є –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞, –Њ–ґ–Є—А–µ–љ–Є–µ–Љ 1–2 —Б—В.
–Т—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–Ї–∞–Љ –њ—А–Њ–≤–µ–і–µ–љ–Њ –Њ–±—Й–µ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤–Ї–ї—О—З–∞—О—Й–µ–µ –Є–Ј—Г—З–µ–љ–Є–µ –∞–љ–∞–Љ–љ–µ–Ј–∞, –Њ–±—Й–Є–є –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Њ—Б–Љ–Њ—В—А, –∞ —В–∞–Ї–ґ–µ –∞–љ—В—А–Њ–њ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ –Ш–Ь–Ґ –њ–Њ Brey, –Ї–Њ—В–Њ—А—Л–є —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є –њ–Њ —Д–Њ—А–Љ—Г–ї–µ: –Ш–Ь–Ґ=–Т/—А2 (–Ї–≥/–Љ2). –°–Њ–і–µ—А–ґ–∞–љ–Є–µ –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Њ–њ—А–µ–і–µ–ї—П–ї–Є –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –њ—А–Є–±–Њ—А–∞ OMRON BF 306 (OMRON Corporation, Japan), –і–µ–є—Б—В–≤–Є–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –Њ—Б–љ–Њ–≤–∞–љ–Њ –љ–∞ –Є–Ј–Љ–µ—А–µ–љ–Є–Є —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П —В–Ї–∞–љ–µ–є, —Б —Г—З–µ—В–Њ–Љ —В–∞–Ї–Є—Е –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е –і–∞–љ–љ—Л—Е, –Ї–∞–Ї –≤–µ—Б, —А–Њ—Б—В, –≤–Њ–Ј—А–∞—Б—В –Є –њ–Њ–ї. –Ш–љ–і–Є–Ї–∞—Ж–Є—П –Љ–∞—Б—Б—Л –ґ–Є—А–∞, —Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ—Б—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, –≤—Л—А–∞–ґ–∞–ї–∞—Б—М –≤ –њ—А–Њ—Ж–µ–љ—В–∞—Е –Њ—В –≤–µ—Б–∞ —В–µ–ї–∞ (—Б—Е–µ–Љ–∞ 1).
–Ф–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —В–Є–њ–∞ –Њ–ґ–Є—А–µ–љ–Є—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –≤—Л—З–Є—Б–ї–µ–љ–Є–µ –Њ—В–љ–Њ—И–µ–љ–Є—П –Њ–Ї—А—Г–ґ–љ–Њ—Б—В–Є —В–∞–ї–Є–Є –Ї –Њ–Ї—А—Г–ґ–љ–Њ—Б—В–Є –±–µ–і–µ—А (–Ю–Ґ/–Ю–С). –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –њ–Є—Й–µ–≤–Њ–≥–Њ –њ–Њ–≤–µ–і–µ–љ–Є—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л–є —Б–Њ—В—А—Г–і–љ–Є–Ї–∞–Љ–Є –Њ—В–і–µ–ї–∞ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –У–£ –У–Э–Ш–¶ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л –Ь–Ч–Є–°–† –†–§ –Ї—А–∞—В–Ї–Є–є —З–∞—Б—В–Њ—В–љ—Л–є –і–Є–µ—В–Є—З–µ—Б–Ї–Є–є –Њ–њ—А–Њ—Б–љ–Є–Ї —Б –±–∞–ї–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ–Њ–є –Њ—Ж–µ–љ–Ї–Є. –Ф–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –∞–љ–Ї–µ—В—Г, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ—Г—О –Р.–Ь. –Т–µ–є–љ–Њ–Љ [10]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–≥–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –і–Њ –Є –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є —Б –њ–Њ–Љ–Њ—Й—М—О —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–≥–Њ –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є (–≠–Ь–Ф). –Ш—Б—Б–ї–µ–і—Г–µ–Љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Є–Ј–Љ–µ—А—П–ї–Є –≤ –њ–Њ–Ї–Њ–µ (–Є—Б—Е–Њ–і–љ—Л–є –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л–є —В–Њ–љ—Г—Б) –Є –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є (–≠–Ь–Ф).
–Ч–∞–±–Њ—А –≤–µ–љ–Њ–Ј–љ–Њ–є –Ї—А–Њ–≤–Є –і–ї—П –≤—Б–µ—Е –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–Є –њ—Г—В–µ–Љ –≤–µ–љ–Њ–њ—Г–љ–Ї—Ж–Є–Є –љ–∞—В–Њ—Й–∞–Ї, —Б–њ—Г—Б—В—П 12–14 —З –њ–Њ—Б–ї–µ –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є –Є —З–µ—А–µ–Ј 3 –і–љ—П –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –∞–ї–Ї–Њ–≥–Њ–ї—П.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –ї–Є–њ–Є–і–Њ–≤ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –і–Є—Б–ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–µ–Љ–Є–є –Њ—В–і–µ–ї–∞ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –У–£ –У–Э–Ш–¶ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л –Ь–Ч–Є–°–† –†–§. –Ы–Є–њ–Є–і—Л —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є –Њ–њ—А–µ–і–µ–ї—П–ї–Є –і–Њ –љ–∞—З–∞–ї–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є –њ–Њ—Б–ї–µ –Њ—В–Љ–µ–љ—Л –Ъ–Ю–Ъ (—З–µ—А–µ–Ј 6 –Љ–µ—Б. –Ї—Г—А—Б–∞ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є). –°–Њ–і–µ—А–ґ–∞–љ–Є–µ –Ю–•–°, –•–° –Ы–Я–Т–Я, –Ґ–У –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Њ–њ—А–µ–і–µ–ї—П–ї–Є –љ–∞ –∞–≤—В–Њ–∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–µ Airone 200, —Д–Є—А–Љ—Л Crony Instruments (–Ш—В–∞–ї–Є—П) —Д–µ—А–Љ–µ–љ—В–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е –љ–∞–±–Њ—А–Њ–≤ —Д–Є—А–Љ—Л Biocon (–Ъ–∞—В. вДЦ BD–404400–01 –Є –Ъ–∞—В. вДЦ BD–505500–61), –У–µ—А–Љ–∞–љ–Є—П. –°–Њ–і–µ—А–ґ–∞–љ–Є–µ –•–° –Ы–Я–Э–Я –Њ–њ—А–µ–і–µ–ї—П–ї–Є –њ–Њ —Д–Њ—А–Љ—Г–ї–µ Friedwald; –∞—В–µ—А–Њ–≥–µ–љ–љ—Г—О –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ—Б—В—М –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –ї–Є–њ–Є–і–Њ–≤ – –њ–Њ —Д–Њ—А–Љ—Г–ї–µ –Р.–Ъ. –Ъ–ї–Є–Љ–Њ–≤–∞. –°–Њ–і–µ—А–ґ–∞–љ–Є–µ –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ–∞ –∞ – –Ы–Я(–∞) – –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Њ–њ—А–µ–і–µ–ї—П–ї–Є –Љ–µ—В–Њ–і–Њ–Љ «—А–∞–Ї–µ—В–љ–Њ–≥–Њ» –Є–Љ–Љ—Г–љ–Њ—Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–∞ –≤ 1% –∞–≥–∞—А–Њ–Ј–љ–Њ–Љ –≥–µ–ї–µ. –Ф–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–Њ–≤ (–§–Ы) –Ы–Т–Я –њ—А–Њ–≤–Њ–і–Є–ї–Є –Є—Е —Н–Ї—Б—В—А–∞–Ї—Ж–Є—О –Є–Ј —Б—Г–њ–µ—А–љ–∞—В–∞–љ—В–∞, –њ–Њ—Б–ї–µ –Њ—Б–∞–ґ–і–µ–љ–Є—П –Є–Ј —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є –∞–њ–Њ––Т–—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–Њ–≤ —Б–Љ–µ—Б—М—О —Д–Њ—Б—Д–Њ–≤–Њ–ї—М—Д—А–∞–Љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —Б —Е–ї–Њ—А–Є–і–Њ–Љ –Љ–∞–≥–љ–Є—П, —Б–Љ–µ—Б—М—О —Е–ї–Њ—А–Њ—Д–Њ—А–Љ: –Љ–µ—В–∞–љ–Њ–ї (2:1 –њ–Њ –Њ–±—К–µ–Љ—Г), —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–µ–є —Б –Љ–Њ–ї–Є–±–і–∞—В–Њ–Љ –∞–Љ–Љ–Њ–љ–Є—П –Є –∞—Б–Ї–Њ—А–±–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –•–°––∞–Ї—Ж–µ–њ—В–Є—А—Г—О—Й–µ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Б—Л–≤–Њ—А–Њ—В–Њ–Ї –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ––Ї–ї–µ—В–Њ—З–љ—Л—Е –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–є (—А—Г–Ї. –њ—А–Њ—Д. –Т.–Р. –Ь–µ—В–µ–ї—М—Б–Ї–∞—П) –У–£ –У–Э–Ш–¶ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л –Ь–Ч–Є–°–† –†–§ –Љ–µ—В–Њ–і–Њ–Љ –Ы–ї–µ—А–∞––Ь–Њ–є–∞ –Є —Б–Њ–∞–≤—В.
–Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≥–ї—О–Ї–Њ–Ј—Л –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є –≥–ї—О–Ї–Њ–Ј–Њ–Њ–Ї—Б–Є–і–∞–Ј–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –њ–Њ –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–µ –љ–∞ –∞–≤—В–Њ–∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–µ Airone 200 —Б –њ–Њ–Љ–Њ—Й—М—О –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е –љ–∞–±–Њ—А–Њ–≤ Biocon (–Ъ–∞—В. вДЦ BD–461100–04). –°–Њ–і–µ—А–ґ–∞–љ–Є–µ –Є–љ—Б—Г–ї–Є–љ–∞ –Њ–њ—А–µ–і–µ–ї—П–ї–Є –Є–Љ–Љ—Г–љ–Њ—Д–ї—О–Њ—А–Є–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–Љ –Љ–µ—В–Њ–і–Њ–Љ –≤ –љ–∞—Г—З–љ–Њ–Љ —Ж–µ–љ—В—А–µ «–≠–Ї–Њ–ї–Њ–≥–Є—П, —Д–Є–Ј–Ї—Г–ї—М—В—Г—А–∞ –Є —Б–њ–Њ—А—В» –≤ –Њ—В–і–µ–ї–µ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –љ–∞ –∞–≤—В–Њ–∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–µ Immulite 2000. –Ф–ї—П –Ї–Њ—Б–≤–µ–љ–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Г—О D. Matthews –≥–Њ–Љ–µ–Њ—Б—В–∞—В–Є—З–µ—Б–Ї—Г—О –Љ–Њ–і–µ–ї—М –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Є–љ–і–µ–Ї—Б–∞ –Э–Ю–Ь–Р.
–Я—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л–є –≤ –†–Њ—Б—Б–Є–Є –љ–Є–Ј–Ї–Њ–і–Њ–Ј–Є—А–Њ–≤–∞–љ–љ—Л–є –Ъ–Ю–Ъ, —Б–Њ–і–µ—А–ґ–∞—Й–Є–є 30 –Љ–Ї–≥ —Н—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї–∞ –Є 3 –Љ–≥ –і—А–Њ—Б–њ–Є—А–µ–љ–Њ–љ–∞ (–Ь–Є–і–Є–∞–љ–∞, «–У–µ–і–µ–Њ–љ –†–Є—Е—В–µ—А», –Т–µ–љ–≥—А–Є—П) –њ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ–Њ–є —Б—Е–µ–Љ–µ 21/7. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–Є–µ–Љ–∞ –Ъ–Ю–Ъ (30 –Љ–≥ –≠–≠ + 3–Љ–Ї–≥ –Ф–†–°–Я) —Б–Њ—Б—В–∞–≤–Є–ї–∞ 6 –Љ–µ—Б.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –љ–∞ –њ–µ—А—Б–Њ–љ–∞–ї—М–љ–Њ–Љ –Ї–Њ–Љ–њ—М—О—В–µ—А–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Њ–±—Й–µ–њ—А–Є–љ—П—В—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є —Б—В–∞—В–Є—Б—В–Є–Ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –њ—А–Њ–≥—А–∞–Љ–Љ–љ—Л—Е —Б–Є—Б—В–µ–Љ Microsoft Excel –Є Biostat. –Т—Б–µ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–µ —В–µ—Б—В—Л –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М –і–ї—П —Г—А–Њ–≤–љ—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є p<0,05. –Я—А–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–Є, –±–ї–Є–Ј–Ї–Њ–Љ –Ї –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ—Г, –Њ—Ж–µ–љ–Ї—Г —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є –њ–Њ t––Ї—А–Є—В–µ—А–Є—О –°—В—М—О–і–µ–љ—В–∞. –Т —Б–ї—Г—З–∞–µ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П, –Њ—В–ї–Є—З–∞—О—Й–µ–≥–Њ—Б—П –Њ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ, –і–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П –≥—А—Г–њ–њ –љ–∞–±–ї—О–і–µ–љ–Є—П –і–Њ –Є –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Ї—А–Є—В–µ—А–Є–є –£–Є–ї–Ї–Њ–Ї—Б–Њ–љ–∞ [15].
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б–Њ—Б—В–∞–≤–Є–ї 25,65±4,97 –≥–Њ–і–∞. –Ч–∞ 6 –Љ–µ—Б. –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ъ–Ю–Ъ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–µ–є –Є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –љ–µ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ. –Т—Б–µ –ґ–µ–љ—Й–Є–љ—Л, –њ–Њ –і–∞–љ–љ—Л–Љ –∞–љ–Ї–µ—В–Є—А–Њ–≤–∞–љ–Є—П, –±—Л–ї–Є —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–µ–љ—Л –≤—Л–±—А–∞–љ–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є.
–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –і–ї—П –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –Ј–∞ –њ—А–Є–µ–Љ–Њ–Љ –Ъ–Ю–Ъ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Ш–Ь–Ґ, –±–Њ–ї–µ–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–Љ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –њ—А–Њ—Ж–µ–љ—В–∞ –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–Њ–≤ –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є –і–ї—П –Ї–Њ–љ—В—А–Њ–ї—П –Ј–∞ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М—О –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ –µ—Й–µ –Є —Б —В–µ—Е –њ–Њ–Ј–Є—Ж–Є–є, —З—В–Њ –њ—А–Є–±–∞–≤–Ї–∞ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –Є–ї–Є –µ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Ъ–Ю–Ъ –Љ–Њ–≥—Г—В –±—Л—В—М —Б–≤—П–Ј–∞–љ—Л —Б–Њ —Б–њ–µ—Ж–Є—Д–Є–Ї–Њ–є –њ—А–Њ–≥–µ—Б—В–∞–≥–µ–љ–љ–Њ–є —Б–Њ—Б—В–∞–≤–ї—П—О—Й–µ–є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞.
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Њ—Б–љ–Њ–≤–љ—Л—Е –∞–љ—В—А–Њ–њ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Г –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ –±–µ–Ј —Г—З–µ—В–∞ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є –љ–∞–Љ–Є –љ–µ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–є —А–∞–Ј–љ–Є—Ж—Л –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Ъ–Ю–Ъ (—В–∞–±–ї. 1).
–Т–Љ–µ—Б—В–µ —Б —В–µ–Љ, –і–µ—В–∞–ї–Є–Ј–∞—Ж–Є—П —В–Є–њ–∞ –Њ–ґ–Є—А–µ–љ–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–∞ –≤—Л—П–≤–Є—В—М –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –њ—А–Є –њ—А–Є–µ–Љ–µ –Ъ–Ю–Ъ –ґ–µ–љ—Й–Є–љ–∞–Љ–Є —Б –∞–љ–і—А–Њ–Є–і–љ—Л–Љ —В–Є–њ–Њ–Љ –Њ–ґ–Є—А–µ–љ–Є—П. –Ь–Њ–ґ–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –і–∞–љ–љ—Л–є —Н—Д—Д–µ–Ї—В —Б–≤—П–Ј–∞–љ —Б –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –∞–љ–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Є –і–∞–љ–љ–Њ–Љ —В–Є–њ–µ –Њ–ґ–Є—А–µ–љ–Є—П, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є (—В–∞–±–ї. 2).
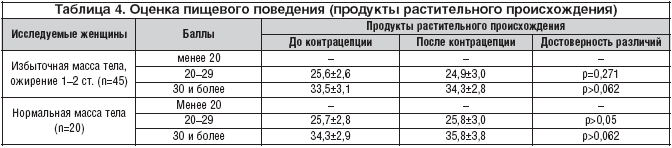
–С–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П –њ–Њ—П–≤–ї–µ–љ–Є—П –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞ –Є –Њ–ґ–Є—А–µ–љ–Є—П –Є–Љ–µ—О—В —Б—А–µ–і–Њ–≤—Л–µ —Д–∞–Ї—В–Њ—А—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Њ–±—А–∞–Ј–Њ–Љ –ґ–Є–Ј–љ–Є, –≤–∞–ґ–љ–µ–є—И–Є–Љ –Є–Ј –љ–Є—Е —П–≤–ї—П–µ—В—Б—П –њ–Є—В–∞–љ–Є–µ. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Є—Й–µ–≤—Л—Е –њ—А–Є—Б—В—А–∞—Б—В–Є–є –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ –ґ–µ–љ—Й–Є–љ—Л —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –Є –Њ–ґ–Є—А–µ–љ–Є–µ–Љ 1–2 —Б—В. –Њ—В–і–∞—О—В –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ –њ—А–Њ–і—Г–Ї—В–∞–Љ —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –ґ–Є—А–∞. –Э–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Ъ–Ю–Ъ –Ї–∞–Ї–Є—Е––ї–Є–±–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –њ–Є—Й–µ–≤–Њ–≥–Њ –њ–Њ–≤–µ–і–µ–љ–Є—П –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ (—В–∞–±–ї. 3, 4).
–Я–Њ–Љ–Є–Љ–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –њ–Є—Й–µ–≤–Њ–≥–Њ –њ–Њ–≤–µ–і–µ–љ–Є—П —Г–і–µ–ї—П–ї–Њ—Б—М –≤–љ–Є–Љ–∞–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—О –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є —А–µ–≥—Г–ї—П—Ж–Є–Є. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –≤–µ–≥–µ—В–∞—В–Є–≤–љ–∞—П –љ–µ—А–≤–љ–∞—П —Б–Є—Б—В–µ–Љ–∞ –Є–≥—А–∞–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Г—О —А–Њ–ї—М –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –ґ–µ–љ—Й–Є–љ, –∞ —Б–Є–љ–і—А–Њ–Љ –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є –і–Є—Б—В–Њ–љ–Є–Є –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –і–Њ–Љ–Є–љ–Є—А—Г—О—Й–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –≤ –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –±–∞–ї–∞–љ—Б–∞. –°–Њ—Б—В–Њ—П–љ–Є–µ —Б–Є–Љ–њ–∞—В–Є–Ї–Њ—В–Њ–љ–Є–Є, —А–∞–Ј–≤–Є–≤–∞—О—Й–µ–µ—Б—П —Г –ї—О–і–µ–є —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–≤ —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –ї—О–±–∞—П –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П –њ–µ—А–µ—Б—В—А–Њ–є–Ї–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–Љ «—Б–Є–љ–і—А–Њ–Љ–Њ–Љ –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є –і–Є—Б—В–Њ–љ–Є–Є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –њ–µ—А–µ—Б—В—А–Њ–µ–Ї». –†–∞–Ј–≤–Є—В–Є–µ –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –≤ –њ–Њ–ї—М–Ј—Г –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–Љ –њ—А–Њ—Д–Є–ї–µ –ґ–µ–љ—Й–Є–љ—Л.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є –≤—Л—П–≤–Є—В—М –љ–∞–ї–Є—З–Є–µ –≤ –≥—А—Г–њ–њ–∞—Е –ґ–µ–љ—Й–Є–љ c –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞, –Є–Ј–±—Л—В–Њ—З–љ—Л–Љ –≤–µ—Б–Њ–Љ –Є –Њ–ґ–Є—А–µ–љ–Є–µ–Љ 1–2 —Б—В. –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б —Г–ґ–µ –Є–Ј–Љ–µ–љ–µ–љ–љ—Л–Љ –Є—Б—Е–Њ–і–љ—Л–Љ –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л–Љ —В–Њ–љ—Г—Б–Њ–Љ. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ, –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 6 –Љ–µ—Б. –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ъ–Ю–Ъ —Г—Б—Г–≥—Г–±–ї–µ–љ–Є—П –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М (—В–∞–±–ї. 5).
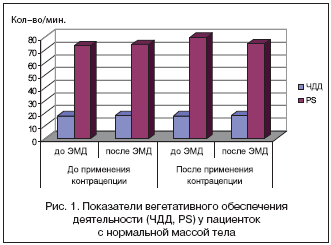
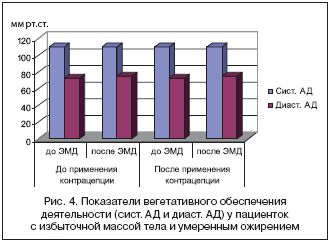
–Э–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Ъ–Ю–Ъ –Є –њ–Њ –Ј–∞–≤–µ—А—И–µ–љ–Є–Є –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є –Њ—В–Љ–µ—З–µ–љ–Њ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–µ –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–µ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–µ –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є, –Њ —З–µ–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Є–љ—В–µ–≥—А–∞—В–Є–≤–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —Б–Є—Б—В–µ–Љ (–≤–µ–ї–Є—З–Є–љ—Л —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ, –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф, –њ—Г–ї—М—Б–∞ (PS), —З–∞—Б—В–Њ—В—Л –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –і–≤–Є–ґ–µ–љ–Є–є (–І–Ф–Ф) –і–Њ –≠–Ь–Ф –Є –њ–Њ—Б–ї–µ (—А–Є—Б.1–4).
–Я—А–Є —Д–Њ–љ–Њ–≤–Њ–Љ –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г 28,1% –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞, –Њ–ґ–Є—А–µ–љ–Є–µ–Љ 1 —Б—В. –≤—Л—П–≤–ї–µ–љ—Л –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є—П, –≥–Є–њ–Њ–∞–ї—М—Д–∞–ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–µ–Љ–Є—П. –Т –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П —Г 33,3% –ґ–µ–љ—Й–Є–љ —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є—П –љ–∞ —Д–Њ–љ–µ —Б–љ–Є–ґ–µ–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–Њ–≤ –≤—Л—Б–Њ–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є (–•–° –Ы–Я–Т–Я). –Я–Њ—Б–ї–µ –Њ—В–Љ–µ–љ—Л –Ъ–Ю–Ъ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –≤—Л—П–≤–ї–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ґ–У –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є (p<0,03). –Р–љ–∞–ї–Њ–≥–Є—З–љ–∞—П —В–µ–љ–і–µ–љ—Ж–Є—П (p<0,06) –Њ—В–Љ–µ—З–µ–љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞, —Г–Љ–µ—А–µ–љ–љ—Л–Љ –Њ–ґ–Є—А–µ–љ–Є–µ–Љ. –Ъ–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –∞—В–µ—А–Њ–≥–µ–љ–љ–Њ—Б—В–Є –љ–∞ —Д–Њ–љ–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є –і—А–Њ—Б–њ–Є—А–µ–љ–Њ–љ—Б–Њ–і–µ—А–ґ–∞—Й–Є–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –≥—А—Г–њ–њ–∞—Е –љ–µ –Є–Ј–Љ–µ–љ—П–ї—Б—П (p>0,05) (—А–Є—Б. 5,6).
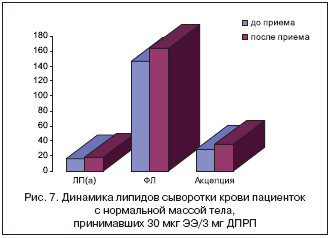
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –њ–µ—А–µ–љ–Њ—Б–∞ –Ю–•–° –Є–Ј –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —В–Ї–∞–љ–µ–є –њ—А–Є –њ—А–Є–µ–Љ–µ 30 –Љ–≥ –≠–≠ + 3 –Љ–Ї–≥ –Ф–†–°–Я –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є –Њ—В–Љ–µ—В–Є—В—М —Г—Б–Є–ї–µ–љ–Є–µ –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞. –І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞, —Г–Љ–µ—А–µ–љ–љ—Л–Љ –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, —В–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –∞–Ї—Ж–µ–њ—Ж–Є–Є –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Ю–•–° –≤ –љ–∞—Б—В–Њ—П—Й–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Є –њ—А–Є–µ–Љ–µ –і—А–Њ—Б–њ–Є—А–µ–љ–Њ–љ—Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–∞ –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ. –£—З–Є—В—Л–≤–∞—П, —З—В–Њ –•–° –≤—Б–µ–≥–і–∞ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—В –§–Ы, –Ї–∞–Ї –Њ–і–љ–Є –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –ї–Є–њ–Є–і–Њ–≤ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–µ —Б–Њ–±–Њ–є —Б–ї–Њ–ґ–љ—Л–µ —Н—Д–Є—А—Л –Љ–љ–Њ–≥–Њ–∞—В–Њ–Љ–љ—Л—Е —Б–њ–Є—А—В–Њ–≤ –≥–ї–Є—Ж–µ—А–Є–љ–∞ –Є–ї–Є —Б—Д–Є–љ–≥–Њ–Ј–Є–љ–∞ —Б –≤—Л—Б—И–Є–Љ–Є –ґ–Є—А–љ—Л–Љ–Є –Ї–Є—Б–ї–Њ—В–∞–Љ–Є –Є —Д–Њ—Б—Д–Њ—А–љ–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є, –љ–∞–Љ–Є —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Њ –≤–ї–Є—П–љ–Є–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–Њ–≤ –љ–∞ –і–∞–љ–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –§–Ы –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —Д–Њ–љ–Њ–≤—Л–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є (—А<0,03) –Ї–∞–Ї —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є, —В–∞–Ї –Є —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–ї—Г—З–µ–љ—Л –Є –њ—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –ї–Є–њ–Є–і––±–µ–ї–Ї–Њ–≤–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –Ы–Я(–∞) –і–Њ –Є —З–µ—А–µ–Ј 6 –Љ–µ—Б. –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ъ–Ю–Ъ (—А–Є—Б. 7,8).
–Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –Є–Љ–Љ—Г–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Є–љ—Б—Г–ї–Є–љ–∞ –Є –≥–ї—О–Ї–Њ–Ј—Л –Ї–∞–Ї –Ї–Њ—Б–≤–µ–љ–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є–љ—Б—Г–ї–Є–љ–∞ –≤ —В–Ї–∞–љ—П—Е (–Э–Ю–Ь–Р) –Њ—В–Љ–µ—З–µ–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Н—В–Њ–≥–Њ –Є–љ–і–µ–Ї—Б–∞ –≤–Њ –≤—Б–µ—Е –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –≥—А—Г–њ–њ–∞—Е (—В–∞–±–ї. 6), —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В –і–∞–љ–љ—Л–µ –Њ —Б–љ–Є–ґ–µ–љ–Є–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї –Є–љ—Б—Г–ї–Є–љ—Г –њ—А–Є –њ—А–Є–µ–Љ–µ –Ъ–Ю–Ъ.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В —Б—З–Є—В–∞—В—М, —З—В–Њ –љ–Є–Ј–Ї–Њ–і–Њ–Ј–Є—А–Њ–≤–∞–љ–љ—Л–є –Ъ–Ю–Ъ, —Б–Њ–і–µ—А–ґ–∞—Й–Є–є 30 –Љ–Ї–≥ —Н—В–Є–љ–Є–ї—Н—Б—В—А–∞–і–Є–Њ–ї–∞ –Є 3 –Љ–≥ –і—А–Њ—Б–њ–Є—А–µ–љ–Њ–љ–∞, –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –Ш–Ь–Ґ < 30 –Ї–≥/–Љ2 –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ–ї—Г–≥–Њ–і–∞, –њ—А–Є —Н—В–Њ–Љ –љ–µ –Њ–ґ–Є–і–∞–µ—В—Б—П –њ—А–Є–±–∞–≤–Ї–Є –Љ–∞—Б—Б—Л —В–µ–ї–∞, –∞ —В–∞–Ї–ґ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –љ–∞—А—Г—И–µ–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –ї–Є–њ–Є–і–Њ–≤ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–є –Ї–Њ–љ—В—А–Њ–ї—М –љ–µ–Њ–±—Е–Њ–і–Є–Љ —В–Њ–ї—М–Ї–Њ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –∞–љ–і—А–Њ–Є–і–љ—Л–Љ —В–Є–њ–Њ–Љ –Њ–ґ–Є—А–µ–љ–Є—П –Є –≥–Є–њ–µ—А—В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–µ–Љ–Є–µ–є. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –Є–љ–і–µ–Ї—Б–∞ –Э–Ю–Ь–Р –Ј–∞—Б—В–∞–≤–ї—П–µ—В —Б –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М—О –њ–Њ–і—Е–Њ–і–Є—В—М –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –Ъ–Ю–Ъ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є.











–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Caprio M., Antelmi A., Chetrite G. et al. Antiadipogenic effects of the mineralocorticoid receptor antagonist drospirenone: potential implications for the treatment of metabolic syndrome // Endocrinology. – 2011. –Vol. 152(1). – P.113–25.
2. Fertil Steril. – 2010; 1793 – 8.2010 by American Society for Reproductive Medicine
3. Gallo M.F., Lopez L.M., Grimes D.A. et al. Combination contraceptives: effects on weight //Corhrane Database Syst. Rev. – 2008. – вДЦ 4: –°D 003987.
4. Kriplani A., Periyasamy A.J., Agarwal N. et al. Effect of oral contraceptive containing ethinyl estradiol combined with drospirenone vs. desogestrel on clinical and biochemical parameters in patients with polycystic ovaru syndrome // Contraception. – 2010. – Vol. 82(2). – P.139–46.
5. Oner G., Muderris I.I. A prospective randomized trial comparing low–dose ethinyl estradiol and drospirenone 24/4 combined oral contraceptive vs.ethinyl estradioland drospirenone 21/7 combined oral contraceptive in the treatment of hirsutism // Contraception. – 2011. – Vol. 84(5). – P.508 – 511.
6. Regine Sitruc, Anita Nath. Metabolic effects of contraceptive steroids. //Journal Med. – 2011. – Vol.12 – вДЦ 2. – P. 63–75.
7. Tan J.K., Ediriweera C. EffIcacy and safety of combined ethinyl estradiol/drospirenoneoral contraceptives in the treatment of acne // Int. J. Women Health.– 2010. – Vol. 9;1.– P. 213–221.
8. Gaspard U., Endrikat J., Desager J.P. A randomized study on the influence of oral contraceptives containing ethinylestradiol combined with drospirenone or desogestrel on lipid and lipoprotein metabolism over a period of 13 cycles // Contraception. – 2004.– Vol. 69.– P. 271–278.
9. Verchaeghe J. Hormonal contraception in women with metabolic syndrome // Contraception Reprod. Health Care. – 2010. – Vol. 5(5). – P.305–314.
10. –Т–µ–≥–µ—В–∞—В–Є–≤–љ—Л–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞: –Ї–ї–Є–љ–Є–Ї–∞, –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞, –ї–µ—З–µ–љ–Є–µ / –Я–Њ–і —А–µ–і. –Р.–Ь. –Т–µ–є–љ–∞ – –Ь.: –Ю–Ю–Ю «–Ь–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–µ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Њ–љ–љ–Њ–µ –∞–≥–µ–љ—В—Б—В–≤–Њ», 2003. – 752 —Б.
11. –У–µ–≤–Њ—А–Ї—П–љ –Ь.–Р., –Ь–∞–љ—Г—Е–Є–љ –Ш.–С., –Ѓ—А–Ї–Њ–≤–µ—Ж –Ь.–У. –У–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є—П: –Ї–Њ–љ—Б—Г–ї—М—В–Є—А–Њ–≤–∞–љ–Є–µ –≤ –≤—Л–±–Њ—А–µ –Љ–µ—В–Њ–і–Њ–≤ –Є —А–µ–ґ–Є–Љ–Њ–≤ –њ—А–µ–і–Њ—Е—А–∞–љ–µ–љ–Є—П –Њ—В –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ–Њ–є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є // –Т–Њ–њ—А–Њ—Б—Л –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є–Є, –∞–Ї—Г—И–µ—А—Б—В–≤–∞ –Є –њ–µ—А–Є–љ–∞—В–Њ–ї–Њ–≥–Є–Є. – 2011. – –Ґ. 10; вДЦ1,4,5. – –°. 7–10.
12. –Я–Њ–і–Ј–Њ–ї–Ї–Њ–≤–∞ –Э.–Ь. –Ю—А–≥–∞–љ–Њ—Б–Њ—Е—А–∞–љ—П—О—Й–Є–є –Є –Њ–љ–Ї–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–Њ–≤ // –У–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—П (—Н–Ї—Б—В—А–∞–≤—Л–њ—Г—Б–Ї). – 2011. – –°. 9–12.
13. –Я—А–Є–ї–µ–њ—Б–Ї–∞—П –Т.–Э. –Ъ–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–љ—Л–µ –≥–Њ—А–Љ–Њ–љ—Л –≤ –ї–µ—З–µ–љ–Є–Є –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є // –У–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—П (—Н–Ї—Б—В—А–∞–≤—Л–њ—Г—Б–Ї). – 2011. – –°. 3–5.
14. –†—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ –њ–Њ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є / –Я–Њ–і —А–µ–і. –Т.–Э. –Я—А–Є–ї–µ–њ—Б–Ї–Њ–є. – –Ь.: –Ь–µ–і–њ—А–µ—Б—Б – –Є–љ—Д–Њ—А–Љ, 2006. – 400—Б.
15. –°–µ—А–≥–Є–µ–љ–Ї–Њ –Т.–Ш., –С–Њ–љ–і–∞—А–µ–≤–∞ –Ш.–С. –Ь–∞—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–∞—П —Б—В–∞—В–Є—Б—В–Є–Ї–∞ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е. – –Ь.: –Ш–Ј–і–∞—В–µ–ї—М—Б–Ї–Є–є –і–Њ–Љ «–У–≠–Ю–Ґ–Р–† – –Ь–Х–Ф», 2001. – 255—Б.
16. –Ґ–Є—Е–Њ–Љ–Є—А–Њ–≤ –Р.–Ы., –С–∞—В–∞–µ–≤–∞ –Р.–Х. –≠–≤–Њ–ї—О—Ж–Є—П –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є // –Т–Њ–њ—А–Њ—Б—Л –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є–Є, –∞–Ї—Г—И–µ—А—Б—В–≤–∞ –Є –њ–µ—А–Є–љ–∞—В–Њ–ї–Њ–≥–Є–Є. – 2011. – –Ґ. 10; вДЦ1,4,5. – –°. 11–14.












