Особенностью всех чистогестагенных контрацептивов является изменение менструального цикла [2, 7]. Так, 70% пользователей инъекционных методов в течение первых месяцев отмечают нерегулярные, длительные и/или обильные маточные кровотечения. При этом с каждой инъекцией частота и количество кровяных выделений снижаются и к концу первого года использования метода у 70% женщин менструации отсутствуют [8, 9]. Внутриматочная рилизинг-система с левоноргестрелом также вызывает прогрессирующее уменьшение менструальной кровопотери, которое через год составляет до 10% от исходной, и у многих развивается аменорея [10]. Местное влияние левоноргестрела на эндометрий столь выраженно, что в клинической практике используется для уменьшения кровопотери у женщин с аномальными маточными кровотечениями, в т. ч. обусловленными миомой матки [11].
После установки подкожных имплантатов с этоногестрелом (Импланон, Импланон НКСТ) также происходит изменение менструального цикла. Анализ профиля кровяных выделений у 923 женщин, использующих Импланон в течение 1–3 лет, показал, что в первые 3 мес. у 22% из них развивается аменорея, у 33% отмечаются редкие кровяные выделения и у 20% менструации остаются регулярными. В то же время, у четверти женщин кровотечения становятся длительными и/или обильными [12]. По характеру кровяных выделений в первый 90-дневный период использования имплантата можно прогнозировать профиль кровяных выделений в дальнейшем с учетом того, что у большинства женщин количество дней и обильность кровотечения уменьшаются [12–14].
Доказано, что все происходящие изменения эндометрия при применении чистогестагенной пролонгированной контрацепции не несут в себе никакого риска, а, наоборот, обеспечивают его защиту от развития пролиферативных заболеваний [7, 15, 16]. Тем не менее, нерегулярные маточные кровотечения являются основной причиной прекращения пользования методом: каждая четвертая женщина в течение года отказывается от инъекционной контрацепции [8] и каждая десятая – от имплантационной [12].
Механизм развития маточных кровотечений при применении методов гормональной контрацепции существенно отличается от менструального. Менструальное кровотечение возникает из глубоких спиральных артерий матки и обусловлено отторжением толстого пролиферированного и секреторно трансформированного эндометрия под влиянием эндогенных стероидных гормонов [17, 18].
Гормональные методы предохранения от беременности, содержащие синтетические производные эстрогенов и прогестерона, предотвращают утолщение эндометрия, поэтому он остается тонким на протяжении всего периода использования контрацептивных средств.
При циклическом режиме приема контрацептивов, в котором назначаются комбинированные эстроген-гестагенные методы, менструальноподобное кровотечение происходит в ответ на отмену действия синтетических стероидов и кратковременное повышение секреции эндогенных гормонов [15, 18].
В отличие от комбинированных методов чистогестагенные контрацептивы назначаются в непрерывном режиме, поэтому условия для возникновения регулярных менструальноподобных кровотечений отмены исключаются, в результате контроль цикла нарушается. Механизм развития нерегулярных маточных кровотечений обусловлен длительным непрерывным воздействием синтетического гестагена на структуры эндометрия [19]. В результате целого ряда клеточных и молекулярных механизмов происходят атрофические изменения в эндометрии с повреждением стромальных и сосудистых структур. Появляется сеть мелких тонкостенных расширенных поверхностных капилляров и вен с плохорегенерируемым и легкотравмируемым покрывающим их эпителием. Причины повышения ломкости сосудов и разрушения эпителия многообразны. Доминирующими среди них считаются: уменьшение количества эстрогеновых рецепторов в матке; повышение активности матриксных металлопротеаз и выработки цитокинов; нарушение активности сосудистого эндотелиального фактора роста, тканевого фактора и оксида азота; снижение образования эпителиального цитокератина, увеличение количества и изменение функции лейкоцитов в эндометрии [18–27]. В то же время индивидуальной зависимости между уровнем прогестероновых и эстрогеновых рецепторов в матке, сосудистого эндотелиального фактора роста и состоянием эндотелиальных структур с характером маточных кровотечений не выявлено [20].
Длительные кровотечения возникают также вследствие неспособности мелких сосудов к сокращению, т. к. в их стенках отсутствует мышечный слой, обеспечивающий спазм глубоких спиральных артерий матки при менструальном кровотечении. Также этому способствует спазмолитическое и антикоагулянтное действие синтетических прогестагенов, что приводит к вазодилатации маточных сосудов, и за счет подавления агрегации тромбоцитов – к ухудшению процессов тромбообразования [26, 27].
Для оценки профиля маточных кровотечений при применении методов гормональной контрацепции экспертами ВОЗ рекомендуется использовать 90-дневные интервалы [28]. При нормальном менструальном цикле за 90-дневный промежуток происходит 3–5 эпизодов маточных кровотечений. Меньшее число эпизодов за этот период считается редкими кровотечениями, более 5 – частыми. Отсутствие менструаций в течение 3 мес. называется аменореей. Длительными кровотечениями называются эпизоды кровяных выделений длительностью не менее 14 дней. Нередко имеют место нерегулярные маточные кровотечения, которые проявляются различными комбинациями вышеперечисленных видов кровотечений.
При нормальной реакции эндометрия на непрерывное воздействие чистогестагенного контрацептива длительность кровяных выделений не превышает 21 день за 90-дневный интервал. При частых и/или длительных кровотечениях в этот период в первую очередь необходимо исключить другие возможные причины их возникновения, такие как:
• беременность;
• патология шейки матки;
• инфекции, передаваемые половым путем;
• гиперплазия эндометрия;
• миома матки;
• эндокринные нарушения (гипотиреоз, тиреотоксикоз, гиперпролактинемия);
• курение;
• прием противоэпилептических средств [7, 12, 29, 30].
Рекомендуемый список дополнительного медицинского обследования при частых и/или длительных маточных кровотечениях у женщин, использующих чистогестагенные методы контрацепции, включает:
• тщательный сбор анамнеза;
• выявление жалоб на диспареунию, боли внизу живота, посткоитальные кровяные выделения;
• бимануальное исследование;
• осмотр шейки матки в зеркалах;
• тест на беременность;
• трансвагинальное ультразвуковое сканирование органов малого таза;
• цервикальный скрининг (цитологические исследования, по показаниям – биопсия шейки матки);
• скрининг на инфекции, передаваемые половым путем;
• биопсия эндометрия, гистероскопия (проводится у всех женщин старше 45 лет; у женщин моложе 45 лет – при наличии факторов риска рака эндометрия: ожирение, синдром поликистозных яичников, лечение тамоксифеном) [7, 30].
В международных руководствах [7, 16, 30] указывается, что после исключения дополнительных факторов риска и при продолжающихся более 3 мес. частых и/или длительных маточных кровотечениях требуется проведение мероприятий по их купированию. Коррекция нерегулярных кровотечений ранее 3 мес. не рекомендуется, т. к. в большинстве случаев их интенсивность постепенно уменьшается без медикаментозного вмешательства.
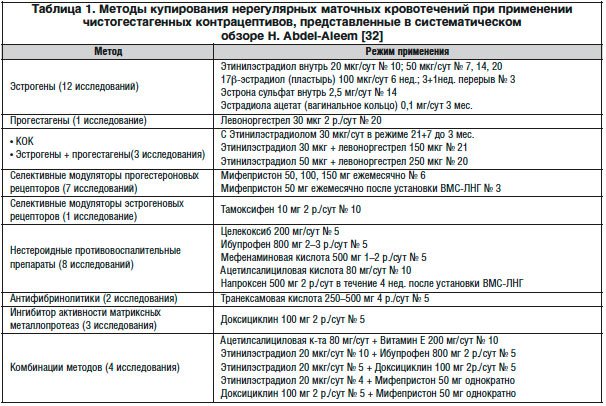
Методы купирования нерегулярных маточных кровотечений при применении чистогестагенных методов контрацепции представлены в Кокрановском систематическом обзоре, впервые опубликованном в 2007 г. [31] и обновленном в 2013 г. [32] группой ученых во главе с Н. Abdel-Aleem (табл. 1). В него вошли результаты 33-х рандомизированных плацебо-контролируемых исследований с участием 3677 женщин, использующих чистогестагенные методы контрацепции. Был проведен систематический анализ эффективности следующих методов купирования маточных кровотечений:
– эстрогены;
– комбинированные пероральные контрацептивы;
– прогестагены;
– нестероидные противовоспалительные препараты (НПВП);
– селективные модуляторы прогестероновых рецепторов (мифепристон);
– селективные модуляторы эстрогеновых рецепторов (тамоксифен);
– антифибринолитики (транексамовая кислота);
– витамины Е и С;
– венотоники;
– доксициклин.
Полученные результаты показали, что весь реестр включенных в исследование лекарственных средств, за исключением витаминов и венотоников, может использоваться для остановки развившегося неадекватного маточного кровотечения при применении методов чистогестагенной контрацепции [32]. В то же время, при профилактическом приеме их эффективность не была доказана, хотя некоторые обнадеживающие результаты получены [33, 34].
Наибольшее количество исследований (n=12) по купированию нерегулярных маточных кровотечений у пользователей чистогестагенной контрацепции посвящено использованию эстрогенов. Эстрогены применялись в таблетированных формах, содержащих этинилэстрадиол в суточной дозе 50 мкг или 2,5 мг эстрона сульфата, также использовался накожный пластырь, выделяющий 100 мкг 17β-эстрадиола в сутки, и вагинальное кольцо с эстрадиола ацетатом в дозе 50 мкг/сут. Высокоэффективными оказались также сочетания этинилэстрадиола и левоноргестрела [22, 35], хотя при применении левоноргестрела без эстрогенов был получен неоднозначный эффект [24].
Известно, что высокие дозы этинилэстрадиола неблагоприятно влияют на желудочно-кишечный тракт и сопряжены с высоким риском тромбофилических осложнений [4]. Поэтому международные эксперты [7, 13, 16] рекомендуют использовать только низкодозированные комбинированные контрацептивы, содержащие 30–35 мкг этинилэстрадиола, в качестве препаратов первой линии для купирования нерегулярных кровотечений при применении чистогестагенной контрацепции. Длительность их назначения в циклическом или непрерывном режиме составляет до 3 мес.
Широко применяются для лечения нерегулярных кровотечений короткие курсы НПВП (ибупрофен, мефенаминовая кислота, целекоксиб, ацетилсалициловая кислота, напроксен) [22, 24, 36]. Они подавляют синтез простагландинов, простациклина и других факторов свертывания путем блокирования фермента циклооксигеназы, что приводит к повышению коагуляционного потенциала крови в сосудах эндометрия. Однако в сочетании с чистогестагенной контрацепцией эффективность их вариабельна, составляя, по разным данным, от 50 до 70% [24, 37, 38].
Селективный модулятор прогестероновых рецепторов мифепристон также продемонстрировал свою эффективность для уменьшения интенсивности маточного кровотечения в результате его активирующего влияния на экспрессию эстрогеновых рецепторов в эндометрии [39]. С другой стороны, этот эффект является антагонистическим с прогестагенами, содержащимися в контрацептиве, что снижает надежность метода предохранения от нежелательной беременности, поэтому эксперты ВОЗ не рекомендуют мифепристон для рутинного использования [16].
Другим патогенетическим способом купирования эпизода кровотечений при приеме чистогестагенной контрацепции является ингибирование активности матриксных металлопротеаз, разрушающих сосудистую стенку, которое обеспечивает антибиотик доксициклин [40]. Кровоостанавливающее действие также оказывает 10-дневный курс приема селективного модулятора эстрогеновых рецепторов тамоксифена [41], антифибринолитическое средство – транексамовая кислота [42], а также различные комбинации вышеперечисленных методов [39].
Как показали проведенные нами исследования [43], одним из факторов риска развития частых и/или длительных маточных кровотечений при применении чистогестагенной контрацепции является дефицит фолатов. Важнейшей функцией фолатов является участие в синтезе и репликации клеточных ДНК, обеспечивая деление и нормальный рост всех клеток организма [44]. Дефицит фолатов в первую очередь отражается на быстропролиферирующих клетках, к которым относятся эпителиальные, эмбриональные и кроветворные. Так, повреждение регенерации эпителиальной ткани может привести к злокачественным заболеваниям, нарушение эмбриогенеза вызывает пороки развития у плода и осложненное течение беременности, воздействие на гемопоэз нарушает деление кроветворных клеток [44].
Причиной дефицита фолатов может быть недостаточное их потребление с пищей, нарушение всасывания при заболеваниях кишечника, курение, алкоголь, прием гормональных контрацептивных средств. Кроме того, фолатдефицит может иметь наследственный характер при наличии полиморфизма гена основного фермента фолатного цикла метилентетрагидрофолатредуктазы (МТГФР). Снижение функции данного фермента нарушает образование метаболически активных форм фолатов, обеспечивающих циклы репликации ДНК и метилирования, в т. ч. в кроветворных клетках [47–50]. В результате происходит замена нормобластного типа кроветворения на мегалобластный, при котором уменьшается количество и увеличивается объем клеток крови, а также вследствие укорочения периода жизни таких клеток в циркулирующей крови и более быстрого разрушения в костном мозге нарушается их функциональная активность [45, 46].
При обследовании 51 женщины с полиморфизмом гена МТГФР у большинства из них (54%) мы обнаружили повреждение тромбоцитарного звена гемопоэза, которое проявлялось умеренной тромбоцитопенией от 105 до 180x109/л в сочетании с признаками функциональной недостаточности тромбоцитов: нарушением агрегации и снижением адгезивности тромбоцитов, удлинением активированного частичного тромбинового времени, времени кровотечения. При этом наследственные и аутоиммунные формы тромбоцитопатий, такие как идиопатическая тромбоцитопеническая пурпура, болезнь Виллебранда и др., были исключены.
Изучение анамнеза у женщин с полиморфизмом гена МТГФР показало высокую частоту акушерских и гинекологических кровотечений. Так, у половины (49%) из них имели место аномальные маточные кровотечения, преимущественно в виде обильных и/или длительных менструаций, у 9 из 10 отмечалось кровотечение во время беременности и у каждой пятой – кровотечение после родов или аборта.
Одним из хорошо известных проявлений мегалобластного пути кроветворения является мегалобластная фолиеводефицитная анемия [45]. Лабораторные признаки анемии имели 37% обследованных женщин (n=19) с полиморфизмом гена МТГФР. Причем в абсолютном большинстве случаев (n=16) снижался только уровень гемоглобина (до 90–110 г/л), тогда как количество эритроцитов находилось в пределах нормы. Характерные для мегалобластного типа кроветворения макроцитоз и гиперхромия эритроцитов отмечались только у трех женщин. Значимых изменений лейкоцитарного звена мы также не обнаружили. Таким образом, мы пришли к заключению, что наиболее выраженное повреждающее влияние фолатдефицит оказывает на тромбоцитарное звено гемопоэза, что, по нашему мнению, обусловило высокую частоту акушерских и гинекологических кровотечений у женщин с полиморфизмом гена МТГФР [43].
Кроме того, с фолатдефицитом традиционно связывают акушерские осложнения [51, 52]. Так, 39% наших пациенток страдали бесплодием, 30% – имели неразвивающуюся беременность в анамнезе, 10% – преэклампсию в предыдущую беременность, 6% – пороки развития плода. Все полученные показатели значительно превышали данные в общей популяции [51].
Такую же акушерско-гинекологическую ситуацию мы наблюдали у женщин с частыми и/или длительными маточными кровотечениями на фоне применения чистогестагенной пролонгированной контрацепции. Мы обследовали 155 женщин в возрасте 17–45 лет, которым в 2012–2014 гг. установили подкожный имплантат с этоногестрелом (Импланон или Импланон НКСТ). У 25 (17%) отмечались частые и/или длительные маточные кровотечения продолжительностью более 3 мес. При этом у всех имелся отягощенный акушерско-гинекологический анамнез: аномальные маточные кровотечения – у 92% женщин, невынашивание – у 32%, преждевременные роды и/или антенатальная гибель плода – у 20%, преэклампсия – у 8%. При дальнейшем обследовании во всех случаях был выявлен полиморфизм гена МТГФР и тромбоцитопатия, в 76% – гипергомоцистеинемия, что также является свидетельством дефицита фолиевой кислоты в организме [48–50]. Всем женщинам с неудовлетворительным контролем цикла после исключения других возможных причин нерегулярных маточных кровотечений [7, 13] назначались различные представленные ранее методы коррекции [32]. В 14 случаях (9% среди всех установивших гормональную рилизинг-систему) положительного эффекта достигнуть не удалось, что привело к досрочному удалению контрацептива через 4–18 мес. после установки.
У 11 женщин купирование маточных кровотечений проводилось низкодозированными пероральными контрацептивами, содержащими 30 мкг этинилэстрадиола и 150 мкг левоноргестрела, в сочетании с дополнительным ежедневным приемом поливитаминно-минерального комплекса фемибион, в состав которого входит 400 мкг фолатов: 200 мкг фолиевой кислоты и 200 мкг метафолина. Метафолин является метаболически активным фолатом и, в отличие от синтетической фолиевой кислоты, поступает в организм без участия фермента МТГФР, функция которого при генетическом полиморфизме существенно снижена [48]. В результате происходит более быстрое восполнение дефицита фолатов в организме и восстановление активности тромбоцитарного звена гемостаза, основной функцией которого является поддержание нормальной структуры и функции стенки микрососудов, тромбообразование в поврежденном сосуде (адгезия, агрегация тромбоцитов) и ингибирование процессов фибринолиза. Во всех случаях проводимого комбинированного лечения была отмечена нормализация контроля цикла в течение 1–3 нед.
У 7 женщин мы выявили полиморфизм гена МТГФР и тромбоцитопатию (у 5 – в сочетании с гипергомоцистеинемией) еще до начала использования имплантационной контрацепции. Все они страдали обильными менструациями и имели отягощенный акушерский анамнез (самопроизвольный выкидыш – 7 женщин, преждевременные роды – 2, преэклампсия – 1). В этих случаях фемибион был назначен за 6–8 нед. до установки гестагенсодержащей подкожной рилизинг-системы с последующим длительным приемом на фоне использования контрацептивного метода. Ни в одном случае мы не наблюдали патологических маточных кровотечений в течение всего периода наблюдения, который составил от 4 до 18 мес.
В заключение нужно отметить, что универсального средства для предотвращения нерегулярных маточных кровотечений у женщин, использующих чистогестагенные контрацептивы, не существует, поэтому исследования в этом направлении продолжаются [32]. Информирование женщины о возможном изменении менструального цикла необходимо проводить еще до назначения контрацептива и объяснять безопасность изменений, происходящих в ее организме. Профессиональные консультации опытного врача способствуют значительному повышению комплаентности пользования гормональными методами предохранения от беременности и являются такими же важными, как правильное использование контрацептивного средства [53].
Литература
1. Trussel J., Henry N., Hassan F. et al. Burden of unintended pregnancy in the United States: potential savings with increased use of long-acting reversible contraception // Contraception. 2013. Vol. 87. P. 154–164.
2. American College of Obstetricians and Gynecologists: Long-acting reversible contraception: Implants and intrauterine devices // Obstet. Gynecol. 2011. Vol. 118. P. 184–191.
3. Winner B., Peipert J.F., Zhao Q. et al. Effectiveness of long-acting reversible contraception // N. Engl. J. Med. 2012. Vol. 366. P. 1998–2011.
4. WHO. Medical eligibility criteria for contraceptive use. Fouth edition, 2009. 125 p.
5. Allen R.H., Cwiak C.A., Kaunitz A.M. Contraception in women over 40 years of age // CMAJ. 2013. Vol. 185. P. 565–570.
6. Brito M.B., Ferriani R.A., Quintana S.M. et al. Safety of the etonogestrel-releasing implant during the immediate postpartum period: a pilot study // Contraception. 2009. Vol. 80. P. 519–526.
7. Faculty of Sexual and Reproductive Health Care. Management of unscheduled bleeding in women using hormonal contraception, 2009 http://www.fsrh.org/pdfs/unscheduledbleedingmay09.pdf
8. Darney P. Bleeding patterns shift to amenorrhea with continued use of subcutaneous or intramuscular depot medroxyprogesterone acetate // Obstet. Gynecol. 2005. Vol. 105(4). P. 54–63.
9. National Institute for Health and Clinical Excellence (NICE).Long-Acting Reversible Contraception: The Effective and Appropriate Use of Long-Acting Reversible Contraception. 2005. http://www.nice.org.uk/Guidance/CG30
10. Baldszti E., Wimmer-Puchinger B., Loschke K. Acceptability of the long-term contraceptive levonorgestrel-releasing intrauterine system (Mirena): a 3-year follow-up study // Contraception. 2003. Vol. 67. P. 87–91.
11. Sangkomkamhang U.S., Lumbiganon P., Laopaiboon M., Mol B.W. Progestogens or progestogen-releasing intrauterine systems for uterine fibroids // Cochrane Database Syst. Rev. 2013; 2:CD008994.
12. Mansour D., Korver T., Marintcheva-Petrova M. The Effects of IMPLANON® on Menstrual Bleeding Patterns. Eur J of Contracept Reprod // Health Care. 2008. Vol. 13(S1). P. 13–28.
13. Mansour D., Bahamondes L., Critchley H. et al. The management of unacceptable bleeding patterns in etonogestrel-releasing contraceptive implant users // Contraception. 2011. Vol. 83. P. 202–210.
14. d'Arcangues C. Management of vaginal bleeding irregularities induced by progestin-only contraceptive // Hum. Reprod. 2000. Vol. 3. P. 24–29.
15. ESHRE Capri Workshop Group. Ovarian and endometrial function during hormonal contraception // Hum. Reprod. 2001. Vol. 16(7). P. 1527–1535.
16. Brache V. Treatment of vaginal bleeding irregularities induced by progestin-only contraceptives: RHL commentary (last revised: 11 September 2007). The WHO Reproductive Health Library; Geneva: World Health Organization.
17. Jabbour H.N., Kelly R.W., Fraser H.M., Critchley H.O.D. Endocrine regulation of menstruation // Endocr. Rev. 2006. Vol. 27. P. 17–46.
18. Critchley H.O., Kelly R.W., Baird D.T., Brenner R.M. Regulation of human endometrial function: mechanisms relevant to uterine bleeding // Reprod. Biol. Endocrinol. 2006. Vol. 4(1). P. 5–14.
19. Smith O.P., Critchley H.O. Progestogen only contraception and endometrial break through bleeding // Angiogenesis. 2005. Vol. 8. P. 117–126.
20. Charnock-Jones D.S., Macpherson A.M., Archer D.F. et al. The effect of progestins on vascular endothelial growth factor, oestrogen receptor and progesterone receptor immunoreactivity and endothelial cell density in human endometrium // Hum. Reprod. 2000. Vol. 15. P. 85–95.
21. Cheng L., Zhu H., Wang A. et al. Once a month administration of mifepristone improves bleeding patterns in women using subdermal contraceptive implants releasing levonorgestrel // Hum. Reprod. 2000. Vol. 15. P. 1969–1972.
22. Alvarez-Sanchez F., Brache V., Thevenin F. et al. Hormonal treatment for bleeding irregularities in Norplant implant users // Amer. J. Obstetrics and Gynecol. 1996. Vol. 174. P. 919–922.
23. Vincent A.J., Salamonsen L.A. The role of matrix metalloproteinases and leukocytes in abnormal uterine bleeding associated with progestin-only contraceptives // Hum. Reprod. 2000. Vol. 15. P. 135–143.
24. Diaz S., Croxatto H.B., Pavez M. et al. Clinical assessment of treatments for prolonged bleeding in users of Norplant implants // Contraception. 1990. Vol. 42. P. 97–109.
25. Labied S, Galant C, Nisolle M, et al. Differential elevation of matrix metalloproteinase expression in women exposed to levonorgestrel-releasing intrauterine system for a short or prolonged period of time // Hum. Reprod. 2009. Vol. 24(1). P. 113–121.
26. Livingstone M., Fraser I.S. Mechanisms of abnormal uterine bleeding // Hum. Reprod. Update. 2002. Vol. 8. P. 60–78.
27. Hickey M., d’Arcangues C. Vaginal bleeding disturbances and implantable contraceptives // Contraception. 2002. Vol. 65. P. 75–84.
28. Fraser I.S. Bleeding arising from the use of exogenous steroids. Baillieres Best Pract Res // Clin. Obstet. Gynaecol. 1999. Vol. 13. P. 203–222.
29. Shapley M., Jordon J., Croft P.R. A systematic review of postcoital bleeding and cervical cancer // Br. J. Gen. Pract. 2006. Vol. 56. P. 453–460.
30. National Institute for Health and Clinical Excellence (NICE). Heavy Menstrual Bleeding (NICE Clinical Guideline 44). 2007. http://www.nice.org.uk/nicemedia/pdf/CG44NICEGuideline.pdf
31. Abdel-Aleem H., d’Arcangues C., Vogelsong K. et al. Treatment of vaginal bleeding irregularities induced by progestin only contraceptives // Cochrane Database Syst. Rev. 2007(4). CD003449.
32. Abdel-Aleem H., d'Arcagues C., Vogelsong K.M. et al. Treatment of vaginal bleeding irregularities induced by progestin only contraceptives // Cochrane Database Syst. Rev. 2013. 10:CD003449.
33. Dempsey A., Roca C., Westhoff C. Vaginal estrogen supplementation during Depo-Provera initiation: a randomized controlled trial // Contraception. 2010. Vol. 82. P. 250–255.
34. Madden T, Proehl S, Allsworth JE, et al. Naproxen or estradiol for bleeding and spotting with the levonorgestrel intrauterine system: a randomized controlled trial // Amer. J. Obstet. Gynecol. 2012. Vol. 206 (2). P. 129–138.
35. Sadeghi-Bazargani H., Ehdaeivand F., Arshi S. et al. Low-dose oral contraceptive to re-induce menstrual bleeding in amenorrheic women on DMPA treatment: A randomized clinical trial // Med. Science Monitor. 2006. Vol. 12. P. 420–425.
36. Archer D.F., Philput C.B., Levine A.S. et al. Effects of ethinyl estradiol and ibuprofen compared to placebo on endometrial bleeding, cervical mucus and the postcoital test in Levonorgestrel subcutaneous implant users // Contraception. 2008. Vol. 78. P. 106–112.
37. Buasang K., Taneepanichskul S. Efficacy of celecoxib on controling irregular uterine bleeding secondary to Jadelle use // J. Med. Assoc. Thai. 2009. Vol. 92. P. 301–307.
38. Phaliwong P., Taneepanichskul S. The effect of Mefenamic acid on controlling irregular uterine bleeding second to Implanon use // J. Med. Assoc. Thai. 2004. Vol. 87 (Suppl. 3). P. 64–68.
39. Weisberg E., Hickey M., Plamer D. et al. A randomized controlled trial of treatment options for troublesome uterine bleeding in Implanon users // Hum. Reprod. 2009. Vol. 24. P. 1852–1856.
40. Abdel-Aleem H., Shaaban O.M., Abdel-Aleem M.A., Fetih G.N. Doxycycline in the treatment of bleeding with DMPA: a double-blinded randomized controlled trial // Contraception. 2012. Vol. 86. P. 224–230.
41. Abdel-Aleem H., Shaaban O.M., Amin A.F., Abdel-Aleem A.M. Tamoxifen treatment of bleeding irregularities associated with Norplant use // Contraception. 2005. Vol. 72. P. 432–437.
42. Senthong A., Taneepanichskul S. The effect of Tranexamic acid for treatment irregular uterine bleeding secondary to DMPA use // J. Med. Assoc. Thai. 2009. Vol. 92. P. 461–465.
43. Пустотина О.А., Ахмедова А.А. Роль фолатов в развитии осложнений беременности // Эффективная фармакотерапия в акуш. и гинекол. 2014. № 3. С. 66–74.
44. Crider K.S., Yang T.P., Berry R.J., Bailey L.B. Folate and DNA methylation: a review of molecular mechanisms and the evidence for folate’s role // Adv. Nutr. 2012. Vol. 3(1). P. 21–38.
45. Шехтман М.М. Руководство по экстрагенитальной патологии у беременных. 5-е изд. М.: Триада-Х, 2011. 896 с.
46. Morris M.S., Jacques P.F., Rosenberg I.H., Selhub J. Circulating unmetabolized folic acid and 5-methyltetrahydrofolate in relation to anemia, macrocytosis, and cognitive test performance in American seniors // Am. J. Clin. Nutr. 2010. Vol. 91. P. 1733–1744.
47. Puri M., Kaur L., Walia G.K. et al. MTHFR C677T polymorphism, folate, vitamin B12 and homocysteine in recurrent pregnancy losses: a case control study among north Indian women // J. Perinat. Med. 2013. Vol. 41(5). P. 549–554.
48. Prinz-Langenohl R., Bramswig S., Tobolski O. et al. (6S)-5-methyltetrahydrofolate increases plasma folate more effectively than folic acid in women with the homozygous or wild-type 677C,T polymorphism of methylenetetrahydrofolate reductase // Br. J. Pharmacol. 2009. Vol. 158. P. 2014–2021.
49. Pietrzik K., Bailey L., Shane B. Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics // Clin. Pharmacok. 2010. Vol. 49(8). P. 535–548.
50. Holm P.I., Hustad S., Ueland P.M. et al. Modulation of the homocysteine-betaine relationship by methylenetetrahydrofolate reductase 677 C genotypes and B-vitamin status in a large-scale epidemiological study // J. Clin. Endocrinol. Metab. 2007. Vol. 92. P. 1535–1541.
51. Vollset S.E., Refsum H., Irgens L.M. et al. Plasma total homocysteine, pregnancy complications, and adverse pregnancy outcomes: the Hordaland Homocysteine study // Am. J. Clin. Nutr. 2000. Vol. 71. P. 962–968.
52. Fekete K., Berti C., Trovato M. et al. Effect of folate intake on health outcomes in pregnancy: a systematic review and meta-analysis on birth weight, placental weight and length of gestation // Nutr. J. 2012. Vol. 11. P. 75–86.
53. Lopez L.M., Steiner M., Grimes D.A. et al. Strategies for communicating contraceptive effectiveness // Cochrane Database Syst. Rev. 2013.Vol. 4:CD006964.












