Миома матки одно из наиболее распространенных доброкачественных опухолевых заболеваний половой системы, которое диагностируется у 20–30% женщин репродуктивного возраста.
Характерные клинические проявления роста и развития миомы матки нередко сопровождаются повышением менструальной кровопотери, иногда и маточными кровотечениями, которые ряд исследователей считают «дисфункциональными», в основном зависящими от «нейроэндокринных расстройств» [4]. Другие – связывают генез патологической кровопотери, прежде всего с ростом и локализацией узлов опухоли, а также с нейроэндокринными и гуморальными сдвигами, вызывающими глубокие метаболические нарушения [9]. Маточные кровотечения, не прекращающиеся после неоднократных выскабливаний слизистой матки, гормонотерапии и других консервативных методов лечения часто создают проблемы, как для больной, так и для врача. Повторяющиеся обильные кровопотери чаще всего связаны с субмукозной или интерстициальной миомой и требуют оперативного лечения, несмотря на то, что матка может и не достигать больших размеров. Клиницисты считают это показанием для срочного оперативного лечения [6]. Хроническая постгеморрагическая анемия фигурирует среди показаний к гистеректомии более чем у 70% больных страдающих миомой [9]. Хорошо известно, что ЖДА часто является тем патологическим фоном, на котором возникают осложнения при оперативном лечении: возникает риск увеличения кровопотери во время операции и инфекционных осложнений в послеоперационном периоде, длительность послеоперационного периода и время заживления раны, что является одним из важных моментов, влияющих на положительный результат лечения.
Главной и очевидной причиной развития ЖДА у больных с миомой матки является патологическая кровопотеря из пораженного болезнью органа. Поэтому, патогенетическим лечением ЖДА у больных с миомой следует считать хирургическое удаление источника кровотечения – матки.
Однако патогенетическое лечение анемии у больных с миомой матки, нередко представляет трудно выполнимую задачу, так как на фоне рецидивирующих менометроррагий, формируется порочный круг, когда из–за тяжести состояния больной – нет условий для удаления матки, а лечение анемии, за короткий период до начала очередного кровотечения – неэффективно.
Таким образом, в лечение ЖДА у больных с миомой матки целесообразно выделять 2 этапа. Задача первого этапа – это устранение ЖДА, которая является следствием кровопотери, за короткий срок (2–3 недели), с целью подготовки к операции. Задача второго этапа – это удаление матки или миоматозного узла, которые являются причиной кровопотери.
В настоящее время оперативному лечению миомы матки уделяется большое внимание, что способствует его совершенствованию. Существуют модификации оперативного доступа, что позволяет индивидуально подбирать наиболее приемлемый метод. При выборе объема оперативного вмешательства и доступа (лапаротомия–лапароскопия) приходится брать во внимание степень анемизации, размер опухоли, клиническую картину заболевания, локализацию миоматозного узла, возраст пациентки, наличие невынашивания беременности и желание женщины иметь детей [13,14].
Больным с миомой матки производят радикальные и консервативные операции. К каждому из этих методов имеются показания и противопоказания.
На сегодняшний день имеется большое количество публикаций, сообщающих, что обоснованным является следующий подход – у женщин младших возрастных групп лечение миомы матки необходимо начинать с применения комплекса малой функциональной хирургии сразу же после обнаружения опухолевых узлов, независимо от их размеров [9].
Использование современной лапароскопической хирургии может позволить произвести полноценное хирургическое вмешательство функционального характера минимум у 80% больных.
По сравнению с лапаротомией (ЛТ), при лапароскопии (ЛС) затрачивается меньше времени, меньше кровопотеря, ниже процент послеоперационных осложнений. Минимизация тотальной хирургической травмы за счет исключения нарушения целостности передней брюшной стенки, сведения к минимуму операционной кровопотери, исключение травматизации петель кишечника салфетками, профилактика «высыхания» брюшины – все это позволяет хирургу добиться более гладкого течения послеоперационного периода и ускоренной реабилитации больных с миомой матки, осложненной анемией [9,13,14].
Многие клиницисты отмечают, что в послеоперационном периоде после ЛС, в отличие от ЛТ, значительно снижается потребность в лекарственных препаратах, анальгетиках и антибиотиках.
Однако необходимо учитывать противопоказания к проведению ЛС при миоме матки – диаметр миоматозного узла более 10 см, расположение узла в перешеечной или шеечной области. Показанием к миомэктомии ЛС– доступом является наличии небольших, (не более 2,5–5,0 см) преимущественно субсерозных или интерстициальных узлов, локализованных в теле и дне матки. Часть показаний к ЛС надвлагалищной ампутации матки или экстирпации матки при наличии одиночных и сравнительно небольших субмукозных узлов может быть заменена на гистерорезектоскопический метод лечения [13,14].
Практически все исследователи придерживаются той точки зрения, что чем больше объем патологического процесса в матке, тем тяжелее и опаснее становится операция, тем сложнее эвакуировать удаленный орган из брюшной полости, тем больше операционная кровопотеря, продолжительность операции и тем меньше ее преимущества перед типичной ЛТ техникой [9].
Основой терапии ЖДА является применение лекарственных препаратов железа внутрь. Необходимо, чтобы суточная доза двухвалентного железа (всасывается только двухвалентное железо) составляла 100–300 мг. В связи с этим при выборе препарата железа и определении суточной его дозировки следует ориентироваться не только на общее содержание в нем железа, но и на количество двухвалентного железа, содержащегося в данном препарате. Рекомендуемыми препаратами железа для перорального применения в настоящее время являются: «Ферро–Фольгамма» (Германия), «Тардиферон» (Швейцария), «Сорбифер Дурулес»(Венгрия), «Мальтофер» (Швейцария), «Феррум–лек» (Швейцария), «Фенюльс» (Индия), «Ферретаб», «Ферлатум» (Италия), «Хеферол», «Актифферин», «Гино–тардиферон» (Швейцария). Из парентеральных препаратов приемлем «Венофер» (Швейцария) для внутривенного введения, представляющий собой железо в форме гидроксид сахарозного комплекса.
Предпочтительнее назначение препаратов с более высоким содержанием двухвалентного железа в связи с удобством приема для больных (1–2 раза в сутки вместо 3–4 раз). Входящие в состав многих лекарственных форм аскорбиновая и янтарная кислоты, фруктоза, цистеин, мальтоза и другие усиливают всасывание железа. Для лучшей переносимости препараты железа следует принимать во время еды [5].
Удачным препаратом железа является «Ферро–Фольгамма» – мультифакторный гемопоэтик, включающий, все необходимые компоненты, обеспечивающие стимуляцию структурного синтеза гемоглобина (Hb) и повышающие репродукцию эритроцитов красным ростком костного мозга. Универсальность препарата связана с его избирательно–стимулирующим действием на синтез железосодержащей и белковой частей Hb. Так, сульфат железа обладает высоким коэффициентом всасывания в желудочно–кишечном тракте и практически не образует в последнем малодоступных сложных соединений. Абсорбционный эффект в значительной степени усилен присутствием в препарате аскорбиновой кислоты. Ранее нами была выявлена высокая эффективность применения Ферро–Фольгаммы в акушерской практике [7].
Прием препаратов железа в достаточной дозировке у больных миомой матки и ЖДА начинается, как правило, до операции и продолжается после хирургического устранения причины кровотечения. Длительность приема препаратов железа определяется степенью тяжести ЖДА и дефицита железа в организме, объемом кровопотери при месячных, в случае сохранения менструальной функции после операции. В среднем, прием железа непрерывно должен осуществляться не менее 3 месяцев.
Так как анемия нередко сопровождается гипопротеинемией, угнетением иммунной системы, обмена электролитов, снижением активности ряда ферментов многие клиницисты рекомендуют наряду с терапией препаратами железа и витаминотерапией назначать диету с целью восполнения дефицита белка, железа, микроэлементов, витаминов.
В последние годы в современной отечественной и зарубежной литературе все чаще звучит мнение о том, что традиционная терапия препаратами железа имеет побочные эффекты чаще всего со стороны желудочно–кишечного тракта, и зачастую не дает желаемого результата, а так же прием препаратов должен проводится длительное время [1,5].
Наиболее рационально проведение антианемической терапии в предоперационном периоде за короткие сроки, так как очередная менометроррагия снижает ее эффективность.
Гемотрасфузии в настоящее время в гинекологической практике, по понятным причинам, производятся в редких случаях и только по жизненным показаниям.
В последние годы, благодаря накопленному в мире опыту по применению у больных с анемией различного генеза человеческого рекомбинантного эритропоэтина (РЭПО) начались исследования, направленные на изучение перспектив применения его в гинекологии. В настоящее время многие исследователи считают лечение анемии рекомбинантным эритропоэтином альтернативой традиционным видам терапии. [10,12].
По своему биологическому действию эритропоэтин (ЭПО) соответствует гормонам: он вырабатывается в почках и оказывает свой стимулирующий эффект на отдаленный орган – костный мозг. ЭПО является уникальным белком. Он способствует пролиферации ранних эритроидных предшественников, поддерживает выживание (препятствует апоптозу) поздних стадий до их созревания, оказывает стимулирующий эффект на синтез Hb и на включение железа клетками костного мозга [8].
В последние годы РЭПО широко используется у больных с анемией различного генеза. В последнее десятилетие появились работы об успешном применении РЭПО для профилактики и лечения анемий у новорожденных, беременных и родильниц [8].
Накоплен опыт применения РЭПО с достижением хороших результатов при подготовке пациентов с анемией к обширным хирургическим вмешательствам (ортопедия, онкология), для стимуляции эритропоэза в послеоперационном периоде, при термических ожогах, в онкогематологии [8]. Применяют РЭПО и в гинекологии в основном для подготовки пациенток с ЖДА для операции [11].
Основной задачей лечения ЖДА у больных с миомой является устранение анемии за короткий срок, что позволило бы провести операцию в оптимальных условиях и с минимальным риском развития осложнений в пред– и послеоперационном периоде.
Патогенетическим обоснованием применение РЭПО у больных с миомой матки и ЖДА явилось недавнее открытие в 2003 году в НЦ АГ и П РАМН, в лаборатории клинической биохимии (руководитель проф. В.А. Бурлев) Синдрома Неадекватной Продукции Эритропоэтина в ответ на анемию у больных с миомой матки [2,3].
Определение в сыворотке ЭПО и адекватности его уровня относительно степени анемии у больных с миомой матки является необходимой процедурой для планирования терапии РЭПО. Только больным с неадекватной продукцией ЭПО в ответ на анемию следует проводить заместительную терапию с помощью стандартных доз РЭПО.
Технологией производства РЭПО обладает несколько фармацевтических компаний США, Германии, Швейцарии и Японии. Рекомбинантный человеческий эритропоэтин относится к числу дорогостоящих медикаментов. Производится за рубежом по лицензиям фирм «Амджен» и «Берингер» следующими компаниями: «Цилаг« Швейцария (препарат «Эпрекс»); «Орто» США, «Кирин–Амджен» Япония, «Чугаи» Япония, «Берингер–Манхейм» Германия (препарат «Рекормон»). Отечественными препаратами РЭПО являются «Эпокрин», выпускаемый ООО «Протеиновый контур» (Санкт–Петербург) и «Эритростим» (Москва).
Отечественные препараты РЭПО не уступают зарубежным аналогам, а по ряду свойств – превосходят их, что подтверждено клиническими исследованиями в России и за рубежом. Для определения активности ЭПО в сыворотке крови в Санкт–Петербурге предприятием «Протеиновый контур» выпускается набор для иммуноферментного анализа. Оценка адекватности продукции ЭПО на основе определения уровня ЭПО в сыворотке крови в сочетании с применением РЭПО у больных с анемией позволяет достигать наиболее оптимальных результатов лечения.
Важной составной и неотъемлемой частью лечения препаратами РЭПО является одновременное назначение достаточных доз элементарного железа.
Наш опыт применения «Эпокрина» в сочетании с препаратом железа Ферро–Фольгамма у больных с анемией и миомой матки в предоперационном и послеоперационном периодах показал его высокую эффективность [2,3].
Материал и методы. 33 женщины с железодефицитной анемией (ЖДА) накануне гистеректомии по поводу миомы матки получали 2 недели до операции препарат «Ферро–Фольгамму» (Вёрваг Фарма, Германия), содержащий сульфат железа 100 мг, цианокобаламин 10 мкг, фолиевую кислоту 5 мг, аскорбиновую кислоту 100 мг, по 1 капсуле 3–4 раза в день и РЭПО (препарат «Эпокрин» «Протеиновый контур» С–Петербург) из расчета: 30–40 МЕ/кг, 2–3 раза в неделю, подкожно. Hb, количество эритроцитов, Ht, ЭПО, железо, трансферрин сыворотки и коэффициент насыщения трансферрина железом (КНТ) определяли исходно, через 2 недели на фоне лечения и при выписке. В 1–ю группу вошло 19 больных с анемией легкой степени тяжести, во 2–ю 14 больных с ЖДА средней и тяжелой степени тяжести. Степень анемии оценивали по А.А. Митереву [1].
Результаты. Как следует из таблицы 1 и 2, в 1–ой и 2–ой группах было достоверное повышение гематологических показателей и КНТ через 2 недели после лечения и через 2 недели после операции по отношению к исходному уровню (p<0,001). Уровень сывороточного ЭПО, был достоверно ниже у больных со средней и тяжелой анемией по сравнению с больными с легкой анемией. ЭПО в сыворотке достоверно повысился в результате лечения РЭПО только у пациенток со средней и тяжелой анемией.

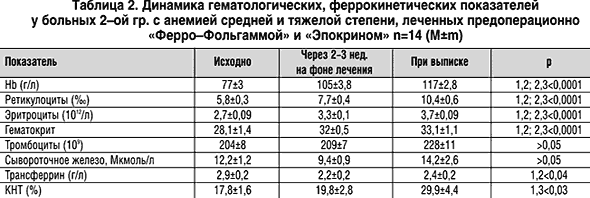
Выводы. При железодефицитной анемии у больных миомой матки развивается синдром неадекватной продукции эритропоэтина, степень выраженности которого зависит от тяжести анемии. Лечение ЖДА у больных миомой матки препаратами рекомбинантного эритропоэтина патогенетически обосновано и может применяться в клинической практике в сочетании с препаратами железа. Применение в предоперационном периоде «Эпокрина» в сочетании с препаратами железа у больных миомой матки и ЖДА, является быстрым и эффективным способом лечения ЖДА.
Таким образом, применение РЭПО в сочетании с насыщением организма железом – это новое, эффективное и патогенетически обоснованное направление в лечении анемии у больных с миомой матки.
Считаем, что применение препаратов рекомбинантного человеческого эритропоэтина – перспективное направление, качественно новый уровень в лечении железодефицитных анемий у больных миомой матки в предоперационном и послеоперационном периодах.
Наш опыт применения «Эпокрина» и «Ферро–Фольгаммы» у больных с анемией показал его высокую эффективность и позволил сформулировать основные принципы лечения ЖДА у больных с миомой матки.
Основные принципы лечения ЖДА у больных с миомой матки с применением препаратов рекомбинантального эритропоэтина
1. При хирургическом лечении больных миомой матки и ЖДА наиболее рационально применение эндоскопических методов лечения, в связи с меньшей травматичностью и кровопотерей, что повышает эффективность антианемической терапии.
2. Больным с миомой матки для лечения ЖДА особенно средней и тяжелой степени тяжести, в пред– и послеоперационном периоде следует применять препараты РЭПО, так как у них может развиваться синдром неадекватной продукции эритропоэтина в ответ на анемию, выраженность которого прямо пропорциональна степени тяжести анемии.
3. Противопоказаниями к назначению РЭПО являются неконтролируемая артериальная гипертензия; состояние после инсульта, инфаркта миокарда.
4. Оптимальным является последовательное применение РЭПО вначале в предоперационном, затем – в послеоперационном периоде, в дозе 60–85 МЕ/кг/неделю подкожно (разделить на 2–3 инъекции).
5. Назначение достаточных доз железа (200 мг элементарного железа в сутки) одновременно с препаратами РЭПО – является важной составной и неотъемлемой частью лечения ЖДА у пациенток с миомой матки в пред– и послеоперационном периодах. Рекомендуются следующие препараты железа для приема внутрь: Ферро–Фольгамма по 3 капсуле в день; Мальтофер по 2–3 таб./ в день; Феррум–Лек по 2–3 таб./ в день; Тардиферон, Гино–тардиферон, Сорбифер Дурулес, по 2 таб./ в день; Ферлатум по 3–4 флак./в день, Хеферол по 2–3 капсуле в день; Актифферин по 2–3 капсуле в день. Из парентеральных препаратов используется Венофер для внутривенного введения по 5–10 мл в 100–200 мл физиологического раствора внутривенно, капельно, медленно в течение 15–30 минут, 2–3 раза в неделю.
6. Дозирование и мониторинг РЭПО и железа при лечении ЖДА у больных миомой матки в пред– и послеоперационном периоде должны основываться на динамической оценке клинических проявлений анемии и определении следующих лабораторных показателей:
Перед началом введения РЭПО:
– Общий анализ крови с подсчетом количества эритроцитов, ретикулоцитов, тромбоцитов, уровня гемоглобина, гематокрита.
– Концентрация сывороточного железа, ферритина, трансферрина, коэффициента насыщения трансферрина железом.
– Эритропоэтин в сыворотке (при имеющихся лабораторных возможностях).
На фоне лечения:
– Общий анализ крови с подсчетом ретикулоцитов, тромбоцитов, гематокрита – 2 раза в неделю.
После окончания введения РЭПО:
– Концентрация сывороточного железа, ферритина, трансферрина, коэффициента насыщения трансферрина железом.
7. Коррекция дозы РЭПО проводится с учетом нарастания уровня Hb или Ht. Необходимо увеличивать дозу в 2 раза при недостаточном эффекте (нет увеличения Ht на 5–6% или уровня Hb на 15–20 г/л после 4 недель лечения). Если уровень Hb повышается чрезмерно быстро (более чем на 20 г/л в неделю) или его концентрация превышает 130 г/л, следует прекратить введение препарата.
8. После нормализации уровня Hb и прекращении менометроррагий, после операции, следует продолжать прием препаратов железа не менее 3–6 месяцев под контролем уровня сывороточного ферритина и коэффициента насыщения трансферрина железом 1 раз в месяц до достижения нормальных значений этих показателей, свидетельствующих об отсутствии дефицита железа в организме. Рекомендуемые дозы и препараты железа: Ферро–Фольгамма по 1 капсуле в день, Ферретаб по 1 таб./ в день; Актиферрин по 1 капсуле в день.
Полученные результаты показывают, что уникальное соотношение между оптимальным содержанием двухвалентного железа, фолиевой кислоты и цианокобаламина в одной капсуле «Ферро–Фольгаммы» в сочетании с препаратом рекомбинантного эритропоэтина «Эпокрин», позволяет добиться отличных результатов в лечении ЖДА у больных с миомой матки. Наличие в препарате «Ферро–Фольгамма» фолиевой кислоты и цианокобаламина является его дополнительным преимуществом, так как при ЖДА часто имеет место дефицит этих витаминов, участвующих в кроветворении. Наличие аскорбиновой кислоты улучшает всасывание и усвоение железа. Микрокапсулированная форма препарата исключает местное раздражение желудка и кишечника. Мы убедились в целесообразности и высокой эффективности применения Ферро–Фольгаммы для лечения железодефицитных состояний в гинекологической практике.
1. Аркадьева Г.В. Диагностика и лечение железодефицитных состояний. //Учебно–методическое пособие. Москва 1999. – с.22–25.
2. Бурлев В.А., Коноводова Е.Н., Гаспаров А.С., Барабанова О.Э., Коробицын Л.П. Рекомбинантный эритропоэтин в предоперационном лечении анемии у больных миомой матки.–Проблемы репродукции.–2003.–N5.–C.23–27.
3. Бурлев В.А.,Гаспаров А.С, Коноводова Е.Н., Барабанова О.Э., Коробицын Л.П. Эпокрин в лечении железодефицитной анемии у больных миомой матки после гистерэктомии.–Проблемы репродукции.–2003.– N6.–С.59–64.
4. Вихляева Е.М.Молекулярно–генетические детерминанты опухолевого роста и обоснования современной стратегии при лейомиоме матки.–Вопросы онкологии.–2001.–47(2–3)С.
5. Дворецкий Л.И. Железодефицитные анемии.– М.,1998.–37 стр.
6. Кулаков В.И., Голубев В.А. Реконструктивная хирургия в современной гинекологии. // Сб. статей «Реконструктивная хирургия и реабилитация репродуктивной функции у гинекологических больных».–1992.– С.11–17.
7. Коноводова Е.Н., Бурлев В.А. Эффективность применения препарата Ферро–Фольгамма у беременных и родильниц с железодефицитной анемией.– Русский медицинский журнал.–2003.–Т.11.–N16.–С.899–901.
8. Румянцев А.Г., Морщакова Е.Ф., Павлов А.Д.– Эритропоэтин в диагостике, профилактике и лечении анемий– М., 2003.–447 С.
9. Савицкий Г.А., Савицкий А.Г. Миома матки: проблемы патогенеза и патогенетической терапии.–СПб.–2000.
10. Шевченко Ю.Л., Данильченко В.В. и др. Эритропоэтин в профилактике и лечении анемии.// Обзор литературы. Военно–медицинский журнал– 1996.–№5.–С.45–47.
11. Bachmann G.A. Epoetin alfa use in gynecology. Past, present and future.– J Reprod Med.–2001.–V.46 (5 Suppl).– P.539–44
12. Dicato M.,Duhem C., Berchem G., Ries F. Clinical benefit from erythropoietin.–Curr Opin Oncol.–2000.–12(4):297–302.
13. Guarnaccia M.M., Rein M.S. Traditional surgical approaches to uterine fibroids:Abdominal myomectomy and hysterectomy.–Clinical Obstet Gyn.–2001.–V.44.–N2.–P.385–400.
14. Milad M.P., Sankpal R.S. Laparoscopic approaches to uterine leiomyomas.–Clin Obstet Gyn.–2001.–V.44.–N2.–P.401–411.












