–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –≤—Б–µ –≤–Њ–Ј—А–∞—Б—В–∞—О—Й–µ–є –і–Њ–ї–µ –њ–Њ–ґ–Є–ї—Л—Е –ї—О–і–µ–є –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Є –Њ–± —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —Б—А–µ–і–љ–µ–є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ґ–Є–Ј–љ–Є –≤ —А–∞–Ј–≤–Є—В—Л—Е —Б—В—А–∞–љ–∞—Е. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї–ї–Є–Љ–∞–Ї—В–µ—А–Є—З–µ—Б–Ї–Є–є –њ–µ—А–Є–Њ–і —Б–Њ—Б—В–∞–≤–ї—П–µ—В –і–Њ —В—А–µ—В–Є –Њ–±—Й–µ–є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ґ–Є–Ј–љ–Є –ґ–µ–љ—Й–Є–љ. –Ґ–∞–Ї–Є–µ –Њ–±—Й–µ–њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ—Л–µ —В–µ–љ–і–µ–љ—Ж–Є–Є –њ–Њ—Б—В–∞–≤–Є–ї–Є –њ–µ—А–µ–і –≤—А–∞—З–∞–Љ–Є –Є —Г—З–µ–љ—Л–Љ–Є –≤—Б–µ–≥–Њ –Љ–Є—А–∞ –Ј–∞–і–∞—З—Г –њ–Њ —Г–ї—Г—З—И–µ–љ–Є—О –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є —Г –ґ–µ–љ—Й–Є–љ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞.
–Я–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ –Њ—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї—М—О –Ч–У–Ґ –±—Л–ї–∞ –±–Њ—А—М–±–∞ —Б –Ї–ї–Є–Љ–∞–Ї—В–µ—А–Є—З–µ—Б–Ї–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ. –Я–Њ–Ј–ґ–µ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –њ—А–Є –њ–Њ–љ–Є–ґ–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л—Е —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В —А–Є—Б–Ї —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г–µ—В –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –і–Њ 50 –ї–µ—В –ґ–µ–љ—Й–Є–љ—Л –≤ 2 —А–∞–Ј–∞ —А–µ–ґ–µ —Б—В—А–∞–і–∞—О—В —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, —З–µ–Љ –Љ—Г–ґ—З–Є–љ—Л, —В–Њ–≥–і–∞ –Ї–∞–Ї –Ї 80 –≥–Њ–і–∞–Љ —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–є –і–ї—П –Њ–±–Њ–Є—Е –њ–Њ–ї–Њ–≤. –£ –ґ–µ–љ—Й–Є–љ —Б –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Љ–µ–љ–Њ–њ–∞—Г–Ј–Њ–є –њ–Њ—Б–ї–µ –±–Є–ї–∞—В–µ—А–∞–ї—М–љ–Њ–є –Њ–≤–∞—А–Є—Н–Ї—В–Њ–Љ–Є–Є —А–Є—Б–Ї —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –њ–Њ–≤—Л—И–∞–µ—В—Б—П –≤ 2 —А–∞–Ј–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –ґ–µ–љ—Й–Є–љ–∞–Љ–Є —В–Њ–≥–Њ –ґ–µ –≤–Њ–Ј—А–∞—Б—В–∞ –і–Њ –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л. –≠—В–Є –љ–∞–±–ї—О–і–µ–љ–Є—П –ї–µ–≥–ї–Є –≤ –Њ—Б–љ–Њ–≤—Г –≥–Є–њ–Њ—В–µ–Ј—Л –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ч–У–Ґ –љ–µ —В–Њ–ї—М–Ї–Њ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ї–ї–Є–Љ–∞–Ї—В–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, –љ–Њ –Є –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞.
–Ъ–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П –Ј–∞–љ–Є–Љ–∞–µ—В –ї–Є–і–Є—А—Г—О—Й—Г—О –њ–Њ–Ј–Є—Ж–Є—О –≤ —Б—В—А—Г–Ї—В—Г—А–µ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є —Г –ґ–µ–љ—Й–Є–љ. –Я–Њ –і–∞–љ–љ—Л–Љ American Heart Association, –µ–ґ–µ–≥–Њ–і–љ–Њ –Њ—В —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Г–Љ–Є—А–∞–µ—В –±–Њ–ї–µ–µ 500 000 –ґ–µ–љ—Й–Є–љ. –Э–∞—З–Є–љ–∞—П —Б 1984 –≥–Њ–і–∞, –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П —З–∞—Б—В–Њ—В–∞ —Б–Љ–µ—А—В–µ–є –Њ—В —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Г –ґ–µ–љ—Й–Є–љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Љ—Г–ґ—З–Є–љ–∞–Љ–Є, –њ—А–Є—З–µ–Љ —А–∞–Ј—А—Л–≤ –Љ–µ–ґ–і—Г —Н—В–Є–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –њ–Њ—Б—В–Њ—П–љ–љ–Њ —А–∞—Б—В–µ—В.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤–Њ–њ—А–Њ—Б –Њ –≤–ї–Є—П–љ–Є–Є –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–Њ–є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б–Є—Б—В–µ–Љ—Г —Б—В–∞–љ–Њ–≤–Є—В—Б—П –≤—Б–µ –±–Њ–ї–µ–µ –∞–Ї—В—Г–∞–ї—М–љ—Л–Љ. –Т —Б–≤—П–Ј–Є —Б —В–∞–Ї–Є–Љ —И–Є—А–Њ–Ї–Є–Љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ–Љ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–∞–ґ–µ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —А–Є—Б–Ї–∞, —Б–≤—П–Ј–∞–љ–љ–Њ–µ —Б –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ, –Љ–Њ–ґ–µ—В –љ–∞–љ–µ—Б—В–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–є –≤—А–µ–і –Ј–і–Њ—А–Њ–≤—М—О –Њ—З–µ–љ—М –±–Њ–ї—М—И–Њ–є –≥—А—Г–њ–њ–µ –љ–∞—Б–µ–ї–µ–љ–Є—П.
–Ч–У–Ґ –Є –≤–µ–љ–Њ–Ј–љ—Л–µ —В—А–Њ–Љ–±–Њ–Ј—Л
–Ш—Б—Е–Њ–і—П –Є–Ј —В–Њ–≥–Њ, —З—В–Њ —Н—Б—В—А–Њ–≥–µ–љ-—Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –≤–ї–Є—П—О—В –љ–∞ –ї–Є–њ–Є–і–љ—Л–є –њ—А–Њ—Д–Є–ї—М, –±—Л–ї–Њ –≤—Л–і–≤–Є–љ—Г—В–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ, —З—В–Њ –Ч–У–Ґ –Љ–Њ–ґ–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–ґ–∞—В—М —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Э–∞ —Д–Њ–љ–µ –њ–µ—А–≤—Л—Е –≤–µ—Б—М–Љ–∞ –Њ–±–љ–∞–і–µ–ґ–Є–≤–∞—О—Й–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –≤–µ—Б—М–Љ–∞ –љ–µ–Њ–ґ–Є–і–∞–љ–љ—Л–Љ–Є –і–ї—П –Љ–љ–Њ–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –і–∞–љ–љ—Л–µ –Њ —В–Њ–Љ, —З—В–Њ –Ч–У–Ґ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –Є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.–†—П–і–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є 80-90-—Е –≥–Њ–і–Њ–≤ –њ—А–Њ—И–ї–Њ–≥–Њ –≤–µ–Ї–∞ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–Є—Б–Ї–∞ –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –≤ 2-4 —А–∞–Ј–∞ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ч–У–Ґ. –Я–Њ–Ј–ґ–µ —Н—В–Є –і–∞–љ–љ—Л–µ –±—Л–ї–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ—Л –≤ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б–њ—Л—В–∞–љ–Є—П—Е (—В–∞–±–ї. 1).
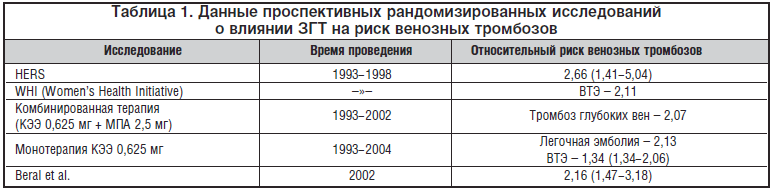
–Я—А–Є –љ–∞–ї–Є—З–Є–Є —Г –ґ–µ–љ—Й–Є–љ—Л —Д–∞–Ї—В–Њ—А–Њ–≤, –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є—Е –Ї —А–∞–Ј–≤–Є—В–Є—О –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞ (–Њ–ґ–Є—А–µ–љ–Є–µ, –њ–Њ–ґ–Є–ї–Њ–є –≤–Њ–Ј—А–∞—Б—В, –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–∞—П —В—А–∞–≤–Љ–∞, —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ, –≤–∞—А–Є–Ї–Њ–Ј–љ–Њ–µ —А–∞—Б—И–Є—А–µ–љ–Є–µ –≤–µ–љ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є, —Н–њ–Є–Ј–Њ–і—Л –Т–Ґ–≠ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П), –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ч–У–Ґ –Љ–Њ–ґ–µ—В —Б–њ—А–Њ–≤–Њ—Ж–Є—А–Њ–≤–∞—В—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Т–ї–Є—П–љ–Є–µ –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л—Е —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є–є –љ–∞ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –Ч–У–Ґ
–С—Л–ї–Њ –Ј–∞–Љ–µ—З–µ–љ–Њ, —З—В–Њ —А–Є—Б–Ї —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ –Ч–У–Ґ (—В–∞–±–ї. 2).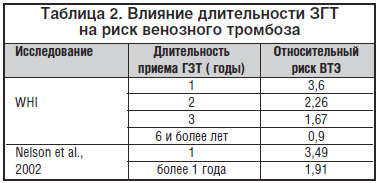
–Ґ–Њ—В —Д–∞–Ї—В, —З—В–Њ –Ї–∞–Ї –њ—А–Є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є, —В–∞–Ї –Є –њ—А–Є –Ч–У–Ґ —З–∞—Б—В–Њ—В–∞ —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –≤—Л—И–µ –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Њ —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–љ–Є–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞, –Њ –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В–Є –Ї —А–∞–Ј–≤–Є—В–Є—О —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Т–∞–ґ–љ–µ–є—И–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є–Љ —А–Є—Б–Ї –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ч–У–Ґ, —П–≤–ї—П–µ—В—Б—П –љ–∞–ї–Є—З–Є–µ —Б–Ї—А—Л—В–Њ–є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є–Є (–Љ—Г—В–∞—Ж–Є—П FV Leiden, –Љ—Г—В–∞—Ж–Є—П –њ—А–Њ—В—А–Њ–Љ–±–Є–љ–∞ G20210A –Є –і—А.) –Є –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–є —Б–Є–љ–і—А–Њ–Љ (–Р–§–°). –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –≤–µ—Б—М–Љ–∞ –Є–љ—В–µ—А–µ—Б–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –ХV–Ґ–Х–Ґ [Hoibraaten et al., 2000] –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Ч–У–Ґ —Г –ґ–µ–љ—Й–Є–љ —Б –≤–µ–љ–Њ–Ј–љ—Л–Љ–Є —В—А–Њ–Љ–±–Њ–Ј–∞–Љ–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–µ–Ї—А–∞—Й–µ–љ–Њ –і–Њ—Б—А–Њ—З–љ–Њ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤: —З–∞—Б—В–Њ—В–∞ —А–µ—Ж–Є–і–Є–≤–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 10,7% –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б —В—А–Њ–Љ–±–Њ–Ј–∞–Љ–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –љ–∞ —Д–Њ–љ–µ –Ч–У–Ґ –Є 2,3% –≤ –њ–ї–∞—Ж–µ–±–Њ-–≥—А—Г–њ–њ–µ. –Т—Б–µ —Б–ї—Г—З–∞–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –±—Л–ї–Є –Њ—В–Љ–µ—З–µ–љ—Л –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ –Ч–У–Ґ. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –ґ–µ–љ—Й–Є–љ —Б —А–µ—Ж–Є–і–Є–≤–Њ–Љ –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є–Љ–µ–ї–Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–µ –Є–ї–Є –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ—Л–µ –і–µ—Д–µ–Ї—В—Л —Б–Є—Б—В–µ–Љ—Л –≥–µ–Љ–Њ—Б—В–∞–Ј–∞.
–†–Є—Б–Ї —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Љ—Г—В–∞—Ж–Є–Є FV Leiden (—В–∞–±–ї. 3).
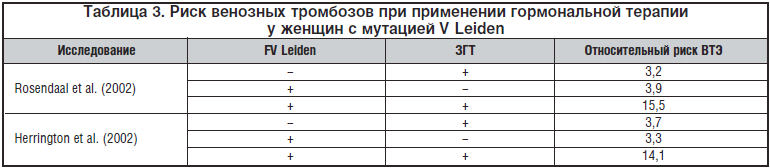
–Я–Њ –і–∞–љ–љ—Л–Љ Lowe et al. (2005), –љ–∞–ї–Є—З–Є–µ —В–∞–Ї–Є—Е –і–µ—Д–µ–Ї—В–Њ–≤ —Б–Є—Б—В–µ–Љ—Л –≥–µ–Љ–Њ—Б—В–∞–Ј–∞, –Ї–∞–Ї –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П FIX, —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ–Њ–Љ—Г –њ—А–Њ—В–µ–Є–љ—Г –°, –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ–∞, –њ—А–Њ—В–µ–Є–љ–∞ –°, –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П –≤ —Б—А–µ–і–љ–µ–Љ —Б —З–µ—В—Л—А–µ—Е–Ї—А–∞—В–љ—Л–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –Т–Ґ–≠ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ –Ј–і–Њ—А–Њ–≤—Л–Љ–Є –ґ–µ–љ—Й–Є–љ–∞–Љ–Є, –њ—А–Є–љ–Є–Љ–∞—О—Й–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В—Л –Ч–У–Ґ.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ч–У–Ґ, —В–∞–Ї–ґ–µ –Ї–∞–Ї –Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –Њ—А–∞–ї—М–љ—Л–µ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤—Л, –Њ–±–ї–∞–і–∞–µ—В —Б–Є–љ–µ—А–≥–Є—З–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ —Б –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –Є –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ–Њ–є —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є–µ–є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤.
–Т–∞–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –Р–§–° –Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ —Д–Њ—А–Љ—Л —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є–Є –≤—Л—П–≤–ї—П—О—В—Б—П —Г 7-15% –ґ–µ–љ—Й–Є–љ –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, —П–≤–ї—П—О—В—Б—П –Њ–і–љ–Њ–є –Є–Ј –≤–µ–і—Г—Й–Є—Е –њ—А–Є—З–Є–љ —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ч–У–Ґ.
–Ь—Л –Њ–±—Б–ї–µ–і–Њ–≤–∞–ї–Є 27 –ґ–µ–љ—Й–Є–љ, —Г –Ї–Њ—В–Њ—А—Л—Е —А–∞–Ј–≤–Є–ї–Є—Б—М —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Ч–У–Ґ. –Я—А–Є —Н—В–Њ–Љ —Г 75% –ґ–µ–љ—Й–Є–љ –≤—Л—П–≤–ї–µ–љ—Л –∞–Ї—Г—И–µ—А—Б–Ї–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ (—Б–Є–љ–і—А–Њ–Љ –њ–Њ—В–µ—А–Є –њ–ї–Њ–і–∞, –≥–µ—Б—В–Њ–Ј—Л, –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–∞—П –Њ—В—Б–ї–Њ–є–Ї–∞ –љ–Њ—А–Љ–∞–ї—М–љ–Њ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ–є –њ–ї–∞—Ж–µ–љ—В—Л). –Т 100% —Б–ї—Г—З–∞–µ–≤ –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —А–∞–Ј–ї–Є—З–љ—Л–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ —Д–Њ—А–Љ—Л —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є–Є (–≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ—Л–µ —Д–Њ—А–Љ—Л –≤ 20%, –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ вАУ –≤ 80% —Б–ї—Г—З–∞–µ–≤).
–Т 49% —Б–ї—Г—З–∞–µ–≤ –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –Љ–∞—А–Ї–µ—А—Л –Р–§–°: —Ж–Є—А–Ї—Г–ї—П—Ж–Є—П –Т–Р –Є –∞–љ—В–Є—В–µ–ї–∞ –Ї –Ї–Њ—Д–∞–Ї—В–Њ—А–∞–Љ. –°—В—А—Г–Ї—В—Г—А–∞ —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є–є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 4.
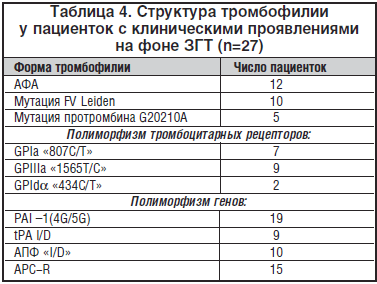
–°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —З–∞—Б—В–Њ –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Ч–У–Ґ –Њ—В—П–≥–Њ—Й–µ–љ–љ—Л–є –∞–Ї—Г—И–µ—А—Б–Ї–Є–є –∞–љ–∞–Љ–љ–µ–Ј –Є–≥–љ–Њ—А–Є—А—Г–µ—В—Б—П, –љ–µ –≥–Њ–≤–Њ—А—П —Г–ґ–µ –Њ —Б–Ї—А–Є–љ–Є–љ–≥–Њ–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –љ–∞ –њ—А–µ–і–Љ–µ—В –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є–є –Є –Љ–∞—А–Ї–µ—А–Њ–≤ –Р–§–°.
–Ф–∞–љ–љ—Л–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —А–Њ–ї–Є –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ –Є –і–ї—П –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –њ—А–Є–µ–Љ–µ –Ч–У–Ґ. –†–Є—Б–Ї –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ–Ј–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є–Є —Б –і—А—Г–≥–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Я–Њ –і–∞–љ–љ—Л–Љ Rosendaal et al. (2002), —А–Є—Б–Ї –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ —Г –Ї—Г—А—П—Й–Є—Е –ґ–µ–љ—Й–Є–љ —Б –≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ–Њ–є —Д–Њ—А–Љ–Њ–є FV Leiden –≤—Л—И–µ –≤ 30 —А–∞–Ј, —В–Њ–≥–і–∞ –Ї–∞–Ї –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Ї—Г—А–µ–љ–Є—П –≤–ї–Є—П–љ–Є–µ –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞ –љ–∞ —А–Є—Б–Ї –Ш–Ь –±—Л–ї–Њ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ. –Я—А–Є –љ–∞–ї–Є—З–Є–Є –Љ—Г—В–∞—Ж–Є–Є FV Leiden –Є –Љ—Г—В–∞—Ж–Є–Є –њ—А–Њ—В—А–Њ–Љ–±–Є–љ–∞ G20210–Р –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є—П —А–Є—Б–Ї–∞ –Ш–Ь –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ч–У–Ґ, –Њ–і–љ–∞–Ї–Њ, –њ–Њ –і–∞–љ–љ—Л–Љ Psaty et al. (2001), –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є –Љ—Г—В–∞—Ж–Є–Є –њ—А–Њ—В—А–Њ–Љ–±–Є–љ–∞ G20201–Р —Б –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є —Н—В–Њ—В —А–Є—Б–Ї –њ–Њ–≤—Л—И–∞–ї—Б—П –≤ 11 —А–∞–Ј. –†–Є—Б–Ї –Є–љ—Б—Г–ї—М—В–∞ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ч–У–Ґ —Г –ґ–µ–љ—Й–Є–љ —Б —Б–Њ—З–µ—В–∞–љ–љ–Њ–є –Љ—Г—В–∞—Ж–Є–µ–є FV Leiden –Є –њ—А–Њ—В—А–Њ–Љ–±–Є–љ–∞ G20210–Р –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –≤ 2 —А–∞–Ј–∞.
–Т–ї–Є—П–љ–Є–µ –Ч–У–Ґ –љ–∞ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤
–Ф–Њ 1996 –≥. —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–ї–∞ –њ–Њ–Ј–Є—Ж–Є—П –Њ –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–Љ —Н—Д—Д–µ–Ї—В–µ –Ч–У–Ґ, —З—В–Њ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є —А—П–і –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (—В–∞–±–ї. 5).
–Ю–і–љ–∞–Ї–Њ –і–∞–ї—М–љ–µ–є—И–Є–µ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –Њ–њ—А–Њ–≤–µ—А–≥–∞—О—В –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ч–У–Ґ –Ї–∞–Ї –≤ –њ–µ—А–≤–Є—З–љ–Њ–є, —В–∞–Ї –Є –≤–Њ –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Э–Є–ґ–µ –њ—А–Є–≤–µ–і–µ–љ—Л –і–∞–љ–љ—Л–µ –љ–∞–Є–±–Њ–ї–µ–µ –Ї—А—Г–њ–љ—Л—Е –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤–ї–Є—П–љ–Є—П –Ч–У–Ґ –љ–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б–Є—Б—В–µ–Љ—Г
Nurses, Health Study (NHS) (1976вАФ1996) вАУ –Њ–±—Б–µ—А–≤–∞—Ж–Є–Њ–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Г 86000 –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ —Б—А–µ–і–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ 34-59 –ї–µ—В —Б –њ–Њ–Љ–Њ—Й—М—О –Ч–У–Ґ.
–†–µ–Ј—Г–ї—М—В–∞—В—Л: —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –љ–∞ 40% –Љ–µ–љ—М—И–µ –њ—А–Є –њ—А–Є–µ–Љ–µ –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–Њ–є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є —З–Є—Б—В—Л–Љ–Є —Н—Б—В—А–Њ–≥–µ–љ–∞–Љ–Є –Є –љ–∞ 61% –Љ–µ–љ—М—И–µ –њ—А–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ч–У–Ґ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–µ–ї–µ—З–µ–љ–љ—Л–Љ–Є –ґ–µ–љ—Й–Є–љ–∞–Љ–Є.
–Ф–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —Б–љ–Є–ґ–µ–љ–Є–Є —А–Є—Б–Ї–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є –љ–∞ 80% —В–Њ–ї—М–Ї–Њ –Ј–∞ —Б—З–µ—В —Б–Љ–µ–љ—Л –Њ–±—А–∞–Ј–∞ –ґ–Є–Ј–љ–Є (–Њ—В–Ї–∞–Ј –Њ—В –Ї—Г—А–µ–љ–Є—П, –Ш–Ь–Ґ<25 –Ї–≥/–Љ2, —Г–Љ–µ—А–µ–љ–љ–∞—П —Д–Є–Ј–Є—З–µ—Б–Ї–∞—П –љ–∞–≥—А—Г–Ј–Ї–∞, –њ—А–∞–≤–Є–ї—М–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ).
Heart and Estrogen/Progestin replacement Study (HERS) вАУ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –і–≤–Њ–є–љ–Њ–µ —Б–ї–µ–њ–Њ–µ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ч–У–Ґ (1993-1998) –і–ї—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–Њ–≤—В–Њ—А–љ—Л—Е –Є–љ—Д–∞—А–Ї—В–Њ–≤ –Љ–Є–Њ–Ї–∞—А–і–∞ —Г 2763 –ґ–µ–љ—Й–Є–љ (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 66,7 –ї–µ—В) –Є —Б –Ш–С–°.
–Э–∞–Ј–љ–∞—З–∞–ї–Є: –Ї–Њ–љ—К—О–≥–Є—А–Њ–≤–∞–љ–љ—Л–µ —Н—Б—В—А–Њ–≥–µ–љ—Л 0,625 –Љ–≥ + 2,5 –Љ–≥ –Љ–µ–і—А–Њ–Ї—Б–Є–њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ –∞—Ж–µ—В–∞—В–∞.
–Я—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ч–У–Ґ –Њ—В–Љ–µ—З–µ–љ–Њ:
вАУ –њ–Њ–≤—Л—И–µ–љ–Є–µ —А–Є—Б–Ї–∞ –љ–µ—Д–∞—В–∞–ї—М–љ–Њ–≥–Њ –Ш–Ь –Є —Б–Љ–µ—А—В–Є –Њ—В –Ш–С–° –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ —В–µ—А–∞–њ–Є–Є;
вАУ —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ –њ–Њ—Б–ї–µ —В—А–µ—Е –ї–µ—В –њ—А–Є–µ–Љ–∞ –Ч–У–Ґ;
вАУ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б—Г–Љ–Љ–∞—А–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –Ч–У–Ґ –љ–∞ —А–Є—Б–Ї –Ш–Ь –Є —Б–Љ–µ—А—В–Є –Њ—В –Ш–С–° –Ј–∞ –≤–µ—Б—М –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П;
вАУ –њ–Њ–≤—Л—И–µ–љ–Є–µ —А–Є—Б–Ї–∞ –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –≤ 2,7 —А–∞–Ј–∞.
ERA (Estrogen Replacement and Atherosclerosis).
309 –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ —Б—В–∞—А—И–µ 55 –ї–µ—В —Б 30% —Б—В–µ–љ–Њ–Ј–Њ–Љ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –і–ї—П –њ—А–Є–µ–Љ–∞ –Ъ–≠–≠ 0,625 –Љ–≥ –Є–ї–Є –Ъ–≠–≠ 0,625–Љ–≥+–Ь–Я–Р 2,5 –Љ–≥ –≤ —В–µ—З–µ–љ–Є–µ 3 –ї–µ—В. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є –≤–ї–Є—П–љ–Є—П –Ч–У–Ґ –љ–∞ —Б—В—А—Г–Ї—В—Г—А—Г –њ–Њ—А–∞–ґ–µ–љ–љ—Л—Е –∞—А—В–µ—А–Є–є.
WomenвАЩs Health Initiative (WHI) вАУ –і–≤–Њ–є–љ–Њ–µ –њ–∞—А–∞–ї–ї–µ–ї—М–љ–Њ–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ –Є –Њ—Ж–µ–љ–Ї–µ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П —А–Є—Б–Ї–∞ –Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Ч–У–У —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 50-79 –ї–µ—В.
–Я—А–Њ–≤–Њ–і–Є–ї–Є 2 —В–Є–њ–∞ –Ч–У–Ґ. –Я–µ—А–≤—Л–є —В–Є–њ вАУ –љ–∞–Ј–љ–∞—З–∞–ї–Є –Ї–Њ–љ—К—О–≥–Є—А–Њ–≤–∞–љ–љ—Л–µ —Н—Б—В—А–Њ–≥–µ–љ—Л 0,625 –Љ–≥ + 2,5 –Љ–≥ –Љ–µ–і—А–Њ–Ї—Б–Є–њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–∞ –∞—Ж–µ—В–∞—В–∞ 16608 –ґ–µ–љ—Й–Є–љ–∞–Љ. –Я—А–Є –њ–ї–∞–љ–Є—А—Г–µ–Љ–Њ–є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П 8,5 –≥–Њ–і–∞ –Њ–љ–Њ –њ—А–Є–Њ—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —З–µ—А–µ–Ј 5,2 –≥–Њ–і–∞ –≤ —Б–≤—П–Ј–Є —Б –њ—А–µ–≤—Л—И–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –Є–љ–≤–∞–Ј–Є–≤–љ–Њ–≥–Њ —А–∞–Ї–∞ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –і–Њ–њ—Г—Б—В–Є–Љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П.
–Т—В–Њ—А–Њ–є —В–Є–њ вАУ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –Ъ–≠–≠ (0,625 –Љ–≥). –Я—А–µ–њ–∞—А–∞—В –љ–∞–Ј–љ–∞—З–∞–ї–Є 10739 –ґ–µ–љ—Й–Є–љ–∞–Љ –њ–Њ—Б–ї–µ –≥–Є—Б—В–µ—А—Н–Ї—В–Њ–Љ–Є–Є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –і–Њ—Б—А–Њ—З–љ–Њ –Ј–∞–≤–µ—А—И–µ–љ–Њ –≤ 2004 –≥–Њ–і—Г –Є–Ј-–Ј–∞ –≤—Л—П–≤–ї–µ–љ–Є—П –њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ –Є–љ—Б—Г–ї—М—В–∞.
–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ч–У–Ґ —З–∞—Б—В–Њ—В–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ —Г–≤–µ–ї–Є—З–Є–ї–∞—Б—М –љ–∞ 29%; –Є–љ—Б—Г–ї—М—В–Њ–≤ вАУ –љ–∞ 41%, –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ вАУ –≤ 2 —А–∞–Ј–∞, –Є–љ–≤–∞–Ј–Є–≤–љ–Њ–≥–Њ —А–∞–Ї–∞ –Љ–Њ–ї–Њ—З–љ—Л–є –ґ–µ–ї–µ–Ј—Л вАУ –љ–∞ 26%, —З–∞—Б—В–Њ—В–∞ –Њ—Б—В–µ–Њ–њ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є —Б–љ–Є–Ј–Є–ї–Є—Б—М –љ–∞ 23%.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ч–У–Ґ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –Ї–∞–Ї –і–ї—П –њ–µ—А–≤–Є—З–љ–Њ–є, —В–∞–Ї –Є –і–ї—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є; –њ—А–Є –µ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –≤ 2 —А–∞–Ј–∞, –Є–љ—Б—Г–ї—М—В–∞ вАУ –≤ 2-4 —А–∞–Ј–∞.
–Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Ї—А—Г–њ–љ—Л—Е –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (HERS, WHI) –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–∞—П –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Ч–У–Ґ –ґ–µ–љ—Й–Є–љ–∞–Љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –і–ї—П –њ–µ—А–≤–Є—З–љ–Њ–є –Є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–µ—А–і–µ—З–љ–Њ-c–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Я–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –Ч–У–Ґ
–Ь–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ, —З–∞—Б—В–Њ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–µ, –і–∞–љ–љ—Л–µ –Њ –≤–ї–Є—П–љ–Є–Є –ґ–µ–љ—Б–Ї–Є—Е –њ–Њ–ї–Њ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ –љ–∞ —Д—Г–љ–Ї—Ж–Є–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ–Њ—Б—В–∞–≤–Є–ї–Є –≤ —В—Г–њ–Є–Ї –Љ–љ–Њ–≥–Є—Е –≤—А–∞—З–µ–є –Є –Њ–±—Й–µ—Б—В–≤–µ–љ–љ–Њ—Б—В—М. –Я–Њ—Б–ї–µ–і–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б–њ—Л—В–∞–љ–Є—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –њ–Њ–≤—Л—И–µ–љ–Є–Є —А–Є—Б–Ї–∞ –≤–µ–љ–Њ–Ј–љ—Л—Е –Є –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ч–У–Ґ, –≤ —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е in vitro –њ–Њ–ї—Г—З–µ–љ—Л –Њ–±–љ–∞–і–µ–ґ–Є–≤–∞—О—Й–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤ –њ–Њ–ї—М–Ј—Г –≤–∞–Ј–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л—Е –Є –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ—Л—Е —Б–≤–Њ–є—Б—В–≤ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤. –Ґ–∞–Ї, –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–µ —Н—Б—В—А–Њ–≥–µ–љ—Л –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —А–µ–≥—Г–ї–Є—А—Г—О—В –њ—А–Њ—Ж–µ—Б—Б—Л —Н–љ–і–Њ—В–µ–ї–Є–є-–Ј–∞–≤–Є—Б–Є–Љ–Њ–є –Є —Н–љ–і–Њ—В–µ–ї–Є–є-–љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ–є –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є, –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –Є –Љ–Є–≥—А–∞—Ж–Є—О –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤, –∞–љ–≥–Є–Њ–≥–µ–љ–µ–Ј. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Њ–љ–Є –њ—А–µ–њ—П—В—Б—В–≤—Г—О—В —А–∞–Ј–≤–Є—В–Є—О —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Є —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—О —Б–Њ—Б—Г–і–Њ–≤ вАУ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –ї–µ–ґ–∞—Й–Є—Е –≤ –Њ—Б–љ–Њ–≤–µ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Є —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Т–ї–Є—П–љ–Є–µ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –љ–∞ —В–Њ–љ—Г—Б —Б–Њ—Б—Г–і–Њ–≤ –Љ–Њ–ґ–µ—В –±—Л—В—М –љ–µ–≥–µ–љ–Њ–Љ–љ—Л–Љ –Є–ї–Є —А–µ–∞–ї–Є–Ј–Њ–≤—Л–≤–∞—В—М—Б—П –Ј–∞ —Б—З–µ—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –≥–µ–љ–Њ–≤ –Є —Б–≤—П–Ј–∞–љ–Њ —Б –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є —Б–Є–љ—В–µ–Ј–∞ NO, –њ—А–Њ—Б—В–∞—Ж–Є–Ї–ї–Є–љ–∞, cGMP, cAMP, EDHF (—Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–≥–Њ –≥–Є–њ–µ—А–њ–Њ–ї—П—А–Є–Ј—Г—О—Й–µ–≥–Њ —Д–∞–Ї—В–Њ—А–∞) –Є —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П —В–∞–Ї–Є—Е –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ—Л—Е –∞–≥–µ–љ—В–Њ–≤, –Ї–∞–Ї –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ II, —Н–љ–і–Њ—В–µ–ї–Є–љ-1, –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–Њ–≤. –Ґ–∞–Ї, —Н—Б—В—А–Њ–≥–µ–љ—Л, –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—П —Б–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ–Є —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є a (–≠–†a), –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –љ–µ–≥–µ–љ–Њ–Љ–љ—Г—О –∞–Ї—В–Є–≤–∞—Ж–Є—О —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є NO-—Б–Є–љ—В–∞–Ј—Л (eNOS), —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Љ–Њ–Љ–µ–љ—В–∞–ї—М–љ—Г—О –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є—О. –Я–Њ–≤—Л—И–µ–љ–љ–∞—П –њ—А–Њ–і—Г–Ї—Ж–Є—П NO –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –љ–µ —В–Њ–ї—М–Ї–Њ –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є, –љ–Њ –Є –Њ–Ї–∞–Ј—Л–≤–∞—В—М –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –Є –њ—А–Њ—В–Є–≤–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Ј–∞ —Б—З–µ—В –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –∞–≥—А–µ–≥–∞—Ж–Є–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Є –Љ–Є–≥—А–∞—Ж–Є–Є –≥–ї–∞–і–Ї–Є—Е –Љ–Є–Њ—Ж–Є—В–Њ–≤, —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б–≤–Њ–±–Њ–і–љ—Л—Е —А–∞–і–Є–Ї–∞–ї–Њ–≤ –Ї–Є—Б–ї–Њ—А–Њ–і–∞. –≠—Б—В—А–Њ–≥–µ–љ—Л –±–ї–Њ–Ї–Є—А—Г—О—В –Љ–Є—В–Њ–≥–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В PDGF, AT II, ET-1, IGF-1 –љ–∞ –≥–ї–∞–і–Ї–Є–µ –Љ–Є–Њ—Ж–Є—В—Л. –Р–Ї—В–Є–≤–Є—А—Г—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М VEGF, —Н—Б—В—А–Њ–≥–µ–љ—Л –њ—А–µ–њ—П—В—Б—В–≤—Г—О—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –љ–µ–Њ–Є–љ—В–Є–Љ—Л –Є —А–∞–Ј–≤–Є—В–Є—О –Њ–Ї–Ї–ї—О–Ј–Є–Њ–љ–љ—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є —Б–Њ—Б—Г–і–Њ–≤. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–љ–Є —А–µ–∞–ї–Є–Ј—Г—О—В —Н–љ–і–Њ—В–µ–ї–Є–євАУ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Ј–∞ —Б—З–µ—В –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л—Е —Б–≤–Њ–є—Б—В–≤. –≠—Б—В—А–Њ–≥–µ–љ—Л –Є –Є—Е –Њ—Б–љ–Њ–≤–љ—Л–µ –Љ–µ—В–∞–±–Њ–ї–Є—В—Л —В–Њ—А–Љ–Њ–Ј—П—В –Њ–Ї–Є—Б–ї–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Њ–∞—В–µ—А–Њ–≥–µ–љ–љ—Л—Е –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤ –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є (–Ы–Я–Э–Я), –Є–љ–≥–Є–±–Є—А—Г—О—В –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є –∞–њ–Њ–њ—В–Њ–Ј —Н–љ–і–Њ—В–µ–ї–Є–Њ—Ж–Є—В–Њ–≤, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є —Б–≤–Њ–±–Њ–і–љ—Л—Е —А–∞–і–Є–Ї–∞–ї–Њ–≤.–Ф–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П –≤–µ–і—Г—Й–µ–є –њ—А–Є—З–Є–љ–Њ–є —А–∞–Ј–≤–Є—В–Є—П –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Є –Ш–С–° —Б—З–Є—В–∞–ї–Њ—Б—М –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є –Ы–Я–Э–Я –≤ –Ї—А–Њ–≤–Є. –У–Є–њ–Њ—В–µ–Ј–∞ –Њ –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л—Е —Б–≤–Њ–є—Б—В–≤–∞—Е —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Њ—Б–љ–Њ–≤—Л–≤–∞–ї–∞—Б—М –љ–∞ –Ј–љ–∞–љ–Є—П—Е –Њ–± –Є—Е –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–Љ –≤–ї–Є—П–љ–Є–Є –љ–∞ –ї–Є–њ–Є–і–љ—Л–є —Б–њ–µ–Ї—В—А. –Ю–і–љ–∞–Ї–Њ, –њ–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П HERS, —А–Є—Б–Ї –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ч–У–Ґ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –∞—В–µ—А–Њ–≥–µ–љ–љ—Л—Е –ї–Є–њ–Є–і–Њ–≤ –љ–∞ 10-18%.
–Ґ–∞–Ї–Њ–µ –љ–µ—Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–µ –і–∞–љ–љ—Л—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–Љ –≤–ї–Є—П–љ–Є–Є —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –љ–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б–Є—Б—В–µ–Љ—Г –Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —И–Є—А–Њ–Ї–Њ–Љ–∞—Б—И—В–∞–±–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б—В–∞–ї–Њ —Б—В–Є–Љ—Г–ї–Њ–Љ –і–ї—П –Є–Ј—Г—З–µ–љ–Є—П –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–µ–є—Б—В–≤–Є—П –ґ–µ–љ—Б–Ї–Є—Е –њ–Њ–ї–Њ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤, –ї–µ–ґ–∞—Й–Є—Е –≤ –Њ—Б–љ–Њ–≤–µ –Є—Е –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–°–Њ—Б—В–∞–≤, –і–Њ–Ј–Є—А–Њ–≤–Ї–∞ –Є –њ—Г—В—М –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ч–У–Ґ –Љ–Њ–≥—Г—В –≤–ї–Є—П—В—М –љ–µ —В–Њ–ї—М–Ї–Њ –љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М, –љ–Њ –Є –љ–∞ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –°–≤–Њ–є—Б—В–≤–∞ –Ї–Њ–љ—К—О–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤, –љ–∞–Є–±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Њ –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е —Б —Ж–µ–ї—М—О –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Њ—В–ї–Є—З–∞—О—В—Б—П –Њ—В –њ—А–Є—А–Њ–і–љ—Л—Е —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤. –Ґ–∞–Ї, –≤ —Б–Њ—Б—В–∞–≤ –њ—А–µ–Љ–∞—А–Є–љ–∞ –≤—Е–Њ–і—П—В 10 —А–∞–Ј–ї–Є—З–љ—Л—Е —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ (17 b-—Н—Б—В—А–∞–і–Є–Њ–ї, —Н—Б—В—А–Њ–љ, —Н–Ї–≤–Є–ї–Є–љ), –Њ–і–љ–∞–Ї–Њ —В–Њ–ї—М–Ї–Њ 17 b-—Н—Б—В—А–∞–і–Є–Њ–ї —П–≤–ї—П–µ—В—Б—П –Є–і–µ–љ—В–Є—З–љ—Л–Љ –њ–Њ —Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ –Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Б–≤–Њ–є—Б—В–≤–∞–Љ —Н–љ–і–Њ–≥–µ–љ–љ–Њ–Љ—Г –≥–Њ—А–Љ–Њ–љ—Г. –Ш–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ —Н—Б—В—А–Њ–љ –Є —Н—Б—В—А–Є–Њ–ї –љ–µ —В–Њ–ї—М–Ї–Њ –љ–µ –Є–љ–≥–Є–±–Є—А—Г—О—В –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –љ–Њ –Є –±–ї–Њ–Ї–Є—А—Г—О—В –∞–љ—В–Є–Љ–Є—В–Њ–≥–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В —Н—Б—В—А–∞–і–Є–Њ–ї–∞. –£—З–Є—В—Л–≤–∞—П –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Є –Љ–Є–≥—А–∞—Ж–Є–Є –Ї–ї–µ—В–Њ–Ї —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, –Љ–Њ–ґ–љ–Њ —Б–і–µ–ї–∞—В—М –Њ—З–µ–љ—М –≤–∞–ґ–љ—Л–є –≤—Л–≤–Њ–і: –љ–µ –≤—Б–µ —Н—Б—В—А–Њ–≥–µ–љ—Л –Њ–±–ї–∞–і–∞—О—В –≤–∞–Ј–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ. –Ю–і–љ–∞–Ї–Њ –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є–Ї–∞ –Ї–Њ–љ—К—О–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Є –Є—Е —Н—Д—Д–µ–Ї—В—Л –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Њ—Б—В–∞—О—В—Б—П –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –љ–µ —П—Б–љ—Л–Љ–Є.
–Э–∞—В—Г—А–∞–ї—М–љ—Л–µ –≥–µ—Б—В–∞–≥–µ–љ—Л –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Д—Г–љ–Ї—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є—П, —В–Њ–≥–і–∞ –Ї–∞–Ї —Б–≤–Њ–є—Б—В–≤–∞ –Љ–µ–і—А–Њ–Ї—Б–Є–њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–∞ –∞—Ж–µ—В–∞—В–∞ (–Ь–Я–Р), —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ–Њ–≥–Њ –≤ —Б–Њ—Б—В–∞–≤–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ч–У–Ґ, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Њ—В–ї–Є—З–∞—О—В—Б—П –Њ—В —Б–≤–Њ–є—Б—В–≤ –љ–∞—В—Г—А–∞–ї—М–љ—Л—Е –≥–µ—Б—В–∞–≥–µ–љ–Њ–≤. –≠—В–Њ—В –њ—А–µ–њ–∞—А–∞—В –Њ–±–ї–∞–і–∞–µ—В –љ–∞–Є–±–Њ–ї—М—И–µ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М —Н–Ї—Б–њ—А–µ—Б—Б–Є—О —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ (–≠–†), —З—В–Њ –њ—А–Є–Њ–±—А–µ—В–∞–µ—В –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Г –ґ–µ–љ—Й–Є–љ —Б —Г–ґ–µ —А–∞–Ј–≤–Є–≤—И–Є–Љ—Б—П –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ, –Ї–Њ–≥–і–∞ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –≠–† –љ–∞ —Н–љ–і–Њ—В–µ–ї–Є–Є. –Т—Б–ї–µ–і—Б—В–≤–Є–µ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ь–Я–Р –Љ–Њ–ґ–µ—В —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М —Н–Ї—Б–њ—А–µ—Б—Б–Є—О —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —В—А–Њ–Љ–±–Є–љ–∞ –љ–∞ –≥–ї–∞–і–Ї–Є—Е –Љ–Є–Њ—Ж–Є—В–∞—Е –Є –Ї–ї–µ—В–Ї–∞—Е –Ї—А–Њ–≤–Є –Є —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є—О —В—А–Њ–Љ–±–Њ–Ј–Њ–≤.
–Ш–Ј—Г—З–µ–љ–Є–µ –≤–ї–Є—П–љ–Є—П –љ–∞—В—Г—А–∞–ї—М–љ—Л—Е —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤, —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Њ—А–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (—В—А–∞–љ–і–µ—А–Љ–∞–ї—М–љ—Л—Е, –Є–љ—В—А–∞–љ–∞–Ј–∞–ї—М–љ—Л—Е, –≤–љ—Г—В—А–Є–Љ–∞—В–Њ—З–љ—Л—Е, –≤–∞–≥–Є–љ–∞–ї—М–љ—Л—Е) –љ–∞ —А–Є—Б–Ї –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –Ч–У–Ґ —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ–µ–є—И–µ–є –Ј–∞–і–∞—З–µ–є –±—Г–і—Г—Й–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є. –Ю–і–љ–∞–Ї–Њ —Б—В–Њ–Є—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ —В–Њ–Љ, —З—В–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Ч–У–Ґ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е HERS –Є WHI –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —Н—Д—Д–µ–Ї—В–Њ–Љ –≥–µ—Б—В–∞–≥–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –≤ —Б–Њ—Б—В–∞–≤–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Њ—Б—М –≤ —Е–Њ–і–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П ESPRIT (Estrogen in the prevention of Reinfarction Trial, 2003), –≤–Ї–ї—О—З–∞–≤—И–µ–≥–Њ 1017 –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 50 –і–Њ 69, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ш–Ь. –Т —В–µ—З–µ–љ–Є–µ 2 –ї–µ—В –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ —А–∞–Ј–ї–Є—З–Є–є –≤ —З–∞—Б—В–Њ—В–µ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Ш–Ь –њ—А–Є –њ—А–Є–µ–Љ–µ —З–Є—Б—В–Њ–≥–Њ —Н—Б—В—А–∞–і–Є–Њ–ї–∞ –Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ч–У–Ґ.
–†–Њ–ї—М –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ч–У–Ґ
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е –Є –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –Ї–ї—О—З–µ–≤—Г—О —А–Њ–ї—М –Є–≥—А–∞—О—В –њ—А–Њ—Ж–µ—Б—Б—Л –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –Т–Њ—Б–њ–∞–ї–µ–љ–Є—О –Њ—В–≤–Њ–і–Є—В—Б—П –≤–µ–і—Г—Й–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –љ–∞ –≤—Б–µ—Е —Н—В–∞–њ–∞—Е —А–∞–Ј–≤–Є—В–Є—П –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, –≤–Ї–ї—О—З–∞—П –љ–∞—З–∞–ї—М–љ—Л–µ —Д–∞–Ј—Л —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, –Љ–Є–≥—А–∞—Ж–Є—О –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤, –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤, –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –≤ —Б—Г–±—Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л–є –Љ–∞—В—А–Є–Ї—Б, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є –±–ї—П—И–Ї–Є, –µ–µ –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—О –Є —А–∞–Ј–≤–Є—В–Є–µ –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ–Ј–∞. –†–∞–Ј–ї–Є—З–љ—Л–µ –Љ–∞—А–Ї–µ—А—Л –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –≤–Ї–ї—О—З–∞—П –°-—А–µ–∞–Ї—В–Є–≤–љ—Л–є –±–µ–ї–Њ–Ї (–°–†–С), –†-—Б–µ–ї–µ–Ї—В–Є–љ, ICAM-1, IL-6, TNF-a, –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Њ—Ж–µ–љ–Ї–Є —В—П–ґ–µ—Б—В–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –Є —А–Є—Б–Ї–∞ –µ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.–†–∞—Б—И–Є—А–µ–љ–Є–µ –Ј–љ–∞–љ–Є–є –Њ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є —П–≤–ї—П–µ—В—Б—П –µ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Н–љ–і–Њ—В–µ–ї–Є—П –Є –њ—А–Њ—Ж–µ—Б—Б—Л –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –Ю–і–љ–∞–Ї–Њ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е —Н—В–Њ–є –њ—А–Њ–±–ї–µ–Љ–µ, –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –≤–µ—Б—М–Љ–∞ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–Љ–Є. –Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Њ–±–ї–∞–і–∞—О—В –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –њ—А–Њ- –Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О (—В–∞–±–ї. 6).

–Ъ–ї–µ—В–Њ—З–љ—Л–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л –∞–і–≥–µ–Ј–Є–Є (–Ъ–Ь–Р) –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –њ—А–Є–≤–ї–µ—З–µ–љ–Є–µ –Ї–ї–µ—В–Њ–Ї –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Ї —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–µ –Є –Є—Е –Љ–Є–≥—А–∞—Ж–Є—О –≤ —Б—Г–±—Н–љ–і–Њ—В–µ–ї–Є–ї—М–љ—Л–є –Љ–∞—В—А–Є–Ї—Б, –Є–≥—А–∞—П –≤–∞–ґ–љ–µ–є—И—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є. –Ф–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П PEPI (Postmenopausal Estrogen/Progestin Interventions Study), –∞ —В–∞–Ї–ґ–µ –і—А—Г–≥–Є—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б–њ—Л—В–∞–љ–Є–є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —Б–љ–Є–ґ–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –Ъ–Ь–Р –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–ґ–Є–Љ–Њ–≤ –Ч–У–Ґ. –Я—А–Є —Н—В–Њ–Љ —Н—Б—В—А–Њ–≥–µ–љ—Л —А–µ–≥—Г–ї–Є—А—Г—О—В —Г—А–Њ–≤–µ–љ—М –Ъ–Ь–Р –Ј–∞ —Б—З–µ—В —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤: —Б–љ–Є–ґ–µ–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –∞—В–µ—А–Њ–≥–µ–љ–љ—Л—Е –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤, –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л—Е —Б–≤–Њ–є—Б—В–≤ –Є –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є–љ–≥–Є–±–Є—А—Г—О—Й–µ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Д–∞–Ї—В–Њ—А —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є NF-kB, –Ї–Њ—В–Њ—А—Л–є —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ–µ–є—И–Є–Љ —А–µ–≥—Г–ї—П—В–Њ—А–Њ–Љ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П.
–Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Н—Б—В—А–Њ–≥–µ–љ—Л —А–µ–∞–ї–Є–Ј—Г—О—В –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ, –∞–Ї—В–Є–≤–Є—А—Г—П –њ—А–Њ–і—Г–Ї—Ж–Є—О –Љ–∞–Ї—А–Њ—Д–∞–≥–∞–Љ–Є –Љ–∞—В—А–Є–Ї—Б–љ—Л—Е –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј, –Ї–Њ—В–Њ—А—Л–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є –±–ї—П—И–Ї–Є –Є —А–∞–Ј–≤–Є—В–Є—О –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ–Ј–∞. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Н—В–Є—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Њ–є –Є–Ј –њ—А–Є—З–Є–љ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ч–У–Ґ –њ—А–Є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, –∞ –њ–Њ—А–Њ–є –Є –µ–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —А–Є—Б–Ї–∞ –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ–Ј–∞.
–Э–∞–Є–±–Њ–ї–µ–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–Љ–Є –Љ–∞—А–Ї–µ—А–∞–Љ–Є —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞ —П–≤–ї—П—О—В—Б—П –±–µ–ї–Ї–Є –Њ—Б—В—А–Њ–є —Д–∞–Ј—Л, –Ї–Њ—В–Њ—А—Л–µ —Б–Є–љ—В–µ–Ј–Є—А—Г—О—В—Б—П –≤ –њ–µ—З–µ–љ–Є –≤ –Њ—В–≤–µ—В –љ–∞ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ IL-6, –∞ —В–∞–Ї–ґ–µ IL-1b –Є TNF-a.
–Т –Њ–±—Б–µ—А–≤–∞—Ж–Є–Њ–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є M. Cushman et al. (1999), –њ–Њ—Б–≤—П—Й–µ–љ–љ–Њ–Љ –≤–ї–Є—П–љ–Є—О –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ч–У–Ґ –љ–∞ –Љ–∞—А–Ї–µ—А—Л –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞, –≤—Л—П–≤–ї–µ–љ–∞, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —З—В–Њ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –≤ —Б–љ–Є–ґ–µ–љ–Є–Є —Г—А–Њ–≤–љ—П —Д–Є–±—А–Є–љ–Њ–≥–µ–љ–∞ –Є a1-–≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–∞; —Б –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –°–†–С –Є —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –∞–ї—М–±—Г–Љ–Є–љ–∞ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–Љ –і–µ–є—Б—В–≤–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ч–У–Ґ. –Р–ї—М–±—Г–Љ–Є–љ —П–≤–ї—П–µ—В—Б—П –љ–µ–≥–∞—В–Є–≤–љ—Л–Љ –±–µ–ї–Ї–Њ–Љ –Њ—Б—В—А–Њ–є —Д–∞–Ј—Л –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –Ю–љ –∞–Ї—В–Є–≤–Є—А—Г–µ—В —Д–Є–±—А–Є–љ–Њ–ї–Є–Ј, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є, –Њ–±–ї–∞–і–∞–µ—В –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–Љ–Є –Є –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є. –Т —А–∞–Ј–ї–Є—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –∞–ї—М–±—Г–Љ–Є–љ–∞ —П–≤–ї—П–µ—В—Б—П —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–Љ –Є—Е –Є—Б—Е–Њ–і–∞, –њ—А–Є—З–µ–Љ –±–Њ–ї–µ–µ —Б–Є–ї—М–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ —Г –ґ–µ–љ—Й–Є–љ.
–Т–∞–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –љ–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –Љ–∞—А–Ї–µ—А–∞–Љ–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –°–†–С, —Г—А–Њ–≤–µ–љ—М –Ї–Њ—В–Њ—А–Њ–≥–Њ –љ–∞ —Д–Њ–љ–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ч–У–Ґ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –≤ 2 —А–∞–Ј–∞. –Х–≥–Њ –≤—Л—Б–Њ–Ї–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —А–∞–Ј–≤–Є—В–Є—П –Ш–Ь, —П–≤–ї—П–µ—В—Б—П —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ї—О–і–µ–є. –°–Њ–≥–ї–∞—Б–љ–Њ –љ–µ–і–∞–≤–љ–µ–Љ—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—О Vormittag et al. (2005) –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –°–†–С —П–≤–ї—П–µ—В—Б—П —В–∞–Ї–ґ–µ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤. –°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ American Heart Assosiation –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –°–†–С —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ —Н—В–∞–њ–Њ–Љ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —А–Є—Б–Ї–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–°–†–С —П–≤–ї—П–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ –Љ–∞—А–Ї–µ—А–Њ–Љ —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –Ю–љ –њ–Њ—Б—В–Њ—П–љ–љ–Њ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –≤ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є –±–ї—П—И–Ї–µ, –њ—А–Є–љ–Є–Љ–∞–µ—В —Г—З–∞—Б—В–Є–µ –≤ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є –±–ї—П—И–Ї–Є –Є –Љ–Њ–ґ–µ—В –њ–Њ—Б–ї—Г–ґ–Є—В—М —В—А–Є–≥–≥–µ—А–Њ–Љ –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ–Ј–∞. –°–†–С –∞–Ї—В–Є–≤–Є—А—Г–µ—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ IL-1b, IL-6, TNF-a –≤ –Љ–∞–Ї—А–Њ—Д–∞–≥–∞—Е, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—О –Ї–ї–µ—В–Њ–Ї –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –≤ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є –±–ї—П—И–Ї–µ, –Є–љ–і—Г—Ж–Є—А—Г—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –Ъ–Ь–Р (ICAM-1, VCAM-1, –Х-—Б–µ–ї–µ–Ї—В–Є–љ–∞) –Є –Љ–Њ–љ–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ —Е–µ–Љ–Њ–∞—В—В—А–∞–Ї—В–∞–љ—В–∞ –Ь–°–†-1 –љ–∞ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О —В—А–Њ–Љ–±–Њ–Ј–∞ –Ј–∞ —Б—З–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є TF –Љ–Њ–љ–Њ—Ж–Є—В–∞–Љ–Є, –Є–≥—А–∞–µ—В —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є.
–Ш–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –°–†–С, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є IL-6, —П–≤–ї—П—О—Й–µ–≥–Њ—Б—П –≤–∞–ґ–љ–µ–є—И–Є–Љ —А–µ–≥—Г–ї—П—В–Њ—А–Њ–Љ –±–µ–ї–Ї–Њ–≤ –Њ—Б—В—А–Њ–є —Д–∞–Ј—Л –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ч–У–Ґ –љ–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В. –≠—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ–± —Г—З–∞—Б—В–Є–Є –Є–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —А–µ–≥—Г–ї—П—Ж–Є–Є —Б–Є–љ—В–µ–Ј–∞ –°–†–С, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –Њ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–Љ —Н—Д—Д–µ–Ї—В–µ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –љ–∞ —Б–Є–љ—В–µ–Ј –±–µ–ї–Ї–∞ –≤ –њ–µ—З–µ–љ–Є.
–†–∞–Ј–љ—Л–µ —А–µ–ґ–Є–Љ—Л –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Њ—В–ї–Є—З–∞—О—В—Б—П –њ–Њ —Б–≤–Њ–µ–Љ—Г –≤–ї–Є—П–љ–Є—О –љ–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤. –Ґ–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ Stork et al. (2004), –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –љ–∞—В—Г—А–∞–ї—М–љ–Њ–≥–Њ —Н—Б—В—А–Њ–≥–µ–љ–∞ вАУ 17b-—Н—Б—В—А–∞–і–Є–Њ–ї–∞ –≤—Л—П–≤–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Ъ–Ь–Р –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П –°–†–С. –Э–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –°–†–С –Є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —В—А–∞–љ—Б–і–µ—А–Љ–∞–ї—М–љ—Л—Е —Д–Њ—А–Љ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤. –Я—А–Є –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –Љ–µ–љ—М—И–µ.
–Т–ї–Є—П–љ–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –љ–∞ —А–Є—Б–Ї –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ч–У–Ґ
–Т–ї–Є—П–љ–Є–µ –Ч–У–Ґ –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Ј–∞–≤–Є—Б–Є—В –Њ—В —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Н–љ–і–Њ—В–µ–ї–Є—П. –С–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–Ј–Љ–∞ —Б–≤—П–Ј–∞–љ —Б —В–∞–Ї–Є–Љ–Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є, –Ї–∞–Ї –≤–Њ–Ј—А–∞—Б—В, –Ї—Г—А–µ–љ–Є–µ, –љ–∞–ї–Є—З–Є–µ –і–Є–∞–±–µ—В–∞, –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є, –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–Є, –≥–Є–њ–µ—А–≥–Њ–Љ–Њ—Ж–Є—Б—В–µ–Є–љ–µ–Љ–Є–Є, –Љ–Є–≥—А–µ–љ–Є –Є —Б–µ–Љ–µ–є–љ–Њ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞ –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤. –Э–µ—Б–Њ–Љ–љ–µ–љ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е –Є –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —П–≤–ї—П–µ—В—Б—П –Њ–ґ–Є—А–µ–љ–Є–µ. –Ц–Є—А–Њ–≤–∞–љ–Є—П —В–Ї–∞–љ—М —П–≤–ї—П–µ—В—Б—П –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ (TNF-a, IL-1, IL-6), TF –Є PAI-1, –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —Г—З–∞—Б—В–≤—Г—П, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ –њ—А–Њ—Ж–µ—Б—Б–∞—Е –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є –Є —Б–Њ–Ј–і–∞–≤–∞—П –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є —Д–Њ–љ –і–ї—П —А–∞–Ј–≤–Є—В–Є—П —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞. –Я—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є –≤—Л—П–≤–ї—П–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –°–†–С, —З—В–Њ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –Њ—Б—В—А–Њ—Д–∞–Ј–Њ–≤–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤.–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ –њ—А–µ–Љ–Њ—А–±–Є–і–љ–Њ–≥–Њ —Д–Њ–љ–∞, –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—О—Й–µ–≥–Њ —А–∞–Ј–≤–Є—В–Є–µ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –Є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –≥–Њ—В–Њ–≤–љ–Њ—Б—В–Є –Ї —Б–≤–µ—А—В—Л–≤–∞–љ–Є—О –Ї—А–Њ–≤–Є, –њ—А–Є–µ–Љ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј–∞—В—М—Б—П —В—А–Є–≥–≥–µ—А–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –і–ї—П —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Я–Њ–љ—П—В–љ–Њ, —З—В–Њ –±–Њ–ї—М—И–Є–є —А–Є—Б–Ї —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –љ–∞–±–ї—О–і–∞–µ—В—Б—П –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ч–У–Ґ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є, –Ї–Њ—В–Њ—А—Л–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Љ–Њ–ї–Њ–і—Л–µ –ґ–µ–љ—Й–Є–љ—Л —Б –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞. –Ъ–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –≤–Ї–ї—О—З–∞—П –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –і–µ—В–µ—А–Љ–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л —Б—В–∞—А–µ–љ–Є—П, –њ—А–Њ–∞—В–µ—А–Њ–≥–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–Є –≤–∞–Ј–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П —Н–љ–і–Њ–≥–µ–љ–љ—Л—Е —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤, –њ—А–Є–≤–Њ–і–Є—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, –Ї–Њ—В–Њ—А–∞—П —Е–∞—А–∞–Ї—В–µ—А–љ–∞ –і–ї—П –≤—Б–µ—Е –ґ–µ–љ—Й–Є–љ –≤ –Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –Є –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, –Ш–С–°, –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є, —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б–Є—Б—В–µ–Љ—Г –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е HERS –Є WHI —П–≤–ї—П–µ—В—Б—П –≤–Ї–ї—О—З–µ–љ–Є–µ –≤ —Н—В–Є –Є—Б–њ—Л—В–∞–љ–Є—П –ґ–µ–љ—Й–Є–љ —Б—В–∞—А—И–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –Ї–Њ—В–Њ—А—Л–µ –љ–∞—З–∞–ї–Є –њ—А–Є–Љ–µ–љ—П—В—М –њ—А–µ–њ–∞—А–∞—В—Л –Ч–У–Ґ —В–Њ–ї—М–Ї–Њ —З–µ—А–µ–Ј 10-15 –ї–µ—В –њ–Њ—Б–ї–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л вАУ —Г –љ–Є—Е –Љ–Њ–ґ–µ—В –±—Л—В—М —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–Њ–≤—Л—И–µ–љ —А–Є—Б–Ї —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–є –Є —Н–љ–і–Њ—В–µ–ї–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В—Л –Ч–У–Ґ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤—Б–µ –±–Њ–ї—М—И–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –≤ —Б–≤—П–Ј–Є —Б —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–є –Ї–Њ–љ—Ж–µ–њ—Ж–Є–µ–є ¬Ђ–Ј–і–Њ—А–Њ–≤–Њ–≥–Њ¬ї —Н–љ–і–Њ—В–µ–ї–Є—П. –Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –Ч–У–Ґ –Њ—В–Љ–µ—З–∞—О—В—Б—П —Г –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Љ–Њ–ї–Њ–і—Л—Е –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –±–µ–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤, –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –Є/–Є–ї–Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ. –Э–∞ —Г—Б–њ–µ—Е –Ч–У–Ґ –Љ–Њ–ґ–љ–Њ —А–∞—Б—Б—З–Є—В—Л–≤–∞—В—М —В–Њ–ї—М–Ї–Њ —Г –±–Њ–ї–µ–µ –Љ–Њ–ї–Њ–і—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б —Б–Њ—Е—А–∞–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–µ–є —Н–љ–і–Њ—В–µ–ї–Є—П, —В–Њ–≥–і–∞ –Ї–∞–Ї —Г –њ–Њ–ґ–Є–ї—Л—Е –ґ–µ–љ—Й–Є–љ —Б –њ—А–µ–Љ–Њ—А–±–Є–і–љ—Л–Љ–Є —Б–Њ—Б—В–Њ—П–љ–Є—П–Љ–Є –њ–µ—А–µ–≤–µ—И–Є–≤–∞—О—В –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –У–Ч–Ґ.
–Т–ї–Є—П–љ–Є–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –љ–∞ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –Ч–У–Ґ
–Я—А–Є—З–Є–љ–Њ–є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –Ч–У–Ґ –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –љ–∞–ї–Є—З–Є–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В–Є, –Ї–Њ—В–Њ—А–∞—П –љ–µ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є, –љ–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –њ–Њ–≤—Л—И–µ–љ–љ—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П–Љ. –Я—А–Є —Н—В–Њ–Љ –њ—А–Є–µ–Љ –≥–Њ—А–Љ–Њ–љ–Њ–≤ –Љ–Њ–ґ–µ—В —Б—В–∞—В—М –Ї—А–Є—В–Є—З–µ—Б–Ї–Є —Д–∞–Ї—В–Њ—А–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ–Ј–Њ–≤.–Я–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ –≥–µ–љ–∞ aвАУ—А–µ—Ж–µ–њ—В–Њ—А–∞ (–≠–†a) —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–ї–Є—П–µ—В –љ–∞ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М —В–Ї–∞–љ–µ–є –Ї –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Ф–µ—Д–Є—Ж–Є—В —Н—Д—Д–µ–Ї—В–Њ–≤ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Љ–Њ–ґ–µ—В –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ –Њ–±—Г—Б–ї–Њ–≤–Є—В—М —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М –Ї —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ –Є –њ–Њ–≤—Л—И–µ–љ–љ—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –њ—А–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–Љ—Г –≤–ї–Є—П–љ–Є—О –Ч–У–Ґ. –Т–њ–µ—А–≤—Л–µ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–Њ–Љ –≠–†a –±—Л–ї–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –≤ 1997 –≥. Sudhir, –Ї–Њ—В–Њ—А—Л–є –Њ–њ–Є—Б–∞–ї —А–∞–Ј–≤–Є—В–Є–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ —Г –Љ—Г–ґ—З–Є–љ—Л –≤ –≤–Њ–Ј—А–∞—Б—В–µ 31 –≥–Њ–і–∞ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –љ–Њ–љ—Б–µ–љ—Б-–Љ—Г—В–∞—Ж–Є–Є –≠–†a. –Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≤–∞—А–Є–∞–љ—В–Њ–≤ –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞ –≥–µ–љ–∞ –≠–†a, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Љ–µ—А–µ –Њ–њ—А–µ–і–µ–ї—П—В—М —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ї–∞–Ї –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е, —В–∞–Ї –Є –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤. –Ґ–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ D. –Эerrington et al. (2002), —Г –ґ–µ–љ—Й–Є–љ —Б –≤–∞—А–Є–∞–љ—В–Њ–Љ –≥–µ–љ–∞ –≠–† IVS1-401–°/–°, –≤—Л—П–≤–ї—П–µ–Љ–Њ–≥–Њ –≤ 20% —Б–ї—Г—З–∞–µ–≤, –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ч–У–Ґ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –Х-—Б–µ–ї–µ–Ї—В–Є–љ–∞, –Ы–Я–Э–Я, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –Ы–Я–Э–Я/–Ы–Я–Т–Я –Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –∞–Ы–Я –≤—Л—П–≤–ї—П–µ—В—Б—П –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, —З–µ–Љ —Г –ґ–µ–љ—Й–Є–љ —Б –≤–∞—А–Є–∞–љ—В–∞–Љ–Є –°/–Ґ –Є–ї–Є –°/–° –≤ —Н—В–Њ–Љ —Г—З–∞—Б—В–Ї–µ –≥–µ–љ–∞. –≠—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –љ–∞–ї–Є—З–Є–µ–Љ –≤ –°-–∞–ї–ї–µ–ї–µ (–≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –∞–ї–ї–µ–ї—П –Ґ) —Б–∞–є—В–∞ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П –і–ї—П —Д–∞–Ї—В–Њ—А–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –Т-myb, –Ї–Њ—В–Њ—А—Л–є —Б–њ–Њ—Б–Њ–±–µ–љ –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞—В—М —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—О –≠–†a –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М —В–Ї–∞–љ–µ–є –Ї –і–µ–є—Б—В–≤–Є—О —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤. –£ –ґ–µ–љ—Й–Є–љ —Б –≥–µ–љ–Њ—В–Є–њ–Њ–Љ IVS1 вАУ397 –°–° —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Х-—Б–µ–ї–µ–Ї—В–Є–љ–∞ –њ—А–Є –Ч–У–Ґ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –≤ –±–Њ–ї—М—И–µ–є –Љ–µ—А–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –ґ–µ–љ—Й–Є–љ–∞–Љ–Є —Б –≥–µ–љ–Њ—В–Є–њ–Њ–Љ IVS1 вАУ397 –°–Ґ –Є–ї–Є –Ґ–Ґ, –Ї–Њ—В–Њ—А—Л–µ –і–µ—В–µ—А–Љ–Є–љ–Є—А—Г—О—В –≤ 3,2 —А–∞–Ј–∞ –±–Њ–ї—М—И–Є–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≤–∞—А–Є–∞–љ—В–Њ–Љ IVS1 вАУ397 –°–°. –£ –ґ–µ–љ—Й–Є–љ Pvull –∞–ї–ї–µ–ї—М –Ґ –Є Xball –∞–ї–ї–µ–ї—М –Р —П–≤–ї—П—О—В—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є, –≤ 2 —А–∞–Ј–∞ –њ–Њ–≤—Л—И–∞—О—Й–Є–Љ–Є —А–Є—Б–Ї –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞, –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—О—Й–Є–Љ–Є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Є –Љ–µ–љ—М—И–Є–є —А–Є—Б–Ї —А–∞–Ї–∞ —Н–љ–і–Њ–Љ–µ—В—А–Є—П.
–°–Ї—А–Є–љ–Є–љ–≥ –≤–∞—А–Є–∞–љ—В–Њ–≤ –≥–µ–љ–∞ –≠–† –њ–Њ–Ј–≤–Њ–ї–Є—В –≤—Л—П–≤–Є—В—М –≥—А—Г–њ–њ—Г –ґ–µ–љ—Й–Є–љ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –Ч–У–Ґ.
–Ю–і–љ–Њ–є –Є–Ј –≤–∞–ґ–љ–µ–є—И–Є—Е –њ—А–Є—З–Є–љ —А–∞–Ј–≤–Є—В–Є—П –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞ —П–≤–ї—П–µ—В—Б—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ–Њ–Љ—Г –њ—А–Њ—В–µ–Є–љ—Г –°. –І–∞—Й–µ –≤—Б–µ–≥–Њ –Њ–љ–∞ —Б–≤—П–Ј–∞–љ–∞ —Б –Љ—Г—В–∞—Ж–Є–µ–є FV Leiden, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤—Л—П–≤–ї—П–µ—В—Б—П –њ—А–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤, –њ—А–Є –Р–§–°, –њ–Њ–≤—Л—И–µ–љ–љ–Њ–Љ —Г—А–Њ–≤–љ–µ FVIII. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–∞ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —Д–∞–Ї—В–Њ—А–∞ VIII –Є –љ–∞ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –Р–†–° –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М –≤–ї–Є—П–љ–Є–µ –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ –≥–µ–љ–Њ–≤ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ (IL-1, IL-6) –Є —Е–µ–Љ–Њ–Ї–Є–љ–Њ–≤ (–Ь–°–†-1).
–С–Њ–ї—М—И–Њ–є –Є–љ—В–µ—А–µ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —В–∞–Ї–ґ–µ –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ –≥–µ–љ–∞ –∞–Ы–Я, –Ї–Њ—В–Њ—А—Л–є —П–≤–ї—П–µ—В—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Є –Ш–С–°. –Я–Њ–≤—Л—И–µ–љ–Є–µ –µ–≥–Њ —Г—А–Њ–≤–љ—П –≤—Л—П–≤–ї—П–µ—В—Б—П —Г 40% –ґ–µ–љ—Й–Є–љ —Б —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є. –Ъ–Њ–љ–Ї—Г—А–Є—А—Г—П —Б –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–Њ–Љ, –∞–Ы–Я –Є–љ–≥–Є–±–Є—А—Г–µ—В —Д–Є–±—А–Є–љ–Њ–ї–Є—В–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О —В—А–Њ–Љ–±–Њ–Ј–Њ–≤. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є –Ч–У–Ґ —Г—А–Њ–≤–µ–љ—М –∞–Ы–Я —Б–љ–Є–ґ–∞–µ—В—Б—П, –Њ–і–љ–∞–Ї–Њ –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ –≥–µ–љ–∞ –∞–Ы–Я –Љ–Њ–ґ–µ—В –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—В—М —Б–љ–Є–ґ–µ–љ–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї –і–µ–є—Б—В–≤–Є—О —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤.
–Т–ї–Є—П–љ–Є–µ –Ч–У–Ґ –љ–∞ —Б–Є—Б—В–µ–Љ—Г –≥–µ–Љ–Њ—Б—В–∞–Ј–∞
–Т–∞–ґ–љ–µ–є—И–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є–Љ —А–∞–Ј–≤–Є—В–Є–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —П–≤–ї—П–µ—В—Б—П —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б–Є—Б—В–µ–Љ—Л –≥–µ–Љ–Њ—Б—В–∞–Ј–∞. –С–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –Ч–У–Ґ –љ–∞ —Б–Є—Б—В–µ–Љ—Г –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ —Б—Е–Њ–і–љ—Л —Б —В–∞–Ї–Њ–≤—Л–Љ–Є –Ю–Ъ, –Њ–і–љ–∞–Ї–Њ —Б–ї–µ–і—Г–µ—В —Г—З–µ—Б—В—М, —З—В–Њ —Г –ґ–µ–љ—Й–Є–љ –±–Њ–ї–µ–µ —Б—В–∞—А—И–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —А–Є—Б–Ї —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –≤—Л—И–µ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Ї—А–Њ–Љ–µ —Н—Д—Д–µ–Ї—В–Њ–≤ –Ч–У–Ґ, –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е —Б–Ї—А—Л—В—Л—Е —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є, –љ–∞–Ї–ї–∞–і—Л–≤–∞—О—В—Б—П –µ—Й–µ –Є –≤–Њ–Ј—А–∞—Б—В–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П —Б–Є—Б—В–µ–Љ—Л –≥–µ–Љ–Њ—Б—В–∞–Ј–∞. –Ш–Ј–Љ–µ–љ–µ–љ–Є–µ –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ–µ–є—И–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є–Љ –Ї —А–∞–Ј–≤–Є—В–Є—О —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Д–Є–±—А–Є–љ–Њ–≥–µ–љ–∞ –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ш–Ь –≤ 2 —А–∞–Ј–∞ (—Н—Д—Д–µ–Ї—В, —Б—А–∞–≤–љ–Є–Љ—Л–є —Б —В–∞–Ї–Њ–≤—Л–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞). –Я–Њ–≤—Л—И–µ–љ–љ—Л–µ —Г—А–Њ–≤–љ–Є FVIII –Є vWF —П–≤–ї—П—О—В—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –Є –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞. PAI-1 –≤ –≤—Л—Б–Њ–Ї–Є—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –≤ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –±–ї—П—И–Ї–∞—Е, –Є, –њ–Њ –і–∞–љ–љ—Л–Љ Northwick Park Heart Study (1993), —П–≤–ї—П–µ—В—Б—П —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є. –£—А–Њ–≤–µ–љ—М PAI-1 –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ш–Ь, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ –Ј–і–Њ—А–Њ–≤—Л–Љ–Є –ґ–µ–љ—Й–Є–љ–∞–Љ–Є. –Я–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –†–Р–†, F1+2, D-–і–Є–Љ–µ—А–∞, —Д–Є–±—А–Є–љ–Њ–≥–µ–љ–∞ —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —Б–Њ—Б—В–Њ—П–љ–Є–Є –≥–Є–њ–µ—А–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є –Є –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –Ї–∞–Ї –≤–µ–љ–Њ–Ј–љ—Л—Е, —В–∞–Ї –Є –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤. –£–≤–µ–ї–Є—З–µ–љ–Є–µ —Г—А–Њ–≤–љ—П F1+2 –≤—Л—П–≤–ї—П–µ—В—Б—П —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж, —Г –Ї–Њ—В–Њ—А—Л—Е –≤ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–Є —А–∞–Ј–Њ–≤—М–µ—В—Б—П –Ш–Ь.–Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ –њ—А–Є –Ч–У–Ґ –Є–Ј–Љ–µ–љ—П—О—В—Б—П (–Њ–±—Л—З–љ–Њ –≤ –њ—А–µ–і–µ–ї–∞—Е –љ–Њ—А–Љ—Л). –Я—А–Є —Н—В–Њ–Љ –Њ—В–Љ–µ—З–∞—О—В—Б—П –Ї–∞–Ї –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л, –њ—А–Њ—П–≤–ї—П—О—Й–Є–µ—Б—П –≤ —Б–љ–Є–ґ–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ—Л—Е –Є –њ–Њ–≤—Л—И–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ—А–Њ–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ—Л—Е –±–µ–ї–Ї–Њ–≤, —В–∞–Ї –Є –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ–Њ–≤—Л—И–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–Є—Б—В–µ–Љ—Л —Д–Є–±—А–Є–љ–Њ–ї–Є–Ј–∞ (—В–∞–±–ї. 7)

–°–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Д–Є–±—А–Є–љ–Њ–≥–µ–љ–∞ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Ч–У–Ґ –Љ–Њ–ґ–µ—В –±—Л—В—М –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –і–ї—П —Г–Љ–µ–љ—М—И–µ–љ–Є—П —А–Є—Б–Ї–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Њ–і–љ–∞–Ї–Њ —Н—В–Њ—В —Н—Д—Д–µ–Ї—В –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤–µ–і–µ–љ –Ї –Љ–Є–љ–Є–Љ—Г–Љ—Г –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Б–љ–Є–ґ–µ–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ –Р–Ґ III, –њ—А–Њ—В–µ–Є–љ–∞ –° –Є –њ—А–Њ—В–µ–Є–љ–∞ S. –Э–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л–Љ –≤–ї–Є—П–љ–Є–µ–Љ –Ч–У–Ґ –љ–∞ —Б–Є—Б—В–µ–Љ—Г –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ —П–≤–ї—П–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –Р–†–°. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –Р–†–° –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б —А–Є—Б–Ї–Њ–Љ –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –њ—А–Є –Ч–У–Ґ. –°–ї–µ–і—Г–µ—В —Г—З–µ—Б—В—М —В–∞–Ї–ґ–µ, —З—В–Њ —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї –Р–†–° –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –Є —Г—Б–Є–ї–Є–≤–∞–µ—В—Б—П —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ–Ј–Њ–≤. –Ш, –Ї–Њ–љ–µ—З–љ–Њ, –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —В—А–Њ–Љ–±–Њ–Ј–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П, –µ—Б–ї–Є –≤ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї –і–≤—Г–Љ —Г–Ї–∞–Ј–∞–љ–љ—Л–Љ –≤—Л—И–µ –њ—А–Є—З–Є–љ–∞–Љ –і–Њ–±–∞–≤–ї—П–µ—В—Б—П –µ—Й–µ –Є —Б–Ї—А—Л—В–∞—П —Д–Њ—А–Љ–∞ —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є–Є.
–Ю–і–љ–∞–Ї–Њ –і–∞–љ–љ—Л–µ –Љ–љ–Њ–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Њ –≤–ї–Є—П–љ–Є–Є –Ч–У–Ґ –љ–∞ —Б–Є—Б—В–µ–Љ—Г –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ –≤–µ—Б—М–Љ–∞ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л. –Ю—Б–љ–Њ–≤–љ—Л–µ –љ–µ—Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є—П –≤—Л—П–≤–ї—П—О—В—Б—П –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ –≤–ї–Є—П–љ–Є—П –Ч–У–Ґ –љ–∞ –њ—А–Њ–і—Г–Ї—Ж–Є—О —В—А–Њ–Љ–±–Є–љ–∞. –Т —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤—Л—П–≤–ї–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Ґ–Р–Ґ, F1+2, —Д–Є–±—А–Є–љ–Њ–њ–µ–њ—В–Є–і–∞ –Р, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ–± –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Б–≤–µ—А—В—Л–≤–∞—О—Й–µ–є —Б–Є—Б—В–µ–Љ—Л. –Я–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П D-–і–Є–Љ–µ—А–∞ –Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤ –†–Р–† —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –і–ї—П –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Д–Є–±—А–Є–љ–Њ–ї–Є–Ј–∞. –Ю–і–љ–∞–Ї–Њ –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ –њ–Њ–≤—Л—И–µ–љ–Є—П –Љ–∞—А–Ї–µ—А–Њ–≤ —В—А–Њ–Љ–±–Є–љ–µ–Љ–Є–Є –Є —Д–Є–±—А–Є–љ–Њ–ї–Є–Ј–∞ –њ—А–Є –Ч–У–Ґ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В.
–Я–Њ –і–∞–љ–љ—Л–Љ Koh et al. (1997), –њ—А–Є –Ч–У–Ґ —Г—А–Њ–≤–µ–љ—М PAI-1 —Б–љ–Є–ґ–∞–µ—В—Б—П –љ–∞ 50%. –Я–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ –≥–µ–љ–∞ PAI-1 –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Я—А–Є –љ–∞–ї–Є—З–Є–Є 4G –∞–ї–ї–µ–ї—П PAI-1 –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ —А–Є—Б–Ї–∞ –Ш–Ь. –Ш–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ —Н–Ї—Б–њ—А–µ—Б—Б–Є—П 4G –∞–ї–ї–µ–ї—П PAI-1 —А–µ–≥—Г–ї–Є—А—Г–µ—В—Б—П —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–∞–Љ–Є. –Я—А–µ–њ–∞—А–∞—В—Л –Ч–У–Ґ, —Г–≤–µ–ї–Є—З–Є–≤–∞—П —Г—А–Њ–≤–µ–љ—М —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤, –Љ–Њ–≥—Г—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –∞–Ї—В–Є–≤–∞—Ж–Є—П —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є PAI-1. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ, –њ—А–Є –љ–∞–ї–Є—З–Є–Є –∞–ї–ї–µ–ї—П 4G –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Ч–У–Ґ –њ—А–Њ—Ж–µ—Б—Б—Л —Д–Є–±—А–Є–љ–Њ–ї–Є–Ј–∞ –∞–Ї—В–Є–≤–Є—А—Г—О—В—Б—П –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є.
–Ґ—А–∞–љ—Б–і–µ—А–Љ–∞–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –≤–ї–Є—П—О—В –Ї–∞–Ї –љ–∞ –њ—А–Њ–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–µ, —В–∞–Ї –Є –њ—А–Њ—Д–Є–±—А–Є–љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–µ –Ј–≤–µ–љ–Њ –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–µ—А–Њ—А–∞–ї—М–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є. –≠—В–Њ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є—П —В—А–∞–љ—Б–і–µ—А–Љ–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —З–µ—А–µ–Ј –њ–µ—З–µ–љ—М –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Љ–µ–љ—М—И–Є–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ —Б–Є–љ—В–µ–Ј –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ —Б–Є—Б—В–µ–Љ—Л –≥–µ–Љ–Њ—Б—В–∞–Ј–∞. –Я–Њ –і–∞–љ–љ—Л–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —В—А–∞–љ—Б–і–µ—А–Љ–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ч–У–Ґ –љ–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –Р–†–°, –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П –њ—А–Њ–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ (FVII, FXI) –Є –≤—Л—П–≤–ї—П–µ—В—Б—П –Љ–µ–љ—М—И–Є–є —А–Є—Б–Ї –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤, —З–µ–Љ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е —Д–Њ—А–Љ.
–Т–∞–ґ–љ–Њ, —З—В–Њ –љ–∞–Є–±–Њ–ї—М—И–Є–є –≤–Ї–ї–∞–і –≤ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –њ—А–Є –Ч–У–Ґ –≤–љ–Њ—Б–Є—В –Є—Б—Е–Њ–і–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б–Є—Б—В–µ–Љ—Л –≥–µ–Љ–Њ—Б—В–∞–Ј–∞. –£ –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –љ–∞—А—Г—И–µ–љ–Є–є –≤ —Б–Є—Б—В–µ–Љ–µ –≥–µ–Љ–Њ—Б—В–∞–Ј–∞, —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –≤–µ–љ–Њ–Ј–љ—Л—Е –Є –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤, –љ–∞–ї–Є—З–Є–µ–Љ —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П —В—А–∞–љ–Ј–Є—В–Њ—А–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –≥–Є–њ–µ—А–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є, –≤—Л–Ј–≤–∞–љ–љ–Њ–µ –Ч–У–Ґ, —П–≤–ї—П–µ—В—Б—П –Ї—А–Є—В–Є—З–µ—Б–Ї–Є–Љ –і–ї—П —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ч–У–Ґ
1. –Ч–У–Ґ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ї–ї–Є–Љ–∞–Ї—В–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Є —Г–Љ–µ–љ—М—И–∞–µ—В –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤–Њ –≤–ї–∞–≥–∞–ї–Є—Й–µ. –Т–µ–і—Г—Й–Є–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –Ч–У–Ґ —П–≤–ї—П–µ—В—Б—П –Ї–Њ—А—А–µ–Ї—Ж–Є—П –Ї–ї–Є–Љ–∞–Ї—В–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. –Я—А–µ–њ–∞—А–∞—В—Л –і–Њ–ї–ґ–љ—Л –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –≤ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –і–Њ–Ј–∞—Е –Є –≤ —В–µ—З–µ–љ–Є–µ –Ї–∞–Ї –Љ–Њ–ґ–љ–Њ –±–Њ–ї–µ–µ –Ї–Њ—А–Њ—В–Ї–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –≤—А–µ–Љ–µ–љ–Є. –†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ–∞—П –љ–∞—З–∞–ї—М–љ–∞—П –і–Њ–Ј–∞ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1-2 –Љ–≥. –†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ–∞—П –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ч–У–Ґ вАУ 2-3 –≥–Њ–і–∞. –Т —Б–ї—Г—З–∞–µ —А–µ—Ж–Є–і–Є–≤–∞ –Ї–ї–Є–Љ–∞–Ї—В–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ч–У–Ґ –Љ–Њ–ґ–µ—В –±—Л—В—М –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї–µ–љ–Њ. –Я—А–Є –љ–∞–ї–Є—З–Є–Є —Г—А–Њ–≥–µ–љ–Є—В–∞–ї—М–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Љ–µ—В–Њ–і–Њ–Љ –≤—Л–±–Њ—А–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤–љ—Г—В—А–Є–Љ–∞—В–Њ—З–љ—Л—Е –Є –≤–∞–≥–Є–љ–∞–ї—М–љ—Л—Е —Д–Њ—А–Љ—Л –У–Ч–Ґ.2. –Ч–У–Ґ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –Ї–∞–Ї –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–µ—А–≤–Є—З–љ–Њ–є, —В–∞–Ї –Є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –Є–љ—Б—Г–ї—М—В–Њ–≤ (–љ–∞ 40%). –Ґ–Њ–ї—М–Ї–Њ –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є ¬Ђ–Ј–і–Њ—А–Њ–≤–Њ–≥–Њ —Н–љ–і–Њ—В–µ–ї–Є—П¬ї —Г –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Љ–Њ–ї–Њ–і—Л—Е –ґ–µ–љ—Й–Є–љ –≤ –њ–µ—А–Є–Њ–і –њ–µ—А–Є–Љ–µ–љ–Њ–њ–∞—Г–Ј—Л –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б–Є—Б—В–µ–Љ—Г. –Т —Г—Б–ї–Њ–≤–Є—П—Е –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Ч–У–Ґ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є —А–∞–Ј–≤–Є—В–Є—О —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
3. –Ч–У–Ґ –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞ –≤ 3-4 —А–∞–Ј–∞. –°–ї–µ–і—Г–µ—В –Њ—В–і–∞–≤–∞—В—М –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ —В—А–∞–љ—Б–і–µ—А–Љ–∞–ї—М–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ, —В.–Ї. –Њ–љ–Є –љ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ґ–µ–љ—Й–Є–љ. –Ю–і–љ–∞–Ї–Њ –≤–Њ–њ—А–Њ—Б –Њ–± –Є—Е –≤–ї–Є—П–љ–Є–Є –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Г –ґ–µ–љ—Й–Є–љ —Б –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є—П–Љ–Є –Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Њ—Б—В–∞–µ—В—Б—П –Њ—В–Ї—А—Л—В—Л–Љ.
4. –Т–ї–Є—П–љ–Є–µ –Ч–У–Ґ –љ–∞ —Б–Є—Б—В–µ–Љ—Г –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ —В–∞–Ї–Њ–≤–Њ–Љ—Г –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –Њ—А–∞–ї—М–љ—Л—Е –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–Њ–≤. –Ю–і–љ–∞–Ї–Њ, —Г—З–Є—В—Л–≤–∞—П –≤–Њ–Ј—А–∞—Б—В –ґ–µ–љ—Й–Є–љ, —Г –Ї–Њ—В–Њ—А—Л—Е –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –Ч–У–Ґ, –Є –љ–∞–ї–Є—З–Є–µ –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є, —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —Г –љ–Є—Е –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≤—Л—И–µ, —З–µ–Љ —Г –Љ–Њ–ї–Њ–і—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –њ—А–Є –њ—А–Є–µ–Љ–µ –Ю–Ъ
–Ш–Ј–±–µ–ґ–∞—В—М –љ–µ–≥–∞—В–Є–≤–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Ч–У–Ґ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –ї–Є—И—М –њ—А–Є –≤—Б–µ—Б—В–Њ—А–Њ–љ–љ–µ–є –Њ—Ж–µ–љ–Ї–µ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞. –Ґ—Й–∞—В–µ–ї—М–љ–Њ –і–Њ–ї–ґ–µ–љ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В—М—Б—П –Ї–∞–Ї —Б–µ–Љ–µ–є–љ—Л–є, —В–∞–Ї –Є –ї–Є—З–љ—Л–є —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–Љ–љ–µ–Ј, –∞ —В–∞–Ї–ґ–µ –∞–Ї—Г—И–µ—А—Б–Ї–Є–є –∞–љ–∞–Љ–љ–µ–Ј, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –і–Њ 70% –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є (—Б–Є–љ–і—А–Њ–Љ –њ–Њ—В–µ—А–Є –њ–ї–Њ–і–∞, —В—П–ґ–µ–ї—Л–µ –≥–µ—Б—В–Њ–Ј—Л, –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–∞—П –Њ—В—Б–ї–Њ–є–Ї–∞ –љ–Њ—А–Љ–∞–ї—М–љ–Њ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ–є –њ–ї–∞—Ж–µ–љ—В—Л) —Б–≤—П–Ј–∞–љ—Л —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Б–Є—Б—В–µ–Љ—Л –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ (–Р–§–° –Є –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л–Љ–Є —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є—П–Љ–Є). –Т–∞–ґ–љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –Њ–±—Й–µ—Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–Љ–љ–µ–Ј (–љ–∞–ї–Є—З–Є–µ –Љ–Є–≥—А–µ–љ–Є, –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є, –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є, –±–Њ–ї–µ–Ј–љ–µ–є –њ–Њ—З–µ–Ї), —В.–Ї. –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –Р–§–° —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л. –°–Њ–њ—Г—В—Б—В–≤—Г—О—Й–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П (–Њ–ґ–Є—А–µ–љ–Є–µ, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В), –∞ —В–∞–Ї–ґ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–∞—П –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М (–љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л–µ —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є–Є, –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ –≥–µ–љ–Њ–≤ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤) –Љ–Њ–ґ–µ—В —П–≤–ї—П—В—М—Б—П —Д–Њ–љ–Њ–Љ –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, –Є–љ—Д–∞—А–Ї—В–Њ–≤, –Є–љ—Б—Г–ї—М—В–Њ–≤, –≤–µ–љ–Њ–Ј–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤. –Х—Б–ї–Є —Г –ґ–µ–љ—Й–Є–љ –њ–µ—А–µ–і –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –Ю–Ъ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —В—А—Г–і–љ–Њ —Б—Г–і–Є—В—М –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–Љ –љ–∞–ї–Є—З–Є–Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –і–µ—Д–µ–Ї—В–Њ–≤ –≥–µ–Љ–Њ—Б—В–∞–Ј–∞, –∞ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є –Њ–њ—А–∞–≤–і–∞–љ—Л —В–Њ–ї—М–Ї–Њ –≤ —Б–ї—Г—З–∞–µ —Б–µ–Љ–µ–є–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞, —В–Њ —Г –ґ–µ–љ—Й–Є–љ –Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –њ–∞—В–Њ–ї–Њ–≥–Є—О —Б–≤–µ—А—В—Л–≤–∞—О—Й–µ–є —Б–Є—Б—В–µ–Љ—Л –Ї—А–Њ–≤–Є –Љ–Њ–ґ–љ–Њ –Ј–∞–њ–Њ–і–Њ–Ј—А–Є—В—М –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Њ—В—П–≥–Њ—Й–µ–љ–љ–Њ–≥–Њ –∞–Ї—Г—И–µ—А—Б–Ї–Њ–≥–Њ –Є —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞.
–° –љ–∞—И–µ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –≤—Л—Б–Њ–Ї—Г—О —Б—В–Њ–Є–Љ–Њ—Б—В—М –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є, —Б–Ї—А–Є–љ–Є–љ–≥ –љ–∞ –њ—А–µ–і–Љ–µ—В –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ–Њ–є –Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є–Є –њ–µ—А–µ–і –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є —П–≤–ї—П–µ—В—Б—П –Њ–њ—А–∞–≤–і–∞–љ–љ—Л–Љ. –Я—А–Є –љ–∞–ї–Є—З–Є–Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є–Є –Є/–Є–ї–Є –Р–§–° –Ч–У–Ґ –∞–±—Б–Њ–ї—О—В–љ–Њ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–∞. –Я—А–Є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е —Б–Ї—А–Є–љ–Є–љ–≥-—В–µ—Б—В–Њ–≤ –љ–∞ —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є—О –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Ч–У–Ґ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –Љ–∞—А–Ї–µ—А–Њ–≤ —В—А–Њ–Љ–±–Њ—Д–Є–ї–Є–Є (–Ґ–Р–Ґ, D-–і–Є–Љ–µ—А, —Д—Г–љ–Ї—Ж–Є—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤) –Ї–∞–ґ–і—Л–µ 3 –Љ–µ—Б. –Я—А–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –і–∞–ї—М–љ–µ–є—И–∞—П –Ч–У–Ґ –љ–µ –њ–Њ–Ї–∞–Ј–∞–љ–∞.
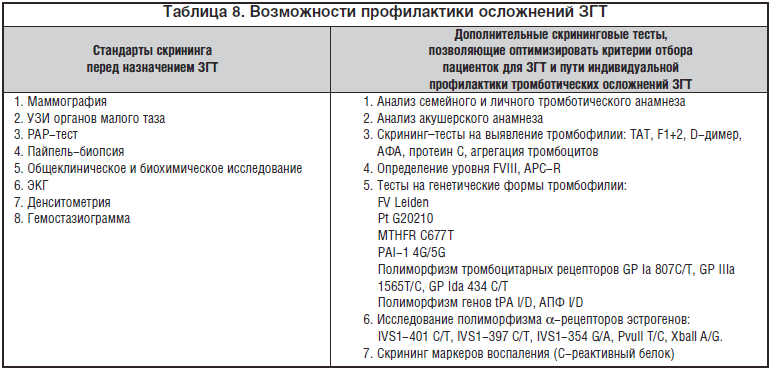
–Я—А–Њ–≤–µ–і–µ–љ–Є–µ —Б–Ї—А–Є–љ–Є–љ–≥–∞ –Љ–∞—А–Ї–µ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –°–†–С) –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ—Г—В–∞—Ж–Є–є a-—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –і–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ–Љ–Њ–ґ–µ—В –≤—Л—П–≤–Є—В—М –ґ–µ–љ—Й–Є–љ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ч–У–Ґ –і–∞–ґ–µ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –і—А—Г–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞. –Ъ–Њ–љ—В—А–Њ–ї—М–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –Љ–∞—А–Ї–µ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ–Њ–Ј–≤–Њ–ї–Є—В —А–µ—И–Є—В—М –≤–Њ–њ—А–Њ—Б –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–Є—П —В–µ—А–∞–њ–Є–Є, —З—В–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ –≤ –њ–µ—А–≤—Л–µ –Љ–µ—Б—П—Ж—Л –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Ї–Њ–≥–і–∞ —А–Є—Б–Ї –≤–µ–љ–Њ–Ј–љ—Л—Е –Є –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В (—В–∞–±–ї. 8).
–°–њ–Є—Б–Њ–Ї —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є
AT II вАУ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ II
AT III вАУ –∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ III
–∞–Ы–Я вАУ –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ –∞
–Р–Я–§ вАУ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–њ—А–µ–≤—А–∞—Й–∞—О—Й–Є–є —Д–µ—А–Љ–µ–љ—В
–Р–§–Р вАУ –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–µ –∞–љ—В–Є—В–µ–ї–∞
–Р–§–° вАУ –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–є —Б–Є–љ–і—А–Њ–Љ
–Т–Р вАУ –≤–Њ–ї—З–∞–љ–Њ—З–љ—Л–є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В
–Т–Ґ–≠ вАУ –≤–µ–љ–Њ–Ј–љ—Л–є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–Ј–Љ
–Х–Ґ-1 вАУ —Н–љ–і–Њ—В–µ–ї–Є–љ-1
–Ч–У–Ґ вАУ –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–∞—П –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П
–Ш–Ь вАУ –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞
–Ъ–≠–≠ вАУ –Ї–Њ–љ—К—О–≥–Є—А–Њ–≤–∞–љ–љ—Л–µ —Н–Ї–≤–Є–љ-—Н—Б—В—А–Њ–≥–µ–љ—Л
–Ы–Т–Я вАУ –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ—Л –≤—Л—Б–Њ–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є
–Ь–Я–Р вАУ –Љ–µ–і—А–Њ–Ї—Б–Є–њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–∞ –∞—Ж–µ—В–∞—В
–Ю–Ъ вАУ –Њ—А–∞–ї—М–љ—Л–µ –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤—Л
–Њ–Ы–Э–Я вАУ –Њ–Ї–Є—Б–ї–µ–љ–љ—Л–µ –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ—Л –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є
–°–†–С вАУ –°-—А–µ–∞–Ї—В–Є–≤–љ—Л–є –±–µ–ї–Њ–Ї
–Ґ–Р–Ґ вАУ –Ї–Њ–Љ–њ–ї–µ–Ї—Б —В—А–Њ–Љ–±–Є–љ-–∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ
–≠–†a вАУ a-—А–µ—Ж–µ–њ—В–Њ—А —Н—Б—В–Њ–≥–µ–љ–Њ–≤
–Р–†–° вАУ –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ—Л–є –њ—А–Њ—В–µ–Є–љ –°
–Р–†–°-R вАУ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ–Њ–Љ—Г –њ—А–Њ—В–µ–Є–љ—Г –°
bFGF вАУ —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞ —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ b
F1+2 вАУ —Д—А–∞–≥–Љ–µ–љ—В—Л 1+2 –њ—А–Њ—В—А–Њ–Љ–±–Є–љ–∞
FV Leiden вАУ –ї–µ–є–і–µ–љ–Њ–≤—Б–Ї–∞—П –Љ—Г—В–∞—Ж–Є—П —Д–∞–Ї—В–Њ—А–∞ V
GP вАУ –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ
IGF-1 вАУ–Є–љ—Б—Г–ї–Є–љ–Њ–њ–Њ–і–Њ–±–љ—Л–є —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞
IL вАУ –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ
MTHFR вАУ –Љ–µ—В–Є–ї–µ–љ—В–µ—В—А–∞–≥–Є–і—А–Њ—Д–Њ–ї–∞—В—А–µ–і—Г–Ї—В–∞–Ј–∞
PAI-1 вАУ –Є–љ–≥–Є–±–Є—В–Њ—А –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞ 1
–†–Р–† вАУ –Ї–Њ–Љ–њ–ї–µ–Ї—Б –њ–ї–∞–Ј–Љ–Є–љ-–∞–љ—В–Є–њ–ї–∞–Ј–Љ–Є–љ
PDGF вАУ —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л–є —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞
Pt вАУ –њ—А–Њ—В—А–Њ–Љ–±–Є–љ
TF вАУ —В–Ї–∞–љ–µ–≤—Л–є —Д–∞–Ї—В–Њ—А
TFPI вАУ –Є–љ–≥–Є–±–Є—В–Њ—А –њ—Г—В–Є —В–Ї–∞–љ–µ–≤–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞
TNF-a - —В—Г–Љ–Њ—А-–љ–µ–Ї—А–Њ—В–Є–Ј–Є—А—Г—О—Й–Є–є —Д–∞–Ї—В–Њ—А a
tPA вАУ —В–Ї–∞–љ–µ–≤—Л–є –∞–Ї—В–Є–≤–∞—В–Њ—А –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞
VEGF вАУ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л–є —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞












