Начиная с 80–х годов XX века, АСК активно вошла в клиническую практику при лечении острого коронарного синдрома (ОКС) с целью предупреждения развития ИМ как антиагрегант с полностью доказанным действием в профилактике смертности при сердечно–сосудистых и цереброваскулярных заболеваниях.
В 1989 году в исследовании Physicians’ Health Study (США), в которое было включено 22000 врачей–мужчин в возрасте 40–84 года, в группе здоровых лиц, принимавших АСК (325 мг/сут.), в среднем через 5 лет отмечено уменьшение риска развития ИМ на 44% по сравнению с аналогичной группой обследуемых без приема АСК. В 2002 году в журнале «Antithrombotic Trialists’ Collaboration» были опубликованы результаты метанализа 287 рандомизированных клинических исследований у 135000 пациентов, в которых было показано, что при назначении АСК как антиагреганта отмечено снижение на 25% риска развития сердечно–сосудистых осложнений: нефатальный инфаркт миокарда, нефатальный мозговой инсульт.
Инфаркт миокарда – ишемический некроз сердечной мышцы в 95% случаев развивается в результате формирования тромба в коронарной артерии, что подтверждается данными аутопсии среди умерших в первые три часа от начала развития болевого синдрома и результатами коронарографического исследования у больных, поступивших в стационар в первые часы развития миокардиальной катастрофы.
Тромбообразование играет ключевую роль в развитии различных сердечно–сосудистых осложнений. В патогенезе тромбообразования ключевую роль играют три патологических процесса, определяемых как триада Вирхова: 1 – повреждение эндотелия сосудистой стенки (воспаление, атеросклероз); 2 – замедление кровотока в сосудистом русле (застой, сердечная недостаточность); 3 – изменения коагуляционного потенциала крови (гиперкоагуляция). Побудительными моментами в развитии триады Вирхова являются различные заболевания, сопровождающиеся длительным гипокинезом (постельный режим), воспалительной реакцией организма, нарушениями кровотока в периферических отделах ССС и сопровождающиеся различными инвазивными лечебно–диагностическими мероприятиями.
В патогенезе ишемических болезней органов и систем человеческого организма ИБС (острый коронарный синдром, инфаркт миокарда), ишемического мозгового инсульта, гангрены конечностей и других нарушений кровоснабжения органов и тканей значительное место занимают воспалительные и атеросклеротические повреждения сосудов с нарушением целостности интимы, замедление кровотока, дисбаланс свертывающей и противосвертывающей системы и нарушение реологических параметров крови. При повреждении эндотелия сосудов различной этиологии происходит формирование тромба и вследствие этого критическое сужение просвета сосудов или его полное закрытие (частичная или полная окклюзия). В нарушениях реологических параметров крови агрегационное состояние тромбоцитов и эритроцитов играют ведущую роль.
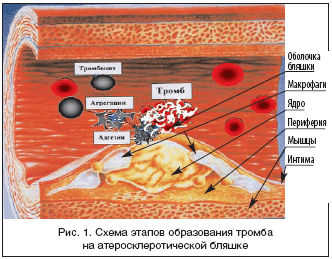
При воспалительном и атеросклеротическом повреждении эндотелия сосудов различной локализации отмечены регионарные и системные изменения коагуляционного потенциала крови в сторону гиперкоагуляции за счет повышения агрегационной и адгезивной активности тромбоцитов и эритроцитов, активации плазменных коагуляционных факторов (фибриноген, фибринстабилизирующий фактор, появление фибрин–мономерных комплексов), что ведет к истощению активности антикоагулянтных компонентов крови и угнетению фибринолиза (рис. 1).
В настоящее время в клинической практике с целью профилактики и лечения тромбоэмболических осложнений используют 4 класса антитромботических препаратов: 1 – антиагреганты (препараты, воздействующие на адгезию и агрегацию тромбоцитов – нестероидные противовоспалительные препараты – АСК, клопидогрел), 2 – непрямые антикоагулянты (ингибиторы тромбина, воздействующие на витамин К–зависимые факторы свертывания – варфарин), 3 – прямые антикоагулянты (гепарин, низкомолекулярные гепарины), 4 – тромболитические препарты (средства, активирующие фибринолитическую систему через преобразование плазминогена в плазмин).
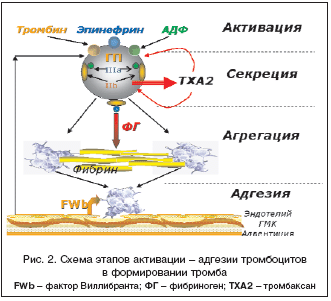
Современное лечение и профилактика сердечно–сосудистых осложнений, в частности инфаркта миокарда, невозможны без четкого представления механизмов тромбообразования, материальным субстратом которого являются тромбоциты, эритроциты, фибриноген. В процессе тромбообразования тромбоцит проходит четыре стадии: стадия активации, стадия высвобождения активных биологических веществ (тромбоксаны, АДФ, серотонин, гликопротеидных рецепторов – IIIa/IIb), стадия агрегации, стадия адгезии. Эти процессы (макро– и микротромбообразование) особенно бурно проявляются при дестабилизации коронарного кровотока – остром коронарном синдроме (ОКС), включая инфаркт миокарда (ИМ). В основе макро– и микротромбообразования лежат механизмы, стимулирующие агрегационную активность тромбоцитов и эритроцитов – наличие ускоренного, турбулентного тока крови в суженном атеросклеротической бляшкой участке сосуда, что способствует повреждению эндотелия с развитием эндотелиальной дисфункции и «обнажению» коллагена, одного из главных факторов агрегации и адгезии тромбоцитов. Тромбоциты вступают в контакт с субэндотелиальным слоем, в частности с главным стимулятором адгезии – коллагеном, образуют отростки с образованием тромбоцитарных конгломератов (агрегация) и приклеиваются (адгезия) на этих участках, образуя белый тромб.
Активация тромбоцитов осуществляется катехоламинами, тромбином, АДФ, серотонином, коллагеном, тромбоксаном 2 (ТХА2) – продуктом метаболизма арахидоновой кислоты.
В результате активации тромбоцитов происходит высвобождение из последних биологически активных веществ (АДФ, ТХА2, серотонина) и лабилизация мембраны тромбоцита с образованием гликопротеидных (ГП) рецепторов IIIa/IIb под действием АДФ и ТХА2.
Агрегация тромбоцитов – образование тромбоцитарных конгломератов в плазме крови происходит при активации и взаимодействии ГП рецепторов IIIa/IIb, через образования фибриновых мостиков между тромбоцитами.
Адгезия – прилипание тромбоцитарных конгломератов к поврежденной интиме сосудов контролируется фактором Виллибранта (FWb) (рис. 2).
Таким образом, активация тромбоцитов – ключевой момент в патогенезе сердечно–сосудистых осложнений, во многом определяющий выраженность нарушений кровоснабжения органов и тканей (сердце, головной мозг, периферические сосуды), поэтому антиагрегационная терапия является патогенетически обоснованной.
В настоящее время выделяют две группы антитромбоцитарных препаратов, в основе разделения которых лежат принципы доказательной медицины, использующие понятия эффективности и наличия побочных эффектов. Первая группа антитромбоцитарных препаратов, применение которых не рекомендуется для практической кардиологии вследствие отсутствия доказательной основы преимуществ перед АСК, неэффективности и потенциальной опасности: сульфинпиразон, дипиридамол, простациклин, блокаторы синтетазы тромбоксана А2, антагонисты рецепторов тромбоксана А2, ингибиторы IIIa/IIb рецепторов тромбоцитов для приема внутрь. Вторая группа, составляющая основу современной антитромбоцитарной терапии: АСК, тиенопиридины (клопидогрел, тиклопидин) и блокаторы ГП рецепторов IIIa/IIb для внутривенного применения (абсиксимаб, эптифибатид, тирофибан) [2,4,7–10,12].
Наиболее перспективным, c точки зрения эффективности профилактики и лечения тромбозов, является использование ацетилсалициловой кислоты без или в сочетании с тиенопиридинами, что и является предметом обсуждения данной работы.
Как указывалось выше, АСК используется в медицинской практике более 100 лет. Начиная с 80–х годов XX века, АСК активно вошла в клиническую практику при лечении острого коронарного синдрома (ОКС) с целью предупреждения развития ИМ. Проведено несколько значительных исследований (VA, RISC, ISIS–2), которые убедительно продемонстрировали способность АСК снизить риск развития ОИМ и острой коронарной смерти на 41–70% [3,4,12]. Однако в ряде независимых исследований ОКС без подъема сегмента ST на ЭКГ (ESSENCE, PISM PLUS) было установлено, что ближайший прогноз зависит от предшествующего приема АСК до развития обострения ИБС. Так, в исследовании PRISM PLUS при применении АСК при ОКС частота развития ИМ, рефрактерной стенокардии и внезапной смерти к 7–му дню наблюдения составила 12,1% среди больных, не принимавших ранее АСК, и 23,5% – среди лиц, принимавших АСК до развития обострения. Этот факт получил образное название «аспириновый парадокс», что послужило поводом для Bhatt D.L. и Topol E.J. (2003 г.) отнести АСК к «субоптимальным антитромбоцитарным средствам» [10,16].
Одновременно отмечено, что применение АСК в малых дозах в сочетании с антиангинальными препаратами у больных ИБС повышает риск возникновения безболевой формы ишемии миокарда, что может привести к развитию более выраженной ишемии миокарда во время физической нагрузки в связи с отсутствием своевременного сигнала в виде болевого приступа. Существует мнение, что при вазоспастической форме стенокардии (Ангина Принцметала) не рекомендуется назначать АСК, так как она ингибирует действие естественного вазодилататора простагландина I2.
В последние годы активно обсуждается проблема резистентности к терапии АСК (АР), под которой понимают неспособность АСК у некоторых больных в должной мере подавлять функцию тромбоцитов, снижать синтез тромбоксана А2 и/или удлинять время кровотечения. Распространенность резистентности к терапии АСК, по данным различных исследований, составляет от 10 до 45%, что противоречит положительным клиническим результатам применения АСК. Одна из наиболее вероятных причин АР – недостаточная приверженность пациентов лечению (non–complience). Режим лечения АСК не соблюдают до 40% больных с сердечно–сосудистыми заболеваниями.
Среди возможных причин этого феномена выделяют следующие:
1. Фармакодинамические взаимодействия АСК с нестероидными противовоспалительными препаратами;
2. Наличие нетромбоцитарных источников синтеза тромбоксанов А2 (эндотелий, моноцитарная/макрофагальная циклооксигиназа–2 – ЦОГ–2);
3. Экспрессия ЦОГ–2 во вновь образующихся тромбоцитах;
4. Гидролиз АСК эстеразами слизистой оболочки ЖКТ;
5. Повышенный синтез тромбоксана А2 (Тромбоцитоз);
6. Гиперлипидемия;
7. Генетические особенности.
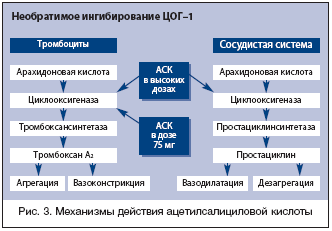
Есть основания полагать, что резистентность к терапии АСК может быть связана с полиморфизмом гена циклооксигеназы, затрагивающим активный центр фермента (Ser529), полиморфизмом генов, кодирующих другие ферменты, участвующие в мобилизации и метаболизме арахидоновой кислоты (фосфолипазы, тромбоксансинтетазы) и полиморфизмом генов, кодирующих другие ГП рецепторы тромбоцитов [8]. Механизм действия ацетилсалициловой кислоты представлен на рисунке 3.
Существуют и другие механизмы действия АСК, которые отличают от других антиагрегантных препаратов и обуславливают ее уникальность. АСК оказывает ингибирующее влияние на образование фибрина через подавление образования тромбина и функционального состояния фибриногена (блокирует лизин в молекулах фибриногена). Одновременно АСК способна активировать фибринолиз через высвобождение активаторов плазминогена и «разрыхления» волокон фибрина.
Выбор оптимальной дозировки АСК базируется на представлениях о том, что ее антитромботический эффект связан с подавлением агрегации тромбоцитов за счет необратимой блокады в них фермента циклооксигеназы–1 (ЦОГ–1) и почти полного подавления продукции тромбоксана А2. Особенностью этого фермента является его чрезвычайно высокая чувствительность к действию АСК, которая в десятки раз превышает таковую циклооксигеназы–2 (ЦОГ–2), ответственной за продукцию простациклина в эндотелии сосудов. Таким образом, в малых дозах АСК, блокируя только ЦОГ–1 и оставляя интактной ЦОГ–2, вызывает преимущественное снижение продукции тромбоксана А2, в то время как уровень простациклина, мощного естественного вазодилататора и антиагреганта, сохраняется достаточно высоким. В более высоких дозах АСК вызывает подавление обоих изоферментов. По мнению C. Patrono (1996 г.), наиболее адекватной дозой АСК является 75 мг/сут., поскольку, будучи наименьшей реально эффективной, она обладает предупреждающим действием в отношении инсульта и сосудистой смерти у лиц с цереброваскулярной патологией.
В отличие от АСК, которая ингибирует только вторую фазу агрегации тромбоцитов индуцированную АДФ, тиклопидины ингибируют обе фазы – агрегацию и адгезию. Тиенопиридины также тормозят активацию тромбоцитов вызванную коллагеном, адреналином, тромбином и серотонином. При этом они не затрагивают метаболизм арахидоновой кислоты и, таким образом, не влияют на синтез простациклина эндотелием сосудов. Поэтому в настоящее время группа тиенопиридинов – синергистов АСК, представляет интерес для практической медицины [5,6,7]. Клопидогрел относится к группе тиенопиридинов, его действие начинается с 2–го – 4–го часа от начала лечения и достигает максимума к концу 2 – 3 дня лечения.
Кроме всего перечисленного, тиенопиридины повышают пластичность (деформируемость) эритроцитов, способствуя улучшению реологических свойств крови и микроциркуляции, что подтверждено в наших исследованиях – увеличение электрофоретической подвижности эритроцитов под действием тиклопидина в дозе 400 мг/сут.; одновременно препарат понижал вязкость крови путем снижения фибриногена плазмы [6–8].
В настоящее время накоплен значительный клинический опыт применения тиенопиридинов при различных сердечно–сосудистых патологиях: ОКС, инсульт головного мозга, облитерирующий атеросклероз сосудов нижних конечностей и диабетическая ангиопатия.
Наилучшие результаты получены при комбинированном лечении тиенопиридинами в сочетании с АСК, что позволило уменьшить терапевтические дозы указанных препаратов, снизить количество побочных эффектов и удешевить лечение [3,12].
В исследованиях CATS (Canadian–American Ticlopidin Stady), куда были включены результаты лечения 1053 пациентов, перенесших недавно (в последние 4 месяца) эпизоды ишемических приступов, было продемонстрировано уменьшение риска развития ИМ, повторного инсульта и сосудистой смерти на 30,2% [12,20].
Сходные результаты представлены французскими исследователями Aican Y.C. с сотрудниками (1989) и в шведском многоцентровом исследовании STIM. Французские исследователи наблюдали за 169 пациентами, в исследование STIM было включено 687 пациентов с перемежающейся хромотой. Назначение тиклопидина проводилось по стандартной методике: 250 мг в сутки с добавлением 75–100 мг АСК в сутки. В обеих группах наблюдения количество сосудистых осложнений снизилось на 38–40%, с одновременным улучшением периферического кровотока [12,16].
По данным исследования TASS (Ticlopidine Aspirine Stroke Stady), которое было выполнено с целью сравнения профилактической активности тиклопидина (500 мг в сутки) и ацетилсалициловой кислоты (1300 мг в сутки) у больных с ИБС, эффективность тиклопидина была значительно выше при меньшем количестве побочных эффектов: риск развития инсультов в группе тиклопидина был на 24% меньше в первый год наблюдения по сравнению с группой пациентов, принимавших АСК в указанной дозе [3,5,9,20].
Таким образом, в настоящее время наиболее предпочтительным, с точки зрения критерия «эффект/стоимость», является использование АСК (75 мг в сутки) в сочетании с тиенопиридинами или в виде монотерапии (в дозе не более 150 мг), так как последние являются мощными ингибиторами агрегации и адгезии тромбоцитов и эритроцитов, а следовательно, эффективными антитромботическими средствами, применяющимися в кардиологической практике.
Основной клинической проблемой применения АСК, помимо риска кровотечений (особенно у пожилых пациентов), являются осложнения со стороны желудочно–кишечного тракта в виде развития диспептических расстройств и эрозивно–язвенного гастрита. Эрозивно–язвенные изменения слизистой желудочно–кишечного тракта на фоне приема ацетилсалициловой кислоты в стандартизированных дозах, применяемых в кардиологической практике, – общеизвестный факт [12–14,21].
Долгое время единственным и практически 100% решением этой проблемы многие клиницисты считали применение кишечно–растворимых форм ацетилсалициловой кислоты. Однако, согласно результатам последних исследований, отмечено образование эрозий и язв желудка даже при применении Аспирина, покрытого кишечно–растворимой оболочкой, которые рубцевались в 90% наблюдений при применении циметидина и антацидов только после отмены этих форм АСС [1,3].
Сравнительно мало известны и недавно описаны поражения тонкого и толстого кишечника, вызванные АСК и другими нестеродными противовоспалительными препаратами: скрытые и явные кровотечения, перфорации, стриктуры, обострения хронических энтероколитов. Частота этих осложнений дистальнее двенадцатиперстной кишки значительно меньше, чем в желудке и начальном отделе двенадцатиперстной кишки, тем не менее они также оказывают отрицательное влияние на практическую значимость АСК в профилактике ишемических приступов [17–19].
Поражения тонкого кишечника в виде энтеропатий при приеме ацетилсалициловой кислоты встречались чаще, чем в контрольной группе пациентов (не принимавших АСК). Наиболее характерными были: диафрагмоподобные стриктуры – синдром обструкции тонкого кишечника и АСК–индуцированная энтеропатия – синдром, характеризующийся кишечными кровотечениями, потерей белка и малбабсорбцией.
Поражения толстого кишечника при приеме нестероидных противовоспалительных препаратов бывают двух типов:
I – поражения в ранее неизмененной толстой кишке (острый колит, одиночные язвы–эрозии в слепой, ободочной, сигмовидной кишке);
II – поражения в ранее измененном кишечнике (перфорации при дивертикулезе, обострение хронических воспалительных процессов).
Вопросы профилактики поражения слизистой желудочно–кишечного тракта при назначении ацетилсалициловой кислоты до конца не изучены. В настоящее время, по данным литературы, очевидно лишь то, что использование кишечно–растворимых форм ацетилсалициловой кислоты не решает этой проблемы.
Все выше перечисленное ставит перед фармакологами и клиницистами задачи создания и внедрения в клиническую практику новых форм лекарственных препаратов, способных защитить желудочно–кишечный тракт от повреждающего воздействия пероральных нестероидных противовоспалительных препаратов.
АСК–индуцированные осложнения в слизистой желудочно–кишечного тракта диктуют его отмену и назначение цитопротекторов – антацидов. В ряде клинических и экспериментальных исследований показано, что антациды способны эффективно лечить и профилактировать возникновение эрозий и язв в слизистой оболочке желудка при применении нестероидных противовоспалительных препаратов. Было продемонстрировано, что цитопротекторный эффект антацидов реализуется через стимуляцию образования простагландинов в стенке желудка (снижение простагландинов в слизистой желудка – основной механизм эрозивно–язвенного процесса, вызванного применением АСК), усиление секреции бикарбонатов и увеличение гликопротеинов в слизистой желудка.
В настоящее время собый интерес представляет препарат Кардиомагнил (фармацевтическая компания «Nycomed»), который включает в себя соединение ацетилсалициловую кислоту (в наиболее эффективных и безопасных дозах – 75 и 150 мг) с невсасывающимся антацидом – гидроокисью магния.
Невсасывающиеся антациды являются одними из наиболее часто применяемых препаратов в гастроэнтерологической практике при лечении заболеваний желудка, в том числе и язвенной болезни. Свой положительный эффект невсасывающиеся антациды реализуют через адсорбцию соляной кислоты в желудке. Кроме того, они обладают и рядом других положительных эффектов: снижают протеолитическую активность желудочного секрета (адсорбируют пепсин, снижают его активность через повышение рН среды), обладают обволакивающим свойством, связывают лизолецитин и желчные кислоты, оказывающие неблагоприятное воздействие на слизистую желудочно–кишечного тракта.
Гидроокись магния, входящая в состав Кардиомагнила, является наиболее быстродействующим антацидом по сравнению с гидроокисью алюминия, что является чрезвычайно важным моментом при использовании этого препарата в антиагрегантном лечении. Ацетилсалициловая кислота быстро всасывается из желудочно–кишечного тракта: терапевтические концентрации АСК в плазме крови достигаются через 15–20 минут от момента приема препарата, при этом специально проведенные исследования показали, что гидроокись магния в составе Кардиомагнила не влияет на скорость всасывания ацетилсалициловой кислоты [1,3].
Кому показан Кардиомагнил?
• Пожилые люди (после 60 лет)
• Пациенты, страдающие ИБС
• Пациенты, страдающие цереброваскулярными заболеваниями
• Пациенты, перенесшие инфаркты и инсульты
• Люди среднего возраста (35–50 лет), имеющие высокий риск сердечно–сосудистых заболеваний.
Дозы и способы применения Кардиомагнила:
• Для первичной профилактики:
первые 2–3 дня по 150 мг, далее по 75 мг в сутки вечером, после еды
• Для вторичной профилактики и лечения:
по 150 мг в сутки длительно.
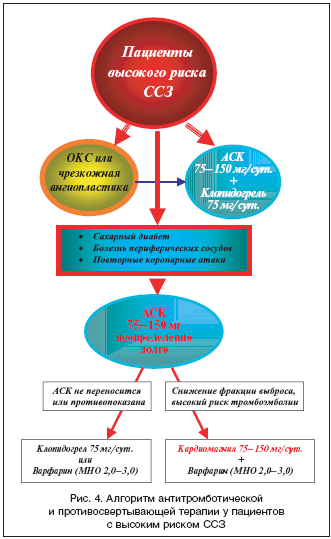
На рисунке 4 представлен алгоритм применения АСК в группе пациентов с высоким риском сердечно–сосудистых заболеваний.
Таким образом, профилактика тромбозов и тромбоэболий, являющихся ключевым моментом в развитии сердечно–сосудистых патологий (острый коронарный синдром, острый инфаркт миокарда, ишемические инсульты, тромбоэмболии легочной артерии, поражение почек, периферические ангиопатии) с помощью антиагрегантных препаратов является определяющим направлением в лечении больных в терапевтической и хирургической практике. Ацетилсалициловая кислота, тиенопиридины (в частности клопидогрел) способствуют активной профилактике тромбоэмболизма, а их сочетание позволяет уменьшить количество принимаемого препарата с повышением терапевтической активности и снижением побочных эффектов.
Кардиомагнил – первая комбинация в России ацетилсалициловой кислоты (антиагрегант) и гидроокиси магния (антацидный компонент) как протектора ульцерогенного и диспептического действия АСК, что позволяет рекомендовать его в широкую практику лечения и профилактики сердечно–сосудистых катастроф.
Литература
1. Кукес В.Г., Остроумова О.Д. Кардиомагнил. Новый взгляд на ацетилсалициловую кислоту. Пособие для врачей.2004.
2. Остроумова О.Д. Ацетилсалициловая кислота – препарат номер один для лечения сердечно–сосудистых заболеваний. Основные показания к применению, клинические преимущества, эффективные дозы и пути повышения переносимости. Рус. Мед. Журнал. 2003. т 11,№5, 253.
3. Остроумова О.Д. Возможности применения кардиомагнила у пациентов с сахарным диабетом. Рус. Мед. Журнал. 2004, т.12, №5, 350.
4. Панченко Е.П. Антитромботическая терапия острых коронарных синдромов без подъема сегмента ST. Consilium Medicum. 2001.Т3, №10, 472.
5. Шалаев С.В. Антитромбоцитарные средства в лечение острых коронарных синдромов. Фарматека. 2003.312, 94.
6. Шилов А.М., Мельник М.В. Тиклин в профилактике и лечении сердечно–сосудистых заболеваний. Ж. Рос. Мед. Вести. 2003, №4, 42.
7. Шилов А.М., Святов И.С., Санодзе И.Д. Антиагреганты – современное состояние вопроса. Рус. Мед. Журнал. 2003. Т11, №9, 552.
8. Ушкалова Е.А. Аспиринорезистентность: механизмы развития, методы определения и клиническое значение. Фарматека. 2006. №13,35–41.
9. Antitrobotic Nrialists, Collaboration, Collaborative meta–analisis of randomized trials of antiplatielet therapy for prevention of death, myocardial infaction and stroke in high risk patients. BMJ. 2002, 324, 71.
10. Bhatt D.L., Topol E.J. Scientific and therapeutic advances in antiplatelet therapy. Nature Reviews. 2003. 2, 15.
11. Chan F.K., Chung S.C., Suen B.Y. et al. Preventing recurrent upper gastrointestinal bleeding in paitients with Helicobacter pylori infection who are taking low–dose aspirin or naproxen. N. Engl. J. Med. 2001, 29; 344(13):967.
12. Clopidogrel in Unstable angina to prevent Recurrent Events trial (CURE) investigators. Effects of dopidogrel in addition to aspirin in patients with acute coronary syndromes without ST–segment elevation. N.Engl.J.Med. 2001.345, 494.
13. Cole F.T., Hudson N., Liew L.C. et al. Protection of Human gastric mucosa against aspirin–enteric coating or dose reduction?. Aliment. Pharmacol. Ther. 1999. 13 (2): 187.
14. Dommann H. G., Burhardt F., Wolf N. Enteric coating of aspirin significantly decreases gastroduodenal mucosal lesions. Aliment. Pharmacol. Ther. 1999. 13 (8): 1109.
15. Kelly J.P., Kaufman D.W., Jugelon J.M. et al. Risk of aspirin–associated major upper– gastrointestinal bleeding with enteric–coated or buffered product. Luncet. 199б, 348:1413/
16. Mehta S., Ysuf S., Peters R and all. Effects of pretreatment with clopidogrel and aspirin fallowed by long–term therapy in patients undergoing percutaneous coronary intervention: the PCI–CURE study. Lancet. 2001. 358, 527.
17. Petrosky D. Gastric safety and enteric–coated aspirin. Luncet, 1997, 349.
18. Petrosky D. Endoscopic comparison of three aspirin preparations and placebo. Clin. Ther. 1993, 15: 314.
19. Petrosky D. Endoscopic comparison of various preparations: gastric mucosal adaptability to aspirin restudied. Curr. Ther. Res. 1989, 45:345.
20. The Assessment of the Safety and Efficacy of a New Thrombolytc Regimen. (ASSENT) – 3 investigators. Efficacy and safety of tenecteplase in comination with enoxaparine, aboximab or unfractionated heparin: the ASSENT –3 randomised trial in acute myocardial infarction. Lancet. 2001. 358, 605.
21. Savon J., Allen M.L., DiMarino A.J. Gastrointestinal blood loss with low–dose (325 mg) plain and enteric–coated aspirin administration. Am. J. Gastrointerol. 1995, 90: 581.












