В Европе ХСН является прямой или косвенной причиной до 70% всех госпитализаций больных старше 70 лет. Ежегодно госпитализируется 20–30% больных с ХСН. Из них примерно 1/3 нуждается в повторной госпитализации в течение 6–12 мес.
Наиболее удобна и отвечает запросам практики функциональная классификация Нью–Йоркской ассоциации сердца (NYHA), предполагающая выделение четырех функциональных классов (ФК) по способности больных переносить физические нагрузки (табл. 1). Эта классификация рекомендована к использованию ВОЗ.
Рабочая группа по сердечной недостаточности Европейского общества кардиологов (1995, 2001) рекомендует диагностировать сердечную недостаточность на основании наличия трех критериев:
1) симптомы сердечной недостаточности (в покое или при физической нагрузке);
2) объективные признаки дисфункции сердца (в покое);
3) положительный эффект терапии (в случаях, когда диагноз вызывает сомнение).
Критерии 1 и 2 являются обязательными для постановки диагноза сердечной недостаточности.
При определении тактики лечения ХСН необходимо учитывать немедикаментозные и медикаментозные подходы к лечению.
Немедикаментозные методы лечения сердечной недостаточности. На сегодняшний день рекомендации по диете больных с ХСН носят весьма конкретный характер. Основные позиции заключаются в следующем. При ХСН рекомендуется ограничение приема поваренной соли, причем тем большее, чем выраженнее симптомы болезни и застойные явления.
I ФК – не употреблять соленой пищи (до 3 г NaCL в день);
II ФК – плюс не досаливать пищу (до 1,5 г NaCL в день);
III ФК – плюс продукты с уменьшенным содержанием соли и приготовление еды без соли (<1,0 г NaCL в день).
Ограничение потребления жидкости актуально только в крайних ситуациях: при декомпенсированном тяжелом течении ХСН, требующем в/в введения диуретиков. В обычных ситуациях объем жидкости не рекомендуется увеличивать более 1,5 л/сут.
Пища больных ХСН должна быть калорийной, легкоусваиваемой, с достаточным содержанием витаминов, белка.
Больным с алкогольной кардиопатией употребление алкоголя строго запрещено, пациентам с ишемическим генезом ХСН употребление до 20 мл чистого этанола в сутки может способствовать улучшению прогноза.
Контроль за массой тела пациентов с ХСН приобретает важнейшее значение. Наличие ожирения ухудшает прогноз больного с ХСН, во всех случаях при индексе массы тела (ИМТ) более 25 кг/м2 требуются специальные меры и ограничение калорийности питания.
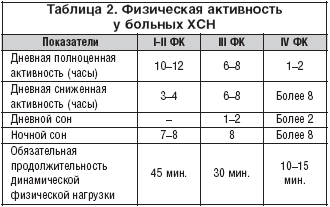
Большое значение для больного с ХСН имеет и физическая реабилитация: ходьба или велотренажер по 20–30 мин. в день до пяти раз в неделю с осуществлением самоконтроля самочувствия, пульса (эффективной считается нагрузка при достижении 75–80% от максимальной для пациента ЧСС) (табл. 2).
Распорядок дня пациента должен быть напрямую увязан с функциональным классом сердечной недостаточности.
При определении подходов к медикаментозной терапии нужно учитывать три ключевые цели:
1) улучшение качества жизни больных (устранение симптомов и признаков застоя во внутренних органах и периферических отеков, повышение толерантности к физической нагрузке);
2) уменьшение необходимости в госпитализации в связи с декомпенсацией ХСН или другими сердечно–сосудистыми осложнениями;
3) увеличение продолжительности жизни больных.
Все лекарственные средства для лечения ХСН можно разделить на три группы:
1. Основные, эффект которых доказан, не вызывает сомнений и которые рекомендованы во всем мире:
• ингибиторы АПФ (иАПФ) – всем больным с ХСН вне зависимости от этиологии, стадии процесса и типа декомпенсации;
• диуретики – всем больным при клинических симптомах ХСН, связанных с избыточной задержкой натрия и воды в организме;
• сердечные гликозиды – в малых дозах и с осторожностью при синусовом ритме, хотя при мерцательной аритмии они остаются средством выбора;
• β–адреноблокаторы (БАБ) – дополнительно в комплексе с назначением иАПФ.
В литературе имеется единственное исследование о возможности улучшения прогноза больных при применении комбинации вазодилататоров (нитратов (изосорбида динитрат) вместе с гидралазином), однако эти результаты никогда не были подтверждены, а побочные реакции подобного лечения (тахикардия, гипотония, головная боль) столь выражены, что в «эру» иАПФ рекомендовать подобный метод лечения нецелесообразно.
2. Дополнительные лекарственные препараты, эффективность и безопасность которых показана в крупных исследованиях, но требует уточнения:
• антагонисты рецепторов к альдостерону, применяемые вместе у больных с выраженной ХСН;
• блокаторы АРА II, используемые у больных, плохо переносящих иАПФ;
• блокаторы медленных кальциевых каналов (амлодипин), применяемые дополнительно к иАПФ при клапанной регургитации и неишемической этиологии ХСН.
Некоторые авторы относят к этой группе препаратов также амиодарон, выделяя его из ряда других антиаритмических средств, так как специальные исследования показали его способность несколько улучшать прогноз больных с ХСН.
3. Вспомогательные лекарственные препараты, эффект которых и влияние на прогноз больных с ХСН не известны (не доказаны), но их применение диктуется определенными клиническими ситуациями:
• периферические вазодилататоры (нитраты) – при сопутствующей стенокардии;
• антиаритмические средства – при жизнеопасных желудочковых аритмиях;
• АСК или иные антиагреганты – у больных после перенесенного ИМ;
• кортикостероиды – при упорной гипотонии;
• негликозидные инотропные стимуляторы – при обострении ХСН, протекающей с упорной гипотонией;
• непрямые антикоагулянты – при дилатации сердца, внутрисердечных тромбозах, мерцательной аритмии и после операций на клапанах сердца (варфарин, фенилин);
• статины – при дислипопротеидемиях.
Важнейшую роль играют, несомненно, препараты основной группы – ингибиторы ангиотензинпревращающего фермента. Этот класс лекарств, безусловно, относится к первой линии в лечении ХСН.
Основные позиции по применению иАПФ в лечении ХСН:
• иАПФ показаны всем больным с ХСН, при любой этиологии и стадии процесса;
• иАПФ улучшают клиническую симптоматику, качество жизни, замедляют прогрессирование болезни, снижают заболеваемость и улучшают прогноз больных с ХСН, т.е. позволяют достичь всех необходимых целей в лечении этого заболевания;
• эти препараты эффективны от самых начальных, включая бессимптомную дисфункцию левого желудочка, до самых поздних стадий ХСН;
• чем раньше начато лечение иАПФ, тем больше шансов на успех и продление жизни пациентов;
• иАПФ являются наиболее обоснованным способом лечения ХСН с сохраненной систолической функцией сердца (уровень доказанности В);
• неназначение иАПФ ничем не оправдано и ведет к повышению смертности среди декомпенсированных больных;
• побочные эффекты (требующие остановки лечения) осложняют применение иАПФ редко: в 1–2% случаев – из–за азотемии; в 2–3% – из–за сухого кашля и в 3–4% – из–за гипотонии; в этих случаях иАПФ могут быть заменены на блокаторы АРА II;
• абсолютными противопоказаниями к назначению иАПФ являются непереносимость (ангионевротический отек), двусторонний стеноз почечных артерий, беременность;
• назначение всех иАПФ начинается с маленьких доз, при их постепенном (не чаще одного раза в 2–3 дня, а при системной гипотонии еще реже – не чаще одного раза в неделю) титровании до оптимальных (средних терапевтических) доз.
При отсутствии клинических противопоказаний и снижении АД необходимо пытаться постепенно увеличивать дозу иАПФ до максимально переносимой, поскольку при этом снижается число ухудшений состояния здоровья пациентов и госпитализаций по поводу ХСН.
Одним из популярных и часто назначаемых иАПФ является рамиприл. По рамиприлу проведено большое количество многоцентровых исследований, на которые стоит обратить внимание.
Одним из самых крупных исследований рамиприла является НОРЕ, в котором изучалась эффективность препарата в профилактике сердечно–сосудистых осложнений у 9297 пациентов группы высокого риска, не страдающих скрытой дисфункцией левого желудочка или сердечной недостаточностью. Терапия рамиприлом привела к снижению суммарного риска ИМ, инсульта и смерти от сердечно–сосудистых причин на 22%.
В исследовании АIRE изучалось влияние рамиприла на выживаемость больных сердечной недостаточностью после ИМ [9]. В международное многоцентровое исследование были включены 2006 больных, которые получали плацебо или рамиприл с 3–10–го дня после острого ИМ. Больных наблюдали в течение по крайней мере 6 мес. (в среднем 15 мес.). При лечении рамиприлом общая смертность снизилась на 27% (р=0,002). Кроме того, рамиприл вызвал снижение риска других неблагоприятных исходов (смерть, тяжелая/рефрактерная сердечная недостаточность, ИМ или инсульт) на 19% (р=0,008).
Польза лечения проявлялась уже в течение первого месяца и была сопоставимой в различных подгруппах больных (мужчины и женщины, пациенты пожилого и более молодого возраста). Обращает на себя внимание тот факт, что при лечении рамиприлом отмечалось снижение риска повторного ИМ и инсульта. Это позволяет предположить, что благоприятный эффект рамиприла был связан не только с подавлением ремоделирования левого желудочка, но и с его влиянием на развитие атеросклероза.
Также нужно обратить внимание на исследование AASK, в котором приняли участие 1094 афроамериканца в возрасте от 18 до 70 лет с заболеваниями почек (скорость клубочковой фильтрации – 20–65 мл/мин.). Проводилось сравнение влияния трех классов антигипертензивных препаратов на скорость гломерулярной фильтрации при АГ. Пациенты были рандомизированы в группы терапии метопрололом в дозе 50–200 мг/сут. (n=441), амлодипином – 5–10 мг/сут. (n=217) и рамиприлом – 2,5–10 мг/сут. (n=436).
Общая длительность приема препаратов составляла от 3 до 6,4 года. Для одной группы пациентов (n=554) целевой уровень среднего АД был определен как 102–107 мм рт. ст. (обычный уровень), для другой (n=540) – 92 мм рт. ст. и ниже (группа низкого давления). Основными направлениями сравнения являлись: рамиприл против метопролола; амлодипин против метопролола; группа обычного АД против группы низкого АД. Конечными точками исследования были: снижение скорости клубочковой фильтрации от исходной на 50% и более, терминальная почечная недостаточность, смерть. По сравнению с атенололом и амлодипином рамиприл достоверно снижал риск развития конечных точек (на 38% против 22%). Более медленное снижение скорости гломерулярной фильтрации наблюдалось в группе низкого давления.
В рандомизированном открытом исследовании RACE (n=193) сравнивалось влияние рамиприла и атенолола на уровень АД, частоту сердечных сокращений (ЧСС), массу миокарда ЛЖ. Уровень АД достоверно снижался в обеих группах. Достоверное снижение ЧСС наблюдалось только в группе пациентов, принимавших атенолол. Достоверное снижение массы миокарда (по данным эхокардиографии) отмечалось в группе пациентов, принимавших рамиприл.
В исследовании CONSENSUS (Cooperative North Scandinavian Enalapril Survival Study) было показано, что ингибиторы АПФ повышают выживаемость больных ХСН любой тяжести (ФК I–IV по классификации NYHA) [17]. У пациентов с клиническими признаками сердечной недостаточности снижаются как частота внезапной смерти, так и смертность от прогрессирующей сердечной недостаточности. Так, больных с IV ФК наблюдали в среднем 188 дней. При лечении ингибитором АПФ смертность через 6 мес. значительно снизилась (26% против 44%).
Среди представленных на российском фармацевтическом рынке аналогов рамиприла интерес представляет отечественный препарат Дилапрел®, выпускаемый компанией «Вертекс» (Санкт–Петербург).
Дилапрел® тормозит превращение циркулирующего ангиотензина I в ангиотензин II и синтез ангиотензина II в тканях; угнетает тканевую ренин–ангиотензиновую систему, в т.ч. и сосудистой стенки; тормозит высвобождение норадреналина из окончаний нейронов и ослабляет вазоконстрикторные реакции, обусловленные повышением нейрогуморальной активности; понижает секрецию альдостерона и деградацию брадикинина; расширяет почечные сосуды, индуцирует реверсию гипертрофии левого желудочка и патологического ремоделирования сердечно–сосудистой системы.
Кардиопротективный эффект Дилапрела® является следствием влияния на биосинтез простагландинов и стимуляции образования оксида азота (NO) в эндотелии. Препарат уменьшает общее периферическое сопротивление сосудов (ОПСС), особенно в почках, в меньшей степени – во внутренних органах, в т.ч. в печени, коже и незначительно – в мышцах и мозге. Увеличивает регионарный кровоток в этих органах. Повышает чувствительность тканей к инсулину, уровень фибриногена, активирует синтез тканевого активатора плазминогена, способствуя тромболизису.
В печени Дилапрел® метаболизируется с образованием активного метаболита – рамиприлата (в 6 раз активнее ингибирует АПФ, чем рамиприл) – и неактивных метаболитов – дикетопиперазинового эфира, дикетопиперазиновой кислоты, а также глюкуронидов (рамиприла и рамиприлата). Все образующиеся метаболиты, за исключением рамиприлата, фармакологической активности не имеют.
Рамиприлат, активный метаболит рамиприла, подавляет фермент дипептидилкарбоксипептидазу I (синонимы: ангиотензинпревращающий фермент, кининаза II). Этот фермент катализирует превращение ангиотензина I тканями в активный вазоконстриктор ангиотензин II, а также распад активного вазодилататора брадикинина. Уменьшение количества ангиотензина II и подавление распада брадикинина приводят к расширению сосудов. Поскольку ангиотензин II также стимулирует выброс альдостерона, рамиприлат уменьшает выброс альдостерона.
Использование Дилапрела® приводит к выраженному снижению ОПСС. Обычно не наблюдается существенных изменений скорости почечного кровотока и клубочковой фильтрации.
Связывание с белками плазмы крови для действующего вещества препарата Дилапрел рамиприла составляет 73%, для рамиприлата – 56%.
У пациентов с сердечной недостаточностью, развившейся в первые дни острого ИМ (2–9 сут.), при приеме Дилапрела®, начиная с 3–х по 10–е сутки болезни, снижается показатель риска смертности (на 27%), риска внезапной смерти (на 30%), риска прогрессирования ХСН до тяжелой степени (III–IV ФК по классификации
NYHA), резистентной к терапии (на 27%), вероятность последующей госпитализации из–за развития сердечной недостаточности (на 26%).
Начальная доза препатата Дилапрел® составляет 1,25–2,5 мг/сут. В зависимости от реакции пациента на проводимую терапию дозу можно увеличивать. Рекомендуется удваивать ее с интервалами в 1–2 нед. Дозу от 2,5 мг и более принимают однократно или делят на 2 приема в сутки. Максимальная суточная доза – 10 мг.
Препарат улучшает качество жизни больных ХСН и увеличивает выживаемость. У пациентов с острым ИМ Дилапрел® ограничивает зону распространения некроза, улучшает прогноз для жизни. При 6–месячном приеме редуцирует степень легочной гипертензии у пациентов с врожденными и приобретенными пороками сердца. Резкое прекращение приема Дилапрела® не приводит к быстрому и чрезмерному повышению АД.
β–адреноблокаторы (БАБ) долгое время не использовались при лечении ХСН; более того, их считали противопоказанными, поскольку полагали, что БАБ снижают сократимость миокарда. Однако исследования последних лет показали, что БАБ умеренно (в пределах 3–4%) снижают фракцию выброса (ФВ) лишь в первые 10–14 дней лечения.
Механизм действия БАБ при ХСН весьма разнообразен, следует отметить наиболее важные моменты: уменьшение ЧСС и электрической нестабильности миокарда; блокирование процессов ремоделирования сердца и нормализация диастолической функции левого желудочка; уменьшение гипоксии миокарда и восстановление чувствительности β–адренорецепторов к внешним воздействиям.
При длительной терапии ХСН БАБ проявляют уникальное гемодинамическое действие, сходное с сердечными гликозидами, – увеличение насосной функции сердца при снижении ЧСС.
В двух двойных плацебо–контролируемых исследованиях – MERIT–HF и CIBIS–II – показано, что метопролол и бисопролол (на фоне приема иАПФ и диуретиков) снижали общую смертность, вероятность внезапной смерти и смерти от сердечной недостаточности. В исследовании COPERNICUS у таких больных также отмечена положительная роль БАБ карведилола.
Проведенные исследования позволяют рекомендовать для лечения ХСН (на фоне приема иАПФ и мочегонных) и БАБ: карведилол – начиная с дозы с 3,125 мг 2 раза/сут., бисопролол – 1,25 мг 1 раз/сут., метопролол – 12,5 мг 1 раз/сут.
Диуретики. Эти препараты показаны всем больным с отчетливыми признаками ХСН и симптомами избыточной задержки жидкости в организме. Несмотря на их положительное действие, нерациональное применение мочегонных обусловливает активизацию нейрогормонов (прежде всего РААС) и развитие электролитных нарушений.
В связи с этим при использовании мочегонных препаратов необходимо соблюдать следующие правила: применять диуретики вместе с иАПФ; дозы мочегонных должны быть минимальными, не следует стремиться к форсированному диурезу и сразу назначать наиболее сильнодействующие препараты.
Наиболее часто назначают гидрохлоротиазид в дозе 25 мг (натощак), при отсутствии достаточного эффекта дозу повышают до 75–100 мг на прием. Фуросемид – наиболее мощный диуретик, с началом действия через 15–30 мин. после приема (максимум действия – через 1–2 ч). В случаях выраженной ХСН дозы фуросемида варьируют в пределах 20–500 мг (при рефрактерных отеках). Этакриновая кислота назначается в дозах 50–100 мг (реже 200 мг), обладает сходным эффектом с фуросемидом.
Следует иметь в виду, что диурез при наличии отеков не должен более чем на 800 мл превышать количество потребляемой жидкости. Целесообразным считается ежедневное применение подобранных мочегонных препаратов, позволяющих поддерживать стабильный диурез и массу тела больного.
«Ударные» дозы мочегонных препаратов, применяемые 1 раз в несколько дней, тяжело переносятся больными и не могут быть рекомендованы. При рефрактерных отеках, обусловленных прогрессированием ХСН, а также снижением функции почек, гипотонией, диспротеинемией, дисбалансом электролитов, целесообразно сочетание высоких доз фуросемида, вводимого внутривенно (до 200 мг), тиазидного диуретика и спиронолактона (в самых различных дозах – 50–200 мг/сут.).
Сердечные гликозиды остаются в числе основных средств лечения ХСН, хотя и не находятся, как 30 лет назад, во главе этого списка. Препараты этой группы не улучшают прогноза больных ХСН и не замедляют прогрессирования болезни, но улучшают клиническую симптоматику, качество жизни и снижают потребность в госпитализациях из–за декомпенсации, причем не только при мерцательной аритмии, но и при синусовом ритме (уровень доказанности А).
Гликозиды имеют три основных механизма действия: положительный инотропный, отрицательный хронотропный и нейромодуляторный эффекты. В настоящее время в клинической практике обычно используется дигоксин, обладающий оптимальными фармакодинамическими свойствами и доказанной клинической эффективностью (уровень доказанности А). Применение других гликозидов для длительного лечения больных ХСН (например, лантозида) имеет недостаточно оснований.
Таким образом, назначение иАПФ при отсутствии противопоказаний необходимо всем пациентам с ХСН на любой стадии процесса, независимо от этиологии. Рамиприл – иАПФ с обширной доказательной базой по предотвращению развития ХСН, а также улучшению выживаемости пациентов с сердечной недостаточностью, в том числе после инфаркта миокарда.
В настоящее время появилась возможность использования рамиприла не только импортного, но и российского производства. Дилапрел® – первый и единственный в России рамиприл отечественного производства, выпускающийся по стандартам GMP.

Литература
1. AIRE Study Group. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. // Lancet. 1999;342:821–828.
2. The Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin–converting–enzyme inhibitor, ramipril, on cardiovascular events in high–risk patients. // N. Engl. J. Med. 2000;342:145–53.
3. Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П. и др. Национальные рекомендации ВНОК и ОССН по диагностике и лечению ХСН (2–й пересмотр) // Сердечная недостаточность. – 2007. –
№ 8 (1). – С. 4–41.
4. Моисеев В.С. Эффекты рамиприла в лечении и профилактике заболеваний сердечно–сосудистой системы и почек // Клиническая фармакология и терапия. – 2005. – № 5. – С. 52–58.
5. Материалы сайта http://www.efins.ru
6. Материалы сайта http://www.medicinform.net
7. Материалы сайта http://lekmed.ru
8. Материалы сайта http://medic.ossn.ru
9. Материалы сайта http://www.smed.ru
10. Материалы сайта http://www.rlsnet.ru
11. Материалы сайта http://www.medlinks.ru












