–Р–Љ–Є–Њ–і–∞—А–Њ–љ (–Ъ–Њ—А–і–∞—А–Њ–љ) —Б–Њ–Ј–і–∞–≤–∞–ї—Б—П –Ї–∞–Ї –Ї–Њ—А–Њ–љ–∞—А–љ—Л–є –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—В–Њ—А –Є –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ –њ—А–µ–і–љ–∞–Ј–љ–∞—З–∞–ї—Б—П –і–ї—П –ї–µ—З–µ–љ–Є—П —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є. –Ф–µ–ї–Њ –≤ —В–Њ–Љ, —З—В–Њ –≤ 60––µ –≥–Њ–і—Л –њ—А–Њ—И–ї–Њ–≥–Њ –≤–µ–Ї–∞ –≥–Њ—Б–њ–Њ–і—Б—В–≤–Њ–≤–∞–ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П, —З—В–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–є –∞–љ—В–Є–∞–љ–≥–Є–љ–∞–ї—М–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –і–Њ–ї–ґ–µ–љ –Њ–Ї–∞–Ј—Л–≤–∞—В—М –Ї–Њ—А–Њ–љ–∞—А–Њ—А–∞—Б—И–Є—А—П—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ.
–Т 1962 –≥. G. Deltour –Є —Б–Њ–∞–≤—В. –Њ–њ–Є—Б–∞–ї–Є –Ї–Њ—А–Њ–љ–∞—А–Њ—А–∞—Б—И–Є—А—П—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –Є –і—А—Г–≥–Є—Е –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е –±–µ–љ–Ј–Њ—Д—Г—А–∞–љ–∞ –Є –њ—А–µ–і–ї–Њ–ґ–Є–ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Є—Е –і–ї—П –ї–µ—З–µ–љ–Є—П —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –∞–Љ–Є–Њ–і–∞—А–Њ–љ –Њ–±–ї–∞–і–∞–µ—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є –∞–љ—В–Є–∞–љ–≥–Є–љ–∞–ї—М–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –∞–љ—В–Є–∞–љ–≥–Є–љ–∞–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –њ—А–µ–њ–∞—А–∞—В–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –љ–µ —Б—В–Њ–ї—М–Ї–Њ –µ–≥–Њ –њ—А—П–Љ—Л–Љ –Ї–Њ—А–Њ–љ–∞—А–Њ—А–∞—Б—И–Є—А—П—О—Й–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ, —Б–Ї–Њ–ї—М–Ї–Њ –љ–µ–Ї–Њ–љ–Ї—Г—А–µ–љ—В–љ–Њ–є –±–ї–Њ–Ї–∞–і–Њ–є b––∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Б–µ—А–і—Ж–∞. –Ъ–∞–Ї –∞–љ—В–Є–∞–љ–≥–Є–љ–∞–ї—М–љ—Л–є –њ—А–µ–њ–∞—А–∞—В, –∞–Љ–Є–Њ–і–∞—А–Њ–љ –љ–µ –њ–Њ–ї—Г—З–Є–ї —И–Є—А–Њ–Ї–Њ–≥–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—П, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –µ–≥–Њ –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Е—Г–ґ–µ, —З–µ–Љ —Г b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –Є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ –Ї–∞–ї—М—Ж–Є—П.
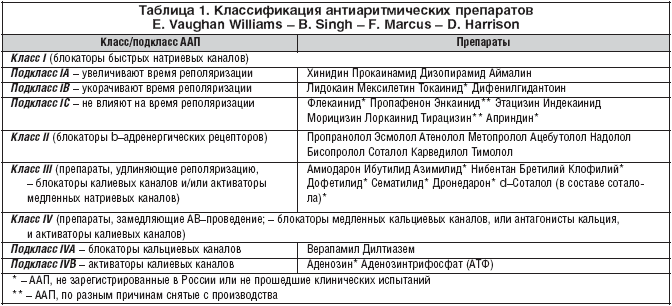
–Т –Ї–Њ–љ—Ж–µ 60–—Е –≥–Њ–і–Њ–≤ XX –≤–µ–Ї–∞ R. Charlier –Є —Б–Њ–∞–≤—В. –≤ –Њ–њ—Л—В–∞—Е –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞. –Т 70––µ –≥–Њ–і—Л –≤ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –≤—Б–µ—Б—В–Њ—А–Њ–љ–љ–µ –Є–Ј—Г—З–µ–љ—Л –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ (–Є –∞–љ—В–Є—Д–Є–±—А–Є–ї–ї—П—В–Њ—А–љ–Њ–≥–Њ) –і–µ–є—Б—В–≤–Є—П –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞, –∞ —В–∞–Ї–ґ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Њ—А–Љ–∞—Е –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞. –Я–Њ —Б–≤–Њ–Є–Љ —Н–ї–µ–Ї—В—А–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Б–≤–Њ–є—Б—В–≤–∞–Љ –∞–Љ–Є–Њ–і–∞—А–Њ–љ –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В –і—А—Г–≥–Є—Е –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Р–Р–Я) (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Е–Є–љ–Є–і–Є–љ–∞, –њ—А–Њ–Ї–∞–Є–љ–∞–Љ–Є–і–∞, –і–Є–Ј–Њ–њ–Є—А–∞–Љ–Є–і–∞, –ї–Є–і–Њ–Ї–∞–Є–љ–∞, b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤), —З—В–Њ –і–∞–ї–Њ –Њ—Б–љ–Њ–≤–∞–љ–Є–µ E.M. Vaughan Williams [ 1 ] –Њ—В–љ–µ—Б—В–Є –µ–≥–Њ –Ї –Њ—Б–Њ–±–Њ–Љ—Г, —В—А–µ—В—М–µ–Љ—Г –Ї–ї–∞—Б—Б—Г –Р–Р–Я (—В–∞–±–ї. 1).
–Т —В–µ—З–µ–љ–Є–µ –±–Њ–ї–µ–µ 30 –ї–µ—В –∞–Љ–Є–Њ–і–∞—А–Њ–љ —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –Р–Р–Я, –Ї–Њ—В–Њ—А—Л–є —Б —Г—Б–њ–µ—Е–Њ–Љ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Ї–∞–Ї –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л—Е –∞—А–Є—В–Љ–Є–є, —В–∞–Ї –Є –Њ—Б–Њ–±–µ–љ–љ–Њ –Љ–µ—А—Ж–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є.
–§–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л
–Я–Њ –Њ—Б–љ–Њ–≤–љ—Л–Љ —Н–ї–µ–Ї—В—А–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Б–≤–Њ–є—Б—В–≤–∞–Љ –∞–Љ–Є–Њ–і–∞—А–Њ–љ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї III –Ї–ї–∞—Б—Б—Г –Р–Р–Я, –Њ–±—Й–Є–Љ —Б–≤–Њ–є—Б—В–≤–Њ–Љ –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П–µ—В—Б—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Є–љ–∞–Ї—В–Є–≤–Є—А–Њ–≤–∞—В—М –Ї–∞–ї–Є–µ–≤—Л–µ –Ї–∞–љ–∞–ї—Л –≤ –Љ–µ–Љ–±—А–∞–љ–µ –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤ –Є —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ —Г–і–ї–Є–љ—П—В—М —В—А–∞–љ—Б–Љ–µ–Љ–±—А–∞–љ–љ—Л–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї –і–µ–є—Б—В–≤–Є—П. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Г–і–ї–Є–љ–µ–љ–Є—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞ –і–µ–є—Б—В–≤–Є—П —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–є —А–µ—Д—А–∞–Ї—В–µ—А–љ—Л–є –њ–µ—А–Є–Њ–і –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤, –њ—А–µ–і—Б–µ—А–і–Є–є, –∞—В—А–Є–Њ–≤–µ–љ—В—А–Є–Ї—Г–ї—П—А–љ–Њ–≥–Њ (A–Т–) —Г–Ј–ї–∞, –∞ —В–∞–Ї–ґ–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е (–∞–љ–Њ–Љ–∞–ї—М–љ—Л—Е) –њ—Г—В–µ–є –њ—А–Њ–≤–µ–і–µ–љ–Є—П.
–£–≤–µ–ї–Є—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞ –і–µ–є—Б—В–≤–Є—П –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –љ–∞ –≠–Ъ–У —Г–і–ї–Є–љ–µ–љ–Є–µ–Љ –Є–љ—В–µ—А–≤–∞–ї–∞ Q–T. –Р–Љ–Є–Њ–і–∞—А–Њ–љ —Г–і–ї–Є–љ—П–µ—В –њ–Њ—В–µ–љ—Ж–Є–∞–ї –і–µ–є—Б—В–≤–Є—П –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–є —А–µ—Д—А–∞–Ї—В–µ—А–љ—Л–є –њ–µ—А–Є–Њ–і –њ—А–µ–і—Б–µ—А–і–Є–є –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, —З–µ–Љ –Р–Р–Я I–Р –Є I–° –Ї–ї–∞—Б—Б–Њ–≤.
–Ф–Є–∞–њ–∞–Ј–Њ–љ —Н–ї–µ–Ї—В—А–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –≥–Њ—А–∞–Ј–і–Њ —И–Є—А–µ, —З–µ–Љ —Г «—З–Є—Б—В—Л—Е» –Р–Р–Я III –Ї–ї–∞—Б—Б–∞, –Ї–Њ—В–Њ—А—Л–Љ–Є —П–≤–ї—П—О—В—Б—П d–—Б–Њ—В–∞–ї–Њ–ї, –і–Њ—Д–µ—В–Є–ї–Є–і –Є –Є–±—Г—В–Є–ї–Є–і. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –∞–Љ–Є–Њ–і–∞—А–Њ–љ –Љ–Њ–ґ–µ—В –Є–љ–∞–Ї—В–Є–≤–Є—А–Њ–≤–∞—В—М –±—Л—Б—В—А—Л–µ –љ–∞—В—А–Є–µ–≤—Л–µ –Є –Љ–µ–і–ї–µ–љ–љ—Л–µ –Ї–∞–ї—М—Ж–Є–µ–≤—Л–µ –Ї–∞–љ–∞–ї—Л –≤ –Љ–µ–Љ–±—А–∞–љ–∞—Е –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤, —В.–µ. –Њ–±–ї–∞–і–∞–µ—В —Н–ї–µ–Ї—В—А–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є, —Е–∞—А–∞–Ї—В–µ—А–љ—Л–Љ–Є –і–ї—П –Р–Р–Я I –Є IV –Ї–ї–∞—Б—Б–Њ–≤ (—В–∞–±–ї. 1).
–Р–Љ–Є–Њ–і–∞—А–Њ–љ –Њ–±–ї–∞–і–∞–µ—В –∞–љ—В–Є–∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –Ї–Њ—В–Њ—А–∞—П —Б—З–Є—В–∞–µ—В—Б—П —Е–∞—А–∞–Ї—В–µ—А–љ—Л–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–Љ –Р–Р–Я II –Ї–ї–∞—Б—Б–∞. –Я—А–∞–≤–і–∞, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —П–≤–ї—П—О—В—Б—П –Ї–Њ–љ–Ї—Г—А–µ–љ—В–љ—Л–Љ–Є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–Њ–≤ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є b––∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –∞–Љ–Є–Њ–і–∞—А–Њ–љ –і–µ–є—Б—В–≤—Г–µ—В –Ї–∞–Ї –љ–µ–Ї–Њ–љ–Ї—Г—А–µ–љ—В–љ—Л–є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В b––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Ю–љ –љ–µ —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —Б b––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є, –љ–Њ —В–Њ—А–Љ–Њ–Ј–Є—В –∞–Ї—В–Є–≤–∞—Ж–Є—О –∞–і–µ–љ–Є–ї–∞—В—Ж–Є–Ї–ї–∞–Ј—Л, —З—В–Њ –≤–µ–і–µ—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О —З–Є—Б–ї–∞ b––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –љ–∞ –Љ–µ–Љ–±—А–∞–љ–∞—Е –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤ [2–7].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –∞–Љ–Є–Њ–і–∞—А–Њ–љ (–Ъ–Њ—А–і–∞—А–Њ–љ), –Ї–Њ—В–Њ—А—Л–є –њ—А–Є–љ—П—В–Њ —Б—З–Є—В–∞—В—М –Р–Р–Я III –Ї–ї–∞—Б—Б–∞, –љ–∞ —Б–∞–Љ–Њ–Љ –і–µ–ї–µ –Њ–±–ї–∞–і–∞–µ—В —Н–ї–µ–Ї—В—А–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤—Б–µ—Е —З–µ—В—Л—А–µ—Е –Њ—Б–љ–Њ–≤–љ—Л—Е –Ї–ї–∞—Б—Б–Њ–≤ –Р–Р–Я.
–Т –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –∞–Љ–Є–Њ–і–∞—А–Њ–љ –Њ–±–ї–∞–і–∞–µ—В –∞–љ—В–Є—Д–Є–±—А–Є–ї–ї—П—В–Њ—А–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –Ю–љ –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞–µ—В —А–∞–Ј–≤–Є—В–Є–µ —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤ –њ–Њ—Б–ї–µ –њ–µ—А–µ–≤—П–Ј–Ї–Є –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є –∞—А—В–µ—А–Є–Є, –∞ —В–∞–Ї–ґ–µ –≤ –њ–µ—А–Є–Њ–і —А–µ–њ–µ—А—Д—Г–Ј–Є–Є.
–Р–Љ–Є–Њ–і–∞—А–Њ–љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–µ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є–µ –Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –≤ –Љ–Є–Њ–Ї–∞—А–і–µ. –Ю–љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —А–∞—Б—И–Є—А—П—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ –Ї–Њ—А–Њ–љ–∞—А–љ—Л–µ –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–µ –∞—А—В–µ—А–Є–Є –Є —Б–њ–Њ—Б–Њ–±–µ–љ —Г—Б—В—А–∞–љ—П—В—М –Є –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—В—М —Б–њ–∞–Ј–Љ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є. –Ь–µ—Е–∞–љ–Є–Ј–Љ—Л —Б–Њ—Б—Г–і–Њ—А–∞—Б—И–Є—А—П—О—Й–µ–≥–Њ –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –і–Њ –Ї–Њ–љ—Ж–∞ –љ–µ –≤—Л—П—Б–љ–µ–љ—Л. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –≤ –Њ—Б–љ–Њ–≤–µ —Н—В–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Љ–Њ–ґ–µ—В –ї–µ–ґ–∞—В—М —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –≤—Л–Ј—Л–≤–∞—В—М –љ–µ–Ї–Њ–љ–Ї—Г—А–µ–љ—В–љ—Г—О –±–ї–Њ–Ї–∞–і—Г a––∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є –Є–љ–∞–Ї—В–Є–≤–∞—Ж–Є—О –Ї–∞–ї—М—Ж–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤ –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —А–µ–Ј–Є—Б—В–Є–≤–љ—Л—Е –∞—А—В–µ—А–Є–є. –Э–µ–і–∞–≤–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –∞–Љ–Є–Њ–і–∞—А–Њ–љ –Љ–Њ–ґ–µ—В —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –Њ–Ї—Б–Є–і–∞ –∞–Ј–Њ—В–∞ –Є–Ј —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї [7].
–Р–Љ–Є–Њ–і–∞—А–Њ–љ —Г–Љ–µ–љ—М—И–∞–µ—В –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –Љ–Є–Њ–Ї–∞—А–і–∞ –≤ –Ї–Є—Б–ї–Њ—А–Њ–і–µ –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—О –Љ–∞–Ї—А–Њ—Н—А–≥–Є—З–µ—Б–Ї–Є—Е —Д–Њ—Б—Д–∞—В–Њ–≤ –≤ –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–∞—Е.
–Р–Љ–Є–Њ–і–∞—А–Њ–љ –Њ–±–ї–∞–і–∞–µ—В –љ–µ–Ї–Њ—В–Њ—А—Л–Љ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–Љ –Є–љ–Њ—В—А–Њ–њ–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ, –Ї–Њ—В–Њ—А–Њ–µ, –Њ–і–љ–∞–Ї–Њ, –≤—Л—А–∞–ґ–µ–љ–Њ –≤ –≥–Њ—А–∞–Ј–і–Њ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, —З–µ–Љ –Ї–∞—А–і–Є–Њ–і–µ–њ—А–µ—Б—Б–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ —В–∞–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –Р–Р–Я, –Ї–∞–Ї —Е–Є–љ–Є–і–Є–љ, –њ—А–Њ–Ї–∞–Є–љ–∞–Љ–Є–і, –і–Є–Ј–Њ–њ–Є—А–∞–Љ–Є–і, –њ—А–Њ–њ–∞—Д–µ–љ–Њ–љ, —Д–ї–µ–Ї–∞–Є–љ–Є–і –Є —Б–Њ—В–∞–ї–Њ–ї. –≠—В–Њ – –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–є –Р–Р–Я, –Ї–Њ—В–Њ—А—Л–є —Б—З–Є—В–∞–µ—В—Б—П –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л–Љ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О (–•–°–Э), –µ—Б–ї–Є –љ–µ —Б—З–Є—В–∞—В—М –љ–µ–і–Њ—Б—В—Г–њ–љ–Њ–≥–Њ –≤ –†–Њ—Б—Б–Є–Є –і–Њ—Д–µ—В–Є–ї–Є–і–∞. –Я–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–Љ –љ–∞–±–ї—О–і–µ–љ–Є—П–Љ, –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –±–Њ–ї—М–љ—Л—Е –•–°–Э —Д—А–∞–Ї—Ж–Є—П –≤—Л–±—А–Њ—Б–∞ –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–Ы–Ц) –љ–µ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П –Є–ї–Є –і–∞–ґ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П.
–Р–Љ–Є–Њ–і–∞—А–Њ–љ —В–∞–Ї–ґ–µ —П–≤–ї—П–µ—В—Б—П –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –Р–Р–Я, —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ—Л–Љ –і–ї—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –Љ–µ—А—Ж–∞–љ–Є–µ–Љ –њ—А–µ–і—Б–µ—А–і–Є–є –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –≥–Є–њ–µ—А—В—А–Њ—Д–Є–µ–є –Ы–Ц, –∞ —В–∞–Ї–ґ–µ –і–ї—П –ї–µ—З–µ–љ–Є—П –љ–∞–і–ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л—Е —В–∞—Е–Є–∞—А–Є—В–Љ–Є–є –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ (–Ш–Ь) [5,6,8].
–Т –Њ—Б–љ–Њ–≤–µ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –ї–µ–ґ–Є—В –µ–≥–Њ –∞–љ—В–Є—В–Є—А–µ–Њ–Є–і–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –∞–Љ–Є–Њ–і–∞—А–Њ–љ –Ї–∞–Ї –є–Њ–і–—Б–Њ–і–µ—А–ґ–∞—Й–µ–µ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є–µ –Љ–Њ–ґ–µ—В —В–Њ—А–Љ–Њ–Ј–Є—В—М —Б–Є–љ—В–µ–Ј —В–Є—А–Њ–Ї—Б–Є–љ–∞ –≤ —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј–µ, –∞ —В–∞–Ї–ґ–µ —Г–Љ–µ–љ—М—И–∞—В—М –њ—А–µ–≤—А–∞—Й–µ–љ–Є–µ —В–Є—А–Њ–Ї—Б–Є–љ–∞ –≤ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –±–Њ–ї–µ–µ –∞–Ї—В–Є–≤–љ—Л–є —В—А–Є–є–Њ–і—В–Є—А–Њ–љ–Є–љ [2–6].
–§–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–∞
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–∞ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –і–Њ –Ї–Њ–љ—Ж–∞ –љ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–∞, –Њ–і–љ–∞–Ї–Њ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Њ–љ–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–∞–Ј–ї–Є—З–∞–µ—В—Б—П –њ—А–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–Љ –Є –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞. –Я–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М –∞–Љ–Є–Њ–і–∞—А–Њ–љ –Љ–µ–і–ї–µ–љ–љ–Њ –Є –љ–µ–њ–Њ–ї–љ–Њ—Б—В—М—О –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П –≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–Љ —В—А–∞–Ї—В–µ. –С–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Є –њ—А–Є–µ–Љ–µ –≤–љ—Г—В—А—М —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 30–80%; –Њ—Б—В–∞–ї—М–љ–∞—П —З–∞—Б—В—М –њ—А–Є–љ—П—В–Њ–є –≤–љ—Г—В—А—М –і–Њ–Ј—Л –њ—А–Є –њ–µ—А–≤–Њ–Љ –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є–Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Є –њ–µ—З–µ–љ–Є. –Ъ–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –і–Њ—Б—В–Є–≥–∞—О—В –Љ–∞–Ї—Б–Є–Љ—Г–Љ–∞ —З–µ—А–µ–Ј 3–7 —З –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –≤–љ—Г—В—А—М. –С–Њ–ї–µ–µ 95% –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –Ї—А–Њ–≤–Є –≤ —Б–≤—П–Ј–Є —Б –њ–ї–∞–Ј–Љ–µ–љ–љ—Л–Љ–Є –±–µ–ї–Ї–∞–Љ–Є. –С–Њ–ї—М—И–∞—П —З–∞—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ —Б–≤—П–Ј–∞–љ–∞ —Б –∞–ї—М–±—Г–Љ–Є–љ–∞–Љ–Є (62%), –Њ—Б—В–∞–ї—М–љ–∞—П —З–∞—Б—В—М – —Б b––ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–∞–Љ–Є (33,5%).
–Р–Љ–Є–Њ–і–∞—А–Њ–љ –Є–Љ–µ–µ—В –Њ—З–µ–љ—М –±–Њ–ї—М—И–Њ–є –Њ–±—К–µ–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П (500 –ї) –Є –Њ—З–µ–љ—М –і–ї–Є—В–µ–ї—М–љ—Л–є –њ–µ—А–Є–Њ–і –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П (20–110 –і–љ–µ–є). –Ф–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —А–∞–≤–љ–Њ–≤–µ—Б–Є—П –њ–ї–∞–Ј–Љ–µ–љ–љ—Л—Е —Г—А–Њ–≤–љ–µ–є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ —В—А–µ–±—Г–µ—В—Б—П –Њ—В –Њ–і–љ–Њ–≥–Њ –і–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Љ–µ—Б—П—Ж–µ–≤. –Я—А–µ–њ–∞—А–∞—В –ї–Є—И—М –≤ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –≤—Л–≤–Њ–і–Є—В—Б—П –Є–Ј –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —З–µ—А–µ–Ј –њ–Њ—З–Ї–Є. –Я—А–Є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –љ–µ –љ—Г–ґ–љ–Њ —Б–љ–Є–ґ–∞—В—М –і–Њ–Ј—Г –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞.
–Р–Љ–Є–Њ–і–∞—А–Њ–љ –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–Љ—Г –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ—Г –≤ –њ–µ—З–µ–љ–Є, –≥–і–µ –Њ–љ –њ—А–µ–≤—А–∞—Й–∞–µ—В—Б—П –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤ –і–µ–Ј—Н—В–Є–ї–∞–Љ–Є–і–∞—А–Њ–љ. –Р–Љ–Є–Њ–і–∞—А–Њ–љ –Є –і–µ–Ј—Н—В–Є–ї–∞–Љ–Є–і–∞—А–Њ–љ –Њ—В–ї–Є—З–∞—О—В—Б—П –≤—Л—Б–Њ–Ї–Њ–є –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В—М—О, –±–ї–∞–≥–Њ–і–∞—А—П –Ї–Њ—В–Њ—А–Њ–є –Њ–љ–Є –≤ –±–Њ–ї—М—И–Є—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞—Е –љ–∞–Ї–∞–њ–ї–Є–≤–∞—О—В—Б—П –≤ –њ–µ—З–µ–љ–Є, –ї–µ–≥–Ї–Є—Е, –Ї–Њ–ґ–µ, –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є, —А–Њ–≥–Њ–≤–Є—Ж–µ –≥–ї–∞–Ј–∞ –Є –і—А—Г–≥–Є—Е –Њ—А–≥–∞–љ–∞—Е. –Ъ–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –≤ –Љ–Є–Њ–Ї–∞—А–і–µ –≤ 10–50 —А–∞–Ј –≤—Л—И–µ, —З–µ–Љ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є.
–Э–∞–Є–±–Њ–ї—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –љ–∞–Ї–∞–њ–ї–Є–≤–∞–µ—В—Б—П –≤ —Б–Ї–µ–ї–µ—В–љ—Л—Е –Љ—Л—И—Ж–∞—Е –Є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В —А–∞—Б—З–µ—В—Л, –і–Њ 15 –≥ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–ї—П —В–Њ–≥–Њ, —З—В–Њ–±—Л –љ–∞—Б—Л—В–Є—В—М –µ–≥–Њ —В–Ї–∞–љ–µ–≤—Л–µ –і–µ–њ–Њ. –Ф–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤ –њ—А–µ–њ–∞—А–∞—В–∞ (–Є–ї–Є –µ–≥–Њ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞) –≤ —В–Ї–∞–љ—П—Е –Њ–±—К—П—Б–љ—П–µ—В—Б—П, –њ–Њ—З–µ–Љ—Г –і–ї—П –њ—А–Њ—П–≤–ї–µ–љ–Є—П –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ —В—А–µ–±—Г–µ—В—Б—П –і–ї–Є—В–µ–ї—М–љ—Л–є –Є –љ–µ–њ–Њ—Б—В–Њ—П–љ–љ—Л–є –њ–µ—А–Є–Њ–і –љ–∞—Б—Л—Й–µ–љ–Є—П (–Њ—В 5 –і–Њ 60 –і–љ–µ–є), –∞ —В–∞–Ї–ґ–µ –µ–≥–Њ —Б–≤–µ—А—Е–і–ї–Є—В–µ–ї—М–љ–Њ–µ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–µ–µ –њ—А–Є–љ–Є–Љ–∞—В—М –њ—А–µ–њ–∞—А–∞—В –Њ–і–Є–љ —А–∞–Ј –≤ —Б—Г—В–Ї–Є –Є–ї–Є –і–∞–ґ–µ —З–µ—А–µ–Ј —Б—Г—В–Ї–Є. –£–љ–Є–Ї–∞–ї—М–љ—Л–Љ —Б–≤–Њ–є—Б—В–≤–Њ–Љ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ —П–≤–ї—П–µ—В—Б—П —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ—А–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –≤ —В–µ—З–µ–љ–Є–µ 10—150 –і–љ–µ–є –њ–Њ—Б–ї–µ –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ—Б–ї–µ –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Э–∞ –њ—А–∞–Ї—В–Є–Ї–µ —Н—В–Њ –Њ–Ј–љ–∞—З–∞–µ—В, —З—В–Њ –њ—А–Њ–њ—Г—Б–Ї –њ—А–Є–µ–Љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–Њ–Ј –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –љ–µ –њ—А–Є–≤–µ–і–µ—В –Ї —А–µ—Ж–Є–і–Є–≤—Г —В–∞—Е–Є–∞—А–Є—В–Љ–Є–Є [2,3,6].
–Я–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л
–Я—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–є –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –≤—Б—В—А–µ—З–∞—О—В—Б—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —З–∞—Й–µ, —З–µ–Љ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –і—А—Г–≥–Є–Љ–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ–Є –Р–Р–Я. –Я–Њ —Б–≤–Њ–і–љ—Л–Љ –і–∞–љ–љ—Л–Љ, –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ (–љ–µ –±–Њ–ї–µ–µ 200 –Љ–≥/—Б—Г—В.) –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–∞—А–Њ–Ї—Б–Є–Ј–Љ–Њ–≤ –Љ–µ—А—Ж–∞–љ–Є—П –Є —В—А–µ–њ–µ—В–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є –Њ–±—Й–∞—П —З–∞—Б—В–Њ—В–∞ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 17 –і–Њ 52%. –Т 1–15% —Б–ї—Г—З–∞–µ–≤ –∞–Љ–Є–Њ–і–∞—А–Њ–љ –њ—А–Є—Е–Њ–і–Є—В—Б—П –Њ—В–Љ–µ–љ—П—В—М –Є–Ј––Ј–∞ –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ [2,3,9].
–°–ї–µ–і—Г–µ—В –Є–Љ–µ—В—М –≤ –≤–Є–і—Г, —З—В–Њ –∞—А–Є—В–Љ–Њ–≥–µ–љ–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –Є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–∞—П —В–∞—Е–Є–Ї–∞—А–і–Є—П —В–Є–њ–∞ «–њ–Є—А—Г—Н—В» (torsade de pointes) –њ—А–Є –ї–µ—З–µ–љ–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –≤ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј–∞—Е –≤—Б—В—А–µ—З–∞—О—В—Б—П –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ (<1%), –њ—А–Є—З–µ–Љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–µ–ґ–µ, —З–µ–Љ –њ—А–Є –ї–µ—З–µ–љ–Є–Є —Е–Є–љ–Є–і–Є–љ–Њ–Љ, –њ—А–Њ–Ї–∞–Є–љ–∞–Љ–Є–і–Њ–Љ, —Н–љ–Ї–∞–Є–љ–Є–і–Њ–Љ, —Д–ї–µ–Ї–∞–Є–љ–Є–і–Њ–Љ, –њ—А–Њ–њ–∞—Д–µ–љ–Њ–љ–Њ–Љ –Є —Б–Њ—В–∞–ї–Њ–ї–Њ–Љ.
L. Harris [9] –Њ–±–Њ–±—Й–Є–ї —А–µ–Ј—Г–ї—М—В–∞—В—Л 88 –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ —Г 7834 –±–Њ–ї—М–љ—Л—Е. –Я–Њ —Б–≤–Њ–і–љ—Л–Љ –і–∞–љ–љ—Л–Љ, –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ–Є –њ–Њ–±–Њ—З–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –±—Л–ї–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –Ї–Њ–ґ–Є –≤ –≤–Є–і–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –µ–µ —Ж–≤–µ—В–∞, —Д–Њ—В–Њ—Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є–Є, –≤—Л—Б—Л–њ–∞–љ–Є–є –Є –Ї–Њ–ґ–љ–Њ–≥–Њ –Ј—Г–і–∞ (6,8%), –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ—Л–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ (5,2%), –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –±—А–∞–і–Є–Ї–∞—А–і–Є—П (1,1%), –≥–Є–њ–Њ—В–Є—А–µ–Њ–Ј (1,0%), –ї–µ–≥–Њ—З–љ—Л–µ –Є–љ—Д–Є–ї—М—В—А–∞—В—Л (0,9%) –Є –≥–Є–њ–µ—А—В–Є—А–µ–Њ–Ј (0,7%). –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В, —З—В–Њ –≥–Є–њ–Њ– –Є –≥–Є–њ–µ—А—В–Є—А–µ–Њ–Ј –њ—А–Є –ї–µ—З–µ–љ–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –Њ–±—Л—З–љ–Њ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П —Г –±–Њ–ї—М–љ—Л—Е —Б –Є—Б—Е–Њ–і–љ—Л–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є–ї–Є –µ–µ –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є.
–Т —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –∞–Љ–Є–Њ–і–∞—А–Њ–љ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –≤ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј–∞—Е, –Њ–љ –љ–µ —Б—В–Њ–ї—М —З–∞—Б—В–Њ –≤—Л–Ј—Л–≤–∞–µ—В —Б–µ—А—М–µ–Ј–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л. –Э–µ —Б–ї–µ–і—Г–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М –њ—А–µ–њ–∞—А–∞—В –±–Њ–ї—М–љ—Л–Љ —Б –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є–ї–Є —Б–µ—А—М–µ–Ј–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –њ–µ—З–µ–љ–Є.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ
–Т 80––µ –≥–Њ–і—Л –њ—А–Њ—И–ї–Њ–≥–Њ –≤–µ–Ї–∞ –∞–Љ–Є–Њ–і–∞—А–Њ–љ –љ–µ –њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –±–Њ–ї—М—И–Њ–є –њ–Њ–њ—Г–ї—П—А–љ–Њ—Б—В—М—О –Ї–∞–Ї –Р–Р–Я, —В–∞–Ї –Ї–∞–Ї –њ–Њ—П–≤–Є–ї–Є—Б—М —В–∞–Ї–Є–µ –Р–Р–Я, –Ї–∞–Ї —Н–љ–Ї–∞–Є–љ–Є–і, —Д–ї–µ–Ї–∞–Є–љ–Є–і, –њ—А–Њ–њ–∞—Д–µ–љ–Њ–љ, –Ї–Њ—В–Њ—А—Л–µ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є–ї–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –Њ—В–ї–Є—З–∞–ї–Є—Б—М –ї—Г—З—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є. –Т –Ї–Њ–љ—Ж–µ 80–—Е––љ–∞—З–∞–ї–µ 90–—Е –≥–Њ–і–Њ–≤ –±—Л–ї–Є –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –Р–Р–Я, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –њ–Њ–і–∞–≤–ї—П—О—Й–Є–µ –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–µ –∞—А–Є—В–Љ–Є–Є, –љ–µ —В–Њ–ї—М–Ї–Њ –љ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В, –љ–Њ, –љ–∞–Њ–±–Њ—А–Њ—В, —Г–Љ–µ–љ—М—И–∞—О—В –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е. –Ґ–∞–Ї, –љ–∞–њ—А–Є–Љ–µ—А, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е Cardiac Arrhythmia Suppression Trial (CAST–I –Є CAST–2) –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї —Б–Љ–µ—А—В–Є —Г –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ш–Ь, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Н–љ–Ї–∞–Є–љ–Є–і –Є–ї–Є —Д–ї–µ–Ї–∞–Є–љ–Є–і, —Б–Њ—Б—В–∞–≤–ї—П–µ—В 2,5 (—А<0,05). –Ф–∞–ґ–µ –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Љ–Њ—А–Є—Ж–Є–Ј–Є–љ–∞ –≤ –љ–∞—З–∞–ї–µ –ї–µ—З–µ–љ–Є—П –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –±–Њ–ї–µ–µ —З–µ–Љ –≤ 5 —А–∞–Ј [10,11]. –Я–Њ –і–∞–љ–љ—Л–Љ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–∞ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ 6 –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –і–ї–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Е–Є–љ–Є–і–Є–љ–∞ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В —А–µ—Ж–Є–і–Є–≤–Є—А–Њ–≤–∞–љ–Є–µ –њ–∞—А–Њ–Ї—Б–Є–Ј–Љ–Њ–≤ –Љ–µ—А—Ж–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є, –љ–Њ —Б–Њ—З–µ—В–∞–µ—В—Б—П —Б –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О (2,9% –њ—А–Њ—В–Є–≤ 0,8% –љ–∞ –њ–ї–∞—Ж–µ–±–Њ) [12]. –Я–Њ–≤—Л—И–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є —Г –±–Њ–ї—М–љ—Л—Е —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є —В–∞–Ї–Є–Љ–Є –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ–Є –Р–Р–Я, –Ї–∞–Ї —Е–Є–љ–Є–і–Є–љ, —Н–љ–Ї–∞–Є–љ–Є–і, —Д–ї–µ–Ї–∞–Є–љ–Є–і –Є –Љ–Њ—А–Є—Ж–Є–Ј–Є–љ, —Б–≤—П–Ј—Л–≤–∞—О—В —Б –∞—А–Є—В–Љ–Њ–≥–µ–љ–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є, –њ—А–Є—Б—Г—Й–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ IA –Є –Њ—Б–Њ–±–µ–љ–љ–Њ IC –њ–Њ–і–Ї–ї–∞—Б—Б–Њ–≤ [13].
–Э–∞–Ї–Њ–њ–ї–µ–љ–љ—Л–µ –Ї –љ–∞—З–∞–ї—Г 90–—Е –≥–Њ–і–Њ–≤ –і–∞–љ–љ—Л–µ –Ј–∞—Б—В–∞–≤–Є–ї–Є –њ–µ—А–µ—Б–Љ–Њ—В—А–µ—В—М –њ–Њ–і—Е–Њ–і—Л –Ї –і–ї–Є—В–µ–ї—М–љ–Њ–є –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ—Л–Љ–Є –Є –Љ–∞–ї–Њ—Б–Є–Љ–њ—В–Њ–Љ–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞. –°—В–∞–ї–Њ –Њ—З–µ–≤–Є–і–љ—Л–Љ, —З—В–Њ –њ—А–Є –≤—Л–±–Њ—А–µ –Р–Р–Я –і–ї—П –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤–∞–ґ–љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –љ–µ —В–Њ–ї—М–Ї–Њ –µ–≥–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –њ–Њ–і–∞–≤–ї—П—В—М –љ–∞—А—Г—И–µ–љ–Є—П —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞, –љ–Њ –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Г–≤–µ–ї–Є—З–Є—В—М –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е.
–Ы—Г—З—И–µ –≤—Б–µ–≥–Њ –Є–Ј—Г—З–µ–љ–Њ –≤–ї–Є—П–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ –Њ—В–і–∞–ї–µ–љ–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј —Г –±–Њ–ї—М–љ—Л—Е —Б –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ—Л–Љ–Є –Є –Љ–∞–ї–Њ—Б–Є–Љ–њ—В–Њ–Љ–љ—Л–Љ–Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–Љ–Є –∞—А–Є—В–Љ–Є—П–Љ–Є, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ш–Ь. –Я–Њ –і–∞–љ–љ—Л–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –ї–Є—И—М b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л –Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Б–њ–Њ—Б–Њ–±–љ—Л —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—В—М –ї–µ—В–∞–ї—М–љ—Л–є –Є—Б—Е–Њ–і –њ–Њ—Б–ї–µ –Ш–Ь [14]. –Т—Б–µ –і—А—Г–≥–Є–µ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л –ї–Є–±–Њ –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М, –ї–Є–±–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В —Б–Љ–µ—А—В–љ–Њ—Б—В—М. –Т —Б–µ—А–µ–і–Є–љ–µ 90–—Е –≥–Њ–і–Њ–≤ –њ–Њ –Љ–µ—А–µ —А–∞–Ј–Њ—З–∞—А–Њ–≤–∞–љ–Є—П –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Р–Р–Я IA –Є IC –Ї–ї–∞—Б—Б–∞ –≤–љ–Њ–≤—М –≤–Њ–Ј–љ–Є–Ї –Є–љ—В–µ—А–µ—Б –Ї –∞–Љ–Є–Њ–і–∞—А–Њ–љ—Г, –∞ —В–∞–Ї–ґ–µ –і—А—Г–≥–Є–Љ –Р–Р–Я III –Ї–ї–∞—Б—Б–∞. –£—З–Є—В—Л–≤–∞—П –љ–Є–Ј–Ї—Г—О —З–∞—Б—В–Њ—В—Г –∞—А–Є—В–Љ–Њ–≥–µ–љ–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞, –∞ —В–∞–Ї–ґ–µ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ —Б–Њ–Ї—А–∞—В–Є–Љ–Њ—Б—В—М –Љ–Є–Њ–Ї–∞—А–і–∞, –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ —Б—З–Є—В–∞–µ—В—Б—П –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–љ–µ–Ј–∞–њ–љ–Њ–є –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —Б–Љ–µ—А—В–Є —Г –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ш–Ь, –∞ —В–∞–Ї–ґ–µ —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э –Є –њ–Њ—Б–ї–µ —Г—Б–њ–µ—И–љ–Њ–є —А–µ–∞–љ–Є–Љ–∞—Ж–Є–Є –≤ —Б–≤—П–Ј–Є —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є —В–∞—Е–Є–Ї–∞—А–і–Є–Є –Є–ї–Є —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤.
–Ц–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–µ –∞—А–Є—В–Љ–Є–Є
–Є –≤–љ–µ–Ј–∞–њ–љ–∞—П —Б–µ—А–і–µ—З–љ–∞—П —Б–Љ–µ—А—В—М
–Ю—Б–љ–Њ–≤–љ–Њ–є –Њ–±–ї–∞—Б—В—М—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л—Е —В–∞—Е–Є–∞—А–Є—В–Љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –≤–љ–µ–Ј–∞–њ–љ–Њ–є –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —Б–Љ–µ—А—В–Є –Њ—Б–Њ–±–µ–љ–љ–Њ –≤—Л—Б–Њ–Ї–∞ —Г —В—А–µ—Е —Б–ї–µ–і—Г—О—Й–Є—Е –Ї–∞—В–µ–≥–Њ—А–Є–є –±–Њ–ї—М–љ—Л—Е: 1) —Г –±–Њ–ї—М–љ—Л—Е, –љ–µ–і–∞–≤–љ–Њ –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ш–Ь; 2) —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц; –Є 3) —Г –±–Њ–ї—М–љ—Л—Е –њ–Њ—Б–ї–µ —Г—Б–њ–µ—И–љ–Њ–є —А–µ–∞–љ–Є–Љ–∞—Ж–Є–Є –≤ —Б–≤—П–Ј–Є —Б –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є —В–∞—Е–Є–Ї–∞—А–і–Є–µ–є –Є–ї–Є —Д–Є–±—А–Є–ї–ї—П—Ж–Є–µ–є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤ [3–6].
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –њ–Њ—Б–ї–µ –Ш–Ь —Г –±–Њ–ї—М–љ—Л—Е —Б –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ—Л–Љ–Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–Љ–Є –∞—А–Є—В–Љ–Є—П–Љ–Є –Є–Ј—Г—З–∞–ї–∞—Б—М –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е. –Т –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Њ—В–Љ–µ—З–∞–ї–∞—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–∞—П —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –ї–µ—З–µ–љ–љ—Л—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ. –Я–Њ —Б–≤–Њ–і–љ—Л–Љ –і–∞–љ–љ—Л–Љ –і–µ–≤—П—В–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–∞–µ—В —Б–Љ–µ—А—В–љ–Њ—Б—В—М – –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 29% [14,15].
–Т —Б–µ—А–µ–і–Є–љ–µ 90–—Е –≥–Њ–і–Њ–≤ XX –≤–µ–Ї–∞ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –і–≤–∞ –Ї—А—Г–њ–љ—Л—Е –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П – EMIAT –Є CAMIAT.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ EMIAT –≤–Ї–ї—О—З–∞–ї–Є—Б—М –±–Њ–ї—М–љ—Л–µ, –њ–µ—А–µ–љ–µ—Б—И–Є–µ –Ш–Ь, —Б —Д—А–∞–Ї—Ж–Є–µ–є –≤—Л–±—А–Њ—Б–∞ –Ы–Ц 40% –Є–ї–Є –Љ–µ–љ—М—И–µ, –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –љ–∞–ї–Є—З–Є—П –Є–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Є—П —Г –љ–Є—Е –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л—Е –∞—А–Є—В–Љ–Є–є [16]. –Ч–∞ –≤—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П (–≤ —Б—А–µ–і–љ–µ–Љ 21 –Љ–µ—Б.) —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –≤ –Њ–±—Й–µ–є –Є —Б–µ—А–і–µ—З–љ–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Љ–µ–ґ–і—Г —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л–Љ–Є –≥—А—Г–њ–њ–∞–Љ–Є –љ–µ –±—Л–ї–Њ, –љ–Њ —З–∞—Б—В–Њ—В–∞ –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —Б–Љ–µ—А—В–Є –±—Л–ї–∞ –љ–∞ 35% –љ–Є–ґ–µ —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е, –ї–µ—З–µ–љ–љ—Л—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ (—А=0,05). –Р—А–Є—В–Љ–Њ–≥–µ–љ–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –њ—А–Є –ї–µ—З–µ–љ–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –љ–µ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ CAMIAT –≤–Ї–ї—О—З–∞–ї–Є—Б—М –±–Њ–ї—М–љ—Л–µ, –њ–µ—А–µ–љ–µ—Б—И–Є–µ –Ш–Ь, —Б –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–Љ–Є –∞—А–Є—В–Љ–Є—П–Љ–Є –њ–Њ –і–∞–љ–љ—Л–Љ 24–—З–∞—Б–Њ–≤–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є—П –≠–Ъ–У [17]. –Ч–∞ –≤—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П (2 –≥–Њ–і–∞) –Њ–±—Й–∞—П –Є —Б–µ—А–і–µ—З–љ–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е, –ї–µ—З–µ–љ–љ—Л—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ, –±—Л–ї–∞ –љ–Є–ґ–µ, —З–µ–Љ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ. –Ю–±—Й–µ–µ —З–Є—Б–ї–Њ —Б–ї—Г—З–∞–µ–≤ –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —Б–Љ–µ—А—В–Є –Є–ї–Є —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —Г—Б–њ–µ—И–љ–Њ–є —А–µ–∞–љ–Є–Љ–∞—Ж–Є–µ–є –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ, –±—Л–ї–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ (–≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 38%; —А=0,029) –Љ–µ–љ—М—И–µ, —З–µ–Љ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ. –І–∞—Б—В–Њ—В–∞ –∞—А–Є—В–Љ–Њ–≥–µ–љ–љ—Л—Е —Б–Њ–±—Л—В–Є–є –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –ї–µ—З–µ–љ–љ—Л—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ, –±—Л–ї–∞ –љ–Є–ґ–µ, —З–µ–Љ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ.
–Р–љ–∞–ї–Є–Ј —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є EMIAT –Є CAMIAT –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Ј–∞–Ї–ї—О—З–Є—В—М, —З—В–Њ –∞–Љ–Є–Њ–і–∞—А–Њ–љ —П–≤–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–љ–µ–Ј–∞–њ–љ–Њ–є –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —Б–Љ–µ—А—В–Є —Г –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ш–Ь. –Ю—Б–Њ–±–µ–љ–љ–Њ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј–∞—В—М—Б—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ —Б —Ж–µ–ї—М—О –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є –њ–Њ—Б–ї–µ –Ш–Ь —Г –±–Њ–ї—М–љ—Л—Е —Б —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц, —Г –Ї–Њ—В–Њ—А—Л—Е b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л –Є –і—А—Г–≥–Є–µ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л –ї–Є–±–Њ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ—Л, –ї–Є–±–Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л.
–Т –љ–∞—З–∞–ї–µ 90–—Е –њ—А–Њ—И–ї–Њ–≥–Њ –≤–µ–Ї–∞ –±—Л–ї–Є –≤—Л–њ–Њ–ї–љ–µ–љ—Л –і–≤–∞ –Ї—А—Г–њ–љ—Л—Е –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ –Ї–Њ—В–Њ—А—Л—Е –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ GESICA –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 516 –±–Њ–ї—М–љ—Л—Е –•–°–Э II–IV —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞ (–§–Ъ) [18]. –Ч–∞ 2 –≥–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–ї—Г—З–∞–µ–≤ —Б–Љ–µ—А—В–Є –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –ї–µ—З–µ–љ–љ—Л—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ, –±—Л–ї–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–µ (—Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ –љ–∞ 28%), —З–µ–Љ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ (—А=0,024). –Ю—В–Љ–µ—З–µ–љ–Њ –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ (—А=0,16) —А–Є—Б–Ї–∞ –Ї–∞–Ї —Б–ї—Г—З–∞–µ–≤ –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є (–љ–∞ 27%), —В–∞–Ї –Є —Б–ї—Г—З–∞–µ–≤ —Б–Љ–µ—А—В–Є –Њ—В –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–љ–∞ 23%). –Т –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ, –±—Л–ї–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–µ –Њ–±—Й–µ–µ —З–Є—Б–ї–Њ —Б–ї—Г—З–∞–µ–≤ —Б–Љ–µ—А—В–Є –Є–ї–Є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –≤ —Б–≤—П–Ј–Є —Б –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–µ–є –•–°–Э (—Б–љ–Є–ґ–µ–љ–Є–µ –љ–∞ 31%; —А=0,0024). –Ю—Б–Њ–±–µ–љ–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –∞–Љ–Є–Њ–і–∞—А–Њ–љ –Њ–Ї–∞–Ј–∞–ї—Б—П —Г –ґ–µ–љ—Й–Є–љ (—Б–љ–Є–ґ–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 48%), —Г –±–Њ–ї—М–љ—Л—Е —Б –љ–µ—Б—В–Њ–є–Ї–Њ–є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є —В–∞—Е–Є–Ї–∞—А–і–Є–µ–є (—Б–љ–Є–ґ–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 34%) –Є –њ—А–Є –•–°–Э II –§–Ъ (—Б–љ–Є–ґ–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 41%, —А=0,024).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–ї–Є—В–µ–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –љ–Є–Ј–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ (300 –Љ–≥/—Б—Г—В.) –Љ–Њ–ґ–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–ї—Г—З—И–Є—В—М –Њ—В–і–∞–ї–µ–љ–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј —Г –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Ї–∞—В–µ–≥–Њ—А–Є–є –±–Њ–ї—М–љ—Л—Е –•–°–Э, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц.
–Э–µ—Б–Ї–Њ–ї—М–Ї–Њ –Є–љ—Л–µ –і–∞–љ–љ—Л–µ, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э, –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –≤ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CHF–STAT. –Т —Н—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Є 674 –±–Њ–ї—М–љ—Л—Е –•–°–Э II–IV –§–Ъ, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Г—О —В–µ—А–∞–њ–Є—О, –≤–Ї–ї—О—З–∞–≤—И—Г—О —Б–µ—А–і–µ—З–љ—Л–µ –≥–ї–Є–Ї–Њ–Ј–Є–і—Л, –і–Є—Г—А–µ—В–Є–Ї–Є –Є –Є–љ–≥–Є–±–Є—В–Њ—А—Л –Р–Я–§. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Є –±–Њ–ї—М–љ—Л—Е —Б —Д—А–∞–Ї—Ж–Є–µ–є –≤—Л–±—А–Њ—Б–∞ –Ы–Ц –Љ–µ–љ—М—И–µ 40% –Є –љ–µ –Љ–µ–љ–µ–µ —З–µ–Љ 10 –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–Љ–Є —Н–Ї—Б—В—А–∞—Б–Є—Б—В–Њ–ї–∞–Љ–Є –≤ —З–∞—Б –њ–Њ –і–∞–љ–љ—Л–Љ 24–—З–∞—Б–Њ–≤–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є—П –≠–Ъ–У [19]. –Ч–∞ –≤—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П (–≤ —Б—А–µ–і–љ–µ–Љ 45 –Љ–µ—Б.) –љ–µ –±—Л–ї–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –≤ –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Љ–µ–ґ–і—Г –±–Њ–ї—М–љ—Л–Љ–Є, –ї–µ—З–µ–љ–љ—Л–Љ–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ, –Є –±–Њ–ї—М–љ—Л–Љ–Є, –њ–Њ–ї—Г—З–∞–≤—И–Є–Љ–Є –њ–ї–∞—Ж–µ–±–Њ (39% –њ—А–Њ—В–Є–≤ 42%, —А=0,6). –Ю—В–Љ–µ—З–∞–ї–∞—Б—М –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –Њ—В —Н—В–Є–Њ–ї–Њ–≥–Є–Є –•–°–Э. –Ґ–∞–Ї, –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –Њ—В—З–µ—В–ї–Є–≤–∞—П —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Г–ї—Г—З—И–µ–љ–Є—О –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –±–Њ–ї—М–љ—Л—Е –•–°–Э –љ–µ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є, –Ї–Њ—В–Њ—А—Л–µ —Б–Њ—Б—В–∞–≤–ї—П–ї–Є –Њ–Ї–Њ–ї–Њ 30% –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ (—А=0,07). –Я–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э –љ–µ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Њ–±—Й–∞—П —З–∞—Б—В–Њ—В–∞ —Б–ї—Г—З–∞–µ–≤ —Б–Љ–µ—А—В–Є –Є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М – –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 44% (–Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї 0,56 –њ—А–Є 95%––Љ –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ–Њ–Љ –Є–љ—В–µ—А–≤–∞–ї–µ [–Ф–Ш] –Њ—В 0,36 –і–Њ 0,87).
–Я—А–Є—З–Є–љ—Л –љ–µ—Б–Њ–≤–њ–∞–і–µ–љ–Є—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є GESICA –Є CHF–STAT –љ–µ–Є–Ј–≤–µ—Б—В–љ—Л. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є GESICA –њ—А–µ–Њ–±–ї–∞–і–∞–ї–Є (–Њ–Ї–Њ–ї–Њ 60%) –±–Њ–ї—М–љ—Л–µ –•–°–Э –љ–µ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є, —Г –Ї–Њ—В–Њ—А—Л—Е, –њ–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П CHF–STAT, –∞–Љ–Є–Њ–і–∞—А–Њ–љ, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є GESICA –∞–Љ–Є–Њ–і–∞—А–Њ–љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–ї—Г—З—И–∞–ї –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –ї–Є—И—М —Г –ґ–µ–љ—Й–Є–љ (—Б–љ–Є–ґ–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 48%), –Ї–Њ—В–Њ—А—Л–µ —Б–Њ—Б—В–∞–≤–ї—П–ї–Є –Њ–Ї–Њ–ї–Њ 20% –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е. –У–Њ—А–∞–Ј–і–Њ –Љ–µ–љ–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Њ–љ –±—Л–ї —Г –Љ—Г–ґ—З–Є–љ – —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 26% (95%––Ф–Ш –Њ—В –2 –і–Њ +46%). –Ь–µ–ґ–і—Г —В–µ–Љ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CHF–STAT —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е –±—Л–ї –≤—Б–µ–≥–Њ 1% –ґ–µ–љ—Й–Є–љ. –°—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –І–°–° –і–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–ї–Є –Њ–Ї–Њ–ї–Њ 90 —Г–і. –≤ 1 –Љ–Є–љ. –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є GESICA –Є –Њ–Ї–Њ–ї–Њ 80 —Г–і. –≤ 1 –Љ–Є–љ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CHF–STAT. –Ш–љ—Л–Љ–Є —Б–ї–Њ–≤–∞–Љ–Є, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CHF–STAT –њ—А–µ–Њ–±–ї–∞–і–∞–ї–Є –±–Њ–ї—М–љ—Л–µ —Б –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Њ–є –Є—Б—Е–Њ–і–љ–Њ–є –І–°–°, —Г –Ї–Њ—В–Њ—А—Л—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ, –њ–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П GESICA, –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–µ–љ. –Э–∞–Ї–Њ–љ–µ—Ж, —Б–ї–µ–і—Г–µ—В —Г—З–Є—В—Л–≤–∞—В—М —А–∞–Ј–ї–Є—З–Є—П –≤ —З–Є—Б–ї–µ –±–Њ–ї—М–љ—Л—Е, –њ—А–µ–Ї—А–∞—В–Є–≤—И–Є—Е —В–µ—А–∞–њ–Є—О. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є GESICA —В–µ—А–∞–њ–Є—О –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –њ—А–µ–Ї—А–∞—В–Є–ї–Є –≤—Б–µ–≥–Њ 15 (5,8%) –±–Њ–ї—М–љ—Л—Е, –њ—А–Є—З–µ–Љ —В–Њ–ї—М–Ї–Њ —Г 12 (4,6%) –±–Њ–ї—М–љ—Л—Е – –Є–Ј––Ј–∞ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CHF–STAT —В–µ—А–∞–њ–Є—О –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –њ—А–µ–Ї—А–∞—В–Є–ї–Є 136 (41%) –±–Њ–ї—М–љ—Л—Е, –≤ —В–Њ–Љ —З–Є—Б–ї–µ 90 (27%) –Є–Ј––Ј–∞ –њ–Њ—П–≤–ї–µ–љ–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤. –С–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П —З–∞—Б—В–Њ—В–∞ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CHF–STAT –Њ–±—К—П—Б–љ—П–µ—В—Б—П, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –њ—А–µ–њ–∞—А–∞—В–∞. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є GESICA –±–Њ–ї—М–љ—Л–µ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 2 –ї–µ—В –њ–Њ–ї—Г—З–∞–ї–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ –≤ –і–Њ–Ј–µ 300 –Љ–≥/—Б—Г—В., –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CHF–STAT –±–Њ–ї—М–љ—Л–µ –≤ —В–µ—З–µ–љ–Є–µ 50 –љ–µ–і–µ–ї—М –њ–Њ–ї—Г—З–∞–ї–Є –њ–Њ 400 –Љ–≥ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –і–µ–љ—М, –∞ –Ј–∞—В–µ–Љ –і–Њ –Ї–Њ–љ—Ж–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П – –њ–Њ 300 –Љ–≥/—Б—Г—В.
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —А–∞–Ј–љ–Њ—А–µ—З–Є–≤–Њ—Б—В—М —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є GESICA –Є CHF–STAT, –Њ—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –∞–Љ–Є–Њ–і–∞—А–Њ–љ –≤ –і–Њ–Ј–µ –і–Њ 300 –Љ–≥/—Б—Г—В. –Љ–Њ–ґ–µ—В —Г–ї—Г—З—И–∞—В—М –Њ—В–і–∞–ї–µ–љ–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э –љ–µ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є, —В.–µ. –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Г –±–Њ–ї—М–љ—Л—Е –і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–Њ–є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ–њ–∞—В–Є–µ–є. –Р–Љ–Є–Њ–і–∞—А–Њ–љ, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, –≤ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ —Г –ґ–µ–љ—Й–Є–љ, –∞ —В–∞–Ї–ґ–µ —Г –±–Њ–ї—М–љ—Л—Е —Б –Є—Б—Е–Њ–і–љ–Њ–є —В–∞—Е–Є–Ї–∞—А–і–Є–µ–є (–І–°–°390 —Г–і./–Љ–Є–љ.) –Є —Н–њ–Є–Ј–Њ–і–∞–Љ–Є –љ–µ—Б—В–Њ–є–Ї–Њ–є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є —В–∞—Е–Є–Ї–∞—А–і–Є–Є –њ–Њ –і–∞–љ–љ—Л–Љ 24–—З–∞—Б–Њ–≤–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є—П –≠–Ъ–У.
–Т –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Є–Ј—Г—З–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—А–µ–і—Б—В–≤–∞ –і–ї—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є —Г –±–Њ–ї—М–љ—Л—Е, —А–µ–∞–љ–Є–Љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ—Б–ї–µ –Њ—Б—В–∞–љ–Њ–≤–Ї–Є —Б–µ—А–і—Ж–∞.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CASCADE —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Є 228 –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–ґ–Є–≤—И–Є—Е —Д–Є–±—А–Є–ї–ї—П—Ж–Є—О –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤. –Я–Њ–ї–Њ–≤–Є–љ–∞ –±–Њ–ї—М–љ—Л—Е –њ–Њ–ї—Г—З–∞–ї–∞ –∞–Љ–Є–Њ–і–∞—А–Њ–љ (–њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–∞—П –і–Њ–Ј–∞ 100–400 –Љ–≥/—Б—Г—В.), –і—А—Г–≥–∞—П –њ–Њ–ї–Њ–≤–Є–љ–∞ – –і—А—Г–≥–Є–µ –Р–Р–Я. –Р–Љ–Є–Њ–і–∞—А–Њ–љ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–ї –≤–љ–µ–Ј–∞–њ–љ—Г—О —Б–Љ–µ—А—В—М –Є –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Є–µ —Б–Њ–±—Л—В–Є—П –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ, —З–µ–Љ –і—А—Г–≥–Є–µ –Р–Р–Я. –Ч–∞ 6 –ї–µ—В –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–≤–Њ–±–Њ–і–љ—Л–Љ–Є –Њ—В –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є –Є –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Є—Е —Б–Њ–±—Л—В–Є–є –±—Л–ї–Є 53% –±–Њ–ї—М–љ—Л—Е, –ї–µ—З–µ–љ–љ—Л—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ, –Є 40% –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –і—А—Г–≥–Є–µ –Р–Р–Я (—А=0,007) [20].
–Т —Б–µ—А–µ–і–Є–љ–µ 80–—Е –≥–Њ–і–Њ–≤ XX –≤–µ–Ї–∞ –±—Л–ї–Њ –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Є–Љ–њ–ї–∞–љ—В–∞—Ж–Є—П –Ї–∞—А–і–Є–Њ–≤–µ—А—В–µ—А–∞––і–µ—Д–Є–±—А–Є–ї–ї—П—В–Њ—А–∞ (–Ъ–Т–Ф) —П–≤–ї—П–µ—В—Б—П –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ, —З–µ–Љ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П, —Б–њ–Њ—Б–Њ–±–Њ–Љ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ. –Я–Њ —Н—В–Њ–є –њ—А–Є—З–Є–љ–µ 105 –Є–Ј 228 (46%) –±–Њ–ї—М–љ—Л—Е, —Г—З–∞—Б—В–≤–Њ–≤–∞–≤—И–Є—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CASCADE, –±—Л–ї –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ –Ъ–Т–Ф.
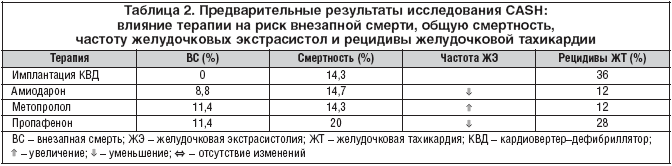
–Я–Њ—Б–ї–µ 1985 –≥. –≤ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Р–Р–Я —Г –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–ґ–Є–≤—И–Є—Е –Њ—Б—В–∞–љ–Њ–≤–Ї—Г —Б–µ—А–і—Ж–∞, —Б—В–∞–ї–Є –Њ—Ж–µ–љ–Є–≤–∞—В—М –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –≥—А—Г–њ–њ–Њ–є –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–Љ –±—Л–ї –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ –Ъ–Т–Ф. –Ґ–∞–Ї, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CASH —Г 230 –±–Њ–ї—М–љ—Л—Е —Б—А–∞–≤–љ–Є–≤–∞–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —З–µ—В—Л—А–µ—Е –Љ–µ—В–Њ–і–Њ–≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є: 1) –Є–Љ–њ–ї–∞–љ—В–∞—Ж–Є—П –Ъ–Т–Ф; 2) –∞–Љ–Є–Њ–і–∞—А–Њ–љ (400–600 –Љ–≥/—Б—Г—В.); 3) –Љ–µ—В–Њ–њ—А–Њ–ї–Њ–ї (–і–Њ 300 –Љ–≥/—Б—Г—В.); 4) –њ—А–Њ–њ–∞—Д–µ–љ–Њ–љ (–і–Њ 900 –Љ–≥/—Б—Г—В.). –Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ–∞—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П – 2 –≥–Њ–і–∞. –£—З–Є—В—Л–≤–∞—П –≤—Л—Б–Њ–Ї—Г—О —З–∞—Б—В–Њ—В—Г –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є –Є —А–µ—Ж–Є–і–Є–≤–Њ–≤ —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ—А–Њ–њ–∞—Д–µ–љ–Њ–љ, –Є–Ј—Г—З–µ–љ–Є–µ –≤–ї–Є—П–љ–Є—П —Н—В–Њ–≥–Њ –Р–Р–Я –і–ї—П —Г–ї—Г—З—И–µ–љ–Є—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –±—Л–ї–Њ –і–Њ—Б—А–Њ—З–љ–Њ –њ—А–µ–Ї—А–∞—Й–µ–љ–Њ [21]. –Я–Њ—Б–ї–µ 11 –Љ–µ—Б. –љ–∞–±–ї—О–і–µ–љ–Є—П –љ–µ –±—Л–ї–Њ —А–∞–Ј–ї–Є—З–Є–є –≤ –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Љ–µ–ґ–і—Г —В—А–µ–Љ—П –і—А—Г–≥–Є–Љ–Є –≥—А—Г–њ–њ–∞–Љ–Є –±–Њ–ї—М–љ—Л—Е. –Э–µ –±—Л–ї–Њ —Б–ї—Г—З–∞–µ–≤ –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–Љ –±—Л–ї –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ –Ъ–Т–Ф; —З–∞—Б—В–Њ—В–∞ –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є —Б—А–µ–і–Є –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 8,8%, —Б—А–µ–і–Є –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Љ–µ—В–Њ–њ—А–Њ–ї–Њ–ї – 11,4%. –І–∞—Б—В–Њ—В–∞ —А–µ—Ж–Є–і–Є–≤–Њ–≤ —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ –њ–Њ 12% –≤ –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е, –ї–µ—З–µ–љ–љ—Л—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –Є –Љ–µ—В–Њ–њ—А–Њ–ї–Њ–ї–Њ–Љ; —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е —Б –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Ъ–Т–Ф –Њ–љ–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 36% (—В–∞–±–ї. 2).
–°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –њ–Њ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л–Љ –і–∞–љ–љ—Л–Љ, —Г –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–ґ–Є–≤—И–Є—Е –Њ—Б—В–∞–љ–Њ–≤–Ї—Г —Б–µ—А–і—Ж–∞, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–∞ —Б —В–∞–Ї–Њ–≤–Њ–є –Є–Љ–њ–ї–∞–љ—В–Є—А—Г–µ–Љ–Њ–≥–Њ –Ъ–Т–Ф, –Ї–Њ—В–Њ—А—Л–є —Б—З–Є—В–∞–µ—В—Б—П —Б–∞–Љ—Л–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —Б–њ–Њ—Б–Њ–±–Њ–Љ –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є –≤ –≥—А—Г–њ–њ–∞—Е —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ.
–Т —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є AVID —Б—А–∞–≤–љ–Є–≤–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є–Љ–њ–ї–∞–љ—В–Є—А—Г–µ–Љ—Л—Е –Ъ–Т–Ф –Є –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є —Г 1016 –±–Њ–ї—М–љ—Л—Е. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –±–Њ–ї—М–љ—Л–µ –њ–Њ—Б–ї–µ —А–µ–∞–љ–Є–Љ–∞—Ж–Є–Є –њ–Њ –њ–Њ–≤–Њ–і—Г —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤ –Є–ї–Є —Б—В–Њ–є–Ї–Њ–є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є —В–∞—Е–Є–Ї–∞—А–і–Є–Є —Б —Д—А–∞–Ї—Ж–Є–µ–є –≤—Л–±—А–Њ—Б–∞ –Ы–Ц –љ–µ –±–Њ–ї–µ–µ 40% [22]. –Я–Њ—Б–ї–µ —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є 507 –±–Њ–ї—М–љ—Л–Љ –±—Л–ї –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ –Ъ–Т–Ф, –∞ —Г 509 –±–Њ–ї—М–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П. –С–Њ–ї–µ–µ —З–µ–Љ –≤ 80–90% —Б–ї—Г—З–∞–µ–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –∞–Љ–Є–Њ–і–∞—А–Њ–љ. –Ф–Њ–Ј–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ–і–±–Є—А–∞–ї–∞—Б—М —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Є–Љ –њ—Г—В–µ–Љ. –Я–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–Є–µ –і–Њ–Ј—Л –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–ї–Є –≤ —Б—А–µ–і–љ–µ–Љ –Њ–Ї–Њ–ї–Њ 400–250 –Љ–≥/—Б—Г—В.
–°–Љ–µ—А—В–љ–Њ—Б—В—М –Ј–∞ –≤—Б–µ –≤—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–∞ 15,8% –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Ъ–Т–Ф –Є 24,0% –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Г—О —В–µ—А–∞–њ–Є—О (—А<0,02). –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї–Є —А–∞—Б—З–µ—В—Л, –Њ–ґ–Є–і–∞–µ–Љ–∞—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ґ–Є–Ј–љ–Є –њ–Њ—Б–ї–µ –Є–Љ–њ–ї–∞–љ—В–∞—Ж–Є–Є –і–Њ—А–Њ–≥–Њ—Б—В–Њ—П—Й–µ–≥–Њ –Ъ–Т–Ф —Г–≤–µ–ї–Є—З–Є–ї–∞—Б—М –Љ–µ–љ–µ–µ —З–µ–Љ –љ–∞ 3 –Љ–µ—Б –Ј–∞ —В—А–Є –≥–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П. –Ъ —В–Њ–Љ—Г –ґ–µ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –Є–Љ–њ–ї–∞–љ—В–Є—А—Г–µ–Љ—Л–µ –Ъ–Т–Ф –љ–µ —Г–ї—Г—З—И–∞–ї–Є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б —Д—А–∞–Ї—Ж–Є–µ–є –≤—Л–±—А–Њ—Б–∞ –Ы–Ц –±–Њ–ї–µ–µ 35%. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є AVID –∞–Ї—В–Є–≤–∞—Ж–Є—П –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ъ–Ф –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є —В–∞—Е–Є–Ї–∞—А–і–Є–µ–є (81% –Ј–∞ 2 –≥–Њ–і–∞ –Є 85% –Ј–∞ 3 –≥–Њ–і–∞) –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ, —З–µ–Љ –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б —Д–Є–±—А–Є–ї–ї—П—Ж–Є–µ–є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤ (53 –Є 69% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —В–µ—А–∞–њ–Є—П –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–Њ–є –Є–Љ–њ–ї–∞–љ—В–∞—Ж–Є–Є –Ъ–Т–Ф —Г –±–Њ–ї—М–љ—Л—Е —Б —Д—А–∞–Ї—Ж–Є–µ–є –≤—Л–±—А–Њ—Б–∞ –Ы–Ц –±–Њ–ї–µ–µ 35%. –Ш—Б—Е–Њ–і—П –Є–Ј –і–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П AVID –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –Є–Љ–њ–ї–∞–љ—В–∞—Ж–Є—П –Ъ–Т–Ф –±–Њ–ї–µ–µ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –±–Њ–ї—М–љ—Л–Љ —Б –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є —В–∞—Е–Є–Ї–∞—А–і–Є–µ–є, –∞ —В–µ—А–∞–њ–Є—П –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ – –±–Њ–ї—М–љ—Л–Љ, —А–µ–∞–љ–Є–Љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ –њ–Њ—Б–ї–µ —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤.
–Т —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CIDS —Б—А–∞–≤–љ–Є–≤–∞–ї–Є –≤–ї–Є—П–љ–Є–µ –Є–Љ–њ–ї–∞–љ—В–∞—Ж–Є–Є –Ъ–Т–Ф –Є —В–µ—А–∞–њ–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ (400—200 –Љ–≥/—Б—Г—В.) –љ–∞ –Њ—В–і–∞–ї–µ–љ–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј —Г 659 –±–Њ–ї—М–љ—Л—Е —Б–Њ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–Љ–Є –∞—А–Є—В–Љ–Є—П–Љ–Є. –Ч–∞ 3 –≥–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–Є–ї–∞ 25% –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Ъ–Т–Ф –Є 30% –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –ї–µ—З–µ–љ–љ—Л—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ (—А=0,072) [23].
–°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П CIDS —В–∞–Ї–ґ–µ —Г–Ї–∞–Ј—Л–≤–∞—О—В –љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–ї—М—В–µ—А–љ–∞—В–Є–≤—Л –Є–Љ–њ–ї–∞–љ—В–Є—А—Г–µ–Љ—Л–Љ –Ъ–Т–Ф —Г –±–Њ–ї—М–љ—Л—Е —Б–Њ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–Љ–Є —В–∞—Е–Є–∞—А–Є—В–Љ–Є—П–Љ–Є.
–Я–Њ –і–∞–љ–љ—Л–Љ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–∞ 15 —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –∞–Љ–Є–Њ–і–∞—А–Њ–љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–ґ–∞–µ—В —Б–Љ–µ—А—В–љ–Њ—Б—В—М —Г —В—А–µ—Е –Ї–∞—В–µ–≥–Њ—А–Є–є –±–Њ–ї—М–љ—Л—Е, –∞ –Є–Љ–µ–љ–љ–Њ, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞, —Б –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ –Є —А–µ–∞–љ–Є–Љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ—Б–ї–µ –Њ—Б—В–∞–љ–Њ–≤–Ї–Є —Б–µ—А–і—Ж–∞ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є [24]. –†–∞—Б—З–µ—В—Л –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –Њ–±—Й–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М —Б–љ–Є–ґ–∞–µ—В—Б—П –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 19% (—А<0,01), —Б–µ—А–і–µ—З–љ–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М – –љ–∞ 23% (—А<0,001) –Є –≤–љ–µ–Ј–∞–њ–љ–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М – –љ–∞ 30% (—А<0,001). –°–љ–Є–ґ–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –±—Л–ї–Њ –њ—А–Є–Љ–µ—А–љ–Њ –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–Љ —Г –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ш–Ь (–љ–∞ 22%), –±–Њ–ї—М–љ—Л—Е —Б —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц (–љ–∞ 22%) –Є —Г –±–Њ–ї—М–љ—Л—Е –њ–Њ—Б–ї–µ –Њ—Б—В–∞–љ–Њ–≤–Ї–Є —Б–µ—А–і—Ж–∞ (–љ–∞ 25%). –Ю–±—Й–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М –љ–∞ 25% –њ—А–Є –ї–µ—З–µ–љ–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –±–Њ–ї—М–љ—Л—Е —Б –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–Љ–Є –∞—А–Є—В–Љ–Є—П–Љ–Є, –і–Њ–Ї—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –њ—А–Є 24–—З–∞—Б–Њ–≤–Њ–Љ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є–Є –≠–Ъ–У, –љ–Њ –ї–Є—И—М –љ–∞ 10% —Г –±–Њ–ї—М–љ—Л—Е –±–µ–Ј –і–Њ–Ї—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–љ—Л—Е –∞—А–Є—В–Љ–Є–є.
–Я–Њ –і–∞–љ–љ—Л–Љ –і—А—Г–≥–Њ–≥–Њ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–∞, —Г –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ш–Ь –Є–ї–Є —Б—В—А–∞–і–∞—О—Й–Є—Е –•–°–Э, –і–ї–Є—В–µ–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –њ—А–Є–≤–Њ–і–Є—В –Ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –Ї–∞–Ї –Њ–±—Й–µ–є, —В–∞–Ї –Є –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є/–≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є [25]. –Ґ–∞–Ї, –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї —Б–Љ–µ—А—В–Є –Њ—В –≤—Б–µ—Е –њ—А–Є—З–Є–љ —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е, –ї–µ—З–µ–љ–љ—Л—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ, —Б–Њ—Б—В–∞–≤–Є–ї 0,87 (95%––Ф–Ш –Њ—В 0,78 –і–Њ 0,99) –Є –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є/–≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є – 0,71 (95%––Ф–Ш –Њ—В 0,59 –і–Њ 0,85). –Ш–љ—Л–Љ–Є —Б–ї–Њ–≤–∞–Љ–Є, —Г –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ш–Ь, –∞ —В–∞–Ї–ґ–µ —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э –∞–Љ–Є–Њ–і–∞—А–Њ–љ (–Ъ–Њ—А–і–∞—А–Њ–љ) —Б–љ–Є–ґ–∞–µ—В –Њ–±—Й—Г—О —Б–Љ–µ—А—В–љ–Њ—Б—В—М –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 13%, –∞ —А–Є—Б–Ї –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є/–≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є – –љ–∞ 29%.
–Ь–µ—А—Ж–∞–љ–Є–µ –њ—А–µ–і—Б–µ—А–і–Є–є
–£ –±–Њ–ї—М–љ—Л—Е —Б –Љ–µ—А—Ж–∞–љ–Є–µ–Љ (–Є —В—А–µ–њ–µ—В–∞–љ–Є–µ–Љ) –њ—А–µ–і—Б–µ—А–і–Є–є –∞–Љ–Є–Њ–і–∞—А–Њ–љ (–Ъ–Њ—А–і–∞—А–Њ–љ) –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –њ–Њ —Б–ї–µ–і—Г—О—Й–Є–Љ –Њ—Б–љ–Њ–≤–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ: 1) –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞; 2) –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞ –њ–Њ—Б–ї–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є –Є–ї–Є —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є–Є.
–Т—Л—Б–Њ–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –њ—А–Є –Љ–µ—А—Ж–∞–љ–Є–Є (–Є —В—А–µ–њ–µ—В–∞–љ–Є–Є) –њ—А–µ–і—Б–µ—А–і–Є–є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –≤ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е [3–8,26–30]. –Я–Њ —Б–≤–Њ–і–љ—Л–Љ –і–∞–љ–љ—Л–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —Б–Є–љ—Г—Б–Њ–≤—Л–є —А–Є—В–Љ —Г–і–∞–≤–∞–ї–Њ—Б—М –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В—М –≤ —Б—А–µ–і–љ–µ–Љ —Г 66% –±–Њ–ї—М–љ—Л—Е —Б –Љ–µ—А—Ж–∞–љ–Є–µ–Љ –њ—А–µ–і—Б–µ—А–і–Є–є (–Ї–Њ–ї–µ–±–∞–љ–Є—П –Њ—В 37 –і–Њ 100% –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞ –Є —Б—А–Њ–Ї–Њ–≤ –љ–∞–±–ї—О–і–µ–љ–Є—П) [29].
–£—З–Є—В—Л–≤–∞—П –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –љ–∞ —Б–Њ–Ї—А–∞—В–Є–Љ–Њ—Б—В—М –Љ–Є–Њ–Ї–∞—А–і–∞, –Њ–љ —Б—З–Є—В–∞–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤—Л–±–Њ—А–∞ –і–ї—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б —П–≤–љ–Њ–є –Є–ї–Є —Б–Ї—А—Л—В–Њ–є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц, –Ї–Њ—В–Њ—А–∞—П —П–≤–ї—П–µ—В—Б—П –∞–±—Б–Њ–ї—О—В–љ—Л–Љ –Є–ї–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–Љ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –Р–Р–Я I –Ї–ї–∞—Б—Б–∞, –∞ —В–∞–Ї–ґ–µ —Б–Њ—В–∞–ї–Њ–ї–∞. –Ф–ї—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –њ–∞—А–Њ–Ї—Б–Є–Ј–Љ–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ–Њ–є –Љ–µ—А—Ж–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є –∞–Љ–Є–Њ–і–∞—А–Њ–љ, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –≤–≤–Њ–і–Є—В—Б—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –≤ –≤–Є–і–µ –Љ–µ–і–ї–µ–љ–љ–Њ–є –Є–љ—Д—Г–Ј–Є–Є (1,5 –Љ–≥/–Ї–≥ —Б–Њ —Б–Ї–Њ—А–Њ—Б—В—М—О –љ–µ –±–Њ–ї–µ–µ 15 –Љ–≥/–Љ–Є–љ.). –Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В—Б—П –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ –љ–∞–≥—А—Г–Ј–Њ—З–љ—Л–µ –і–Њ–Ј—Л –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –њ—А–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є – –і–Њ 1200 –Є–ї–Є 1800 –Љ–≥ –≤ —Б—Г—В–Ї–Є (—Б–Њ–≥–ї–∞—Б–љ–Њ –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–Њ—А–і–∞—А–Њ–љ, –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —Б—Г—В–Њ—З–љ–∞—П –і–Њ–Ј–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1,2 –≥). –†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ–∞—П —Б—Г–Љ–Љ–∞—А–љ–∞—П –і–Њ–Ј–∞ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 10 –≥, –њ–Њ—Б–ї–µ —З–µ–≥–Њ –њ–µ—А–µ—Е–Њ–і—П—В –љ–∞ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–Є–µ –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞ –≤–љ—Г—В—А—М (200–400 –Љ–≥/—Б—Г—В.) [6,8,27,28].
–Ч–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–µ–ґ–µ –∞–Љ–Є–Њ–і–∞—А–Њ–љ –љ–∞–Ј–љ–∞—З–∞—О—В –≤–љ—Г—В—А—М. –Я—А–µ–і–ї–∞–≥–∞—О—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–µ —Б—Е–µ–Љ—Л –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –љ–∞–≥—А—Г–Ј–Њ—З–љ—Л—Е –і–Њ–Ј –њ—А–µ–њ–∞—А–∞—В–∞: 1) 600 –Љ–≥/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 4–6 –љ–µ–і–µ–ї—М; 2) 800 –Љ–≥/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 1 –љ–µ–і–µ–ї–Є, –Ј–∞—В–µ–Љ 600 –Љ–≥/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 1 –љ–µ–і–µ–ї–Є, 400 –Љ–≥/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 4 –љ–µ–і–µ–ї—М; 3) 1200–1800 –Љ–≥/—Б—Г—В. (—Б–Њ–≥–ї–∞—Б–љ–Њ –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–Њ—А–і–∞—А–Њ–љ, –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —Б—Г—В–Њ—З–љ–∞—П –і–Њ–Ј–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1,2 –≥) –≤ —Г—Б–ї–Њ–≤–Є—П—Е —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞ –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Б—Г–Љ–Љ–∞—А–љ–Њ–є –і–Њ–Ј—Л –≤ 10 –≥; 4) 600–800 –Љ–≥/—Б—Г—В. –≤ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Б—Г–Љ–Љ–∞—А–љ–Њ–є –і–Њ–Ј—Л 10 –≥ –≤–љ—Г—В—А—М. –С–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ—Л–є –њ–µ—А–Є–Њ–і –љ–∞—Б—Л—Й–µ–љ–Є—П –Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П —Г –±–Њ–ї—М–љ—Л—Е —Б –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Д—Г–љ–Ї—Ж–Є–Є —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —Г–Ј–ї–∞ –Є–ї–Є –Р–Т––њ—А–Њ–≤–Њ–і–Є–Љ–Њ—Б—В–Є [5,6,8,28].
–Т–Њ –≤—А–µ–Љ—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –љ–∞—Б—Л—Й–∞—О—Й–Є—Е –і–Њ–Ј –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ —В—А–µ–±—Г–µ—В—Б—П –≠–Ъ–У––Ї–Њ–љ—В—А–Њ–ї—М – –љ–∞—Б—Л—Й–µ–љ–Є–µ –њ—А–µ–Ї—А–∞—Й–∞—О—В, –µ—Б–ї–Є —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –±—А–∞–і–Є–Ї–∞—А–і–Є—П –Є–ї–Є –Є–љ—В–µ—А–≤–∞–ї Q–T –њ—А–µ–≤—Л—И–∞–µ—В 520 –Љ—Б. –†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ–∞—П –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–∞—П –і–Њ–Ј–∞ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –њ–Њ—Б–ї–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 200–400 –Љ–≥/—Б—Г—В. –≤–љ—Г—В—А—М. –Ю–±—Л—З–љ–Њ –Њ–љ–∞ –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 150–200 –Љ–≥/—Б—Г—В., –Є –ї–Є—И—М –њ—А–Є —А–µ—Д—А–∞–Ї—В–Њ—А–љ–Њ–Љ –Љ–µ—А—Ж–∞–љ–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–Є–µ –і–Њ–Ј—Л –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ (–і–Њ 400 –Є–ї–Є –і–∞–ґ–µ 600 –Љ–≥/—Б—Г—В.) [5,6,8,27,28].
–Р–Љ–Є–Њ–і–∞—А–Њ–љ (–Ъ–Њ—А–і–∞—А–Њ–љ) —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В —А–µ—Ж–Є–і–Є–≤—Л –Љ–µ—А—Ж–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є. –Я–Њ –і–∞–љ–љ—Л–Љ –і–ї–Є—В–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —Г 50—80% –±–Њ–ї—М–љ—Л—Е —Б –њ–∞—А–Њ–Ї—Б–Є–Ј–Љ–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ–Њ–є –Љ–µ—А—Ж–∞–љ–Є—П –Є–ї–Є —В—А–µ–њ–µ—В–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є, –ї–µ—З–µ–љ–љ—Л—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ, —Б–Є–љ—Г—Б–Њ–≤—Л–є —А–Є—В–Љ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 6—22 –Љ–µ—Б. –£ 93% –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ, —Б–Є–љ—Г—Б–Њ–≤—Л–є —А–Є—В–Љ —Б–Њ—Е—А–∞–љ—П–ї—Б—П –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –†–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ —Г 70% –±–Њ–ї—М–љ—Л—Е —Б –Љ–µ—А—Ж–∞–љ–Є–µ–Љ –њ—А–µ–і—Б–µ—А–і–Є–є, —А–µ—Д—А–∞–Ї—В–µ—А–љ—Л—Е –Ї —В–µ—А–∞–њ–Є–Є –Р–Р–Я I –Ї–ї–∞—Б—Б–∞, –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ —Б–Є–љ—Г—Б–Њ–≤—Л–є —А–Є—В–Љ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ 3 –ї–µ—В –Є —Г 55% –±–Њ–ї—М–љ—Л—Е –≤ —В–µ—З–µ–љ–Є–µ 5 –ї–µ—В [31–34].
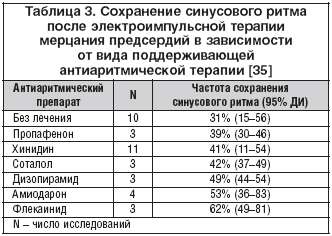
–Э–∞–Ї–Њ–њ–ї–µ–љ –±–Њ–ї—М—И–Њ–є –Њ–њ—Л—В –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞ –њ–Њ—Б–ї–µ —Н–ї–µ–Ї—В—А–Њ–Є–Љ–њ—Г–ї—М—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Љ–µ—А—Ж–∞–љ–Є—П –Є —В—А–µ–њ–µ—В–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є. –Я–Њ –і–∞–љ–љ—Л–Љ —А–µ—В—А–Њ–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ [35], –∞–Љ–Є–Њ–і–∞—А–Њ–љ –љ–∞—А—П–і—Г —Б —Д–ї–µ–Ї–∞–Є–љ–Є–і–Њ–Љ –Є –і–Є–Ј–Њ–њ–Є—А–∞–Љ–Є–і–Њ–Љ –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В —А–µ—Ж–Є–і–Є–≤—Л –Љ–µ—А—Ж–∞–љ–Є—П –Є —В—А–µ–њ–µ—В–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є –њ–Њ—Б–ї–µ —Н–ї–µ–Ї—В—А–Њ–Є–Љ–њ—Г–ї—М—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є (—В–∞–±–ї. 3).
–Т –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—В—М —Б–Є–љ—Г—Б–Њ–≤—Л–є —А–Є—В–Љ –њ–Њ—Б–ї–µ –Ї–∞—А–і–Є–≤–µ—А—Б–Є–Є –њ–Њ –њ–Њ–≤–Њ–і—Г –Љ–µ—А—Ж–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –і—А—Г–≥–Є–Љ–Є –Р–Р–Я. –Т–Њ –≤—Б–µ—Е —Н—В–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є–ї –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Р–Р–Я I–Р –Є I–° –Ї–ї–∞—Б—Б–∞. –Ґ–∞–Ї, –≤ –Ї–∞–љ–∞–і—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CTAF –њ–Њ—Б–ї–µ —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є 403 –±–Њ–ї—М–љ—Л—Е —Б –њ–∞—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –Є–ї–Є –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–є —Д–Њ—А–Љ–∞–Љ–Є –Љ–µ—А—Ж–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є –њ–Њ–ї—Г—З–∞–ї–Є –ї–Є–±–Њ –∞–Љ–Є–Њ–і–∞—А–Њ–љ (–њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–∞—П –і–Њ–Ј–∞ 200 –Љ–≥/—Б—Г—В.), –ї–Є–±–Њ –њ—А–Њ–њ–∞—Д–µ–љ–Њ–љ –Є–ї–Є —Б–Њ—В–∞–ї–Њ–ї [36]. –Ч–∞ –≤—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П (–≤ —Б—А–µ–і–љ–µ–Љ 16 –Љ–µ—Б—П—Ж–µ–≤) —А–µ—Ж–Є–і–Є–≤ –Љ–µ—А—Ж–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є —Б–Њ—Е—А–∞–љ–Є–ї—Б—П —Г 63% –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ—А–Њ–њ–∞—Д–µ–љ–Њ–љ –Є–ї–Є —Б–Њ—В–∞–ї–Њ–ї, –љ–Њ –ї–Є—И—М —Г 35% –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ (—А<0,001).
–Т –і—А—Г–≥–Њ–Љ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SAFE–T 665 –±–Њ–ї—М–љ—Л—Е —Б –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–Є–Љ –Љ–µ—А—Ж–∞–љ–Є–µ–Љ –њ—А–µ–і—Б–µ—А–і–Є–є –≤ —В–µ—З–µ–љ–Є–µ 12—54 –Љ–µ—Б. –њ–Њ–ї—Г—З–∞–ї–Є –ї–Є–±–Њ –∞–Љ–Є–Њ–і–∞—А–Њ–љ (–њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–∞—П –і–Њ–Ј–∞ 200 –Љ–≥/—Б—Г—В.), –ї–Є–±–Њ —Б–Њ—В–∞–ї–Њ–ї, –ї–Є–±–Њ –њ–ї–∞—Ж–µ–±–Њ [37]. –Я–Њ—Б–ї–µ 1 –≥–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П —А–µ—Ж–Є–і–Є–≤ –Љ–µ—А—Ж–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є –Њ—В–Љ–µ—З–µ–љ —Г 82% –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ–ї–∞—Ж–µ–±–Њ, 60% –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Б–Њ—В–∞–ї–Њ–ї, –Є 35% –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ.
–Т —В—А–µ—В—М–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є – AFFIRM —Г 410 –±–Њ–ї—М–љ—Л—Е —Б –Љ–µ—А—Ж–∞–љ–Є–µ–Љ –њ—А–µ–і—Б–µ—А–і–Є–є —Б—А–∞–≤–љ–Є–≤–∞–ї–Є—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ (–њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–∞—П –і–Њ–Ј–∞ 200 –Љ–≥/—Б—Г—В.), —Б–Њ—В–∞–ї–Њ–ї–∞ –Є –Р–Р–Я I–Р –Є I–° –Ї–ї–∞—Б—Б–∞ (—Е–Є–љ–Є–і–Є–љ, –њ—А–Њ–Ї–∞–Є–љ–∞–Љ–Є–і, –і–Є–Ј–Њ–њ–Є—А–∞–Љ–Є–і, –Љ–Њ—А–Є—Ж–Є–Ј–Є–љ, –њ—А–Њ–њ–∞—Д–µ–љ–Њ–љ –Є —Д–ї–µ–Ї–∞–Є–љ–Є–і) [38]. –Э–∞–±–ї—О–і–µ–љ–Є–µ –Ј–∞ –±–Њ–ї—М–љ—Л–Љ–Є –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Њ—Б—М –і–Њ 5 –ї–µ—В. –Ч–∞ –≤—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П –і–Њ–ї—П –±–Њ–ї—М–љ—Л—Е –±–µ–Ј —А–µ—Ж–Є–і–Є–≤–∞ –Љ–µ—А—Ж–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–Њ–Љ –±—Л–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Љ–µ–љ—М—И–µ, —З–µ–Љ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Р–Р–Я I –Ї–ї–∞—Б—Б–∞ (—А=0,011) –Є–ї–Є —Б–Њ—В–∞–ї–Њ–ї–Њ–Љ (—А<0001). –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Р–Р–Я I –Ї–ї–∞—Б—Б–∞ –Є —Б–Њ—В–∞–ї–Њ–ї–∞ –≤ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞ –±—Л–ї–∞ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є. –Ю–±—Й–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М –≤ –≥—А—Г–њ–њ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ –±—Л–ї–∞ –Љ–µ–љ—М—И–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–∞—Е –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Р–Р–Я I –Ї–ї–∞—Б—Б–∞ –Є–ї–Є —Б–Њ—В–∞–ї–Њ–ї, –њ—А–Є—З–µ–Љ —А–∞–Ј–ї–Є—З–Є—П –≤ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Љ–µ–ґ–і—Г –±–Њ–ї—М–љ—Л–Љ–Є, –њ–Њ–ї—Г—З–∞–≤—И–Є–Љ–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ –Є –Р–Р–Я I –Ї–ї–∞—Б—Б–∞, –±—Л–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ–Є (—А=0,008). –І–∞—Б—В–Њ—В–∞ —Б–ї—Г—З–∞–µ–≤ –∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —Б–Љ–µ—А—В–Є –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–Љ–Є–Њ–і–∞—А–Њ–љ, –±—Л–ї–∞ –Љ–µ–љ—М—И–µ, —З–µ–Љ —Г –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Р–Р–Я I –Ї–ї–∞—Б—Б–∞, –љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–∞—Б—М –Њ—В —В–∞–Ї–Њ–≤–Њ–є —Г –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Б–Њ—В–∞–ї–Њ–ї.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Њ–њ—Л—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –Љ–µ—А—Ж–∞–љ–Є–µ–Љ –њ—А–µ–і—Б–µ—А–і–Є–є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —В–Њ–Љ, —З—В–Њ –њ—А–µ–њ–∞—А–∞—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Р–Р–Я I –Ї–ї–∞—Б—Б–∞ –Є —Б–Њ—В–∞–ї–Њ–ї. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –∞–Љ–Є–Њ–і–∞—А–Њ–љ, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, –±–Њ–ї–µ–µ –±–µ–Ј–Њ–њ–∞—Б–µ–љ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є, —З–µ–Љ –Р–Р–Я I –Ї–ї–∞—Б—Б–∞, –Ї–Њ—В–Њ—А—Л–µ —Б—З–Є—В–∞—О—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ–Є –Є–Ј –і–Њ—Б—В—Г–њ–љ—Л—Е –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Р–Р–Я.
–Ф—А—Г–≥–Є–µ —В–∞—Е–Є–∞—А–Є—В–Љ–Є–Є
–Р–Љ–Є–Њ–і–∞—А–Њ–љ —Б —Г—Б–њ–µ—Е–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –њ—А–Є –ї–µ—З–µ–љ–Є–Є –і—А—Г–≥–Є—Е —В–∞—Е–Є–∞—А–Є—В–Љ–Є–є. –Я—А–Є –њ–∞—А–Њ–Ї—Б–Є–Ј–Љ–∞–ї—М–љ–Њ–є –Р–Т–—Г–Ј–ї–Њ–≤–Њ–є —А–µ—Ж–Є–њ—А–Њ–Ї–љ–Њ–є —В–∞—Е–Є–Ї–∞—А–і–Є–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ –Љ–µ–љ–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ, —З–µ–Љ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –Ї–∞–ї—М—Ж–Є—П, –∞–і–µ–љ–Њ–Ј–Є–љ –Є–ї–Є –∞–і–µ–љ–Њ–Ј–Є–љ—В—А–Є—Д–Њ—Б—Д–∞—В (–Р–Ґ–§). –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –Њ–љ –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –і–ї—П –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П —Н—В–Њ–є –љ–∞–і–ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є —В–∞—Е–Є–∞—А–Є–Љ–Є–Є, –µ—Б–ї–Є –≤–µ—А–∞–њ–∞–Љ–Є–ї, –і–Є–ї—В–Є–∞–Ј–µ–Љ, –∞–і–µ–љ–Њ–Ј–Є–љ –Є–ї–Є –Р–Ґ–§ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –Є–ї–Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ—Л. –Ю—Б–Њ–±–µ–љ–љ–Њ –њ–Њ–ї–µ–Ј–µ–љ –Њ–љ –њ—А–Є –ї–µ—З–µ–љ–Є–Є —Н—В–Њ–є —В–∞—Е–Є–∞—А–Є—В–Љ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —Б —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –Т–Њ–ї—М—Д–∞––Я–∞—А–Ї–Є–љ—Б–Њ–љ–∞––£–∞–є—В–∞, –Ї–Њ–≥–і–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ –Ї–∞–ї—М—Ж–Є—П, –∞–і–µ–љ–Њ–Ј–Є–љ –Є–ї–Є –Р–Ґ–§ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ–Њ –Є–Ј––Ј–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ —Г—Б–Ї–Њ—А–µ–љ–Є—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ –њ—Г—В—П–Љ [39].
–Ш—В–∞–Ї, –∞–Љ–Є–Њ–і–∞—А–Њ–љ (–Ъ–Њ—А–і–∞—А–Њ–љ) —П–≤–ї—П–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Є–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ —Б —И–Є—А–Њ–Ї–Њ–Љ —Б–њ–µ–Ї—В—А–Њ–Љ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П. –Ю–љ —Б —Г—Б–њ–µ—Е–Њ–Љ –Ї—Г–њ–Є—А—Г–µ—В –Ї–∞–Ї –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–µ, —В–∞–Ї –Є –љ–∞–і–ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–µ —В–∞—Е–Є–∞—А–Є—В–Љ–Є–Є. –Р–Љ–Є–Њ–і–∞—А–Њ–љ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–µ—В —Б–Є–љ—Г—Б–Њ–≤—Л–є —А–Є—В–Љ —Г –±–Њ–ї—М–љ—Л—Е —Б –Љ–µ—А—Ж–∞–љ–Є–µ–Љ –Є —В—А–µ–њ–µ—В–∞–љ–Є–µ–Љ –њ—А–µ–і—Б–µ—А–і–Є–є. –Ю–љ —В–∞–Ї–ґ–µ —П–≤–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–љ–µ–Ј–∞–њ–љ–Њ–є (–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є) —Б–Љ–µ—А—В–Є —Г –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞ –Є–ї–Є —Б—В—А–∞–і–∞—О—Й–Є—Е —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О, –∞ —В–∞–Ї–ґ–µ —Г –±–Њ–ї—М–љ—Л—Е, —А–µ–∞–љ–Є–Љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ—Б–ї–µ –Њ—Б—В–∞–љ–Њ–≤–Ї–Є —Б–µ—А–і—Ж–∞.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Vaughan Williams E.M. Classification of antiarrhythmic drugs – In: Symposium of on cardiac arrhythmias. Ed. by E. Sandoe et al. – Sodertajie (Sweden), AB Astra, 1970, 440–449.
2. Marcus F.I. Clinical pharmacology of amiodarone – Ann. N.Y. Acad. Sci., 1984; 427; 112–125.
3. Kerr C.R., Rosenbaum M.B., Chiale P.A. Amiodarone – In: F.H.Messerli (ed.) Cardiovascular drug therapy. – 2nd edition, Philadelphia, 1996, pp. 1247–1264.
4. –Ъ—Г—И–∞–Ї–Њ–≤—Б–Ї–Є–є –Ь.–°. –Р—А–Є—В–Љ–Є–Є —Б–µ—А–і—Ж–∞. –°–∞–љ–Ї—В––Я–µ—В–µ—А–±—Г—А–≥, 1992.
5. –Я—А–µ–Њ–±—А–∞–ґ–µ–љ—Б–Ї–Є–є –Ф.–Т., –°–Є–і–Њ—А–µ–љ–Ї–Њ –С.–Р. –Ь–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –Љ–µ—А—Ж–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є. – –Ь–Њ—Б–Ї–≤–∞, 2003.
6. –Я—А–µ–Њ–±—А–∞–ґ–µ–љ—Б–Ї–Є–є –Ф.–Т., –°–Є–і–Њ—А–µ–љ–Ї–Њ –С.–Р., –Ы–µ–±–µ–і–µ–≤–∞ –Ю.–Т., –Ъ–Є–Ї—В–µ–≤ –Т.–У. –Р–Љ–Є–Њ–і–∞—А–Њ–љ (–Ї–Њ—А–і–∞—А–Њ–љ): –Љ–µ—Б—В–Њ –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –∞–љ—В–Є–∞—А–Є—В–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є. // –Ъ–ї–Є–љ. —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—П –Є —В–µ—А–∞–њ–Є—П, 1999; 4: 2–7.
7. Kishida S., Nakajima T., Ma J. et al. Amiodarone and N–desethylfamiodarone ehance endothelial nitric oxide production in human endothelial cells. – Int. Heart J., 2006; 47: 85—93.
8. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation–executive summary. – Europ. Heart J., 2006; 27: 1979–2030.
9. Harris L. Unwanted effects. – In: L.Harris and R.Roncucci (eds.). Amiodarone. – Paris, 1986, pp. 204–269.
10. The CAST Investigators. Preliminary report: effect of encainide and flecainide on mortality in a randomized trials of arrhythmia suppression after myocardial infarction. // New Engl. J. Med., 1989; 321: 406—412.
11. The Cardiac Arrhythmia Suppression Trial II Investigators. `Effect of the antiarrhythmic agent moricizine on survival after myocardial infarction. // New Engl. J. Med., 1992; 327: 227—233.
12. Coplen S.E. Antmann E.M., Berlin J.A. et al. Efficacy and safety of quinidine therapy for maintenance of sinus rhythm after cardioversion: A meta–analysis of randomized control trials. – Circulation, 1990, 82: 1106–1116.
13. Flaker G.C., Blackshear J.L., McBride R. et al. on behalf of the Stroke Prevention in Atrial Fibrillation Investigators. Antiarrhythmic drug therapy and cardiac mortality in atrial fibrillation //JACC, 1992; 20: 527–532.
14. Teo K.K., Yusuf s., Furberg C.D. Effects of prophylactic antiarrhythmic drug therapy in acute myocardial infarction. An overview of results from randomized controlled trials – JAMA, 1993; 270 (13): 1589–1595.
15. Zarembski D.G., Nolan, Jr., P.E., Slack M.K., Caruso A.C. –Хmpiric long–term amiodarone prophylaxis following myocardial infarction. // Arch. Intern. Med., 1993; 153 (23): 2661–2667.
16. Julian D.G., Camm A.J., Frangin G. et al. Randomised trial of effect amiodarone on mortality in patients with left–ventricular dysfunction after recent myocardial infarction: EMIAT – Lancet 1997; 349 (9053): 667–674.
17. Cairns J.A., Connolly S.J., Roberts R. et al. Randomised trial of outcome effect amiodarone on mortality after myocardial Infarction in patients with frequent or repetitive ventricular premature depolarisations: CAMIAT – Lancet 1997; 349 (9053): 675–682.
18. Doval H.C., Nul D.R., Doval H.C, Grancelli H.O. et al. Randomised trial of low–dose amiodarone in severe congestive heart failure – Lancet, 1994; 344 (8921): 493–498.
19. Singh S.N., Fletcher R.D., Fisher S.G. et al. Amiodarone in patients with congestive heart failure and asymptomatic ventricular arrhythmia. // New Engl. J. Med., 1995; 333 (2): 77–82.
20. The CASCADE Investigators. Randomized antiarrhythmic drug therapy in survivors of cardial arrest (the CASCADE study). – Amer. J. Cardiol., 1993; 72: 280–287.
21. Siebels J., Kuck K.H. at the CASH Investigators. Implantable cardioverter defibrillator compared with antiarrhythmic drug therapy in cardiac arrest survivors (the Cardiac Arrest Study Hamburg). – Amer. Heart J., 1994; 127: 1139–1144.
22. The Antiarrhythmics versus Implantable defibrillators (AVID) Investigators. A comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from near–fatal ventricular arrhythmias. // New Engl. J. Med., 1997; 337 (22): 1576–1583.
23. Touboul P. A decade of clinical trials: CAST to AVID. // Europ. Heart J., 1999; 1 (suppl. C): C2–C10.
24. Sim I., McDonald K.M., Lavori P.W. Quantitative overview or randomized trials of amiodarone to prevent sudden cardiac death. – Circulation, 1997; 96: (9): 2823–2829.
25. Amiodarone Trials meta–Analysis Investigators. Effect of prophylactic amiodarone on mortality after myocardial infarction and in congestive heart failure: Meta–analysis of individual data from 6500 patients in randomised trial. – Lancet, 1997; 350: 1417—1427.
26. Anderson J.L. Acute treatment of atrial fibrillation and flutter. // Amer. J. Cardiol., 1996; 78 (8A): 17–21.
27. Falk R.H. Atrial fibrillation. // New Engl. J. Med., 2001; 344 (14): 1067–1078.
28. Zimetbaum P. Amiodarone for atrial fibrillation. // New Engl. J. Med., 2007; 356 (9): 935–941.
29. Golzari H., Cebul R.D., Bahler R.C Atrial fibrillation: Restoration and maintenance of sinus rhythm and indications for anticoagulation therapy. // Ann. Intern. Med., 1996; 125 (4): 311–323.
30. Donovan K.D., Power B.M., Hockings B.E. et al. Intravenous flecainide versus amiodarone for recent–onset atrial fibrillation. // Amer. J.Cardiol., 1995; 75: 693–697.
31. Prystowsky E.N. Perspective and controversies in atrial fibrillation. // Amer. J. Cardiol., 1998; 82 (4A): 3I–6I.
32. Zarembski D.G., Nolan P.E., Jr., Slack M.K., Caruso A.C. Treatment of resistant atrial fibrillation. // Arch. Intern. Med., 1995; 155 (17): 1885–1891.
33. Gosselink A.T.M., Crijns H.J.G..M., van Gelder I.C. et al. Low–dose amiodarone for maintenance of sinus rhythm after cardioversion of atrial fibrilation or flutter. – JAMA, 1992; 267 (24): 3289–3293.
34. Tieleman R.G., Gosselink A.T.M., Crijns H.J.G.M et al. Efficacy, safety, and determinants of conversion of atrial fibrillation and flutter with oral amiodarone. – Amer. J. Cardiol., 1997; 79: 53–57.
35. Crijns H.J., Gosselink A.T., van Gelder I.C. et al. Drugs after cardioversion to prevent relapses of atrial fibrillation – In: Atrial fibrillation, a treatable disease? Ed. by J.H. Kingma et al. – Dordrecht, The Netherlands, 1992, pp. 105–148.
36. Roy D., Talajic M., Dorian P. et al. Amiodarone to prevent recurrence of atrial fibrillation. – New Engl. J. Med., 2000; 342: 913–320.
37. Singh B. N., Singh S. N., Reda D. J. et al. Amiodarone versus sotalol for atrial fibrillation. – New Engl. J. Med., 2005; 352: 1861–1872.
38. AFFIRM First Antiarrythmic Drug Substudy Investigators. Maintenance of sinus rhythm in patients with atrial fibrillation. – JACC, 2003; 42: 20–29.
39. Mannino M.M., Mehra D., Gomes J.A. Current treatment options for paroxysmal supraventricular tachycardia. – Amer Heart J., 1994; 127 (2): 475–480.












