Амиодарон, синтезированный в 1960 году в Бельгии, первоначально использовался, как средство для лечения стенокардии. Но через некоторое время было выявлено, что этот препарат обладает антиаритмическим потенциалом. В этом качестве амиодарон (Кордарон, фармацевтическая компания «Санофи–авентис») быстро распространился по всему миру, получив заслуженное признание, как высокоэффективное средство профилактики и лечения аритмий.
Во многом широкому использованию амиодарона способствовали его уникальные свойства, выделяющие его среди всех антиаритмических средств. Это естественным образом нашло свое отражение в частоте применения препарата. На сегодняшний день при необходимости назначения антиаритмической терапии свой выбор в пользу амиодарона делают 24,1% врачей в США, 34,5% – в Европе и 73,8% – в Латинской Америке [1].
Фармакокинетика
По своей химической структуре амиодарон является йодированным производным бензофурана. Каждая доза амиодарона 200 мг содержит 75 мг йода. Препарат выпускается как в виде таблеток, так и в виде раствора для внутривенного введения.
Несмотря на длительный опыт применения, фармакокинетика амиодарона остается не до конца понятной. Отчасти сложный фармакокинетический профиль амиодарона может быть объяснен его крайне высокой липофильностью и большим объемом распределения [2,3]. Биодоступность амиодарона после перорального приема составляет 30–80%. Амиодарон медленно накапливается в тканях, причем скорость накопления может сильно различаться у отдельных групп пациентов [4]. Период полувыведения амиодарона отличается большой вариабельностью и зависит от способа его измерения. Относительно быстрое снижение концентрации амиодарона в плазме крови после внутривенного введения не отражает истинного периода полувыведения, так как препарат переходит в ткани [5].
При длительном пероральном приеме амиодарона, когда создается тканевое депо препарата, период его полувыведения составляет от 20 до 100 дней [6,7]. Медленное накопление препарата в тканях требует длительного (до нескольких месяцев) периода насыщения до достижения равновесного состояния. Использование высоких нагрузочных доз (800–1200 мг/сут. в 2–3 приема) позволяет ускорить наступление терапевтического эффекта, однако даже при использовании высоких стартовых доз возможны рецидивы аритмии в течение первых недель после начала терапии, что вовсе не означает отсутствия эффекта, который может проявляться в более поздние сроки [2].
В организме человека амиодарон превращается в активный метаболит дезэтиламиодарон, концентрация которого превышает концентрацию исходного вещества в течение длительной терапии. Существуют выраженные индивидуальные различия в плазменной концентрации как амиодарона, так и дезэтиламиодарона, определяющие антиаритмическую эффективность препарата [8]. Концентрация амиодарона в плазме, превышающая 2,5 мг/л, связана с повышенным риском развития побочных эффектов [2]. Исследования, посвященные определению оптимальной поддерживающей дозы амиодарона, отсутствуют. В реальной практике поддерживающая доза составляет 200–400 мг/сут., но имеются сообщения об эффективности назначения амиодарона в дозе 100 мг/сут. [9].
Электрофизиологические свойства
Амиодарон по формальным признакам может быть отнесен к III классу антиаритмических препаратов по классификации Vaughan–Williams, как средство, увеличивающее потенциал действия кардиомиоцита благодаря блокаде выходящего калиевого тока и, как следствие, удлиняющее интервал QT. Однако, помимо воздействия на калиевый ток, амиодарону присущи свойства всех других классов антиаритмических препаратов, что, вероятно, объясняет его высокую безопасность и эффективность. У амиодарона имеются заметные свойства антиаритмических препаратов I класса. Он блокирует входящий натриевый ток в фазу 0 потенциала действия [10]. Кроме этого, амиодарон обладает отчетливым b–блокирующим действим, но в отличие от традиционных b–адреноблокаторов блокада b–адренорецепторов у амиодарона неконкурентная и поэтому он может оказывать дополнительное ингибирующее действие на данную группу рецепторов и использоваться в качестве дополнения при необходимости применения b–адреноблокаторов [2,11]. Помимо вышеуказанных свойств, амиодарон оказывает незначительно выраженное блокирующее действие на медленные кальциевые каналы и обладает a–блокирующим эффектом [11].
Клиническое применение
Желудочковые нарушения ритма
и профилактика внезапной сердечной смерти
Внезапная сердечная смерть является самым тяжелым осложнением многих кардиологических заболеваний, поэтому профилактика ее возникновения является важной задачей кардиолога. В 83,5% случаев внезапная смерть развивается вследствие возникновения фатальных желудочковых тахиаритмий (ЖТ), включая полиморфную желудочковую тахикардию типа torsade de pointes (12,7%), первичную фибрилляцию желудочков (ФЖ) (8,3%) и трансформацию пароксизма желудочковой тахикардии (ЖТ) в фибрилляцию желудочков (62,5%) [12].
Амиодарон является наиболее эффективным препаратом для первичной профилактики желудочковых нарушений ритма и внезапной смерти у различных групп пациентов. Опыт применения амиодарона у больных, перенесших инфаркт миокарда, пациентов с частой желудочковой экстрасистолией, больных с дисфункцией левого желудочка и кардиомиопатией показал его высокую эффективность у этих групп пациентов, причем данные были получены в ходе рандомизированных плацебо–контролируемых многоцентровых исследований.
Наибольшими по объему исследованиями, проведенными среди пациентов с перенесенным инфарктом миокарда, являются два – EMIAT (European Myocardial Infarction Amiodarone Trial) и CAMIAT (Canadian Myocardial Infarction Amiodarone Trial). В первое исследование было включено 1486 пациентов, перенесших ИМ, с фракцией выброса меньше 40%. Пациенты были стратифицированы на 2 подгруппы – с фракцией выброса 31–40% и 30% и ниже. Общая смертность в группе больных, получавших амиодарон, была такой же, как и в группе больных, получавших плацебо. Амиодарон снижал смертность от нарушений ритма на 35% (р=0,05). Кроме этого, была отмечена тенденция к снижению общей смертности в подгруппе пациентов, получавших сочетание амиодарона и b–блокаторов [13].
В исследование CAMIAT включались пациенты, перенесшие ИМ, у которых при Холтеровском мониторировании выявлялось более 10 желудочковых экстрасистол в час или регистрировались пробежки ЖТ (1202 человека). Так же, как и в предыдущем исследовании, не было отмечено влияния амиодарона на общую смертность и отмечено снижение комбинированного показателя, включавшего смерть от аритмии в сочетании с ФЖ, успешно устраненной после реанимации на 38,2% (р=0,029). В подгруппе пациентов, получавших амиодарон и b–блокаторы, результаты были еще более значимыми (р=0,008) [14].
Наиболее представительным исследованием по профилактике внезапной смерти среди больных ХСН является исследование GESICA. Оно включало 516 пациентов с фракцией выброса менее 35%, у 61% которых ХСН была следствием неишемической кардиомиопатии. Амиодарон достоверно снижал общую смертность по сравнению с плацебо (33,5 и 41,4% соответственно, р=0,024). Особенно выраженным эффект был в подгруппе пациентов, имевших пробежки ЖТ. При дальнейшем анализе было выявлено, что амиодарон улучшал выживаемость только у лиц с изначальной ЧСС в покое более 90 в минуту [15].
В некотором противоречии с исследованием GESICA находятся результаты исследования CHF–STAT, в которое вошли 674 больных с ФВ<40% и имевших более 10 желудочковых экстрасистол в час. У 71% пациентов причиной ХСН была ишемическая кардиомиопатия. Исследование не показало различий в общей и внезапной смертности между группами амиодарона и плацебо. Однако в подгруппе пациентов с неишемической кардиомиопатией была отмечена тенденция к снижению общей смертности (р=0,07) [16].
Различия в полученных результатах в исследованиях GESICA и CHF–STAT объясняются, видимо, различным числом пациентов с ишемическим генезом ХСН (39% в GESICA и 71% в CHF–STAT), различной средней ЧСС (90/мин в GESICA и 80/мин в CHF–STAT), различной частотой неустойчивой ЖТ (33% в GESICA и 77% в CHF–STAT), а также тем, что в исследование GESICA включались более тяжелые пациенты (доля пациентов с III/IV ФК по NYHA в GESICA составила 79%, в CHF–STAT – 43%, а частота неблагоприятных исходов в группе плацебо в GESICA была 21,0%, в CHF–STAT – 9,4%).
Данные этих исследований были обобщены в двух мета–анализах, посвященных изучению влияния амиодарона на смертность больных с левожелудочковой дисфункцией, перенесших инфаркт миокарда.
В мета–анализе Sim et al. (рис. 1), включавшем 15 исследований по применению амиодарона (5864 пациентов), показано, что амиодарон достоверно снижал общую смертность по сравнению с плацебо (отношение шансов (ОШ)=0,81, 95% ДИ 0,69–0,94; р<0,01), смертность от сердечно–сосудистых заболеваний (ОШ=0,77, 95% ДИ 0,66–0,89; р<0,001), а также частоту внезапных смертей (ОШ=0,70, 95% ДИ 0,58–0,85; р<0,001). При анализе в подгруппах (ИМ в анамнезе, наличие дисфункции левого желудочка, остановка сердца в анамнезе) указанные тенденции сохранялись. Особо следует подчеркнуть, что в наибольшей степени амиодарон снижал именно риск внезапной смерти [17].
В другом мета–анализе – ATMA (Amiodarone Trial Meta–Analysis) (рис. 2) было объединено 13 испытаний: в 8 из них амиодарон назначали 5101 больному с ИМ в анамнезе, в 5 — 1452 больным хронической сердечной недостаточностью. В группе амиодарона уровень общей смертности оказался ниже на 13%, а смертности от аритмии (включая внезапную сердечную смерть) – на 29%, чем в контрольной группе (p=0,03 и p<0,001 соотв.) [18,19].
Несмотря на успехи применения имплантируемых кардиовертеров–дефибрилляторов у больных, переживших остановку сердца, их эффективность в качестве средств первичной профилактики изучена в меньшей степени, а результаты исследований на эту тему противоречивы. В ряде работ эффективность амиодарона достоверно не отличалась от эффективности имплантируемых устройств (исследование CIDS). Кроме этого, некоторые из них были небезупречны с точки зрения дизайна. Так, в исследовании CABG–PATCH вопреки условиям рандомизации, у части больных как в контрольной группе, так и в группе применения кардиовертеров–дефибрилляторов использовались антиаритмические препараты, включая b–блокаторы в т.ч. соталол и амиодарон. В исследовании MADIT 23% больных в группе антиаритмической терапии не получали лечения, и, напротив, 44% больных с имплантированными кардиовертерами–дефибрилляторами принимали противоаритмические препараты. В группе последних b–блокаторы использовались в 5,4 раза чаще. И, наконец, «рутинная» антиаритмическая терапия была неконтролируемой и включала в том числе препараты IС класса [20].
И все–таки после опубликования в 2004 году результатов исследования SCD–HeFT чаша весов в проблеме первичной профилактики внезапной сердечной смерти стала склоняться в пользу ИКД. В исследовании SCD–HeFT участвовал 2521 пациент с ХСН II–III ФК по NYHA (ФВ<35%). В нем было показано, что имплантация кардиовертера–дефибриллятора на 23% достоверно повышает 5–летнюю выживаемость пациентов с ХСН, в то время как назначение амиодарона не влияет на смертность таких пациентов [21]. Другие исследования (MADIT II, DEFINITE) не ставили своей задачей сравнение эффективности амиодарона и имплантируемых дефибрилляторов, хотя и продемонстрировали высокую эффективность последних.
Кроме того, имплантация кардиовертера–дефибриллятора (ИКД) не влияет на механизм возникновения аритмии, и он играет роль стража, предотвращающего фатальные последствия аритмий. Высокая частота срабатывания имплантированного устройства снижает качество жизни и приводит к преждевременной потере заряда аккумулятора, снижая срок службы прибора. По данным разных авторов, до 40% пациентов с ИКД могут попадать в т.н. «электрический шторм». Под этим термином понимают два или более эпизода желудочковой тахикардии/фибрилляции, приводящих к срабатыванию ИКД в течение 24 часов [22].
Недавно было закончено исследование OPTIC [23] по применению амиодарона у больных с ИКД. В исследование было включено 412 пациентов, которые были рандомизированы на 3 группы. Первая группа (138 пациентов) получала b–адреноблокаторы (метопролол 100 мг/сут., бисопролол 10 мг/сут. или карведилол 50 мг/сут.), вторая группа (140 пациентов) получала амиодарон в нагрузочной дозе 800 мг/сут. с последующим снижением до 200 мг/сут. в сочетании с одним из перечисленных b–адреноблокаторов и третья группа (134 пациента) получала соталол в дозе 160–240 мг/сут. Наилучший результат был получен у пациентов, получавших амиодарон в сочетании с b–адреноблокаторами. Частота срабатывания ИКД в течение года в данной группе составила 10,3%, в то время как в группе принимавших только b–адреноблокаторы она была 38,5%, а в группе, получавшей соталол – 24,3% (р<0,0001 и р=0,015 соответственно). Кроме того, в группе, получавшей амиодарон, отмечена достоверно более низкая частота ложных срабатываний ИКД.
Достигалось это, вероятнее всего, за счет более эффективного подавления наджелудочковых аритмий на фоне приема амиодарона, т.к. эти нарушения ритма могут приводить к ложным срабатываниям ИКД [24].
Последнее положение нашло свое подтверждение в недавней работе Lee C. H. et al., в которой сравнивалась частота ложных срабатываний ИКД у пациентов, получавших амиодарон, соталол или b–блокаторы. Частота ложных срабатываний в течение 4–х лет наблюдения составила 27,3, 54,3 и 70,6% соответственно [25].
Отдельно стоит упомянуть использование амиодарона при проведении реанимационных мероприятий. Внутривенное введение амиодарона при некупирующейся электрической кардиоверсией ЖТ или ФЖ увеличивало количество пациентов, доставленных живыми в стационар по сравнению с внутривенным введением лидокаина. В группе амиодарона доля выживших составила 22,8%, а в группе лидокаина – 12,0%. ОШ 2,17 (95% ДИ 1,21–3,83, р=0,009). В связи с этим амиодарон является препаратом выбора при некупирующейся ЖТ/ФЖ согласно Европейским рекомендациям по сердечно–легочной реанимации [26,27].
Фибрилляция и трепетание предсердий
К настоящему времени проведено довольно большое количество исследований по изучению эффективности амиодарона, как средства для купирования пароксизмов фибрилляции предсердий (ФП), так и в качестве средства для удержания синусового ритма. К сожалению, все эти исследования очень разнородны по своему дизайну, времени оценки наступления эффекта и виду ФП (пароксизмальная, персистирующая или больные с ФП обеих форм).
Так, в неконтролируемых исследованиях у пациентов, находящихся в отделениях реанимации в критическом состоянии, эффективность амиодарона в купировании ФП, по разным данным, составила до 80% в течение 24 часов. Среднее время восстановления синусового ритма составило 27–171 мин (этот показатель оценивался не во всех исследованиях) [28].
В рандомизированных исследованиях несколькими авторами сравнивалась эффективность в отношении восстановления синусового ритма при ФП внутривенного введения амиодарона с плацебо, с внутривенным введением дигоксина и верапамила. Эти исследования могут быть объединены, т.к. антиаритмическая активность дигоксина и верапамила не отличается от плацебо. В этих исследованиях в группе амиодарона наблюдался значительно более высокий процент восстановления синусового ритма, нежели, чем в группе контроля (табл. 1). Следует отметить, что эффективность амиодарона оценивалась в течение 24 часов. В первые же три часа эффективность препарата не столь высока, а при персистирующей форме ФП в этот срок практически не отличается от плацебо.
При сравнении амиодарона с другими препаратами для восстановления синусового ритма он демонстрирует несколько меньшую эффективность, чем антиаритмики I класса. У больных с послеоперационной ФП хинидин восстанавливал синусовый ритм в 64%, а амиодарон – в 41% случаев (р=0,04). В другом исследовании на 75 пациентах амиодарон продемонстрировал сходную с хинидином эффективность (92 и 100% соответственно). В случае восстановления ритма у больных ФП длительностью более 3–х недель оба препарата были малоэффективны [29].
Но при ФП главной задачей является не восстановление, а удержание синусового ритма. И здесь амиодарон является непревзойденным по эффективности препаратом. Данные многочисленных исследований свидетельствуют, что назначение амиодарона для предупреждения рецидивов ФП эффективнее соталола [30,31] и пропафенона [32]. По данным мета–анализа McNamara R.L., отношение шансов для удержания синусового ритма на фоне приема амиодарона по сравнению с любым контрольным препаратом составило 6,8 (95% ДИ 4,0–11,4) при р<0,01 [28].
Еще одной областью использования амиодарона является его применение для предупреждения фибрилляции предсердий после кардиохирургических вмешательств. ФП возникает, по разным данным, у 30% больных после АКШ, у 50% пациентов после операций по протезированию клапанов и у 70% пациентов, перенесших сочетанные кардиохирургические вмешательства. Возникновение ФП в послеоперационном периоде является независимым фактором риска смертности и увеличения длительности пребывания в стационаре [33]. В 10 рандомизированных исследованиях по профилактическому применению амиодарона приняло участие 1699 пациентов. В четырех из них амиодарон значительно снизил частоту послеоперационной ФП, а в шести его влияние на частоту возникновения этого осложнения было минимальным. По разным оценкам, амиодарон снижает относительный риск развития ФП после операции на 8–72%. Недостатком применения амиодарона является необходимость семидневного периода, в течение которого назначается нагрузочная доза препарата [34]. Исследование PAPABEAR, включавшее 600 пациентов, показало, что амиодарон достоверно снижал частоту развития ФП после кардиохирургических вмешательств по сравнению с плацебо, ФП возникала в 29,6% в группе плацебо и в 16,1% случаев в группе амиодарона (р<0,001). Однако не было получено достоверных различий в смертности, хотя и имелась тенденция к ее уменьшению в группе амиодарона (3,3 и 2,3%) соответственно. Амиодарон был эффективен у всех подгрупп пациентов. Следует отметить, что многие больные получали b–блокаторы, которые сами по себе являются эффективным средством профилактики послеоперационной ФП. В подгруппе же пациентов, не получавших b–блокаторы, разница между группой плацебо и группой амиодарона была наибольшей. Частота развития ФП составила 35,8 и 16,3% соответственно (р<0,05) [35].
Переносимость
Вероятно, благодаря тому, что амиодарону присущи свойства всех четырех классов антиаритмических препаратов, проаритмические эффекты на фоне его применения развиваются редко. Хотя амиодарон формально относится к III классу антиаритмических средств и, следовательно, удлиняет интервал QT, тахикардия типа «пируэт» на фоне его применения возникает очень редко (менее 0,5% случаев) [2]. При длительном приеме амиодарона также не наблюдается увеличения количества проаритмических эффектов [36,37].
Чаще на фоне приема амиодарона возникают внекардиальные побочные эффекты. Наиболее серьезным (хотя и не частым) из них является поражение легких в виде альвеолита, который возникает из–за прямого токсического действия препарата или в результате иммунных механизмов [38]. Проспективные исследования показали, что при использовании препарата в дозах ниже 300 мг/сут. частота возникновения данного побочного эффекта составляет не более 1% в год [39].
Одним из относительно частых побочных эффектов амиодарона является его влияние на функцию щитовидной железы. Это связано с высоким содержанием йода в препарате. Каждая доза амиодарона 200 мг содержит около 75 мг йода. При назначении амиодарона в дозе 200–600 мг/сут. пациент получает 6–18 мг свободного йода ежедневно, что в 50 раз превышает оптимальное количество этого элемента [39,40]. Кроме этого, амиодарон нарушает периферическую конверсию трийодтиронина в тироксин, что может приводить к повышению уровня трийодтиронина. Наиболее часто (около 6% случаев) это воздействие проявляется в виде гипотиреоза [41]. В том случае, когда амиодарон назначается по жизненным показаниям, при развитии гипотиреоза его можно не отменять, назначив соответствующую заместительную терапию тиреоидными гормонами (Согласно инструкции по применению Кордарона при дисфункции щитовидной железы (гипертиреоз, гипотериоз) препарат противопоказан).
Более серьезным представляется возникновение тиреотоксикоза на фоне приема амиодарона, развивающегося примерно в 2% случаев [40]. Амиодарон–индуцированный тиреотоксикоз бывает двух типов. Первый тип развивается на фоне исходно измененной щитовидной железы (узловой или диффузно–узловой зоб, диффузный токсический зоб и др.) и формируется по типу йодиндуцированного тиреотоксикоза. Он чаще встречается в зонах йодного дефицита. Второй тип представляет собой деструктивный тиреоидит с разрушением клеток железы из–за токсического действия самого амиодарона, а не только содержащегося в нем йода. Деструкция клеток щитовидной железы сопровождается выходом в кровь повышенного количества тиреоидных гормонов [40,41].
В дифференциальной диагностике, помимо данных анамнеза и ультразвукового исследования железы (обнаружение узлов, определение объема железы), используется исследование с радиоактивным йодом. При первом типе могут определяться участки повышенного накопления изотопа, а при втором типе накопление изотопа в железе нормальное или сниженное [41].
Тактика лечения при этих двух состояниях различна. Развитие тиреотоксикоза обычно требует отмены приема амиодарона, однако это решение принимается для каждого больного индивидуально на основании тяжести аритмии и выраженности клинических проявлений тиреотоксикоза. При первом типе назначают тиреостатические препараты (иногда в сочетании с кортикостероидами), а при отсутствии эффекта проводят оперативное лечение заболевания. При втором типе используют кортикостероидные гормоны (преднизолон 30–40 мг/сут.) [40].
На фоне приема амиодарона могут развиваться побочные эффекты со стороны кожи. Они выражаются в изменении цвета кожных покровов при длительном приеме за счет отложения препарата в коже. Амиодарон может откладываться также и в роговице глаза, приводя к появлению радужного ореола при взгляде на светящиеся объекты и снижению зрения. Эти побочные эффекты постепенно проходят после отмены препарата. Кроме этого, наблюдается повышение чувствительности кожи к ультрафиолету. В связи с этим пациентам, получающим амиодарон, рекомендуется избегать действия прямых солнечных лучей и использовать солнцезащитные кремы с высоким коэффициентом защиты [39].
Побочные эффекты со стороны желудочно–кишечного тракта развиваются, как правило, при использовании высоких нагрузочных доз препарата и проявляются болями в животе, тошнотой, рвотой и снижением аппетита. При снижении дозы эти явления обычно проходят [39].
К другим, редко возникающим побочным эффектам амиодарона относится поражение печени, выражающееся, как правило, в виде бессимптомного повышения печеночных трансаминаз. В редких случаях может развиться токсический гепатит. При повышении уровня трансаминаз в три раза следует рассмотреть вопрос об отмене амиодарона или замене его на другой препарат.
На фоне приема амиодарона могут развиваться и неврологические нарушения в виде атаксии, парестезии, тремора и периферической полинейропатии. Частота этих явлений составляет 0,3% в год. В большинстве случаев поражение нервной системы возникает на фоне приема высоких доз амиодарона [39].
При назначении амиодарона на длительный срок необходимо наблюдение за пациентом. Во время контрольных визитов (каждые 3–6 месяцев) следует спрашивать об изменении аппетита, зрения, о проявлениях полинейропатии, оценивать цвет кожных покровов, регистрировать ЭКГ. Кроме того, каждые 6 месяцев необходимо определять уровень тиреотропного гормона и печеночных трансаминаз, а один раз в год проводить рентгенографию органов грудной клетки.
Лекарственное взаимодействие
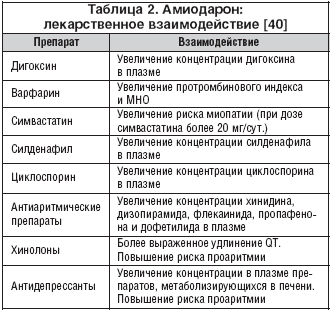
Амиодарон является потенциальным ингибитором печеночного и почечного метаболизма многих лекарственных препаратов. Амиодарон изменяет фармакокинетику препаратов, метаболизирующихся с помощью цитохрома Р450, включая изоформы CYP 2C9, CYP 2D6 и CYP 3A4. Наиболее важные взаимодействия амиодарона с другими лекарственными препаратами представлены в таблице 2. Клинически важным представляется взаимодействие амиодарона с дигоксином и варфарином. Амиодарон снижает клиренс варфарина, что может приводить к усилению действия последнего. Наибольшей выраженности усиление эффекта варфарина достигает к седьмой неделе терапии амиодароном [39].
Концентрация дигоксина при начале терапии амиодароном может увеличиваться приблизительно вдвое за счет снижения экскреции дигоксина канальцами почек и блокады Р–гликопротеина мембранной транспортной системы. В связи с этим при совместном назначении амиодарона и дигоксина требуется 50%–е снижение дозы последнего [39].
Заключение
• Амиодарон (в России наиболее широко применяемый под торговым названием Кордарон фармацевтической компании Санофи–авентис) является единственным из существующих на сегодняшний день антиаритмических препаратов, доказавшим в крупных клинических исследованиях свою эффективность, как средство первичной профилактики внезапной смерти. Он способен снижать как риск внезапной аритмической смерти, так и общую летальность у больных, перенесших инфаркт миокарда и имеющих желудочковые аритмии III–IV класса Lown и/или дисфункцию левого желудочка (ФВ<40%).
• Амиодарон с целью первичной профилактики внезапной сердечной смерти у больных, перенесших инфаркт миокарда, целесообразно применять в течение первых двух лет в дозах, не превышающих 400 мг в сутки.
• Амиодарон (особенно в сочетании с b–адреноблокаторами) является эффективным средством для уменьшения частоты как истинных, так и ложных срабатываний ИКД и повышает качество жизни пациентов с имплантированными устройствами и срок службы ИКД. Также сочетание показано в том случае, когда имплантация ИКД невозможна по медицинским показаниям или с экономической точки зрения.
• Амиодарон эффективен в отношении купирования жизнеугрожающих нарушений ритма, рефрактерных к электрической кардиоверсии.
• Внутривенное введение амиодарона является достаточно эффективным и безопасным средством в отношении купирования пароксизмов ФП, особенно у тяжелых больных.
• Амиодарон наиболее эффективен среди всех антиаритмических препаратов в отношении поддержания синусового ритма у больных с пароксизмальной и персистирующей формой фибрилляции предсердий.
• У пациентов, перенесших кардиохирургические вмешательства, амиодарон является эффективным средством профилактики послеоперационной ФП.
• Необходим тщательный мониторинг у пациентов, получающих амиодарон в течение длительного времени, особенно в дозах, превышающих 200 мг/сут., в связи с возможностью развития экстракардиальных побочных эффектов.



Литература
1. Fang M. C. et al. National trends in antiarrhythmics and antithrombotic medications use in atrial fibrillation. Arch. Intern. Med., 2004; 164: 55–60.
2. Connolly S. J. Evidence–Based Analysis of Amiodarone Efficacy and Safety. Circulation, 1999;100: 2025–2034.
3. Chatelain P., Laruel R. Amiodarone partitioning with phospholipids bilayers and erythrocyte membranes. J Pharm Sci., 1985; 74: 783–784.
4. Holt D. W., Tucker G. T., Jackson P. R., Storey C. G. A. Amiodarone pharmacokinetics. Am Heart J., 1983;106: 840–847.
5. Roden D. M. Pharmacokinetics of amiodarone: implications for drug therapy. Am J Cardiol., 1993; 72: 45F–50F.
6. Kannan R., Nademanee K., Hendrickson J. Et al. Amiodarone kinetics after oral doses. Clin Pharmacol Ther., 1982; 31: 438–444.
7. Marchiset D., Bruno R., Dijane P. et al. Amiodarone and desethylamiodarone elimination kinetics following withdrawal of long–term amiodarone maintenance therapy. Biopharm Drug Dispos., 1985; 6: 209 –215.
8. Connolly S. J, Gupta R. N, Hoffert D, Roberts R. S. Concentration response relationships of amiodarone and desethylamiodarone. Am Heart J., 1988; 115:1208 –1213.
9. Mahmarian J. J, Smart F. W, Moye? L. E et al. Exploring the minimal dose of amiodarone with antiarrhythmic and hemodynamic activity. Am J Cardiol., 1994; 74: 681–686.
10. Mason J. W., Honegham LM, Katzung BG. Block of inactivated sodium channels and of depolarization–induced automaticity in guinea pig papillary muscle by amiodarone. Circ Res. 1984; 55: 277–285.
11. Naccarelli G. V., Sager P. T., Singh B. N. Antiarrhytmic drug. In “Cardiac Arrhythmia. Mechanisms, Diagnosis and Management” 2nd editions. Eds. Podrid P. J., Kowey P. R., Lippincott Williams & Wilkins.
12. Сулимов В. А., Гиляров М. Ю. Амиодарон: первичная профилактика внезапной сердечной смерти. Врач, 2004; (7): 73–75.
13 Julian DG, Camm AJ, Franglin G, Janse MJ, Munoz A, Schwartz PJ, Simon P, for the European Myocardial Infarct Amiodarone Trial Investigators: Randomized trial of effect of amiodarone on mortality in patients with leftventricular dysfunction after recent myocardial infarction: EMIAT. Lancet, 1997; 349: 667–674.
14. Cairns, JA, Connolly SJ, Roberts R, Gent M, for the Canadian Amiodarone Myocardial Infarction Arrhythmia Trial Investigators: Randomized trial of outcome after myocardial infarction in patients with frequent or repetitive ventricular premature depolarisations: CAMIAT. Lancet, 1997; 349: 675–682.
15. Doval H., Nul D., Grancelli H. et al for de Estudio de la Sobrevida en la Insuficiencia Cardiaca en Argentina (GESICA) Randomized trial of low–dose amiodarone in severe congestive heart failure. Lancet, 1994; 344: 493–498
16. Singh SN, Fletcher RD, Fisher SG, Singh BN, Lewis HD, Deedwania PC, et al. for the Survival Trial of Antiarrhythmic Therapy in Congestive Heart Failure: Amiodarone in patients with congestive heart failure and asymptomatic ventricular arrhythmia. N Engl J Med, 1995; 333: 77–82.
17. Sim I, McDonald KM, Lavori PW, Norbutas CM, Hlatky MA: Quantitative overview of randomized trials of amiodarone to prevent sudden cardiac death. Circulation, 1997; 96: 2823–2829.
18. Amiodarone Trials Meta–Analysis Investigators. Effect of prophylactic amiodarone on mortality after acute myocardial infarction and in congestive heart failure: meta–analysis of individual data from 6500 patients in randomised trials. Lancet, 1997; 350: 1417–1424.
19. Обзор: применение амиодарона снижает смертность среди больных с застойной сердечной недостаточностью и после инфаркта миокарда. Международный журнал медицинской практики, 1999, (1): http://www.mediasphera.ru/mjmp/99/1/r1–99–2.htm
20. Голицын С. П. Лечение желудочковых аритмий с позиции первичной и вторичной профилактики внезапной смерти. Сердечная недостаточность, 2001; 2(5): 2–10.
21. Bardy G. H. et al. Amiodarone or an Implantable Cardioverter–Defibrillator for Congestive Heart Failure N Engl J Med, 2005; 352: 225–237.
22. Dorian P., Mangat I. Role of amiodarone in the era of the implantable cardioverter defibrillator. J. Cardiovasc. Electrophysiol, 2003; 14: S78–S81.
23. Connolly SJ, Hohnloser S, Dorian P, et al. Optimal Pharmacological Therapy in Implantable Cardioverter Defibrillator Patients (OPTIC) trial. Program and abstracts of the American College of Cardiology Annual Scientific Session, 2005; March 6–9, 2005; Orlando, Florida. Late Breaking Clinical Trials I.
24. Swerdlow C. D., Friedman P. A. Advanced ICD Troubleshooting: Part I. Pacing Clin Electrophysiol., 2005; 28: 1322–1346.
25. Lee C. H. et al. Effects of antiarrhythmic drugs on inappropriate shocks in patients with implantable cardioverter defibrillators. Circ J., 2008; 72: 102–105.
26. Dorian P., Cass D., Schwartz B., Cooper R., Gelaznikas R., Barr A. Amiodarone as Compared with Lidocaine for Shock–Resistant Ventricular Fibrillation. N Engl J Med, 2002; 346: 884–890.
27. International Liaison Committee on Resuscitation. Part 4: Advanced life support. Resuscitation, 2005; 67: 213–247.
28. McNamara R. L, Tamariz L. J., Segal J. B., Bass E. B. Role of Pharmacologic Therapy, Electrical Cardioversion, and Echocardiography. Ann Intern Med., 2003; 139: 1018–1033.
29. Гиляров М. Ю., Сулимов В. А. Амиодарон в XXI веке. Врач, 2006; № 4: 78–87.
30. Roy D., Talajic M., Dorian P. et al. Amiodarone to prevent recurrence of atrial fibrillation. N Engl J Med, 2000; 342: 913–920.
31. Singh B. N., Singh S. N., Reda D. J. Amiodarone versus Sotalol for Atrial Fibrillation. N Engl J Med, 2005; 352: 1861–1872.
32. The AFFIRM First Antiarrhythmic Drug Substudy Investigators. Maintenance of sinus rhythm in patients with atrial fibrillation. An AFFIRM Substudy of the First Antiarrhythmic Drug. J Am Coll Cardiol., 2003; 42: 20–29.
33. Hogue C. W. et al. Epidemiology, Mechanisms, and Risks. American College of Chest Physicians Guidelines for the Prevention and Management of Postoperative Atrial Fibrillation After Cardiac Surgery. Chest, 2005; 128: 9S–16S.
34. Bradley D. et al. Pharmacologic Prophylaxis. American College of Chest Physicians Guidelines for the Prevention and Management of Postoperative Atrial Fibrillation After Cardiac Surgery. Chest, 2005; 128: 39S–47S.
35. Mitchell LB, Exner DV, Wyse DG et al. Prophylactic Oral Amiodarone for the Prevention of Arrhythmias that Begin Early After Revascularization, Valve Replacement, or Repair: PAPABEAR: a randomized controlled trial. JAMA, 2005; 294 :3093–3100.
36. Herre JM, Sauve MJ, Malone P, Griffin JC, Helmy I, Langberg JJ, Goldberg H, Scheinman MM. Long term results of amiodarone therapy in patients with recurrent sustained ventricular tachycardia or ventricular fibrillation. J Am Coll Cardiol., 1989; 13: 442– 449.
37. Weinberg BA, Miles WM, Klein LS, Bolander JE, Dusman RE, Stanton MS, Heger JJ, Langefeld C, Zipes DP. Five–year follow–up of 589 patients treated with amiodarone. Am Heart J., 1993; 125: 109 –120.
38. Pollak PT. Clinical organ toxicity of antiarrhythmic compounds: ocular and pulmonary manifestations. Am J Cardiol, 1999; 84: 37R–45R.
39. Siddoway L. A. Amiodarone: Guidelines for Use and Monitoring. Am Fam Physician, 2003; 68: 2189–2196.
40. Cardenas G. A., Cabral J. M., Leslie C. A. Amiodarone–induced thyrotoxicosis: Diagnostic and therapeutic strategies. Clev Clin J Med, 2003; 70: 624 – 631.
41. Чазов Е.И., Дедов И.И., Голицын С.П., Бакалов С.А., Сердюк С.Е., Свириденко Н.Ю., Платонова Н.М., Молашенко Н.В. Кардиальные и эндокринные аспекты применения амиодарона в современной практике лечения нарушений ритма сердца. М., 2005.
RU.AMD.08.03.01.












